|
|
(21), (22) Заявка: 2005132293/13, 19.10.2005
(24) Дата начала отсчета срока действия патента:
19.10.2005
(46) Опубликовано: 27.03.2007
(56) Список документов, цитированных в отчете о
поиске:
RU 2138509 C1, 27.09.1999. RU 2151598 C1, 27.06.2000. RU 2155599 C1, 10.09.2000.
Адрес для переписки:
167982, г.Сыктывкар, ул. Коммунистическая, 28, Институт биологии Коми НЦ УрО РАН, Пат. пов. Л.Б. Печерской
|
(72) Автор(ы):
Филиппова Валерия Николаевна (RU),
Володина Светлана Олеговна (RU),
Смоленская Ирина Николаевна (RU),
Зоринянц Светлана Эдуардовна (RU),
Ковлер Лидия Анатольевна (RU),
Ануфриева Эмилия Николаевна (RU),
Носов Александр Михайлович (RU),
Володин Владимир Витальевич (RU)
(73) Патентообладатель(и):
Институт биологии Коми научного центра Уральского отделения Российской академии наук (RU)
|
(54) ШТАММ КУЛЬТИВИРОВАННЫХ КЛЕТОК РАСТЕНИЙ SERRATULA CORONATA L.
(57) Реферат:
Изобретение относится к биотехнологии и может быть использовано в медицинской, пищевой и парфюмерной промышленности. Штамм GI 1.1 суспензионной культуры растительных клеток Serratula coronata L. N 64 – продуцент экдистероидов. Изобретение позволяет эффективно получить экдистероиды. 2 ил.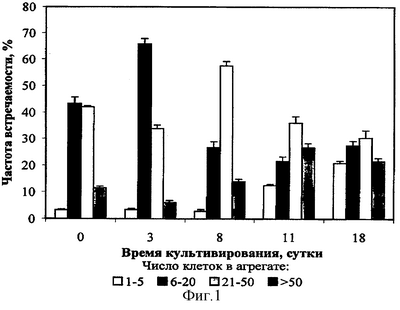
Изобретение относится к биотехнологии и может быть использовано в медицинской, пищевой и парфюмерной промышленности.
В настоящее время проводятся интенсивные исследования по получению фитоэкдистероидов из лекарственного растительного сырья (Фитоэкдистероиды / Под ред. В.В.Володина. Санкт-Петербург: Наука, 2003. 293 с.; Патент РФ №2153346, МКИ А 61 К 35/78. Способ получения экдистероидов / В.В.Володин, С.О.Володина; Патент РФ N21555 99, МКИ А 61 К 35/78. Способ выделения индивидуальных соединений из смеси экдистероидов из надземной части растений Serratula coronata / В.В.Володин, С.О.Володина).
Для этих соединений показана перспектива использования в составе актопротекторных, сахароснижающих и ранозаживляющих препаратов, тонизирующих пищевых добавок и косметических композиций (Фитоэкдистероиды / Под ред. В.В.Володина. Санкт-Петербург: Наука, 2003. 293 с.; Патент РФ №2119331, МКИ А 61 К 9/06, 35/78. Средство для лечения ожоговых ран “Витадерм” / В.Н.Дармограй, С.М.Потехинский и др.; Patent ЕР №0436650, МКИ А 61 К N 7/00. Meybeck A., Bonte F. Phases lamellaires lipidiques hydratees on liposomes a base d’ecdysteroides; Патент РФ №1561263, МКИ А 61 К 35/78. Способ лечения инсулинзависимого сахарного диабета./ М.И.Косовский, В.Н.Сыров, М.М.Мирахмедов, С.П.Каткова и З.А.Хушбактова. Альтернативой растительному сырью могут служить культивируемые клетки растений.
Задачей настоящего изобретения является получение активно растущего штамма суспензионной культуры растительных клеток серпухи венценосной (Serratula coronata L.), характеризующегося высоким содержанием фитоэкдистероидов.
Штамм Serratula coronata GI 1.1 депонирован в Российскую коллекцию клеток высших растений при Институте физиологии им. К.А.Тимирязева РАН под коллекционным номером 64.
Описание исходного материала.
Источником получения штамма суспензионной культуры Serratula coronata служила длительно культивируемая каллусная культура, которая была получена в 1993 г. в лаборатории биохимии и биотехнологии растений Института биологии Коми НЦ УрО РАН из гипокотиля проростка семян растений серпухи венценосной, выращиваемой в научной коллекции указанного Института. Каллусную культуру выращивали на модифицированной среде Мурасиге-Скуга с добавлением сахарозы 30 г/л; 2,4-Д 1 мг/мл; БАП 0,2 г/мл; мезо-инозита 100 мг/л и витаминов по Стаба, мг/л: фолиевой кислоты 0,5; рибофлавина (В2) 0,5; биотина 1,0; Са-пантотената 1,0; кобаламина (В 12) 0,0015. pH до автоклавирования 5,8. Для получения суспензионных культур каллусную культуру переносили в жидкую питательную среду, идентичную по составу среде, на которой культивировались каллусные культуры, с исключением агара. Примерно через две неделисуспензионную культуру фракционировали, используя отстаивание в течение 1-2 мин (отбирали среднюю фракцию). Суспензии выращивали в конических колбах объемом 500 мл с 60-70 мл среды при 25-26°С, относительной влажности воздуха 60%, в темноте, на качалке, 90-100 качаний в минуту. Установлен следующий режим пересева: 17,5±1,8 мл инокулюма на 100 мл среды. Интервал субкультивирования 12-14 дней.
Культуральные свойства штамма.
Характер роста: суспензия белого цвета, индекс роста по сырой биомассе 10,54±0.53, по сухой биомассе 10,65±0,72. Удельная скорость роста по сырой биомассе 0,35±0,08 сут-1, по сухой биомассе 0,31±0,05 сут-1, по числу клеток 0,58±0,16 сут-1. Число живых клеток 75,44±8,77%.
Цитологическая характеристика.
Суспензия клеток серпухи венценосной состоит из четырех типов клеток: меристематического типа (размером 40-80 мкм), паренхимного типа (размером 100-200 мкм), удлиненные клетки (поперечный размер варьирует от 4 до 80 мкм, длина 200-350 мкм), почкующиеся клетки (клетки неправильной формы, имеющие крупные размеры, диаметр которых превышает 200 мкм). В течение всего периода субкультивирования преобладают крупные агрегаты, состоящие из 20-50 клеток. В начале экспоненциального роста увеличивается число мелких кластеров, состоящих из 6-10 клеток. На протяжении всего периода субкультивирования преобладают агрегаты с числом клеток 21-50. К концу пассажа возрастает количество одиночных клеток и происходит укрупнение агрегатов в суспензии. На фиг.1, показана агрегированность суспензионной культуры Serratula coronata L. с циклом культивирования две недели.
Кариологическая характеристика.
Число хромосом в меристеме корня интактного растения серпухи венценосной равно 22, что соответствует литературным данным. Популяция длительно культивируемых клеток характеризуется значительным разнообразием кариотипов. Модальный класс представлен клетками с числом хромосом 49-68 (58%). Имеются клетки, по числу хромосом, близких к диплоидному уровню (5%). Присутствуют также клетки с числом хромосом более 8n (10%). На фиг.2 представлено распределение числа хромосом в клетках суспензионной культуры Serratula coronata L.
Характеристика биосинтеза экдистероидов в суспензионной культуре клеток.
Анализ биомассы клеток на содержание экдистероидов проводили методом обращенно-фазной ВЭЖХ на аналитической системе ВЭЖХ Varian, Pro Star (США).
Состав элюента: вода – ацетонитрил (100:20), скорость элюирования 1,5 мл/мин;  =242 нм; колонка Diasorb C16/T (150×4 мм; 7 мкм). Основным компонентом клеточной биомассы, как и в интактных растениях, является 20-гидроксиэкдизон (используется в качестве субстанции известного тонизирующего препарата “Экдистен”). В проанализированных образцах биомассы присутствовали минорные количества инокостерон, экдизон и макистерон А, также характерные для интактных растений серпухи венценосной. Динамика накопления экдистероидов в цикле выращивания носит периодический характер. Максимум синтеза экдистероидов отмечается в начале стационарной фазы и на стадии замедления роста (0,4-0,5% по сухой биомассе). Результаты анализа проб культуральной жидкости показали, что на протяжении всего цикла выращивания выделения экдистероидов в среду не происходит. =242 нм; колонка Diasorb C16/T (150×4 мм; 7 мкм). Основным компонентом клеточной биомассы, как и в интактных растениях, является 20-гидроксиэкдизон (используется в качестве субстанции известного тонизирующего препарата “Экдистен”). В проанализированных образцах биомассы присутствовали минорные количества инокостерон, экдизон и макистерон А, также характерные для интактных растений серпухи венценосной. Динамика накопления экдистероидов в цикле выращивания носит периодический характер. Максимум синтеза экдистероидов отмечается в начале стационарной фазы и на стадии замедления роста (0,4-0,5% по сухой биомассе). Результаты анализа проб культуральной жидкости показали, что на протяжении всего цикла выращивания выделения экдистероидов в среду не происходит.
Пример конкретного выполнения.
Штамм суспензионной культуры растительных клеток серпухи венценосной культивируют на среде указанного выше состава при 26°С в темноте. В фазу замедления роста (12-14 сутки) биомассу клеток отделяют от жидкой среды фильтрованием под ваккумом. 500 г сырой биомассы промывают дистиллированной водой и разрушают гомогенизатором при скорости 15 тыс. об/мин в течение 5 минут при комнатной температуре. В гомогенат добавляют двойной объем водного этанола или метанола. Экстракцию проводят в течение 2 часов при перемешивании при температуре 20-40°С. После отделения осадка проводят вторичную экстракцию биомассы водным этанолом или метанолом. Экстракты объединяют и упаривают под вакуумом. Сгущение экстракта проводят не досуха, а оставляют 10% от исходного количества жидкой фазы. Остаток трижды экстрагируют гексаном для удаления побочных веществ липидной природы, а затем дважды смесью этилацетат:метанол для извлечения целевого продукта. Органические извлечения упаривают досуха, наносят на оксид алюминия и проводят колоночную хроматографию смесью хлороформ-метанол возрастающей полярности. Определение целевых фракций, содержащих 20-гидроксиэкдизона, проводят с помощью ТСХ и ВЭЖХ-хроматографии. Целевые фракции упаривают и перекристаллизовывают в смеси этилацетат:метанол 9:1. Получают 0,05 г 20-гидроксиэкдизона (чистота продукта – 92%), содержащего в качестве сопутствующих экдистероидов – 25S-инокостерон и экдизон, в минорных концентрациях. По своему составу экдистероидный препарат, выделенный из биомассы культивируемых клеток, идентичен препарату, получаемому из нативных растений серпухи венценосной, что указывает на возможность использования суспензионной культуры клеток в качестве альтернативного источника 20-гидроксиэкдизона – субстанции актопротекторных и тонизирующих экдистероидсодержащих лекарственных препаратов.
Формула изобретения
Штамм GI 1.1 суспензионной культуры растительных клеток Serratula coronata L. N 64 – продуцент экдистероидов (Российская коллекция клеток высших растений при Институте физиологии им. К.А.Тимирязева РАН).
РИСУНКИ
|
|