|
|
(21), (22) Заявка: 2003132454/13, 04.04.2002
(24) Дата начала отсчета срока действия патента:
04.04.2002
(30) Конвенционный приоритет:
06.04.2001 DK PA 2001 00579
(43) Дата публикации заявки: 10.05.2005
(46) Опубликовано: 27.03.2007
(56) Список документов, цитированных в отчете о
поиске:
RU 2054044 C1, 10.02.2006. WO 9208737, 29.05.1992. US 5690925, 25.11.1997.
(85) Дата перевода заявки PCT на национальную фазу:
06.11.2003
(86) Заявка PCT:
DK 02/00226 (04.04.2002)
(87) Публикация PCT:
WO 02/081507 (17.10.2002)
Адрес для переписки:
103735, Москва, ул. Ильинка, 5/2, ООО “Союзпатент”, пат.пов. А.П.Агурееву
|
(72) Автор(ы):
ЕНСЕН Анна Дам (DK)
(73) Патентообладатель(и):
МАКСИДЖЕН ХОЛДИНГЗ ЛТД. (KY)
|
(54) ВАРИАНТЫ ПОЛИПЕПТИДА ГАММА-ИНТЕРФЕРОНА
(57) Реферат:
Изобретение относится к области генной инженерии, конкретно к получению новых вариантов полипептида гамма-интерферона, обладающих активностью гамма-интерферона (IFNG), и может быть использовано в медицине для лечения интерстициальных легочных заболеваний. Новые варианты полипептида включают замены S99T по сравнению с аминокислотной последовательностью huIFNG, могут быть укорочены с С-конца на 1-15 аминокислот и способны повышать использование природного сайта N-гликозилирования в положении 97. Мутантные формы гамма-интерферона, содержащие треонин в положении 99, могут включать от 1 до 10 модификаций, без потери активности полипептида. Полипептид получают путем экспрессии в клетках-хозяевах, трансформированных вектором, включающим нуклеиновую кислоту, которая кодирует мутантный IFNG. Путем ПЭГилирования получают конъюгат мутантного полипептида с ПЭГ, который обладает увеличенным временем полужизни в сыворотке и сниженной иммуногенностью. Полученный полипептид IFNG используют в способах лечения и профилактики интерстициальных легочных заболеваний в составе фармацевтической композиции. Изобретение позволяет получить мутантный гамма-интерферон с повышенным использованием сайта N-гликозилирования в положении 97 по сравнению с природной формой huIFNG. 11 н. и 31 з.п. ф-лы, 3 ил., 4 табл.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение касается новых вариантов полипептида  -интерферона, обладающих активностью -интерферона, обладающих активностью  -интерферона (IFNG), способов их получения, фармацевтических композиций, включающих варианты полипептида, и их применения при лечении заболеваний, в частности, при лечении интерстициальных легочных заболеваний, таких как идиопатический фиброз легких. -интерферона (IFNG), способов их получения, фармацевтических композиций, включающих варианты полипептида, и их применения при лечении заболеваний, в частности, при лечении интерстициальных легочных заболеваний, таких как идиопатический фиброз легких.
УРОВЕНЬ ТЕХНИКИ
 -Интерферон (IFNG) – это цитокин, вырабатываемый Т-лимфоцитами и естественными клетками-киллерами, который существует в виде гомодимера из двух нековалентно связанных полипептидных субъединиц. Зрелая форма каждого димера содержит 143 аминокислотных остатка (приведены в SEQ ID No:17), а их предшественник включает 166 аминокислотных остатков (приведены в SEQ ID No:18). -Интерферон (IFNG) – это цитокин, вырабатываемый Т-лимфоцитами и естественными клетками-киллерами, который существует в виде гомодимера из двух нековалентно связанных полипептидных субъединиц. Зрелая форма каждого димера содержит 143 аминокислотных остатка (приведены в SEQ ID No:17), а их предшественник включает 166 аминокислотных остатков (приведены в SEQ ID No:18).
Каждая субъединица содержит два потенциальных сайта N-гликозилирования (Aggarwal et al., Human Cytokines, Blackwell Scientific Publications, 1992) в положении 25 и 97. В зависимости от степени гликозилирования молекулярный вес IFNG в виде димера составляет 34-50 кДа (Farrar et al., Ann. Rev. Immunol. 1993, 11: 571-611).
Первичная последовательность IFNG дикого типа человека (huIFNG) представлена в Gray et al. (Nature 298: 859-863, 1982), Taya et al. (EMBO J. 1: 953-958, 1982), Devos et al. (Nucleic Acids Res. 10: 2487-2501, 1982) и Rinderknecht et al. (J.Biol. Chem. 259: 6790-6797, 1984), а также в ЕР 0077670, ЕР 0089676 и ЕР 0110044. Трехмерная структура hulFNG приведена в Ealick et al. (Science 252: 698-701, 1991).
Сообщалось о различных естественных или мутированных формах полипептидов субъединиц IFNG, включая форму, содержащую N-концевую последовательность из аминокислот Cys-Tyr-Cys в положениях (-3)-(-1) относительно SEQ ID No:17, форму, содержащую N-концевой метионин (в положении – 1 относительно SEQ ID No:17) и различные укороченные с С-конца формы, содержащие 127-134 аминокислотных остатка. Известно, что удаление 1-15 аминокислотных остатков с С-конца не вызывает потери активности молекулы IFNG. К тому же Pan et al. (Eur. J. Biochem. 166: 145-149, 1987) сообщали о гетерогенности С-конца huIFNG.
О мутеинах huIFNG сообщали Slodowski et al. (Eur. J. Biochem. 202: 1133-1140, 1991), Luk et al. (J. Biol. Chem 265: 13314-13319, 1990), Seelig et al. (Biochemistry 27: 1981-1987, 1988), Trousdale et al. (Invest. Ophtalmol. Vis. Sci 26: 1244-1251, 1985), а также в ЕР 146354. О природном варианте huIFNG сообщали Nishi et al. (J. Biochem. 97: 153-159, 1985).
В US 6046034 раскрыты термостабильные рекомбинантные варианты huIFNG (rhuIFNG), в которые включено до 4 пар остатков цистеина для обеспечения образования дисульфидных мостиков и, таким образом, стабилизации варианта hulFNG в гомодимерной форме.
В WO 92/08737 раскрыты варианты IFNG, содержащие добавочный метионин на N-конце полной (остатки 1-143) или укороченной (остатки 1-132) аминокислотной последовательности IFNG дикого типа человека. В ЕР 0219781 раскрыта частичная последовательность huIFNG, содержащая аминокислотные остатки 3-124 (SEQ ID No:17). В US 4832959 раскрыты частичные последовательность hulFNG, содержащие остатки 1-127, 5-146 и 5-127 из аминокислотной последовательности, которая по сравнению с SEQ ID No:17 имеет три дополнительных N-концевых аминокислотных остатка (Cys-Tyr-Cys). В US 5004689 раскрыта последовательность ДНК, кодирующая huIFNG без трех аминокислотных остатков на N-конце (Cys-Tyr-Cys), и ее экспрессия в Е.coli. В ЕР О 446582 раскрыт полученный в Е.coli rhuIFNG, лишенный N-концевого метионина. В US 6120762 раскрыт пептидный фрагмент huIFNG, содержащий остатки 95-134 (относительно SEQ ID No:18).
Wang et al. (Sci. Sin. В 24: 1076-1084,1994) сообщали о высоком уровне экспрессии rhuIFNG.
Curling et al. (Biochem. J. 272: 333-337, 1990) и Hooker et al. (J. of Interferon and Cytokine Research, 1998, 18: 287-295) сообщали о гликозилированных вариантах rhuIFNG.
О модификации rhuIFNG полимерами сообщали Kita et al. (Drug Des. Deliv. 6: 157-167, 1990) и в ЕР 236987 и US 5109120.
В WO 92/22310 раскрыты асиалогликопротеиновые конъюгаты интерферонов, в том числе и huIFNG.
Были описаны и слитые белки IFNG. Например, в ЕР 0237019 раскрыт одноцепочечный полипептид, у которого один участок обладает активностью  -интерферона, а другой участок – активностью IFNG. -интерферона, а другой участок – активностью IFNG.
В ЕР 0158198 раскрыт одноцепочечный полипептид, у которого один участок обладает активностью IFNG, а другой участок – активностью IL-2. В нескольких работах описаны одноцепочечные димерные белки IFNG, например Landar et al. (J. Mol. Biol. 2000, 299: 169-179).
В WO 99/02710 раскрыты одноцепочечные полипептиды, среди которых один из многих представляет собой IFNG.
В WO 99/03887 раскрыты модифицированные PEG варианты полипептидов, принадлежащих к суперсемейству гормонов роста, в которых несущественный аминокислотный остаток, расположенный в определенном участке полипептида, был заменен остатком цистеина. IFNG упоминается как один из представителей суперсемейства гормонов роста, но о его модификации не приводится никаких подробностей.
IFNG предлагали для лечения интерстициальных легочных заболеваний (также известных как интерстициальный фиброз легких (IPF) (Ziesche et al., N. Engl. J. Med. 341: 1264-1269, 1999; Chest 110: Suppi: 25S, 1996) и в ЕР 0795332, для этих целей IFNG может применяться в сочетании с преднизолоном. Помимо IPF, с помощью IFNG можно лечить грануломатозные заболевания (Bolinger et al., Clinical Pharmacy, 1992, 11: 834-850), некоторые микобактериальные инфекции (N. Engl. J. Med. 330: 1348-1355, 1994), рак почек (J. Urol. 152: 841-845, 1994), остеопетроз (N. Engl. J. Med. 332: 1594-1599, 1995), склеродермию (J. Rheumatol. 23: 654-658, 1996), гепатит В (Hepatogastroenterology 45: 2282-2294, 1998), гепатит С (Int. Hepatol. Communic. 6: 264-273, 1997), септический шок (Nature Medicine 3: 678-681, 1997) и ревматоидный артрит.
В качестве фармацевтического соединения rhuIFNG применяется с определенным успехом, прежде всего, против некоторых вирусных инфекций и опухолей. rhuIFNG обычно применяется в виде парентеральных, предпочтительно подкожных, инъекций. Максимальная концентрация в сыворотке обнаруживается через 7 часов. Период полужизни в плазме составляет 30 минут после внутривенного введения. По этой причине эффективное лечение при помощи rhuIFNG подразумевает частые инъекции. Основные неблагоприятные побочные эффекты заключаются в жаре, ознобе, потливости, головной боли, миалгии и сонливости. Такие эффекты связаны с введением rhuIFNG и наблюдаются в первые часы после инъекции. К редко встречающимся побочным эффектам относятся боль и эритема в месте инъекции, повышение печеночных ферментов, обратимая грануло- и тромбопения и кардиотоксичность.
В WO 01/36001 раскрыты новые конъюгаты IFNG, содержащие неполипептидный компонент, присоединенный к полипептиду IFNG, который был модифицирован путем введения и/или удаления сайтов для присоединения таких неполипептидных компонентов, например, сайтов для PEG и сайтов гликозилирования.
Хорошо известно, что когда N-гликозилированные молекулы, такие как IFNG, продуцируются в гликозилирующем хозяине, не все потенциальные сайты N-гликозилирования полностью утилизируются. Это означает, что достаточно часто получается смесь белков с различной степенью N-гликозилирования in vivo, что в свою очередь приводит к необходимости последующей очистки. К тому же зачастую разделение идентичных белков с различной степенью гликозилирования требует времени и представляется затруднительным. Однако неожиданно оказалось, что замещение одного или нескольких аминокислотных остатков, расположенных вблизи от сайта N-гликозилирования in vivo (независимо от того, присутствует ли сайт N-гликозилирования in vivo естественным образом в IFNG или он был введен, к примеру, как описано в WO 01/36001), дает возможность повысить долю полностью гликозилированных молекул IFNG. В частности, было обнаружено, что замена естественных сайтов N-гликозилирования N-Y-S в положениях 97, 98 и 99 в huIFNG на N-Y-T приводит к резкому увеличению доли полностью гликозилированных молекул IFNG.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Итак, первый аспект изобретения касается варианта полипептида  -интерферона (IFNG), обладающего активностью IFNG и имеющего аминокислотную последовательность, представленную в SEQ ID No:1 ([S99T]huIFNG), или его фрагмента, обладающего активностью IFNG. -интерферона (IFNG), обладающего активностью IFNG и имеющего аминокислотную последовательность, представленную в SEQ ID No:1 ([S99T]huIFNG), или его фрагмента, обладающего активностью IFNG.
Следующий аспект изобретения касается варианта SEQ ID No:1, включая вариант фрагментов SEQ ID No:1 (таких как SEQ ID No:2-16), при этом данный вариант включает по меньшей мере одну дополнительную модификацию и обладает активностью IFNG.
Другие аспекты настоящего изобретение касаются нуклеотидной последовательности, кодирующей вариант полипептида по изобретению.
Следующие аспекты настоящего изобретения касаются экспрессионного вектора, содержащего нуклеотидные последовательности по изобретению, и гликозилирующих клеток-хозяев, содержащих нуклеотидную последовательность по изобретению или экспрессионный вектор по изобретению.
Настоящее изобретение также касается фармацевтической композиции, содержащей вариант полипептида по изобретению, и варианта полипептида по изобретению или фармацевтической композиции по изобретению для применения в качестве лекарственного средства.
Следующие аспекты изобретения касаются применения варианта полипептида по изобретению или применения фармацевтической композиции по изобретению для изготовления лекарственного средства для лечения интерстициальных легочных заболеваний.
Аналогичным образом, настоящее изобретение также касается способа лечения или профилактики интерстициальных легочных заболеваний, при этом способ заключается во введении млекопитающему, в частности человеку, нуждающемуся в этом, эффективного количества варианта полипептида по изобретению или фармацевтической композиции по изобретению.
Следующий аспект изобретения касается популяции вариантов полипептида IFNG или композиции, содержащей популяцию вариантов полипептида IFNG, при этом популяция содержит по меньшей мере 70% варианта полипептида IFNG по изобретению.
Следующий аспект настоящего изобретения касается способа повышения степени N-гликозилирования in vivo исходного полипептида IFNG, содержащего по меньшей мере один сайт N-гликозилирования in vivo с аминокислотной последовательностью N-X-S, где Х – любой аминокислотный остаток, за исключением пролина, причем способ включает замену остатка серина в указанной аминокислотной последовательности N-X-S остатком треонина для получения варианта IFNG.
Следующий аспект настоящего изобретения касается способа получения варианта полипептида IFNG по изобретению, при этом способ включает:
(a) культивирование гликозилирующей клетки-хозяина, содержащей нуклеотидную последовательность, кодирующую вариант полипептида IFNG по изобретению, в условиях, способствующих экспрессии этого варианта полипептида;
(b) необязательно проведение реакции указанного варианта полипептида с неполипептидным компонентом in vitro в условиях, способствующих осуществлению конъюгации; и
(c) извлечение варианта полипептида.
Другие аспекты настоящего изобретения станут понятными из нижеследующего описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлены результаты Вестерн блоттинга оптимизированных по гликозилированию вариантов rhuIFNG. Левый блот: дорожка 1 – стандарт, 2 – Actimmune®, 3 – rhuIFNG, 4 – [E38N]rhuIFNG. Средний блот: дорожка 1 – стандарт, 2 – rhuIFNG, 3 – [E38N+S40T]rhuIFNG. Правый блот: дорожка 1 – стандарт, 2 – rhuIFNG, 3 – [S99T]rhuIFNG, 4 – [E38N+S40T+S99T]rhuIFNG.
На фиг.2 представлена кривая активность IFNG в сыворотке-время после подкожного введения крысам.  – Actimmune®, – Actimmune®,  – rhuIFNG, – rhuIFNG,  – [E38N+S40T+S99T]-rhuIFNG. Все соединения вводили в одинаковых дозах (1,15×107 AU/кг). – [E38N+S40T+S99T]-rhuIFNG. Все соединения вводили в одинаковых дозах (1,15×107 AU/кг).
На фиг.3 представлена кривая активность IFNG в сыворотке-время после подкожного введения крысам.  – [N16C+S99T]rhuIFNG (присоединен mPEG размером в 5 кДа), – [N16C+S99T]rhuIFNG (присоединен mPEG размером в 5 кДа),  – [N16C+S99T]rhuIFNG (присоединен mPEG размером в 10 кДа), – [N16C+S99T]rhuIFNG (присоединен mPEG размером в 10 кДа),  – [E38N+S40T+S99T]rhuIFNG. Вариант [E38N+S40T+S99T] вводили в дозе 1,15×107 AU/кг, тогда как оба модифицированных PEG варианта вводили в дозах 4,6×106 AU/кг. – [E38N+S40T+S99T]rhuIFNG. Вариант [E38N+S40T+S99T] вводили в дозе 1,15×107 AU/кг, тогда как оба модифицированных PEG варианта вводили в дозах 4,6×106 AU/кг.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Определения
В контексте настоящей заявки и изобретения применимы следующие определения.
Термин “конъюгат” (или взаимозаменяемо “конъюгированный полипептид” или “конъюгированный вариант”) служит для обозначения гетерогенной (в смысле состава или химерной) молекулы, образованной при ковалентном присоединении одного или нескольких вариантов полипептида к одному или нескольким неполипептидным компонентам. Термин ковалентное присоединение означает, что вариант полипептида и неполипептидный компонент ковалентно связаны друг с другом либо непосредственно, либо непрямо через промежуточный компонент или компоненты, такие как мостики, спейсеры или молекулы линкера. Предпочтительно конъюгированный вариант полипептида растворим при релевантной концентрации и условиях, то есть растворим в физиологических средах типа крови. Примеры конъюгированных вариантов полипептида по изобретению включают гликозилированные и/или модифицированные PEG варианты полипептида. Термин “неконъюгированный вариант полипептида” может применяться к полипептидному компоненту конъюгированного варианта полипептида.
Термин “неполипептидный компонент” служит для обозначения молекулы, способной к конъюгированию со связующей группой варианта полипептида IFNG. Предпочтительные примеры таких молекул включают молекулы полимеров, липофильные соединения, сахара и органические модифицирующие агенты. Подразумевается, что неполипептидный компонент связан с полипептидом через связующую группу варианта полипептида. За исключением случаев, когда число неполипептидных компонентов типа молекул полимеров, присоединенных к варианту полипептида IFNG, указано точно, всякое упоминание “неполипептидного компонента”, присоединенного к варианту полипептида IFNG или иным образом используемого в настоящем изобретении, следует понимать как одну или несколько “неполипептидных компонентов”, присоединенных к варианту полипептида IFNG.
Термин “молекула полимера” означает молекулу, образованную путем ковалентной связи между двумя и более мономерами, причем ни один из мономеров не является остатком аминокислоты. Термин “полимер” может применяться взаимозаменяемо с термином “молекула полимера”.
Термин “остаток сахара” служит для обозначения молекулы углевода, присоединенной путем гликозилирования in vivo или in vitro, например N- или О-гликозилирования.
“Сайт N-гликозилирования” имеет последовательность N-X-S/T/C, где Х – любая аминокислота за исключением пролина, N – аспарагин и S/T/C – серин, треонин или цистеин, предпочтительно серии или треонин, наиболее предпочтительно – треонин. “Сайт О-гликозилирования” представляет собой ОН-группу остатка серина или треонина.
Термин “связующая группа” служит для обозначения группы аминокислотного остатка, способной к конъюгированию с релевантным неполипептидным компонентом, таким как молекула полимера или остаток сахара. Подходящие связующие группы и соответствующие им неполипептидные компоненты приведены ниже в таблице.
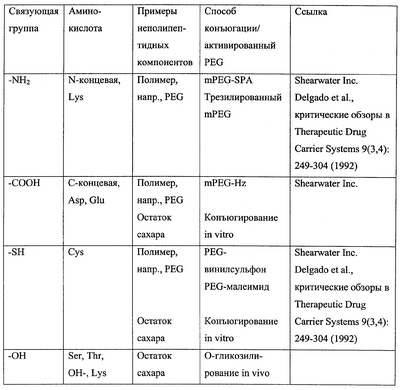 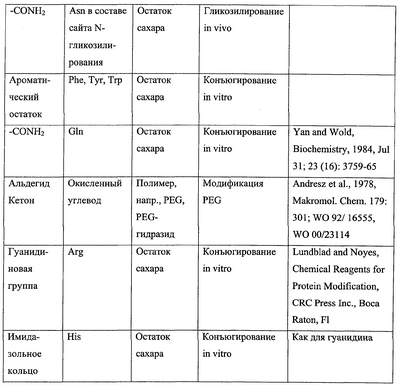
В отношении N-гликозилирования in vivo термин “связующая группа” применяется нестандартным образом для обозначения аминокислотных остатков, составляющих сайт N-гликозилирования (имеющий последовательность N-X-S/T/S, где Х – любой аминокислотный остаток, кроме пролина, N – аспарагин и S/T/C – серин, треонин или цистеин, предпочтительно серин или треонин, наиболее предпочтительно – треонин). Несмотря на то что именно остаток аспарагина в сайте N-гликозилирования служит для присоединения остатка сахара при гликозилировании, такое присоединение не происходит, если отсутствуют другие аминокислотные остатки сайта N-гликозилирования. Соответственно, когда неполипептидный компонент представлен остатком сахара, а конъюгация происходит путем N-гликозилирования, термин “аминокислотный остаток, содержащий связующую группу для неполипептидного компонента” в применении к изменениям аминокислотной последовательности полипептида IFNG следует понимать как то, что один, два или все аминокислотные остатки, составляющие сайт N-гликозилирования, подвергаются такому изменению, при котором функциональный сайт N-гликозилирования вводится в аминокислотную последовательность либо удаляется из нее, или же функциональный сайт N-гликозилирования сохраняется в аминокислотной последовательности (например, при замещении остатка серина, уже входящего в состав сайта N-гликозилирования, остатком треонина и наоборот).
В настоящей заявке названия и обозначения аминокислот и атомов (к примеру, CA, CB, CD, CG, SG, NZ, N, O, C и т.д.) применяются согласно определениям Базы Данных по Белкам (Protein DataBank, PDB) (www.pdb.org), которые основаны на номенклатуре IUPAC (IUPAC Nomenclature and Symbolism for Amino Acids and Peptides (residue names, atom names etc.), Eur. J. Biochem., 138, 9-37 (1984) вместе с поправками в Eur. J. Biochem., 152, 1 (1985). СА иногда обозначается как С , СВ – как С , СВ – как С . Термин “аминокислотный остаток” служит для обозначения аминокислотных остатков, входящих в группу, состоящую из остатков аланина (Ala или А), цистеина (Cys или С), аспарагиновой кислоты (Asp или D), глутаминовой кислоты (Glu или Е), фенилаланина (Phe или F), глицина (Gly или G), гистидина (His или Н), изолейцина (Ile или I), лизина (Lys или К), лейцина (Leu или L), метионина (Met или М), аспарагина (Asn или N), пролина (Pro или Р), глутамина (Gln или Q), аргинина (Arg или R), серина (Ser или S), треонина (Thr или Т), валина (Val или V), триптофана (Trp или W) и тирозина (Tyr или Y). . Термин “аминокислотный остаток” служит для обозначения аминокислотных остатков, входящих в группу, состоящую из остатков аланина (Ala или А), цистеина (Cys или С), аспарагиновой кислоты (Asp или D), глутаминовой кислоты (Glu или Е), фенилаланина (Phe или F), глицина (Gly или G), гистидина (His или Н), изолейцина (Ile или I), лизина (Lys или К), лейцина (Leu или L), метионина (Met или М), аспарагина (Asn или N), пролина (Pro или Р), глутамина (Gln или Q), аргинина (Arg или R), серина (Ser или S), треонина (Thr или Т), валина (Val или V), триптофана (Trp или W) и тирозина (Tyr или Y).
Нумерация аминокислотных остатков в настоящем документе начинается с N-конца [S99T]huIFNG без сигнального пептида (то есть SEQ ID No:1) или, где уместно, с N-конца huIFNG без сигнального пептида (то есть SEQ ID No:17).
Терминология, используемая для обозначения положения/замены аминокислот, иллюстрируется следующим образом: G18 означает положение 18, занятое глицином в аминокислотной последовательности, приведенной в SEQ ID No:17 G18N означает, что остаток Gly в положении 18 был заменен на Asn. Множественные замены обозначаются через “+”, например G18N+S20T означает аминокислотную последовательность, содержащую замену остатка Gly в положении 18 на Asn и замену остатка Ser в положении 20 на Thr. Альтернативные замены обозначаются через “/”. Например, G18S/T охватывает следующие индивидуальные замены: G18S и G18T. Делеции обозначаются звездочкой. Например, G18* означает, что остаток Gly в положении 18 был удален. Инсерции обозначаются следующим образом: инсерция дополнительного остатка Ser после остатка Gly, находящегося в положении 18, обозначается как G18GS. Комбинированные замены и инсерции обозначаются следующим образом: замена остатка Gly в положении 18 остатком Ser и инсерция остатка Ala после аминокислоты в положении 18 обозначается как G18SА.
Термин “нуклеотидная последовательность” служит для обозначения непрерывной цепочки из двух и более молекул нуклеотидов. Нуклеотидная последовательность может происходить из генома, кДНК, РНК, иметь полусинтетическое или синтетическое происхождение либо представлять собой любую их комбинацию.
Термин “полимеразная цепная реакция” или “ПЦР” в общем относится к методу амплификации требуемой нуклеотидной последовательности in vitro, как описано, к примеру, в US 4683195. В общем случае метод ПЦР заключается в многократном повторении цикла реакций удлинения праймера с использованием олигонуклеотидных праймеров, способных предпочтительно гибридизоваться с матричной нуклеиновой кислотой.
Термины “клетка”, “клетка-хозяин”, “линия клеток” и “культура клеток” в настоящем изобретении применяются взаимозаменяемо и следует иметь в виду, что все они включают потомство, образующееся в результате роста или культивирования клетки.
Термины “трансформация” и “трансфекция” в настоящем изобретении применяются взаимозаменяемо для обозначения процесса введения ДНК в клетку.
“Функционально связанный” относится к ковалентному соединению двух и более нуклеотидных последовательностей путем ферментативного лигирования или иным способом, в такой конфигурации друг относительно друга, чтобы могло осуществляться нормальное функционирование этих последовательностей. Например, нуклеотидная последовательность, кодирующая последовательность предшественника или лидера секреции, функционально связана с нуклеотидной последовательностью полипептида, если она экспрессируется в виде белка-предшественника, участвующего в секреции этого полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию этой последовательности; сайт связывания с рибосомой функционально связан с кодирующей последовательностью, если он располагается в таком положении, что способствует трансляции. В общем случае “функционально связанный” означает, что соединяемые нуклеотидные последовательности – смежные, а в случае лидера секреции – смежные и находятся в одной рамке считывания. Соединение осуществляется путем лигирования в соответствующих сайтах рестрикции. Если таких сайтов нет, то применяются синтетические олигонуклеотидные адаптеры или линкеры в соответствии со стандартными методами рекомбинантной ДНК.
Термин “модификация” в применении к настоящему изобретению охватывает замены, инсерции и делеции.
Термины “мутация” и “замена” применяются здесь взаимозаменяемо.
Термин “ввести” главным образом означает замещение существующего аминокислотного остатка, но может означать и вставку дополнительного аминокислотного остатка.
Термин “удалить” главным образом означает замещение аминокислотного остатка, подлежащего удалению, другим аминокислотным остатком, но может означать и делецию (без замещения) аминокислотного остатка, подлежащего удалению.
Выражение “аминокислотный остаток, содержащий связующую группу для неполипептидного компонента” служит для обозначения именного того аминокислотного остатка, с которым связывается неполипептидный компонент (в случае введения аминокислотного остатка) или с которым он мог бы связаться (в случае удаления аминокислотного остатка).
Выражение “одно отличие” или “отличается от” в применении к конкретным модификациям служит для обозначения дополнительных отличий, присутствующих помимо уже указанного различия по аминокислотам. Так, в дополнение к описанным изменениям аминокислотных остатков, имеющих целью оптимизацию использования сайтов гликозилирования или удаление и/или введение аминокислотных остатков, содержащих связующую группу для неполипептидного компонента, вариант полипептида IFNG может, если нужно, содержать другие модификации, не связанные с такими изменениями. Они могут включать, к примеру, укорочение С-конца на одну или несколько аминокислот, добавление одного и более дополнительных остатков на N- и/или С-конце, например, добавление остатка Met на N-конце, добавление аминокислотной последовательности Cys-Tyr-Cys на N-конце, а также “консервативные замены аминокислот”, то есть замены, осуществляемые в пределах группы аминокислот с близкими характеристиками, например, малых аминокислот, кислых аминокислот, полярных аминокислот, основных аминокислот, гидрофобных аминокислот и ароматических аминокислот. Примеры консервативных замен в настоящем изобретении, в частности, можно выбрать из групп, перечисленных в нижеследующей таблице.
| 1 |
Аланин (A) |
Глицин (G) |
Серии (S) |
Треонин (T) |
| 2 |
Аспарагиновая к-та (D) |
Глутаминовая к-та (Е) |
|
|
| 3 |
Аспарагин (N) |
Глутамин (Q) |
|
|
| 4 |
Аргинин (R) |
Гистидин (Н) |
Лизин (K) |
|
| 5 |
Изолейцин (I) |
Лейцин (L) |
Метионин (M) |
Валин(V) |
| 6 |
Фенилаланин (F) |
Тирозин (Y) |
Триптофан (W) |
|
Выражение “по меньшей мере” в применении к неполипептидному компоненту, аминокислотному остатку, замене и т.д. означает один или более.
Термин “AUCsc“, или “площадь под кривой при подкожном введении” применяется в его обычном значении, а именно как площадь под кривой активность IFGN в сыворотке/время после подкожного введения варианта полипептида IFGN, в частности при подкожном введении его крысам. После определения экспериментальных точек активности IFGN в зависимости от времени можно без труда рассчитать AUCsc с помощью компьютерной программы типа GraphPad Prism 3.01.
Термин “функциональный период полужизни in vivo” применяется в его обычном значении, как время, по прошествии которого в организме/органе-мишени остается 50% биологической активности полипептида, или как время, по прошествии которого активность полипептида составляет 50% от первоначального значения.
В качестве альтернативы определению функционального периода полужизни in vivo можно определять “время полужизни в сыворотке”, то есть время, по прошествии которого в плазме или кровотоке циркулирует 50% полипептида до полного выведения. Определение времени полужизни в сыворотке часто бывает проще, чем определение функционального периода полужизни in vivo, и величина полужизни в сыворотке обычно является хорошим показателем величины функционального периода полужизни in vivo. Термины, альтернативные времени полужизни в сыворотке – это “время полужизни в плазме”, “время полужизни в кровотоке”, “сывороточный клиренс”, “плазменный клиренс” и “период полувыведения”. Время полужизни в сыворотке можно без труда определить у крыс, см. раздел Материалы и Методы. Важно иметь в виду, что “время полужизни в сыворотке”, когда оно применяется в настоящем изобретении для данного варианта полипептида IFNG, необходимо определять для образца, который был введен внутривенно.
Термин “сыворотка” применяется в его обычном значении, как плазма крови без фибриногена и других факторов свертываемости.
Полипептид обычно выводится под действием одной или более ретикулоэндотелиальных систем (RES), почек, селезенки или печени, либо путем специфического или неспецифического протеолиза. Термин “почечный клиренс” применяется в его обычном значении для обозначения любого типа выведения через почки, например, посредством клубочковой фильтрации, выделения с мочой или элиминации в трубочках. Обычно выведение через почки зависит от физических характеристик полипептида, таких как молекулярный вес, размер (относительно предела исключения для клубочковой фильтрации), симметрия, форма/ упругость, заряд, присоединенные углеводные цепи и наличие клеточных рецепторов для полипептида. Молекулярный вес примерно в 67 кДа обычно считается пределом исключения при почечном клиренсе. Почечный клиренс можно определить любым подходящим методом, например одним из принятых методов in vivo. Например, почечный клиренс можно определить путем введения пациенту меченного (радиоактивной или флуоресцентной меткой) конъюгированного полипептида и измерения активности метки в собранной у пациента моче. Снижение почечного клиренса определяется относительно контрольной молекулы, такой как huIFNG, [S99T]huIFNG или Actimmune®. Функциональность, которая должна сохраняться, обычно выбирается из антивирусной, антипролиферативной, иммуномодуляторной активности или связывания с рецептором IFNG.
Термин “увеличение (повышение)” в применении к функциональному времени полужизни in vivo или в сыворотке означает, что соответствующее время полужизни варианта IFNG статистически достоверно увеличивается по сравнению с таковым для контрольной молекулы, такой как гликозилированный nuIFNG (SEQ ID No:17), гликозилированный [S99T]huIFNG (SEQ ID No:1) или Actimmune® (SEQ ID No:34 – продуцируемый в Е.coli), при внутривенном введении и при измерении в сравнимых условиях. Так, представляют интерес такие варианты полипептида IFNG, которые обладают увеличенным функциональным временем полужизни in vivo или в сыворотке по сравнению с любой из контрольных молекул, указанных выше.
В частности, представляют интерес такие варианты полипептида IFNG, для которых соотношение между временем полужизни в сыворотке (или функциональным периодом полужизни in vivo) данного варианта и временем полужизни в сыворотке (или функциональным периодом полужизни in vivo) huIFNG или [S99T]huIFNG в их гликозилированных формах составляет по меньшей мере 1,25, более предпочтительно по меньшей мере 1,50, например, по меньшей мере 1,75, например, по меньшей мере 2, еще более предпочтительно по меньшей мере 3, типа по меньшей мере 4, например, по меньшей мере 5, при внутривенном введении, в частности при внутривенном введении крысам.
Другими примерами представляющих интерес вариантов IFNG являются такие варианты, для которых соотношение между временем полужизни в сыворотке (или функциональным периодом полужизни in vivo) данного варианта и временем полужизни в сыворотке (или функциональным периодом полужизни in vivo) Actimmune® (SEQ ID No:34 – продуцируемый в Е.coli) составляет по меньшей мере 2, более предпочтительно по меньшей мере 3, типа по меньшей мере 4, например, по меньшей мере 5, еще более предпочтительно по меньшей мере 6, типа по меньшей мере 7, например, по меньшей мере 8, наиболее предпочтительно по меньшей мере 9, например, по меньшей мере 10, при внутривенном введении, в частности при внутривенном введении крысам.
Термин “повышение (увеличение)” в применении к AUCsc означает, что площадь под кривой для варианта IFNG по изобретению, при подкожном введении, статистически достоверно повышается по сравнению с таковой для контрольной молекулы, такой как гликозилированный huIFNG (SEQ ID No:17), гликозилированный [S99T]huIFNG (SEQ ID No:1) или Actimmune® (SEQ ID No:34 – продуцируемый в Е.coli), при определении в сравнимых условиях. Так, предпочтительны такие варианты IFNG, у которых AUCsc повышается по сравнению с любой из контрольных молекул, указанных выше. Конечно, следует вводить одинаковое количество активности варианта IFNG по изобретению и контрольной молекулы. Впоследствии, для проведения прямых сравнений между различными молекулами IFNG значение AUCsc можно нормализировать, то есть их можно выражать в виде AUCsc/введенная доза.
Особенно предпочтительны такие варианты IFNG, для которых соотношение между AUCsc данного варианта и AUCsc гликозилированного huIFNG или гликозилированного [S99T]huIFNG составляет по меньшей мере 1,25, типа по меньшей мере 1,5, например, по меньшей мере 2, более предпочтительно по меньшей мере 3, типа по меньшей мере 4, например, по меньшей мере 5 или 6, еще более предпочтительно по меньшей мере 7, типа по меньшей мере 8, например, по меньшей мере 9 или 10, наиболее предпочтительно по меньшей мере 12, типа по меньшей мере 14, например, по меньшей мере 16, 18 или 20, в частности при (подкожном) введении крысам.
Другими примерами особенно предпочтительных вариантов IFNG являются такие варианты, для которых соотношение между AUCsc данного варианта и AUCsc Actimmune® составляет по меньшей мере 100, более предпочтительно по меньшей мере 150, типа по меньшей мере 200, например, по меньшей мере 250, еще более предпочтительно по меньшей мере 300, типа по меньшей мере 400, например, по меньшей мере 500, наиболее предпочтительно по меньшей мере 750, типа по меньшей мере 1000, например, по меньшей мере 1500 или 2000, в частности при (подкожном) введении крысам.
Термин “Tmax,sc” относится к тому времени на кривой активность IFNG в сыворотке-время, когда наблюдается максимальная активность IFNG в сыворотке. Предпочтительными вариантами IFNG по изобретению являются такие варианты, у которых Тmax,sc повышается по сравнению с Actimmune® и/или по сравнению с гликозилированным huIFNG. В частности, у таких предпочтительных вариантов Tmax,sc (при определении после подкожного введения крысам) составляет по меньшей мере 200 мин, типа по меньшей мере 250 мин, например, по меньшей мере 300 мин, более предпочтительно по меньшей мере 350 мин, например, по меньшей мере 400 мин.
Термин “пониженная иммуногенность” означает, что вариант полипептида IFNG вызывает измеримо меньший иммунный ответ, чем контрольная молекула, к примеру, huIFNG или Actimmune®, при определении в сравнимых условиях. Иммунный ответ может быть клеточным или антительным (развернутое определение иммуногенности см., к примеру, в Roitt: Essential Immunology (8th edition, Blackwell). Обычно снижение антительной реакции является показателем пониженной иммуногенности. Пониженная иммуногенность может быть определена любым подходящим способом, известным в этой области, например, in vivo или in vitro.
В контексте настоящего изобретения термин “повышенное гликозилирование”, “повышение степени N-гликозилирования in vivo” или “повышение степени N-гликозилирования” служит для обозначения повышенного содержания присоединенных углеводных молекул, что обычно происходит вследствие более высокого (или лучшего) использования сайта/ов гликозилирования. Хорошо известно (Hooker et al., 1998, J. Interferon and Cytokine Res. 18, 287-295 и Sarenva et al., 1995, Biochem J., 308, 9-14), что при экспрессии huIFNG в клетках СНО только у 50% молекул IFNG используются оба сайта гликозилирования, у 40% – используется один сайт гликозилирования (1N) и около 10% не гликозилированы (0N). Повышение степени N-гликозилирования in vivo можно определить любым подходящим способом, известным в этой области, например электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE). Один из удобных методов определения повышенного гликозилирования описан в Материалах и Методах, в разделе под названием “Определение повышенной степени гликозилирования”.
Применяемый в настоящем изобретении термин “популяция вариантов полипептида IFNG” или “композиция, содержащая популяцию вариантов полипептида IFNG” служит для обозначения композиции, содержащей по меньшей мере два полипептида IFNG, в разной степени гликозилированных. Как это станет ясно, настоящее изобретение обеспечивает способы получения популяции полипептидов IFNG, в которой содержится повышенное количество полностью гликозилированных молекул IFNG.
Таким образом, настоящее изобретение также касается гомогенной популяции полипептидов IFNG по изобретению (то есть популяции, в которой большинство полипептидов IFNG полностью гликозилировано) или композиций, содержащих гомогенную популяцию полипептидов IFNG по изобретению. Например, популяция полипептидов IFNG может содержать по меньшей мере 70% полипептида IFNG по изобретению, предпочтительно по меньшей мере 75%, типа по меньшей мере 80%, например, по меньшей мере 85%, более предпочтительно по меньшей мере 90%, типа по меньшей мере 95%, например, по меньшей мере 96%, еще более предпочтительно 97%, типа по меньшей мере 98%, например, по меньшей мере 99%.
Термин “обладающий активностью IFNG” означает то, что вариант полипептида обладает одной или более функциями нативного huIFNG или rhuIFNG, включая его способность связываться с рецептором IFNG и вызывать передачу сигнала при связывании hulFNG со своим рецептором при определении in vitro или in vivo (то есть биоактивность in vitro или in vivo). Рецептор IFNG был описан Aguet et al. (Cell 55: 273-280, 1988) и Calderon et al. (Proc. Natl. Acad. Sci. USA 85: 4837-4841, 1988). Подходящим способом измерения активности IFNG является способ, раскрытый в настоящем изобретении под названием “Первичный анализ”. При применении описанного здесь “первичного анализа” удельная активность вариантов полипептида, “обладающих активностью IFNG”, составляет по меньшей мере 5% по сравнению с rhuIFNG. Следует иметь в виду, что в зависимости от того, какая проводилась конкретная модификация, например, модифицирован PEG этот вариант или нет, активность может варьировать в широком диапазоне. Так, примеры удельных активностей могут варьировать от таких низких значений, как 5%, до таких высоких, как 150% по сравнению с rhuIFNG. Например, удельная активность может составлять по меньшей мере 10% (например, 10-125%), по меньшей мере 15% (например, 15-125%), по меньшей мере 20% (например, 20-125%), по меньшей мере 25% (например, 25-125%), по меньшей мере 30% (например, 30-125%), по меньшей мере 35% (например, 35-125%), по меньшей мере 40% (например, 40-125%), по меньшей мере 45% (например, 45-125%), по меньшей мере 50% (например, 50-125%), по меньшей мере 55% (например, 55-125%), по меньшей мере 60% (например, 60-125%), по меньшей мере 65% (например, 65-125%), по меньшей мере 70% (например, 70-125%), по меньшей мере 75% (например, 75-125%), по меньшей мере 80% (например, 80-125%), или по меньшей мере 90% (например, 90-110%) по сравнению с удельной активностью rhuIFNG.
“Полипептид IFNG” – это полипептид, обладающий активностью IFNG, то есть термин “полипептид IFNG” относится к любой молекуле IFNG (независимо от того, является ли она huIFNG, укороченной его формой или вариантом), если указанная молекула IFNG обладает активностью IFNG согласно данному определению. Термин “полипептид IFNG” относится и к полипептиду в форме мономера или димера, по ситуации. Например, при обозначении конкретных замен их обычно указывают относительно мономерного полипептида huIFNG. В случае, когда указана молекула IFNG по изобретению, то обычно это означает димер (она при этом содержит два мономера полипептида IFNG, модифицированных, как описано). Димерная форма полипептидов IFNG может быть получена при нормальной ассоциации двух мономеров или находиться в форме одноцепочечного димера полипептида IFNG.
Термин “исходный” служит для обозначения того, что полипептид IFNG содержит сайт(ы) гликозилирования, улучшенные в соответствии с настоящим изобретением. Хотя исходный полипептид, подлежащий модификации в соответствии с настоящим изобретением, может быть любым полипептидом, обладающим активностью IFNG, и, таким образом, он может быть любого происхождения, например из любого млекопитающего (не человека), однако предпочтительно, чтобы исходным полипептидом был huIFNG с аминокислотной последовательностью, представленной в SEQ ID No:17, или его фрагмент.
“Фрагмент” – это часть полноразмерной последовательности полипептида IFNG (например, фрагмент полноразмерного полипептида huIFNG, приведенного в SEQ ID No:17, или фрагмент полноразмерного варианта полипептида [S99T]huIFNG, приведенного в SEQ ID No:1), обладающий активностью IFNG, например, укороченный с С- или N-конца вариант. Конкретные примеры фрагментов варианта полипептида IFNG включают фрагменты [S99T]huIFNG, укороченные с С-конца на 1-15 аминокислотных остатков, например, на 1 аминокислотный остаток (SEQ ID No:2), на 2 аминокислотных остатка (SEQ ID No:3), на 3 аминокислотных остатка (SEQ ID No:4), на 4 аминокислотных остатка (SEQ ID No:5), на 5 аминокислотных остатков (SEQ ID No:6), на 6 аминокислотных остатков (SEQ ID No:7), на 7 аминокислотных остатков (SEQ ID No:8), на 8 аминокислотных остатков (SEQ ID No:9), на 9 аминокислотных остатков (SEQ ID No:10), на 10 аминокислотных остатков (SEQ ID No:11), на 11 аминокислотных остатков (SEQ ID No:12), на 12 аминокислотных остатков (SEQ ID No:13), на 13 аминокислотных остатков (SEQ ID No:14), на 14 аминокислотных остатков (SEQ ID No:15) или 15 аминокислотных остатков (SEQ ID No:16), и/или укороченные с N-конца на 1-3 аминокислотных остатка. Конкретные примеры фрагментов huIFNG включают huIFNG, укороченные с С-конца на 1-15 аминокислотных остатков, например, на 1 аминокислотный остаток (SEQ ID No:19), на 2 аминокислотных остатка (SEQ ID No:20), на 3 аминокислотных остатка (SEQ ID No:21), на 4 аминокислотных остатка (SEQ ID No:22), на 5 аминокислотных остатков (SEQ ID No:23), на 6 аминокислотных остатков (SEQ ID No:24), на 7 аминокислотных остатков (SEQ ID No:25), на 8 аминокислотных остатков (SEQ ID No:26), на 9 аминокислотных остатков (SEQ ID No:27), на 10 аминокислотных остатков (SEQ ID No:28), на 11 аминокислотных остатков (SEQ ID No:29), на 12 аминокислотных остатков (SEQ ID No:30), на 13 аминокислотных остатков (SEQ ID No:31), на 14 аминокислотных остатков (SEQ ID No:32) или 15 аминокислотных остатков (SEQ ID No:33), и/или укороченные с N-конца на 1-3 аминокислотных остатка.
Как указано выше, вариант полипептида IFNG может содержать по меньшей мере еще одну модификацию в дополнение к замене S99T, до тех пор, пока этот вариант обладает активностью IFNG, то есть он может быть вариантом [S99T]huIFNG или вариантом фрагмента [S99T]huIFNG. Конкретными примерами таких вариантов являются варианты со введенными и/или удаленными аминокислотными остатками, содержащими связующую группу для неполипептидного компонента. Другие примеры вариантов [S99T]huIFNG (и его фрагментов) описаны в предыдущем разделе “Уровень техники” и включают, к примеру, [S99T]huIFNG с добавлением Cys-Tyr-Cys или Met на N-конце, а также варианты с модификациями по цистеину, раскрытые в US 6046034.
В норме вариант согласно изобретению кодируется нуклеотидной последовательностью, которая, по сравнению с нуклеотидной последовательностью, кодирующей исходный полипептид IFNG, подвергалась модификации в соответствии с настоящим изобретением.
Однако это не всегда верно, так как вариант полипептида может подвергаться укорочению с С- или N-конца во время посттрансляционного процессинга, например, при С- или N-концевом расщеплении протеазами в клетке, в экспрессионной среде, во время очистки и т.д., так что конечный вариант полипептида будет укороченной версией первоначально полученного варианта полипептида (например, хотя сначала образуется полноразмерный вариант, однако в результате его посттрансляционного процессинга может быть получен укороченный с С-конца вариант полипептида). В этом случае под термином “исходный (родительский)” следует понимать укороченную форму, которая подвергается модификации согласно настоящему изобретению.
Термин “вариант” служит для обозначения полипептида, отличающегося по одному или более аминокислотным остаткам от родительского полипептида (обычно это SEQ ID No:17 или любая укороченная его форма, приведенная в SEQ ID No:19-33), обычно по 1-15 аминокислотным остаткам (к примеру, по 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотным остаткам), например, по 1-10 аминокислотным остаткам, по 1-5 аминокислотным остаткам или по 1-3 аминокислотным остаткам.
Термин “функциональный сайт” служит для обозначения одного или нескольких аминокислотных остатков, необходимых для функционирования или работы IFNG или иным образом участвующих в этом. Такие аминокислотные остатки “располагаются” в функциональном сайте. Функциональный сайт можно определить способами, известными в этой области, но предпочтительно его идентифицируют путем анализа структуры полипептида в комплексе с соответствующим рецептором, таким как рецептор IFNG.
Термин “huIFNG” служит для обозначения зрелой формы IFNG дикого типа человека с аминокислотной последовательностью, представленной в SEQ ID No:17.
Термин “rhuIFNG” служит для обозначения зрелой формы IFNG дикого типа человека с аминокислотной последовательностью, представленной в SEQ ID No:17, которая была получена рекомбинантным путем.
Термин “[S99T]huIFNG” служит для обозначения зрелой формы IFNG дикого типа человека, в которой остаток серина в положении 99 был заменен остатком треонина (приведена в SEQ ID No:1).
Применяемый в настоящем изобретении термин “гликозилированный huIFNG” означает, что полипептид huIFNG был получен в клетке, способной к гликозилированию полипептида, таким образом, полипептид huIFNG гликозилирован по природным сайтам N-гликозилирования (положения 25 и 97 в SEQ ID No:17).
Аналогичным образом “гликозилированный вариант huIFNG” означает, что этот вариант полипептида huIFNG был получен в клетке, способной к гликозилированию варианта полипептида.
Применяемый в настоящем изобретении термин “Actimmune®” относится к форме IFNG из 140 аминокислот (Actimmune® укорочен с С-конца на 4 аминокислотных остатка и включает один N-концевой остаток Met) (приведена в SEQ ID No:34), полученной при ферментации созданных методами генетической инженерии бактерий Е. coli. Дополнительную информацию об Actimmune® можно получить на сайте www.actimmune.com.
Варианты полипептида г-интерферона по настоящему изобретению
Варианты IFNG по изобретению с оптимизированными сайтами гликозилирования in vivo
Как указывалась ранее, неожиданно было обнаружено, что гликозилирование природного сайта N-гликозилирования, находящегося в положении 97 huIFNG, может быть повышено, то есть может быть увеличена доля полностью или практически полностью гликозилированных молекул IFNG, при замещении остатка серина в положении 99 huIFNG (или его фрагментов) остатком треонина. Анализ фиг.1 показывает, что можно добиться значительного повышения доли полностью гликозилированного полипептида IFNG. В случае варианта полипептида [S99T]huIFNG (SEQ ID No:1) можно видеть, что примерно в 90% полипептидных вариантов в собранной культуральной среде использованы оба сайта N-гликозилирования, тогда как лишь около 60% находящегося в собранной среде полипептидов rhuIFNG было полностью гликозилировано.
Соответственно, первый аспект настоящего изобретения касается варианта полипептида IFNG, обладающего активностью IPNG и имеющего аминокислотную последовательность, приведенную в SEQ ID No:1 (то есть [S99T]huIFNG), или его фрагментов, обладающих активностью IFNG.
Как уже обсуждалось выше, известно, что укороченные с С-конца формы huIFNG сохраняют активность, а в некоторых случаях даже обладают повышенной активностью по сравнению с huIFNG. Так, представляет интерес воплощение изобретения, в котором вариант полипептида IFNG по изобретению представлен фрагментом SEQ ID No:1, укороченным с С-конца на 1-15 аминокислотных остатков, в типичном случае на 1-10 аминокислотных остатков. Конкретные примеры таких укороченных с С-конца форм SEQ ID No:1 раскрыты в SEQ ID No:2-16. Фрагмент полипептида IFNG согласно этому воплощению настоящего изобретения обладает активностью IFNG.
Следует иметь в виду, что гликозилированные варианты полипептида IFNG по этому аспекту следует экспрессировать рекомбинантным путем в гликозилирующей клетке-хозяине, предпочтительно клетке млекопитающего, из числа тех, что перечислены в разделе “Конъюгирование с сахаридным компонентом”.
Как объяснялось выше, лишь около 50-60% из всей популяции экспрессированных полипептидов IFNG полностью гликозилировано при экспрессии rhuIFNG в клетках СНО. Таким образом, одно из главных преимуществ вариантов полипептида IFNG настоящего изобретения состоит в повышении использования сайта N-гликозилирования in vivo в положении 97, что в свою очередь ведет к получению более гомогенной популяции по сравнению с huIFNG. Вследствие большей гомогенности популяции очистка композиций (к примеру, собранной среды), содержащих такую популяцию вариантов полипептида IFNG, не столь обременительна и не требует таких затрат времени, как в случае rhuIFNG.
Таким образом, следующий аспект настоящего изобретения касается популяции вариантов полипептида IFNG или композиции, включающей популяцию вариантов полипептида IFNG, причем указанная популяция содержит по меньшей мере 70% варианта полипептида IFNG по изобретению. Предпочтительно композиция содержит по меньшей мере 75%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 85%, например, около 90% варианта полипептида IFNG по изобретению.
В частности, изобретение касается популяции вариантов полипептида IFNG или композиции, включающей популяцию вариантов полипептида IFNG, причем указанная популяция содержит по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 85%, например, около 90% варианта полипептида IFNG, имеющего аминокислотную последовательность, приведенную в SEQ ID No:1.
Аналогичным образом, изобретение также касается популяции вариантов полипептида IFNG или композиции, включающей популяцию вариантов полипептида IFNG, причем указанная популяция содержит по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 85%, например, около 90% фрагмента варианта полипептида IFNG, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:2, SEQ ID No:3, SEQ ID No:4, SEQ ID No:5, SEQ ID No:6, SEQ ID No:7, SEQ ID No:8, SEQ ID No:9, SEQ ID No:10, SEQ ID No:11, SEQ ID No:12, SEQ ID No:13, SEQ ID No:14, SEQ ID No:15 и SEQ ID No:16.
Наряду с уже указанной мутацией S99T, необходимой для оптимизации сайта N-гликозилирования in vivo в положении 97 в rhuIFNG, можно оптимизировать и другие сайты гликозилирования in vivo, введенные в SEQ ID No:1 или его фрагменты (к примеру, для увеличения времени полужизни в сыворотке и/или для повышения AUCsc). Обычно сайтом гликозилирования in vivo является сайт N-гликозилирования, но сайт O-гликозилирования также предусматривается как относящийся к настоящему изобретению. Такая оптимизация может быть достигнута проведением модификации, предпочтительно замены, в положении, находящемся вблизи от сайта гликозилирования, в частности вблизи от сайта N-гликозилирования in vivo. Обычно таким сайтом N-гликозилирования in vivo является введенный сайт N-гликозилирования in vivo. Конкретные примеры положений подходящих для введения сайтов N-гликозилирования in vivo, раскрыты в WO 01/36001 и далее в тексте.
Аминокислотный остаток, “расположенный вблизи от” сайта гликозилирования, обычно находится в положении -4, -3, -2, -1, +1, +2, +3 или +4 относительно того аминокислотного остатка сайта гликозилирования, к которому присоединен углевод, предпочтительно в положении -1, +1 или +3, особенно в положении +1 или +3. Так, аминокислотный остаток, расположенный вблизи от сайта N-гликозилирования in vivo (имеющего последовательность N-X-S/T/C), может находиться в положении -4, -3, -2, -1, +1, +2, +3 или +4 относительно остатка N.
Когда модификация проводится в положении +2 относительно остатка N, то следует иметь в виду, что возможно лишь ограниченное число модификаций, так как для сохранения/введения сайта N-гликозилирования in vivo аминокислотный остаток в указанном положении должен быть представлен Ser, Thr или Cys.
В отдельном предпочтительном воплощении изобретения модификация аминокислотного остатка в положении +2 относительно сайта N-гликозилировании in vivo представляет собой замену, при которой данный аминокислотный остаток замещается остатком Thr. С другой стороны, если данный аминокислотный остаток уже представлен Thr, то обычно не является предпочтительным или необходимым осуществлять какие-либо замены в этом положении. Когда Х подвергается модификации, Х не должен быть Pro, и предпочтительно не Trp, Asp, Glu или Leu. Кроме того, вводимый аминокислотный остаток предпочтительно выбирают из группы, состоящей из Phe, Asn, Gln, Tyr, Val, Ala, Met, Ile, Lys, Gly, Arg, Thr, His, Cys и Ser, более предпочтительно Ala, Met, He, Lys, Gly, Arg, Thr, His, Cys и Ser, в особенности Ala или Ser.
Когда модификация проводится в положении +3 относительно остатка N, то вводимый аминокислотный остаток предпочтительно выбирают из группы, состоящей из His, Asp, Ala, Met, Asn, Thr, Arg, Ser и Cys, более предпочтительно Thr, Arg, Ser и Cys. Такие модификации особенно важны, если остаток Х представлен остатком Ser.
Таким образом, в отношении природного сайта N-гликозилирования in vivo предусматривается, что сайт N-гликозилирования в положении 97 может быть еще более оптимизирован проведением модификации типа замены в положении, выбранном из группы, состоящей из Е93, К94, L95, Т96, Y98, V100 и Т101 (то есть в положении -4, -3, -2, -1, +1, +3 или +4 относительно N97). Конкретные примеры замен, проводимых в положении 98 SEQ ID No:1 (или его фрагментов), включают Y98F, Y98N, Y98Q, Y98V, Y98A, Y98M, Y98I, Y98K, Y98G. Y98R, Y98T, Y98H, Y98C и Y98S, предпочтительно Y98A, Y98M, Y98I, Y98K, Y98G, Y98R, Y98T, Y98H, Y98C и Y98S, в особенности Y98S. Конкретные примеры замен, проводимых в положении 100 SEQ ID No:1 (или его фрагментов), включают V100H, V100D, V100A, V100M, V100N, V100T, V100R, V100S или V100C, в особенности V100T, V100R, V100S или V100C.
Аналогичным образом, в отношении сайта N-гликозилирования in vivo в положении 25 предусматривается, что этот сайт может быть еще более оптимизирован проведением модификации типа замены в положении, выбранном из числа D21, V22, А23, D24, G26, L28 и F29 (то есть в положении -4, -3, -2, -1, +1, +3 или +4 относительно N25). Конкретные примеры замен, проводимых в положении 26 SEQ ID No:1 (или его фрагментов) включают G26F, G26N, G26Y, G26Q, G26V, G26A, G26M, G26I, G26K, G26R, G26T, G26H, G26C и G26S, предпочтительно G26A, G26M, G26I, G26K, G26R, G26T, G26H, G26C и G26S, более предпочтительно G26A и G26S, в особенности G26A. Конкретные примеры замен, проводимых в положении 28 SEQ ID No:1 (или его фрагментов) включают G28H, G28D, G28A, G28M, G28N, G28T, G28R, G28S или G28C, в особенности G28A, G28T, G28R, G28S или G28C.
Очевидно, что любая из модификаций, указанных в связи с оптимизацией гликозилирования в положении 97, может сочетаться с любой из указанных выше модификаций, проводимых в связи с оптимизацией гликозилирования в положении 25.
Варианты IFNG по изобретению с повышенным AUCsc и/или увеличенным временем полужизни в сыворотке
Следующий аспект настоящего изобретения касается варианта полипептида IFNG, имеющего аминокислотную последовательность, приведенную в SEQ ID No:1, при этом данный вариант обладает активностью IFNG.
Кроме того, настоящее изобретение также касается варианта фрагмента полипептида IFNG, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:2, SEQ ID No:3, SEQ ID No:4, SEQ ID No:5, SEQ ID No:6, SEQ ID No:7, SEQ ID No:8, SEQ ID No:9, SEQ ID No: 10, SEQ ID No:11, SEQ ID No:12, SEQ ID No:13, SEQ ID No:14, SEQ ID No:15 и SEQ ID No:16, при этом данный вариант обладает активностью IFNG.
Таким образом, этот вариант содержит по меньшей мере еще одну дополнительную модификацию по сравнению с SEQ ГО No:1-16.
Для того чтобы избежать слишком сильного нарушения структуры и функции варианта полипептида [S99T]huIFNG (или его фрагментов), общее число аминокислотных остатков, подлежащих модификации в соответствии с настоящим изобретением, в типичном случае не превышает 15. Обычно вариант полипептида IFNG содержит 1-10 модификаций относительно аминокислотной последовательности, приведенной в SEQ ID No:1, например, 1-8, 2-8, 1-5, 1-3 или 2-5 модификаций относительно аминокислотной последовательности, приведенной в SEQ ID No:1. Предпочтительно модификация/и представляет/ют собой замену/ы. Следует иметь в виду, что такие же соображения справедливы и для вариантов фрагментов варианта полипептида IFNG, имеющего аминокислотную последовательность, приведенную в SEQ ID No:1. Так, если вариант является вариантом любой из последовательностей, представленных в SEQ ID No:2-16, такой вариант обычно содержит менее 15 модификаций, в типичном случае 1-10 модификаций относительно соответствующей аминокислотной последовательности, приведенной в SEQ ID No:2-16, например, 1-8, 2-8, 1-5, 1-3 или 2-5 модификаций относительно соответствующей аминокислотной последовательности, представленной SEQ ID No:2-16. Предпочтительно модификация/и представляет/ют собой замену/ы.
Таким образом, в норме такой вариант полипептида IFNG (то есть вариант, содержащий по меньшей мере еще одну дополнительную модификацию вдобавок к замене S99T) имеет аминокислотную последовательность, отличающуюся от аминокислотной последовательности SEQ ID NO:1 (или ее фрагментов) по 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотным остаткам.
В предпочтительном воплощении изобретения вариант IFNG (дополнительно) содержит по меньшей мере один введенный и/или один удаленный аминокислотный остаток, содержащий связующую группу для неполипептидного компонента.
Путем удаления или введения аминокислотного остатка, содержащего связующую группу для неполипептидного компонента, становится возможным специфически адаптировать полипептид так, чтобы молекула стала более подверженной конъюгации с выбранным неполипептидным компонентом, оптимизировать профиль конъюгации (например, обеспечить оптимальное распределение неполипептидных компонентов на поверхности варианта полипептида IFNG) и при этом получить новую молекулу конъюгата, обладающего активностью IFNG, наряду с улучшением одного или нескольких свойств по сравнению с молекулами на основе huIFNG или rhuIFNG, доступными на сегодняшний день. Например, при введении связующих групп у варианта полипептида IFNG увеличивается или иным образом изменяется содержание специфических аминокислотных остатков, с которыми связывается соответствующий неполипептидный компонент, вследствие чего достигается более эффективная, специфичная и/или полная конъюгация. При удалении одной или нескольких связующих групп можно избежать конъюгации с неполипептидным компонентом в тех частях полипептида, с которыми такая конъюгация невыгодна, например, с аминокислотным остатком, расположенным в функциональном сайте полипептида или вблизи от него (так как конъюгация в таком сайте может привести к инактивации или снижению активности IFNG у полученного при этом конъюгированного полипептида вследствие нарушения узнавания рецептором). Далее, может быть полезным удаление связующей группы, находящейся вблизи от другой связующей группы, чтобы избежать гетерогенной конъюгации с такими группами. Представляют интерес воплощения, в которых происходит изменение более чем одного аминокислотного остатка полипептида IFNG, например, изменение охватывает как удаление, так и введение аминокислотных остатков, содержащих сайты для присоединения выбранного неполипептидного компонента. Такие воплощения представляют особенный интерес тем, что они дают возможность целенаправленно конструировать варианты полипептида IFNG с тем, чтобы достичь оптимальной конъюгации неполипептидного компонента.
Наряду с удалением и/или введением аминокислотных остатков вариант полипептида может включать и другие модификации, например замены, которые не связаны со введением и/или удалением аминокислотных остатков, содержащих связующую группу для неполипептидного компонента. Примеры таких модификаций включают консервативные замены аминокислот и/или введение Cys-Tyr-Cys или Met на N-конце.
Точное число связующих групп, доступных для конъюгации и присутствующих в димерной форме варианта полипептида IFNG, зависит от того эффекта, которого нужно достичь при конъюгации. Получаемый эффект зависит, к примеру, от природы и степени конъюгации (природы неполипептидного компонента, числа неполипептидных компонентов, которые нужно или можно конъюгировать с полипептидом, места, в котором их следует конъюгировать или избежать конъюгации, и т.д.).
Следует иметь в виду, что аминокислотный остаток, содержащий связующую группу для неполипептидного компонента и подлежащий удалению или введению, выбирается на основании природы выбранного неполипептидного компонента и, в большинстве случаев, на основании метода, применяемого для конъюгации. Например, когда неполипептидный компонент представлена молекулой полимера типа молекул – производных полиэтиленгликоля или полиалкиленоксида, то аминокислотные остатки, способные функционировать в качестве связующей группы, можно выбрать из числа цистеина, лизина, аспарагиновой кислоты, глутаминовой кислоты и аргинина. Особенно предпочтителен цистеин. Когда неполипептидный компонент представлен остатком сахара, то связующей группой служит, к примеру, сайт гликозилирования in vivo, предпочтительно сайт N-гликозилирования.
Когда связующую группу для неполипептидного компонента нужно ввести в полипептид IFNG с аминокислотной последовательностью, приведенной в SEQ ID No:1 (или его фрагмент), либо удалить из него, то подлежащее модификации положение в полипептиде обычно выбирают следующим образом.
Такое положение предпочтительно находится на поверхности полипептида IFNG, более предпочтительно оно занято аминокислотным остатком, у которого более 25% боковой цепи экспонировано на поверхности, предпочтительно более 50% боковой цепи экспонировано на поверхности, что установлено на основании трехмерной структуры или модели IFNG в димерной форме, причем структура или модель необязательно дополнительно содержит одну или две молекулы рецептора IFNG. Такие положения перечислены далее в Примере 1.
Также представляет интерес модификация любого из 23 С-концевых аминокислотных остатков исходного полипептида IFNG (в частности, путем введения аминокислотных остатков, содержащих связующую группу для неполипептидного компонента, например, остатков Cys), так как считается, что эти остатки располагаются на поверхности полипептида IFNG.
Кроме того, может представлять интерес модификация одного и более аминокислотных остатков, расположенных в областях петель полипептида IFNG, так как большинство аминокислотных остатков в этих областях петель экспонированы на поверхности и находятся достаточно далеко от функциональных сайтов, так что можно вводить неполипептидные компоненты типа молекул полимеров, особенно PEG, и/или сайтов N-гликозилирования, не нарушая функции молекулы. Такие области петель можно идентифицировать путем анализа трехмерной структуры huIFNG. Аминокислотные остатки, образующие области петель, – это остатки N16-K37 (петля “А-В”), F60-S65 (петля “В-С”), N83-S84 (петля “C-D”) и Y98-L103 (петля “D-E”).
Аминокислотные остатки, входящие в состав сайта связывания с рецептором IFNG, – это Q1, D2, Y4, V5, Е9, К12, G18, Н19, S20, D21, V22, А23, D24, N25, G26, Т27, L30, К34, К37, К108, H111, E112, I114, Q115, A118, E119 (см. далее Пример 2). В общем, в этот сайт молекулы предпочтительно не вводятся связующие группы для неполипептидного компонента (такие, как дополнительные сайты N-гликозилирования и/или остатки цистеина).
Для того чтобы установить оптимальное распределение связующих групп, рассчитывают расстояния между аминокислотными остатками, расположенными на поверхности полипептида IFNG, исходя из трехмерной структуры димера полипептида IFNG. В частности, определяют расстояния между атомами СВ аминокислотных остатков, содержащих такие связующие группы, или рассчитывают расстояния между функциональной группой (NZ у лизина, CG у аспарагиновой кислоты, CD у глутаминовой кислоты, SG у цистеина) одного и атомом СВ другого аминокислотного остатка, содержащего связующую группу. В случае глицина используют СА вместо СВ. В полипептиде IFNG по изобретению все такие расстояния предпочтительно составляют более 8 Å, в особенности более 10 Å, чтобы избежать гетерогенной конъюгации или уменьшить ее.
Кроме того, аминокислотная последовательность варианта полипептида IFNG может отличаться от SEQ ID No:1 (или ее фрагментов) тем, что один или несколько аминокислотных остатков, входящих в состав эпитопа, были удалены, предпочтительно путем замены аминокислотного остатка, содержащего связующую группу для неполипептидного компонента, с тем, чтобы разрушить или инактивировать эпитоп. Эпитопы [S99T]huIFNG, huIFNG или rhuIFNG можно идентифицировать известными в этой области методами, также известными как эпитопное картирование, например, см. Romagnoli et al., Biol Chem, 1999, 380 (5): 553-9; DeLisser HM, Methods Mol Biol, 1999, 96: 11-20; Van de Water et al., Clin Immunol Immunopathol, 1997, 85 (3): 229-35; Saint-Remy JM, Toxicology, 1997, 119 (1): 77-81; Lane DP and Stephen CW, Curr Opin Immunol, 1993, 5 (2): 268-71. Один из методов заключается в создании библиотеки фагового дисплея, экспрессирующей случайные олигопептиды, состоящие, к примеру, из 9 аминокислотных остатков. Антитела IgG1 очищают из антисывороток, специфичных к [S99T]huIFNG, huIFNG или rhuIFNG, методом иммунопреципитации, и идентифицируют реактивные фаги методом иммуноблоттинга. Секвенируя ДНК очищенных реактивных фагов, можно установить последовательность олигопептида, а затем локализировать эту последовательность на трехмерной структуре IFNG. Идентифицированный таким образом участок на структуре составляет эпитоп, который затем можно выбрать в качестве мишени для введения связующей группы для неполипептидного компонента.
Функциональный период полужизни in vivo и время полужизни в сыворотке зависят от молекулярного веса варианта полипептида, а число связующих групп, необходимых для увеличения времени полужизни, может зависеть от молекулярного веса данного неполипептидного компонента. В одном из воплощений вариант полипептида IFNG имеет молекулярный вес по меньшей мере 67 кДа, в особенности по меньшей мере 70 кДа, при измерении методом SDS-PAGE согласно Laemmli U.K., Nature Vol.227 (1970), 680-85. Молекулярный вес IFNG находится в пределах 34-50 кДа, поэтому нужны дополнительные 20-40 кДа для достижения требуемого эффекта. Это могут обеспечить, к примеру, 2-4 молекулы PEG по 10 кДа или комбинация из дополнительных сайтов гликозилирования in vivo и дополнительных молекул PEG, а также иным образом, как описано далее.
Предпочтительно конъюгированный вариант полипептида IFNG по изобретению содержит 1-10 (дополнительных) неполипептидных компонентов, например, 1-8, 2-8, 1-5, 1-3 или 2-5 (дополнительных) неполипептидных компонентов. Обычно конъюгированный вариант содержит 1-3 (дополнительные) неполипептидных компонента, например, 1, 2 или 3 (дополнительные) неполипептидных компонента.
Как указывалось выше, в физиологических условиях huIFNG существует в виде димерного полипептида. Обычно полипептид находится в виде гомодимера (к примеру, полученный путем ассоциации двух молекул полипептида IFNG, полученного как описано в настоящем изобретении). Однако при желании вариант полипептида IFNG может быть получен в одноцепочечной форме, когда два мономера полипептида IFNG соединены пептидной связью или через пептидный линкер. Получение варианта полипептида IFNG в одноцепочечной форме имеет то преимущество, что составляющие его два полипептида IFNG могут быть разными, что может быть выгодным, например, это создает возможность асимметричного мутагенеза этих полипептидов. Например, можно удалить сайты модификации PEG из рецептор-связывающего сайта одного из мономеров, но сохранить их в другом. При этом после модификации PEG у одного мономера будет интактный рецептор-связывающий сайт, тогда как другой может быть полностью модифицирован PEG (и таким образом обеспечит значительное повышение молекулярного веса).
Варианты IFNG по изобретению, у которых неполипептидный компонент представлен остатком сахара
В предпочтительном воплощении изобретения вариант IFNG с последовательностью SEQ ID No:1 (или его фрагменты) включает по меньшей мере один введенный сайт гликозилирования и/или по меньшей мере один удаленный сайт гликозилирования. Предпочтительно сайт гликозилирования представляет собой сайт N-гликозилирования in vivo, то есть неполипептидный компонент представлен остатком сахара, например, O-связанным или N-связанным остатком сахара, предпочтительно N-связанным остатком сахара.
В одном представляющем интерес воплощении изобретения данный вариант включает по меньшей мере один введенный сайт гликозилирования, в частности введенный сайт N-гликозилирования in vivo. Предпочтительно введенный сайт гликозилирования вводится путем замещения.
Например, сайт N-гликозилирования in vivo можно ввести в положение полипептида IFNG с последовательностью SEQ ID No:1 (или его фрагмента), занятое аминокислотным остатком, экспонированным на поверхности. Предпочтительно у такого экспонированного на поверхности аминокислотного остатка не менее 25% боковой цепи экспонировано на поверхности, в особенности не менее 50% боковой цепи экспонировано на поверхности. Подробности об определении таких положений приводятся далее в Примере 1.
Сайт N-гликозилирования вводится таким образом, чтобы остаток N этого сайта находился в указанном положении. Аналогичным образом вводится и сайт O-гликозилирования так, чтобы остаток S или Т, входящий в этот сайт, находился в указанном положении. Следует иметь в виду, что когда выражение “не менее 25% (или 50%) боковой цепи экспонировано на поверхности” применяется в связи со введением сайта N-гликозилирования in vivo, это выражение относится к поверхностной доступности боковой цепи аминокислоты именно в том положении, в котором происходит присоединение остатка сахара. Во многих случаях необходимо вводить остаток серина или треонина в положение +2 относительно именно того остатка аспарагина, к которому в действительности присоединяется остаток сахара, и те положения, в которые вводятся остатки серина или треонина, могут быть утоплены, то есть иметь экспонированными на поверхности молекулы менее 25% (или 50%) боковой цепи.
Кроме того, чтобы обеспечить эффективное гликозилирование, сайт гликозилирования in vivo, в частности остаток N сайта N-гликозилирования или остаток S или Т сайта O-гликозилирования предпочтительно должен находиться в пределах 118 N-концевых аминокислотных остатков полипептида IFNG, более предпочтительно в пределах 97 N-концевых аминокислотных остатков. Еще более предпочтительно сайт гликозилирования in vivo вводится в такое положение, в котором для создания этого сайта требуется лишь одна мутация (то есть туда, где все другие аминокислотные остатки, необходимые для создания функционального сайта гликозилирования, уже представлены в молекуле).
Так, замены, ведущие к введению дополнительного сайта N-гликозилирования в положения, экспонированные на поверхности полипептида IFNG и занятые аминокислотными остатками, у которых не менее 25% боковой цепи экспонировано на поверхности (в структуре с молекулой рецептора), включают: Q1N+P3S/T, P3N+V5S/T, K6N+A8S/T, E9N+L11S/T, K12S/T, K13N+F15S/T, Y14N+N16S/T, G18S/T, G18N, G18N+S20T, H19N+D21S/T, D21N+A23S/T, G26N+L28S/T, G31N+L33S/T, K34N+W36S/T, K37S/T, K37N+E39S/T, E38N, E38N+S40T, E39N+D41S/T, S40N+R42S/T, K55N+F57S/T, K58N+F60S/T, K61S/T, K61N+D63S/T, D62N+Q64S/T, D63N, D63N+S65T, Q64N+I66S/T, S65N+Q67S/T, Q67N, Q67N+S69T, K68N+V70S/T, E71N+I73S/T, T72N+K74S/T, K74N+D76S/T, E75N+M77S/T, K80S/T, V79N+F81S/T, K80N+F82S/T, N85S/T, S84N+K86S/T, K87S/T, K86N+K88S/T, K87N+R89S/T, D90N+F92S/T, E93N+L95S/T, K94N, K94N+T96S, T101N+L103S/T, D102N+N104S/T, L103N+V105S/T, Q106S/T, E119N, E119N+S121T, P122N+A124S/T, A123N+K125S/T, A124N, A124N+T126S, K125N+G127S/T, T126N+K128S/T, G127N+R129S/T, K128N+K130S/T, R129N+R131S/T, K130N, K130N+S132T, R131N+Q133S/T, S132N+M134S/T, Q133N+L135S/T, M134N+F136S/T, L135N+R137S/T, F136N+G138S/T, R137N+R139S/T, G138N+R140S/T, R139N+A141S/T, R140N и R140N+S142T, при этом замены указаны относительно [S99T]huIFNG с аминокислотной последовательностью, приведенной в SEQ ID No:1 (или относительно соответствующих фрагментов с аминокислотными последовательностями, приведенными в SEQ ID No:2-16). S/T означает замену на остаток серина или треонина, предпочтительно остаток треонина.
Замены, ведущие к введению дополнительного сайта N-гликозилирования в положения, экспонированные на поверхности полипептида IFNG, в которых не менее 50% боковой цепи экспонировано на поверхности (в структуре с молекулой рецептора), включают:
P3N+V5S/T, K6N+A8S/T, K12S/T, K13N+F15S/T, G18S/T, D21N+A23S/T, G26N+L28S/T, G31N+L33S/T, K34N+W36S/T, K37N+E39S/T, E38N, E38N+S40T, E39N+D41S/T, K55N+F57S/T, K58N+F60S/T, K61S/T, D62N+Q64S/T, Q64N+I66S/T, S65N+Q67S/T, K68N+V70S/T, E71N+I73S/T, E75N+M77S/T, N85SA, S84N+K86S/T, K86N+K88S/T, K87N+R89S/T, K94N, K94N+T96S, T101N+L103S/T, D102N+N104S/T, L103N+V105S/T, Q106S/T, P122N+A124S/T, A123N+K125S/T, A124N, A124N+T126S, K125N+G127S/T, T126N+K128S/T, G127N+R129S/T, K128N+K130S/T, R129N+R131S/T, K130N, K130N+S132T. R131N+Q133S/T, S132N+M134S/T, Q133N+L135S/T, M134N+P136S/T, L135N+R137S/T, F136N+G138S/T, R137N+R139S/T, G138N+R140S/T, R139N+A141S/T, R140N и R140N+S142T, при этом замены указаны относительно [S99T]huIFNG с аминокислотной последовательностью, приведенной в SEQ ID No:1 (или относительно соответствующих фрагментов с аминокислотными последовательностями, приведенными в SEQ ID No:2-16). S/T означает замену на остаток серина или треонина, предпочтительно остаток треонина.
Замены, при которых для введения сайта N-гликозилирования требуется замена лишь одной аминокислоты, включают: K12S/T, G18S/T, G18N, K37S/T, E38N, M45N, I49N, K61S/T, D63N, Q67N, V70N, K80S/T, F82N, N85S/T, K87S/T, K94N, Q106S/T, E119N, A124N, K130N и R140N, в особенности K12S/T, G18N, G18S/T, K37S/T, E38N, K61S/T, D63N, Q67N, K80S/T, N85S/T, K94N, Q106S/T, A124N, K130N и R140N (положения, в которых более 25% боковой цепи экспонировано на поверхности, в структуре без молекулы рецептора), более предпочтительно G18N, E38N, D63N, Q67N, K94N, S99N, A124N, K130N и R140N (положения, в которых более 50% боковой цепи экспонировано на поверхности, в структуре без молекулы рецептора).
Обычно сайт N-гликозилирования предпочтительно не вводится в участок, составляющий сайт связывания с рецептором (за исключением особых случаев, как в разделе “Варианты с пониженным сродством к рецептору”). Соответственно, в норме не следует проводить мутации Q1N+P3S/T, E9N+L11S/T, G18N, G18N+S20T, H19N+D21S/T, D21N+A23S/T, G26N+L28S/T, K34N+W36S/T, K37N+E39S/T, E119N и E119N+S121T, если только не требуется понизить сродство к рецептору.
К особенно предпочтительным вариантам по настоящему изобретению относится вариант SEQ ID No:1 (или его фрагментов с аминокислотными последовательностями, приведенными в SEQ ID No:2-16), обладающий активностью IFNG и содержащий по меньшей мере одну замену, выбранную из группы, состоящей из K12S, К12Т, G18T, E38N, E38N+S40T, K61S, К61Т, N85S, N85T, K94N, Q106S и Q106T, более предпочтительно выбранную из группы, состоящей из К12Т, G18T, E38N+S40T, К61Т, N85T, K94N и Q106T, еще более предпочтительно выбранную из группы, состоящей из К12Т, G18T, E38N+S40T, К61Т и N85T, особенно E38N+S40T.
В другом представляющем интерес воплощении изобретения вариант SEQ ID No:1 (или его фрагментов с аминокислотными последовательностями, приведенными в SEQ ID No:2-16) содержит по меньшей мере два введенных сайта гликозилирования, в частности, по меньшей мере два введенных сайта N-гликозилирования. Эти по меньшей мере две модификации, в частности замены, ведущие к введению по меньшей мере двух введенных сайтов N-гликозилирования, можно предпочтительно выбрать из группы, состоящей из K12S, К12Т, G18S, G18T, E38N, E38N+S40T, K61S, К61Т, N85S, N85T, K94N, Q106S и Q106T, более предпочтительно из группы, состоящей из К12Т, G18T, E38N+S40T, К61Т, N85T, K94N и Q106T, еще более предпочтительно выбрать из группы, состоящей из К12Т, G18T, E38N+S40T, К61Т и N85T. Конкретные примеры таких замен, ведущих к появлению варианта, содержащего по меньшей мере два дополнительных сайта N-гликозилирования, включают K12T+G18T, K12T+E38N+S40T, К12Т+К61Т, K12T+N85T, G18T+E38N+S40T, G18T+K61T, G18T+N85T, E38N+S40T+ Кб IT, E38N+S40T+N85T и K61T+N85T.
Из представленных выше списков замен следует предпочтительно выбирать замены, находящиеся в пределах 118 N-концевых аминокислотных остатков, в особенности в пределах 97 N-концевых аминокислотных остатков.
Вариант полипептида IFNG по изобретению может содержать один дополнительный сайт гликозилирования in vivo на мономер (по сравнению с SEQ ID No:1 или его фрагментами). Однако для того, чтобы достичь размера, достаточного для увеличения времени полужизни в сыворотке, зачастую необходимо, чтобы полипептид содержал более одного сайта N-гликозилирования in vivo, в частности 2-7 или 2-5 дополнительных сайтов N-гликозилирования in vivo, например, 2, 3, 4 или 5 сайтов N-гликозилирования in vivo. Такие сайты N-гликозилирования in vivo предпочтительно вводят путем одной и более замен, описанных в любом из вышеприведенных списков.
Кроме того, следует иметь в виду, что любые из вышеприведенных модификаций могут сочетаться с любыми из модификаций, описанных в разделе “Варианты IFNG по изобретению с оптимизированными сайтами гликозилирования”, в особенности с заменой G26A.
Варианты IFNG по изобретению, у которых связующей группой для неполипептидного компонента служит цистеин
В следующем предпочтительном воплощении изобретения вариант IFNG с последовательностью SEQ ID No:1 (или его фрагментов) содержит по меньшей мере один введенный остаток цистеина. Например, остаток цистеина может быть введен в положение полипептида IFNG с последовательностью ID No:1 (или его фрагментов), содержащее аминокислотный остаток, экспонированный на поверхности. Предпочтительно у такого экспонированного на поверхности аминокислотного остатка не менее 25% боковой цепи экспонировано на поверхности, в особенности не менее 50% боковой цепи экспонировано на поверхности. Подробности об определении таких положений приводятся далее в Примере 1.
Так, замены, ведущие к введению остатка цистеина в положения, экспонированные на поверхности полипептида IFNG и занятые аминокислотными остатками, у которых не менее 25% боковой цепи экспонировано на поверхности (в структуре с молекулой рецептора), включают: Q1C, D2C, Р3С, К6С, Е9С, N10C, К13С, Y14C, N16C, G18C, Н19С, D21C, N25C, G26C, G31C, К34С, N35C, К37С, Е38С, Е39С, S40C, К55С, К58С, N59C, К61С, D62C, D63C, Q64C, S65C, Q67C, К68С, Е71С, Т72С, К74С, Е75С, N78C, V79C, К80С, N83C, S84C, N85C, К86С, К87С, D90C, Е93С, К94С, Т101С, D102C, L103C, N104C и Е119С, при этом замены указаны относительно [S99T]huIFNG с аминокислотной последовательностью, приведенной в SEQ ID No:1 (или относительно соответствующих фрагментов с аминокислотными последовательностями, приведенными в SEQ ID No:2-16).
Замены, ведущие к введению остатка цистеина в положения, экспонированные на поверхности полипептида IFNG и занятые аминокислотными остатками, у которых не менее 50% боковой цепи экспонировано на поверхности (в структуре с молекулой рецептора), включают: Р3С, К6С, N10C, К13С, N16C, D21C, N25C, G26C, G31C, К34С, К37С, Е38С, Е39С, К55С, К58С, N59C, D62C, Q64C, S65C, К68С, Е71С, Е75С, N83C, S84C, К86С, К87С, К94С, Т101С, D102C, L103C и N104C, при этом замены указаны относительно [S99T]huIFNG с аминокислотной последовательностью, приведенной в SEQ ID No:1 (или относительно соответствующих фрагментов с аминокислотными последовательностями, приведенными в SEQ ID No:2-16).
Обычно остаток цистеина предпочтительно не вводится (и впоследствии к этому остатку цистеина не присоединяется неполипептидный компонент) в участок, составляющий сайт связывания с рецептором (за исключением особых случаев, как в разделе “Варианты с пониженным сродством к рецептору”). Соответственно, в норме не следует проводить мутации Q1C, Е9С, G18C, Н19С, D21C, G26C, К34С, К37С и Е119С, если только не требуется понизить сродство к рецептору.
Более предпочтительно остаток цистеина вводится путем замены, выбираемой из группы, состоящей из N10C, N16C, Е38С, N59C, N83C, К94С, N104C и А124С.
В другом представляющем интерес воплощении изобретения вариант SEQ ID No:1 (или его фрагментов с аминокислотными последовательностями, приведенными в SEQ ID No:2-16) содержит по меньшей мере два введенных остатка цистеина. Эти по меньшей мере две модификации, в частности замены, ведущие к введению по меньшей мере двух введенных остатков цистеина, предпочтительно можно выбрать из группы, состоящей из N10C, N16C, Е38С, N59C, N83C, К94С, N104C и А124С. Конкретные примеры таких замен, ведущих к появлению варианта, содержащего по меньшей мере два введенных остатка цистеина, включают N10C+N16C, N10C+E38C, N10C+N59C, N10C+N83C, N10C+K94C, N10C+N104C, N10C+A124C, N16C+E38C, N16C+N59C, N16C+N83C, N16C+K94C, N16C+N104C, N16C+A124C, E38C+N59C, E38C+N83C, Е38С+К94С, E38C+N104C, E38N+A124C, N59C+N83C, N59C+K94C, N59C+N104C, N59C+A124C, N83C+K94C, N83C+K94C, N83C+N104C, N83C+A124C, K94C+N104C, К94С+А124С и N104C+A124C.
Предусматривается, что введенные остатки цистеина можно предпочтительно конъюгировать с неполипептидным компонентом типа PEG, более предпочтительно mPEG. Конъюгирование между содержащим цистеин вариантом полипептида и молекулой полимера может осуществляться любым удобным способом, к примеру, как описано в разделе “Конъюгирование с молекулой полимера”, например, в одну стадию или в несколько стадий, как указано в этом разделе. Предпочтительный метод получения PEG-производного варианта полипептида IFNG заключается в ковалентном присоединении PEG к остаткам цистеина с помощью реагирующих с цистеином разновидностей PEG. Коммерчески доступны целый ряд высокоспецифичных, реагирующих с цистеином разновидностей PEG с различными группами (как-то: ортопиридилдисульфид, малеимид и винилсульфон) и разного размера (от 2 до 20 кДа, к примеру, 5 кДа, 10 кДа, 12 кДа или 15 кДа), например, от фирмы Shearwater Polymers Inc., Huntsville, AL, USA.
Следует иметь в виду, что любые из вышеприведенных модификаций могут сочетаться с любыми из модификаций, описанных в разделе “Варианты IFNG по изобретению с оптимизированными сайтами гликозилирования”, в особенности с заменой G26A.
Варианты IFNG по изобретению, у которых первый неполипептидный компонент представлен остатком сахара, а вторым неполипептидным компонентом служит молекула, имеющая цистеин в качестве связующей группы
В следующем предпочтительном воплощении изобретения вариант IFNG с последовательностью SEQ ID No:1 (или его фрагментов) содержит по меньшей мере один введенный сайт N-гликозилирования и по меньшей мере один введенный остаток цистеина. Такие варианты можно получить, выбирая остатки, описанные в двух предыдущих разделах, где описаны подходящие положения для введения сайтов N-гликозилирования и остатков цистеина, соответственно. Однако в предпочтительном воплощении изобретения такой вариант включает замены, выбранные группы, состоящей из K12T+N16C, К12Т+Е38С, K12T+N59C, K12T+N83C, К12Т+К94С, K12T+N104C, К12Т+А124С, G18T+N10C, G18T+E38C, G18T+N59C, G18T+N83C, G18T+K94C, G18T+N104C, G18T+A124C, E38N+S40T+N10C, E38N+S40T+N16C, E38N+S40T+N59C, E38N+S40T+N83C, E38N+S40T+K94C, E38N+S40T+N104C, E38N+S40T+A124C, K61T+N10C, K61T+N16C, К61Т+Е38С, K61T+N83C, К61Т+К94С, K61T+N104C, К61Т+А124С, N85T+N10C, N85T+N16C, N85T+E38C, N85T+N59C, N85T+K94C, N85T+N104C, N85T+A124C, K94N+N10C, K94N+N16C, K94N+E38C, K94N+N59C, K94N+N83C, K94N+N104C, K94N+A124C, Q106T+N10C, Q106T+N16C, Q106T+E38C, Q106T+N59C, Q106T+N83C, Q106T+K94C и Q106T4-A124C, более предпочтительно из группы, состоящей из E38N+S40T+N10C, E38N+S40T+N16C, E38N+S40T+N59C, E38N+S40T+N83C, E38N+S40T+K94C и E38N+S40T+N104C.
Предусматривается, что введенные остатки цистеина можно предпочтительно конъюгировать с неполипептидным компонентом типа PEG, более предпочтительно mPEG. Конъюгирование между содержащим цистеин вариантом полипептида и полимером может осуществляться любым удобным способом, к примеру, как описано в разделе “Конъюгирование с молекулой полимера”, например, в одну стадию или в несколько стадий, как указано в этом разделе. Подходящим полимером является VS-mPEG или OPSS-mPEG.
Кроме того, следует иметь в виду, что любые из вышеприведенных модификаций могут сочетаться с любыми из модификаций, описанных в разделе “Варианты IFNG по изобретению с оптимизированными сайтами гликозилирования”, в особенности с заменой G26A.
Варианты IFNG с пониженным сродством к рецептору
Одним из путей увеличения времени полужизни в сыворотке полипептида IFNG может быть уменьшение опосредованной рецептором интернализации и тем самым снижение опосредованного рецептором клиренса.
Опосредованная рецептором интернализация зависит от сродства димера IFNG к IFNG-рецепторному комплексу, соответственно, вариант IFNG с пониженным сродством к IFNG-рецепторному комплексу должен интернализоваться, а тем самым и подвергаться клиренсу, в меньшей степени.
Сродство димера IFNG с своему рецепторному комплексу можно понизить путем одной или нескольких модификаций, в частности замен, в сайте связывания с рецептором полипептида IFNG. Аминокислотные остатки, образующие сайт связывания с рецептором, определены далее в Примере 2. Один из классов замен, которые можно проводить, – это консервативные замены аминокислот. В другом воплощении проводимые модификации ведут к появлению сайта N-гликозилирования.
Таким образом, в следующем отдельном предпочтительном воплощении изобретения вариант IFNG с последовательностью SEQ ID No:1 (или его фрагментов) включает по меньшей мере одну модификацию, такую как замена, в сайте связывания с рецептором (как он определен в настоящем изобретении). В частности, полипептид IFNG включает по меньшей мере одну модификацию, предпочтительно замену, создающую сайт N-гликозилирования, в сайте связывания с рецептором. Например, такие замены можно выбрать из числа Q1N+P3S/T, D2N+Y4S/T, Y4N+K6S/T, V5N+E7S/T, E9N+L11S/T, K12N+Y14S/T, G18N, G18N+S20T, H19N+D21S/T, S20N+V22S/T, D21N+A23S/T, V22N+D24S/T, D24N+G26S/T, G26N+L28S/T, L30N+I32S/T, K34N+W36S/T, K37N+E39S/T, K108N+I110S/T, H111N+L113S/T, E112N+I114S/T, I114N+V116S/T, Q115N+M117S/T, A118N+L120S/T, E119N и E119N+S121T, предпочтительно из группы, состоящей из Q1N+P3S/T, D2N+Y4S/T, E9N+L11S/T, K12N+Y14S/T, G18N, G18N+S20T, H19N+D21S/T, S20N+V22S/T, D21N+A23S/T, K34N+W36S/T, K37N+E39S/T, H111N+L113S/T, Q115N+M117S/T, A118N+L120S/T, E119N и E119N+S121T (введение сайта N-гликозилирования в положения, содержащие аминокислотный остаток, у которого не менее 25% боковой цепи экспонировано на поверхности), более предпочтительно из числа Q1N+P3S/T, D2N+Y4S/T, E9N+L11S/T, G18N, G18N+S20T, H19N+D21S/T, S20N+V22S/T, D21N+A23S/T, K34N+W36S/T, K37N+E39S/T, Q115N+M117S/T, A118N+L120S/T, E119N и E119N+S121T (введение сайта N-гликозилирования в положения, содержащие аминокислотный остаток, у которого не менее 50% боковой цепи экспонировано на поверхности), еще более предпочтительно из группы, состоящей из Q1N+P3T, D2N+Y4T, E9N+L11T, G18N+S20T, H19N+D21T, S20N+V22T, D21N+A23T, K34N+W36T, K37N+E39T, Q115N+M117T, A118N+L120T и E119N+S121T, наиболее предпочтительно из группы, состоящей из G18N+S20T, H19N+D21T, D21N+A23T и El 19N+S121T, в особенности D21N+A23T.
Предусматривается, что такие варианты будут обладать пониженным сродством к рецептору по сравнению с huIFNG или Actimmune®. Сродство к рецептору можно измерить любым удобным методом, известным специалистам в этой области. Один из примеров подходящего метода определения сродства связывания с рецептором – метод BIAcore®, описанный в Michiels et al., Int. J. Biochem. Cell Biol. 30: 505-516 (1998). С применением этого метода пригодными для целей настоящего изобретения считаются такие варианты IFNG, у которых константа связывания (Кd) составляет 1-95% от значения Kd гликозилированного [S99T]huIFNG или Actimmune®. Например, значение Кd полипептида IFNG может составлять 1-75% или 1-50%, например 1-25%, например 1-20%, и даже 1-15%, 1-10% или 1-5% от значения Кd гликозилированного [S99T]huIFNG или Actimmune®.
Обычно такие варианты IFNG с пониженным сродством к рецептору обладают и пониженной активностью IFNG, например, при тестировании методом, описанным в разделе “Первичный анализ”. Так, вариант полипептида IFNG может обладать 1-95% удельной активности Actimmune® или rhuIFNG, например, 1-75% или 1-50%, 1-20% или 1-10% от удельной активности Actimmune® или rhuIFNG.
Как указано выше, предусматривается, что такие варианты IFNG будут обладать увеличенным временем полужизни в сыворотке вследствие снижения опосредованного рецептором клиренса. Поэтому предусматривается, что варианты полипептида IFNG согласно этому аспекту изобретения будут соответствовать требованиям по увеличению времени полужизни в сыворотке, описанным ранее в настоящем изобретении в связи с определением понятия “увеличение времени полужизни в сыворотке”.
Конечно, любые из вышеприведенных модификаций, ведущих к понижению сродства связывания с рецептором, могут сочетаться с любыми из других модификаций, описанных в настоящем изобретении, в частности, в разделах “Варианты IFNG по изобретению с оптимизированными сайтами N-гликозилирования”, “Варианты IFNG по изобретению, у которых неполипептидный компонент представлен остатком сахара”, “Варианты IFNG по изобретению, у которых связующей группой для неполипептидного компонента служит цистеин” и “Варианты IFNG по изобретению, у которых первый неполипептидный компонент представлен остатком сахара, а вторым неполипептидным компонентом служит молекула, имеющая цистеин” в качестве связующей группы, например, G26A, E38N+S40T и их комбинации.
Способы конъюгирования
Неполипептидный компонент
Как указывалось выше, неполипептидный компонент предпочтительно выбирается из группы, состоящей из молекул полимеров, липофильных соединений, остатков сахаров (путем гликозилирования in vivo) и органических модифицирующих агентов. Все эти агенты могут придавать желательные свойства варианту полипептида IFNG, в частности, повышенную AUCsc, увеличенное время полужизни в сыворотке и/или сниженную иммуногенность. Обычно вариант полипептида конъюгируют с неполипептидными компонентами только одного типа, но можно конъюгировать и с неполипептидными компонентами двух и более разных типов, например, с молекулой полимера и остатком сахара, с липофильной группой и остатком сахара, с органическим модифицирующим агентом и остатком сахара, с липофильной группой и молекулой полимера и т.д. При конъюгировании с неполипептидными компонентами двух разных типов они предпочтительно представлены остатком сахара и полимером. Конъюгирование с двумя или несколькими различными неполипептидными компонентами может осуществляться одновременно или поочередно. В последующих разделах “Конъюгирование с липофильным соединением”, “Конъюгирование с молекулой полимера”, “Конъюгирование с остатком сахара” и “Конъюгирование с органическим модифицирующим агентом” описывается Конъюгирование с неполипептидными компонентами конкретных типов.
Конъюгирование с липофильным соединением
Вариант полипептида и липофильное соединение можно конъюгировать друг с другом либо непосредственно, или с помощью линкера. Липофильное соединение может быть природным соединением, таким как насыщенная или ненасыщенная жирная кислота, дикетон жирной кислоты, терпен, простагландин, витамин, каротиноид или стероид, либо синтетическим соединением, таким как карбоновая кислота, спирт, амин или сульфоновая кислота с одной или несколькими алкил-, арил-, алкенильными группами, или же другими многочисленными ненасыщенными соединениями. Конъюгация между вариантом полипептида и липофильным соединением, необязательно через линкер, может осуществляться методами, известными в этой области, например, как описано Bodanszky в Peptide Synthesis, John Wiley, New York, 1976 и в WO 96/12505.
Конъюгирование с молекулой полимера
Для конъюгирования с вариантом полипептида можно использовать любые подходящие молекулы полимеров, например, природные и синтетические гомополимеры или гетерополимеры, обычно с молекулярным весом в интервале 300-100000 Да или 1000-50000 Да, например, в интервале 2000-40000 Да или 2000-30000 Да, к примеру, в интервале 2000-20000 Да, 2000-10000 Да или 1000-5000 Да. В частности, молекула полимера типа PEG, в особенности mPEG, обычно имеет молекулярный вес примерно 2, 5, 10, 12, 15, 20, 30, 40 или 50 кДа, особенно молекулярный вес около 5 кДа, около 10 кДа, около 12 кДа, около 15 кДа или около 20 кДа.
В применении к молекулам полимеров слово “около” означает приблизительный средний молекулярный вес и отражает тот факт, что обычно существует определенное распределение молекулярных весов в данном препарате полимера.
Примеры гомополимеров включают полиолы (то есть поли-ОН), полиамины (поли-NH2), поликарбоновые кислоты (поли-СООН). Гетерополимер – это полимер, содержащий одну и более различных конъюгируемых групп, например, гидроксильную группу и аминогруппу.
Примеры подходящих молекул полимеров включают полимерные молекулы, выбранные из группы, состоящей из полиалкиленоксидов (РАО), включая полиалкиленгликоли (PAG) типа полиэтиленгликоля (PEG) и полипропиленгликоля (PPG), разветвленных PEG, поливинилового спирта (PVA), поликарбоксилата, поливинилпирролидона, сополимера этилена и ангидрида малеиновой кислоты, сополимера стирола и ангидрида малеиновой кислоты, декстрана, включая карбоксиметилдекстран, или любые другие биополимеры, подходящие для уменьшения иммуногенности и/или увеличения функционального периода полужизни in vivo и/или времени полужизни в сыворотке. Другие примеры молекул полимеров – альбумин человека или другие распространенные белки плазмы. Обычно полимеры на основе полиалкиленгликолей биосовместимы, нетоксичны, неантигенны, неиммуногенны, обладают разнообразием в отношении водорастворимости и легко выводятся из живого организма.
Предпочтительно в качестве полимерной молекулы используют PEG, так как он обладает весьма малым количеством групп, способных к образованию перекрестных сшивок, по сравнению с полисахаридами, например декстраном и т.п. Особый интерес представляет монофункциональный PEG, например, монометоксиполиэтиленгликоль (mPEG), так как он обладает относительно простым механизмом реакции конъюгирования (только одна реакционно-способная группа доступна для конъюгации со связующими группами на полипептиде). Вследствие этого устраняется риск перекрестных сшивок, образующиеся конъюгированные варианты полипептида более гомогенны, и реакция молекул полимера с полипептидом легче поддается контролю.
Для ковалентного присоединения молекул полимера к варианту полипептида концевые гидроксильные группы молекулы полимера должны находиться в активированной форме, то есть иметь реакционноспособные функциональные группы, примеры которых включают первичные аминогруппы, гидразид (HZ), тиол, сукцинат (SUC), сукцинимидилсукцинат (SS), сукцинимидилсукцинамид (SSA), сукцинимидилпропионат (SPA), сукцинимидилкарбоксиметилат (SCM), бензотриазолкарбонат (ВТС), N-гидроксисукцинимид (NHS), альдегид, нитрофенилкарбонат (NPC) и тресилат (TRES). Активированные соответствующим образом молекулы полимеров доступны коммерчески, например, от фирмы Shearwater Polymers, Inc., Huntsville, AL, USA. Альтернативно молекулы полимеров можно активировать стандартными методами, известными в этой области, к примеру, раскрытыми в WO 90/13540. Конкретные примеры активированных линейных или разветвленных полимерных молекул, пригодных для применения в настоящем изобретении, описаны в каталогах Shearwater Polymers, Inc., за 1997 и 2000 г.г. (Functionalized Biocompatible Polymers for Research and Pharmaceuticals, Polyethylene Glycol and Derivates, включены в настоящее изобретение путем отсылки). Конкретные примеры активированных PEG-полимеров включают следующие линейные полиэтиленгликоли: NHS-PEG (например, SPA-PEG, SSPA-PEG, SBA-PEG, SS-PEG, SSA-PEG, SC-PEG, SG-PEG и SCM-PEG), NOR-PEG, BTC-PEG, EPOX-PEG, NCO-PEG, NPC-PEG, CDI-PEG, ALD-PEG, TRES-PEG, VS-PEG, IODO-PEG и MAL-PEG; разветвленные полиэтиленгликоли типа PEG2-NHS и тех, что описаны в US 5932462 и US 5643575, которые оба включены путем отсылки. Кроме того, в следующих публикациях, включенных путем отсылки, раскрыты полезные полимерные молекулы и/или механизмы получения PEG-производных: US 5824778, US 5476653, WO 97/32607, ЕР 229 108, ЕР 402378, US 4902502, US 5281698, US 5122614, US 5219564, WO 92/16555, WO 94/04193, WO 94/14758, WO 94/17039, WO 94/18247, WO 94/28024, WO 95/00162, WO 95/11924, WO 95/13090, WO 95/33490, WO 96/00080, WO 97/18832, WO 98/41562, WO 98/48837, WO 99/32134, WO 99/32139, WO 99/32140, WO 96/40791, WO 98/32466, WO 95/06058, ЕР 439 508, WO 97/03106, WO 96/21469, WO 95/13312, ЕР 921 131, US 5736625, WO 98/05363, ЕР 809996, US 5629384, WO 96/41813, WO 96/07670, US 5473034, US 5516673, ЕР 605963, US 5382657, ЕР 510356, ЕР 400472, ЕР 183503 и ЕР 154316.
Конкретные примеры активированных полимеров PEG, особенно предпочтительных для конъюгации с остатками цистеина, включают следующие линейные полиэтиленгликоли: винилсульфон-PEG (VS-PEG), предпочтительно винилсульфон-mPEG (VS-mPEG), малеимид-PEG (MAL-PEG), предпочтительно малеимид-mPEG (MAL-mPEG), и ортопиридилдисульфид-PEG (OPSS-PEG), предпочтительно ортопиридилдисульфид-mPEG (OPSS-mPEG). Обычно такие полимеры PEG или mPEG имеют размер около 5 кДа, около 10 кДа, около 12 кДа или около 20 кДа.
Конъюгация варианта полипептида с активированными молекулами полимеров проводится любым стандартным методом, например, как описано в следующих ссылках (в которых также описаны удобные методы активации полимерных молекул): Harris and Zaiipsky, eds., Poly(ethylene glycol) Chemistry and Biological Applications, AZC, Washington; R.F.Taylor (1991) “Protein immobilisation. Fundamental and applications”, Marcel Dekker, N.Y.; S.S.Wong (1992) “Chemistry of Protein Conjugation and Crosslinking”, CRC Press, Boca Raton; G.T.Hermanson et al. (1993) “Immobilized Affinity Ligand Techniques”, Academic Press, N.Y.). Для получения PEG-производных по остаткам цистеина (см. выше) вариант IFNG обычно обрабатывают восстановителем типа дитиотреитола (DTT) перед модификацией ПЭГ. После этого восстановитель удаляют любым стандартным методом, например, обессоливанием. Конъюгирование PEG с остатком цистеина обычно происходит в соответствующем буфере при рН 6-9 при температуре от 4°С до 25°С на протяжении до 16 часов.
Специалисту известно, что применяемый метод активации и/или механизм конъюгации зависят от связующих групп варианта полипептида, а также от функциональных групп полимера (например, представлены они амином, гидроксилом, карбоксилом, альдегидом или сульфгидрилом). Модификация PEG может быть направлена на конъюгирование со всеми доступными связующими группами на варианте полипептида (то есть с теми связующими группами, которые экспонированы на поверхности полипептида) или может быть направлено на специфические связующие группы, например, N-концевую аминогруппу (US 5985265). Кроме того, конъюгация может осуществляться в одну стадию или поэтапно (например, как описано в WO 99/55377).
Следует иметь в виду, что модификацию PEG нужно планировать таким образом, чтобы получить оптимальную молекулу в отношении числа присоединенных молекул PEG, размера и формы таких молекул (например, линейные или разветвленные), и того, в каком месте варианта полипептида присоединяются такие молекулы. Например, молекулярный вес используемого полимера выбран на основании того эффекта, которого требуется достичь. Так, если главная цель конъюгации заключается в получении конъюгата с высоким молекулярным весом (например, чтобы уменьшить почечный клиренс), то обычно желательно конъюгировать как можно меньше молекул высокомолекулярного полимера, чтобы достичь требуемого молекулярного веса. Когда же нужно получить высокую степень экранирования эпитопов, то это достигается использованием достаточно большого числа молекул низкомолекулярного полимера (к примеру, с молекулярным весом около 5000 Да) для эффективного экранирования всех или большинства эпитопов полипептида. Например, можно использовать 2-8, например, 3-6 таких молекул полимера.
При конъюгировании с единственной связующей группой на белке (как описано в US 5985265) лучше всего, чтобы молекула полимера, который может быть линейным или разветвленным, имела высокий молекулярный вес, к примеру, около 20 кДа.
Обычно конъюгация с полимером проводится в условиях, направленных на то, чтобы все имеющие связующие группы для полимера прореагировали с молекулами полимера. Как правило, молярное отношение активированных молекул полимера к варианту полипептида составляет 1000-1, в частности 200-1, например, 100-1, 10-1 или 5-1, для достижения оптимальной реакции. Однако можно использовать и эквимолярные соотношения.
По изобретению также предусматривается присоединение полимерных молекул к варианту полипептида через линкер. Соответствующие линкеры хорошо известны специалистам. Предпочтительным примером служит цианурхлорид (Abuchowski et al. (1977) J.Biol. Chem., 252, 3578-3581; US 4,179,337; Shafer et al. (1986) J.Polym. Sci. Polym. Chem. Ed., 24, 375-378).
После конъюгации оставшиеся активированные молекулы полимера блокируют методами, известными в этой области, например, добавлением первичного амина в реакционную смесь, после чего образовавшиеся инактивированные молекулы полимера удаляют подходящим способом.
Конъюгирование с остатком сахара
Присоединение остатков сахара может происходить in vivo или in vitro. Для того, чтобы осуществить гликозилирование in vivo полипептида с активностью IFNG, который был модифицирован путем введения одного или нескольких сайтов гликозилирования in vivo (см. раздел “Варианты IFNG по изобретению, у которых неполипептидный компонент представлен остатком сахара”), нуклеотидную последовательность, кодирующую полипептид, необходимо ввести в гликозилирующего эукариотического хозяина для экспрессии. Экспрессирующая клетка-хозяин может быть выбрана из клеток грибов (нитчатых грибов или дрожжей), насекомых или животных либо трансгенных растений. Кроме того, гликозилирование может осуществляться в организме человека при использовании нуклеотидной последовательности, кодирующей вариант полипептида по изобретению, в генной терапии. В одном из воплощений клеткой хозяином служит клетка млекопитающего типа клеток СНО, ВНК или НЕК, например, клетки НЕК 293, или клетка насекомого типа клеток SF9, или клетка дрожжей, к примеру, Saccharomyces cerevisiae, Pichia pastoris или любой другой подходящий гликозилирующий хозяин, описанный далее. Необязательно остатки сахара, присоединенные к варианту полипептида IFNG посредством гликозилирования in vivo, подвергаются дальнейшей модификации с помощью гликозилтрансфераз, например, по технологии glycoAdvance фирмы Neose, Horsham, PA, USA. Это дает возможность, например, повысить сиалилирование гликозилированного варианта полипептида IFNG после экспрессии и гликозилирования in vivo в клетках СНО. фирмы Neose, Horsham, PA, USA. Это дает возможность, например, повысить сиалилирование гликозилированного варианта полипептида IFNG после экспрессии и гликозилирования in vivo в клетках СНО.
Ковалентное конъюгирование in vitro гликозидов с аминокислотными остатками полипептидов IFNG может применяться для модификации или увеличения числа или профиля углеводных заместителей. В зависимости от способа конъюгирования сахар/сахара могут присоединяться к: a) аргинину и гистидину, b) свободным карбоксильным группам, c) свободным сульфгидрильным группам типа групп цистеина, d) свободным карбоксильным группам типа групп серина, треонина, тирозина или гидроксипролина, е) ароматическим остаткам типа остатков фенилаланина или триптофана, f) амидной группе глутамина. Эти аминокислотные остатки представляют примеры связующих групп для остатков сахаров, которые могут быть введены в полипептид IFNG и/или удалены из него. Подходящие методы конъюгирования in vitro описаны, к примеру, в WO 87/05330 и в Aplin et al., CRC Crit. Rev. Biochem., pp.259-306, 1981. Присоединение остатков сахаров или PEG in vitro к остаткам Gin белка или пептида также может проводиться с помощью трансглутаминаз (ТГаз), например, как описано Sato et al., 1996, Biochemistry 35,13072-13080 или в ЕР 725145.
Конъюгирование с органическим модифицирующим агентом
Ковалентная модификация варианта полипептида IFNG может осуществляться путем реакции одной или нескольких связующих групп варианта полипептида с органическим модифицирующим агентом. Соответствующие реагенты и методы хорошо известны в этой области. Например, остатки цистеинила чаще всего подвергают реакции с  -галоацетатами (и соответствующими аминами) типа хлоруксусной кислоты или хлорацетамида, получая карбоксиметильные или карбоксиамидометильные производные. Остатки цистеинила также модифицируют путем реакции с бромотрифторацетоном, -галоацетатами (и соответствующими аминами) типа хлоруксусной кислоты или хлорацетамида, получая карбоксиметильные или карбоксиамидометильные производные. Остатки цистеинила также модифицируют путем реакции с бромотрифторацетоном,  -бром- -бром- -(4-имидазоил)-пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, n-хлормеркурибензоатом, 2-хлоромеркури-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом. Остатки гистидила модифицируют путем реакции с диэтилпирокарбонатом при pH 5,5-7,0, так как этот реагент относительно специфичен к боковой цепи гистидила. Применяется также пара-бромфенацилбромид, а реакцию предпочтительно проводят в 0,1 М какодилате натрия при pH 6,0. Остатки лизинила и концевые аминогруппы подвергают реакции с ангидридом янтарной или другой карбоновой кислоты. Модификация с помощью таких реагентов вызывает обращение заряда остатков лизинила. Другие подходящие реагенты для модификации содержащих -(4-имидазоил)-пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, n-хлормеркурибензоатом, 2-хлоромеркури-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом. Остатки гистидила модифицируют путем реакции с диэтилпирокарбонатом при pH 5,5-7,0, так как этот реагент относительно специфичен к боковой цепи гистидила. Применяется также пара-бромфенацилбромид, а реакцию предпочтительно проводят в 0,1 М какодилате натрия при pH 6,0. Остатки лизинила и концевые аминогруппы подвергают реакции с ангидридом янтарной или другой карбоновой кислоты. Модификация с помощью таких реагентов вызывает обращение заряда остатков лизинила. Другие подходящие реагенты для модификации содержащих  -аминогруппу остатков включают имидоэфиры, такие как метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлороборгидрид, тринитробензолсульфоновую кислоту, О-метилизомочевину, 2,4-пентандион, а также катализируемую трансаминазами реакцию с глиоксилатом. Остатки аргинила модифицируют путем реакции с одним или несколькими стандартными реагентами, в числе которых фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. При модификации остатков аргинина необходимо проводить реакцию в щелочных условиях из-за высокого значения рКа гуанидиновой функциональной группы. Кроме того, эти реагенты могут реагировать с группами лизина, а также с гуанидиновой группировкой аргинина. Боковые карбоксильные группы (аспартила или глутамила) избирательно модифицируют при реакции с карбодиимидами (R-N=C=N-R -аминогруппу остатков включают имидоэфиры, такие как метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлороборгидрид, тринитробензолсульфоновую кислоту, О-метилизомочевину, 2,4-пентандион, а также катализируемую трансаминазами реакцию с глиоксилатом. Остатки аргинила модифицируют путем реакции с одним или несколькими стандартными реагентами, в числе которых фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. При модификации остатков аргинина необходимо проводить реакцию в щелочных условиях из-за высокого значения рКа гуанидиновой функциональной группы. Кроме того, эти реагенты могут реагировать с группами лизина, а также с гуанидиновой группировкой аргинина. Боковые карбоксильные группы (аспартила или глутамила) избирательно модифицируют при реакции с карбодиимидами (R-N=C=N-R ), где R и R ), где R и R – различные алкильные группы, такие как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азониа-4,4-диметилпентил)карбодиимид. Кроме того, остатки аспартила и глутамила превращают в остатки аспарагинила и глутаминила реакцией с ионами аммония. – различные алкильные группы, такие как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азониа-4,4-диметилпентил)карбодиимид. Кроме того, остатки аспартила и глутамила превращают в остатки аспарагинила и глутаминила реакцией с ионами аммония.
Блокирование функционального сайта
Были сообщения, что чрезмерная конъюгация с полимерами может привести к потере активности того полипептида, с которым конъюгирован полимер. Эту проблему можно устранить, к примеру, удалением связующих групп, находящихся в функциональном сайте, или блокированием функционального сайта перед конъюгацией. Такие стратегии составляют дальнейшие воплощения изобретения, причем первая стратегия была проиллюстрирована выше, например, путем удаления остатков лизина, находящихся вблизи от функционального сайта, и/или введения остатков цистеина и/или сайтов гликозилирования in vivo в положения, не мешающие функциональным сайтам.
В частности, согласно второй стратегии конъюгация между вариантом полипептида и неполипептидным компонентом проводится в условиях, когда функциональный сайт варианта полипептида IFNG блокирован с помощью вспомогательной молекулы, способной к связыванию с функциональным сайтом варианта полипептида. Предпочтительно вспомогательная молекула является такой молекулой, которая специфически распознает функциональный сайт варианта полипептида, например, рецептором. С другой стороны, вспомогательная молекула может представлять собой антитело, в частности моноклональное антитело, распознающее вариант полипептида. В частности, вспомогательная молекула может представлять собой нейтрализующее моноклональное антитело.
Вариант полипептида подвергают реакции со вспомогательной молекулой перед проведением конъюгации. Это обеспечивает экранирование или защиту функционального сайта варианта полипептида, который вследствие этого становится недоступным для реакции с неполипептидным компонентом типа полимера. После отделения от вспомогательной молекулы можно выделить конъюгат неполипептидного компонента и варианта полипептида с сохранившимся, по крайней мере частично, функциональным сайтом.
Последующая конъюгация варианта полипептида с заблокированным функциональным сайтом с полимером, липофильным соединением, остатком сахара, органическим модифицирующим агентом или любым другим соединением проводится обычным образом, например, как описано выше в разделах, озаглавленных “Конъюгирование с…”.
В следующем воплощении вспомогательные молекулы сначала ковалентно пришивают к твердой фазе типа носителей для колоночной хроматографии, например, шарикам Сефадекса или агарозы, или к поверхности, например, реакционного сосуда. После этого вариант полипептида наносят на колонку со вспомогательной молекулой и проводят конъюгацию в соответствии с методами, известными в этой области, например, как описано выше в разделах, озаглавленных “Конъюгирование с…”. Эта процедура позволяет отделять конъюгированный вариант полипептида от вспомогательной молекулы путем элюирования. Конъюгированный вариант полипептида элюируют стандартными методами в таких физико-химических условиях, которые не приводят к существенной деградации конъюгированного варианта полипептида. Жидкую фазу, содержащую конъюгированный вариант полипептида, отделяют от твердой фазы, с которой вспомогательные молекулы остаются ковалентно связанными. Разделение может осуществляться и другими способами. Так, вспомогательные молекулы можно подвергнуть реакции со второй молекулой (например, биотином), которая распознается специфически связывающимся с ней веществом (например, стрептавидином). Специфически связывающееся вещество можно пришить к твердой фазе, что позволит отделить конъюгированный вариант полипептида от комплекса вспомогательная молекула-вторая молекула при пропускании через колонку со второй вспомогательной молекулой на твердой фазе, на которой при последующей элюции будет удерживаться комплекс вспомогательная молекула-вторая молекула, но не конъюгированный вариант полипептида. Конъюгированный вариант полипептида можно отделить от вспомогательной молекулы любым подходящим способом. Деблокирование может осуществляться обеспечением условий, в которых вспомогательная молекула диссоциирует из функционального сайта варианта полипептида, с которым она связана. Например, комплекс между антителом, с которым конъюгирован полимер, и антиидиотипическим антителом можно диссоциировать путем изменения pH в сторону кислых или щелочных значений.
Конъюгация несущего метку варианта полипептида
В альтернативном воплощении вариант полипептида IFNG экспрессируется в виде слитого с меткой белка, то есть с аминокислотной последовательностью или отрезком пептида, как правило состоящим из 1-30, например, 1-20 аминокислотных остатков. Помимо того, что метка дает возможность быстрой и легкой очистки, она является удобным инструментом для осуществления конъюгации между несущим метку вариантом полипептида IFNG и неполипептидным компонентом. В частности, метка может применяться для осуществления конъюгации в микропланшетах или на носителях типа магнитных шариков, на которых несущий метку полипептид можно иммобилизовать через метку. Конъюгация несущего метку варианта полипептида IFNG, например, в микропланшетах имеет то преимущество, что несущий метку вариант полипептида может быть иммобилизован в микропланшетах прямо из культуральной жидкости (в принципе, без какой-либо очистки) и подвергнут конъюгации. При этом уменьшается общее число стадий процесса (от экспрессии до конъюгации). Кроме того, метка может функционировать в качестве молекулы спейсера, обеспечивая лучший доступ к иммобилизованному варианту полипептида при конъюгации. Несущий метку вариант полипептида можно конъюгировать с любым из описанных здесь неполипептидных компонентов, например, с молекулой полимера типа PEG.
Природа конкретной используемой метки не является критической, если только метка способна экспрессироваться вместе с вариантом полипептида и способна иммобилизоваться на подходящей поверхности или носителе. Целый ряд таких меток доступны коммерчески, например, у фирмы Unizyme Laboratories, Дания. Например, метка может представлять собой любую из следующих последовательностей:
His-His-His-His-His-His (SEQ ID NO:35),
Met-Lys-His-His-His-His-His-His (SEQ ID NO:36),
Met-Lys-His-His-Ala-His-His-Gln-His-His (SEQ ID NO:37),
Met-Lys-His-Gln-His-Gln-His-Gln-His-Gln-His-Gln-His-Gln (SEQ ID NO:38),
(все от фирмы Unizyme Laboratories, Дания)
или любую из следующих:
EQKLISEEDL (SEQ ID NO:39) (С-концевая метка, описанная в Mol. Cell. Biol. 5: 3610-16, 1985),
DYKDDDDK(SEQ ID NO:40) (С- или N-концевая метка),
YPYDVPDYA (SEQ ID NO:41).
Антитела к вышеуказанным меткам коммерчески доступны, например, от фирм ADI, Aves Lab и Research Diagnostics.
Последующее отщепление метки от полипептида может осуществляться с помощью коммерчески доступных ферментов.
Способы получения варианта полипептида IFNG по изобретению
Вариант полипептида IFNG можно получить любым подходящим способом, известным в этой области. Такие способы включают конструирование нуклеотидной последовательности, кодирующей вариант полипептида, и экспрессирование этой последовательности в соответствующем трансформированном или трансфицированном хозяине. Однако варианты полипептида по изобретению могут быть получены, хотя и с меньшей эффективностью, путем химического синтеза или комбинации химического синтеза и технологии рекомбинантной ДНК.
Нуклеотидная последовательность по изобретению, кодирующая вариант полипептида IFNG (мономера или одноцепочечной формы), может быть сконструирована путем выделения или синтеза нуклеотидной последовательности, кодирующей исходный IFNG, например, huIFNG с аминокислотной последовательностью SEQ ID No.17 или его фрагмент, с последующим изменением нуклеотидной последовательности так, чтобы обеспечить введение (то есть вставку или замену) или удаление (то есть делению или замену) соответствующего/их аминокислотного/ых остатка/ов.
Нуклеотидную последовательность удобно модифицировать методом направленного мутагенеза в соответствии со стандартными методами, например, см. Mark et al., “Site-specific Mutagenesis of the Human Fibroblast Interferon Gene”, Proc. Natl. Acad. Sci. USA, 81, pp. 5662-66 (1984), и US 4588585.
В качестве альтернативы нуклеотидную последовательность можно получить химическим синтезом, например, с помощью синтезатора олигонуклеотидов, при этом олигонуклеотиды конструируют на основе аминокислотной последовательности желаемого варианта полипептида и предпочтительно выбирают кодоны, которым отдается предпочтение в тех клетках-хозяевах, которые будут вырабатывать рекомбинантный полипептид. Например, можно синтезировать несколько небольших олигонуклеотидов, кодирующих отдельные части желаемого варианта полипептида, и собрать их вместе с помощью ПЦР, лигирования или цепной реакции лигирования (LCR). Индивидуальные олигонуклеотиды, как правило, содержат выступающие 5 – или 3 – или 3 -концы для комплементарной сборки. -концы для комплементарной сборки.
После сборки (путем синтеза, направленного мутагенеза или другим способом) нуклеотидную последовательность, кодирующую вариант полипептида, встраивают в рекомбинантный вектор и функционально связывают с контрольными последовательностями, необходимыми для экспрессии варианта полипептида IFNG в требуемых транформированных клетках-хозяевах.
Конечно, следует иметь в виду, что не все векторы и контролирующие экспрессию последовательности функционируют одинаково хорошо при экспрессии нуклеотидной последовательности, кодирующей описанный вариант полипептида IFNG. Также не все клетки-хозяева функционируют одинаково хорошо с одной и той же экспрессионной системой. Однако специалист в этой области имеет возможность сделать выбор из этих векторов, контролирующих экспрессию последовательностей и клеток-хозяев без излишнего экспериментирования. Например, при выборе вектора следует учитывать клетку-хозяина, так как вектор должен реплицироваться в нем или быть способным встраиваться в хромосому. Следует также учитывать число копий вектора, способность контролировать это число копий и экспрессию любых других белков, кодируемых вектором, таких как антибиотические маркеры. При выборе контролирующей экспрессию последовательности также следует учитывать целый ряд факторов. К ним относятся, к примеру, относительная сила последовательности, ее контролируемость и совместимость с нуклеотидной последовательностью, кодирующей вариант полипептида, особенно в отношении возможных вторичных структур. Хозяев следует выбирать с учетом их совместимости с выбранным вектором, токсичности продукта, кодируемого нуклеотидной последовательностью, особенностей секреции, способности к правильной укладке полипептида, требований к ферментации и культивированию, а также легкости очистки продуктов, кодируемых нуклеотидной последовательностью.
Рекомбинантный вектор может быть автономно реплицирующимся вектором, то есть вектором, существующим в виде внехромосомной единицы, репликация которого не зависит от хромосомной репликации, представляя собой, к примеру, плазмиду. В качестве альтернативы вектором может быть такой вектор, который при введении в клетку хозяина встраивается в ее геном и реплицируется вместе с хромосомой/ами, в которую/ые он встроился.
Вектором предпочтительно служит экспрессионный вектор, в котором нуклеотидная последовательность, кодирующая вариант полипептида IFNG, функционально связана с дополнительными сегментами, необходимыми для транскрипции этой нуклеотидной последовательности. Как правило, вектор происходит из плазмиды или вирусной ДНК. Целый ряд экспрессионных векторов, подходящих для экспрессии в указанных клетках, коммерчески доступны или описаны в литературе. К числу полезных экспрессионных векторов для эукариотических клеток относятся векторы, содержащие контролирующие экспрессию последовательности из SV40, вируса бычьей папилломы, аденовируса и цитомегаловируса. Конкретно, такими векторами являются, к примеру, pCDNA3.1(+)/Hyg (InVitrogen, Carlsbad, CA, USA) и pCI-Neo (Stratagene, La Jolla, CA, USA). К числу полезных экспрессионных векторов для бактериальных клеток относятся известные бактериальные плазмиды, такие как плазмиды из Е.coli, включая pBR322, рЕТ3а и рЕТ12а (оба фирмы Novagen Inc., WI, USA), плазмиды для более широкого круга хозяев типа RP4, фаговые ДНК, например, многочисленные производные фага лямбда типа NM989 и других ДНК-содержащих фагов типа М13 и нитчатых фагов с одноцепочечной ДНК. К числу полезных экспрессионных векторов для дрожжевых клеток относятся плазмида 2(t и ее производные, вектор РОТ1 (US 4931373), вектор pJS037, описанный Okkels, Ann. New York Acad. Sci. 782, 202-207, 1996, и pPICZ А, В или С (InVitrogen). К числу полезных векторов для клеток насекомых относятся pVL941, pBG311 (Cate et al., “Isolation of the Bovine and Human Genes for Mullerian Inhibiting Substance and Expression of the Human Gene in Animal Cells”, Cell, 45, pp.685-98 (1986)), pBlueBac 4.5 и pMelbac (оба фирмы In Vitrogen).
Другие векторы для применения в настоящем изобретении включают векторы, позволяющие амплифицировать число копий нуклеотидной последовательности, кодирующей вариант полипептида IFNG. Такие амплификационные векторы хорошо известны в этой области. Так, к ним относятся векторы, способные амплифицироваться путем DHFR-амплификации (например, см. Kaufman, U.S.Pat. No.4470461, Kaufinan and Sharp, “Construction of a Modular Dihydrofolate Reductase cDNA Gene: Analysis of Signals Utilized for Efficient Expression”, Mol. Cell. BioL, 2, pp. 1304-19 (1982) и глутаминсинтетазной амплификации (“CS”-амплификации) (например, см. US 5122464 и ЕР 338841).
Рекомбинантный вектор также может дополнительно содержать и последовательность ДНК, дающую вектору способность реплицироваться в данных клетках-хозяевах. Примером такой последовательности (когда клетка-хозяин представлена клеткой млекопитающего) является ориджин репликации (origin) SV40. Когда клетка-хозяин представлена клеткой дрожжей, то подходящими последовательностями, дающими вектору способность к репликации, являются гены репликации REP 1-3 и ориджин репликации дрожжевой плазмиды 2 . .
Вектор также может содержать и селективный маркер, скажем, ген, продукт которого комплементирует дефект в клетке-хозяине, например, ген, кодирующий дигидрофолатредуктазу (DHFR), или ген TPI Schizosaccharomyces pombe (описаны в P.R.Russel, Gene 40, 1985, pp.125-130), либо ген, придающий устойчивость к лекарственному препарату – ампициллину, канамицину, тетрациклину, хлорамфениколу, неомицину, гигромицину или метотрексату. К селективным маркерам для нитчатых грибов относятся amdS, pyrG, arcB, niaD и sC.
Термин “контролирующая последовательность” в настоящем изобретении относится ко всем компонентам, необходимым или полезным для экспрессии варианта полипептида IFNG. Каждая контролирующая последовательность может быть природной или чужеродной для последовательности нуклеиновой кислоты, кодирующей вариант полипептида. К таким контролирующим последовательностям относятся лидерные последовательности, последовательности полиаденилирования, последовательности пропептидов, промоторы, энхансеры или вышерасположенные (upstream) активирующие последовательности, последовательности сигнальных пептидов и терминаторы транскрипции, но не ограничиваются ими. Как минимум, контролирующая последовательность включает промотор.
В настоящем изобретении может применяться широкий набор контролирующих последовательностей экспрессии. К таким полезным последовательностям относятся контролирующие экспрессию последовательности, связанные со структурными генами вышеописанных экспрессионных векторов, а также любые последовательности, которые известны как контролирующие экспрессию генов прокариотических и эукариотических клеток или их вирусов, а также различные их сочетания.
Примеры подходящих контролирующих последовательностей, управляющих транскрипцией в клетках млекопитающих, включают ранние и поздние промоторы SV40 и аденовирусов, например, основной поздний промотор аденовируса 2, промотор МТ-1 (гена металлотионеина), промотор немедленноранних генов цитомегаловируса человека (CMV), промотор фактора элонгации человека 1 (EF-1 (EF-1 ), минимальный промотор белка теплового шока 70 Drosophila, промотор вируса саркомы Рауса (RSV), промотор убиквитина С (UbC) человека, терминатор гормона роста человека, сигналы полиаденилирования SV40 или области Elb аденовирусов и консенсусные последовательности Козака (Kozak M., J. Mol. Biol. 1987, Aug. 20, 196 (4): 947-50). ), минимальный промотор белка теплового шока 70 Drosophila, промотор вируса саркомы Рауса (RSV), промотор убиквитина С (UbC) человека, терминатор гормона роста человека, сигналы полиаденилирования SV40 или области Elb аденовирусов и консенсусные последовательности Козака (Kozak M., J. Mol. Biol. 1987, Aug. 20, 196 (4): 947-50).
Для того чтобы усилить экспрессию в клетках млекопитающих, можно встроить синтетический интрон в 5 -нетраслируемый участок нуклеотидной последовательности, кодирующей вариант полипептида IFNG. Пример синтетического интрона представлен искусственным интроном из плазмиды pCI-Neo (фирмы Promega Corporation, WI, USA). -нетраслируемый участок нуклеотидной последовательности, кодирующей вариант полипептида IFNG. Пример синтетического интрона представлен искусственным интроном из плазмиды pCI-Neo (фирмы Promega Corporation, WI, USA).
Примеры подходящих контролирующих последовательностей, управляющих транскрипцией в клетках насекомых, включают промотор полиэдрина, промотор Р10, промотор основного белка вируса полиэдроза Autographa califomica, промотор немедленно-раннего гена 1 бакуловируса, промотор задержанно-раннего гена 39К бакуловируса и последовательность полиаденилирования SV40.
Примеры подходящих контролирующих последовательностей для дрожжевых клеток включают промоторы  -системы спаривания дрожжей, промотор дрожжевой триозофосфатизомеразы (TPI), промоторы гликолитических генов или генов алкогольдегидрогеназы дрожжей, промотор ADH2-4c и индуцибельный промотор GAL. -системы спаривания дрожжей, промотор дрожжевой триозофосфатизомеразы (TPI), промоторы гликолитических генов или генов алкогольдегидрогеназы дрожжей, промотор ADH2-4c и индуцибельный промотор GAL.
Примеры подходящих контролирующих последовательностей для клеток-хозяев нитчатых грибов включают промотор и терминатор ADH3, промоторы из генов, кодирующих ТАКА-амилазу, триозофосфатизомеразу или щелочную протеазу Aspergillus oryzae,  -амилазу A. niger, глюкоамилазу A. niger или A. nidulans, ацетамидазу A. nidulans, аспартатную протеиназу или липазу Rhizomucor miehei, терминатор ТРI1 и терминатор ADH3. -амилазу A. niger, глюкоамилазу A. niger или A. nidulans, ацетамидазу A. nidulans, аспартатную протеиназу или липазу Rhizomucor miehei, терминатор ТРI1 и терминатор ADH3.
Примеры подходящих контрольных последовательностей для бактериальных клеток-хозяев включают промоторы системы lac, системы trp, системы ТАС или TRC и основные промоторные участки фага  . .
Нуклеотидная последовательность по изобретению, получена ли она путем направленного мутагенеза, синтеза или другим методом, может необязательно включать нуклеотидную последовательность, кодирующую сигнальный пептид. Сигнальный пептид имеется в случае, когда полипептид должен секретироваться из клеток, в которых он экспрессируется. Такой сигнальный пептид, если он есть, должен быть узнаваемым клетками, выбранными для экспрессии варианта полипептида. Сигнальный пептид может быть гомологичным (то есть в норме связанным с huIFNG) или гетерологичным (то есть происходить из другого источника, чем huIFNG) полипептиду, или может быть гомологичным или гетерологичным клетке-хозяину, то есть либо представлять собой сигнальный пептид, который в норме экспрессируется в клетке-хозяине, либо в норме не экспрессируется в клетке-хозяине. Соответственно, сигнальный пептид может быть прокариотическим, например, из таких бактерий, как Е.coli, или эукариотическим, к примеру, из клеток млекопитающих, насекомых или дрожжей.
Присутствие или отсутствие сигнального пептида зависит от экспрессирующей клетки-хозяина, используемой для получения варианта полипептида, подлежащего экспрессии белка (является он внутриклеточным или внеклеточным белком) и того, желательна ли его секреция. Для нитчатых грибов сигнальный пептид можно легко получить из гена, кодирующего амилазу или глюкоамилазу Aspergillus sp., из гена, кодирующего липазу или протеазу Rhizomucor miehei или липазу Humicola lanuginosa. Сигнальный пептид предпочтительно получают из гена, кодирующего ТАКА-амилазу А.oryzae, нейтральную  -амилазу A.niger, кислотоустойчивую амилазу A.niger или глюкоамилазу А.niger. Для клеток насекомых сигнальный пептид можно легко получить из таких генов насекомых (см. WO 90/05783), как предшественник адипокинетического гормона бабочки Manduca sexta (см. US 5023328), мелиттин пчел (In Vitrogen), UDP-глюкозилтрансфераза экдистероидов (egt) (Murphy et al., Protein Expression and Purification 4, 349-357 (1993) или панкреатическая липаза человека (hpl) (Methods in Enzymology 284, pp.262-272, 1997). -амилазу A.niger, кислотоустойчивую амилазу A.niger или глюкоамилазу А.niger. Для клеток насекомых сигнальный пептид можно легко получить из таких генов насекомых (см. WO 90/05783), как предшественник адипокинетического гормона бабочки Manduca sexta (см. US 5023328), мелиттин пчел (In Vitrogen), UDP-глюкозилтрансфераза экдистероидов (egt) (Murphy et al., Protein Expression and Purification 4, 349-357 (1993) или панкреатическая липаза человека (hpl) (Methods in Enzymology 284, pp.262-272, 1997).
Предпочтительным сигнальным пептидом для клеток млекопитающих является таковой huTFNG или сигнальный пептид легкой цепи каппа Ig мышей (Coloma M. (1992) J.Imm. Methods 152: 89-104). Для дрожжевых клеток подходящим сигнальным пептидом оказался сигнальный пептид  -фактора S. cerevisiae (см. US 4870008), сигнальный пептид амилазы слюны мышей (см. О.Hagen buchle et. al., Nature 289, 1981, pp.643-646), модифицированный сигнальный пептид карбоксипептидазы (см. L.A.Vails et al., Cell 48, 1987, pp.887-897), сигнальный пептид BAR1 дрожжей (см. WO 87/02670), сигнальный пептид аспартатной протеазы-3 (YAP3) дрожжей (см. M.Egel-Mitani et al., Yeast 6, 1990, pp.127-137). -фактора S. cerevisiae (см. US 4870008), сигнальный пептид амилазы слюны мышей (см. О.Hagen buchle et. al., Nature 289, 1981, pp.643-646), модифицированный сигнальный пептид карбоксипептидазы (см. L.A.Vails et al., Cell 48, 1987, pp.887-897), сигнальный пептид BAR1 дрожжей (см. WO 87/02670), сигнальный пептид аспартатной протеазы-3 (YAP3) дрожжей (см. M.Egel-Mitani et al., Yeast 6, 1990, pp.127-137).
Для получения варианта полипептида IFNG можно использовать любого подходящего хозяина, включая бактерии, грибы (включая дрожжи), растения, насекомых, млекопитающих, или другие подходящие клетки или клеточные линии животных, а также трансгенных животных или растений. Примеры бактериальных клеток-хозяев включают такие грам-положительные бактерии, как штаммы Bacillus, к примеру, В.brevis или В.subtilis, или Streptomyces, или такие грам-отрицательные бактерии, как штаммы Е.coli или Pseudomonas. Введение вектора в бактериальные клетки может осуществляться, к примеру, путем трансформации протопластов (например, см. Chang and Cohen, 1979, Molecular General Genetics 168: 111-115), с помощью компетентных клеток (например, см. Young and Spizizen, 1961, Journal of Bacteriology 81: 823-829 или Dubnau and Davidoff-Abelson, 1971, Journal of Molecular Biology 56:209-221), электропорации (например, см. Shigekawa and Dower, 1988, Biotechniques 6: 742-751) или конъюгации (например, см. Koehler and Thome, 1987, Journal of Bacteriology 169: 5771-5278).
Примеры подходящих клеток нитчатых грибов включают штаммы Aspergillus, например A.oryzae, А.niger или A.nidulans, Fusarium или Trichoderma. Клетки грибов можно трансформировать способом, включающим образование протопластов, трансформацию протопластов и регенерацию клеточной стенки известными методами. Подходящие способы трансформации клеток Aspergillus описаны в ЕР 238 021 и US 5679543. Подходящие способы трансформации штаммов Fusarium описаны Malardier et al., 1989, Gene 78: 147-156, и WO 96/00787. Дрожжи можно трансформировать способами, описанными Becker and Guarente, In: Abelson J.N. and Simon M.I., editors. Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, Volume 194, pp.182-187, Academic Press, Inc., New York; Ito et al., 1983, Journal of Bacteriology 153: 163; Hinnen et al., 1978, Proceedings of the National Academy of Sciences USA 75: 1920.
Примеры подходящих дрожжевых клеток включают штаммы Saccharomyces, например, S.cerevisiae, Schizosaccharomyces, Kluyveromyces, Pichia, как Р.pastoris или Р.methanolica, Hansenula, как H.polymorpha, или Yarrowia. Методы трансформации дрожжевых клеток гетерологичной ДНК и получения из них гетерологичных полипептидов раскрыты фирмой Clontech Laboratories, Inc., Palo Alto, CA, USA (в методических рекомендациях для продукта Yeastmaker Yeast Transformation System Kit), и Reeves et al., FEMS Microbiology Letters 99 (1992) 193-198; Manivasakam and Schiesti, Nucleic Acids Research, 1993, Vol.21, No.18, pp.4414-4415; Ganeva et al., FEMS Microbiology Letters 121 (1994) 159-164. Yeast Transformation System Kit), и Reeves et al., FEMS Microbiology Letters 99 (1992) 193-198; Manivasakam and Schiesti, Nucleic Acids Research, 1993, Vol.21, No.18, pp.4414-4415; Ganeva et al., FEMS Microbiology Letters 121 (1994) 159-164.
Примеры подходящих клеток насекомых включают клеточные линии бабочек, таких как Spodoptera frugiperda (Sf9 или Sf21), или клетки Trichoplusia ni (High Five) (US 5,077,214). Трансформация клеток насекомых и продукция в них гетерологичных полипептидов может проводиться как описано In Vitrogen.
Примеры подходящих клеток млекопитающих включают клеточные линии из яичников китайского хомячка (СНО), например, СНО-К1 (АТСС CCL-61); клеточные линии зеленой мартышки (COS), например, COS 1 (АТСС CRL-1650), COS 7 (АТСС CRL-1651); клетки мышей (например, NS/O); клеточные линии из почек новорожденных хомячков (ВНК), например, АТСС CRL-1632 или АТСС CCL-10, и клетки человека, например, НЕК 293 (АТСС CRL-1573), а также клетки растений в культуре ткани. В этой области известны и другие подходящие клеточные линии из таких общедоступных депозитариев, как American Type Culture Collection, Rockville, Maryland. Кроме того, клетки млекопитающих, к примеру, клетки СНО, можно модифицировать таким образом, чтобы они экспрессировали сиалилтрансферазу, например, 1,6-сиалилтрансферазу, как описано в US 5,047,335, чтобы обеспечить улучшенное гликозилирование варианта полипептида IFNG.
Методы введения экзогенной ДНК в клетки-хозяева млекопитающих включают трансфекцию с помощью фосфата кальция, электропорацию, трансфекцию с помощью DEAE-декстрана, трансфекцию с помощью липосом, вирусные векторы и метод трансфекции с помощью Lipofectamine 2000, описанный Life Technologies Ltd, Paisley, UK. Эти методы хорошо известны в данной области и описаны, к примеру, в Ausbel et al. (eds.), 1996, Current Protocols in Molecular Biology, John Wiley & Sons, New York, USA. Культивирование клеток млекопитающих проводят согласно общепринятым методам, например, как описано в Animal Cell Biotechnology, Methods and Protocols, Edited by Nigel Jenkins, 1999, Human Press Inc., Totowa, New Jersey, USA, и Harrison MA and Rae IF, General Technologies of Cell Culture, Cambridge University Press, 1997.
Для того чтобы получить гликозилированный полипептид, используют эукариотические клетки типа тех, что указаны выше.
В способах получения по настоящему изобретению клетки культивируют в питательной среде, пригодной для продукции варианта полипептида способами, известными в этой области. Например, клетки можно культивировать в колбах со встряхиванием либо в лабораторных или промышленных ферментерах на большие или малые объемы (включая непрерывную, периодическую, периодическую с подпиткой или ферментацию или ферментацию на твердых средах), в соответствующей среде и в условиях, способствующих экспрессии и/или выделению варианта полипептида. Культивирование проводят в подходящей питательной среде, содержащей источники углерода и азота и неорганические соли, применяя методы, известные в этой области. Подходящие среды доступны от коммерческих поставщиков или могут быть приготовлены согласно опубликованным составам (например, в каталогах American Type Culture Collection). Если вариант полипептида секретируется в питательную среду, его можно извлечь прямо из этой среды. Если вариант полипептида не секретируется, его можно извлечь из клеточных лизатов.
Полученный вариант полипептида может быть извлечен способами, известными в этой области. Так, вариант полипептида может быть извлечен из питательной среды стандартными методами, которые включают центрифугирование, фильтрование, экстракцию, распылительную сушку, упаривание или осаждение, но не ограничиваются ими.
Варианты полипептида могут быть очищены при помощи ряда методов, известных в этой области, включая хроматографию (например, ионообменную хроматографию, аффинную, гидрофобную, хроматофокусирование и эксклюзионную), электрофоретические методы (например, препаративное изофокусирование), дифференциальную растворимость (например, осаждение сульфатом аммония), ВЭЖХ или экстракцию (например, см. Protein Purification, J. – C.Janson and Lars Ryden, editors, VCH Publishers, New York, 1989), но не ограничиваясь ими. Специфические методы очистки полипептидов, обладающих активностью IFNG, раскрыты в ЕР 0110044 и Japanese patent application No.186995/84, не законченную в производстве.
Биологическую активность варианта полипептида IFNG можно определить любым удобным методом, известным в этой области. К таким методам относятся нейтрализация антителами антивирусной активности, индукция протеинкиназной, олигоаденилат-2,5-А-синтетазной или фосфодиэстеразной активностей, как описано в ЕР 0041313 В1. К таким методам анализа также относятся иммуномодуляторные методы (например, см. US 4753795), анализ ингибирования роста и измерение связывания с клетками, экспрессирующими рецепторы интерферона. Конкретные методы описаны в разделе описания Материалы и Методы.
Фармацевтические композиции и их применение
Кроме того, настоящее изобретение касается улучшенных способов лечения или профилактики, в частности, воспалительных заболеваний, например, интерстициальных легочных заболеваний, таких как идиопатический фиброз легких, а также грануломатозных заболеваний; рака, в частности рака яичников; инфекций, таких как атипичные легочные микобактериальные инфекции; костных заболеваний (нарушений метаболизма костной ткани типа злокачественного остеопетроза); аутоиммунных заболеваний, таких как ревматоидный артрит; а также других заболеваний, таких как туберкулез со множественной устойчивостью к лекарствам; криптококковый менингит; кистозный фиброз и фиброз печени, в частности вторичный фиброз печени после гепатита С; при этом способ включает введение нуждающемуся в этом млекопитающему, в частности человеку, эффективного количества варианта полипептида по изобретению или композиции по изобретению, а главное преимущество заключается в менее частом и/или менее агрессивном применении более эффективной терапии, и необязательно меньшем риске иммунных реакций на терапевтически активное/ые соединение/я.
Молекулы по изобретению предпочтительно вводятся в составе композиции, включающей фармацевтически приемлемый носитель или наполнитель. “Фармацевтически приемлемый” означает, что носитель или наполнитель не вызывает никаких неблагоприятных эффектов у тех пациентов, которым он вводится. Такие фармацевтически приемлемые носители и наполнители хорошо известны в этой области (Remington s Pharmaceutical Sciences, 18th edition, A.R.Gennaro, Ed., Mack Publishing Company [1990]; Pharmaceutical Formulation Development of Peptides and Proteins, S. Frokjaer and L.Hovgaard, Eds., Taylor & Francis [2000]; и Handbook of Pharmaceutical Excipients, 3rd edition, A.Kibbe, Ed., Pharmaceutical Press [2000]). s Pharmaceutical Sciences, 18th edition, A.R.Gennaro, Ed., Mack Publishing Company [1990]; Pharmaceutical Formulation Development of Peptides and Proteins, S. Frokjaer and L.Hovgaard, Eds., Taylor & Francis [2000]; и Handbook of Pharmaceutical Excipients, 3rd edition, A.Kibbe, Ed., Pharmaceutical Press [2000]).
Молекулы по изобретению могут применяться “как есть” и/или в форме соли. Приемлемые соли включают соли щелочных или щелочноземельных металлов – натрия, калия, кальция и магния, а также соли цинка, но не ограничиваются ими. Эти соли или комплексы могут находиться в кристаллическом и/или аморфном состоянии.
Варианты по изобретению вводятся в дозах, приблизительно равных тем, что применяются в терапии известными коммерческими препаратами IFNG типа Actimmune® или как указано в ЕР 0795332. Точная доза для введения зависит от обстоятельств. Как правило, доза должна быть способна предупреждать или уменьшать тяжесть или развитие подлежащего лечению состояния или показания. Специалисты знают, что эффективное количество варианта или композиции по изобретению зависит, среди прочего, от заболевания, дозировки, схемы применения, от того, вводится ли вариант полипептида или композиция сама по себе или в сочетании с другими терапевтическими средствами, времени полужизни композиции в сыворотке и общего состояния пациента.
Настоящее изобретение также касается применения варианта полипептида IFNG по настоящему изобретению или фармацевтической композиции по настоящему изобретению в качестве лекарственного средства.
Кроме того, изобретение также касается применения i) варианта IFNG по настоящему изобретению или ii) фармацевтической композиции по изобретению для изготовления лекарственого средства, фармацевтической композиции или набора компонентов для лечения заболеваний, входящих в группу, состоящую из воспалительных заболеваний, таких как интерстициальные легочные заболевания, в частности идиопатическего фиброза легких; рака, в частности рака яичников; инфекций, таких как атипичные легочные микобактериальные инфекции; костных заболеваний (нарушений метаболизма костной ткани типа злокачественного остеопетроза); грануломатозных заболеваний; аутоиммунных заболеваний, таких как ревматоидный артрит; туберкулеза со множественной устойчивостью к лекарствам; криптококкового менингита; кистозного фиброза и фиброза печени, в частности вторичного фиброза печени после гепатита С. Наиболее предпочтительно заболевание представляет собой интерстициальное легочное заболевание, в особенности идиопатический фиброз легких.
Также раскрыты усовершенствованные средства доставки молекул или препаратов, необязательно дополнительно включающих глюкокортикоиды.
Предпочтительная дозировка составляет 1-4, более предпочтительно 2-3 мкг полипептидного компонента на 1 кг веса пациента на 1 дозу. Предпочтительная дозировка составляет 100-350, более предпочтительно 100-150 мкг глюкокортикоида на 1 кг веса пациента на 1 дозу.
Изобретение также касается набора из компонентов, пригодного для лечения интерстициальных легочных заболеваний, включающего первую фармацевтическую композицию, содержащую активные компоненты i) и ii), указанные выше, и вторую фармацевтическую композицию, содержащую по меньшей мере один глюкокортикоид, причем каждая необязательно вместе с фармацевтически приемлемым носителем и/или наполнителем.
Рецептура фармацевтической композиции может быть разработана для варианта по изобретению хорошо известными методами. Подходящие рецептуры описаны в Remington s Pharmaceutical Sciences, E.W.Martin и US 5183746. s Pharmaceutical Sciences, E.W.Martin и US 5183746.
Фармацевтическая композиция может быть составлена в различных формах, включая жидкие, гелеобразные, лиофилизованные, порошкообразные, в виде спрессованного твердого вещества или любой другой подходящей форме. Предпочтительная форма зависит от конкретного показания, подвергающегося лечению, и специалисту в этой области она будет очевидной.
Фармацевтическую композицию можно вводить перорально, подкожно, внутривенно, интрацеребрально, интраназально, чрезкожно, внутрибрюшинно, внутримышечно, внутрилегочно, вагинально, ректально, интраокулярно или любым другим приемлемым способом, например, с применением технологии Powder Ject или ProLease. Композиции можно вводить непрерывно путем инфузии, хотя приемлемы и болюсные инъекции, пользуясь методами, хорошо известными в этой области, такими как насосы или имплантантация. В некоторых случаях композиции можно наносить прямо в виде раствора или аэрозоля. Предпочтительный способ применения зависит от конкретного показания, подвергающегося лечению, и специалист в этой области сможет его определить.
Фармацевтическую композицию изобретения можно вводить саму по себе или в сочетании с другими терапевтическими средствами. Эти средства могут входить в состав одной и той же фармацевтической композиции или могут вводиться отдельно от варианта полипептида по изобретению, как одновременно, так и в соответствии с любым другим приемлемым режимом лечения. Кроме того, вариант полипептида или фармацевтическая композиция изобретения может применяться как вспомогательное средство при другом лечении. В частности, предусматриваются комбинации с глюкокортикоидами, как описано в ЕР 0795332.
Следующий аспект изобретения касается способа лечения млекопитающих с циркулирующими антителами к huIFNG или rhuIFNG, причем способ включает введение варианта IFNG, обладающего биоактивностью IFNG и не реагирующего с данными антителами. Соединение предпочтительно представляет собой описанный в настоящем изобретении вариант, а млекопитающее предпочтительно представляет собой человека. Подлежащие лечению млекопитающие могут страдать любым из заболеваний, перечисленных выше, для которых IFNG является полезным средством лечения. Кроме того, изобретение касается способа изготовления фармацевтического препарата для лечения млекопитающих с циркулирующими антителами к huIFNG или rhuIFNG, при этом вариант IFNG, обладающий биоактивностью IFNG и не реагирующий с такими антителами, включен в состав предназначенной для инъекций или другой подходящей композиции. Термин “циркулирующие антитела” служит для обозначения аутоантител, образующихся у млекопитающего в ответ на лечение его любым из коммерчески доступных препаратов IFNG.
Также предусматривается применение нуклеотидной последовательности, кодирующей вариант полипептида IFNG по изобретению, для генной терапии. В частности, может представлять интерес применение нуклеотидной последовательности, кодирующей вариант полипептида IFNG, описанный в разделе “Варианты IFNG по изобретению, у которых неполипептидный компонент представлен остатком сахара”. При этом гликозилирование варианта полипептида происходит во время курса генной терапии, то есть после экспрессии нуклеотидной последовательности в организме человека.
Предусматриваемые применения в генной терапии включают лечение тех заболеваний, при которых ожидается, что вариант полипептида обеспечит эффективную терапию.
Местная доставка варианта IFNG при генной терапии может обеспечить доставку терапевтического средства в область мишени и при этом избежать возможных проблем с токсичностью, связанных с неспецифическим введением.
Предусматриваются методики генной терапии как in vitro, так и in vivo.
Известно несколько методов переноса потенциально терапевтических генов в определенные популяции клеток. Дополнительно см. Mulligan, “The Basic Science of Gene Therapy”, Science, 260, pp.926-31 (1993). Эти методы включают:
прямой перенос генов, как описано Wolff et al., “Direct Gene Transfer into Mouse Muscle in vivo”, Science, 247, pp.1465-68 (1990);
перенос ДНК с помощью липосом, как описано Caplen et al., “Liposome-mediated CFTR Gene Transfer to the Nasal Epithelium of Patients with Cystic Fibrosis”, Nature Med., 3, pp.39-46 (1995); Crystal, “The Gene as a Drug”, Nature Med., 1, pp.15-17 (1995); Gao and Huang, “A Novel Cationic Liposome Reagent for Efficient Transfection of Mammalian Cells”, Biochem. Biophys. Res. Comm., 179, pp.280-85 (1991);
перенос ДНК с помощью ретровируса, как описано Kay et al., “In vivo Gene Therapy of Hemophilia B: Sustained Partial Correction in Factor IX-deficient Dogs”, Science, 262, pp.117-19 (1993); Anderson, “Human Gene Therapy”, Science, 256, pp.808-13 (1992);
перенос ДНК с помощью ДНК-содержащего вируса. К таким ДНК-содержащим вирусам относятся аденовирусы (предпочтительны векторы на основе Ad-2 или Ad-5), герпесвирусы (предпочтительны векторы на основе вируса Herpes simplex) и парвовирусы (предпочтительны векторы на основе “дефектных” или неавтономных парвовирусов, более предпочтительны векторы на основе аденоассоциированных вирусов, наиболее предпочтительны векторы на основе AAV-2). Например, см. Alt et al., “The Use of DNA Viruses as Vectors for Gene Therapy”, Gene Therapy, 1, pp.367-84 (1994); US 4797368 и US 5139941.
Парентеральные препараты
Примером фармацевтической композиции является раствор, предназначенный для парентерального введения. Несмотря на то что во многих случаях растворы фармацевтических композиций находятся в жидкой форме, удобной для немедленного применения, такие парентеральные составы могут находиться и в замороженном или лиофилизованном виде. Замороженную композицию необходимо оттаять перед употреблением. Лиофилизация часто применяется для увеличения стабильности содержащегося в композиции активного соединения при хранении в широком диапазоне условий хранения, поскольку, как известно специалистам в этой области, лиофилизованные препараты обычно более стабильны, чем их жидкие аналоги. Такие лиофилизованные препараты восстанавливают перед употреблением, добавляя один или несколько подходящих фармацевтически приемлемых растворителей, таких как стерильная вода для инъекций или стерильный физраствор.
Парентеральные препараты готовят для хранения в виде лиофилизованных композиций или водных растворов, смешивая надлежащим образом вариант полипептида требуемой степени чистоты с одним или более фармацевтически приемлемыми носителями, наполнителями или стабилизаторами, обычно применяющимися в данной области (все они именуются “наполнители”), например, буферными веществами, стабилизирующими веществами, консервантами, поддерживающими изотоничность веществами, неионными детергентами, антиоксидантами и/или другими разнообразными добавками.
Буферные вещества способствуют поддержанию pH в диапазоне, близком к физиологическим условиям. Как правило, они присутствуют в концентрациях от 2 мМ до 50 мМ. К числу пригодных для применения в настоящем изобретении буферных веществ относятся как органические, так и неорганические кислоты и их соли, например, цитратные буферы (смесь однозамещенного цитрата натрия и двузамещенного цитрата натрия, смесь лимонной кислоты и трехзамещенного цитрата натрия, смесь лимонной кислоты и однозамещеного цитрата натрия и т.д.), сукцинатные буферы (смесь янтарной кислоты и однозамещенного сукцината натрия, смесь янтарной кислоты и гидроокиси натрия, смесь янтарной кислоты и двузамещенного сукцината натрия и т.д.), тартратные буферы (смесь виннокаменной кислоты и тартрата натрия, смесь виннокаменной кислоты и тартрата калия, смесь виннокаменной кислоты и гидроокиси натрия и т.д.), фумаратные буферы (смесь фумаровой кислоты и однозамещенного фумарата натрия, смесь фумаровой кислоты и двузамещенного фумарата натрия, смесь однозамещенного фумарата натрия и двузамещенного фумарата натрия и т.д.), глюконатные буферы (смесь глюконовой кислоты и глюконата натрия, смесь глюконовой кислоты и гидроокиси натрия, смесь глюконовой кислоты и глюконата калия и т.д.), оксалатные буферы (смесь щавелевой кислоты и оксалата натрия, смесь щавелевой кислоты и гидроокиси натрия, смесь щавелевой кислоты и оксалата калия и т.д.), лактатные буферы (смесь молочной кислоты и лактата натрия, смесь молочной кислоты и гидроокиси натрия, смесь молочной кислоты и лактата калия и т.д.) и ацетатные буферы (смесь уксусной кислоты и ацетата натрия, смесь уксусной кислоты и гидроокси натрия и т.д.). Дополнительно к этому могут применяться фосфатные буферы, гистидиновые буферы и такие триметиламиновые соли, как Трис.
Консерванты могут быть добавлены для сдерживания роста микробов, и обычно их добавляют в количестве 0,2%-1% (вес/об). К числу подходящих консервантов для применения в настоящем изобретении относятся фенол, бензиловый спирт, мета-крезол, метилпарабен, пропилпарабен, хлорид октадецилдиметилбензиламмония, галогениды бензалкония (например, хлорид, бромид или иодид бензалкония), гексаметония хлорид, такие алкилпарабены, как метил- или пропилпарабен, катехол, резорцинол, циклогексанол и 3-пентанол.
Вещества, поддерживающие изотоничность, добавляются для обеспечения изотоничности жидких композиций и включают многоатомные сахароспирты, предпочтительно трехатомные и выше, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит. Многоатомные спирты могут присутствовать в количестве от 0,1% до 25% по весу, обычно от 1% до 5%, с учетом относительных количеств других ингредиентов.
Под стабилизаторами подразумевается обширная категория наполнителей с разнообразными функциями, от увеличения объема до солюбилизации лекарственного средства, либо предотвращения денатурации или прилипания к стенкам посуды. К типичным стабилизаторам относятся многоатомные сахароспирты (перечисленные выше); аминокислоты, такие как аргинин, лизин, глицин, глутамин, аспарагин, гистидин, аланин, орнитин, L-лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.д.; органические сахара или сахароспирты, такие как лактоза, трегалоза, стахиоза, маннит, сорбит, ксилит, рибит, миоинозит, галактит, глицерин и им подобные, включая циклиты типа инозита; полиэтиленгликоль; аминокислотные полимеры; мочевина; серосодержащие восстановители, такие как глутатион, липоевая кислота, тиогликолат натрия, тиоглицерин,  -монотиоглицерин и тиосульфат натрия; низкомолекулярные полипептиды (<10 остатков); белки, такие как сывороточный альбумин человека, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры типа поливинилпирролидона; моносахариды, такие как ксилоза, манноза, фруктоза и глюкоза; дисахариды, такие как лактоза, мальтоза и сахароза; трисахариды, такие как раффиноза, и такие полисахариды, как декстран. Как правило, стабилизаторы присутствуют в пределах от 0,1 до 10 000 весовых частей относительно веса активного белка. -монотиоглицерин и тиосульфат натрия; низкомолекулярные полипептиды (<10 остатков); белки, такие как сывороточный альбумин человека, бычий сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры типа поливинилпирролидона; моносахариды, такие как ксилоза, манноза, фруктоза и глюкоза; дисахариды, такие как лактоза, мальтоза и сахароза; трисахариды, такие как раффиноза, и такие полисахариды, как декстран. Как правило, стабилизаторы присутствуют в пределах от 0,1 до 10 000 весовых частей относительно веса активного белка.
Неионные поверхностно-активные вещества, или детергенты (также известны как “смачивающие вещества”), могут присутствовать для обеспечения солюбилизации лекарственного средства, а также для защиты терапевтического полипептида от агрегации, вызванной взбалтыванием, что также позволяет подвергать композицию поверхностному напряжению сдвига, не вызывая денатурации полипептида. К числу подходящих неионных детергентов относятся полисорбаты (20, 80 и т.д.), полиоксамеры (184, 188 и т.д.), полиолы Pluronic®, моноэфиры полиоксиэтиленсорбитана (Tween®-20, Tween®-80 и т.д.).
К дополнительным разнообразным добавкам относятся вещества, увеличивающие объем, или заполнители (например, крахмал), хелатирующие вещества (например, ЭДТА), антиоксиданты (например, аскорбиновая кислота, метионин, витамин Е) и вспомогательные растворители.
Активный ингредиент также может быть заключен в микрокапсулы, полученные, к примеру, методами коацервации или межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы, желатина или полиметилметакрилата, в коллоидные системы доставки лекарств (например, липосомы, микросферы из альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы изложены в Remington s Pharmaceutical Sciences, supra. s Pharmaceutical Sciences, supra.
Препараты для парентерального введения in vivo должны быть стерильными. Это легко осуществляется, к примеру, фильтрованием через стерильные фильтровальные мембраны.
В предпочтительном воплощении изобретения фармацевтическая композиция включает: i) вариант IFNG по изобретению; ii) буферное вещество, в частности соль органической кислоты, способную поддерживать pH между 5,0 и 6,5; iii) стабилизатор, в частности органический сахар или сахароспирт; iv) неионный детергент; v) стерильную воду. В частности, буферное вещество выбирают из группы, состоящей из ацетата, сукцината и цитрата, стабилизатор представлен маннитом или сорбитом, неионный детергент представлен Tween®-20 или Tween®-80. Предпочтительно фармацевтическая композиция не содержит никаких консервантов.
Препараты с замедленным высвобождением
Примеры подходящих препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие вариант полипептида, причем эти матрицы находятся в удобном виде типа пленки или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт), полилактиды, сополимеры L-глутаминовой кислоты и этил-L-глутамата, недеградируемый этилен-винилацетат, деградируемые сополимеры молочной кислоты и гликолевой кислоты, такие как технология ProLease или Lupron Depot® (микросферы для инъекций, состоящие из сополимера молочной и гликолевой кислоты и лейпролида ацетата), и поли-D-(-)-3-гидроксимасляная кислота. В то время как полимеры типа этилен-винилацетата и сополимеров молочной и гликолевой кислоты обеспечивают высвобождение молекул в течение длительного времени, вплоть до 100 дней и больше, некоторые гидрогели высвобождают белки в течение более короткого времени. Когда инкапсулированные полипептиды находятся в организме долгое время, они могут денатурировать или агрегировать под влиянием влажности при 37°С, что ведет к потере биологической активности и возможным изменениям в иммуногенности. Можно разработать рациональные способы стабилизации в зависимости от действующих механизмов. Так, если окажется, что механизм агрегации состоит в образовании межмолекулярных S-S-связей через тиол-дисульфидный обмен, стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контролирования степени влажности с помощью соответствующих добавок и разработки специфических составов полимерного матрикса.
Пероральное применение
Фармацевтическая композиция для перорального применения может находиться в твердом или жидком виде, например в виде капсул, таблеток, суспензий, эмульсий или растворов. Фармацевтическая композиция предпочтительно готовится в виде дозированной единицы, содержащей заданное количество активного ингредиента. Подходящая ежедневная доза для человека или другого млекопитающего может колебаться в широких пределах, в зависимости от состояния пациента и других факторов, но специалист в этой области может ее определить рутинными методами.
К твердым дозированным формам для перорального применения можно отнести капсулы, таблетки, свечи, порошки и гранулы. В таких твердых дозированных формах активное соединение может находиться в смеси с по меньшей мере одним инертным разбавителем типа сахарозы, лактозы или крахмала. Такие дозированные формы могут содержать, как это обычно бывает, и другие вещества, к примеру, смазывающие вещества типа стеарата магния. В случае капсул, таблеток и пилюль дозированные формы могут включать и буферные вещества. Кроме того, таблетки и пилюли могут быть изготовлены с энтеросолюбильным покрытием.
Варианты полипептида могут быть смешаны со вспомогательными веществами, такими как лактоза, сахароза, крахмал, эфиры целлюлозы и алкановых кислот, стеариновая кислота, тальк, стеарат магния, окись магния, натриевые и кальциевые соли фосфорной и серной кислот, гуммиарабик, желатин, альгинат натрия, поливинилпирролидон и/или поливиниловый спирт, а затем подвергнуты таблетированию или капсулированию для обычного применения. Альтернативно, они могут быть растворены в физрастворе, воде, полиэтиленгликоле, пропиленгликоле, этаноле, масле (к примеру, кукурузном, арахисовом, хлопковом или кунжутном масле), трагакантовой камеди и/или различных буферах. Другие вспомогательные вещества и способы их применения хорошо известны в области фармацевтики. Наполнитель или разбавитель может включать замедлитель, например, глицерилмоностеарат или глицерилдистеарат, один или вместе с воском, а также другие материалы, хорошо известные в этой области.
Фармацевтические композиции могут подвергаться стандартной фармацевтической обработке типа стерилизации и/или содержать обычные вспомогательные вещества, такие как консерванты, стабилизаторы, смачивающие вещества, эмульгаторы, буферы, заполнители и т.д., как описано в других частях настоящего изобретения.
К жидким дозированным формам для перорального применения можно отнести фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обычно применяемые в этой области, например воду. Такие композиции могут содержать и вспомогательные вещества – смачивающие вещества, подсластители, ароматизаторы и отдушки.
Местное применение
К лекарственным формам, пригодным для местного применения, относятся жидкие или полужидкие препараты, пригодные для проникновения через кожу (жидкие мази, лосьоны, притирания, кремы, пасты), и капли, пригодные для введения в глаза, уши или нос.
Легочное введение
Композиции, пригодные для применения с распылителем, струйным или ультразвуковым, как правило включают вариант полипептида, растворенный в воде, к примеру, в концентрации от около 0,01 до около 25 мг варианта на 1 мл раствора, предпочтительно от около 0,1 до около 10 мг/мл. Композиция может также включать буфер и простой сахар (для стабилизации белка и регуляции осмотического давления), и/или сывороточный альбумин человека в концентрации от 0,1 до 10 мг/мл. Примеры буферов, которые можно использовать, – ацетат натрия, цитрат и глицин. Предпочтительно буфер имеет состав и молярность, позволяющие доводить рН в пределах от 3 до 9. Обычно для этой цели подходит молярность буфера от 1 мМ до 50 мМ. Примеры сахаров, которые можно использовать, – лактоза, мальтоза, маннит, сорбит, трегалоза и ксилоза, обычно в количестве от 1% до 10% от веса композиции.
Композиция для распылителя также может содержать детергент для снижения или предотвращения поверхностной агрегации белка, вызванной пульверизацией раствора при образовании аэрозоля. Можно использовать различные традиционные детергенты, такие как полиоксиэтиленовые эфиры жирных кислот и спиртов и эфиры полиоксиэтиленсорбитана и жирных кислот. Количества обычно колеблются от 0,001% до 4% от веса композиции. Особенно предпочтительный детергент для настоящего изобретения – полиоксиэтиленсорбитанмоноолеат.
Конкретные композиции и способы получения подходящих дисперсий жидких частиц настоящего изобретения описаны в WO 94/20069, US 5915378, US 5960792, US 5957124, US 5934272, US 5915378, US 5855564, US 5826570 и US 5522385, которые включены в настоящее изобретение путем отсылки.
Композиции для применения с дозирующим ингалятором обычно включают тонко измельченный порошок. Такой порошок может быть получен путем лиофилизации и последующего измельчения жидкой композиции и может также содержать стабилизатор типа сывороточного альбумина человека (HSA). Как правило, добавляют более 0,5% (вес/вес) HSA. Кроме того, при необходимости в препарат можно добавить один или несколько Сахаров или сахароспиртов. Примеры включают лактозу, мальтозу, маннит, сорбит, сорбитозу, трегалозу, ксилит и ксилозу. Добавляемое в препарат количество может колебаться от 0,01 до 200% (вес/вес), предпочтительно от 1 до 50% от содержания варианта. Затем такие композиции лиофилизируют и измельчают до нужного размера частиц.
Частицы нужного размера затем суспендируют в пропелленте с помощью детергента. Пропеллентом может быть любой стандартный материал, применяемый для этой цели, как-то: хлорфторуглерод, гидрохлорфторуглерод, гидрофторуглерод или углеводород, включая трихлорфторметан, дихлордифторметан, дихлортетрафторэтанол и 1,1,1,2-тетрафторэтан, или их комбинации. Подходящие детергенты включают сорбитантриолеат и соевый лецитин. Олеиновая кислота также может быть полезной в качестве детергента. Затем эту смесь заправляют в ингалятор. Пример коммерчески доступного дозирующего ингалятора, пригодного для настоящего изобретения, – это дозирующий ингалятор Ventolin фирмы Glaxo Inc., Research Triangle Park, N.C.
Композиции для порошковых ингаляторов включают тонко измельченный сухой порошок, содержащий вариант, а также могут включать увеличивающее объем вещество, такое как лактоза, сорбит, сахароза или маннит, в таком количестве, которое способствует распылению порошка из устройства, например, от 50% до 90% от веса композиции. Частицы порошка должны обладать такими аэродинамическими свойствами в легких, которые соответствуют частицам, имеющим плотность около 1 г/см2 и средний диаметр менее 10 мкм, предпочтительно от 0,5 до 5 мкм, наиболее предпочтительно от 1,5 до 3,5 мкм. Пример порошкового ингалятора, пригодного для применения в соответствии с настоящим изобретением, – порошковый ингалятор Spinhaler фирмы Fisons Corp., Bedford, Mass.
Порошки для этих устройств можно получить и/или вводить способами, раскрытыми в US 5997848, US 5993783, US 5985248, US 5976574, US 5922354, US 5785049 и US 5654007.
К механическим устройствам, предназначенным для легочного введения лекарственных препаратов, относятся, не ограничиваясь ими, распылители, дозирующие ингаляторы и порошковые ингаляторы, причем все они известны специалистам в этой области. Конкретные примеры коммерчески доступных устройств, пригодных для осуществления настоящего изобретения, – это распылитель Ultravent фирмы Mallinckrodt Inc., St. Louis, Missouri; распылитель Acorn II фирмы Marquest Medical Products, Englewood, Colorado; дозирующий ингалятор Ventolin фирмы Glaxo Inc., Research Triangle Park, North Carolina; порошковый ингалятор Spinhaler фирмы Fisons Corp., Bedford, Massachusetts; устройство типа “стоячее облако” фирмы Inhale Therapeutic Systems Inc., San Carlos, California; ингалятор AIR фирмы Alkermes, Cambridge, Massachusetts; и система для легочного введения лекарств AERx фирмы Aradigm Corporation, Hayward, California.
Далее изобретение раскрывается на следующих примерах. Эти примеры ни в коем случае не следует воспринимать как ограничивающие универсальность настоящего описания и формулы изобретения.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Клетки СНО-К1 (доступны American Type Culture Collection (ATCC#CCL-61)).
Клетки HeLa (доступны American Type Culture Collection (ATCC#CCL-2)).
ISRE-Luc от фирмы Stratagene, La Jolla, USA.
pCDNA 3.1/hygro от фирмы InVitrogen, Carlsbad, USA.
Рестрикционные ферменты и полимеразы получены от фирмы New England Biolabs Inc., Beverly, USA.
Среда DMEM: модифицированная Дюльбекко среда Игла (DMEM), 10% эмбриональная телячья сыворотка и гигромицин В были получены от фирмы Life Technologies A/S, Копенгаген, Дания.
Субстрат LucLite был получен от фирмы Packard Bioscience, Гронинген, Нидерланды.
Люминометр TopCount получен от фирмы Packard Bioscience, Гронинген, Нидерланды.
Биотинилированное поликлональное антитело BAF285 против IFNG человека было получено от фирмы R&D Systems Inc., Minneapolis, USA.
Конъюгированный с пероксидазой хрена стрептавидин РОЗ 97 получен от фирмы DAKO, Копенгаген, Дания.
Реагент ТМВ для блоттинга получен от фирмы KEM-EN-TEC, Копенгаген, Дания.
Методы
Принцип определения интерферона
Ранее сообщалось, что IFNG реагирует с рецепторами IFNG на поверхности клеток HeLa и активирует их. Вследствие этого активируется транскрипция на промоторах, содержащих стимулируемый интерфероном респонсивный элемент (ISRE). Поэтому для скрининга на агонисты рецептора интерферона можно использовать конъюгированный с ISRE репортерный ген люциферазы (ISRE-luc), помещенный в клетки HeLa.
Первичный анализ
Клетки HeLa трансфицировали ISRE-Luc совместно с pCDNA 3.1/hygro и получали очаги (клеточные клоны) при селекции в среде DMEM, содержащей гигромицин В. Клеточные клоны подвергали скринингу на люциферазную активность в присутствии и в отсутствие IFNG. Клоны, проявляющие самое высокое отношение стимулированной к нестимулированной люциферазной активности, использовали для дальнейшего анализа.
Для скрининга вариантов полипептида в 96-луночные планшеты засевали по 15000 клеток/лунку и инкубировали в течение ночи в среде DMEM. На следующий день к клеткам добавляли варианты полипептида в различных концентрациях, а также известный стандарт. В качестве “известного стандарта” использовали Actimmune®; ампулу Actimmune® разбавляли до 300 Ед/мл в DMEM с 5% FBS и хранили при -80°С до употребления.
Планшеты инкубировали 6 часов при 37°С в атмосфере 5% CO2. После этого в каждую лунку добавляли субстрат LucLite (Packard Bioscience, Groningen, Нидерланды). Планшеты плотно закрывали и измеряли люминесценцию в люминометре TopCount (Packard) в режиме SPC (счета единичных фотонов).
В каждом планшете имеются лунки, инкубируемые в присутствии IFNG в качестве стимулированного контроля, и другие лунки, содержащие нормальную среду в качестве нестимулированного контроля. Соотношение между стимулированной и нестимулированной люциферазной активностью служит внутренним стандартом как на активность IFNG, так и на вариации от эксперимента к эксперименту. Для каждого образца IFNG рассчитывали количество единиц относительно стандарта Actimmune® и выражали в единицах активности (AU).
Определение повышенной степени гликозилирования
Для определения различных степеней гликозилирования мономеров варианта IFNG разгоняли гель SDS-PAGE в стандартных условиях и переносили на нитроцеллюлозную мембрану. Проводили Вестерн-блоттинг согласно стандартной методике, используя биотинилированное поликлональное антитело против IFNG человека (BAF285 фирмы R&D Systems) в качестве первичного антитела и конъюгированный с пероксидазой хрена стрептавидин (Р0397 фирмы DAKO) в качестве вторичного антитела, а затем окрашивали с помощью реагента ТМВ для блоттинга (KEM-EN-TEC, Копенгаген, Дания). Распределение мономеров варианта IFNG с различной степенью гликозилирования оценивали путем визуального осмотра окрашенной мембраны.
Определение AUCsc
AUCsc у крыс определяли путем однократного (200 мкл) подкожного болюсного введения равного количества (по активности) варианта полипептида IFNG по изобретению.
Для этих экспериментов использовали самок крыс Sprag-Dawley весом 220-260 г. Полипептид IFNG вводили в рецептуру с сукцинатом натрия (720 мг/л), маннитом (40 г/л) и полисорбатом-20 (100 мг/л) при pH 6,0.
Перед подкожным введением отбирали пробу крови из хвостовой вены, чтобы убедиться, что не обнаруживается фоновой активности IFNG. После введения отбирали пробы крови из хвостовой вены через 10 мин, 20 мин, 40 мин, 60 мин, 120 мин, 240 мин, 480 мин, 720 мин, 1440 мин, 1620 мин, 1920 мин и 2880 мин (иногда и через 3600 мин). Получали сыворотку, оставляя пробы крови на 20 мин при комнатной температуре для свертывания, после чего центрифугировали 20 мин при 5000xg при комнатной температуре. Затем выделяли сыворотку и хранили при -80°С до определения активности IFNG, используя “Первичный анализ”, описанный выше. Следует отметить, что при определении количества единиц в образцах сыворотки из опытов по фармакокинетике у крыс стандарт Actimmune® разбавляли в DMEM с 5% FBS и 5% сыворотки крыс.
Затем количество единиц в сыворотке (AU/мл) наносили на график зависимости от времени и рассчитывали AUCsc с помощью GraphPad Prism 3.01.
Аналогичные эксперименты проводили с применением huIFNG в гликозилированной форме и/или Actimmune® для того, чтобы оценить повышение AUCsc у варианта полипептида IFNG по изобретению по сравнению с гликозилированной формой huIFNG и/или Actimmune®.
Время полужизни в сыворотке
Время полужизни в сыворотке у крыс определяли путем однократного болюсного внутривенного введения (200 мкл) равного количества (по активности) варианта полипептида IFNG по изобретению.
Для этих экспериментов использовали самок крыс Sprag-Dawley весом 220-260 г. Полипептид IFNG вводили в рецептуру с сукцинатом натрия (720 мг/л), маннитом (40 г/л) и полисорбатом-20 (100 мг/л) при pH 6,0.
Перед внутривенным введением отбирали пробу крови из хвостовой вены, чтобы убедиться, что не обнаруживается фоновой активности IFNG. После введения в хвостовую вену отбирали пробы крови из другой хвостовой вены через 5 мин, 10 мин, 20 мин, 40 мин, 60 мин, 120 мин, 240 мин, 480 мин, 720 мин, 1440 мин, 1620 мин, 1920 мин и 2880 мин. Получали сыворотку, оставляя пробы крови на 20 мин при комнатной температуре для свертывания, после чего центрифугировали 20 мин при 5000×g при комнатной температуре. Затем выделяли сыворотку и хранили при -80°С до определения активности IFNG, используя “Первичный анализ”, описанный выше. Следует отметить, что при определении количества единиц в образцах сыворотки из опытов по фармакокинетике у крыс стандарт Actimmune® разбавляли в DMEM с 5% FBS и 5% сыворотки крыс.
Затем количество единиц в сыворотке (AU/мл) наносили на график зависимости от времени и рассчитывали время полужизни в сыворотке с помощью WinNonLin Pro 3.3.
Аналогичные эксперименты проводили с применением huIFNG в гликозилированной форме и/или Actimmune® для того, чтобы оценить повышение времени полужизни в сыворотке у варианта полипептида IFNG по изобретению по сравнению с гликозилированной формой huIFNG и/или Actimmune®.
Идентификация экспонированных на поверхности аминокислотных остатков
Структуры
Известны экспериментальные трехмерные структуры hulFNG, определенные методом рентгеноструктурного анализа. Ealick et al. Science 252: 698-702 (1991) представили контур расположения С-альфа атомов гомодимера IFNG. Walter et al. Nature 376: 230-235 (1995) представили структуру гомодимера IFNG в комплексе с двумя молекулами растворимой формы рецептора IFNG. Однако координаты этой структуры никогда не были обнародованы. Thiel et al. Structure 8: 927-936 (2000) представили структуру гомодимера IFNG в комплексе с двумя молекулами растворимой формы рецептора IFNG, при этом третья молекула рецептора в структуре не взаимодействовала с гомодимером IFNG.
Площадь доступной поверхности (ПДП)
Для расчета площади доступной поверхности (ПДП) индивидуальных атомов в структуре применяли компьютерную программу Access (В.Lee and F.M.Richards, J. Mol. Biol. 55: 379-400 (1971), версия 2 (© 1983 Yale University). В этом методе обычно применяется зонд размером в 1,4 Å, а площадь доступной поверхности (ПДП) определяется как площадь, образуемая центром зонда. Перед выполнением этих вычислений из набора координат исключали все молекулы воды, атомы водорода и другие атомы, не связанные непосредственно с белком.
Значения относительной ПДП боковых цепей
Значения относительной ПДП атомов боковой цепи вычисляли путем деления суммы ПДП атомов боковой цепи на величину, представляющую ПДП атомов боковой цепи остатка этого типа в развернутом трипептиде Ala-x-Ala (см. Hubbard, Campbell & Thomton (1991) J.Mol. Biol. 220, 507-530). В этом примере атом СА рассматривается как часть боковой цепи остатков глицина, но не остальных остатков. В качестве стандартных значений 100% ПДП для боковой цепи использовали следующие значения:
| Ala |
69,23 Å2 |
Leu |
140,76 Å2 |
| Arg |
200,35 Å2 |
Lys |
162,50 Å2 |
| Asn |
106,25 Å2 |
Met |
156,08 Å2 |
| Asp |
102,06 Å2 |
Phe |
163,90 Å2 |
| Cys |
96,69 Å2 |
Pro |
119,65 Å2 |
| Gln |
140,58 Å2 |
Ser |
78,16 Å2 |
| Glu |
134,61 Å2 |
Thr |
101,67 Å2 |
| Gly |
32,28 Å2 |
Trp |
210,89 Å2 |
| His |
147,00 Å2 |
Tyr |
176,61 Å2 |
| Ile |
137,91 Å2 |
Val |
114,14 Å2 |
Остатки, не вошедшие в структуру, принимали за экспонированные на 100%, так как считается, что они находятся в гибких участках.
Определение расстояний между атомами
Расстояния меду атомами определяли с помощью компьютерной программы молекулярной графики InsightII v.98.0 фирмы MSI Inc.
Определение сайта связывания с рецептором
Сайт связывания с рецептором определяется как включающий все остатки, у которых площадь доступной поверхности изменяется при связывании с рецептором. Это устанавливали по данным как минимум двух вычислений ПДП: одного для изолированного(ых) лиганда(ов) в комплексе лиганд(ы)/рецептор(ы) и другого для полного комплекса лиганд(ы)/рецептор(ы).
ПРИМЕРЫ
Пример 1. Определение экспонированных на поверхности аминокислотных остатков
Использовали рентгенографическую структуру гомодимера IFNG в комплексе с двумя молекулами растворимой формы рецептора IFNG, при этом третья молекула рецептора IFNG в структуре не взаимодействовала с гомодимером IFNG, описанную Thiel et al. Structure 8: 927-936 (2000). Структура состоит из гомодимера IFNG, две молекулы которого обозначены А и B. В целях конструирования сюда вставлен дополнительный метионин перед последовательностью IFNG, обозначенный как МО, и последовательность укорочена с С-конца на 10 остатков (последним остатком в сконструированной молекуле является Q133). МО исключали из структуры при всех вычислениях данного примера. Структура двух мономеров IFNG имеет очень слабую электронную плотность после остатка 120, и моделирование остатков доводили только до остатка Т126. Поэтому остатки S121-Т126 исключали из структуры перед проведением вычислений данного примера. Фрагменты двух рецепторов, обозначенные как С и D, непосредственно взаимодействуют с гомодимером IFNG, а третья молекула рецептора, обозначаемая как Е, не имеет контакта с гомодимером IFNG и не включена в эти вычисления.
Экспонирование на поверхности
Проведение расчетов значений относительных ПДП в гомодимере из молекул А и В, исключая МО и S121-T126 в обеих молекулах, показало, что у следующих остатков более 25% боковой цепи экспонировано на поверхности по крайней мере у одного из мономеров: Q1, D2, Р3, К6, Е9, N10, К12, К13, Y14, N16, G18, Н19, S20, D21, А23, D24, N25, G26, Т27, G31, К34, N35, К37, Е38, Е39, S40, К55, К58, N59, К61, D62, D63, Q64, S65, Q67, Кб8, Е71, Т72, К74, Е75, N78, V79, К80, N83, S84, N85, К86, К87, D90, Е93, К94, N97, S99, Т101, D102, L103, N104, H111, Q115, A118 и Е119.
У следующих остатков более 50% боковой цепи экспонировано на поверхности по крайней мере у одного из мономеров: Q1, D2, P3, K6, Е9, N10, К13, N16, G18, Н19, S20, D21, А23, D24, N25, G26, Т27, G31, К34, К37, Е38, Е39, К55, К58, N59, D62, Q64, S65, К68, Е71, Е75, N83, S84, К86, К87, К94, N97, S99, Т101, D102, L103, N104, Q115, А118, Е119.
Проведение расчетов значений относительных ПДП в гомодимере из молекул А и В, исключая МО и S121-Т126 в обеих молекулах, но в присутствии молекул рецептора С и D показало, что у следующих остатков более 25% боковой цепи экспонировано на поверхности по крайней мере у одного из мономеров: Q1, D2, Р3, К6, Е9, N10, К13, Y14, N16, G18, Н19, D21, N25, G26, G31, К34, N35, К37, Е38, Е39, S40, К55, К58, N59, К61, D62, D63, Q64, S65, Q67, К68, Е71, Т72, К74, Е75, N78, V79, К80, N83, S84, N85, К86, К87, D90, Е93, К94, N97, S99, Т101, D102, L103, N104, Е119.
У следующих остатков более 50% боковой цепи экспонировано на поверхности по крайней мере у одного из мономеров: Р3, К6, N10, К13, N16, D21, N25, G26, G31, К34, К37, Е38, Е39, К55, К58, N59, D62, Q64, S65, К68, Е71, Е75, N83, S84, К86, К87, К94, N97, S99, Т101, D102, L103 и N104.
Все указанные выше положения являются мишенями для модификации в соответствии с настоящим изобретением.
Сравнивая оба списка, получаем, что при связывании с рецептором из списка ПДП с более 25% боковой цепи исключаются К12, S20, А23, D24, Т27, H111, Q115 и А118, а из списка ПДП с более 50% боковой цепи при связывании с рецептором исключаются Q1, D2, Е9, G18, Н19, S20, А23, D24, Т27, Q115, А118 и E119.
Остатки, не включенные при определении структуры, рассматриваются как полностью экспонированные на поверхности; это остатки S121, Р122, А123, А124, К125, Т126, G127, К128, R129, К130, R131, S132, Q133, М134, L135, F136, R137, G138, R139, R140, А141, S142, Q143. Эти остатки также представляют отдельные мишени для введения связующих групп в соответствии с настоящим изобретением (их можно рассматривать как принадлежащие к группе экспонированных на поверхности аминокислотных остатков, то есть у которых более 25% или более 50% боковой цепи экспонировано на поверхности).
Пример 2. Определение сайта связывания с рецептором
Проведение расчетов ПДП, как описано выше, показало, что у следующих остатков молекулы IFNG значение ПДП уменьшается по крайней мере в одном из мономеров при образовании комплекса по сравнению с расчетными значениями для изолированного димера: Q1, D2, Y4, V5, Е9, К12, G18, Н19, S20, D21, V22, А23, D24, N25, G26, Т27, L30, K34, K37, K108, H111, E112, I114, Q115, A118, E119.
Пример 3. Конструирование кассеты для экспрессии IFNG с оптимизированным употреблением кодонов
Последовательность ДНК (номер доступа X13274 в GenBank), охватывающей полноразмерную кДНК, кодирующую зрелый huIFNG с его природным сигнальным пептидом, модифицировали так, чтобы облегчить экспрессию на высоком уровне в клетках СНО. Кодоны нуклеотидной последовательности huIFNG модифицировали, создавая предпочтение в употреблении кодонов в сторону тех, что употребляются более часто у Homo sapiens. После этого определенные нуклеотиды в последовательности были заменены другими с тем, чтобы ввести сайты узнавания для эндонуклеаз рестрикции ДНК. Праймеры конструировали таким образом, чтобы можно было синтезировать ген.
Праймеры были собраны в синтетический ген методом ПЦР в одну стадию с помощью набора с Platinum Pfx-polymerase (Life Technologies) при стандартных параметрах трех циклов. Собранный ген амплифицировали методом ПЦР в тех же условиях и его последовательность представлена в SEQ ID No:42. Синтезированный ген клонировали в pcDNA3.1/hygro (InVitrogen) между сайтами BamHI и Xbal, получая pIGY-22.
pIGY-22 трансфицировали в клетки СНО К1 с помощью Lipofectamine 2000 (Life Technologies) в качестве трансфекционного агента. Через 24 часа культуральную среду собирали и анализировали на активность и концентрацию IFNG методом ELISA. При использовании “Первичного анализа”, описанного выше, активность составила 1,4×107 AU/мл.
Пример 4. Сайт-специфический мутагенез
Создание вариантов по гликозилированию
Для введения мутаций в IFNG конструировали олигонуклеотиды таким образом, чтобы можно было ввести ПЦР-индуцированные изменения в экспрессионную плазмиду (pIGY-22) классическим методом ПЦР в две стадии.
Использовали два праймера к вектору вместе со специфическими мутационными праймерами:
ADJ013: 5 -GATGGCTGGCAACTAGAAG-3 -GATGGCTGGCAACTAGAAG-3 (антисмысловой нижний праймер к вектору) (SEQ ID No:43) и ADJ014: 5 (антисмысловой нижний праймер к вектору) (SEQ ID No:43) и ADJ014: 5 -TGTACGGTGGGAGGTCTAT-3 -TGTACGGTGGGAGGTCTAT-3 (смысловой верхний праймер к вектору) (SEQ ID No:44). (смысловой верхний праймер к вектору) (SEQ ID No:44).
Вариант S99T создавали классическим методом ПЦР в две стадии, используя ADJ013 и ADJ014 в качестве праймеров к вектору, ADJ093 (5 -GTTCAGGTCTGTCACGGTGTAATTGGTCAGCTT-3 -GTTCAGGTCTGTCACGGTGTAATTGGTCAGCTT-3 ) (SEQ ID No:45) и ADJ094 (5 ) (SEQ ID No:45) и ADJ094 (5 -AAGCTGACCAATTACACCGTGACAGACCTGAAC-3 -AAGCTGACCAATTACACCGTGACAGACCTGAAC-3 ) (SEQ ID No:46) в качестве мутационных праймеров и pIGY-22 в качестве матрицы. Продукт ПЦР длиной 447 п.о. субклонировали в pcDNA3.1/hygro (In Vitrogen) с помощью BamHI и Xbal, получая плазмиду pIGY-48. ) (SEQ ID No:46) в качестве мутационных праймеров и pIGY-22 в качестве матрицы. Продукт ПЦР длиной 447 п.о. субклонировали в pcDNA3.1/hygro (In Vitrogen) с помощью BamHI и Xbal, получая плазмиду pIGY-48.
pIGY-48 трансфицировали в клетки СНО К1 с помощью Lipofectamine 2000 (Life Technologies) в качестве трансфекционного агента. Через 24 часа культуральную среду собирали и анализировали на активность IFNG. При использовании “Первичного анализа”, описанного выше, активность составила 5,1×106 AU/мл.
Вариант E38N+S40T+S99T создавали классическим методом ПЦР в две стадии, используя ADJ013 и ADJ014 в качестве праймеров к вектору, ADJ091 (5 -CATGATCTTCCGATCGGTCTCGTTCTTCCAATT-3 -CATGATCTTCCGATCGGTCTCGTTCTTCCAATT-3 ) (SEQ ID No:47) и ADJ092 (5′-AATTGGAAGAACGAGACCGATCGGAAGATCATG-3′) (SEQ ID No:48) в качестве мутационных праймеров и pIGY-48 в качестве матрицы. Продукт ПЦР в 447 bp субклонировали в pcDNA3.1/hygro (In Vitrogen) с помощью BamHI и XbaI, получая плазмиду pIGY-54. ) (SEQ ID No:47) и ADJ092 (5′-AATTGGAAGAACGAGACCGATCGGAAGATCATG-3′) (SEQ ID No:48) в качестве мутационных праймеров и pIGY-48 в качестве матрицы. Продукт ПЦР в 447 bp субклонировали в pcDNA3.1/hygro (In Vitrogen) с помощью BamHI и XbaI, получая плазмиду pIGY-54.
pIGY-54 трансфицировали в клетки СНО К1 с помощью Lipofectamine 2000 (Life Technologies) в качестве трансфекционного агента. Через 24 часа культуральную среду собирали и анализировали на активность IFNG. При использовании “Первичного анализа”, описанного выше, активность составила 1,3×107 AU/мл.
Используя стандартные методы, аналогичные описанным выше, были получены несколько полноразмерных вариантов по гликозилированию. Эти варианты обобщены ниже в табл.1.
Создание укороченных с С-конца вариантов IFNG
Укороченные с С-конца варианты IFNG, содержащие стоп-кодон сразу после кодона для Leu135, получали методом ПЦР в одну стадию, используя pIGY-22, pIGY-48 и pIGY-54 в качестве матриц, после чего продукты ПЦР субклонировали в pcDNA3.1/hygro (In Vitrogen) с помощью BamHI и XbaI. При конструировании этих вариантов использовали праймеры: ADJ014 (см. выше, верхний) и 5 -GAGTCTAGATTACAGCATCTGGCTTCTCTT-3 -GAGTCTAGATTACAGCATCTGGCTTCTCTT-3 ) (SEQ ID No:49) (нижний). Полученные плазмиды были обозначены как pIGY-72 (IFNG дикого типа, укороченный после Leu135), pIGY-73 (вариант S99T, укороченный после Leu135) и pIGY-74 (E38N+S40T+S99T, укороченный после Leu135). ) (SEQ ID No:49) (нижний). Полученные плазмиды были обозначены как pIGY-72 (IFNG дикого типа, укороченный после Leu135), pIGY-73 (вариант S99T, укороченный после Leu135) и pIGY-74 (E38N+S40T+S99T, укороченный после Leu135).
Создание содержащих цистеин вариантов IFNG
Варианты IFNG, содержащие остатки цистеина, создавали с помощью набора для сайт-специфического мутагенеза QuickChange XL фирмы Stratagene согласно инструкциям изготовителя. Было создано 7 вариантов IFNG, содержащих по одному введенному остатку цистеина, используя pIGY-48 в качестве матрицы: N10C+S99T, N16C+S99T, E38C+S99T, N59C+S99T, N83C+S99T, K94C+S99T и S99T+N104C. Аналогичным образом было создано 6 вариантов IFNG, содержащих по одному введенному остатку цистеина, используя pIGY-54 в качестве матрицы: N10C+E38N+S40T+S99T, N16C+E38N+S40T+S99T, E38N+S40T+N59C+S99T, E38N+S40T+N83C+S99T, E38N+S40T+K94C+S99T, E38N+S40T+S99T+N104C. XL фирмы Stratagene согласно инструкциям изготовителя. Было создано 7 вариантов IFNG, содержащих по одному введенному остатку цистеина, используя pIGY-48 в качестве матрицы: N10C+S99T, N16C+S99T, E38C+S99T, N59C+S99T, N83C+S99T, K94C+S99T и S99T+N104C. Аналогичным образом было создано 6 вариантов IFNG, содержащих по одному введенному остатку цистеина, используя pIGY-54 в качестве матрицы: N10C+E38N+S40T+S99T, N16C+E38N+S40T+S99T, E38N+S40T+N59C+S99T, E38N+S40T+N83C+S99T, E38N+S40T+K94C+S99T, E38N+S40T+S99T+N104C.
Пример 5. Получение PEG-производных содержащих цистеин вариантов
Все буферы освобождали от кислорода перед употреблением. Концентрацию белка определяли, измеряя А280.
Получение PEG-производных методом конъюгации через OPSS
7,2 мл варианта IFNG N16C+S99T (полноразмерного, 1,3 мг/мл) в 5 мМ сукцинате натрия, 4% манните, 0,01% Tween 20, рН 6,0, восстанавливали инкубацией с 300 мкл 0,5 М DTT в течение 30 мин при комнатной температуре. Вариант IFNG обессоливали, пропуская 3 порции по 2,5 мл через колонку для гель-фильтрации NAP25 (Pharmacia) в буфере А (50 мМ фосфат натрия, 1 мМ ЭДТА, pH 8,1). Каждая порция элюировалась в объеме 3,5 мл.
mPEG-OPSS (10 кДа) растворяли в буфере А до концентрации 2 мг/мл, добавляли в равном объеме к восстановленному и обессоленному варианту IFNG и инкубировали в течение 60 мин с легким встряхиванием при комнатной температуре.
11 мл реакционной смеси концентрировали до 1-6 мл с помощью колонки Vivaspin 20 (VivaScience) и удаляли оставшийся mPEG гель-фильтрацией на колонке Sephacryl S-100 (Pharmacia), уравновешенной буфером А
Модифицированный PEG вариант IFNG подвергали диафильтрации в 5 мМ сукцинате натрия, 4% манните, pH 6,0, с помощью колонки Vivaspin 6 (VivaScience) и добавляли Tween 20 до 0,01%. Очищенный модифицированный PEG вариант IFNG имел удельную активность в 1,3×106 AU/мг при измерении методом “Первичного анализа”, описанным выше (15% от удельной активности соответствующего не модифицированного PEG варианта IFNG).
Получение PEG-производных методом конъюгации через MAL
1,6 мл варианта IFNG N59C+S99T (полноразмерного, 1,5 мг/мл) в 5 мМ сукцинате натрия, 4% манните, 0,01% Tween 20, рН 6,0, восстанавливали инкубацией с 64 мкл 0,5 М DTT в течение 30 мин при комнатной температуре. Вариант IFNG обессоливали пропусканием через колонку для гель-фильтрации NAP25 (Pharmacia) в буфере А (50 мМ фосфат натрия, 1 мМ ЭДТА, pH 8,1). Вариант IFNG элюировался в объеме 3,5 мл.
mPEG-MAL (5 кДа) растворяли в буфере А до концентрации 0,5 мг/мл, добавляли в равном объеме к восстановленному и обессоленному варианту IFNG и инкубировали в течение 120 мин с легким встряхиванием при комнатной температуре.
Добавляли сульфат аммония до концентрации 0,9 М и модифицированный PEG вариант IFNG наносили на колонку Resource -phenyl (Pharmacia) объемом 1 мл, уравновешенную буфером В (20 мМ фосфат натрия, 0,9 М сульфат аммония, pH 6,6). Колонку промывали 5 объемами буфера В перед элюированием связавшегося модифицированного PEG варианта IFNG 30 колоночными объемами линейного градиента 0-50% буфера С (20 мМ фосфат натрия, pH 6,6). Модифицированный PEG вариант IFNG элюировался в районе 0,6 М сульфата аммония. -phenyl (Pharmacia) объемом 1 мл, уравновешенную буфером В (20 мМ фосфат натрия, 0,9 М сульфат аммония, pH 6,6). Колонку промывали 5 объемами буфера В перед элюированием связавшегося модифицированного PEG варианта IFNG 30 колоночными объемами линейного градиента 0-50% буфера С (20 мМ фосфат натрия, pH 6,6). Модифицированный PEG вариант IFNG элюировался в районе 0,6 М сульфата аммония.
Фракции, содержащие модифицированный PEG вариант IFNG, объединяли и подвергали диафильтрации в 5 мМ сукцинате натрия, 4% манните, pH 6,0, с помощью колонки Vivaspin 6 (VivaScience) и добавляли Tween 20 до 0,01%. Очищенный модифицированный PEG вариант IFNG имел удельную активность в 2,4×106 AU/мг при измерении методом “Первичного анализа”, описанным выше (15% от удельной активности соответствующего не модифицированного PEG варианта IFNG).
Пример 6. Экспрессия IFNG и вариантов IFNG в клетках млекопитающих
Для временной экспрессии IFNG клетки культивировали до 95% конфлюэнтности в среде DMEM, содержащей питательную смесь F-12 (Ham), L-глутамин, 15 мМ Hepes и пиридоксин-HCl (Life Technologies, кат. №31330-038), с добавлением 1:10 эмбриональной телячьей сыворотки (BioWhittaker, кат. №02-70 IF) и 1:100 смеси пенициллина и стрептомицина (BioWhittaker, кат. №17-602Е). Кодирующие IFNG плазмиды трансфицировали в клетки с помощью Lipofectamine 2000 (Life Technologies) согласно инструкциям изготовителя. Через 24 часа после трансфекции культуральную среду собирали и анализировали на активность IFNG. Кроме того, для определения относительного числа используемых сайтов гликозилирования проводили Вестерн-блоттинг, используя собранную культуральную среду.
Стабильные клоны, экспрессирующие IFNG, были получены при трансфекции клеток СНО К1 плазмидами, кодирующими IFNG, с последующей инкубацией клеток в среде, содержащей гигромицин (0,36 мг/мл). Выделяли и субклонировали стабильно трансфицированные клетки методом предельного разведения. Клоны, продуцирующие высокий уровень IFNG, идентифицировали методом ELISA.
Пример 7. Крупномасштабная продукция
Стабильные линии клеток, экспрессирующие IFNG или его варианты, культивировали до конфлюэнтности в среде DMEM, содержащей питательную смесь F-12 (Ham), L-глутамин, 15 мМ Hepes и пиридоксин-HCl (Life Technologies, кат. №31330-038), с добавлением 1:10 эмбриональной телячьей сыворотки (Bio Whittaker, кат. №02-701 F) и 1:100 смеси пенициллина и стрептомицина (Bio Whittaker, кат. №17-602 Е), в роллерных флоконах площадью 1700 см2 (Coming, №431200). Затем среду заменяли на 300 мл UltraCHO с L-глутамином (Bio Whittaker, кат. №12-724 Q), с добавлением 1:500 Ex-Cyte VLE (Serological Proteins Inc., №81-129) и 1:100 смеси пенициллина и стрептомицина (Bio Whittaker, кат. №17-602 Е). После 48 часов культивирования среду заменяли свежей средой UltraCHO с теми же добавками. После следующих 48 часов культивирования среду заменяли средой DMEM, содержащей питательную смесь F-12 (Ham), L-глутамин и пиридоксин-HCl (Life Technologies, кат. №21041-025), с добавлением 1:100 ITS-A (Gibco/BRL, №51300-044), 1:500 Ex-Cyte VLB (Serological Proteins Inc., №81-129) и 1:100 смеси пенициллина и стрептомицина (BioWhittaker, кат. №17-602Е). После этого, через каждые 24 часа культуральную среду собирали и заменяли на 300 мл свежей среды, не содержащей сыворотки, с теми же добавками. Собранную среду фильтровали через фильтры с диаметром пор 0,22 мкм для удаления клеток.
Пример 8. Очистка
Фильтрат подвергали микрофильтрации (0,22 мкм) и перед ультрафильтрацией приблизительно до 1/15 объема с помощью системы TFF фирмы Millipore. В той же системе концентрат подвергали диафильтрации в 10 мМ Трис, pH 7,6. Добавляли сульфат аммония до концентрации 1,7 М и после перемешивания удаляли выпавший осадок центрифугированием при 8000 об/мин в течение 25 мин в центрифуге Sorvall, используя ротор GS3.
Супернатант наносили на колонку Phenyl Sephasose High Performance (Pharmacia) объемом 25 мл, предварительно уравновешенную 10 мМ Трис, 1,7 М сульфатом аммония, pH 7,6. После нанесения колонку промывали 3 объемами 10 мМ Трис, 1,7 М сульфата аммония, pH 7,6, а затем элюировали связавшийся вариант IFNG пропусканием 10 колоночных объемов линейного градиента до 100% 10 мМ Трис, pH 7,6. Свободный объем, так же как и элюируемый вариант IFNG собирали отдельными фракциями. Фракции, обогащенные вариантом IFNG, объединяли и заменяли буфер на 10 мМ Трис, pH 9,0, путем диафильтрации с помощью системы Vivaflow 200 (VivaScience) с пределом исключения в 10000 кДа.
Вариант IFNG затем наносили на колонку Q-Sepharose Fast Flow (Pharmacia) объемом 18 мл, предварительно уравновешенную 10 мМ Трис, рН 9,0. После нанесения колонку промывали 3 объемами 10 мМ Трис, рН 9,0 перед элюированием связавшегося варианта IFNG 15 колоночными объемами градиента 0-100% 10 мМ Трис, 0,5 М NaCl, рН 9,0. Свободный объем, так же как и элюируемый вариант IFNG собирали отдельными фракциями. Фракции, обогащенные вариантом IFNG, объединяли и заменяли буфер на 10 мМ фосфат натрия, рН 7,0, путем диафильтрации с помощью колонки Vivaspin 20 (VivaScience) с пределом исключения в 10000 кДа.
После этого вариант IFNG наносили на колонку с гидроксиапатитом СНТ (BioRad) объемом 8 мл, предварительно уравновешенную 10 мМ фосфатом натрия, рН 7,0. После нанесения колонку промывали 5 объемами 10 мМ фосфата натрия, рН 7,0 перед элюированием связавшегося варианта IFNG 30 колоночными объемами градиента 0-60% 500 мМ фосфата натрия, рН 7,0. Свободный объем, так же как и элюируемый вариант IFNG собирали отдельными фракциями. Фракции, содержащие вариант IFNG, объединяли и заменяли буфер на 5 мМ сукцинат натрия, 4% маннит, рН 6,0, с помощью колонки Vivaspin 20 (VivaScience), после чего добавляли Tween 20 до концентрации 0,01%. Вариант IFNG стерилизировали фильтрованием и хранили при -80°С.
В качестве альтернативы варианты IFNG могут быть очищены по нижеследующей схеме очистки.
Фильтрат подвергают микрофильтрации (0,22 мкм) перед ультрафильтрацией приблизительно до 1/15 объема с помощью системы TFF фирмы Millipore. В той же системе концентрат подвергают диафильтрации в 10 мМ Трис, pH 7,6, после чего доводят pH до 9,0 и удаляют выпавший осадок фильтрованием через микрофильтр.
Образец наносят на колонку Q-Sepharose Fast Flow (Pharmacia), предварительно уравновешенную 10 мМ Трис, pH 9,0. После нанесения колонку промывают 3 объемами 10 мМ Трис, pH 9,0 перед элюированием связавшегося варианта IFNG 15 колоночными объемами градиента 0-100% 10 мМ Трис, 0,5 М NaCl, pH 9,0. Свободный объем, так же как и элюируемый вариант IFNG собирают отдельными фракциями. Фракции, обогащенные вариантом IFNG, объединяют и доводят pH до 7,6. Добавляют сульфат аммония до 1,5 М и после перемешивания удаляют выпавший осадок центрифугированием.
Вариант IFNG затем наносят на колонку Phenyl Sephasose High Performance (Pharmacia), предварительно уравновешенную 10 мМ Трис, 1,5 М сульфатом аммония, pH 7,6. После нанесения колонку промывают 3 объемами 10 мМ Трис, 1,5 М сульфатом аммония, pH 7,6 перед элюированием связавшегося варианта IFNG 10 колоночными объемами линейного градиента до 100% 10 мМ Трис, pH 7,6. Свободный объем, так же как и элюируемый вариант IFNG собирают отдельными фракциями. Фракции, обогащенные вариантом IFNG, объединяют и доводят концентрацию сульфата аммония до 1,7 М.
После этого вариант IFNG наносят на колонку Butyl Sepharose, предварительно уравновешенную 10 мМ фосфатом натрия, 1,7 М сульфатом аммония, pH 7,6. После нанесения колонку промывают 10 мМ фосфатом натрия, 1,7 М сульфатом аммония, pH 7,6 перед элюированием связавшегося варианта IFNG 10 мМ фосфата натрия, pH 6,5 в одну стадию. Свободный объем, так же как и элюируемый вариант IFNG, собирают отдельными фракциями.
Затем фракции, содержащие вариант IFNG, объединяют и наносят на колонку с гидроксиапатитом, предварительно уравновешенную 10 мМ фосфатом натрия, pH 6,5. После нанесения колонку промывают 5 объемами 10 мМ фосфата натрия, рН 6,5 перед элюированием связавшегося варианта IFNG 30 колоночными объемами линейного градиента 0-100% 500 мМ фосфата натрия, pH 6,5. Свободный объем, так же как и элюируемый вариант IFNG собирают отдельными фракциями.
Фракции, содержащие вариант IFNG, объединяют и заменяют буфер на 5 мМ сукцинат натрия, 4% маннит, pH 6,0. После этого добавляют Tween 20 до концентрации 0,01%. Вариант IFNG стерилизуют фильтрованием и хранят при -80°С.
Пример 9. Активность вариантов и модифицированных PEG вариантов
Используя “Первичный анализ”, описанный выше, получили следующие данные по активности (после кратковременной трансфекции).
Таблица 1
Активность полноразмерных и укороченных вариантов полипептида rhuIFNG после временной трансфекции |
| Мутации |
Активность (AU/мл) |
% от активности полноразмерного дикого типа |
| Дикий тип (полноразмерный) |
1,4×107 |
– |
| S99T (полноразмерный) |
5,1×106 |
36% |
| E38N (полноразмерный) |
1,4×107 |
100% |
| E38N+S40T (полноразмерный) |
9,9×106 |
71% |
| E38N+S40T+S99T (полноразмерный) |
1,3×107 |
93% |
| E38N+K61T (полноразмерный) |
1,2×107 |
86% |
| E38N+K61T+S99T (полноразмерный) |
1,4×106 |
10% |
| N10C+S99T (полноразмерный) |
2,5×106 |
18% |
| N16C+S99T (полноразмерный) |
1,1×107 |
79% |
| E38C+S99T (полноразмерный) |
1,0×107 |
71% |
| S99T+N104C (полноразмерный) |
5,0×106 |
36% |
| N10C+E38N+S40T+S99T (полноразмерный) |
1,5×106 |
11% |
| N16C+E38N+S40T+S99T (полноразмерный) |
3,7×106 |
26% |
| Е38N+S40T+N59C+S99T (полноразмерный) |
1,1×107 |
79% |
| E38N+S40T+N83C+S99T (полноразмерный) |
7,2×105 |
5% |
| E38N+S40T+K94C+S99T (полноразмерный) |
9,4×105 |
7% |
| Е38N+S40T+S99T+N 104С (полноразмерный) |
2,3×106 |
16% |
| Дикий тип (укороченный) |
6,3×106 |
45% |
| S99T (укороченный) |
3,5×106 |
25% |
| E38N+S40T+S99T (укороченный) |
4,0×106 |
29% |
Используя “Первичный анализ”, описанный выше, получили следующие данные по активности (после очистки).
Таблица 2
Активность полноразмерных и укороченных вариантов полипептида rhuIFNG после очистки |
| Мутации |
Удельная активность (AU/мг) |
% от активности полноразмерного дикого типа |
| Дикий тип (полноразмерный) |
2,1×107 |
– |
| S99T (полноразмерный) |
2,2×107 |
105% |
| E38N+S40T+S99T (полноразмерный) |
1,4×107 |
67% |
| N10C+S99T (полноразмерный) |
3,8×106 |
18% |
| N16C+S99T (полноразмерный) |
2,3×106 |
11% |
| N16C+S99T (полноразмерный+ 10 кДат РЕС)) |
1,3×106 |
6% |
| E38C+S99T (полноразмерный) |
3,4×106 |
16% |
| N59C+S99T (полноразмерный) |
6,3×106 |
30% |
| N59C+S99T (полноразмерный+ 5 кДа mPEG) |
2,4×106 |
11% |
| S99T+N104C (полноразмерный) |
3,5×106 |
17% |
Активность ряда модифицированных PEG вариантов измеряли путем сравнения активности продуктов модификации PEG с образцами, подвергавшимися такой же процедуре модификации PEG (см. выше пример 5), но без добавления самого PEG в реакционную среду. Результаты приведены ниже в табл.3.
Таблица 3
Активность модифицированных PEG вариантов полноразмерного полипептида rhuIFNG |
| Мутации |
Активность относительно не модифицированного PEG продукта, подвергавшегося “процедуре модификации PEG” (%) |
| N10C+S99T (полноразмерный+5 кДа mPEG) |
23 |
| N16C+S99T (полноразмерный+5 кДа mPEG) |
59 |
| E38C+S99T (полноразмерный+10кДа mPEG)1) |
41 |
| S99T+N104C (полноразмерный+5 кДа mPEG) |
42 |
| 1) Применялся метод конъюгации через ODSS. Для остальных модифицированных PEG вариантов применялся метод конъюгации через MAL. |
Следует подчеркнуть, что данные по активности в табл.1 отражают сочетание удельной активности и уровня экспрессии в клетках СНО-К1. Поэтому можно сделать вывод, что все варианты проявляют сравнимые уровни экспрессии/удельные активности относительно rhuIFNG.
Как видно из табл.2, все варианты с цистеином проявляют меньшую удельную активность по сравнению с rhuIFNG, тогда как варианты, содержащие мутации E38N, S40T и/или S99T, сохраняют удельную активность, сравнимую с rhuIFNG. Когда варианты с цистеином подвергались модификации PEG на 5 или 10 кДа, наблюдалось дальнейшее падение удельной активности в 2-3 раза (табл.3). Не ограничиваясь какой-либо одной теорией, можно предполагать, что уменьшение удельной активности может быть вызвано снижением связывания с рецептором вследствие стерических препятствий со стороны конъюгированной группировки PEG.
Пример 10. Оценка использования сайтов N-гликозилирования
Для того, чтобы оценить относительное число используемых сайтов N-гликозилирования, проводили Вестерн-блоттинг, используя собранную культуральную среду (см. фиг.1). Оказалось, что в случае rhuIFNG (полноразмерного) дикого типа в приблизительно 50% используется оба сайта гликозилирования (2N), в примерно 40% используется один сайт гликозилирования (1N) и около 10% не гликозилировано (0N).
Эти данные согласуются с ранее опубликованными данными Hooker et al., 1998, J. Interferon and Cytokine Res. 18, 287-295, и Sarenva et al., 1995, Biochem. J. 308, 9-14.
Как видно из фиг.1, у варианта S99T (полноразмерного) два сайта гликозилирования используются значительно более эффективно, чем у соответствующего дикого типа. Оказалось, что у около 90% варианта S99T используется оба сайта гликозилирования (2N), у примерно 7% используется один сайт гликозилирования (1N) и около 3% не гликозилировано (ON).
Более того, из фиг.1 видно, что введенный сайт гликозилирования в положении 38 у варианта E38N+S40T (полноразмерного) используется значительно лучше по сравнению с неоптимизированным вариантом E38N (полноразмерным).
Эти данные четко показывают, что можно добиться лучшего использования сайтов гликозилирования, будь это природные или введенные сайты, при введении остатка треонина, а не остатка серина, в положение +2 относительно остатка аспарагина.
Пример 11. Фармакокинетические исследования
Значения AUC при подкожном введении (AUCsc) у крыс определяли, как описано выше, у ряда вариантов IFNG. Результаты обобщены в табл.4 и фиг.2, 3.
Таблица 4
Фармакокинетические данные при подкожном введении крысам |
| Вариант |
AUCsc/доза (мин×г)/мл |
AUCsc,вариант/AUCsc,Actimmune® |
AUCsc,вариант/AUCsc,дикий тип, полноразмерный |
Tmax.sc (мин) |
| Actimmune® |
0,3-0,4 |
– |
0,013-0,027 |
43 |
| rhuIFNG (полноразмерный) |
15-24 |
37-80 |
|
362-446 |
| E38N+S40T+S99T1) |
111-192 |
277-640 |
4,6-13 |
308-374 |
| N16C+S99T2) |
37 |
92-123 |
1,5-2,5 |
247 |
| N16C+S99T3) |
114 |
285-380 |
4,8-7,6 |
249 |
| 1) полноразмерный; 2) полноразмерный + 5 кДа mPEG присоединенный к введенному остатку цистеина; 3) полноразмерный +10 кДа mPEG присоединенный к введенному остатку цистеина |
Как видно из фиг.2, 3 и табл.4, варианты (включая модифицированные PEG варианты) проявляют значительно большие значения AUC при подкожном введении по сравнению с rhuIFNG, в частности по сравнению с коммерчески доступным Actimmune®. Обращаясь к фиг.3, следует отметить, что вводимые дозы двух модифицированных PEG вариантов были уменьшены в 2,5 раза по сравнению с вводимой дозой варианта [E38N+S40T+S99T].
Очевидно, это открывает возможность для введения меньших доз, что ведет к уменьшению побочных эффектов, и/или менее частого введения активного начала, чем в настоящее время, что ведет к лучшему выполнению пациентом назначений врача.
Формула изобретения
1. Полипептид  -интерферона (IFNG), имеющий аминокислотную последовательность, приведенную в SEQ ID No:1, или его фрагмент, укороченный с С-конца на 1-15 аминокислотных остатков, где указанный полипептид IFNG или его фрагмент характеризуется повышенным использованием сайта N-гликозилирования в положении 97 по сравнению с huIFN (SEQ ID NO:17), причем указанный полипептид IFNG или его фрагмент проявляет активность связывания с рецептором IFNG. -интерферона (IFNG), имеющий аминокислотную последовательность, приведенную в SEQ ID No:1, или его фрагмент, укороченный с С-конца на 1-15 аминокислотных остатков, где указанный полипептид IFNG или его фрагмент характеризуется повышенным использованием сайта N-гликозилирования в положении 97 по сравнению с huIFN (SEQ ID NO:17), причем указанный полипептид IFNG или его фрагмент проявляет активность связывания с рецептором IFNG.
2. Полипептид по п.1, который имеет аминокислотную последовательность, приведенную в SEQ ID No:1.
3. Полипептид по п.1, который является фрагментом аминокислотной последовательности, приведенной в SEQ ID No:1, укороченным с С-конца на 1-15 аминокислотных остатков.
4. Полипептид по п.3, который имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID No:2, SEQ ID No:3, SEQ ID No:4, SEQ ID No:5, SEQ ID No:6, SEQ ID No:7, SEQ ID No:8, SEQ ID No:9, SEQ ID No:10, SEQ ID No:11, SEQ ID No:12, SEQ ID No:13, SEQ ID No:14, SEQ ID No:15 и SEQ ID No:16.
5. Полипептид по любому из пп.1-4, который гликозилирован.
6. Полипептид  -интерферона (IFNG) с последовательностью SEQ ID No:1 или его фрагмент, укороченный с С-конца на 1-15 аминокислотных остатков, где указанный полипептид или его фрагмент включает треонин в положении 99 и 1-10 модификаций относительно SEQ ID No:1 или ее фрагмента, и где указанный полипептид или его фрагмент характеризуется повышенным использованием сайта N-гликозилирования в положении 97 по сравнению с huIFN (SEQ ID NO:17), причем указанный полипептид или его фрагмент проявляет активность связывания с рецептором IFNG. -интерферона (IFNG) с последовательностью SEQ ID No:1 или его фрагмент, укороченный с С-конца на 1-15 аминокислотных остатков, где указанный полипептид или его фрагмент включает треонин в положении 99 и 1-10 модификаций относительно SEQ ID No:1 или ее фрагмента, и где указанный полипептид или его фрагмент характеризуется повышенным использованием сайта N-гликозилирования в положении 97 по сравнению с huIFN (SEQ ID NO:17), причем указанный полипептид или его фрагмент проявляет активность связывания с рецептором IFNG.
7. Полипептид или его фрагмент по п.6, который включает 1-10 модификаций относительно фрагмента SEQ ID No:1, укороченного с С-конца на 1-15 аминокислотных остатков.
8. Полипептид или его фрагмент по п.7, который включает 1-10 модификаций относительно аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID No:2, SEQ ID No:3, SEQ ID No:4, SEQ ID No:5, SEQ ID No:6, SEQ ID No:7, SEQ ID No:8, SEQ ID No:9, SEQ ID No:10, SEQ ID No:11, SEQ ID No:12, SEQ ID No:13, SEQ ID No:14, SEQ ID No:15 и SEQ ID No:16.
9. Полипептид или его фрагмент по п.8, который включает 1-10 модификаций относительно аминокислотной последовательности, приведенной в SEQ ID No:12.
10. Полипептид или его фрагмент по любому из пп.6-9, который включает по меньшей мере один введенный и/или по меньшей мере один удаленный аминокислотный остаток, содержащий связующую группу для неполипептидного компонента.
11. Полипептид или его фрагмент по п.10, который включает по меньшей мере один введенный сайт гликозилирования.
12. Полипептид или его фрагмент по п.11, в котором указанный сайт гликозилирования представляет собой сайт N-гликозилирования.
13. Полипептид или его фрагмент по п.12, в котором указанный сайт N-гликозилирования введен в положение, занятое аминокислотным остатком, у которого не менее 25% боковой цепи экспонировано на поверхности (как определено в Примере 1 в описании).
14. Полипептид или его фрагмент по п.13, в котором указанный сайт N-гликозилирования введен в положение, занятое аминокислотным остатком, у которого не менее 50% боковой цепи экспонировано на поверхности (как определено в Примере 1 в описании).
15. Полипептид или его фрагмент по п.13 или 14, в котором указанный сайт N-гликозилирования введен путем замены.
16. Полипептид или его фрагмент по п.15, в котором указанная замена выбрана из группы, состоящей из K12S, K12T, G18S, G18T, E38N, E38N+S40T, K61S, К61T, N85S, N85T, K94N, Q106S и Q106T.
17. Полипептид или его фрагмент по п.16, в котором указанная замена выбрана из группы, состоящей из К12Т, G18T, E38N+S40T, К61Т, N85T, K94N и Q106T.
18. Полипептид или его фрагмент по п.17, в котором указанная замена представляет собой E38N+S40T.
19. Полипептид или его фрагмент по п.10, который включает по меньшей мере один введенный остаток цистеина.
20. Полипептид или его фрагмент по п.19, в котором указанный остаток цистеина введен в положение, занятое аминокислотным остатком, у которого не менее 25% боковой цепи экспонировано на поверхности (как определено в Примере 1 в описании).
21. Полипептид или его фрагмент по п.20, в котором указанный остаток цистеина введен в положение, занятое аминокислотным остатком, у которого не менее 50% боковой цепи экспонировано на поверхности (как определено в Примере 1 в описании).
22. Полипептид или его фрагмент по п.20 или 21, в котором указанный остаток цистеина введен путем замены.
23. Полипептид или его фрагмент по п.22, в котором указанная замена выбрана из группы, состоящей из N10C, N16C, Е38C, N59C, N83C, К94C, N104C и A124C.
24. Полипептид по п.10, который включает по меньшей мере один введенный сайт N-гликозилирования и по меньшей мере один введенный остаток цистеина.
25. Полипептид по п.24, в котором сайт N-гликозилирования введен в положение, определенное по любому из пп.13-18, а остаток цистеина введен в положение, определенное по любому из пп.20-23.
26. Полипептид по любому из пп.1-25 для применения в качестве лекарственного средства.
27. Конъюгат полипептида  -интерферона (IFNG) с неполипептидным компонентом, где указанный конъюгат включает полипептид по п.6, ковалентно присоединенный к молекуле полиэтиленгликоля. -интерферона (IFNG) с неполипептидным компонентом, где указанный конъюгат включает полипептид по п.6, ковалентно присоединенный к молекуле полиэтиленгликоля.
28. Конъюгат по п.27, в котором указанная молекула полиэтиленгликоля является линейным или разветвленным полиэтиленгликолем.
29. Конъюгат по любому из пп.27-28 для применения в качестве лекарственного средства.
30. Рекомбинантная молекула нуклеиновой кислоты, кодирующая полипептид rhuIFNG, обладающий повышенной способностью к гликозилированию по сравнению с молекулой huIFNG, и характеризующаяся нуклеотидной последовательностью, которая по существу соответствует нуклеотидной последовательности, кодирующей аминокислотную последовательность полипептида по пп.1, 6 или 27.
31. Экспрессионный вектор, включающий нуклеотидную последовательность, охарактеризованную в п.30.
32. Гликозилирующая клетка-хозяин, включающая нуклеотидную последовательность, охарактеризованную в п.30, или экспрессионный вектор по п.31.
33. Клетка-хозяин по п.32, представляющая собой клетку CHO или клетку BHK.
34. Фармацевтическая композиция для лечения или профилактики интерстициального легочного заболевания, включающая эффективное количество полипептида, охарактеризованного в любом из пп.1-29, и фармацевтически приемлемый разбавитель, носитель или вспомогательное вещество.
35. Фармацевтическая композиция по п.34 для применения в качестве лекарственного средства.
36. Применение полипептида по любому из пп.1-29 для изготовления лекарственного средства для лечения интерстициальных легочных заболеваний.
37. Применение по п.36, при котором указанное интерстициальное легочное заболевание представляет собой идиопатический фиброз легких.
38. Применение фармацевтической композиции по п.34 для изготовления лекарственного средства для лечения интерстициальных легочных заболеваний.
39. Применение по п.38, при котором указанное интерстициальное легочное заболевание представляет собой идиопатический фиброз легких.
40. Способ лечения или профилактики интерстициальных легочных заболеваний, который включает введение нуждающемуся в этом млекопитающему, в частности человеку, эффективного количества полипептида по любому из пп.1-29 или композиции по п.34.
41. Способ по п.40, в котором указанное интерстициальное легочное заболевание представляет собой идиопатический фиброз легких.
42. Способ получения полипептида IFNG по любому из пп.1-29, который включает
(a) культивирование гликозилирующей клетки-хозяина, содержащей нуклеотидную последовательность, кодирующую полипептид IFNG по любому из пп.1-29, в условиях, способствующих экспрессии этого полипептида;
(b) необязательно проведение реакции данного полипептида с неполипептидным компонентом in vitro в условиях, способствующих конъюгированию;
(c) извлечение полипептида.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 05.04.2009
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
|