|
|
(21), (22) Заявка: 2005118907/28, 17.06.2005
(24) Дата начала отсчета срока действия патента:
17.06.2005
(46) Опубликовано: 10.03.2007
(56) Список документов, цитированных в отчете о
поиске:
Методические указания по измерению массовой концентрации меди флуориметрическим методом в пробах питьевой воды и воды поверхностных и подземных источников водопользования. Сборник методических указаний. Измерение массовой концентрации химических веществ люминесцентными методами в объектах окружающей среды. М., Минздрав России, 1997, с.67-76. RU 2201592 С2, 27.03.2003. SU 972343 A1, 07.11.1982. JP 91778662 A, 11.07.1997.
Адрес для переписки:
620016, г.Екатеринбург, Амундсена, 101, ГУ ИМЕТ УрО РАН, Зав. патентно-информационным отделом Л.А. Сандлер
|
(72) Автор(ы):
Неудачина Людмила Константиновна (RU),
Ятлук Юрий Григорьевич (RU),
Осинцева Елена Валерьевна (RU),
Печищева Надежда Викторовна (RU),
Вшивков Александр Акиндинович (RU),
Леонтьев Леопольд Игоревич (RU),
Шуняев Константин Юрьевич (RU)
(73) Патентообладатель(и):
Государственное учреждение Институт металлургии Уральского отделения Российской академии наук (ГУ ИМЕТ УрО РАН) (RU)
|
(54) СПОСОБ ФЛУОРИМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ МЕДИ (II) В РАСТВОРАХ
(57) Реферат:
Изобретение относится к области аналитической химии. Способ включает введение в исследуемый раствор комплексообразующего реагента и регистрацию изменения значения интенсивности флуоресценции. В качестве комплексообразующего реагента используют водный раствор  -ААПК – N,N-ди(2-карбоксиэтил)-3,4-ксилидина или водный раствор -ААПК – N,N-ди(2-карбоксиэтил)-3,4-ксилидина или водный раствор  -ААПК – N-(2-карбоксиэтил)-о-аминобензойной кислоты, который облучают светом с длиной волны в диапазоне 210-220 нм, регистрируют интенсивность возникающей флуоресценции при длине волны в диапазоне 350-370 нм или в диапазоне 400-440 нм соответственно, при этом поддерживают ацетатным буферным раствором рН, равное 6.0. Технический результат – повышение селективности и чувствительности определения меди (II) в растворах на фоне сопутствующих компонентов без предварительного их отделения. 2 ил., 4 табл. -ААПК – N-(2-карбоксиэтил)-о-аминобензойной кислоты, который облучают светом с длиной волны в диапазоне 210-220 нм, регистрируют интенсивность возникающей флуоресценции при длине волны в диапазоне 350-370 нм или в диапазоне 400-440 нм соответственно, при этом поддерживают ацетатным буферным раствором рН, равное 6.0. Технический результат – повышение селективности и чувствительности определения меди (II) в растворах на фоне сопутствующих компонентов без предварительного их отделения. 2 ил., 4 табл.
Изобретение относится к области аналитической химии, в частности к флуориметрическому способу определения концентрации ионов меди(II) в растворах с использованием ароматических амино- -пропионовых кислот ( -пропионовых кислот ( -ААПК) – N,N-ди(2-карбоксиэтил)-3,4-ксилидина (реагент I) или N-(2-карбоксиэтил)-о-аминобензойной кислоты (реагент II). В основе способа лежит регистрация изменения значения интенсивности флуоресценции растворов -ААПК) – N,N-ди(2-карбоксиэтил)-3,4-ксилидина (реагент I) или N-(2-карбоксиэтил)-о-аминобензойной кислоты (реагент II). В основе способа лежит регистрация изменения значения интенсивности флуоресценции растворов  -ААПК при добавлении к ним анализируемого раствора, содержащего ионы меди (II). Гашение флуоресценции растворов -ААПК при добавлении к ним анализируемого раствора, содержащего ионы меди (II). Гашение флуоресценции растворов  -ААПК при образовании ими комплексов с ионами меди (II) пропорционально концентрации иона-гасителя. -ААПК при образовании ими комплексов с ионами меди (II) пропорционально концентрации иона-гасителя.
Известно несколько способов флуориметрического определения меди (Головина А.П., Левшин Л.В. Химический люминесцентный анализ неорганических веществ – М: Химия, 1978 – 248 с. [1], Столяров К.П., Григорьев Н.Н. Введение в люминесцентный анализ неорганических веществ. Л.: Химия, 1967. 364 с. [2], Божевольнов Е. А. Люминесцентный анализ неорганических веществ. М.: Химия, 1966. 416 с.[3]). Краткая характеристика некоторых из них представлена в таблице 1.
Из таблицы 1 следует, что существующие флуориметрические методы либо низкоселективны, либо требуют использования органических растворителей. Определению концентрации меди (II) мешает присутствие в анализируемых растворах ионов никеля (II), кобальта (II), железа (III) и т.п., что вызывает необходимость отделения сопутствующих компонентов из раствора путем осаждения их нерастворимых в воде соединений, введения дополнительных комплексообразующих реагентов, либо проведения экстракции их комплексов с использованием органических растворителей. Эти дополнительные процедуры существенно увеличивают время, затрачиваемое на проведение анализа, его трудоемкость, а применение токсичных растворителей делает измерения небезопасными.
3 без разбавления пробы.
Недостатками данного метода являются:
– необходимость разбавлять исследуемые пробы, если концентрация меди в них превышает 0,5 мг/дм3, что вносит дополнительную погрешность в результаты анализа и удлиняет его;
– мешающее влияние на результаты анализа более чем 3-кратных молярных избытков ионов железа, более чем 7-кратных молярных избытков ионов алюминия, кобальта и никеля;
– необходимость работы с токсичным растворителем.
Задачей предлагаемого технического решения является разработка флуориметрического способа определения концентрации меди (II) в растворах, обладающего более высокой селективностью и экологичностью за счет исключения работы с органическими растворителями.
Технический результат настоящего изобретения выражается в повышении селективности, что позволяет проводить определение меди (II) в растворах на фоне сопутствующих компонентов без предварительного их отделения. Способ не предусматривает дополнительных операций при пробоподготовке.
Решение поставленной задачи достигается тем, что в способе флуориметрического определения содержания меди (II) в растворах, включающем введение в исследуемый раствор комплексообразующего реагента и регистрацию изменения значения интенсивности флуоресценции, согласно изобретению в качестве комплексообразующего реагента используют водный раствор ароматической амино- -пропионовой кислоты ( -пропионовой кислоты ( -ААПК)-N,N-ди(2-карбоксиэтил)-3,4-ксилидина (реагент I) или водный раствор -ААПК)-N,N-ди(2-карбоксиэтил)-3,4-ксилидина (реагент I) или водный раствор  -ААПК – N-(2-карбоксиэтил)-о-аминобензойной кислоты (реагент II), который облучают светом с длиной волны в диапазоне 210-220 нм, регистрируют интенсивность возникающей флуоресценции при длине волны в диапазоне 350-370 нм, или в диапазоне 350-370 нм, или в диапазоне 400-440 нм соответственно, при этом поддерживают ацетатным буферным раствором рН, равное 6.0. -ААПК – N-(2-карбоксиэтил)-о-аминобензойной кислоты (реагент II), который облучают светом с длиной волны в диапазоне 210-220 нм, регистрируют интенсивность возникающей флуоресценции при длине волны в диапазоне 350-370 нм, или в диапазоне 350-370 нм, или в диапазоне 400-440 нм соответственно, при этом поддерживают ацетатным буферным раствором рН, равное 6.0.
+, Na+, NH4 +, Ва2+, Cd2+, N=750 для Со2+, N=500 для Ni2+, Mn2+, Mg2+, N=250 для Са2+, N=200 для Zn2+; для реагента II – N=1000 для К+, Na+, NH4 +, Ва2+, N=25 для Cd2+, N=10 для Co2+, Ni2+, Mn2+, Mg2+, N=50 для Zn2+, N=20 для Са2+. Также было проверено влияние ионов хрома(III), алюминия(III), железа(III), ряда редкоземельных элементов. Не мешают определению меди с помощью реагентов I и II тысячекратные молярные избытки хлорид-, ацетат-, сульфат- и карбонат-иона, 25-кратные избытки нитрат-иона.
Растворы реагентов I и II обладают способностью к флуоресценции под действием УФ-излучения, интенсивность флуоресценции уменьшается по мере протекания реакции комплексообразования.
На фиг. 1 и 2 приведены спектры регистрации флуоресценции растворов реагентов I и II при различной кислотности.
Как видно из фиг. 1, в спектре регистрации флуоресценции раствора реагента I наблюдаются две полосы, с максимумами при длинах волн регистрации 280 и 360 нм. Испытания показали, что полоса с максимумом 360 нм уменьшает свою интенсивность при возрастании концентрации ионов меди (II) в растворе, тогда как интенсивность полосы с максимумом 280 нм остается неизменной. Поэтому для разработки флуориметрического способа определения концентрации ионов меди (II) в растворах с помощью реагента I для регистрации интенсивности флуоресценции была выбрана длина волны 360 нм (в максимуме наблюдается наибольший коэффициент чувствительности сигнала).
Из фиг. 2 видно, что раствор реагента II имеет в своем спектре регистрации флуоресценции одну полосу, максимум которой смещается в сторону меньших длин волн при увеличении рН, при значении рН 6 (оптимальном для комплексообразования реагента II и ионов меди (II)) максимальная интенсивность флуоресценции наблюдается при 411 нм. Поэтому во флуориметрическом способе определения концентрации ионов меди (II) в растворах с помощью реагента II используется именно эта длина волны регистрации флуоресценции для достижения максимально возможной чувствительности сигнала.
Пример 1.  -ААПК – реагенты для флуориметрического определения меди -ААПК – реагенты для флуориметрического определения меди
Гашение флуоресценции растворов реагентов I и II пропорционально концентрации иона-гасителя, что позволяет определять концентрацию иона-гасителя в растворе. Установлены оптимальные условия определения меди (II) с использованием реагентов I и II флуориметрическим методом (таблица 2).
Как видно из таблицы 2, флуориметрический метод с использованием реагента I позволяет определять медь (II) в диапазоне концентраций 0,05-5,0 мг/дм3, создавая pH 6 ацетатным буферным раствором, причем определение можно производить через 20 мин после добавления реактивов. Метод с использованием реагента II требует выдерживания раствора в течение 60 мин (оптимальная рН 6 также создается ацетатным буферным раствором), но имеет больший диапазон определяемых концентраций меди – 0,005-5,0 мг/дм3, который также шире, чем диапазон флуориметрического метода с использованием люмокупферона (0,005-0,2 мг/дм3).
Испытания показали высокую селективность флуориметрического метода определения концентрации меди с использованием  -ААПК. Флуориметрическому определению концентрации меди не мешают N-кратные молярные избытки следующих ионов: -ААПК. Флуориметрическому определению концентрации меди не мешают N-кратные молярные избытки следующих ионов:
Определение с реагентом I:
N-2000-К+, Na+, Са2+, Mg2+, SO42-, Zn2+;
N=1000-NH4 +, Cl–, СН3СОО–, F–,
N=500-Mn2+, Ba2+; N=300-PO4 3-;
N=100-Ni2+, Co2+;
N=10-HCO3 –, Al3+, Cr3+;
N=1-Fe2+;
N=0.5-NO3 –, Fe3+;
Определение с реагентом II:
N=1000-К+, Na+, NH4 +, SO4 2-, Cl–, СН3СОО–, BO4 3-, F–, Zn2+;
N=200-Ва2+;
N=100-Са2+, Mg2+;
N=50-Fe2+, Mn2+, F–,
N=10-HCO3 –, Cd2+;
N=3-Co2+;
N=2-Al3+, NO2 –;
N=0.5-Cr3+, S2-.
Отсутствие мешающего влияния ряда ионов металлов и неметаллов в условиях люминесцентного определения меди позволяет проводить анализ различных экологических объектов, таких как поверхностные воды суши, сточные воды, питьевая вода, а также технологических растворов.
Пример 2. Флуориметрический метод определения меди с использованием реагентов I и II
Метод позволяет определять медь в воде поверхностных водах, а также питьевой, сточной воде и технологических растворах с рН не более 3.0 в диапазоне концентраций меди от 0,005 до 5,0 мг/дм3 без разбавления пробы. Допускается разбавление проб при концентрации меди 5,0-50,0 мг/дм3.
Приготовление 0,2 М ацетатно-аммиачного буферного раствора с рН 6.
К 52 мл концентрированной уксусной кислоты с концентрацией 2 моль/дм3 добавляют 50 см3 аммиака водного такой же концентрации и разбавляют бидистиллированной водой до метки в колбе вместимостью 1000 см3, контролируя значение рН с помощью иономера.
Приготовление стандартных растворов ионов меди
Раствор ионов меди (II) с концентрацией 500 мг/дм3 (раствор А) готовят растворением навески 0,1964 г меди сернокислой пятиводной CuSO4·5Н2О в 100 см3 бидистиллированной воде. Раствор ионов меди (II) с концентрацией 50 мг/дм3 (раствор Б) и 5 мг/дм (раствор В) готовят последовательным разбавлением 10 см3 раствора А (или соответственно Б) в мерной колбе вместимостью 100 см3 до метки бидистиллированной водой. Растворы А и Б годны в течение 2 недель, раствор В готовят в день употребления.
Приготовление растворов реагента I с концентрацией 6 ммоль/дм3, 0,6 ммоль/дм3 и 0,06 ммоль/дм3.
Навеску 0,3180 г реагента I растворяют в бидистиллированной воде при нагревании на водяной бане и доводят объем до 200 см3 в мерной колбе. Раствор хранится в темном прохладном месте в течение 3 недель. Растворы с концентрацией 0,6 и 0,06 ммоль/дм3 готовят разбавлением 5 см3 растворов 6 ммоль/дм3 и 0,6 ммоль/дм3 соответственно в мерной колбе вместимостью 50 см3. Растворы готовят перед употреблением.
Градуировка спектрофлюориметра
При содержании меди в исследуемых пробах свыше 0,5 мг/дм3 в ряде мерных колб вместимостью 50 см3 готовят растворы, содержащие 0, 0,5, 1, 2, 3 см3 раствора меди Б, 5 см3 раствора реагента I с концентрацией 0,6 ммоль/дм3, 5 см3 буферного раствора с рН=6 и бидистиллированную воду до метки.
При содержании меди в исследуемых пробах от 0,05 до 0,5 мг/дм3 растворы для градуировки готовят аналогично, но с использованием стандартного раствора меди В и раствора реагента I с концентрацией 0,06 ммоль/дм3.
Измеряют интенсивность флуоресценции градуировочных растворов на спектрофлюориметре “Флюорат-02-Панорама” при максимальной чувствительности ФЭУ, длине волны возбуждения флуоресценции 215 нм и регистрации флуоресценции 360 нм (усреднение сигнала производят по 250 измерениям). Измерения для каждого из раствора повторяют 3 раза, вычисляя среднее арифметическое, и строят график в координатах Iфлуоресценции=f(Cмеди).
Приготовление анализируемых растворов
В колбу вместимостью 50 см3 вносят 25 см3 предварительно отфильтрованной анализируемой пробы, содержащей медь, 5 см3 раствора реагента I, 5 см3 буферного раствора с рН 6, и бидистиллированную воду до метки. Концентрацию раствора реагента (0,6 ммоль/дм3 либо 0,06 ммоль/дм3) выбирают, исходя из ожидаемого значения концентрации меди в анализируемой пробе. Проводят измерения в тех же условиях, что и для градуировочных растворов. Измерения повторяют 3 раза, вычисляют среднее арифметическое. Концентрацию меди в растворе для измерения Сх определяют по градуировочному графику. Для определения концентрации меди в анализируемой пробе полученное значение удваивают: Спр=2·Сх. Определение концентрации меди в анализируемом растворе повторяют дважды, за результат анализа принимают среднее арифметическое.
При содержании меди в исследуемой пробе в интервале 0,005-0,5 мг/дм3 проводится анализ по аналогичной процедуре, но с использованием раствора реагента II с концентрацией 6·10-6 моль/дм3, стандартного раствора меди с концентрацией 0,5 мг/дм3 и соответствующих условий определения (см. таблицу 2 для реагента II). Раствор 0,6 ммоль/дм3 реагента II в этом случае готовят, растворяя при нагревании на водяной бане его навеску массой 0,0125 г в 100 см3 бидистиллированной воды. Его аликвоту 5 см3 разбавляют до метки бидистиллированной водой в мерной колбе вместимостью 500 см3, получая раствор реагента II с концентрацией 6·10-6 моль/дм3.
При установленном содержании в анализируемой пробе флуоресцирующих органических примесей и ионов в количествах, превышающих концентрации, в которых они не оказывают мешающего влияния на определение меди (см. выше), возможно применение варианта метода добавок (Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим методам анализа. – 5-е изд., – Л.: Химия, 1986. – 432 с.), в котором в качестве аналитического сигнала рассматривается разница интенсивности флуоресценции  I=Iреагента-Iпробы и исследуется ее зависимость от концентрации добавки стандартного раствора меди. I=Iреагента-Iпробы и исследуется ее зависимость от концентрации добавки стандартного раствора меди.
Результаты сравнительного определения содержания меди в образце сточной воды металлургического предприятия, содержащем ионы никеля, флуориметрическим методом с использованием раствора реагента II и атомно-абсорбционным методом приведены в таблице 3.
Результаты определения ионов меди(II) в искусственной смеси, приготовленной на основе природной питьевой воды, содержащей ионы Са2+ (30-100 мг/дм3), Mg2+ (<50 мг/дм3), НСО3 – (150-300 мг/дм3) и другие компоненты (общая минерализация 300-600 мг/дм3), в которую был добавлен стандартный раствор ионов меди(II) таким образом, чтобы содержание меди составило 1,27 мг/см3, приведены в таблице 4.
Таким образом, как видно из таблиц 3 и 4, предлагаемый флуориметрический способ позволяет с удовлетворительной точностью определять медь в сложных растворах без использования токсичных органических растворителей.
3 по сравнению с 3-25 мг/дм3) и обладает большей чувствительностью (коэффициент чувствительности  равен 2·105-3·107 л/моль·см по сравнению с 1700-3300 л/моль·см), что может быть использовано для целей экологического мониторинга (ПДК меди в питьевой воде и поверхностных водах суши составляет 1 мг/дм). равен 2·105-3·107 л/моль·см по сравнению с 1700-3300 л/моль·см), что может быть использовано для целей экологического мониторинга (ПДК меди в питьевой воде и поверхностных водах суши составляет 1 мг/дм).
Таблица 1
Сравнительная характеристика некоторых флуориметрических способов определения концентрации меди(II) |
| Реагент |
 , нм , нм |
Диапазон определяемых концентраций, мг/дм3 |
Условия |
Ионы, мешающие определению |
Литер. |
| Бензоин |
422 |
0,002-0,06 |
С2Н5OH |
Ag+, Со2+, Ni2+ |
1,2 |
| Люминол |
|
0,02-0,2 |
Н2O2, рН>6,0 |
Fe3+, Co2+, Ni2+, Cr3+, F–, Ag+, Al3+, Mn2+ и др. |
1,3 |
| Тиамин |
650 |
0,1-30 |
С2Н5OH, NH2OH, рН 7 |
|
1 |
| 1,1,3-трициано-2-амино-1-пропен |
500 |
0,015-0,6 |
Имидазол, рН 7,5-8,9 |
|
1 |
| Эозин, 1,10-фенантролин |
580 |
0,01-0,1 |
CHCl3, (СН3)2СО до 50%, рН 9 |
|
1 |
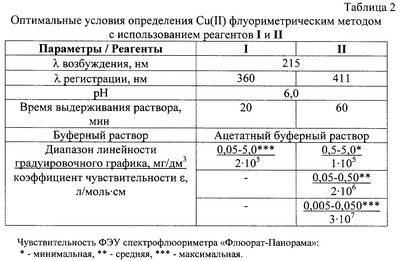
Таблица 3
Результаты определения меди(II) в сточной воде, содержащей 20 мг/см3 никеля(II) |
| № п/п |
Флуориметрический метод с использованием реагента II |
Атомно-абсорбционный метод |
| 1 |
2,04 |
2,35 |
| 2 |
2,36 |
2,30 |
| 3 |
2,11 |
2,26 |
| 4 |
2,38 |
2,29 |
| 5 |
2,29 |
2,20 |
| 6 |
2,21 |
2,25 |
| 7 |
2,15 |
2,30 |
| Среднее арифметическое |
2,24 |
2,28 |
| СКО |
0,13 |
0,05 |
| Результат анализа, Р=0,95 |
2,24±0,12 |
2,28±0,05 |
Таблица 4
Результаты определения меди(II) в питьевой воде
по ТУ 9185-004-41645795-01 (введенная концентрация меди 1,27 мг/дм3) |
| № п/п |
Концентрация меди найденная, мг/дм3 |
| 1 |
1,25 |
| 2 |
1,39 |
| 3 |
1,18 |
| 4 |
1,61 |
| 5 |
1,29 |
| 6 |
1,66 |
| 7 |
1,16 |
| 8 |
1,34 |
| Среднее арифметическое |
1,36 |
| СКО |
0,19 |
| Результат анализа, Р=0,95 |
1,36±0,16 |
Формула изобретения
Способ флуориметрического определения содержания меди (II) в растворах, включающий введение в исследуемый раствор комплексообразующего реагента и регистрацию изменения значения интенсивности флуоресценции, отличающийся тем, что в качестве комплексообразующего реагента используют водный раствор  -ААПК – N,N-ди(2-карбоксиэтил)-3,4-ксилидина или водный раствор -ААПК – N,N-ди(2-карбоксиэтил)-3,4-ксилидина или водный раствор  -ААПК – N-(2-карбоксиэтил)-о-аминобензойной кислоты, который облучают светом с длиной волны 210-220 нм, регистрируют интенсивность возникающей флуоресценции при длине волны 350-370 нм или 400-440 нм соответственно, при этом поддерживают ацетатным буферным раствором рН 6,0. -ААПК – N-(2-карбоксиэтил)-о-аминобензойной кислоты, который облучают светом с длиной волны 210-220 нм, регистрируют интенсивность возникающей флуоресценции при длине волны 350-370 нм или 400-440 нм соответственно, при этом поддерживают ацетатным буферным раствором рН 6,0.
РИСУНКИ
|
|