|
|
(21), (22) Заявка: 2004131970/13, 03.11.2004
(24) Дата начала отсчета срока действия патента:
03.11.2004
(43) Дата публикации заявки: 10.04.2006
(46) Опубликовано: 10.03.2007
(56) Список документов, цитированных в отчете о
поиске:
SU 629548 A1, 25.10.1978. JP 2004000060, 08.01.2004. CA 2477002, 04.09.2003. HUGHES S.R., GOYAL S., SUN J.E., GONZALEZ-DEWHITT P., FORTES M.A., RIEDEL N.G., SAHASRABUDHE S.R., Two-hybrid system as a model to study the interaction of beta-amyloid peptide monomers, Proc Natl Acad Sci USA. 1996 Mar 5; 93(5):2065-70. HINES V., ZHANG W., RAMAKRISHNA N.,
Адрес для переписки:
199034, Санкт-Петербург, Университетская наб., 7/9, Университет, Департамент интеллектуальной собственности и трансфера технологий, Т.И. Матвеевой
|
(72) Автор(ы):
Галкин Алексей Петрович (RU),
Цапонина Ольга Евгеньевна (RU),
Рубель Александр Анатольевич (RU),
Наволоцкая Виктория Васильевна (RU),
Лада Артем Геннадиевич (RU),
Петрова Ирина Томасовна (RU),
Смирнов Александр Федорович (RU),
Инге-Вечтомов Сергей Георгиевич (RU)
(73) Патентообладатель(и):
Санкт-Петербургский государственный университет (СПбГУ) (RU)
|
(54) ГИБРИДНЫЙ ГЕН Pcupl – A SUP35MC ДЛЯ АНАЛИЗА ФАКТОРОВ, РЕГУЛИРУЮЩИХ ПРОДУКЦИЮ, АГРЕГАЦИЮ И ДИСАГРЕГАЦИЮ ПЕПТИДА АМИЛОИД SUP35MC ДЛЯ АНАЛИЗА ФАКТОРОВ, РЕГУЛИРУЮЩИХ ПРОДУКЦИЮ, АГРЕГАЦИЮ И ДИСАГРЕГАЦИЮ ПЕПТИДА АМИЛОИД  (A (A ) ЧЕЛОВЕКА В ДРОЖЖЕВОЙ СИСТЕМЕ ) ЧЕЛОВЕКА В ДРОЖЖЕВОЙ СИСТЕМЕ
(57) Реферат:
Изобретение относится к области биотехнологии и может быть использовано в медицине. Гибридный ген Pcupl-A -SUP35MC получен на основе промотора CUP1, последовательности, кодирующей полноразмерный амилоидный пептид бета (А -SUP35MC получен на основе промотора CUP1, последовательности, кодирующей полноразмерный амилоидный пептид бета (А -пептид) человека, последовательности, кодирующей М и С домены белка Sup35 дрожжей Saccharomyces cerevisiae, и последовательности, терминирующей трансляцию. Применение изобретения позволяет проводить масштабный скрининг агентов, регулирующих агрегацию А -пептид) человека, последовательности, кодирующей М и С домены белка Sup35 дрожжей Saccharomyces cerevisiae, и последовательности, терминирующей трансляцию. Применение изобретения позволяет проводить масштабный скрининг агентов, регулирующих агрегацию А -пептида. 2 ил. -пептида. 2 ил.
(56) (продолжение):
CLASS=”b560m”STYLES J., MEHTA P., KIM K.S., INNIS M., MILLER D.L., The expression and processing of human beta-amyloid peptide precursors in Saccharomyces cerevisiae: evidence for a novel endopeptidase in the yeast secretory system, Cell Mol Biol Res. 1994; 40(4):273-84.
Изобретение относится к генной инженерии и биомедицинской промышленности и представляет собой последовательность нуклеотидов ДНК, кодирующих гибридный ген A -SUP35MC. -SUP35MC.
Изобретение имеет большой практический, медицинский и нравственный аспект, поскольку касается, в частности, не только проблемы увеличения средней продолжительности жизни человека, но и его психического здоровья. С увеличением средней продолжительности жизни в развитых странах закономерно увеличивается число людей, страдающих нейродегенеративными заболеваниями. В связи с этим исследование механизмов нейродегенеративных заболеваний и поиски пути их лечения являются одним из приоритетных направлений современной биомедицины. Наибольший практический интерес представляют исследования болезни Альцгеймера (одной из широко распространенных форм старческого маразма), связанной с формированием в тканях центральной нервной системы так называемых амилоидных бляшек, основным компонентом которых является пептид А . А . А -пептид представляет собой продукт одного из двух путей протеолиза белка АРР (Amiloid Precusor Protein) (1) – Wisniewski Т., Ghiso J., Frangione В. Bilology of A -пептид представляет собой продукт одного из двух путей протеолиза белка АРР (Amiloid Precusor Protein) (1) – Wisniewski Т., Ghiso J., Frangione В. Bilology of A   -пептид представлен в виде -пептид представлен в виде 
Характеристика гибридного гена.
Гибридный ген Pcupl-A -SUP35MC для анализа факторов, регулирующих продукцию, агрегацию и дисагрегацию пептида амилоид -SUP35MC для анализа факторов, регулирующих продукцию, агрегацию и дисагрегацию пептида амилоид  (А (А ) человека в дрожжевой системе, имеющий размер 2493 пар оснований, состоит из следующих элементов: ) человека в дрожжевой системе, имеющий размер 2493 пар оснований, состоит из следующих элементов:
фрагмента Xhol-BamHl размером 477 п.о., представляющего последовательность, индуцибельного CUPl-промотора для экспрессии последовательностей в дрожжевой клетке. Уровень экспрессии последовательностей под контролем CUPl-промотора зависит от концентрации ионов меди в питательной среде. С увеличением концентрации ионов меди увеличивается уровень экспрессии последовательностей, контролируемых CUPl-промотором;
BamHI-BamHl фрагмента размером 135 пар оснований, представляющего собой последовательность, кодирующую амилоидный пептид бета (А -пептид) человека, размером 40 аминокислот, фланкированную ТАТА-боксом и старт-кодоном (АТО) с 5′-конца; -пептид) человека, размером 40 аминокислот, фланкированную ТАТА-боксом и старт-кодоном (АТО) с 5′-конца;
Взаимное расположение элементов гибридного гена PCUPl-A -SUP35MC представлено на фиг.1. -SUP35MC представлено на фиг.1.
На фиг.1 указаны сайты рестрикции (Xhol, BamHl, BamHl и Sad), фланкирующие элементы гибридного гена (CUPl-промотор, последовательность, кодирующая А -пептид человека и фрагмент, кодирующий М и С домены дрожжевого гена SUP35). Цифрами указаны номера нуклеотидов кодирующей цепи, вслед за которыми соответствующая рестриктаза гидролизует последовательность. -пептид человека и фрагмент, кодирующий М и С домены дрожжевого гена SUP35). Цифрами указаны номера нуклеотидов кодирующей цепи, вслед за которыми соответствующая рестриктаза гидролизует последовательность.
Элементы (последовательности, кодирующие А -пептид и Sup35MC) находятся под контролем CUPl-промотора, фланкированы сайтами рестрикции и представляют собой одну открытую рамку считывания. -пептид и Sup35MC) находятся под контролем CUPl-промотора, фланкированы сайтами рестрикции и представляют собой одну открытую рамку считывания.
В конкретном примере ген встроен в центромерную плазмиду [PCUPl-A -SUP35MC(UBA3)], которая содержит бактериальный и дрожжевой орижины репликации, ген устойчивости к ампицилину – AmpR и ген URE3. -SUP35MC(UBA3)], которая содержит бактериальный и дрожжевой орижины репликации, ген устойчивости к ампицилину – AmpR и ген URE3.
Нуклеотидная последовательность гибридного гена Pcupl-A -SUP35MC: -SUP35MC:

Получение гибридного гена Pcupl-A -SUP35MC и пример реализации. -SUP35MC и пример реализации.
Последовательность, кодирующая А -пептид, была получена при помощи стандартного метода «RT-PCR» из тотальной РНК мозга абортуса (протокол приведен ниже). Праймеры содержат регуляторные последовательности (ТАТА-бокс и кодон ATG, инициирующий транскрипцию), сайты рестрикции BamHl и Sad и последовательности комплиментарные 5′ и 3′ концам А -пептид, была получена при помощи стандартного метода «RT-PCR» из тотальной РНК мозга абортуса (протокол приведен ниже). Праймеры содержат регуляторные последовательности (ТАТА-бокс и кодон ATG, инициирующий транскрипцию), сайты рестрикции BamHl и Sad и последовательности комплиментарные 5′ и 3′ концам А , кодирующего 40 аминокислот. , кодирующего 40 аминокислот.
Нуклеотидная последовательность праймеров:
F-primer: 5′ GGGTCCAC GGATCC TAT ATG TCT GATGCAGAATTCCGACAT 3′
R-primer: 5′ GTTATAAA GGATCC GACAACACCGCCCACCAT 3′
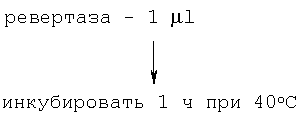
Для получения однонитевой копиии сДНК была проведена реакция обратной транскрипции:
Тотальная РНК из мозга абортуса – 1  l (1 l (1  g/ g/ l) l)
Праймер F – 1  l (100 ng) l (100 ng)
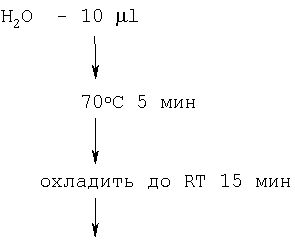
Добавить:
5 × буфер – 4  l l
dNTP – 3  l (2mM) l (2mM)
Полимеразная цепная реакция:
кДНК – 2  l l
10 × буфер – 5
dNTP – 2  l (2mM) l (2mM)
праймер F -1  l (100 ng) l (100 ng)
праймер R – 1  l (100 ng) l (100 ng)
H2O – 38  l l
– полимераза “Vent” – 1  l l
Полимеразная цепная реакция:
Фаза 1 94° 1 мин
Фаза 2 94° 1 мин
41° 1 мин 1 цикл
72° 1 мин
Фаза 3 94° 1 мин
63° 1 мин 40 циклов
72° 1 мин
Плазмида [Psup35-SUP35MC(URA3)] (Werzyn et al., 2001) была гидролизована с помощью рестриктаз Xhol и BamHl, что позволило заместить промотор SUP35 на последовательность, кодирующую промотор CUP1 (нуклеотидная последовательность промотора CUPl представлена). Реакция лигирования проводилась по стандартному протоколу фирмы “Promega”. Таким образом, была сконструирована плазмида [РCUPl SUP35MC(URA3)].
Амплифицированная последовательность, кодирующая А -пептид, была проверена секвенированием (фирма «Хеликс») и, затем, с помощью лигирования, встроена в плазмиду [Рcupl-SUP35MC(URA3)] по сайтам BamHl и Sad, расположенными вслед за CUPl-промотором. Полученная нами центромерная плазмида [Рcupl-A -пептид, была проверена секвенированием (фирма «Хеликс») и, затем, с помощью лигирования, встроена в плазмиду [Рcupl-SUP35MC(URA3)] по сайтам BamHl и Sad, расположенными вслед за CUPl-промотором. Полученная нами центромерная плазмида [Рcupl-A -SUP35MC(URA3)] содержит последовательность гибридного гена A -SUP35MC(URA3)] содержит последовательность гибридного гена A -SUP35MC под контролем индуцибельного CUPl-промотора, бактериальный и дрожжевой орижины репликации, ген устойчивости к ампилицилину – AmpR и ген URE3. -SUP35MC под контролем индуцибельного CUPl-промотора, бактериальный и дрожжевой орижины репликации, ген устойчивости к ампилицилину – AmpR и ген URE3.
Пример использования гибридного гена Рcupl-A -SUP35MC -SUP35MC
Поиск агентов, блокирующих агрегацию А -пептида, планируется проводить с использованием дрожжевой тест-системы, которая позволит вести масштабный скрининг белков, пептидов и химических агентов, блокирующих и (или) предотвращающих агрегацию A -пептида, планируется проводить с использованием дрожжевой тест-системы, которая позволит вести масштабный скрининг белков, пептидов и химических агентов, блокирующих и (или) предотвращающих агрегацию A -пептида. Ключевым элементом такой тест-системы является заявляемый гибридный ген Рcupl-A -пептида. Ключевым элементом такой тест-системы является заявляемый гибридный ген Рcupl-A -SUP35MC. Данный гибридный ген экспрессируется в дрожжевом штамме и кодирует гибридный белок A -SUP35MC. Данный гибридный ген экспрессируется в дрожжевом штамме и кодирует гибридный белок A -Sup35MC. Последовательность, соответствующая М и С доменам дрожжевого белка Sup35, выполняет функцию фактора терминации трансляции. Аминокислотные последовательности A -Sup35MC. Последовательность, соответствующая М и С доменам дрожжевого белка Sup35, выполняет функцию фактора терминации трансляции. Аминокислотные последовательности A -пептида человека способны агрегировать друг с другом, что приводит к агрегации и частичной инактивации гибридного белка Ap-Sup35MC. Используемый дрожжевой штамм имеет делецию хромосомной копии гена SUP35 и маркирован нонсенс-мутацией adel-14. Агрегация и инактивация A -пептида человека способны агрегировать друг с другом, что приводит к агрегации и частичной инактивации гибридного белка Ap-Sup35MC. Используемый дрожжевой штамм имеет делецию хромосомной копии гена SUP35 и маркирован нонсенс-мутацией adel-14. Агрегация и инактивация A -Sup35MCp приводит к снижению точности терминации трансляции, что приводит к супрессии нонсенс-мутации adel-14 и детектируется по критерию «рост – отсутствие роста на селективной среде без аденина». Таким образом, использование гибридного гена Рcupl-A -Sup35MCp приводит к снижению точности терминации трансляции, что приводит к супрессии нонсенс-мутации adel-14 и детектируется по критерию «рост – отсутствие роста на селективной среде без аденина». Таким образом, использование гибридного гена Рcupl-A -SUP35MC позволяет выявлять агрегацию А -SUP35MC позволяет выявлять агрегацию А -пептида человека на фенотипическом уровне. Это дает возможность быстро и дешево проводить первичный масштабный поиск белков, пептидов и химических соединений, блокирующих и предотвращающих болезнетворную агрегацию А -пептида человека на фенотипическом уровне. Это дает возможность быстро и дешево проводить первичный масштабный поиск белков, пептидов и химических соединений, блокирующих и предотвращающих болезнетворную агрегацию А -пептида. В частности, планируется провести полный скрининг кДНК библиотеки из мозга человека и выявить белки, контролирующие олигомеризацию А -пептида. В частности, планируется провести полный скрининг кДНК библиотеки из мозга человека и выявить белки, контролирующие олигомеризацию А -пептида. Такие белки можно рассматривать в качестве потенциальных терапевтических средств против болезни Альцгеймера. -пептида. Такие белки можно рассматривать в качестве потенциальных терапевтических средств против болезни Альцгеймера.
Другие тест-системы
Заявителю неизвестны из патентной и научной литературы аналогичные тест-системы, позволяющие вести указанный выше масштабный скрининг агентов, блокирующих агрегацию А -пептида. Поиск факторов, контролирующих агрегацию А -пептида. Поиск факторов, контролирующих агрегацию А , проводится в экспериментах на млекопитающих, в культуре клеток, или в системе in vitro. , проводится в экспериментах на млекопитающих, в культуре клеток, или в системе in vitro.
В частности, получена трансгенная линия мышей, которые несут ген АРР человека и предрасположены к развитию нейродегенеративного заболевания в результате отщепления А
Эксперименты с культурами клеток и в системе in vitro требуют использования биохимических методов (9) – Pike C.J., Walencewicz A.J., Glabe C.G., Cotman C.W. In vitro aging of beta-amyloid protein causes peptide aggregation and neurotoxicity. Brain Research. 1991 Nov 1; 563(1-2), P.311-314); (10) – Lorenzo A., Yankner B.A. Beta-amyloid neurotoxicity requires fibril formation and is inhibited by congo red. Proc Nati Acad Sci USA. 1994 Dec 6; 91(25), P.12243-12247). Совершенно очевидно, что данные подходы не позволяют осуществлять масштабный скрининг агентов, блокирующих формирование амилоидов.
Анализ проводился при помощи стандартного метода дифференциального центрифугирования с последующей Вестерн-блот гибридизацией (Ма and Lindquist, 1999, Nature Cell Biol, 1(6): 358-361).
Тотальный белок был выделен из штамма Saccharomyces cerevisiae, содержащего гибридный ген Pcupl-A -SUP35MC, и разделен с помощью ультрацентрифугирования в градиенте сахарозы на различные фракции. Верхняя (самая легкая) фракция содержит белок в мономерной изоформе. Во всех других фракциях (осадочных) белок может выявляться только в том случае, если он формирует в клетках высокомолекулярные агрегаты за счет агрегации. После этого белок из всех полученных фракций денатурировали до мономерного состояния и наносили на полиакриламидный гель для проведения белкового электрофореза. Белки переносили с геля на нитроцеллюлозную мембрану и проводили Вестерн-блот гибридизацию с моноклональными антителами (4F “Sigma”) к А -SUP35MC, и разделен с помощью ультрацентрифугирования в градиенте сахарозы на различные фракции. Верхняя (самая легкая) фракция содержит белок в мономерной изоформе. Во всех других фракциях (осадочных) белок может выявляться только в том случае, если он формирует в клетках высокомолекулярные агрегаты за счет агрегации. После этого белок из всех полученных фракций денатурировали до мономерного состояния и наносили на полиакриламидный гель для проведения белкового электрофореза. Белки переносили с геля на нитроцеллюлозную мембрану и проводили Вестерн-блот гибридизацию с моноклональными антителами (4F “Sigma”) к А -пептиду. Во всех проанализированных фракциях выявляется специфичный сигнал гибридизации в районе 80-90 kDa, что соответствует размеру белка А -пептиду. Во всех проанализированных фракциях выявляется специфичный сигнал гибридизации в районе 80-90 kDa, что соответствует размеру белка А -Sup35MC. На второй дорожке специфический сигнал соответствует мономерной фракции белка A -Sup35MC. На второй дорожке специфический сигнал соответствует мономерной фракции белка A -Sup35MC. Наличие специфического сигнала на 2-й, 3-й, 4-й и 5-й дорожках свидетельствует о наличии в клетках дрожжей агрегатов A -Sup35MC. Наличие специфического сигнала на 2-й, 3-й, 4-й и 5-й дорожках свидетельствует о наличии в клетках дрожжей агрегатов A -Sup35MC различного размера (фиг.2). -Sup35MC различного размера (фиг.2).
Поскольку значительная доля белка выявляется в осадочных фракциях, можно утверждать, что белок A -Sup35MC агрегирует в дрожжевой клетке. Поскольку укороченный белок Sup35MC не способен к агрегации (Ter-Avanesyan et al., 1994, Genetics, 137:671-676), то можно утверждать, что агрегация обусловлена наличием в составе гибридного белка последовательности A -Sup35MC агрегирует в дрожжевой клетке. Поскольку укороченный белок Sup35MC не способен к агрегации (Ter-Avanesyan et al., 1994, Genetics, 137:671-676), то можно утверждать, что агрегация обусловлена наличием в составе гибридного белка последовательности A -пептида. -пептида.
Список использованной литературы
4. Tamaoka A., Odaka A., Ishibashi Y., Usami M. et al. APP717 missense mutation affects the ratio of amyloid beta protein species (A beta 1-42/43 and a beta 1-40) in familial Alzheimer’s disease brain. J Biol Chem. 1994. 269(52). P.32721-32724.
5. Price D.L., Sisodia S.S. Mutant genes in familial Alzheimer’ s disease and transgenic models. Annu Rev Neurosci. 1998. V21. P.479-505.
9. Pike C.J., Walencewicz A.J., Glabe C.G., Cotman CW. In vitro aging of beta-amyloid protein causes peptide aggregation and neurotoxicity. Brain Research. 1991 Nov 1; 563(1-2), P.311-314.
10. Lorenzo A., Yankner B.A. Beta-amyloid neurotoxicity requires fibril formation and is inhibited by congo red. Proc Nati Acad Sci USA. 1994 Dec 6; 91(25), P.12243-12247.
Формула изобретения
Гибридный ген Pcupl-A -SUP35MC для анализа факторов, регулирующих продукцию, агрегацию и дисагрегацию пептида амилоид -SUP35MC для анализа факторов, регулирующих продукцию, агрегацию и дисагрегацию пептида амилоид  (А (А ) человека в дрожжевой системе, состоящий из фрагмента Xhol-BamHl размером 477 пар оснований, представляющего собой последовательность CUPl-промотора, BamHl-BamHl фрагмента размером 135 пар оснований, представляющего собой последовательность, кодирующую полноразмерный амилоидный пептид бета (А ) человека в дрожжевой системе, состоящий из фрагмента Xhol-BamHl размером 477 пар оснований, представляющего собой последовательность CUPl-промотора, BamHl-BamHl фрагмента размером 135 пар оснований, представляющего собой последовательность, кодирующую полноразмерный амилоидный пептид бета (А -пептид) человека, размером 40 аминокислот (см. нуклеотидную последовательность, представленную в перечне последовательностей под цифрой «2»), фланкированную ТАТА-боксом и старт-кодоном (ATG) с 5′-конца, BamHl-Sacl фрагмента размером 1879 пар оснований, представляющего собой последовательность, кодирующую М и С домены белка Sup35 дрожжей Saccharomyces cerevisiae, фланкированную сайтом рестрикции BamHl с 5′, а также последовательностью, терминирующей трансляцию и сайтом Sad с 3′-конца. -пептид) человека, размером 40 аминокислот (см. нуклеотидную последовательность, представленную в перечне последовательностей под цифрой «2»), фланкированную ТАТА-боксом и старт-кодоном (ATG) с 5′-конца, BamHl-Sacl фрагмента размером 1879 пар оснований, представляющего собой последовательность, кодирующую М и С домены белка Sup35 дрожжей Saccharomyces cerevisiae, фланкированную сайтом рестрикции BamHl с 5′, а также последовательностью, терминирующей трансляцию и сайтом Sad с 3′-конца.
РИСУНКИ
|
|