Патент на изобретение №2294322
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ КЕТОНОВ И КАТАЛИЗАТОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
(57) Реферат:
Изобретение относится к области основного органического синтеза, а именно к способу получения кетонов, например диметилкетона (ДМК, СН3СОСН3), метилэтилкетона (МЭК, СН3СОС2Н5) прямым каталитическим окислением соответствующих алкенов, например пропилена, н-бутенов, а также к катализаторам для его осуществления. Описан способ получения кетонов окислением алкенов в присутствии металлокомплексных катализаторов, содержащих органическую компоненту, в котором в качестве окислителя используют оксид азота (I). В процессе используют катализатор на основе пероксополиоксометаллатных комплексов тетракис(оксодипероксометаллат)-фосфата(3-) в сочетании с четвертичными аммониевыми катионами, с общей формулой Q3{PO4[МеО(O2)2]4}, где Ме-Мо, W, V; Q3 – четвертичный аммониевый катион, содержащий алкильные цепочки C4-C8 или N-гексадецилпиридиний. Технический результат – повышение селективности процесса. 2 н. и 8 з.п. ф-лы.
Изобретение относится к области основного органического синтеза, а именно к способу получения кетонов, например диметилкетона (ДМК, СН3СОСН3), метилэтилкетона (МЭК, СН3СОС2Н5) прямым каталитическим окислением соответствующих алкенов, например пропилена, н-бутенов, а также к катализаторам для его осуществления. ДМК и МЭК являются крупнотоннажными продуктами промышленности органического синтеза. Вследствие исключительно высокой растворяющей способности ДМК и МЭК находят широкое промышленное применение [The Chemical Economics Handbook – New York: SRI International (СЕН), 1996]. Они являются основой различных красок и клеев, используются в качестве растворителей в производстве полиуретановых лаков, служащих для покрытия магнитных лент аудио- и видеокассет и различного инструментария, применяются при создании пленочных покрытий таблеток и капсул медпрепаратов, как экстрагенты в основном производстве лекарств. МЭК – один из лучших депарафинизаторов топлив и смазочных масел, обеспечивающий их морозостойкость, используется в производстве пенопластов, искусственных кож, полихлорвинила, эпоксидных и глифталевых смол. В качестве сырья МЭК используется при получении метилизопропил-кетона, 2,3-бутандиона; оксима метилэтилкетона, предотвращающего образование пленок при хранении красок; для получения этилакриловой и изомерных метилкротоновых кислот, антиоксидантов резин, для пластификации производных нитроцеллюлозы, используемых в производстве бездымных порохов и др. Основные области применения ДМК как реагента – это синтез метилметакрилата, метилизобутилкетона, метакриловой кислоты, ацетата целлюлозы, метилизобутилкарбинола и прочие. ДМК в мире производят тремя основными синтетическими методами. Кумольный способ, заключающийся в проведении процесса в две стадии: получение гидроперекиси кумола и расщепление ее на фенол и ДМК [FR 2050175; US 3803243, US 3839461; GB 1359047; JP 50-1258]. По этой технологии кумол окисляют кислородом воздуха до гидроперикиси кумола в присутствии карбоната и стеарата натрия. При этом на данной стадии образуются побочные продукты диметилбензиловый спирт и ацетофенон. Окисление протекает по свободно-радикальному механизму и ингибируется непредельными соединениями. Оксидат концентрируют до содержания гидроперекиси 80%, а затем подвергают расщеплению в присутствии кислого катализатора. Последующие усовершенствования кумольного метода сводятся к применению новых катализаторов, например состоящих из полифталоцианина меди и гетероциклического амина (пиридина, хинолина, триазина, пиразина), либо проведение реакции получения гидроперекиси кумола последовательно в нескольких реакторах при температуре от 80 до 120°С. При этом содержание гидроперекиси в первом реакторе низкое до 2%; во втором до 18-20%, в третьем 26%, а в четвертом его повышают до 31%. Двухстадийный процесс получения ДМК из пропилена через изопропиловый спирт разработан совместно двумя фирмами Великобритании и Германии [Hydrocarbon Process., v.54, №11, 1975, Р.103]. На первой стадии пропилен и пары воды перегревают до 180°С и затем пропускают в реакторе гидратации над катализатором под давлением 35 атм. Вторая стадия процесса заключается в дегидрировании полученного изопропанола. Ее проводят при 450-550°С в многотрубчатом реакторе. Ацетоновую фракцию отгоняют в колонне, которую затем ректифицируют в чистый продукт. Полученный ДМК содержит около 0,1% воды. К числу промышленно важных реакций относится каталитическое окисление пропилена в ДМК с использованием гомогенного катализатора на основе хлоридов палладия (II) и меди(II) Вакер-процесс. Этот катализатор, работающий в сравнительно мягких условиях (температура 120°С, давление этилена 5 атм), обладает высокой активностью и селективностью. Однако практическое использование (PdCl2+CuCl2)-системы осложняется рядом существенных недостатков, которые будут подробно освещены на примере получения МЭК (см. реакции 8, 9). В промышленном масштабе МЭК получают несколькими способами. Основным способом является трехстадийная (1)-(3) переработка бутиленовой фракции – побочного продукта производства дивинила на заводах синтетического каучука. Преимущество способа заключается в дешевизне сырья.
Стадии (1) и (2) – жидкофазные, а стадия (3) может быть как в жидкофазном, так и в гетерогенно-каталитическом варианте. Недостатками этого способа являются: большое количество вредных отходов в виде загрязненной кислыми гудронами серной кислоты; высокая коррозионная активность среды на стадиях (1) и (2); высокая энергоемкость стадии (3); сложность процесса выделения МЭК из реакционной смеси, содержащей многочисленные примеси. Одной из модификаций данного способа является процесс, в котором H2SO4 заменена уксусной кислотой, а промежуточным продуктом является втор-бутилацетат: В качестве катализатора стадий (2а) и (3а) используют сульфокатионит, который имеет малый срок службы по причине блокировки поверхности образующимися смолами. Загрязненный сульфокатионит является неутилизируемым отходом производства, что серьезно ухудшает экологические и экономические показатели процесса в целом.
Трехстадийный способ [US 5304684, 1994] основан на реакциях (4)-(6), подобных используемым в современном промышленном способе получения фенола и ацетона через гидроперекись кумола. Однако стадии получения (5) и разложения (6) гидроперекиси втор-бутилбензола протекают с существенно меньшей избирательностью, чем получение и разложение гидроперекиси кумола. Наряду с МЭК и фенолом, в процессе образуются альдегиды, непредельные кетоны, карбоновые кислоты, их эфиры и смолы. Побочные продукты удаляют щелочью, что делает процесс экологически неблагоприятным.
Гомогенную каталитическую реакцию (7) можно проводить в одном реакторе, подавая в него стехиометрическую смесь н-C4H8/О2=2/1, либо проводить в две стадии: 1) взаимодействие н-бутилена с раствором промежуточного обратимо действующего окислителя Ох в присутствии соли палладия по уравнению (8); 2) регенерация Ox кислородом по уравнению (9):
Первоначально в качестве Ох использовали хлорную медь CuCl2 [Jira R., Freiesleben W., см. выше], восстановленная форма которой – ион CuCl– – легко окисляется кислородом. Однако синтез МЭК по реакции (9) в присутствии хлоридной системы (PdCl2+CuCl2) сопровождался образованием большого количества побочных хлорбутанонов (до 25%). В отсутствие Cl–-ионов или при их недостатке Cu(II) вообще не способна служить обратимым окислителем. Скорость окисления н-бутиленов значительно ниже скорости окисления этилена и пропилена. Скорость получения продуктов, выраженная через производительность катализатора для ацетальдегида, составляет 400 г·л-1·ч-1, ацетона 130 г·л-1·ч-1, а для метилэтилкетона 30 г·л-1·ч-1. Существенным недостатком ваккеровской системы является также то, что вследствие наличия хлор-ионов наблюдается сильная коррозия аппаратуры из сплава, содержащего железо. Поэтому для окисления н-бутиленов такой процесс в промышленности не был внедрен. В изобретениях [SU 700973, B 01 J 23/44, 1994; SU 822417, B 01 J 23/44, 1994] и более поздних [SU 1669109, B 01 J 23/44, 1994; RU 2230612, B 01 J 23/44, 2004] для системы (Pd+Ox) было предложено использовать в качестве обратимого окислителя Mo-V-фосфорные гетерополикислоты (ГПК), имеющие общую формулу Н3+nPVnМо12-nО40. С их участием бутиленовая реакция описывалась уравнением (8а), а кислородная – уравнением (9а):
где ГПС – восстановленная форма гетерополикислоты с общей формулой H3+n+mPVIV mVV n-mMo12-nO40. В этом способе каталитическая система (Pd2++ГПК) не содержала Cl–-ионов и потому обеспечивала полное отсутствие хлорорганических соединений в продуктах реакции. Избирательность системы достигала 95-98%, а активность в бутиленовой реакции (8а) в 100 раз превышала активность хлоридной системы (PdCl2+CuCl2). Процесс можно организовать в одностадийном, так и в двухстадийном вариантах. Однако в последнем случае происходило глубокое восстановление молекул ГПК. Поэтому катализатор (Pd+ГПК), как показали пилотные испытания, нельзя было признать вполне устойчивым ни в отношении палладия, ни в отношении ГПК. Низкая стабильность такого катализатора оказалась его главным недостатком. За последние 30 лет было предпринято много попыток стабилизировать палладий в катализаторе (Pd+ГПК), однако все они по разным причинам оказались неприемлемыми для технологии. Простейший способ удержать Pd2+ в растворе введением малых концентраций Cl–-ионов, соответствующих атомным отношениям Cl–/Pd=5÷50, был предложен в патенте фирмы Catalytica Inc. (США) [WO 91/13852, 19.09.1991]. Однако даже при таких концентрациях хлор из раствора катализатора быстро переходил в продукты реакции с образованием хлорорганических соединений. Требовалось непрерывное добавление соляной кислоты в раствор, а продукты очищать от хлорорганических соединений. Поэтому “малохлоридный катализатор” (PdCl2+ГПК) также не нашел промышленного применения. Использование палладия в виде комплексов с пиридинкарбоновыми кислотами ( В изобретении [JP 07-149685, 1995] катализаторы (Pd+ГПК) использовались в смешанных растворителях, содержащих менее 50% воды. В качестве таковых использовались диоксан, этанол, тетрагидрофуран, Прототипом предлагаемого способа и катализатора получения кетонов (ДМК, МЭК) является способ [SU 1584200, B 01 J 23/44,1994], в котором в качестве катализатора используют водный раствора соли палладия 10-4-1,5·10-2 M, производного пиридина 10-4-4,5·10-2 М и водного раствора оксометаллата – кислой соли фосформолибдованадатной гетерополикислоты (ГПК) 0,05-03 М с общей формулой МеаН3+n-аРМо12-nVn-4O40, где Me – щелочной или щелочноземельный металл; n=2-7; 06 n Основными существенными недостатками способа являются нестабильность палладия в растворе – выпадение металлического палладия в бутиленовом реакторе (на стадии 8а) с неполным возвращением его в раствор в воздушном реакторе (на стадии 9а); еще более серьезным недостатком является нестабильность молекул ГПК, обусловленная потерей ими части ванадия, выпадающего в виде коричневого осадка V3O7·2Н2O, являющегося трудноутилизируемым отходом производства. Изобретение решает задачу увеличения эффективности способа получения кетонов. Задача решается способом получения кетонов окислением алкенов в присутствии металлокомплексных катализаторов, содержащих органическую компоненту, в качестве окислителя используют оксид азота (I). Реакцию окисления проводят в жидкой фазе, жидкая фаза может содержать не более 10% воды. Реакцию окисления алкенов проводят в одном реакторе, подавая смесь реагентов, состоящую из алкенов, оксида азота (I) и легких алканов. Реакцию окисления алкенов осуществляют в среде жидкого углеводорода, в качестве которого можно использовать ароматические углеводороды. Реакцию окисления алкенов проводят при температуре 20÷150°С и общем давлении газовой смеси 1÷3,5 атм. Используют катализатор на основе пероксополиоксометаллатных комплексов – тетракис(оксодипероксометаллат)-фосфата(3-) в сочетании с четвертичными аммониевыми катионами, с общей формулой Q3{PO4[МеО(O2)2]4}, где Me – Мо, W, V; Q3 – четвертичный аммониевый катион, содержащий алкильные цепочки C4-C8 или N-гексадецилпиридиний. Концентрация каталитического комплекса составляет 1·10-2÷1·10-4 М. Задача решается также составом катализатора получения метилэтилкетона окислением бутенов оксидом азота (I) в среде жидких углеводородов, который является пероксополиоксометаллатным комплексом – тетракис(оксодипероксометаллат)-фосфата(3-) в сочетании с четвертичными аммониевыми катионами, с общей формулой Q3{PO4[МеО(O2)2]4}, где Me – Мо, W, V; Q3 – четвертичный аммониевый катион, содержащий алкильные цепочки C4-C8 или N-гексадецилпиридиний. Концентрация каталитического комплекса составляет 1·10-2÷1·10-4 М. Основными отличиями предлагаемого процесса получения кетонов являются: а) использование в качестве окислителя оксида азота (I), который позволяет повысить селективность процесса; б) осуществление процесса в одном реакторе в соответствии, например, с реакцией (10) позволяет сократить капитальные затраты на создание производства, соответствующего кетона;
в) проведение реакции в жидкой фазе – жидких углеводородах, содержащих не более 10% воды, это позволяет повысить растворимость газов и, в частности, оксида азота (I); г) проведение процесса в относительно мягких условиях при 20-150°С и общем давлении газовой смеси 1÷3,5 атм, а использование алкенов, содержащих легкие алканы, позволяет сделать процесс безопасным; д) использование в качестве катализаторов пероксополиоксометаллатов с органической компонентой и общей формулой Q3{PO4[МеО(O2)2]4}, где Me – Мо, W, V; Q3 – четвертичный аммониевый катион, содержащий алкильные группы C4-C8 или N-гексадецилпиридиний, например: n-Bu4N+, C5H5N(n-C16H33)+, CH3N(n-C8H17)3 + и т.п. Пероксополиоксометаллатные комплексы обладают большей активностью в различных реакциях окисления органических субстратов, чем катализаторы на основе оксометаллатов процесса-прототипа, где система (Pd+ГПК) стабилизирована фталоцианиновыми лигандами (Рс). Сущность изобретения иллюстрируется следующими примерами. Пример 1. В реактор типа “каталитическая утка” на 220 мл, закрепленный на качалке, помещают 50 мл раствора, содержащего 0,542 г (0,240 ммоль) катализатора, имеющего состав: [СН3(n-С8Н17)3N]3{PO4[WO(O2)2]4}. Реактор термостатируют при 50°С, удаляют воздух с помощью вакуумного насоса и заполняют смесью газа состава, об.%: N2O – 50,0, Пример 2. По примеру 1, отличающийся тем, что в качестве катализатора используют [С5Н5N(n-С16Н33)]3{PO4[WO(O2)2]4}. За 6 мин окисляют 76 мл C4H8. Выход метилэтилкетона составляет 73%. Пример 3. По примеру 1, отличающийся тем, что в качестве катализатора используют [(n-Bu)4N]3{PO4[WO(O2)2]4, за 15 мин окисляют 102 мл C4H8. Выход метилэтилкетона 72%. Пример 4. По примеру 1, отличающийся тем, что добавляют 0,271 ммоль катализатора, за 10 мин окисляют 90 мл C4H8. Выход метилэтилкетона 67,8%. Пример 5. По примеру 1, отличающийся тем, что добавляют 0,048 ммоль катализатора. За 20 мин окисляют 87 мл C4H8. Выход метилэтилкетона 69,7%. Пример 6. По примеру 1, отличающийся тем, что температура реакции составляет 70°С. За 20 мин окисляют 152 мл C4H8. Выход метилэтилкетона 47,8%. Пример 7. По примеру 1, отличающийся тем, что температура реакции составляет 90°С. За 20 мин окисляют 184 мл C4H8. Выход метилэтилкетона 52%. Пример 8. По примеру 1, отличающийся тем, что состав газовой смеси для заполнения реактора был следующим, об.%: N2O – 50,0, Пример 9. По примеру 8, отличающийся тем, что реакцию (10) проводят в металлическом термостатированном автоклаве, соединенном с образцовым монометром. В автоклав помещают раствор толуола с катализатором, автоклав вакуумируют, затем заполняют бутиленовой фракцией состава, об.%: Пример 10. По примеру 9, отличающийся тем, что общее давление смеси газов в автоклаве – 2,0 атм. За 10 мин окисляют 78,3 мл C4H8. Выход метилэтилкетона 85,3%. Пример 11. По примеру 9, отличающийся тем, что температура реакции составляет 70°С. За 10 мин окисляют 239,8 мл C4H8. Выход метилэтилкетона 92,7%. Пример 12. По примеру 1, отличающийся тем, что для заполнения реактора используют газовую смесь, содержащую пропилен и оксид азота (I) следующего состава, об.%: N2O – 50,0, С3Н6 – 49,9, сумма алканов Пример 13. По примеру 9, отличающийся тем, что для заполнения автоклава до давления 1,5 атм используют 99,8% пропилен(С3Н6). За 10 мин окисляют 180 мл С3Н6. Выход ацетона (ДМК) 86,3%. Пример 14. По примеру 3, отличающийся тем, что в качестве катализатора используют [(n-Bu)4N]3{PO4[VO(O2)2]4}, за 20 мин окисляют 80 мл C4H8. Выход метилэтилкетона 42%.
Формула изобретения
1. Способ получения кетонов окислением алкенов в присутствии металлокомплексных катализаторов, содержащих органическую компоненту, отличающийся тем, что в качестве окислителя используют оксид азота (I) и используют катализатор на основе пероксополиоксометаллатных комплексов – тетракис(оксодипероксометаллат)-фосфата(3-) в сочетании с четвертичными аммониевыми катионами с общей формулой Q3{PO4[МеО(O2)2]4}, где Me – Мо, W, V; Q3 – четвертичный аммониевый катион, содержащий алкильные цепочки C4-C8, или N-гексадецилпиридиний. 2. Способ по п.1, отличающийся тем, что реакцию окисления проводят в жидкой фазе. 3. Способ по п.1, отличающийся тем, что реакцию окисления алкенов проводят в одном реакторе, подавая смесь реагентов, состоящую из алкенов, оксида азота (I) и легких алканов. 4. Способ по п.2, отличающийся тем, что реакцию окисления алкенов осуществляют в среде жидкого углеводорода. 5. Способ по п.4, отличающийся тем, что в качестве жидкого углеводорода используют ароматический углеводород. 6. Способ по п.2, отличающийся тем, что жидкая фаза может содержать не более 10% воды. 7. Способ по п.1, отличающийся тем, что реакцию окисления алкенов проводят при температуре 20÷150°С. 8. Способ по п.1, отличающийся тем, что реакцию окисления алкенов проводят при общем давлении газовой смеси 1÷3,5 атм. 9. Способ по п.1, отличающийся тем, что тем, что концентрация каталитического комплекса составляет 1·10-2÷1·10-4 М. 10. Катализатор для процесса получения кетонов окислением алкенов на основе металлокомплексов, содержащих органическую компоненту, отличающийся тем, что он является пероксополиоксометаллатным комплексом – тетракис(оксодипероксометаллат)-фосфата(3-) в сочетании с четвертичными аммониевыми катионами с общей формулой Q3{PO4[МеО(O2)2]4}, где Me – Мо, W, V; Q3 – четвертичный аммониевый катион, содержащий алкильные цепочки С4-С8, или N-гексадецилпиридиний.
|
||||||||||||||||||||||||||

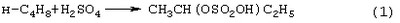
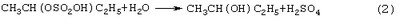
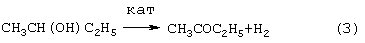
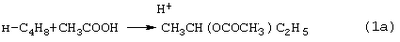
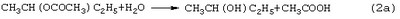
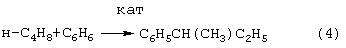
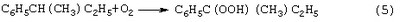
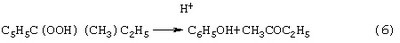
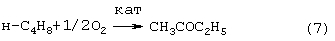
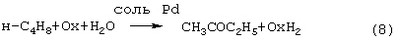
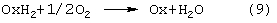
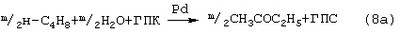

 -пиколиновой или дипиколиновой) повышает его стабильность [SU 1584200, B 01 J 23/44, 1994; SU 1669109, B 01 J 23/44, 1995]. Однако при этом в 10 и более раз снижается активность катализатора в реакции (7а) за счет чрезмерной стабилизации палладия, а следовательно, падает производительность процесса в целом. Поэтому такой способ оказался нетехнологичным.
-пиколиновой или дипиколиновой) повышает его стабильность [SU 1584200, B 01 J 23/44, 1994; SU 1669109, B 01 J 23/44, 1995]. Однако при этом в 10 и более раз снижается активность катализатора в реакции (7а) за счет чрезмерной стабилизации палладия, а следовательно, падает производительность процесса в целом. Поэтому такой способ оказался нетехнологичным. -бутиролактон или сульфолан. Реакцию (7) проводили одностадийно: растворенный
-бутиролактон или сульфолан. Реакцию (7) проводили одностадийно: растворенный  а
а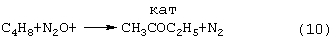
 -C4H8 – 0,7, н-бутан – 1,1, тяжелые примеси –
-C4H8 – 0,7, н-бутан – 1,1, тяжелые примеси –