Патент на изобретение №2293986
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ДИСБАКТЕРИОЗОВ ВЛАГАЛИЩА
(57) Реферат:
Изобретение относится к микробиологии, может быть использовано для диагностики неспецифических инфекционно-воспалительных заболеваний влагалища. Способ диагностики заключается в сочетанной оценке данных микроскопии вагинальных мазков и результатов культурального исследования. В схему посева вводят обогащенную тиогликолевую среду, модифицированную кровяную среду Цейсслера и модифицированный кровяной агар или эритрит-агар. Данное изобретение обеспечивает повышение достоверности и информативности микробиологической диагностики инфекционно-воспалительных заболеваний влагалища, а также позволяет усовершенствовать лабораторную диагностику неспецифических вагинитов и дисбактериозов влагалища и создать предпосылки для оптимизации лечебно-профилактических мероприятий. 2 табл.
(56) (продолжение): CLASS=”b560m”С2, 20.02.2003. RU 2022008 C1, 30.10.1994. US 5700636, 23.12.1997. Donder GG, at al “Definition of a type of abnormal vaginal flora that is distinct from bacterial vaginosis: aerobic vaginitis” BJOG, 2002 Jan; 109(1):34-43.
Изобретение относится к микробиологии, точнее к диагностике неспецифических инфекционно-воспалительных заболеваний влагалища. Известный способ микробиологического исследования отделяемого женских половых путей описан в действующем Приказе МЗ СССР №535. Однако изложенная там методика не предусматривает выделения и количественной оценки микроаэрофилов и облигатных анаэробов, являющихся доминирующей частью вагинального микробиоценоза и индикаторами его состояния. Это приводит к большому количеству «стерильных» посевов, что противоречит реальной картине. Кроме того, хотя приказ и оговаривает необходимость предварительной микроскопии вагинальных мазков, в нем не содержится методик окраски и оценки увиденной картины (лейкоцитарная реакция, состояние эпителия, количественная и качественная оценка микрофлоры), что снижает информативность микроскопии в плане сопоставления ее результатов с результатами культурального исследования (Приказ №535 МЗ СССР Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебных учреждений, М., 1985). Существуют также методические рекомендации, составленные сотрудниками кафедры микробиологии Казанского Государственного института усовершенствования врачей. Изложенный в них способ предусматривает предварительную микроскопию вагинальных мазков, а также количественный посев с инкубацией в аэробных, анаэробных и микроаэрофильных условиях для выделения соответствующих групп микроорганизмов. Однако анаэробная техника посева и работа с культурами облигатных анаэробов малодоступна практическим лабораториям из-за высокой стоимости и трудоемкости исследования, что делает этот способ малоприемлемым для широкого применения. Кроме того, он не предусматривает выделения генитальных микоплазм, являющихся частыми участниками патологических микробиоценозов (Бактериология и бактериологическая диагностика дисбактериоза нижних отделов гениталий. Методические рекомендации для врачей-курсантов, Казань, 1991. – 21 с.). Описанные в некоторых других работах (Кира Е.Ф. Бактериальный вагиноз, С-Пб., 2001, – 363 с.; Л.В.Кудрявцева, Е.Н.Ильина, В.М.Говорун и др. Бактериальный вагиноз. Пособие для врачей М., 2001, – 28 с.) способы исследования вагинального содержимого также предусматривают применение строго анаэробной техники посева, широкого круга селективных сред, что повышает себестоимость исследования, делая его малодоступным для практических лабораторий. Кроме того, они не содержат четких критериев оценки полученных результатов. Задачей изобретения является повышение достоверности и информативности микробиологической диагностики инфекционно-воспалительных заболеваний влагалища. Поставленная задача решается тем, что в способе микробиологической диагностики дисбактериозов влагалища, заключающемся в сочетанной оценке данных микроскопии вагинальных мазков и результатов культурального исследования, в схему посева введены обогащенная тиогликолевая среда, модифицированные варианты кровяных сред, индикационные жидкие и плотные среды для мико- и уреаплазм. Технический результат – усовершенствование лабораторной диагностики неспецифических вагинитов и дисбактериозов влагалища и создание предпосылок для оптимизации лечебно-профилактических мероприятий. Способ осуществляют следующим образом. 1. Взятие материала. Материал забирает акушер-гинеколог после введения зеркала из заднего свода влагалища стерильным ватным тампоном. Для лучшего сохранения анаэробов рекомендуется использовать ватные тампоны с лизированной кровью: тампон пропитывают смесью, которая готовится следующим образом: 10 мл лизированной двукратным замораживанием и оттаиванием донорской крови и 10 мл глицерина растворяют в 80 мл изотонического раствора хлорида натрия, излишки влаги отжимают, тампоны стерилизуют при 1 атм 20 минут, хранят в холодильнике и используют в течение недели. После забора тампон помещают в 4,5 мл транспортной среды (0,4% агаризованный тиогликолевый буфер или среда «для контроля стерильности») и в течение 2 часов доставляют в лабораторию. (При необходимости в исключительных случаях допускается хранение материала в транспортной среде в холодильнике, не замораживая, в течение 18-24 часов). Параллельно готовят мазок на стекле из влагалища, уретры и цервикального канала по общепринятой методике. 2. Микроскопия Микроскопия вагинальных мазков, окрашенных по Граму, позволяет выявить некоторые облигатно-патогенные возбудители (гонококки, трихомонады), а также оценить состояние вагинального эпителия (соотношение клеток базального, промежуточного и поверхностного эпителиальных слоев, наличие «ключевых клеток»), наличие и степень выраженности лейкоцитарной реакции, количественный и качественный состав микрофлоры. Оценку общей микробной обсемененности вагинального отделяемого проводят по 4-балльной системе – по числу микробных клеток, обнаруживаемых в одном поле зрения при микроскопии с иммерсией: (А.С.Анкирская, В.В.Муравьева, 2001) – + до 10 микробных клеток в поле зрения, незначительное их количество; – ++(2+) от 11 до 100 микробных клеток в поле зрения, умеренное их количество; – +++(3+) от 100 до 1000 микробных клеток в поле зрения, большое их количество; – ++++(4+) более 1000 микробных клеток в поле зрения, массивное их количество. Качественная оценка микрофлоры включает обнаружение возбудителей ИППП (трихомонады, гонококки), а также дифференциацию различных морфотипов по их тинкториальным и морфологическим признакам. Различают морфотипы лактобацилл, фузобактерий, бактероидов, мобилункусов, лептотрихий, гарднереллы, вейллонеллы, а также грамположительных кокков, колиформных палочек, дрожжеподобных грибов. 3. Методика культурального исследования 1 день. Транспортную среду с помещенным в нее тампоном условно принимают за разведение 1/10. Для выявления энтеробактерий и некоторых неферментирующих грамотрицательных микроорганизмов (НФГОМ) делают посев тампоном с последующим растиранием петлей по секторам для получения изолированных колоний на среду Эндо; для стафилококков – на желточно-солевой агар (ЖСА); для дрожжеподобных грибов рода Candida – на среду Сабуро. Затем готовят разведения исходного материала 1/1000 и 1/100000 на агаризованном тиогликолевом буфере и из полученных разведении делают посевы: – для выявления микоплазм и уреаплазм по 0,1 мл засевают на жидкие среды для индикации микоплазм и уреаплазм (Санкт-Петербургский НИИЭМ им. Пастера); – для выявления лактобактерий – по 0,1 мл на сектора модифицированной среды Цейсслера (5% кровяной агар (КА) с добавлением 1% глюкозы и 1% дрожжевого экстракта); – для выявления гарднерелл – по 0,1 мл на сектора модифицированного КА (питательный агар или эритрит-агар с добавлением 2% эритроцитарной массы человека и 5% лошадиной сыворотки); Чашки с посевами для выявления лактобактерий и гарднерелл инкубируют в течение 48-72 часов в условиях повышенного содержания СО2 (эксикатор со свечой или СО2-инкубатор типа ГПИ-01 и др.) – для выделения и количественного учета аэробных и факультативно-анаэробных микроорганизмов и изучения их гемолизирующих свойств – по 0,1 мл на сектора 5% КА; – для выделения некоторых облигатно-анаэробных бактерий делают посев из полученных разведении по 0,1 мл в 10 мл предварительно прогретой обогащенной тиогликолевой среды (на 1000 мл добавляют 1 мл 1% раствора гемина,1 мл 1% раствора менадиона, 1 мл твина-80). 2 день. На ЖСА учитывают рост колоний стафилококка, чашки оставляют до 48 часов инкубации при комнатной температуре; на Эндо – учитывают рост условно-патогенных энтеробактерий (УПЭ) и отдельных представителей неферментирующих грамотрицательных микроорганизмов (НФГОМ); на Сабуро регистрируют рост колоний дрожжеподобных грибов, чашки оставляют при комнатной температуре до 5 суток; на секторах КА проводят количественный учет выросших микроорганизмов. На КА помимо стафилококков, УПЭ, НФГОМ, дрожжеподобных грибов возможен рост стрептококков, коринебактерий, Bacillus и др. Выросшие на питательных средах колонии микроскопируют и отснимают для накопления чистых культур. 3-4 день Окончательно учитывают рост стафилококков на ЖСА; проводят идентификацию выделенных чистых культур факультативных анаэробов(общепринятыми методами); регистрируют рост Gardnerella vaginalis на модифицированном КА (очень мелкие точечные колонии, гладкие, округлые, с ровными краями, окруженные зоной учитывают рост лактобактерий на модифицированной среде Цейсслера (мелкие или средних размеров шероховатые округлые колонии), их ориентировочную идентификацию проводят по морфологии (относительно крупные, грамположительные правильной формы равномерно окрашенные палочки, располагающиеся одиночно или цепочками), отсутствию подвижности и каталазной активности; на этой среде возможен рост также G. vaginalis (He всегда легко различить из-за нечетко видимого гемолиза), Candida (крупные белые матовые колонии); Регистрируют рост и проводят количественный учет микоплазм и уреаплазм по изменению цвета засеянных жидких индикационных питательных сред. Делают высев из пробирок, изменивших цвет, по 0,1 мл капельно на плотные питательные среды для этих микроорганизмов. 4-5 день. Проводят окончательную идентификацию и при необходимости определение чувствительности к антибиотикам выделенных культур факультативных анаэробов. Готовят препараты-мазки с роста в обогащенной тиогликолевой среде, красят по Граму, изучают морфологию выросших микроорганизмов, делают высев на кровяной агар с инкубацией в аэробных условиях. 5-7 день. Окончательно просматривают чашки со средой Сабуро; регистрируют наличие или отсутствие роста на кровяном агаре (высевы с обогащенной тиогликолевой среды), изучают морфологию выросших колоний, сопоставляют с результатами микроскопии; по морфологии, тинкториальным свойствам, отсутствию роста в аэробных условиях в ряде случаев возможно установление родовой принадлежности анаэробов (Peptococcus, Peptostreptococcus, Bacteroides, Lactobacillus, анаэробных коринеформных бактерий); изучают морфологию колоний выросших мико- и уреаплазм на плотных средах (поверхность агара просматривают под малым увеличением микроскопа, колонии уреаплазм имеют размер от 10 до 50 мкм, микоплазм – от 50 до 500 мкм, имеют характерный вид вид яичницы-глазуньи с плотным, врастающим в агар центром и нежной, более поверхностной периферией с зубчатыми краями). Окончательный учет роста на плотных средах проводят на 5 сутки инкубации. Если рост сопутствующей флоры мешает учету результатов на плотной среде для мико- и уреаплазм, результат считают сомнительным, анализ рекомендуется повторить. 4. Оценка состояния микробиоценоза влагалища. По окончании исследования проводят анализ полученных результатов, сопоставление данных культурального исследования с результатами микроскопии вагинального мазка и дают заключение о состоянии микробиоценоза влагалища. В случаях обнаружения в мазках при микроскопии нативного материала узнаваемых морфотипов строгих анаэробов (грамотрицательные полиморфные палочки и коккобациллы, расположенные скоплениями – Bacteroides-Prevotella; грамотрицательные тонкие палочки и нити с заостренными концами – Fusobacterium; грамотрицательные нежные изогнутые палочки в виде полумесяца – Mobiluncus; грамположительные палочки, неравномерно окрашенные, более интенсивно окрашенные на концах, одиночные, в парах, палисадом – анаэробные коринеформные бактерии) в большом количестве и в отсутствие роста морфологически сходных микроорганизмов на засеянных средах делают заключение о наличии строгих анаэробов соответствующих групп в количестве свыше 105 КОЕ/мл. Оценку полученных результатов проводят по следующим критериям: О дисбиозе половых путей свидетельствуют – дефицит лактобактерий менее 104 колониеобразующих единиц /мл; – увеличение содержания условно-патогенных микроорганизмов (УПМ) аэробной, факультативно-анаэробной и облигатно-анаэробной групп более 104 КОЕ/мл; – наличие УПМ в ассоциациях более чем из 2 видов; – наличие гемолизирующих микроорганизмов, в т.ч. гемолизирующих свойств у лактобактерий. Изобретение иллюстрируется следующими примерами. Пример 1. Больная Р., 45 лет, обратилась по поводу патологических выделений из половых путей, сопровождающихся дискомфортом, зудом в области наружных половых органов. Неоднократно лечилась по поводу хронического рецидивирующего кандидоза противогрибковыми препаратами без выраженного эффекта.
Заключение: Увеличено содержание условно-патогенных микроорганизмов в ассоциации G.vaginalis + E.coli + Ureaplasma urealyticum при относительном дефиците лактобактерий. Как видно из примера, хронический воспалительный процесс во влагалище, первоначально вызванный грибами рода кандида, в результате длительного лечения без микробиологического контроля привел к развитию дисбактериоза влагалища, характеризующегося низким содержанием облигатных микроорганизмов – лактобактерий – при избыточном количестве гарднерелл и кишечной палочки в ассоциации с уреаплазмами. Результат позволяет скорректировать лечение с учетом возбудителей, поддерживающих патологический процесс. Для факультативно-анаэробной группы возбудителей также указывается чувствительность выделенных микроорганизмов к антибактериальным препаратам Пример 2. Больная М., 38 лет, после курса комплексной терапии воспалительного процесса придатков отметила усиление выделений из влагалища. Других жалоб (зуд, жжение, дискомфорт) не предъявляет.
Заключение: Дефицит лактобактерий при избыточном содержании Gardnerella vaginalis в ассоциации с облигатными анаэробами родов Bacteroides, Mobiluncus. Отмечен рост грибов рода Candida в допустимой концентрации. В данном случае результат исследования выявляет картину бактериального вагиноза, по-видимому, явившегося следствием антибактериальной терапии. Массивное количество грамвариабельных коккобацилл, а также характерных по морфологии бактерий рода Mobiluncus, обнаруживаемое при микроскопии при росте G.vaginalis в концентрации 10 КОЕ/мл и отсутствии роста факультативных анаэробов позволяет сделать заключение о наличии облигатных анаэробов родов Bacteroides и Mobiluncus в количестве, превышающем допустимый предел. Обращает на себя внимание обнаружение грибов рода Candida в низкой концентрации, не выявляемое при микроскопии, но имеющее значение в плане прогноза.
Формула изобретения
Способ микробиологической диагностики дисбактериоза влагалища, заключающийся в сочетанной оценке данных микроскопии вагинальных мазков и результатов культурального исследования, отличающийся тем, что в схему посева введены обогащенная тиогликолевая среда, содержащая на 1000 мл 1 мл 1%-ного раствора гемина, 1 мл 1%-ного раствора менадиона и 1 мл твина-80, модифицированные варианты кровяных сред, а именно: модифицированная среда Цейсслера, содержащая 5% кровяного агара с добавлением 1% глюкозы и 1% дрожжевого экстракта, и модифицированный кровяной агар, содержащий питательный агар или эритрит-агар с добавлением 2% эритроцитарной массы человека и 5% лошадиной сыворотки, и при дефиците лактобактерий менее 10 колониеобразующих единиц/мл, увеличении содержания условно-патогенных микроорганизмов аэробной, факультативно-анаэробной и облигатно-анаэробной групп более 10 КОЕ/мл и наличии условно-патогенных микроорганизмов в ассоциации более чем из 2 видов, а также наличии гемолизирующих микроорганизмов, в том числе гемолизирующих свойств у лактобактерий судят о дисбактериозе половых путей.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 22.02.2007
Извещение опубликовано: 20.06.2008 БИ: 17/2008
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -гемолиза. Для изучения морфологии колоний рекомендуется пользоваться лупой). Дальнейшая идентификация по морфологии (грамотрицательные или грамвариабельные мелкие полиморфные палочки), отсутствию оксидазной и каталазной активности, а также в реакции непрямой иммунофлюоресценции;
-гемолиза. Для изучения морфологии колоний рекомендуется пользоваться лупой). Дальнейшая идентификация по морфологии (грамотрицательные или грамвариабельные мелкие полиморфные палочки), отсутствию оксидазной и каталазной активности, а также в реакции непрямой иммунофлюоресценции;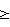 104
104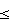 104
104