|
|
(21), (22) Заявка: 2004132640/15, 09.11.2004
(24) Дата начала отсчета срока действия патента:
09.11.2004
(43) Дата публикации заявки: 27.04.2006
(46) Опубликовано: 20.02.2007
(56) Список документов, цитированных в отчете о
поиске:
ВФС 42-2080-91, 22.11.1991. US 4650771 A1, 17.03.1987. СОХ S.K. at all., «Monoethylglycinexylidide and lidocaine determination in porcine microsomal preparations.» J. Pharm Biomed Anal. 2005 Apr 1; V.37(4), P.801-804. MAGGIORELLI E., «Identification and determination of lidocaine. Its differentiation from acetanilide, procaine, benzocaine, amylocaine»., Boll. Chem. Farm., 1960, Jan., 99, P.8-14.
Адрес для переписки:
625023, г.Тюмень, ул. Одесская, 54, ТГМА, научный отдел, Л.Б. Козлову
|
(72) Автор(ы):
Нохрин Дмитрий Фокеевич (RU),
Колмакова Людмила Сергеевна (RU),
Сараева Ольга Артемовна (RU),
Николайчик Оксана Петровна (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования Тюменская государственная медицинская академия (ГОУ ВПО ТюмГМА Минздрава России) (RU)
|
(54) СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ЛИДОКАИНА ГИДРОХЛОРИДА
(57) Реферат:
Изобретение относится к аналитической химии, а именно к способам экстракционно-фотометрического определения производных 2,6-диметиланилина в препарате и лекарственных формах. Сущность способа заключается в том, что для определения лидокаина гидрохлорида нами применен в качестве реагента салицилатный комплекс меди (II) с последующей экстракцией полученного окрашенного соединения хлороформом и фотометрированием экстракта. К раствору препарата добавляют растворы сульфата меди (II) и салицилата натрия, взятые в объемных соотношениях 0,8-1,8:1,0-2,2 мл на объем анализируемой пробы 1 мл 1% раствора лидокаина гидрохлорида. После обработки реагентом смесь экстрагируют хлороформом и измеряют оптическую плотность экстракта при длине волны  =750 нм с последующим определением лидокаина гидрохлорида по калибровочному графику. Технический результат: повышение специфичности, селективности, доступности способа в присутствии продуктов разложения анализируемого вещества. Способ может быть использован для работы контрольно-аналитических лабораторий. 7 табл., 1 ил. =750 нм с последующим определением лидокаина гидрохлорида по калибровочному графику. Технический результат: повышение специфичности, селективности, доступности способа в присутствии продуктов разложения анализируемого вещества. Способ может быть использован для работы контрольно-аналитических лабораторий. 7 табл., 1 ил.
Изобретение относится к аналитической химии, а именно к способам экстракционно-фотометрического определения производных 2,6-диметиланилина в препарате и лекарственных формах.
В литературе описан метод неводного титрования лидокаина гидрохлорида (2-диэтиламино-2 ,6 ,6 -диметилацетанилида гидрохлорида моногидрат) (Временная фармакопейная статья 42-2080-91), взятый нами за прототип, сущность которого заключается в следующем: 0,2 г препарата (точная навеска) растворяют в 1 мл кислоты муравьиной, прибавляют 40 мл ангидрида уксусного и титруют 0,1 моль/л раствором кислоты хлорной до желтого окрашивания (индикатор – 0,05 мл раствора кристаллического фиолетового). -диметилацетанилида гидрохлорида моногидрат) (Временная фармакопейная статья 42-2080-91), взятый нами за прототип, сущность которого заключается в следующем: 0,2 г препарата (точная навеска) растворяют в 1 мл кислоты муравьиной, прибавляют 40 мл ангидрида уксусного и титруют 0,1 моль/л раствором кислоты хлорной до желтого окрашивания (индикатор – 0,05 мл раствора кристаллического фиолетового).
Недостатком такого способа является низкая специфичность реагента в присутствии продуктов разложения препарата (табл.1).
Учитывая, что препарат относится к производным амидов кислот, то под действием света, кислорода воздуха препарат разлагается до 2,6-диметиланилина и диэтиламиноуксусной кислоты. При этом препарат теряет свою фармакологическую активность, что имеет немаловажное значение при приеме его внутрь как специфического местноанестезирующего и антиаритмического средства. Недостатком такого способа является низкая специфичность метода в присутствии продуктов разложения препарата (2,6-диметиланилина и диэтиламиноуксусной кислоты), которые также обладают основными свойствами и титруются хлорной кислотой наряду с неразложившимся препаратом (табл.1).
К существенным недостаткам метода можно отнести низкую селективность реакции. Определение лидокаина гидрохлорида нельзя вести в присутствии других лекарственных веществ. Кроме того, уксусный ангидрид, хлорная кислота очень ядовиты и требуют особых мер предосторожности. Также сокращается время на один анализ с 10 до 5 минут. Уменьшается расход лекарственного препарата на один анализ с 0,2 г до 10 мг (табл.2).
Наша задача состояла в том, чтобы предложить способ количественного определения, отвечающего критериям специфичности, селективности, доступности. Предложенный нами способ отвечает вышеперечисленным критериям и может быть рекомендован для работы контрольно-аналитических лабораторий, аптекоуправлений, фармацевтических заводов, НИИ, на кафедрах фармацевтических ВУЗов и факультетов медицинских ВУЗов.
Методика проведения гидролиза лидокаина гидрохлорида
Гидролиз лекарственных веществ проводили следующим образом: в четыре пробирки помещают равные объемы субстанции лидокаина гидрохлорида (1% раствор 1 мл). К ним добавляют по 1 мл 0,1 моль/л хлористоводородной кислоты. Первую пробирку нагревают на водяной бане 5 минут, вторую 10 минут, третью 15 минут, четвертую 20 минут (табл.1).
Полученные пробы охлаждают и доводят объем до первоначального.
Из первой пробирки берут 1 мл раствора лидокаина гидрохлорида, доводят рН до 4,1-4,4, добавляют смесь растворов сульфата меди (II), салицилата натрия, воды очищенной. Экстрагируют хлороформом и измеряют оптическую плотность органической фазы. Аналогично поступали со 2-ой-4-ой пробирками. Содержание лидокаина гидрохлорида находят по калибровочному графику. Результаты исследования представлены в таблице №1.
Сущность заявляемого способа и его отличительные от прототипа признаки:
1. Определение лидокаина гидрохлорида в препарате. Точную навеску препарата растворяют в мерной колбе. К части приготовленного раствора добавляют смесь растворов сульфата меди (II), салицилата натрия, воды очищенной, экстрагируют хлороформом. Органическую фазу отделяют, фильтруют через складчатый фильтр, содержащий 0,5 г безводного сульфата натрия. Окрашенные экстракты фотометрируют против холостого опыта. Содержание лидокаина гидрохлорида находили по градуировочному (калибровочному) графику (чертеж).
2. Определение раствора лидокаина гидрохлорида в ампулах 2% – 2 мл. К содержимому одной ампулы добавляют 2 мл воды очищенной. К 1 мл полученного раствора лидокаина гидрохлорида добавляют смесь растворов сульфата меди (II), салицилата натрия, воды очищенной, экстрагируют хлороформом. Органическую фазу отделяют, фильтруют через складчатый фильтр, содержащий 0,5 г безводного сульфата натрия. Окрашенные экстракты фотометрируют против холостого опыта. Содержание лидокаина гидрохлорида находят по градуировочному (калибровочному) графику (чертеж).
Отличительными признаками заявляемого способа от прототипа являются:
1. Использование в качестве реагента смеси 0,5 моль/л раствора сульфата меди (II) и 1 моль/л раствора салицилата натрия, взятых в соотношении 0,8-1,8:1,0-2,2 мл, на объем анализированной пробы 1 мл 1% раствора лидокаина гидрохлорида с последующей экстракцией полученного окрашенного соединения хлороформом и фотометрированием экстракта. Заявляемый способ соответствует критерию «новизны».
2. Доказательства соответствия заявляемого способа критерию «существенные отличия»:
Смесь растворов сульфата меди (II) и салицилата натрия ранее не использовались для количественного определения производных 2,6-диметиланилина.
Также для количественного определения производных 2,6-диметиланилина ранее не использовались по отдельности сульфат меди (II) и салицилата натрия.
Сульфат меди (II) и салицилат натрия применяются в химико-фармацевтической практике как обычные химические реактивы для проведения качественных химических реакций на различные соединения. Например, салицилат натрия применяется для качественного обнаружения хлорида железа (III), а сульфат меди применяется для качественного обнаружения сульфаниламидных препаратов и некоторых барбитуратов (Г.А.Мелентьева. Учебник “Фармацевтическая химия”. М.: «Медицина», 1976 г., том 1, с.279, 307, 447).
В изучаемой химико-фармацевтической и патентно-технической литературе нами не обнаружено способов, в которых отличительный признак «Использование в качестве реагента смеси 0,5 моль/л раствора сульфата меди (II) и 1 моль/л раствора салицилата натрия, взятых в объемном соотношении: 0,8-1,8:1,0-2,2 мл, на объем анализируемой пробы 1 мл 1% раствора лидокаина гидрохлорида с последующие экстракцией полученного окрашенного соединения хлороформом и фотометрированием экстракта применялся бы для количественного определения лидокаина гидрохлорида с достижением указанного положительного эффекта. Следовательно, заявляемый способ соответствует критерию «существенные отличия»».
Преимуществом предлагаемого способа является высокая специфичность реагента в присутствии продуктов разложения препарата (табл.1), что имеет важное значение при определении доброкачественности лекарственных форм лидокаина гидрохлорида. В процессе хранения лидокаина гидрохлорид может терять свою физиологическую и терапевтическую активность и уже не оказывает лечебного действия на организм человека. В связи с вышесказанным предлагаемый способ приобретает наибольшую ценность, так как достоверно определяет доброкачественность препарата, способствуя охране здоровья граждан.
Преимущество предлагаемого способа также заключается в его большой селективности по сравнению с прототипом. Определению лидокаина гидрохлорида не мешают большие количества талька, крахмала, глюкозы, сахара, стеарата кальция, гексония, бензогексония, пентамина, мезатона, никотиновой кислоты, кордиамина, фтивазида, ларусана, изониазида, барбитала, фенобарбитала, метилурацила, антипирина, анальгина, бутадиона, новокаина, уротропина, коразола, этакридина, тетрациклина, пенициллина, адреналина, скополамина, кофеина, теофиллина, эфедрина, морфина.
Сравнительные данные, подтверждающие преимущества предлагаемого способа определения лидокаина гидрохлорида перед прототипом, приведены в таблице 2.
Построение градуировочного (калибровочного) графика. В делительную воронку вносили 0,5-1,5 мл 1% стандартного раствора лидокаина гидрохлорида, прибавляли смесь 0,5 моль/л раствора сульфата меди (II) и 1 моль/л раствора салицилата натрия, взятых в объемном соотношении 0,8-1,8:1,0-2,2 на объем анализированной пробы 1 мл 1% раствора лидокаина гидрохлорида и доводили объем водой до 5 мл и экстрагировали 5 мл хлороформа. Органическую фазу отделяли, фильтровали через складчатый фильтр, содержащий 0,5 г безводного сульфата натрия.
Окрашенные экстракты фотометрировали на КФК-2, l=0,5 см при длине волны  =750 нм, раствором сравнения служит хлороформ. По полученным данным строили градуировочный график. =750 нм, раствором сравнения служит хлороформ. По полученным данным строили градуировочный график.
Пример 1. Определение лидокаина гидрохлорида в препарате.
0,25 г препарата (точная навеска) растворяют в воде очищенной в мерной колбе емкостью 25 мл. К 1 мл раствора препарата добавляют смесь 0,5 моль/л раствора сульфата меди (II) и 1 моль/л раствора салицилата натрия, взятых в объемном соотношении 0,8-1,8:1,0-2,2 мл на объем анализируемой пробы 1 мл 1% раствора лидокаина гидрохлорида и воды очищенной до 5 мл и далее поступают, как описано при построении градуировочного графика. Содержание лидокаина гидрохлорида находили по градуировочному графику (чертеж).
Результаты количественного определения лидокаина гидрохлорида в препарате, подтверждающие преимущества предлагаемого способа перед прототипом, приведены в таблице 3.
Пример 2. Определение лидокаина гидрохлорида в ампулах 2% – 2,0 мл.
К содержимому одной ампулы добавляют 2 мл воды очищенной. К 1 мл полученного раствора лидокаина гидрохлорида прибавляют смесь 0,5 моль/л раствор сульфата меди (II) и 1 моль/л раствора салицилата натрия в соотношении 0,8-1,8:1,0-2,2 мл на объем анализируемой пробы 1 мл 1% раствора лидокаина гидрохлорида и воды очищенной до 5 мл, и далее поступают, как описано при построении градуировочного графика.
Содержание лидокаина гидрохлорида в лекарственной форме находили по градуировочному графику (чертеж). Результаты количественного определения лидокаина гидрохлорида в ампулах, подтверждающие преимущества предлагаемого способа перед прототипом, приведены в таблице 4.
На основании вышеизложенного можно сделать вывод, что заявляемый способ соответствует критерию «положительного эффекта».
В таблице 5 приведены оптимальные пограничные значения объемного соотношения смеси растворов сульфата меди (II) и салицилата натрия относительно объема анализируемой пробы в количестве 1 мл, в пределах которых реакция протекает без изменения, и запредельные минимальные и максимальные соотношения смеси растворов сульфата меди (II), салицилата натрия, при которых метод не воспроизводим, относительно объема пробы в количестве 1 мл.
В таблице 6 приведены примеры определения лидокаина гидрохлорида в препарате на граничные значения объемного соотношения компонентов смеси: примеры с оптимальным значением приведены в таблицах 3, 4.
В таблице 7 приведены примеры определения лидокаина гидрохлорида в препарате при запредельном минимальном и максимальном соотношении раствора сульфата меди (II) и салицилата натрия, при которых метод не воспроизводим.
Предлагаемый способ является более специфичным в присутствии продуктов гидролиза препарата, что имеет важное значение при определении доброкачественности растворов лидокаина гидрохлорида (табл.1).
Способ обладает также большей селективностью по отношению к другим органическим основаниям, что позволяет вести определение лидокаина гидрохлорида в присутствии многих лекарственных препаратов (табл.2). Кроме того, сокращается время и расход лидокаина гидрохлорида на один анализ и повышается точность определения. Относительная ошибка предлагаемого способа составляет ±0,99%.
Таблица 1
Влияние продуктов разложения лидокаина гидрохлорида на его количественное определение |
| Предлагаемый способ |
Прототип |
| (Временная фармакопейная статья 42-2080-91) |
| Введено, мг/5 мл |
Введено HCl, 0,1 моль/л, мл |
Время нагревания, мин |
Найдено, мг/5 мл |
Введено, г |
Введено HCl, 0,1 моль/л, мл |
Время нагревания, мин |
Найдено, г |
| 10 |
– |
– |
10,0 |
0,2000 |
20 |
– |
0,2010 |
| 10 |
1 |
0 |
10,0 |
0,2000 |
20 |
0 |
0,1980 |
| 10 |
1 |
5 |
9,0 |
0,2000 |
20 |
5 |
0,2000 |
| 10 |
1 |
10 |
8,0 |
0,2000 |
20 |
10 |
0,1980 |
| 10 |
1 |
15 |
7,0 |
0,2000 |
20 |
15 |
0,2020 |
| 10 |
1 |
20 |
7,0 |
0,2000 |
20 |
20 |
0,2010 |
| Примечание: Методику проведения гидролиза лидокаина гидрохлорида см. на стр.2. |
Таблица 2
Сравнительные данные, подтверждающие преимущества предлагаемого способа определения лидокаина гидрохлорида перед прототипом |
| Характеристики |
Предлагаемый способ |
Прототип |
| Время анализа |
5 минут |
10 минут |
| Расход лидокаина гидрохлорида на 1 анализ |
10 мг |
0,2 г |
| Сущность метода |
Определение ведется по фармакологически активной части молекулы (по органическому основанию) |
Определение ведется не по фармакологически активной части молекулы, потому что продукты разложения препарата тоже титруются хлорной кислотой |
| Токсичность реактивов |
Применяемые реактивы сульфат меди и салицилат натрия – не токсичны |
Хлорная кислота, уксусный ангидрид требуют особых мер предосторожности, так как сильно токсичны. |
| Специфичность метода |
Метод специфичен – позволяет определять лидокаина гидрохлорид в присутствии продуктов разложения (см. табл.1) |
Метод неспецифичен – не позволяет определять препарат в присутствии продуктов разложения (см. табл.1) |
| Селективность метода |
Не мешают определению крахмал, тальк, стеарат кальция, сахар, гексоний, бензогексоний, пентамин, мезатон, никотиновая кислота, кордиамин, фтивазид, ларусан, изониазид, барбитал, фенобарбитал, бутадион, метилурацил, антипирин, анальгин, новокаин, уротропин, этакридин, тетрациклин, морфин пенициллин, скополамин, адреналин, кофеин, эфедрин, теофиллин |
Мешают определению гексоний, бензогексоний, пентамин, мезатон, никотиновая кислота, кордиамин, фтивазид, ларусан, амизил, изониазид, барбитал, фенобарбитал, метилурацил, антипирин, анальгин, бутадион, новокаин, уротропин, этакридин, тетрациклин, пенициллин, адреналин, скополамин, кофеин, теофиллин, эфедрин, морфин |
| Относительная ошибка определения |
±0,99% |
±1,25% |
Таблица 3
Результаты количественного определения лидокаина гидрохлорида в препарате |
| Предлагаемый способ |
Прототип (Временная фармакопейная статья 42-2080-91) |
| Введено, мг/5 мл |
Найдено |
Метрологическая характеристика |
Введено, г |
Найдено |
Метрологическая характеристика |
| мг/5 мл |
% |
г |
% |
| 10 |
10,14 |
101,4 |
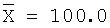 |
0,2000 |
0,1966 |
98,3 |
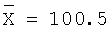 |
| 10 |
10,0 |
100,0 |
n=6 |
0,2000 |
0,1976 |
98,8 |
n=6 |
| 10 |
10,0 |
100,0 |
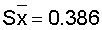 |
0,2000 |
0,2014 |
100,7 |
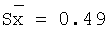 |
| 10 |
10,0 |
100,0 |
E =0.99 =0.99 |
0,2000 |
0,2038 |
101,9 |
E =1,26 =1,26 |
| 10 |
9,86 |
98,6 |
А=±0.99% |
0,2000 |
0,2030 |
101,5 |
A=±1,25% |
| 10 |
10,0 |
100,0 |
|
0,2000 |
0,2014 |
100,7 |
|
Таблица 4
Результаты количественного определения лидокаина гидрохлорида в ампулах 2% – 2,0 мл |
| Предлагаемый способ |
Прототип (нормативная документация 42-145-02) |
| Введено, мг/5 мл |
Найдено |
Метрологическая характеристика |
Введено, мг |
Найдено |
Метрологическая характеристика |
| мг/5 мл |
% |
мг |
% |
| 10,0 |
9,86 |
98,6 |
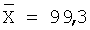 |
40,0 |
40,0 |
100,0 |
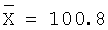 |
| 10,0 |
10,0 |
100,0 |
n=6 |
40,0 |
40,8 |
102,0 |
n=6 |
| 10,0 |
9,92 |
99,2 |
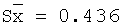 |
40,0 |
40,4 |
101,0 |
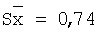 |
| 10,0 |
9,84 |
98,4 |
E =1,12 =1,12 |
40,0 |
41,2 |
103,0 |
E =1,89 =1,89 |
| 10,0 |
9,92 |
99,2 |
А=±1,12% |
40,0 |
39,2 |
98,0 |
A=±1,88% |
| 10,0 |
10,0 |
100,0 |
|
40,0 |
40,0 |
100,0 |
|
Таблица 5
Мольное соотношение растворов сульфата меди и салицилата натрия |
| Соотношение смеси |
Сульфат меди, 0,5 моль/л |
Салицилат натрия, 1 моль/л |
Лидокаина гидрохлорид, 1% раствор |
| Максимальное |
1,8 мл |
2,2 мл |
1 мл |
| Минимальное |
0,8 мл |
1,0 мл |
1 мл |
| Оптимальное |
1,0 мл |
1,5 мл |
1 мл |
| Запредельное минимальное |
0,7 мл |
0,9 мл |
1 мл |
| Запредельное максимальное |
1,9 мл |
2,3 мл |
1 мл |
Таблица 6
Результаты количественного определения лидокаина гидрохлорида в препарате при максимальном и минимальном соотношении сульфата меди и салицилата натрия |
| Минимальное соотношение |
Максимальное соотношение |
| Введено, мг/5 мл |
Найдено |
Метрологическая характеристика |
Введено, мг/5 мл |
Найдено |
Метрологическая характеристика |
| мг/5 мл |
% |
мг/5 мл |
% |
| 10,0 |
10,0 |
100,0 |
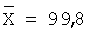 |
10,0 |
10,14 |
101,4 |
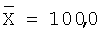 |
| 10,0 |
10,0 |
100,0 |
n=6 |
10,0 |
10,0 |
100,0 |
N=6 |
| 10,0 |
10,14 |
101,4 |
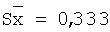 |
10,0 |
10,0 |
100,0 |
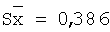 |
| 10,0 |
9,9 |
99,0 |
E =0,98 =0,98 |
10,0 |
10,0 |
100,0 |
E =0,99 =0,99 |
| 10,0 |
10,0 |
100,0 |
А=±0,97% |
10,0 |
9,86 |
98,6 |
А=±0,99% |
| 10,0 |
9,88 |
98,80 |
|
10,0 |
10,0 |
100,0 |
|
Таблица 7
Результаты количественного определения лидокаина гидрохлорида в препарате при максимальном и минимальном запредельном соотношении сульфата меди и салицилата натрия |
| Минимальное соотношение |
Максимальное соотношение |
| Введено, мг/5 мл |
Найдено |
Метрологическая характеристика |
Введено, мг/5 мл |
Найдено |
Метрологическая характеристика |
| мг/5 мл |
% |
мг/5 мл |
% |
| 10,0 |
1,5 |
15,0 |
Метод невоспроизводим, поэтому не приводим метрологическую характеристику |
10,0 |
0,5 |
5,0 |
Метод невоспроизводим, поэтому не приводим метрологическую характеристику |
| 10,0 |
0,9 |
9,0 |
10,0 |
0,6 |
6,0 |
| 10,0 |
1,0 |
10,0 |
10,0 |
0,7 |
7,0 |
| 10,0 |
1,5 |
15,0 |
10,0 |
0,5 |
5,0 |
| 10,0 |
1,0 |
10,0 |
10,0 |
0,6 |
6,0 |
| 10,0 |
0,9 |
9,0 |
10,0 |
0,7 |
7,0 |
Формула изобретения
Способ количественного определения лидокаина гидрохлорида путем обработки анализируемой пробы химическим реагентом, отличающийся тем, что в качестве химического реагента используют смесь 0,5 моль/л раствора сульфата меди (II) и 1 моль/л раствора салицилата натрия, взятых в объемных соотношениях 0,8-1,8:1,0-2,2 мл на объем анализируемой пробы 1 мл 1%-ного раствора лидокаина гидрохлорида, после обработки химическим реагентом доводят объем анализируемой пробы до 5 мл очищенной водой, экстрагируют окрашенное соединение хлороформом, фильтруют экстракт через фильтр, содержащий 0,5 г безводного сульфата натрия, фотометрируют экстракт на КФК-2, 1=0,5 см при длине волны  =750 нм с последующим определением лидокаина гидрохлорида по калибровочному графику. =750 нм с последующим определением лидокаина гидрохлорида по калибровочному графику.
РИСУНКИ
|
|