|
(21), (22) Заявка: 2004109166/04, 28.08.2002
(24) Дата начала отсчета срока действия патента:
28.08.2002
(30) Конвенционный приоритет:
28.08.2001 DE 10141984.8
(43) Дата публикации заявки: 10.10.2005
(46) Опубликовано: 20.02.2007
(56) Список документов, цитированных в отчете о
поиске:
WO 9715558 А, 01.05.1997. WO 9315104 А, 05.08.1993. RASMISSON G.H. et al. J. of Med. Chem. V.27, №12, 1984, p.1690-1701.
(85) Дата перевода заявки PCT на национальную фазу:
29.03.2004
(86) Заявка PCT:
EP 02/09587 (28.08.2002)
(87) Публикация PCT:
WO 03/020744 (13.03.2003)
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, ЕВРОМАРКПАТ, пат.пов. И.А.Веселицкой, рег. № 11
|
(72) Автор(ы):
МЕНЦЕНБАХ Бернд (DE),
ДРЁШЕР Петер (DE),
ХИЛЛИШ Александер (DE),
ЭЛЬГЕР Вальтер (DE),
ШВАЙКЕРТ Ханс-Удо (DE),
ШЁЛЛЬКОПФ Клаус (DE)
(73) Патентообладатель(и):
ШЕРИНГ АГ (DE)
|
(54) ГАЛОГЕН- И ПСЕВДОГАЛОГЕНЗАМЕЩЕННЫЕ 17-МЕТИЛЕН-4-АЗАСТЕРОИДЫ, ИХ ПРИМЕНЕНИЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат:
Описываются новые галоген- и псевдогалогензамещенные 17-метилен-4-азастероиды общей формулы (I), в которой R20 и R20a каждый независимо фтор, хлор, бром, С1-С4алкил, H цианогруппу, R4 и R10 атом водорода или метильную группу, R1 и R2 оба представляют собой атом водорода или образуют дополнительную связь. Соединения являются ингибиторами 5 -редуктазы и могут применяться для лечения заболеваний, обусловленных повышенным уровнем тестостерона и в конечном счете дигидротестостерона в крови и тканях. 7 н. и 2 з.п. ф-лы, 5 ил., 1 табл. -редуктазы и могут применяться для лечения заболеваний, обусловленных повышенным уровнем тестостерона и в конечном счете дигидротестостерона в крови и тканях. 7 н. и 2 з.п. ф-лы, 5 ил., 1 табл.
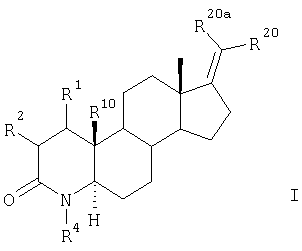
Настоящее изобретение относится к новым 17-метилен-4-азастероидам общей формулы I
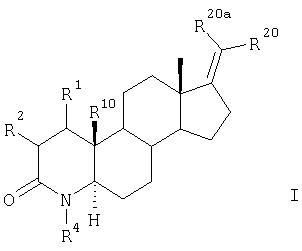
в которой
R20 и R20a – каждый независимо друг от друга представляет собой фтор, хлор, 25 бром и цианогруппу,
R4 и R10 представляют собой соответственно атом водорода или метильную группу,
R1 и R2 вместе представляют собой атом водорода или образуют дополнительную связь.
Изобретение относится также к способам получения новых соединений и их фармацевтических композиций.
Предлагаемые в изобретении 17-метилен-4-азастероиды являются новыми соединениями и их получение, равно как и их биологические свойства, до настоящего времени в каких-либо публикациях не описаны.
Согласно изобретению предпочтительные соединения из числа предлагаемых представлены в пункте 3 формулы изобретения. Объектом настоящего изобретения являются далее фармацевтические композиции, содержащие в качестве действующего вещества по меньшей мере один 17-метилен-4-азастероид общей формулы I, причем состав этих композиций может включать при необходимости также соответствующие вспомогательные вещества и носители.
Предлагаемые в изобретении соединения представляют собой ингибиторы 5 -редуктазы. Благодаря этому они могут применяться для лечения заболеваний, обусловленных повышенным уровнем тестостерона и в конечном счете дигидротестостерона в крови и тканях. -редуктазы. Благодаря этому они могут применяться для лечения заболеваний, обусловленных повышенным уровнем тестостерона и в конечном счете дигидротестостерона в крови и тканях.
Заболевания, связанные с чрезмерной активностью андрогенов, могут иметь место и при нормальном уровне тестостерона в крови, когда в ткани происходит слишком интенсивное превращение тестостерона в дигидротестостерон. Подобный эффект наблюдается, например, при идиопатических формах гирсутизма (согласно литературным источникам).
Прогестерон играет важную роль для плотного закрытия маточного зева (махендра). Снижение плотности такого закрытия перед родами является следствием локального распада прогестерона под действием 5 -редуктазы и его превращения в дигидропрогестерон, который представляет собой слабый гестаген. Поэтому благодаря подавлению катаболизма прогестерона в этой части матки предлагаемые в изобретении соединения пригодны также и для эффективного предотвращения преждевременного развития и раскрытия маточного зева. -редуктазы и его превращения в дигидропрогестерон, который представляет собой слабый гестаген. Поэтому благодаря подавлению катаболизма прогестерона в этой части матки предлагаемые в изобретении соединения пригодны также и для эффективного предотвращения преждевременного развития и раскрытия маточного зева.
Восстановленные по положению 5 метаболиты прогестерона (согласно информации, опубликованной в Lancet) и других С21-стероидов и их образующихся в организме метаболитов, например аллопрегнанолона, обладают свойствами нейростероидов и способны взаимодействовать с нейростероидами. Нарушения этих функций могут тем или иным образом отрицательно влиять на самочувствие. Возможными показаниями для применения предлагаемых в изобретении соединений являются заболевания предстательной железы, алопеция мужского типа, угри и гирсутизм, а также гинекологические расстройства, такие как предменструальный синдром, при возникновении которого важную роль играет наличие восстановленных по положению 5 метаболиты прогестерона (согласно информации, опубликованной в Lancet) и других С21-стероидов и их образующихся в организме метаболитов, например аллопрегнанолона, обладают свойствами нейростероидов и способны взаимодействовать с нейростероидами. Нарушения этих функций могут тем или иным образом отрицательно влиять на самочувствие. Возможными показаниями для применения предлагаемых в изобретении соединений являются заболевания предстательной железы, алопеция мужского типа, угри и гирсутизм, а также гинекологические расстройства, такие как предменструальный синдром, при возникновении которого важную роль играет наличие восстановленных по положению 5 метаболитов прогестерона в ЦНС. Преждевременное открытие маточного зева может быть индуцировано усиленным распадом прогестерона в этой ткани и его превращением в дигидропрогестерон. Предлагаемые в изобретении соединения способны препятствовать такому катаболизму и предотвращать тем самым преждевременное развитие шейки матки. Предлагаемые в изобретении соединения могут проявлять свою эффективность благодаря подавлению восстановления по положению 5 метаболитов прогестерона в ЦНС. Преждевременное открытие маточного зева может быть индуцировано усиленным распадом прогестерона в этой ткани и его превращением в дигидропрогестерон. Предлагаемые в изобретении соединения способны препятствовать такому катаболизму и предотвращать тем самым преждевременное развитие шейки матки. Предлагаемые в изобретении соединения могут проявлять свою эффективность благодаря подавлению восстановления по положению 5 тестостерона или прогестерона в органах и тканях, подверженных подобному нарушению. Кроме того, удается снизить уровень содержания в крови соответствующих метаболитов, восстановленных по положению 5 тестостерона или прогестерона в органах и тканях, подверженных подобному нарушению. Кроме того, удается снизить уровень содержания в крови соответствующих метаболитов, восстановленных по положению 5 . .
Предлагаемые в изобретении соединения представляют собой далее промежуточные продукты, пригодные для синтеза других фармакологически высокоэффективных стероидных продуктов.
Способы получения предлагаемых соединений представлены в пунктах 4 и 5 формулы изобретения.
Соединения по п.1 можно получать согласно изобретению из 17-метиленстероидов общей формулы II и общей формулы VII
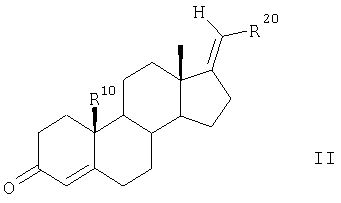 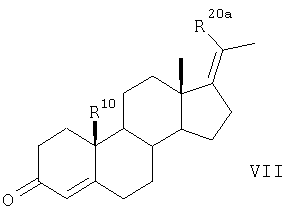
Согласно одному из вариантов соединения по п.1 получают по следующей методике.
Сначала соединения общей формулы II подвергают известным образом взаимодействию с NaIO4 при катализе с использованием KMnO4 в протонном растворителе, предпочтительно в трет-BuOH, с получением 3,5-секокетокислоты. Затем эту кислоту с помощью NH4OAc в ледяной уксусной кислоте циклизуют с образованием ненасыщенного лактама и с помощью НСООН/К2СО3 в ДМФ восстанавливают до насыщенного лактама общей формулы III
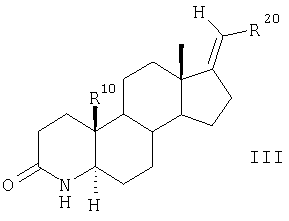
далее соединения общей формулы III взаимодействием с MeI и NaH в диполярном апротонном растворителе, предпочтительно в ДМФ, превращают в 4-метилзамещенные соединения общей формулы IV
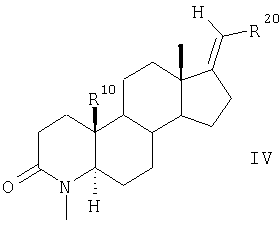
или же соединения общей формулы III путем силильного окисления 2,3-дихлор-5,6-дициано-1,4-бензохиноном (ДДХ) в диполярном апротонном растворителе, таком как диоксан, превращают в дегидрированные лактамы общей формулы V
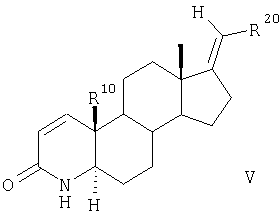
Соединения общей формулы V аналогично соединениям общей формулы III взаимодействием с MeI и NaH превращают в 4-метилзамещенные лактамы общей формулы VI
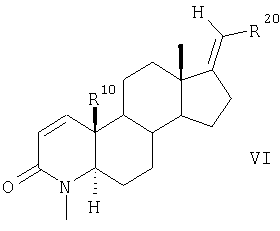
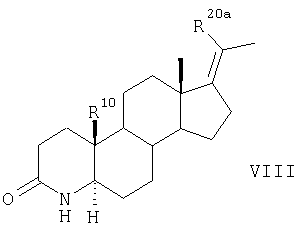
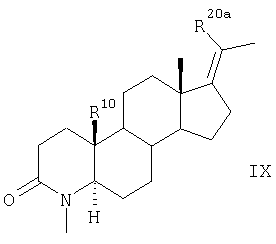
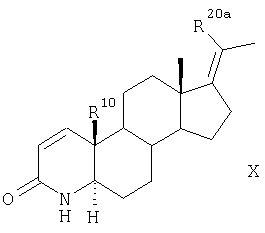
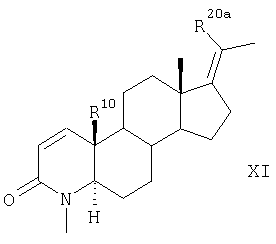
Согласно другому варианту соединения по п.1 получают в результате такого же химического превращения соединений общей формулы VII, что и соединения общей формулы II, с образованием соединений общих формул VIII, IX, Х и XI
Результаты
Исследования антиандрогенной активности проводили на кастрированных, не достигших зрелого возраста самцах крысы (см. фиг.1-5 и таблицу). Подопытным животным (по 5-10 особей в каждой группе) в течение 7 дней вводили подкожно тестостеронпропионат (ТП) и предлагаемые в изобретении субстанции (0,1 мг ТП индивидуально и соответственно 1 мг ингибитора 5 -редуктазы/животное/день). В результате введения ТП наблюдалось значительное увеличение массы ацессорных гонад (предстательной железы и семенных пузырьков). У животных же, которым вводили только носитель и только ингибитор 5 -редуктазы/животное/день). В результате введения ТП наблюдалось значительное увеличение массы ацессорных гонад (предстательной железы и семенных пузырьков). У животных же, которым вводили только носитель и только ингибитор 5 -редуктазы, подобного увеличения массы исследуемых органов не наблюдалось. Таким образом было установлено, что предлагаемые в изобретении соединения в подвергнутых тестированию системах обеспечивают эффект подавления. Приведенные в таблице результаты показывают, что соединения J 1879 и J 1924 позволяют заметно снизить (ослабить) воздействие ТП на предстательную железу и семенные пузырьки. -редуктазы, подобного увеличения массы исследуемых органов не наблюдалось. Таким образом было установлено, что предлагаемые в изобретении соединения в подвергнутых тестированию системах обеспечивают эффект подавления. Приведенные в таблице результаты показывают, что соединения J 1879 и J 1924 позволяют заметно снизить (ослабить) воздействие ТП на предстательную железу и семенные пузырьки.
Таблица
Подавление воздействия тестостеронпропионата (ТП) на рост семенных пузырьков и предстательной железы. Тест на неполовозрелых кастрированных самцах крысы, n=5-10 особей в группе, дозировка: ТП: 0,1 мг/животное/день подкожно, ингибитор 5 -редуктазы: 1 мг/животное/день подкожно, результаты, полученные при применении наполнителя и ТП, принимались за контрольные и равными 100%. -редуктазы: 1 мг/животное/день подкожно, результаты, полученные при применении наполнителя и ТП, принимались за контрольные и равными 100%. |
| ЕТ 01.31: |
Простата |
Семенной пузырек |
ТП+J 1879 |
34 |
25 |
ТП+J 1924 |
39 |
41 |
Исследования по выявлению IC50-значений для 5а-редуктазы при использовании стероидов J 1879 и J 1924 вне генитального тракта проводили на клетках костной ткани человека 4 различных линий (hOB-клетки). Клетки в течение 6 ч инкубировали с использованием в каждом случае 0,5 мкМ андростендиона (0,1 мкМ [3Н]-андростендиона, 0,4 мкМ андростендиона) с добавлением или без добавления ингибиторов в возрастающих концентрациях (1011-1018).
После инкубации среду экстрагировали хлороформом/метанолом (в объемном соотношении 2:1) и стероиды (субстрат и восстановленные по положению 5 метаболиты) разделяли с помощью тонкослойной хроматографии и определяли содержание ДНК в образцах клеток. Активность 5 метаболиты) разделяли с помощью тонкослойной хроматографии и определяли содержание ДНК в образцах клеток. Активность 5 -редуктазы (сумма образованных метаболитов, восстановленных по положению 5 -редуктазы (сумма образованных метаболитов, восстановленных по положению 5 : 5 : 5 -андростандион, 5 -андростандион, 5 -дигидротестостерон, 5 -дигидротестостерон, 5 -андростан-3 -андростан-3 ,17 ,17 -диол, 5 -диол, 5 -андростан-3 -андростан-3 ,17 ,17 -диол, выраженная в пмолях/мкг ДНК/ч) определяли соответственно по двойным образцам. Относительная активность 5 -диол, выраженная в пмолях/мкг ДНК/ч) определяли соответственно по двойным образцам. Относительная активность 5 -редуктазы (активность 5 -редуктазы (активность 5 -редуктазы в образцах с добавлением ингибиторов по сравнению с контрольными показателями, т.е. в образцах без добавления ингибиторов) указана на чертежах соответственно в качестве среднего значения ± среднее квадратичное отклонение. IC50-значения соединений J 1879 и J 1924 для 5 -редуктазы в образцах с добавлением ингибиторов по сравнению с контрольными показателями, т.е. в образцах без добавления ингибиторов) указана на чертежах соответственно в качестве среднего значения ± среднее квадратичное отклонение. IC50-значения соединений J 1879 и J 1924 для 5 -редуктазы в клетках костной ткани составляют соответственно <1010 М. -редуктазы в клетках костной ткани составляют соответственно <1010 М.
В ходе исследований по выявлению IC50-значений для соединений J 1879 и J 1924 в целях сравнения дополнительно определяли ингибирующую эффективность соединения LY 191704, нестероидного специфического ингибитора 5 -редуктазы типа 1, финастеридов, 4-азастероида с преимущественно ингибирующим действием по отношению к 5 -редуктазы типа 1, финастеридов, 4-азастероида с преимущественно ингибирующим действием по отношению к 5 -редуктазе типа 2 и прогестерона, физиологического субстрата 5 -редуктазе типа 2 и прогестерона, физиологического субстрата 5 -редуктазы, в клетках всех 4 линий при концентрации соответственно 10 М. Данные, приведенные на прилагаемых к описанию чертежах, однозначно подтверждают, что предлагаемые в изобретении соединения подавляют 5а-редуктазу в исследовавшихся типах клеток интенсивнее и в существенно более низких концентрациях по сравнению с указанными природными субстратами и контрольными соединениями. -редуктазы, в клетках всех 4 линий при концентрации соответственно 10 М. Данные, приведенные на прилагаемых к описанию чертежах, однозначно подтверждают, что предлагаемые в изобретении соединения подавляют 5а-редуктазу в исследовавшихся типах клеток интенсивнее и в существенно более низких концентрациях по сравнению с указанными природными субстратами и контрольными соединениями.
Ниже изобретение более подробно поясняется на примерах.
Пример 1
Е-17-хлорметилен-4-аза-5 -андростан-3-он -андростан-3-он
К раствору 3,1 ммоля (1,0 г) Е-17-хлорметилен-4-азаандрост-5-ен-3-она в 140 мл диметилформамида добавляют при перемешивании 59 мл муравьиной кислоты (85%-ной) и 115,8 ммоля (16 г) карбоната калия и реакционную смесь в течение 8 ч нагревают с обратным холодильником. Затем реакционный раствор смешивают с толуеном и концентрируют в вакууме. Остаток растворяют в воде и экстрагируют метиленхлоридом. Объединенные экстракты обрабатывают насыщенным раствором карбоната натрия, промывают водой до нейтрального значения рН, сушат над сульфатом натрия и концентрируют. Полученный сырой продукт перекристаллизовывают из ацетона/н-гексана и таким путем получают 543 мг твердого продукта (54%).
tпл=148-151°С; [ ]D20=+16° (CHCl3). ]D20=+16° (CHCl3).
Пример 2
Е-17-хлорметилен-4-метил-4-аза-5а-андростан-3-он
К суспензии 1,06 ммоля (340 мг) Е-17-хлорметилен-4-аза-5а-андростан-3-она в 9 мл диметилформамида добавляют при комнатной температуре в атмосфере аргона 3,08 ммоля (123 мг) гидрида натрия (60%-ного в масле). Реакционную смесь перемешивают в течение 30 мин и затем по каплям добавляют раствор 5,3 ммоля (0,33 мл) метилиодида в 3,0 мл диметилформамида. Через примерно 60 мин добавляют 2 мл насыщенного метанола, а еще через 10 мин добавляют 9 мл насыщенного водного раствора хлорида аммония. После этого реакционную смесь разбавляют водой и экстрагируют толуеном. Объединенные экстракты промывают водой, сушат над сульфатом натрия и концентрируют. Полученный сырой продукт перекристаллизовывают из ацетона/н-гексана и таким путем получают 154 мг твердого продукта (43%).
tпл=150-162°С; [ ]D 20=-7° (CHCl3). ]D 20=-7° (CHCl3).
Пример 3
Е-17-хлорметилен-4-аза-5 -андрост-1 -ен-3-он -андрост-1 -ен-3-он
1,34 ммоля (430 мг) Е-17-хлорметилен-4-аза-5 -андростан-3-она суспендируют в атмосфере аргона при комнатной температуре в 9 мл диоксана, после чего последовательно добавляют 1,5 ммоля (340 мг) 2,3-дихлор-5,6-дициано-n-бензохинона и 6,4 ммоля (1,7 мл) бис(триметилсилил)трифторацетамида. Далее перемешивают сначала в течение 3 ч при комнатной температуре, а затем в течение 3 ч в масляной бане при примерно 100-110°С. Реакционную смесь разбавляют метиленхлоридом и последовательно промывают 2%-ным водным раствором гидросульфата натрия, 2 н. соляной кислотой и водой. Образующийся экстракт сушат над сульфатом натрия и концентрируют. После перекристаллизации из ацетона получают 243 мг твердого продукта (57%). -андростан-3-она суспендируют в атмосфере аргона при комнатной температуре в 9 мл диоксана, после чего последовательно добавляют 1,5 ммоля (340 мг) 2,3-дихлор-5,6-дициано-n-бензохинона и 6,4 ммоля (1,7 мл) бис(триметилсилил)трифторацетамида. Далее перемешивают сначала в течение 3 ч при комнатной температуре, а затем в течение 3 ч в масляной бане при примерно 100-110°С. Реакционную смесь разбавляют метиленхлоридом и последовательно промывают 2%-ным водным раствором гидросульфата натрия, 2 н. соляной кислотой и водой. Образующийся экстракт сушат над сульфатом натрия и концентрируют. После перекристаллизации из ацетона получают 243 мг твердого продукта (57%).
tпл=275-282°С; [ ]D 20=-41° (CHCl3). ]D 20=-41° (CHCl3).
Пример 4
Е-17-хлорметилен-4-метил-4-аза-5 -андрост-1-ен-3-он -андрост-1-ен-3-он
К суспензии 0,87 ммоля (279 мг) Е-17-хлорметилен-4-аза-5 -андрост-1-ен-3-она в 7 мл диметилформамида добавляют при комнатной температуре в атмосфере аргона 2,4 ммоля (98 мг) гидрида натрия (60%-ного в масле). Реакционную смесь перемешивают в течение 30 мин и затем по каплям добавляют раствор 7,5 ммоля (0,47 мл) метилиодида в 3 мл диметилформамида. Через примерно 60 мин добавляют 2 мл метанола и еще через 10 мин добавляют 9 мл насыщенного водного раствора хлорида аммония. После разбавления реакционной смеси водой экстрагируют толуеном, экстракт промывают водой, сушат над сульфатом натрия и концентрируют. Полученный сырой продукт перекристаллизовывают из этилового эфира уксусной кислоты и таким путем получают 122 мг твердого продукта (42%). -андрост-1-ен-3-она в 7 мл диметилформамида добавляют при комнатной температуре в атмосфере аргона 2,4 ммоля (98 мг) гидрида натрия (60%-ного в масле). Реакционную смесь перемешивают в течение 30 мин и затем по каплям добавляют раствор 7,5 ммоля (0,47 мл) метилиодида в 3 мл диметилформамида. Через примерно 60 мин добавляют 2 мл метанола и еще через 10 мин добавляют 9 мл насыщенного водного раствора хлорида аммония. После разбавления реакционной смеси водой экстрагируют толуеном, экстракт промывают водой, сушат над сульфатом натрия и концентрируют. Полученный сырой продукт перекристаллизовывают из этилового эфира уксусной кислоты и таким путем получают 122 мг твердого продукта (42%).
tпл=160-165°С; [ ]D 20=-47° (CHCl3). ]D 20=-47° (CHCl3).
Пример 5
Е-17-хлорметилен-4-аза-5 -эстран-3-он -эстран-3-он
К суспензии 3,27 ммоля (1 г) Е-17-хлорметилен-4-азаэстр-5-ен-3-она в 150 мл диметилформамида добавляют при перемешивании 73,3 мл муравьиной кислоты (85%-ной) и 121,55 ммоля (16,8 г) карбоната калия и реакционную смесь нагревают в течение 12 ч с обратным холодильником. Затем реакционный раствор смешивают с толуеном и концентрируют в вакууме. Остаток растворяют в воде и экстрагируют метиленхлоридом. Объединенные экстракты обрабатывают насыщенным раствором карбоната натрия, промывают водой до нейтрального значения рН, сушат над сульфатом натрия и концентрируют.
Полученный сырой продукт перекристаллизовывают из ацетона/н-гексана и таким путем получают 461 мг твердого продукта (46%).
tпл=(178-200) 262-282°С; [ ]D 20=-21° (CHCl3). ]D 20=-21° (CHCl3).
Пример 6
Е-17-хлорметилен-4-метил-4-аза-5 -эстран-3-он -эстран-3-он
К суспензии 0,65 ммоля (200 мг) Е-17-хлорметилен-4-аза-5 -эстран-3-она в 5,8 мл диметилформамида добавляют при комнатной температуре в атмосфере аргона 1,7 ммоля (73 мг) гидрида натрия (60%-ного в масле). Реакционную смесь перемешивают в течение 30 мин и затем по каплям добавляют раствор 3,2 ммоля (0,2 мл) метилиодида в 2 мл диметилформамида. Через примерно 60 мин добавляют 1 мл метанола и еще через 10 мин добавляют 4 мл насыщенного водного раствора хлорида аммония. После этого реакционную смесь разбавляют водой и экстрагируют метиленхлоридом. Объединенные экстракты промывают водой, сушат над сульфатом натрия и концентрируют. Полученный сырой продукт очищают хроматографией на силикагеле 60 (элюент:метиленхлорид/ацетон в соотношении 8:2) и после перекристаллизации из этилацетата получают 131 мг твердого продукта (62%). -эстран-3-она в 5,8 мл диметилформамида добавляют при комнатной температуре в атмосфере аргона 1,7 ммоля (73 мг) гидрида натрия (60%-ного в масле). Реакционную смесь перемешивают в течение 30 мин и затем по каплям добавляют раствор 3,2 ммоля (0,2 мл) метилиодида в 2 мл диметилформамида. Через примерно 60 мин добавляют 1 мл метанола и еще через 10 мин добавляют 4 мл насыщенного водного раствора хлорида аммония. После этого реакционную смесь разбавляют водой и экстрагируют метиленхлоридом. Объединенные экстракты промывают водой, сушат над сульфатом натрия и концентрируют. Полученный сырой продукт очищают хроматографией на силикагеле 60 (элюент:метиленхлорид/ацетон в соотношении 8:2) и после перекристаллизации из этилацетата получают 131 мг твердого продукта (62%).
tпл=161-171°С; [ ]D 20=-88° (CHCl3). ]D 20=-88° (CHCl3).
Пример 7
Е-17-хлорметилен-4-аза-5 -эстр-1-ен-3-он -эстр-1-ен-3-он
1 ммоль (310 мг) Е-17-хлорметилен-4-аза-5 -эстран-3-она суспендируют в атмосфере аргона при комнатной температуре в 6,3 мл диоксана, после чего последовательно добавляют 2,3 ммоля (522 мг) 2,3-дихлор-5,6-дициано-п-бензохинона и 9,8 ммоля (2,6 мл) бис(триметилсилил)трифторацетамида. Далее перемешивают сначала при комнатной температуре в течение 3 ч, а затем в течение 15 ч в масляной бане при 100-110°С. Реакционный раствор разбавляют метиленхлоридом и последовательно промывают 2%-ным водным раствором гидросульфита натрия, 2 н. соляной кислотой и водой. Образующийся экстракт сушат над сульфатом натрия и концентрируют. После очистки хроматографией на силикагеле 60 (элюент: метиленхлорид/метанол в соотношении 98:2) получают 57 мг твердого продукта (18,5%). -эстран-3-она суспендируют в атмосфере аргона при комнатной температуре в 6,3 мл диоксана, после чего последовательно добавляют 2,3 ммоля (522 мг) 2,3-дихлор-5,6-дициано-п-бензохинона и 9,8 ммоля (2,6 мл) бис(триметилсилил)трифторацетамида. Далее перемешивают сначала при комнатной температуре в течение 3 ч, а затем в течение 15 ч в масляной бане при 100-110°С. Реакционный раствор разбавляют метиленхлоридом и последовательно промывают 2%-ным водным раствором гидросульфита натрия, 2 н. соляной кислотой и водой. Образующийся экстракт сушат над сульфатом натрия и концентрируют. После очистки хроматографией на силикагеле 60 (элюент: метиленхлорид/метанол в соотношении 98:2) получают 57 мг твердого продукта (18,5%).
[ ]D 20=37° (CHCl3). ]D 20=37° (CHCl3).
Пример 8
Z-1-(1′)-Хлорэтилидиенэстр-4-ен-3-он
9,74 ммоля (3,28 г) 17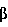 -(1′)-хлорэтил-17-гидроксиэстр-4-ен-3-она растворяли в 34 мл пиридина. Затем при слабом охлаждении и при перемешивании добавляли 12,66 ммоля (0,92 мл) тионилхлорида. Реакционную смесь перемешивали в атмосфере аргона в течение приблизительно 1 ч, а затем при охлаждении на ледяной бане добавляли воду, подкисленную соляной кислотой до рН 3-4. Клейкий (липкий) осадок экстрагировали хлористым метиленом, экстракты объединяли, промывали до нейтрального рН, сушили над сульфатом натрия и концентрировали. Осадок в виде твердого вещества очищали экспресс-хроматографией на силикагеле (элюент: толуол/(метил/этил)ацетат, 95:5) и необязательно перекристаллизацией из метанола, при этом получали 0,6 г продукта в виде твердого вещества. tпл.138-141°С, [ -(1′)-хлорэтил-17-гидроксиэстр-4-ен-3-она растворяли в 34 мл пиридина. Затем при слабом охлаждении и при перемешивании добавляли 12,66 ммоля (0,92 мл) тионилхлорида. Реакционную смесь перемешивали в атмосфере аргона в течение приблизительно 1 ч, а затем при охлаждении на ледяной бане добавляли воду, подкисленную соляной кислотой до рН 3-4. Клейкий (липкий) осадок экстрагировали хлористым метиленом, экстракты объединяли, промывали до нейтрального рН, сушили над сульфатом натрия и концентрировали. Осадок в виде твердого вещества очищали экспресс-хроматографией на силикагеле (элюент: толуол/(метил/этил)ацетат, 95:5) и необязательно перекристаллизацией из метанола, при этом получали 0,6 г продукта в виде твердого вещества. tпл.138-141°С, [ ]D 20+104° (CHCl3). ]D 20+104° (CHCl3).
Пример 9
Z-1-(1′)-Бромэтилидиенэстр-4-ен-3-он
9,7 ммоля (3,7 г) 17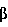 -(1′)-бромэтил-17-гидроксиэстр-4-ен-3-она растворяли в 39 мл пиридина. Затем при слабом охлаждении и при перемешивании добавляли 12,61 ммоля (0,91 мл) тионилхлорида. Реакционную смесь перемешивали в атмосфере аргона в течение приблизительно 1 ч, а затем при охлаждении на ледяной бане добавляли воду, подкисленную соляной кислотой до рН 3-4. Осадок экстрагировали хлористым метиленом, экстракты объединяли, промывали до нейтрального рН, сушили над сульфатом натрия и концентрировали. Осадок в виде пены желтого цвета очищали экспресс-хроматографией на силикагеле (элюент: н-гексан/(метил/этил)ацетат, 95:5) и необязательно перекристаллизацией из метанола/ацетона, при этом получали 536 мг продукта в виде твердого вещества светло-желтого цвета. tпл.153-158°С, [ -(1′)-бромэтил-17-гидроксиэстр-4-ен-3-она растворяли в 39 мл пиридина. Затем при слабом охлаждении и при перемешивании добавляли 12,61 ммоля (0,91 мл) тионилхлорида. Реакционную смесь перемешивали в атмосфере аргона в течение приблизительно 1 ч, а затем при охлаждении на ледяной бане добавляли воду, подкисленную соляной кислотой до рН 3-4. Осадок экстрагировали хлористым метиленом, экстракты объединяли, промывали до нейтрального рН, сушили над сульфатом натрия и концентрировали. Осадок в виде пены желтого цвета очищали экспресс-хроматографией на силикагеле (элюент: н-гексан/(метил/этил)ацетат, 95:5) и необязательно перекристаллизацией из метанола/ацетона, при этом получали 536 мг продукта в виде твердого вещества светло-желтого цвета. tпл.153-158°С, [ ]D 20+109° (CHCl3). ]D 20+109° (CHCl3).
Пример 10
Е-17-Бромметиленэстр-4-ен-3-он
28,58 ммоля (10,5 г) 17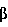 -бромметил-17-гидроксиэстр-4-ен-3-она растворяли в 90 мл пиридина. Затем при слабом охлаждении и при перемешивании добавляли 37,16 ммоля (2,7 мл) тионилхлорида. Реакционную смесь перемешивали в атмосфере аргона в течение приблизительно 1 ч, а затем при охлаждении на ледяной бане добавляли воду, подкисленную соляной кислотой до рН 3-4. Осадок желтого цвета отделяли фильтрованием и очищали экспресс-хроматографией на силикагеле (элюент: н-гексан/(метил/этил)ацетат, 85:16), при этом получали 4,85 г твердого вещества светло-желтого цвета. После перекристаллизации из ацетона получали 3,1 кристаллов белого цвета. tпл.153-164°C, [ -бромметил-17-гидроксиэстр-4-ен-3-она растворяли в 90 мл пиридина. Затем при слабом охлаждении и при перемешивании добавляли 37,16 ммоля (2,7 мл) тионилхлорида. Реакционную смесь перемешивали в атмосфере аргона в течение приблизительно 1 ч, а затем при охлаждении на ледяной бане добавляли воду, подкисленную соляной кислотой до рН 3-4. Осадок желтого цвета отделяли фильтрованием и очищали экспресс-хроматографией на силикагеле (элюент: н-гексан/(метил/этил)ацетат, 85:16), при этом получали 4,85 г твердого вещества светло-желтого цвета. После перекристаллизации из ацетона получали 3,1 кристаллов белого цвета. tпл.153-164°C, [ ]D 20+15° (CHCl3). ]D 20+15° (CHCl3).
По указанным реакциям получали следующие соединения:
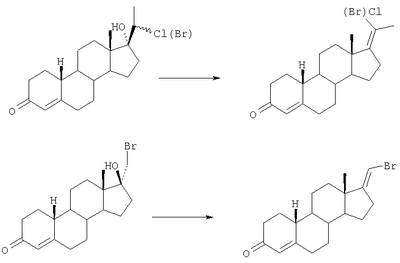
Раскрытие А-циклов проводили аналогично тому, как описано для Е-17-хлорметиленовых соединений в примерах 1-7 описания заявки.
В этом приложении приведено обоснование того, что соединения по изобретению могут ингибировать факторы, которые препятствуют возникновению/прогрессии угревой сыпи.
Происхождение угрей является сложным процессом и является результатом взаимодействия многих факторов. Решающим событием в патогенезе является блокада фоликулярных каналов волос вблизи сальной железы. Существенный вклад в этот процесс вносит продукция секрета сальных желез (кожного сала) себоцитами и пролиферация кератиноцитов. Доказано, что избыточное продуцирование кожного сала находится в прямой связи с повышенным стимулированием андрогеном. Это можно доказать клинически при лечении пациентов с угрями антиандрогенами или эстрогенами и также по недостаточному выделению кожного сала и отсутствию угрей у индивидов с врожденной недостаточностью рецепторов андрогена (Tan J.K. и др. Oral Contaceptive in the treatment of acne. Skin Therapy Lett., 6, 1 (2001), Miller J.A. и др. Anti-androgen treatment in women with acne; a controlled tial, Br. J. Dermatol., 114, 705 (1986), Greenwood R.L. и др. Acne: double blind clinical and laboratory trial of tetracycline, oesrogen-cyproterone acetate and combined treatment, Br. Med. J., (Clin. Res. Ed.), 291, 1231 (1985), Imperato-McGiniey, The androgen control of sebum production. Studies of subjects with dihydrotestjsterone deficiency and complete androgen insensitivity, J. Clin. Endocrinol. Metab., 76, 524 ff.(1993)).
Ингибиторы 5 -редуктазы предотвращают превращение тестостерона в сильно действующий андроген, 5 -редуктазы предотвращают превращение тестостерона в сильно действующий андроген, 5 -дигидротестостерон, поскольку они блокируют фермент 5а-редуктазу. Обе изоформы фермента (5 -дигидротестостерон, поскольку они блокируют фермент 5а-редуктазу. Обе изоформы фермента (5 -редуктаза тип I и тип II) распределяются в организме тканеспецифичным образом и поэтому могут обеспечивать соответствующую потребностям организма тонкую регуляцию андрогенного статуса в различных органах. Например, в таком андрогенчувствительном органе, как предстательная железа, доминирует 5 -редуктаза тип I и тип II) распределяются в организме тканеспецифичным образом и поэтому могут обеспечивать соответствующую потребностям организма тонкую регуляцию андрогенного статуса в различных органах. Например, в таком андрогенчувствительном органе, как предстательная железа, доминирует 5 -редуктаза типа II, а в коже типа I. Тканеселективное понижение андрогенного действия в коже за счет подавления трансформации тестостерона в 5 -редуктаза типа II, а в коже типа I. Тканеселективное понижение андрогенного действия в коже за счет подавления трансформации тестостерона в 5 -дигидротестостерон, соответственно в кожных придатках, требует тем не менее блокады (ингибирования) изофермента типа I. -дигидротестостерон, соответственно в кожных придатках, требует тем не менее блокады (ингибирования) изофермента типа I.
Доказательство того, что соединения по изобретению, кроме того, в условиях in vivo специфично увеличивают сальные железы, экспримирующие 5 -редуктазу типа I, получено в тесте Хершбергера при анализе препуциальных желез у крыс (см. фиг.3). -редуктазу типа I, получено в тесте Хершбергера при анализе препуциальных желез у крыс (см. фиг.3).
В отличие от этого нечувствительная предстательная железа существенно снижает массу препуциальной железы при воздействии соединений по изобретению. Поэтому ингибирующее действие соединений на побочный процесс образования угрей за счет избыточного продуцирования кожного сала сальными железами представляется вполне обоснованным.
Формула изобретения
1. Галоген- и псевдогалогензамещенные 17-метилен-4-азастероиды общей формулы I
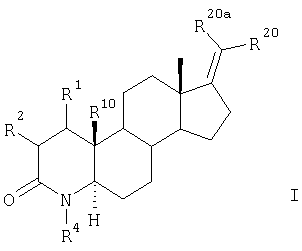
в которой
R20 и R20a каждый независимо друг от друга представляет собой фтор, хлор, бром, С1-С4алкил, цианогруппу или водород,
R10 представляет собой атом водорода или метильную группу,
R4 выбран из группы, включающей водород и С1-С4алкил,
R1 и R2 вместе представляют собой соответственно атом водорода или образуют дополнительную связь.
2. Галоген- и псевдогалогензамещенные 17-метилен-4-азастероиды по п.1, при этом
R4 обозначает Н или СН3,
R20 и R20a каждый представляет собой F, Cl, Br, Н.
3. 17-метилен-4-азастероиды по п.1, выбранные из группы, включающей
Е-17-хлорметилен-4-аза-5 -эстран-3-он, -эстран-3-он,
Е-17-хлорметилен-4-аза-5 -андростан-3-он, -андростан-3-он,
Е-17-хлорметилен-4-метил-4-аза-5 -эстран-3-он, -эстран-3-он,
Е-17-хлорметилен-4-метил-4-аза-5 -андростан-3-он, -андростан-3-он,
Е-17-хлорметилен-4-аза-5 -эстр-1-ен-3-он, -эстр-1-ен-3-он,
Е-17-хлорметилен-4-аза-5 -андрост-1-ен-3-он, -андрост-1-ен-3-он,
Е-17-хлорметилен-4-метил-4-аза-5 -андрост-1-ен-3-он, -андрост-1-ен-3-он,
Е-17-бромметилен-4-метил-4-аза-5 -эстран-3-он, -эстран-3-он,
Е-17-цианометилен-4-метил-4-аза-5 -эстран-3-он, -эстран-3-он,
Z-17-(1′)-хлорэтилиден-4-метил-4-аза-5 -андростан-3-он, -андростан-3-он,
Z-17-(1′)-хлорэтилиден-4-метил-4-аза-5 -эстран-3-он, -эстран-3-он,
Z-17-(1′)-бромметилиден-4-метил-4-аза-5 -андростан-3-он, -андростан-3-он,
Z-17-(1′)-бромметилиден-4-метил-4-аза-5 -эстран-3-он. -эстран-3-он.
4. Способ получения соединений по п.1, где
R20 представляет собой фтор, хлор, бром, С1-С4алкил,
R20a обозначает водород,
R10 представляет собой атом водорода или метильную группу,
R4 обозначает СН3,
R1 и R2 вместе представляют собой соответственно атом водорода, отличающийся тем, что 17-метиленстероиды общей формулы II
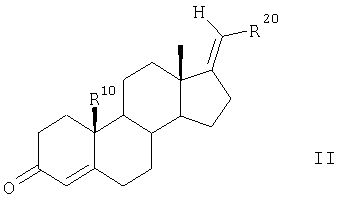
в которой
R20 обозначает фтор, хлор, бром, С1-С4алкил,
R10 представляет собой атом водорода или метильную группу,
известным образом подвергают взаимодействию с NaIO4 при катализе с использованием KMnO4 в протонном растворителе с получением 3,5-секокетокислоты, которую с помощью NH4OAC в ледяной уксусной кислоте циклизуют с образованием ненасыщенного лактама и с помощью НСООН в диметилформамиде восстанавливают до насыщенного лактама общей формулы III
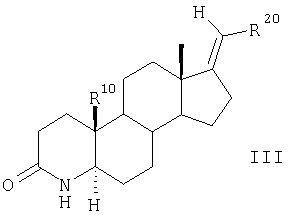
в которой заместители R20 и R10 имеют значения, указанные для формулы II,
затем соединения общей формулы III взаимодействием с MeI и NaH превращают в 4-метилзамещенные соединения общей формулы IV
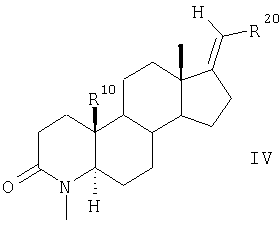
в которой заместители R20 и R10 имеют значения, указанные для формулы II.
5. Способ получения соединений по п.1, где R20 представляет собой фтор, хлор, бром, С1-С4алкил, R20a обозначает водород, R10 представляет собой атом водорода или метильную группу, R4 обозначает СН3, R1 и R2 вместе представляют собой соответственно атом водорода,
отличающийся тем, что 17-метиленстероиды общей формулы II

в которой
R20 обозначает фтор, хлор, бром, С1-С4алкил,
R10 представляет собой атом водорода или метильную группу,
аналогично п.4 подвергают взаимодействию с NaIO4 при катализе с использованием KMnO4 в протонном растворителе с получением 3,5-секокетокислоты, которую с помощью NH4OAc в ледяной уксусной кислоте циклизуют с образованием ненасыщенного лактама и с помощью НСООН в диметилформамиде восстанавливают до насыщенного лактама общей формулы III

в которой заместители R20 и R10 имеют значения, указанные для формулы II,
который далее путем окисления, опосредованного силилом, превращают в дегидрированные соединения общей формулы V, в которой заместители R20 и R10 имеют значения, указанные для формулы II,
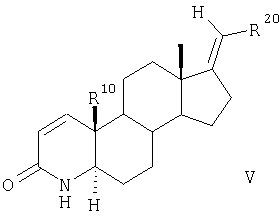
и затем соединения общей формулы V взаимодействием с СН3I и NaH превращают в 4-метилзамещенные соединения общей формулы VI
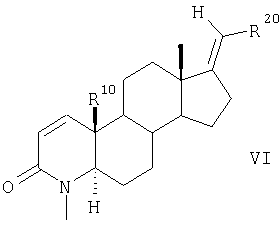
в которой заместители R20 и R10 имеют значения, указанные для формулы II.
6. Способ получения соединений по п.1, где R20a представляет собой фтор, хлор, бром, С1-С4алкил, R20 обозначает водород, R10 представляет собой атом водорода или метильную группу, R4 обозначает СН3, R1 и R2 вместе представляют собой соответственно атом водорода,
отличающийся тем, что 17-метиленстероиды общей формулы VII
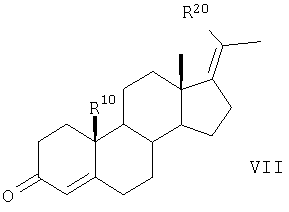
в которой
R20a представляет собой фтор, хлор, бром, С1-С4алкил,
R20 обозначает метильную группу,
R10 представляет собой атом водорода или метильную группу,
превращают аналогично указанному в п.4 способу в соединение формулы
которое далее превращают аналогично указанному в п.4 способу для соединения формулы III в соединение формулы IX
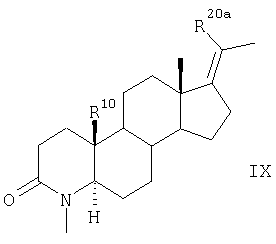
где заместители R20a и R10 имеют значения, указанные для формулы VII.
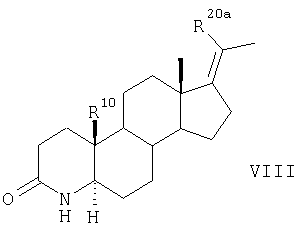
7. Способ получения соединений по п.1, где R20a представляет собой фтор, хлор, бром, С1-С4алкил, R20 обозначает водород, R10 представляет собой атом водорода или метильную группу, R4 обозначает СН3, R1 и R2 вместе представляют собой соответственно атом водорода,
отличающийся тем, что 17-метиленстероиды общей формулы VII

в которой
R20a представляет собой фтор, хлор, бром, С1-С4алкил,
R20 обозначает метильную группу, а
R10 представляет собой атом водорода или метильную группу, превращают аналогично указанному в п.5 способу для соединения формулы II в соединение формулы X,
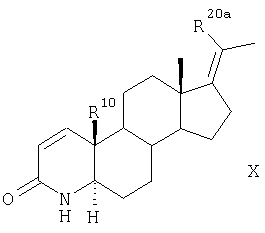
которое далее превращают аналогично указанному в п.5 способу для соединения формулы V в соединение формулы XI
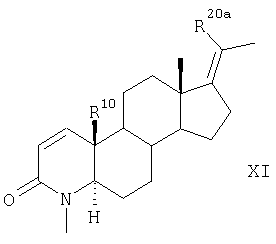
где заместители R20a и R10 имеют значения, указанные для формулы VII.
8. Фармацевтическая композиция, обладающая ингибирующим 5альфа-редуктазу действием и предназначенная для лечения заболеваний, обусловленных повышенным уровнем андрогенов, содержащая по меньшей мере один 17-метилен-4-азастероид по п.1 и при необходимости фармацевтически приемлемое вспомогательное вещество или носитель.
9. Применение по меньшей мере одного 17-метилен-4-азастероида по п.1 для получения фармацевтического препарата для лечения угревой сыпи.
РИСУНКИ
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
БАЙЕР ШЕРИНГ ФАРМА АКЦИЕНГЕЗЕЛЛЬШАФТ (DE)
Адрес для переписки:
129090, Москва, ул.Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”
Извещение опубликовано: 20.03.2010 БИ: 08/2010
|