Патент на изобретение №2293739
|
||||||||||||||||||||||||||
(54) 5
(57) Реферат:
Изобретение относится к новому соединению 5′-холинфосфат 3′-азидо-3′-дезокситимидину формулы I, обладающему противовирусной активностью. Указанное соединение способно более эффективно проникать через клеточные мембраны. 1 табл.
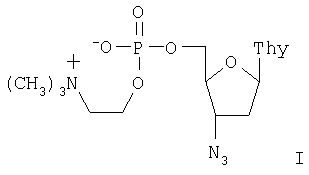
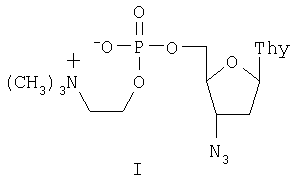
Настоящее изобретение относится к новому биологически активному производному 3′-азидо-3′-дезокситимидина, а именно, к его 5′-холинфосфату. Это соединение обладает противовирусным действием, в первую очередь против вируса иммунодефицита человека (ВИЧ). Известно, что ингибировать репродукцию вируса иммунодефицита можно на разных стадиях его жизненного цикла, но очевидно, что целесообразно использовать ингибиторы наиболее ранних процессов. Именно поэтому обратная транскриптаза ВИЧ, первый по времени функционирования фермент в цикле репликации вируса, является наиболее привлекательной мишенью для подавления размножения вируса. В настоящее время основную группу лекарств, используемых для лечения СПИД, представляют нуклеозидные предшественники ингибиторов обратной транскриптазы. К ним относятся 3′-азидо-3′-дезокситимидин (АЗТ, AZT, зидовудин, «Ретровир», «Тимазид»), 2′,3′-дидезоксицитидин (ddC, зальцитабин, «Гивид»), 2′,3′-дидезоксиинозин (ddI, диданозин, «Видекс»), 3′-дезокси-2′,3′-дидегидротимидин (d4T, ставудин, «Зерит») и 3′-тиоцитидин (3ТС, ламивудин, «Эпивир»). Главным недостатком этих соединений является необходимость их фосфорилирования в клетке до соответствующих трифосфатов, эффективность которого крайне невелика. Так процесс превращения АЗТ в организме человека в соответствующий 5′-трифосфат занимает около 1,5-2 часов. Причем лимитирующей стадией является первое фосфорилирование до монофосфата АЗТ. Поскольку выход трифосфата достигает лишь нескольких сотых долей процента, для лечения необходимо использовать большие дозы препарата. Это, в свою очередь, приводит к многочисленным побочным эффектам и быстрому вырабатыванию вирусной и клеточной резистентности. Использование в качестве лекарственных препаратов нуклеозид-5′-трифосфатов с немодифицированной трифосфатной частью невозможно из-за их низкой стабильности к действию ферментов гидролиза и вследствие этого низкой способности проникать внутрь клетки. Были предприняты попытки синтеза модифицированных нуклеозид-5′-трифосфатов (WO 98/20017). Однако соединения оказались недостаточно активны для создания лекарственного препарата. Более перспективными оказались такие формы активных нуклеозидов, которые позволили сократить процесс фосфорилирования в клетке до двух стадий, были проницаемы для клеточных мембран и достаточно долго были стабильны в кровотоке. Одним из таких соединений, описанных в Европейском патенте №0354246, является 5′-Н-фосфонат 3′-азидо-3′-дезокситимидина (Фосфазид), имеющий следующую формулу: В настоящее время Фосфазид используется в качестве лекарственного средства под названием «Никавир» для лечения СПИД (ВИЧ-инфекций). Иной подход заключается в создании эфира монофосфата АЗТ, имеющего ферментативно гидролизуемую холиновую группу. Этот подход позволяет обойти первую стадию кинирования, а положительный заряд холинового остатка компенсирует заряд фосфата. Таким образом, холинфосфат АЗТ представляет собой практически не заряженное соединение, способное эффективно проникать через клеточные мембраны. В соответствии с настоящим изобретением предлагается 5′-холинфосфат 3′-азидо-3′-дезокситимидина формулы I:
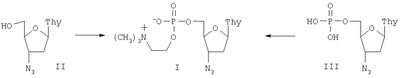
Механизм превращения соединения формулы I в активную форму внутри клетки на сегодняшний день неизвестен. Основной предполагаемый механизм заключается в том, что происходит ферментативное отщепление холиновой группы с высвобождением фосфата АЗТ. Для получения 5′-холинфосфата 3′-азидо-3′-дезокситимидина могут быть использованы два синтетических подхода. Первый из них заключается в конденсации АЗТ (II) с холинфосфатом, а по второму АЗТ монофосфат (III) реагирует с холином. По обоим методам получается соединение I, которое может быть выделено и очищено общепринятыми способами, например, экстракцией, осаждением, хроматографией и т.д. Настоящее изобретение проиллюстрировано нижеследующими примерами получения данного соединения и результатами биохимических испытаний. Пример 1. К эмульсии холинфосфата (0.353 г, 1.6 ммоль) в 0.62 мл диметилформамида прибавляют при перемешивании при комнатной температуре метансульфохлорид (244 мг, 2.13 ммоль). После растворения (около 15 мин) к полученному вязкому раствору добавляют 3′-азидо-3′-дезокситимидин (175 мг, 0.64 ммоль). Реакционную смесь перемешивают 24 ч при 37°С и затем останавливают реакцию прибавлением 25 мл 0.5М NH4НСО3. Непрореагировавший исходный и неполярные продукты экстрагируют этилацетатом (2×10 мл), водный раствор упаривают. Остаток растворяют в 1 мл воды и высаживают холинфосфат прибавлением 10 мл этанола. Маточник упаривают, остаток растворяют в 2 мл воды и хроматографируют на RP-8 колонке (2×20 см), элюируя линейным градиентом (0 1H-NMR: 7.58с (1Н, Н-6); 6.16с (J=6.5 Hz, 1Н, Н-1′); 4.38 к (J=5.7 Гц, 1Н, Н-3′); 4.21 уш.с (2Н, 31P-NMR: -0.33с. 13C-NMR: 169.3+154.6 (С-2 & С-4); 140.3 (С-6); 114.6 (С-5); 88.1 (С-1′); 85.8д (JС,Р=8.8 Гц, С-4′); 69.1 ( UV (этанол): MS: (FAB>0): 433 (MH), (FAB<0): 431 (М-Н+). HRMS: вычислено для MH+ C15H26N6O7P – 433.1601, найдено – 433,1676. Пример 2. К эмульсии холинфосфата (340 мг, 1.52 ммоль) в 0.45 мл диметилформамида прибавляют метансульфохлорид (0.232 г, 2.03 ммоль) при перемешивании при комнатной температуре. После растворения холинфосфата добавлют 3′-азидо-3′-дезокситимидин (0.187 г, 0.70 ммоль). Реакционную смесь перемешивают 3 ч при 50°С. К образовавшейся вязкой массе добавляют раствор 2,4,6-триизопропилбензолсульфонилхлорида (520 мг, 1.62 ммоль) в 1.5 мл пиридина. Реакционную смесь перемешивают 4 ч при 50°С и затем 24 ч при комнатной температуре. Обработку реакционной смеси и выделение холинфосфата АЗТ (I) осуществляют аналогично примеру 1. После очистки выделяют 136 мг (45%) соединения (I) в виде внутренней соли. Пример 3. К раствору 5′-фосфата 3′-азидо-3′-дезокситимидина (185 мг, 0.53 ммоль) в 5 мл диметилформамида добавляют холинбромид (190 мг, 1.03 ммоль) и 2,4,6-триизопропилбензолсульфонилхлорид (780 мг, 2.43 ммоль). Реакционную смесь перемешивают 24 ч при 37°С, затем упаривают диметилформамид и обрабатывают реакционную смесь аналогично примеру 1. После очистки выделяют 74 мг (32%) соединения (I) в виде внутренней соли. Пример 4. Исследование противовирусной активности 5′-холинфосфата 3′-азидо-3′-дезокситимидина в отношении ВИЧ. Исследование проводили с использованием штамма ВИЧ-1 ГКВ 4046 на перевиваемой линии чувствительных клеток МТ-4. Для заражения использовали супернатант инфицированных клеток, хранившийся в жидком азоте, множественность заражения составляла 0,2-0,5 инфекционных единиц на клетку. Суспензию клеток МТ-4 с концентрацией 2×106 в миллилитре и жизнеспособностью не менее 90% помещали в лунки 96-луночного планшета (“Cel-Cult”, Великобритания) непосредственно после внесения вируссодержащего материала и сразу же вносили исследуемый препарат, разведенный в среде RPMI-1640 без добавок до конечных концентраций 0,001-100 мкг/мл (по три лунки на каждую дозу). Контролями служили инфицированные ВИЧ-1 клетки МТ-4 без добавления препарата (вместо препарата вносили такое же количество среды RPMI-1640 без добавок), а также неинфицированные клетки. Планшет инкубировали в течение часа при 37°С для адсорбции вируса, затем клетки разводили до посевной концентрации (0,5×106 в миллилитре) питательной средой RPMI-1640 с добавлением 300 мг/мл L-глютамина и 100 мкг/мл гентамицина, а также 10% фетальной сыворотки КРС, предварительно инактивированной прогреванием при 56°С в течение 30 минут. Планшет помещали в термостат на 37°С в атмосфере 5% СО2. На 3-4 сутки культивирования подсчитывали концентрацию и жизнеспособность клеток методом исключения трипанового синего. По полученным данным определяли прирост жизнеспособности клеток относительно контроля под действием возрастающих доз препаратов. В лунки планшета добавляли Твин-80 до конечной концентрации 0,1% и помещали его на 24 часа при 4°С для инактивации ВИЧ. Затем проводили оценку анти-ВИЧ активности препарата с использованием количественного определения вирусспецифического белка р24 методом прямого иммуноферментного анализа. Дозы препарата, подавляющие прирост вирусного антигена на 50 и 90% (ID50 и ID90), определяли по графику. Полученные данные представлены в таблице. На основании этих количественных показателей ингибирования можно судить об эффективности противовирусного действия препарата, заключающейся в высокой степени подавления размножения ВИЧ-1 в культуре клеток МТ-4. Пример 5. Исследование цитотоксичности 5′-холинфосфата 3′-азидо-3′-дезокситимидина. Оценку цитотоксичности препарата проводили путем добавления его разведений в среде RPMI-1640 к клеточной суспензии МТ-4, помещенной в лунки 96-луночного планшета, до конечных концентраций 0.001-100 мкг/мл (в трех повторах) с последующим культивированием при 37°С в течение 3-4 суток. Контролем служили клетки без добавления препарата. Посевная концентрация составляла 0.5×106 в миллилитре. Жизнеспособность клеток подсчитывали в камере Горяева с предварительным окрашиванием трипановым синим. По полученным результатам были рассчитаны дозы препарата, на 50% снижающие жизнеспособность клеток по сравнению с контролем (CD50), данные приведены в таблице. Следует отметить, что токсическое действие на клетки МТ-4, выражающееся в изменении их морфологии, снижении репродуктивности и жизнеспособности, оказывали только максимальные дозы препаратов (100 мкг/мл), на 4-5 порядков превышающие эффективные в отношении ВИЧ-1 концентрации. Об избирательности действия 5′-холинфосфата 3′-азидо-3′-дезокситимидина судили по величине индекса селективности IS=CD50/ID50. Таким образом, показано, что 5′-холинфосфат 3′-азидо-3′-дезокситимидина обладает способностью ингибировать репродукцию вируса иммунодефицита человека типа 1 в культуре клеток МТ-4, причем эффективность этого препарата превышает эффективность используемого в клинической практике препарата АЗТ. Это говорит о перспективности 5′-холинфосфата 3′-азидо-3′-дезокситимидина для создания новых лекарственных форм, которые могут пополнить арсенал средств, используемых в терапии СПИД.
Формула изобретения
5′-Холинфосфат 3′-азидо-3′-дезокситимидина формулы
как антивирусный агент.
|
||||||||||||||||||||||||||

 -ХОЛИНФОСФАТ 3
-ХОЛИНФОСФАТ 3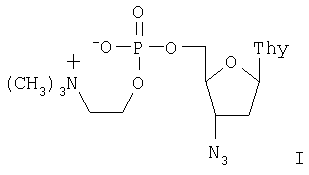

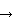 10%) метанола в 0.05 М NH4HCO3 (400 мл). После очистки выделяют 71 мг (26%) соединения (I) в виде внутренней соли.
10%) метанола в 0.05 М NH4HCO3 (400 мл). После очистки выделяют 71 мг (26%) соединения (I) в виде внутренней соли.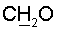 холина); 4.10-3.97 м (3Н, 2Н-5’+Н-4′); 3.60тN (jN,H=4.4 Гц, 2Н,
холина); 4.10-3.97 м (3Н, 2Н-5’+Н-4′); 3.60тN (jN,H=4.4 Гц, 2Н, 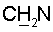 холина); 3.12с (9Н, Ме3 холина) 2.47 т (J=6.4 Гц, 2Н, 2Н-2′); 1.82т (3Н, 5-Ме).
холина); 3.12с (9Н, Ме3 холина) 2.47 т (J=6.4 Гц, 2Н, 2Н-2′); 1.82т (3Н, 5-Ме).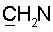 холина); 68.1д (JС,Р=4.8 Hz, С-5′); 63.3 (С-3′); 62.4д (JС,Р=4.8 Гц,
холина); 68.1д (JС,Р=4.8 Hz, С-5′); 63.3 (С-3′); 62.4д (JС,Р=4.8 Гц, 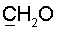 холина); 57.1 тN (JN,C=3.8, Ме3 холина); 39.2 (С-2′); 14.6 (5-Ме).
холина); 57.1 тN (JN,C=3.8, Ме3 холина); 39.2 (С-2′); 14.6 (5-Ме). max=265 (8440),
max=265 (8440),