Патент на изобретение №2293736
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) БЕНЗОТИАЗОЛЫ
(57) Реферат:
Изобретение относится к соединениям общей формулы
в которой R1 представляет собой 3,6-дигидро-2Н-пиран-4-ил, 5,6-дигидро-4Н-пиран-3-ил, 5,6-дигидро-4Н-пиран-2-ил, тетрагидропиран-2,3- или 4-ил, циклогекс-1-енил, циклогексил или представляет собой 1,2,3,6-тетрагидропиридин-4-ил или пиперидин-4-ил, которые необязательно замещены -С(O)СН3 или -С(O)ОСН3 в 1 положении атома N; R2 представляет собой низший алкил, пиперидин-1-ил, необязательно замещенный гидрокси, или представляет собой фенил, необязательно замещенный -(CH2)n-N(R’)-C(O)-(CH2)n-NR’2, -(CH2)n-галогеном, низшим алкилом или -(CH2)n-N(R’)-(СН2)n-O-низшим алкилом, или представляет собой морфолинил или пиридинил, который необязательно замещен галогеном, -N(R’)-(CH2)n-O-низшим алкилом, низшим алкилом, низшим алкокси, морфолинилом или -(СН2)n-пирролидинилом; n обозначает 0, 1 или 2; R’ представляет собой водород или низший алкил; и их фармацевтически приемлемым кислотно-аддитивным солям. Также изобретение относится к лекарственному средству, обладающему сродством к аденозиновому рецептору A2A, содержащему одно или несколько соединений общей формулы (I) и фармацевтически приемлемые эксципиенты. 2 н. и 15 з.п. ф-лы.
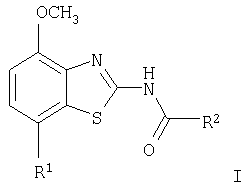
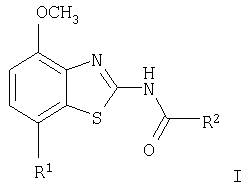
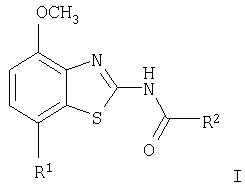
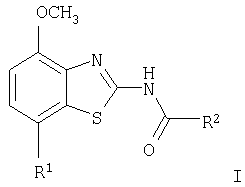
Настоящее изобретение относится к соединениям общей формулы
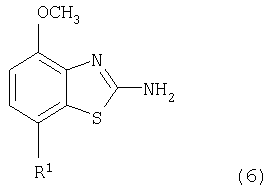
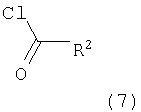
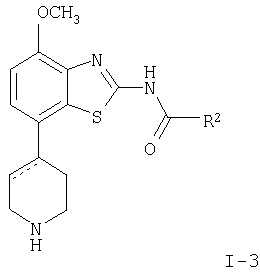
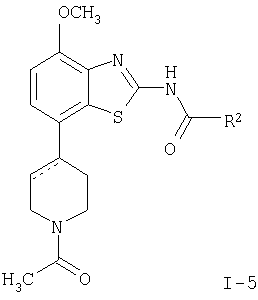
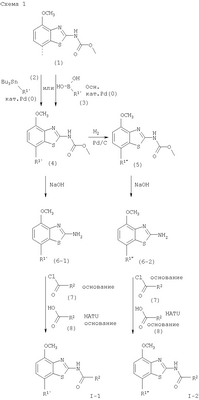
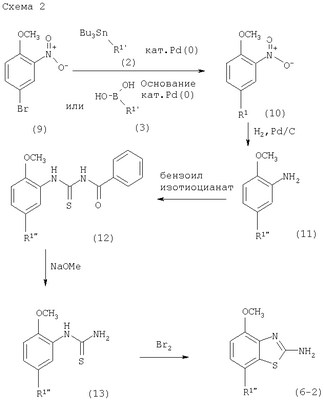
в которой R1 представляет собой 3,6-дигидро-2H-пиран-4-ил, 5,6-дигидро-4H-пиран-3-ил, 5,6-дигидро-4H-пиран-2-ил, тетрагидропиран-2,3- или 4-ил, циклогекс-1-енил, циклогексил или представляет собой 1,2,3,6-тетрагидропиридин-4-ил или пиперидин-4-ил, которые необязательно замещены -С(O)СН3 или -С(O)ОСН3 в 1 положении атома N; R2 представляет собой низший алкил, пиперидин-1-ил, необязательно замещенный гидрокси, или представляет собой фенил, необязательно замещенный -(CH2)n-N(R’)-C(O)-(CH2)n-NR’2, -(СН2)n-галогеном, низшим алкилом или -(СН2)n-N(R’)-(СН2)n-O-низшим алкилом, или представляет собой морфолинил или пиридинил, который необязательно замещен галогеном, -N(R’)-(СН2)n-O-низшим алкилом, низшим алкилом, низшим алкокси, морфолинилом или -(CH2)n-пирролидинилом; n обозначает 0, 1 или 2; R’ представляет собой водород или низший алкил; и к их фармацевтически приемлемым кислотно-аддитивным солям. Неожиданно было обнаружено, что соединения общей формулы I являются лигандами аденозинового рецептора. Конкретно, соединения настоящего изобретения имеют высокое сродство с А2А-рецептором и высокую селективность к рецепторам A1 и A3. Аденозин модулирует множество физиологических функций взаимодействием со специфическими рецепторами клеточной поверхности. Активность аденозиновых рецепторов в качестве лекарственного средства была впервые открыта в 1982 году. Аденозин связан структурно и метаболически с биоактивными нуклеотидами аденозинтрифосфатов (АТФ), аденозиндифосфатов (АДФ), аденозинмонофосфатов (АМФ) и циклических аденозинмонофосфатов (цАМФ); с биохимическим метилированным агентом S-аденосил-L-метионом (SAM) и структурно с коэнзимами NAD, FAD и коэнзимом А; и с РНК. Аденозин и эти связанные с ним соединения вместе важны для регулирования многих аспектов клеточного метаболизма и для модуляции различных действий центральной нервной системы. Рецепторы для аденозина классифицируются как рецепторы A1, A2A, А2В и A3, относясь к семейству рецепторов, связанных с G-белком. Активация аденозиновых рецепторов аденозином запускает механизм передачи сигнала. Эти механизмы зависят от G-белка, связанного с рецептором. Каждый из подтипов аденозиновых рецепторов обычно характеризуют по эффекторной системе аденилатциклазы, которая использует цАМФ в качестве вторичного мессенжера. Рецепторы A1 и A3, связанные с Gi белками, ингибируют аденилатциклазу, что приводит к уменьшению клеточных уровней цАМФ, в то время как рецепторы А2A и А2B связываются с Gs белками и активизируют аденилатциклазу, приводя к увеличению клеточных уровней цАМФ. Известно, что система рецептора A1 включает активацию фосфолипазы С и модуляцию ионных каналов калия и кальция. Подтип А3, в дополнение к его связыванию с аденилатциклазой, также стимулирует фосфолипазу С и, следовательно, активирует ионные каналы кальция. Рецептор A1 (326-328 аминокислот) был клонирован из различных видов (псовый, человеческий, крысиный, собачий, куриный, бычий, морской свинки) с 90-95% идентичностью последовательностей среди млекопитающих. Рецептор А2А (409-412 аминокислот) был клонирован из собаки, крысы, человека, морской свинки и мыши. Рецептор А2B (332 аминокислоты) был клонирован из человека и мыши с 45% гомологичностью рецепторов А2B человека с рецепторами A1 и A2A человека. Рецептор А3 (317-320 аминокислот) был клонирован из человека, крысы, собаки, кролика и овцы. Предполагается, что подтипы рецепторов A1 и A2A играют дополнительные роли в регулировании аденозином поставки энергии. Аденозин, который является метаболическим продуктом АТФ, диффундирует от клетки и действует местно, активируя аденозиновые рецепторы для уменьшения потребности кислорода (A1) или увеличения доставки кислорода (А2A), и таким образом восстанавливая баланс поставки энергии: потребность в пределах ткани. Действия обоих подтипов должны увеличить количество доступного кислорода в тканях и защищать клетки от повреждения, вызванного краткосрочной нестабильностью кислорода. Одной из важных функций эндогенного аденозина является предотвращение повреждения во время травм, таких как гипоксия, ишемия, гипотензия и эпилептический припадок. Кроме того, известно, что связывание агониста аденозинового рецептора с тучными клетками, экспрессирующими рецептор А3 крысы, приводит к увеличению концентраций инозитолтрифосфата и внутриклеточного кальция, что вызывает индуцированную антигеном секрецию воспалительных медиаторов. Поэтому рецептор А3 играет роль в медиировании приступов астмы и других аллергических реакциях. Аденозин является нейромодулятором, способным модулировать множество аспектов физиологической функции мозга. Эндогенный аденозин, центральное связующее звено между метаболизмом энергии и деятельностью нейронов, изменяется в соответствии с поведением и (пато)физиологическими состояниями. В условиях повышенной потребности и пониженной доступности энергии (таких как гипоксия, гипогликемия и/или избыточная деятельность нейронов) аденозин обеспечивает мощный защитный механизм отдачи. Взаимодействие с аденозиновыми рецепторами представляет собой многообещающую цель для терапевтического применения в многочисленных неврологических и психических болезнях, таких как эпилепсия, нарушения сна и движения (болезнь Паркинсона или Хантингтона), болезнь Альцгеймера, депрессия, шизофрения или наркомания. Повышение высвобождения нейротрансмиттеров приводит к травмам, таким как гипоксия, ишемия и эпилептические припадки. Эти нейротрансмиттеры в конечном счете отвечают за разрушение и гибель нервных клеток, что вызывает повреждение мозга или гибель индивидуума. Агонисты аденозина A1, которые имитируют центральные ингибирующие действия аденозина, могут поэтому быть полезны в качестве нейрозащитных агентов. Аденозин был предложен в качестве эндогенного антиконвульсионного агента, ингибирующего высвобождение глутамата из стимулирующих нейронов и ингибирующего нейронное сгорание. Агонисты аденозина поэтому могут использоваться в качестве противоэпилептических агентов. Антагонисты аденозина стимулируют деятельность ЦНС и, как оказывается, являются эффективными в качестве энхансеров распознавания. Селективные антагонисты A2a обладают терапевтической активностью при лечении различных форм слабоумия, например, болезни Альцгеймера и нейродегенеративных нарушений, например, припадка. Антагонисты аденозинового рецептора А2а модулируют деятельность стриарных GABA нейронов и регулируют плавные и хорошо скоординированные движения, таким образом обеспечивая возможное лечение симптомов болезни Паркинсона. Аденозин также вовлечен в многочисленное физиологические процессы, включая успокаивающее действие, гипноз, шизофрению, беспокойство, боль, дыхание, депрессию и наркоманию (амфетамин, кокаин, опиоиды, этанол, никотин, каннабиноиды). Поэтому лекарственные средства, выступающие в качестве аденозиновых рецепторов, обладают терапевтической активностью в качестве успокоительных средств, мышечных релаксантов, антипсихотических средств, транквилизаторов, анальгетиков, дыхательных стимуляторов, антидепрессантов и средств для лечения злоупотребления наркотиками. Они могут также использоваться для лечения ADHD (заболевание гиперактивности дефицита внимания). Важная роль аденозина в сердечно-сосудистой системе заключается в использовании его в качестве кардиозащитного агента. Уровни эндогенного аденозина увеличиваются в ответ на ишемию и гипоксию и защищают сердечную ткань во время травмы и после нее (предварительное состояние). Действуя на рецепторе A1, агонисты аденозина A1 могут защищать от повреждений, вызываемых миокардиальной ишемией и реперфузией. Модулирующее влияние рецепторов А2а на адренергическую функцию может иметь значение для различных заболеваний, таких как коронарная артериальная болезнь и сердечная недостаточность. Антагонисты A2a могут терапевтически применяться в ситуациях, в которых необходим повышенный антиадренергический отклик, таких как острая миокардиальная ишемия. Селективные антагонисты рецепторов А2а могут также увеличивать эффективность аденозина в устранении суправентрикулярных аритмий. Аденозин модулирует множество аспектов функции почек, включая высвобождение ренина, скорость гломерулярной фильтрации и поток крови через почки. Соединения, которые являются антагонистами почечных функций аденозина, активны в качестве почечных защитных агентов. Кроме того, антагонисты аденозина A3 и/или А2B могут быть полезны для лечения астмы и других аллергических ответов или для лечения сахарного диабета и ожирения. Многочисленные документы описывают общий уровень техники относительно аденозиновых рецепторов, например, следующие публикации: Bioorganic & Medicinal Chemistry, 6, (1998), 619-641, Bioorganic & Medicinal Chemistry, 6, (1998), 707-719, J.Med.Chem., (1998), 41, 2835-2845, J.Med.Chem., (1998), 41, 3186-3201, J.Med.Chem., (1998), 41, 2126-2133, J.Med.Chem., (1999), 42, 706-721, J.Med.Chem., (1996), 39, 1164-1171, Arch.Pharm.Med.Chem., 332, 39-41, (1999), Am.J.Physiol, 276, H1113-1116, (1999) или Naunyn Schmied, Arch.Pharmacol. 362, 375-381, (2000). Объектами настоящего изобретения являются соединения формулы I, применение соединений формулы I и их фармацевтически приемлемых солей для изготовления лекарственных средств для лечения заболеваний, связанных с аденозиновым рецептором A2, их получение, лекарственные средства, основанные на соединении в соответствии с изобретением и их получение, а также применение соединений формулы I для контроля или предотвращения заболеваний, основанных на модуляции системы аденозина, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, нейпротективное действие, шизофрения, беспокойство, боль, дефицит дыхания, депрессия, наркомания, такая как зависимость от амфетамина, кокаина, опиоидов, этанола, никотина, каннабиноидов, или для лечения астмы, аллергических реакций, гипоксии, ишемии, эпилептического припадка и токсикомании. Кроме того, соединения настоящего изобретения могут быть полезны в качестве успокоительных средств, мышечных релаксантов, антипсихотических веществ, противоэпилептических средств, антиконвульсантов и кардиозащитных агентов для заболеваний, таких как коронарная артериальная болезнь и сердечная недостаточность. Наиболее предпочтительные показания в соответствии с настоящим изобретением включают показания, которые основываются на антагонистической активности рецептора A2A и которые включают нарушения центральной нервной системы, например лечение или предотвращение болезни Альцгеймера, некоторых депрессивных нарушений, наркомании, защиты нервных клеток и болезни Паркинсона, а также ADHD. Используемый здесь термин “низший алкил” обозначает алкильную группу с насыщенной линейной или разветвленной цепью, содержащей от 1 до 6 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изо-бутил, 2-бутил, трет-бутил и т.п. Предпочтительными низшими алкильными группами являются группы с 1-4 атомами углерода. Термин “галоген” обозначает хлор, иод, фтор и бром. Термин “низший алкокси” обозначает группу, в которой алкильные остатки являются такими, как определено выше, и которая присоединена через атом кислорода. Термин “фармацевтически приемлемые кислотно-аддитивные соли” охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, сукциновая кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и т.п. Предпочтительными соединениями настоящего изобретения являются соединения формулы I, в которой R1 представляет собой 3,6-дигидро-2H-пиран-4-ил, например, следующее соединение: метиловый эфир [7-(3,6-дигидро-2H-пиран-4-ил)-4-метоксибензотиазол-2-ил]карбаминовой кислоты. Также предпочтительными являются соединения, в которых R1 представляет собой тетрагидропиран-4-ил, например, следующие соединения: 4-фтор-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]бензамид, N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-6-метилникотинамид, 2-метокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид, 2-этокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид, 2-этил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид, N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-пропилизоникотинамид, 2-изопропокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид, 2-изопропил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид, N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-пирролидин-1-илметилизоникотинамид, [4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-амид морфолин-4-карбоновой кислоты, [4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]амид 4-гидроксипиперидин-1-карбоновой кислоты, 2-(2-метоксиэтиламино)-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид или 2-[(2-метоксиэтил)метиламино]-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид. Также предпочтительными являются соединения, в которых R1 представляет собой тетрагидропиран-2-ил, например, следующие соединения: 2-бром-N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]изоникотинамид, 4-фтор-N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]бензамид, N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]-2-метилизоникотинамид или N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]-2-морфолин-4-илизоникотинамид. Дальнейшей предпочтительной группой соединений являются соединения, в которых R1 представляет собой 1,2,3,6-тетрагидропиридин-4-ил, замещенный -С(O)СН3, например, следующее соединение: N-[7-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-4-метоксибензотиазол-2-ил]-4-фторбензамид. Предпочтительными соединениями настоящего изобретения являются соединения формулы I, в которой R1 представляет собой пиперидин-4-ил, замещенный на атоме N -С(O)СН3, например, следующие соединения: N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-фторбензамид, [7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]амид морфолин-4-карбоновой кислоты, N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метилизоникотинамид, N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-{[(2-метоксиэтил)метиламино]метил}бензамид, N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-метилбензамид, N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-морфолин-4-ил-изоникотинамид или N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метоксиизоникотинамид. Предпочтительной группой соединений формулы I являются также соединения, в которых R1 представляет собой циклогекс-1-енил, например, следующее соединение: метиловый эфир (7-циклогекс-1-енил-4-метоксибензотиазол-2-ил)карбаминовой кислоты. Предпочтительными соединениями настоящего изобретения являются соединения формулы I, в которых R1 представляет собой циклогексил, например, следующие соединения: N-(7-циклогексил-4-метоксибензотиазол-2-ил)-4-фторбензамид, N-(7-циклогексил-4-метоксибензотиазол-2-ил)-4-{[(2-метоксиэтил)метиламино]метил}бензамид или N-(7-циклогексил-4-метоксибензотиазол-2-ил)-2-пирролидин-1-илметилизоникотинамид. Соединения формулы I согласно настоящему изобретению и их фармацевтически приемлемые соли могут быть получены способами, известными из уровня техники, например, способами, описанными ниже, где способ включает а) взаимодействие соединения формулы
с соединением формулы
или с соединением формулы
с получением соединения формулы
где R1 и R2 имеют определенные выше значения, или б) гидрирование соединения формулы
с получением соединения формулы
где Х представляет собой кольцевой атом, выбранный из группы, включающей О, N или С, который может находиться в различных положениях кольца, и где атом кольцевой N может быть замещен -С(O)СН3 или -С(O)ОСН3, или в) взаимодействие соединения формулы
с Ас2О с получением соединения формулы
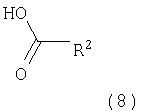
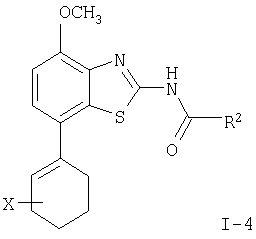
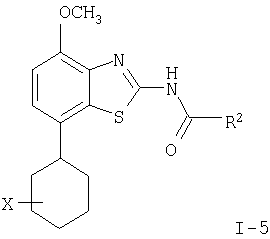
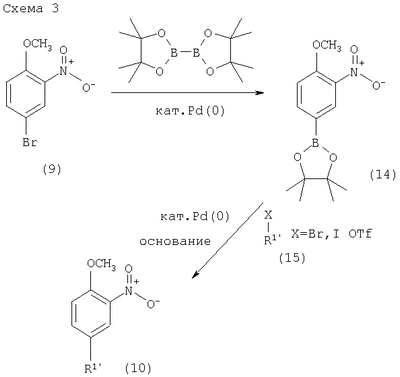
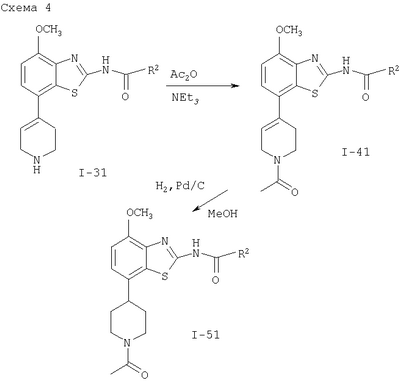
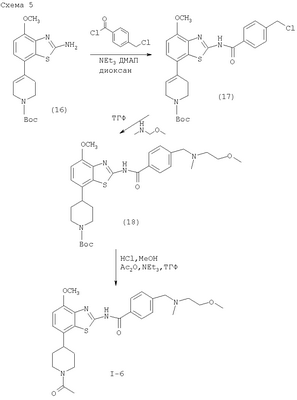
где пунктирная линия может обозначать связь, и R2 имеет определенные выше значения, и при необходимости, преобразование полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли. Соединения формулы I могут быть получены в соответствии с вариантами способа а)-в) и в соответствии со следующими схемами 1-5. где R1′ представляет собой 3,6-дигидро-2H-пиран-4-ил, 5,6-дигидро-4H-пиран-3-ил, 5,6-дигидро-4Н-пиран-2-ил, циклогекс-1-енил или 1,2,3,6-тетрагидропиридин-4-ил и R” представляет собой тетрагидропиран-2,3- или 4-ил, циклогексил или пиперидин-4-ил. Получение соединений формулы (4) Исходные 7-йодобензотиазольные производные формулы (1) могут быть получены способами, раскрытыми в ЕР 00113219,0. Исходные соединения трибутилстаннана формулы (2) могут быть коммерчески доступны, например, от Fluka, или могут быть получены способами, известными из уровня техники. 7-Йодобензотиазольное производное формулы (1) реагирует с избытком соединения трибутилстаннана формулы (2) в органическом растворителе, предпочтительно диоксане, содержащем палладиевый катализатор, предпочтительно бис(дибензилиденацетон)палладия (0), и каталитическое количество фосфинового лиганда, предпочтительно трифурилфосфина. Реакцию проводят при повышенной температуре, предпочтительно около 100°С, в течение около 2-24 часов, предпочтительно около 16 часов. Продукт формулы (4) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Альтернативное получение соединений формулы (4) Исходные соединения бороновой кислоты формулы (3) могут быть коммерчески доступны, например, от Fluka, или могут быть получены способами, известными из уровня техники. Соединения формулы (4) альтернативно могут быть получены обработкой 7-йодобензотиазольных производных формулы (1) избытком соединения бороновой кислоты формулы (3). Реакцию проводят в водном растворителе, предпочтительно в смеси воды и диоксана, содержащей палладиевый катализатор, предпочтительно бис(дибензилиденацетон)палладия (0), и каталитическое количество фосфинового лиганда, предпочтительно трифурилфосфина, и неорганического основания, предпочтительно карбоната натрия. Реакцию предпочтительно проводят при температуре кипения растворителя, предпочтительно около 100°С, в течение около 2-24 часов, предпочтительно около 16 часов. Продукт формулы (4) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Получение соединений формулы (5) Соединения формулы (5) могут быть получены гидрированием соединений формулы (4) в присутствии катализатора гидрирования, предпочтительно 10% палладия на угле. Эти реакции могут проводиться в различных органических растворителях, таких как метанол, этанол или тетрагидрофуран, предпочтительно метанол, при комнатной температуре и при давлении одна атмосфера или выше, предпочтительно при одной атмосфере, в течение 16-72 часов, предпочтительно около 72 часов. Продукт формулы (5) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Получение соединений формулы (6-1) или (6-2) Один способ получения соединений формулы (6-1) или (6-2) заключается в обработке соединения формулы (4) или (5) избытком гидроксида натрия или гидроксида калия в водном растворителе, предпочтительно водном этиленгликоле. Реакцию проводят при повышенной температуре, предпочтительно около 100°С, в течение около 1-16 часов, предпочтительно около 3 часов. Продукт формулы (6-1) или (6-2) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Получение соединений формулы I-1 или I-2 Один способ получения соединений формулы I-1 или I-2 заключается в обработке соединения формулы (6-1) или (6-2) небольшим избытком соответствующего ацилхлорида формулы (7), который может быть коммерчески доступным или может быть получен способами, известными из уровня техники. Реакцию проводят в апротонном органическом растворителе, предпочтительно в смеси дихлорметана и тетрагидрофурана, содержащей основание, предпочтительно N-этилдиизопропиламин или триэтиламин, при комнатной температуре в течение 2-24 часов, предпочтительно 24 часов. Продукт формулы I выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Альтернативное получение соединений формулы I-1 или I-2 Альтернативный способ получения соединений формулы I включает обработку соответствующей карбоновой кислоты формулы (8) стехиометрическим эквивалентом реагента, связывающего пептид, предпочтительно гексафторфосфатом O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония (HATU), в эфирном растворителе, предпочтительно тетрагидрофуране, содержащем основание, предпочтительно N-этилдиизопропиламин, при комнатной температуре в течение 30-90 минут, предпочтительно 1 часа. Эту смесь затем обрабатывают соединением формулы (6) в смеси растворителей, предпочтительно в смеси тетрагидрофурана, диоксана и N,N-диметилформамида, при комнатной температуре в течение 16-24 часов, предпочтительно в течение 16 часов. Продукт формулы I выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Альтернативное получение соединений формулы (6-2) Альтернативным способом получения соединений формулы (6-2) является получение из промежуточных соединений формулы (13), получение которых показано ниже на схеме реакции 2. где R1′ и R1″ определены в схеме 1. Получение соединений формулы (10) Исходные арилбромидные соединения формулы (9) могут быть коммерчески доступны, например от Fluka, или могут быть получены способами, известными из уровня техники. Исходные соединения трибутилстаннана формулы (2) могут быть коммерчески доступны, например от Fluka, или могут быть получены способами, известными из уровня техники. Арилбромидное соединение формулы (9) реагирует с избытком соединения трибутилстаннана формулы (2) в органическом растворителе, предпочтительно диоксане, содержащем палладиевый катализатор, предпочтительно бис(дибензилиденацетон)палладий (0), и каталитическое количество фосфинового лиганда, предпочтительно трифурилфосфина. Реакцию проводят при повышенной температуре, предпочтительно около 100°С, в течение приблизительно 2-24 часов, предпочтительно около 16 часов. Продукт формулы (10) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Альтернативное получение соединений формулы (10) Исходные соединения бороновой кислоты формулы (3) могут быть получены коммерчески, например от Fluka, или могут быть получены способами, известными из уровня техники. Соединения формулы (10) альтернативно могут быть получены обработкой арилбромидных соединений формулы (9) избытком соединения бороновой кислоты формулы (3). Реакцию проводят в водном растворителе, предпочтительно в смеси воды и диоксана, содержащей палладиевый катализатор, предпочтительно бис(дибензилиденацетон)палладий (0), и каталитическое количество фосфинового лиганда, предпочтительно трифурилфосфина, и неорганическое основание, предпочтительно карбонат натрия. Реакцию предпочтительно проводят при температуре кипения растворителя, предпочтительно около 100°С, в течение около 2-24 часов, предпочтительно около 16 часов. Продукт формулы (10) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Получение соединений формулы (11) Соединения формулы (11) могут быть получены гидрированием соединений формулы (10) в присутствии катализатора гидрирования, предпочтительно 10% палладия на угле. Эти реакции могут проводиться в различных органических растворителях, таких как метанол, этанол, тетрагидрофуран или дихлорметан, предпочтительно в смеси метанола и дихлорметана, при комнатной температуре и при давлении одна атмосфера или выше, предпочтительно при одной атмосфере, в течение 0,5-16 часов, предпочтительно около 1 часа. Продукт формулы (11) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Получение соединений формулы (12) Один способ получения соединений формулы (12) включает обработку соединения формулы (11) небольшим избытком бензоилизотиоцианата в ацетоне при температуре между комнатной температурой и температурой кипения, предпочтительно при комнатной температуре, в течение 10-30 минут, предпочтительно 30 минут. Продукт формулы (12) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Получение соединений формулы (13) Соединение формулы (12) обрабатывают стехиометрическим количеством алкоголята щелочного металла в соответствующем спиртовом растворителе, предпочтительно метилатом натрия в метаноле. Реакцию проводят при комнатной температуре в течение около 0,5-2 часов, предпочтительно около 1 часа. Продукт формулы (13) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Получение соединений формулы (6-2) Один способ получения соединений формулы (6-2) заключается в обработке соединения формулы (13) стехиометрическим эквивалентом брома в галогенированном органическом растворителе, предпочтительно хлороформе. Реакцию проводят при повышенной температуре, предпочтительно при температуре кипения растворителя, в течение около 12-18 часов, предпочтительно около 16 часов. Продукт формулы (6) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Альтернативное получение соединений формулы (10) Альтернативным способом получения соединений формулы (10) является получение из промежуточного соединения формулы (14), получение которого показано ниже на схеме реакции 3. где R1′ описан на схеме 1. Получение соединений формулы (14) Арилбромидное соединение формулы (9) реагирует с небольшим избытком бис(пинаколято)дибора в органическом растворителе, предпочтительно диметил сульфоксиде, содержащем палладиевый катализатор, предпочтительно дихлорметановый аддукт дихлор(1,1′-бис(дифенилфосфино)ферроцен)палладия (II), и избыток ацетата калия. Реакцию проводят при повышенной температуре, предпочтительно около 80°С, в течение около 2-24 часов, предпочтительно около 2 часов. Продукт формулы (14) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. Получение соединений Формулы (10) Исходные винилбромидные, винилйодидные или винилтрифлатные соединения формулы (15) могут быть коммерчески доступны, например от Fluka, или могут быть получены способами, известными из уровня техники. Один способ получения соединений формулы (10) заключается в обработке соединения формулы (14) соединением формулы (15) в присутствии палладиевого катализатора, предпочтительно дихлорметанового аддукта дихлор(1,1′-бис(дифенилфосфино)ферроцен)палладия (II), и неорганического основания, предпочтительно карбоната натрия. Реакцию проводят в смеси растворителей, предпочтительно в смеси этанола, толуола и воды, реакцию проводят при повышенной температуре, предпочтительно около 80°С, в течение около 0,1-2 часов, предпочтительно около 20 минут. Продукт формулы (10) выделяют обычными методами и предпочтительно очищают с помощью хроматографии или перекристаллизации. где R2 имеет значения, описанные выше. Получение соединений, описанных в вышеупомянутых схемах, проводят обычными способами. Использовались следующие сокращения:
Выделение и очистка соединений Выделение и очистка описанных здесь соединений и промежуточных соединений могут производиться, при необходимости, любой подходящей процедурой разделения или очистки, такими как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, толстослойная хроматография, препаративная жидкостная хроматография низкого или высокого давления или комбинацией этих процедур. Конкретные примеры подходящих процедур разделения и выделения можно обнаружить ниже в разделе Получение и Примеры. Однако, конечно, могут также использоваться другие эквивалентные процедуры разделения или выделения. Соли соединений Формулы I Соединения формулы I могут являться основаниями, например, когда остаток R содержит основную группу, такую как алифатическая или ароматическая аминогруппа. В таких случаях соединения формулы I могут быть преобразованы в соответствующую кислотную аддитивную соль. Преобразование проводят обработкой по крайней мере стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, манделиновая кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и добавляют кислоту в подобном растворителе. Температуру поддерживают между 0°С и 50°С. Полученную соль осаждают самостоятельно или могут перенести в раствор менее полярного растворителя. Кислотно-аддитивные соли основных соединений формулы I могут быть преобразованы в соответствующие свободные основания обработкой по крайней мере стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и т.п. Соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. Конкретно, было обнаружено, что соединения согласно настоящему изобретению являются лигандами аденозинового рецептора и обладают высоким сродством к аденозиновому рецептору A2A. Соединения были исследованы в соответствии с испытанием, приведенным далее. Аденозиновый рецептор А2A человека Аденозиновый рецептор А2A человека рекомбинантно экспрессировали в клетках яичников китайского хомячка (СНО), используя систему экспрессии вируса semliki forest. Клетки собирали, промывали дважды центрифугированием, гомогенизировали и снова промывали центрифугированием. Полученный промытый мембранный остаток суспендировали в буфере Tris (50 мМ), содержащем 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2 и 10 мМ MgCl2 (pH 7,4) (буфер А). Испытание связывания с [3H]-SCH-58261 (Dionisotti и др., 1997, Br J Pharmacol 121, 353; 1 нМ) проводили в 96-ячеечных планшетах в присутствии 2,5 мкг мембранного белка, 0,5 мг шариков Ysi-поли-1-лизина SPA и 0,1 U аденозиндеаминазы в конечном объеме буфера А 200 мкл. Неспецифическое связывание определяли с помощью представителей ксантинамина (ХАС; 2 мкМ). Соединения проверяли при 10 концентрациях от 10 мкМ до 0,3 нМ. Все испытания проводили дважды и повторяли по крайней мере два раза. Испытательные планшеты инкубировали в течение 1 часа при комнатной температуре перед центрифугированием и затем определяли связавшийся лиганд, используя сцинтилляционный счетчик Packard Topcount. Значения IC50 рассчитывали с помощью программы подгонки нелинейной кривой и значения Ki рассчитывали с помощью уравнения Cheng-Prussoff. Предпочтительные соединения показывают pKi>8,0.
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут использоваться в качестве лекарственных средств, например, в форме фармацевтических составов. Фармацевтические составы могут вводиться перорально, например, в форме таблеток, покрытых таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение, однако, может также осуществляться ректально, например, в форме свечей, парентерально, например, в форме инъекционных растворов. Соединения формулы I могут быть обработаны фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических составов. Например, в качестве носителей для таблеток, покрытых таблеток, драже и твердых желатиновых капсул могут использоваться лактоза, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и т.п. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. В зависимости от природы активного вещества, однако, обычно не требуется никаких носителей для мягких желатиновых капсул. Подходящими носителями для получения растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и т.п. Подходящими носителями для свечей являются, например, природные или закрепляющие масла, воски, жиры, полужидкие или жидкие полиолы и т.п. Фармацевтические составы, кроме того, могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульсификаторы, подслащивающие вещества, красители, отдушки, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие терапевтически полезные вещества. Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, являются также объектом настоящего изобретения, а также способ их получения, который включает введение одного или нескольких соединений формулы I и/или фармацевтически приемлемых кислотных аддитивных солей и, при необходимости, одного или нескольких других терапевтически полезных веществ в галеновую форму введения вместе с одним или несколькими терапевтически инертными носителями. В соответствии с изобретением соединения формулы I, а также их фармацевтически приемлемые соли, полезны для контролирования или предотвращения заболеваний, основанных на антагонистической активности аденозинового рецептора, таких как болезнь Альцгеймера, болезнь Паркинсона, нейропротекторное действие, шизофрения, беспокойство, боль, дефицит дыхания, депрессия, астма, аллергические реакции, гипоксия, ишемия, эпилептический припадок и токсикомания. Кроме того, соединения настоящего изобретения могут быть полезны в качестве седативных средств, мышечных релаксантов, антипсихотических средств, противоэпилептических средств, антиконвульсантов и кардиозащитных агентов и для получения соответствующих лекарственных средств. Наиболее предпочтительными показаниями в соответствии с настоящим изобретением являются показания, которые включают нарушения центральной нервной системы, например, лечение или предотвращение некоторых депрессивных заболеваний, нейропротекторное действие и болезнь Паркинсона. Дозировка может изменяться в широких пределах и, конечно, должна соответствовать индивидуальным требованиям в каждом конкретном случае. В случае перорального введения дозировка для взрослых может меняться от около 0,01 мг до около 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Ежедневная доза может вводиться как в виде разовой дозы, так и раздельными дозами, и, кроме того, верхний предел при необходимости может также быть повышен.
Следующие получение и примеры иллюстрируют изобретение, но не предназначены для ограничения его объема. Пример 1 Метиловый эфир [7-(3,6-дигидро-2H-пиран-4-ил)-4-метоксибензотиазол-2-ил]карбаминовой кислоты К перемешиваемому раствору 600 мг метилового эфира (1,65 ммоль) (7-йодо-4-метоксибензотиазол-2-ил)карбаминовой кислоты в 10 мл диоксана добавляли 1,23 г (3,30 ммоль) три-н-бутил-(3,6-дигидро-2H-пиран-4-ил)станнана, 28 мг (0,05 ммоль) бис(дибензилиденацетон)палладия и 61 мг (0,26 ммоль) трифурилфосфина. Смесь нагревали при 100°С в течение 16 часов и затем выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (1/9-1/3 этилацетат/гексан) приводила к получению 200 мг метилового эфира [7-(3,6-дигидро-2H-пиран-4-ил)-4-метоксибензотиазол-2-ил]карбаминовой кислоты в виде светло-коричневого твердого вещества. ES-MS m/e (%): 319 ([М-Н]–, 100). Пример 2 Метиловый эфир [4-метокси-7-(тетрагидропиран-4-ил)-бензотиазол-2-ил]карбаминовой кислоты К перемешиваемому раствору 200 мг (0,62 ммоль) метилового эфира [7-(3,6-дигидро-2H-пиран-4-ил)-4-метоксибензотиазол-2-ил]карбаминовой кислоты в 20 мл метанола на кончике шпателя добавляли 10% палладия на угле и смесь затем перемешивали в течение 72 часов при комнатной температуре в атмосфере водорода. Затем смесь отфильтровывали, промывали дихлорметаном и фильтрат упаривали в вакууме, получая 130 мг (64%) метилового эфира [4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]карбаминовой кислоты в виде почти белого пенистого вещества. ES-MS m/e (%): 345 (М+Na+, 9), 323 (М+Н+, 100). Пример 3 4-Фтор-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]бензамид а) 2-(4-Метокси-3-нитрофенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолан К перемешиваемому раствору 1,30 г (5,60 ммоль) 4-бром-2-нитроанизола в 25 мл ДМСО добавляли 1,57 г (6,16 ммоль) бис(пинаколято)дибора, 123 мг (0,17 ммоль) дихлорметанового аддукта дихлор(1,1′-бис(дифенилфосфино)ферроцен)палладия (II) и 1,65 г (16,8 ммоль) ацетата калия. Смесь нагревали при 80°С в течение 2 часов и затем охлаждали до комнатной температуры, выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (1/2 этилацетат/гексан, затем этилацетат) приводила к получению 1,39 г 2-(4-метокси-3-нитрофенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана в виде почти белого твердого вещества. ES-MS m/e (%): 280 (М+Н+, 100). б) 4-(4-Метокси-3-нитрофенил)-3,6-дигидро-2H-пиран К перемешиваемому раствору 4,36 г (15,6 ммоль) 2-(4-метокси-3-нитрофенил)-4,4,5,5-тетраметил-[1,3,2]диоксаборолана и 3,30 г (14,2 ммоль) 3,6-дигидро-2H-пиран-4-ильного эфира трифторметансульфоновой кислоты в 33 мл этанола и 82 мл толуола добавляли 580 мг (0,71 ммоль) дихлорметановый аддукт дихлор(1,1′-бис(дифенилфосфино)ферроцен)палладия (II). Смесь нагревали при 80°С и по каплям добавляли 16,5 мл (33,0 ммоль) 2М водного раствора карбоната натрия. Реакционную смесь перемешивали в течение 20 минут при 80°С и затем охлаждали до комнатной температуры, выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (1/4 этилацетат/гексан) приводила к получению 2,00 г (60%) 4-(4-метокси-3-нитрофенил)-3,6-дигидро-2H-пирана в виде светло-желтого твердого вещества. ES-MS m/e (%): 253 (М+NH4 +, 100), 236 (М+Н+, 24). в) 2-Метокси-5-(тетрагидропиран-4-ил)фениламин К перемешиваемому раствору 3,30 г (14,0 ммоль) 4-(4-метокси-3-нитрофенил)-3,6-дигидро-2H-пирана в 70 мл метанола и 70 мл дихлорметана на кончике шпателя добавляли 10% палладий на угле и смесь затем перемешивали в течение 20 минут при комнатной температуре в атмосфере водорода. Затем смесь отфильтровывали, промывали дихлорметаном и фильтрат упаривали в вакууме, получая 2,75 г (95%) 2-метокси-5-(тетрагидропиран-4-ил)фениламина в виде почти белого кристаллического твердого вещества. ES-MS m/e (%): 208 (М+Н+, 100). г) 1-Бензоил-3-[2-метокси-5-(тетрагидропиран-4-ил)фенил]тиомочевина К перемешиваемому раствору 2,75 г (13,3 ммоль) 2-метокси-5-(тетрагидропиран-4-ил)фениламина в 60 мл ацетона по каплям добавляли раствор 2,04 мл (15,2 ммоль) бензоилизотиоцианата в 30 мл ацетона и продолжали перемешивание в течение 30 минут при комнатной температуре. Затем смесь упаривали в вакууме. Ускоренная хроматография (1/1 этилацетат/гексан) с последующим растиранием в эфире приводила к получению 3,25 г (66%) 1-бензоил-3-[2-метокси-5-(тетрагидропиран-4-ил)фенил]тиомочевины в виде белого твердого вещества. ES-MS m/e (%): 371 (М+Н+, 100). д) [2-Метокси-5-(гетрагидропиран-4-ил)фенил]тиомочевина К перемешиваемому раствору 3,25 г (8,77 ммоль) 1-бензоил-3-[2-метокси-5-(тетрагидропиран-4-ил)фенил]тиомочевины в 45 мл метанола по каплям добавляли 0,25 мл (1,32 ммоль) 5,3М раствора метилата натрия и продолжали перемешивание в течение 1 часа при комнатной температуре. Затем смесь выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (этилацетат) приводила к получению 1,90 г (81%) [2-метокси-5-(тетрагидропиран-4-ил)фенил]тиомочевины в виде белого пенистого вещества. ES-MS m/e (%): 267 (М+Н+, 100). е) 4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламин К перемешиваемому раствору 1,90 г (7,13 ммоль) [2-метокси-5-(тетрагидропиран-4-ил)фенил]тиомочевины в 50 мл хлороформа по каплям добавляли 0,37 мл (7,22 ммоль) брома и смесь нагревали при кипячении с обратным холодильником в течение 18 часов. Затем смесь упаривали в вакууме. Остаток повторно перекристаллизовывали из этилацетата, получая 920 мг (49%) 4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламина в виде белого твердого вещества. ES-MS m/e (%): 265 (М+Н+, 100). ж) 4-Фтор-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]бензамид К перемешиваемому раствору 32 мг (0,23 ммоль) 4-фторбензойной кислоты в 5 мл ТГФ добавляли 32 мг (0,25 ммоль) HATU и 0,043 мл (0,25 ммоль) N-этилдиизопропиламина и продолжали перемешивание при комнатной температуре в течение 1 часа. Затем добавляли раствор 60 мг (0,23 ммоль) 4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламина в 5 мл диоксана и 1 мл ДМФА и продолжали перемешивание при комнатной температуре в течение 16 часов. Реакционную смесь затем выливали в 100 мл воды и экстрагировали три раза дихлорметаном. Объединенные органические фазы высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (этилацетат) с последующим растиранием в гексане приводила к получению 45 мг (51%) 4-фтор-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]бензамида в виде белого кристаллического твердого вещества. ES-MS m/e (%): 387 (М+Н+, 100). Аналогичным способом были получены: Пример 4 2-Бром-N-[4-метокси-7-(тетрагидропиран-4-ил)-бензотиазол-2-ил]изоникотинамид Из 2-бромизоникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламином в диоксане и ДМФА. ES-MS m/e (%): 450 (M{81Br}+H+, 100), 448 (M{79Br}+H+, 85). Пример 5 N-[4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-метилизоникотинамид Из хлоргидрата 2-метилизоникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламином в диоксане и ДМФА. ES-MS m/e (%): 406 (M+Na+, 46), 384 (М+Н+, 100). Пример 6 N-[4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-морфолин-4-илизоникотинамид Перемешиваемую суспензию 200 мг (0,45 ммоль) 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида, 0,39 мл (4,46 ммоль) морфолина и 291 мг (0,89 ммоль) карбоната цезия в 5 мл N-метилпирролидона в толстостенной стеклянной пробирке под давлением, оснащенной тефлоновой крышкой, нагревали при 140°С в течение 24 часов. Реакционную смесь затем охлаждали до комнатной температуры и выливали в воду. Смесь экстрагировали три раза этилацетатом и объединенные органические фазы промывали насыщенным соляным раствором, высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (1/1 этилацетат/гексан) с последующим растиранием в эфире и гексане приводила к получению 90 мг (44%) N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-морфолин-4-илизоникотинамида в виде почти белого кристаллического твердого вещества. ES-MS m/e (%): 477 (M+Na+, 13), 455 (M+H+, 100). Пример 7 4-Хлорметил-N-[4-метокси-7-(гетрагидропиран-4-ил)бензотиазол-2-ил]бензамид К перемешиваемому раствору 250 мг (0,95 ммоль) 4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламина и 0,95 мл (5,53 ммоль) N-этилдиизопропиламина в 10 мл ТГФ при комнатной температуре по каплям добавляли раствор 216 мг (1,14 ммоль) 4-(хлорметил)бензоилхлорида в 3 мл дихлорметана и продолжали перемешивание при комнатной температуре в течение 60 часов. Реакционную смесь затем упаривали в вакууме. Ускоренная хроматография (1/1 этилацетат/гексан) с последующим растиранием в эфире приводила к получению 280 мг (71%) 4-хлорметил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]бензамида в виде белого кристаллического твердого вещества. ES-MS m/e (%): 441 (М{37Cl}+Na+, 7), 439 (M{35Cl}+Na+, 21), 419 (М{37Cl}+Н+, 41), 417 (M{35Cl}+H+, 100). Пример 8 4-{[(2-Метоксиэтил)метиламино]метил}-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]бензамид Смесь 100 мг (0,24 ммоль) 4-хлорметил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]бензамида и 0,21 г (5,53 ммоль) N-этилдиизопропиламина обрабатывали ультразвуком при комнатной температуре в течение 30 минут. Реакционную смесь затем упаривали в вакууме. Ускоренная хроматография (этилацетат, затем 5/95 метанол/этилацетат) с последующим растиранием в эфире и гексане приводила к получению 75 мг (67%) 4-{[(2-метоксиэтил)метиламино]метил}-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]бензамида в виде белого кристаллического твердого вещества. ES-MS m/e (%): 470 (М+Н+, 100). Пример 9 Метиловый эфир [4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)-бензотиазол-2-ил]карбаминовой кислоты а) Трет-бутиловый эфир 4-(4-метокси-2-метоксикарбониламинобензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты К перемешиваемому раствору 2,2 г (0,006 моль) метилового эфира (7-йодо-4-метоксибензотиазол-2-ил)карбаминовой кислоты в 60 мл ДМФА добавляли 3,4 г (0,007 моль) трет-бутилового эфира 4-трибутилстаннанил-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты, 0,424 г (0,001 моль) PdCl2(PPh3)2 и 0,12 г (0,001 моль) CuI. Смесь нагревали при 100°С в течение 19 часов и затем упаривали в вакууме. Ускоренная хроматография (этилацетат/гексан 1:1) приводила к получению 0,91 г (36%) трет-бутилового эфира 4-(4-метокси-2-метоксикарбониламинобензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде светло-желтого пенистого вещества. ES-MS m/e (%): 362 ([М+Н]+, 100). б) Метиловый эфир [4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)бензотиазол-2-ил]карбаминовой кислоты 0,03 г (0,072 ммоль) трет-бутилового эфира 4-(4-метокси-2-метоксикарбониламинобензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты растворяли в 0,75 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме, переносили в 3 мл воды и рН доводили до 8 с помощью насыщенного водного бикарбоната натрия. Полученную суспензию отфильтровывали и продукт на фильтре смывали водой и высушивали в вакууме. Остаток подвергали колоночной хроматографии (дихлорметан/метанол 9:1+1% NH4OH) с получением 4 мг (18%) метилового эфира [4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)бензотиазол-2-ил]карбаминовой кислоты в виде бежевого твердого вещества. ES-MS m/e (%): 320 ([М+Н]+, 100). Пример 10 Хлоргидрат 4-фтор-N-[4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)бензотиазол-2-ил]бензамид (1:1) а) Трет-бутиловый эфир 4-(2-амино-4-метоксибензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты 0,9 г (0,002 моль) трет-бутилового эфира 4-(4-метокси-2-метоксикарбониламинобензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты растворяли в смеси 7 мл диоксана, 14 мл этиленгликоля и 14 мл 2N NaOH и нагревали при 100°С в течение 15 часов. После охлаждения до комнатной температуры рН доводили до 7 с помощью 1N HCl. Образовывался осадок, который отфильтровывали, промывали водой и высушивали в вакууме с получением 0,65 г (84%) трет-бутилового эфира 4-(2-амино-4-метоксибензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде светло-желтого твердого вещества; Тпл: 191-196°С. б) Трет-бутиловый эфир 4-[2-(4-фторбензоиламино)-4-метоксибензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты К раствору 0,25 г (0,69 ммоль) трет-бутилового эфира 4-(2-амино-4-метоксибензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 5 мл ТГФ добавляли 0,37 мл этилдиизопропиламина и 1,0 мл (0,83 ммоль) 4-фторбензоилхлорида. Реакционную смесь нагревали при 40°С в течение 3 часов. Затем добавляли 1 мл метанола. Растворитель удаляли, остаток переносили в дихлорметан и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат/гексан 1:1) с получением 0,275 г (82%) трет-бутилового эфира 4-[2-(4-фторбензоиламино)-4-метоксибензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде почти белого твердого вещества; Тпл: 205-211°С. в) Хлоргидрат 4-фтор-N-[4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)бензотиазол-2-ил]бензамида (1:1) 0,20 г (0,52 ммоль) трет-бутилового эфира 4-[2-(4-фторбензоиламино)-4-метоксибензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты растворяли в 5 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме и переносили в 4 мл изопропанола. Полученную суспензию отфильтровывали и продукт с фильтра смывали диэтиловым эфиром и высушивали в вакууме. Получали 200 мг (92%) хлоргидрата 4-фтор-N-[4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)бензотиазол-2-ил]бензамида (1:1) в виде почти белого твердого вещества. Тпл: 268-275°С. Пример 11 N-[7-(1-Ацетил-1,2,3,6-тетрагидропиридин-4-ил)-4-метоксибензотиазол-2-ил]-4-фторбензамид К раствору 0,12 г (0,28 ммоль) хлоргидрата 4-фтор-N-[4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)-бензотиазол-2-ил]бензамида в 3 мл ТГФ добавляли 0,043 мл триэтиламина. По каплям при 0°С добавляли 0,029 мл (0,31 ммоль) уксусного ангидрида и перемешивали в течение 30 мин. Затем добавляли смесь 5 мл насыщенного водного бикарбоната натрия и 15 мл воды. После экстрагировалиия четыре раза 25 мл этилацетата объединенные органические фазы высушивали над сульфатом натрия и досуха упаривали в вакууме с получением 0,088 г (73%) N-[7-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-4-метоксибензотиазол-2-ил]-4-фторбензамида в виде почти белого твердого вещества; Тпл: 264-265°С. Пример 12 N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-фторбензамид К раствору 0,04 г (0,94 ммоль) N-[7-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-4-метоксибензотиазол-2-ил]-4-фторбензамида в 2,0 мл метанола добавляли 10,0 мг Pd/C (10%). Эту реакционную смесь гидрировали при 60°С в течение 6 ч, затем отфильтровывали и досуха упаривали в вакууме с получением 0,021 г (52%) N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-фторбензамида в виде белого твердого вещества. Тпл 225-233°C. Пример 13 Хлоргидрат [4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)бензотиазол-2-ил]амида морфолин-4-карбоновой кислоты (1:1) а) Трет-бутиловый эфир 4-{4-метокси-2-[(морфолин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты К суспензии 0,15 г (0,42 ммоль) трет-бутилового эфира 4-(2-амино-4-метоксибензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 5 мл диоксана добавляли 44 мг (1,0 ммоль) NaH (60% дисперсия в минеральном масле) и перемешивали в течение 1 часа при комнатной температуре. Затем добавляли 0,174 мл (1,24 ммоль) триэтиламина и 0,114 мл (1,0 ммоль) морфолин-4-карбонилхлорида и перемешивали в течение 16 часов при комнатной температуре. После добавления 10 мл воды смесь экстрагировали три раза 15 мл этилацетата. Объединенные органические фазы высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат) с получением 0,135 г (69%) трет-бутилового эфира 4-{4-метокси-2-[(морфолин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде бесцветного пенистого вещества. ES-MS m/e (%): 475 ([М+Н]+, 100). б) Хлоргидрат [4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)бензотиазол-2-ил]амида морфолин-4-карбоновой кислоты (1:1) 0,130 г (0,27 ммоль) трет-бутилового эфира 4-{4-метокси-2-[(морфолин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты растворяли в 3 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме и переносили в 3 мл изопропанола. Полученную суспензию отфильтровывали и продукт с фильтра смывали диэтиловым эфиром и высушивали в вакууме. Получали 95 мг (84%) хлоргидрата [4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)бензотиазол-2-ил]амида морфолин-4-карбоновой кислоты (1:1) в виде почти белого твердого вещества. ES-MS m/e (%): 375 ([М+Н]+, 100). Пример 14 [7-(1-Ацетил-1,2,3,6-тетрагидропиридин-4-ил)-4-метоксибензотиазол-2-ил]амид морфолин-4-карбоновой кислоты К раствору 0,04 г (0,097 ммоль) хлоргидрата [4-метокси-7-(1,2,3,6-тетрагидропиридин-4-ил)бензотиазол-2-ил]амида морфолин-4-карбоновой кислоты в 2 мл ТГФ добавляли 0,016 мл триэтиламина. По каплям при 0°С добавляли 0,01 мл (0,11 ммоль) уксусного ангидрида и перемешивали в течение 30 мин. Затем к смеси добавляли 5 мл насыщенного водного бикарбоната натрия и 10 мл воды. После экстрагирования четыре раза 15 мл этилацетата объединенные органические фазы высушивали над сульфатом натрия и досуха упаривали в вакууме с получением 0,031 г (76%) [7-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-4-метоксибензотиазол-2-ил]амида морфолин-4-карбоновой кислоты в виде белого твердого вещества. ES-MS m/e (%): 417 ([M+H]+, 100). Пример 15 [7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-амид морфолин-4-карбоновой кислоты К раствору 0,03 г (0,72 ммоль) [7-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-4-метоксибензотиазол-2-ил]амида морфолин-4-карбоновой кислоты в 2,0 мл метанола добавляли 10,0 мг Pd/C (10%). Реакционную смесь гидрировали при 60°С в течение 6 часов, затем отфильтровывали и досуха упаривали в вакууме с получением 0,024 г (80%) [7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]амида морфолин-4-карбоновой кислоты в виде белого твердого вещества. Тпл: 196°С (разруш.) Пример 16 Хлоргидрат 4-фтор-N-(4-метокси-7-пиперидин-4-илбензотиазол-2-ил)бензамид (1:1) а) Трет-бутиловый эфир 4-[2-(4-фторбензоиламино)-4-метоксибензотиазол-7-ил]пиперидин-1-карбоновой кислоты К раствору 0,14 г (0,94 ммоль) трет-бутилового эфира 4-[2-(4-фторбензоиламино)-4-метоксибензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 6,0 мл метанола и 6,0 мл ТГФ добавляли 90,0 мг Pd/C (10%). Реакционную смесь гидрировали при 60°С в течение 4 часов, затем отфильтровывали и досуха упаривали в вакууме. Остаток перекристаллизовывали из диэтилового эфира с получением 0,105 г (75%) трет-бутилового эфира 4-[2-(4-фторбензоиламино)-4-метоксибензотиазол-7-ил]пиперидин-1-карбоновой кислоты в виде белого твердого вещества. Тпл: 222-223°С. б) Хлоргидрат 4-фтор-N-(4-метокси-7-пиперидин-4-ил-бензотиазол-2-ил)бензамид (1:1) 0,90 г (0,185 ммоль) трет-бутилового эфира 4-[2-(4-фторбензоиламино)-4-метоксибензотиазол-7-ил]пиперидин-1-карбоновой кислоты растворяли в 3 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме и переносили в 4 мл изопропанола. Полученную суспензию отфильтровывали и продукт с фильтра смывали диэтиловым эфиром и высушивали в вакууме. Получали 55 мг (70%) хлоргидрата 4-фтор-N-[4-метокси-7-пиперидин-4-илбензотиазол-2-ил]бензамида (1:1) в виде белого твердого вещества. Тпл: 310-312°С. Пример 17 N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метилизоникотинамид а) Трет-бутиловый эфир 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты К раствору 0,35 г (0,97 ммоль) трет-бутилового эфира 4-(2-амино-4-метоксибензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 20 мл ТГФ добавляли 0,365 мл этилдиизопропиламина и 0,2 г (1,10 ммоль) хлорида 4-(2-хлорметил)изоникотиновой кислоты, растворенной в 10 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре в течение 72 часов. Затем добавляли 5 мл метанола. Растворитель удаляли, остаток переносили в дихлорметан и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат) с получением 0,32 г (69%) трет-бутилового эфира 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде темно-коричневого твердого вещества. ES-MS m/e (%):481 ([M+H]+, 100). б) Трет-бутиловый эфир 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты К раствору 0,30 г (0,62 ммоль) трет-бутилового эфира 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 15,0 мл метанола и 15,0 мл ТГФ добавляли 160,0 мг Pd/C (10%). Реакционную смесь гидрировали при 60°С в течение 10 часов, затем отфильтровывали и досуха упаривали в вакууме. Остаток обрабатывали диэтиловым эфиром с получением 0,15 г (53%) трет-бутилового эфира 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты в виде белого твердого вещества. Тпл: 155-157°С. в) Хлоргидрат N-(4-метокси-7-пиперидин-4-ил-бензотиазол-2-ил)-2-метилизоникотинамида (1:2) 0,15 г (0,31 ммоль) трет-бутилового эфира 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты растворяли в 4 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме и переносили в 5 мл изопропанола. Полученную суспензию отфильтровывали и продукт с фильтра смывали диэтиловым эфиром и высушивали в вакууме. Получали 80 мг (57%) хлоргидрата N-(4-метокси-7-пиперидин-4-илбензотиазол-2-ил)-2-метилизоникотинамида (1:2) в виде белого твердого вещества. Тпл: 272-277°С. г) N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метилизоникотинамид К раствору 0,75 г (0,165 ммоль) хлоргидрата N-(4-метокси-7-пиперидин-4-ил-бензотиазол-2-ил)-2-метилизоникотинамида (1:2) в 4 мл ТГФ добавляли 0,05 мл триэтиламина. По каплям при 0°С добавляли 0,019 мл (0,2 ммоль) уксусного ангидрида и перемешивали в течение 1 часа. Затем к смеси добавляли 5 мл насыщенного водного бикарбоната натрия и 10 мл воды. Полученный осадок отфильтровывали. Остаток на фильтре обрабатывали водой. После выделения и сушки в вакууме получали 0,052 г (74%) N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метилизоникотинамида в виде белого твердого вещества. Тпл: 213-215°С. Примеры 18+19 N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-{[(2-метоксиэтил)метиламино]метил}бензамид N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-метилбензамид а) Трет-бутиловый эфир 4-[2-(4-хлорметилбензоиламино)-4-метоксибензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты К раствору 0,35 г (0,97 ммоль) трет-бутилового эфира 4-(2-амино-4-метоксибензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 20 мл диоксана добавляли 0,2 мл триэтиламина, 12 мг ДМАП и 0,238 г (1,26 ммоль) 4-хлорметилбензоилхлорида, растворенного в 1 мл диоксана. Реакционную смесь нагревали при кипячении с обратным холодильниклм в течение 3 часов. Затем добавляли 5 мл метанола. Растворитель досуха упаривали, остаток переносили в этилацетат и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат/гексан 1:1) с получением 0,37 г (74%) трет-бутилового эфира 4-[2-(4-хлорметилбензоиламино)-4-метоксибензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде белого пенистого вещества. ES-MS m/e (%): 514 ([М+Н]+, 100). б) Трет-бутиловый эфир 4-[4-метокси-2-(4-{[(2-метоксиэтил)метиламино]метил}бензоиламино)бензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты К раствору 0,30 г (0,58 ммоль) трет-бутилового эфира 4-[2-(4-хлорметилбензоиламино)-4-метоксибензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 10 мл ТГФ добавляли 0,16 г (1,75 ммоль) N-(2-метоксиэтил)метиламина. Реакционную смесь нагревали при 70°С в течение 5 часов. Растворитель удаляли, остаток переносили в этилацетат и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (дихлор метан/метанол 19:1) с получением 0,27 г (82%) трет-бутилового эфира 4-[4-метокси-2-(4-{[(2-метоксиэтил)метиламино]метил}бензоиламино)бензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде белого пенистого вещества. ES-MS m/e (%): 567 ([M+H]+, 100). в) Трет-бутиловый эфир 4-[4-метокси-2-(4-{[(2-метоксиэтил)метиламино]метил}бензоиламино)бензотиазол-7-ил]пиперидин-1-карбоновой кислоты К раствору 0,27 г (0,48 ммоль) трет-бутилового эфира 4-[4-метокси-2-(4-{[(2-метоксиэтил)метиламино]метил}бензоиламино)бензотиазол-7-ил]-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 5,0 мл метанола и 5,0 мл ТГФ добавляли 100 мг Pd/C (10%). Реакционную смесь гидрировали при 60°С в течение 10 часов, затем отфильтровывали и досуха упаривали в вакууме. Остаток обрабатывали диэтиловым эфиром с получением 0,15 г неразделенной смеси трет-бутилового эфира 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты и трет-бутилового эфира 4-[2-(4-метилбензоиламино)-4-метоксибензотиазол-7-ил]пиперидин-1-карбоновой кислоты в виде белого твердого вещества, которую непосредственно использовали на следующей стадии. 0,14 г Вышеупомянутой смеси растворяли в 3 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме и переносили в 5 мл изопропанола. Полученную суспензию отфильтровывали и продукт с фильтра смывали диэтиловым эфиром и высушивали в вакууме. Получали 100 мг смеси хлоргидрата N-[7-(пиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-{[(2-метоксиэтил)метиламино]метил}бензамида и хлоргидрата N-[7-(пиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-метилбензамида в виде белого твердого вещества, которое непосредственно использовали на следующей стадии. г) N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-{[(2-метоксиэтил)метиламино]метил}бензамид N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-метилбензамид К раствору 0,1 г вышеупомянутой смеси в 4 мл ТГФ добавляли 0,05 мл триэтиламина. По каплям при 0°С добавляли 0,02 мл (0,21 ммоль) уксусного ангидрида и перемешивали в течение 1 часа. Затем добавляли смесь 5 мл насыщенного водного бикарбоната натрия и 10 мл воды. Водную фазу экстрагировали три раза 15 мл этилацетата. Объединенные органические фазы высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (дихлорметан/метанол 19:1) с получением 0,02 г (22%) N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-{[(2-метоксиэтил)метиламино]метил}бензамида в виде белого твердого вещества, Тпл: 175-178°С и 0,032 г (42%) N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-метилбензамида в виде белого твердого вещества; Тпл: 255-258°С. Пример 20 N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-морфолин-4-ил-изоникотинамид а) Трет-бутиловый эфир 4-{2-[(2-хлорпиридин-4-карбонил)амино]-4-метоксибензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты К раствору 0,25 г (0,69 ммоль) трет-бутилового эфира 4-(2-амино-4-метоксибензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 10 мл ТГФ добавляли 0,26 мл этилдиизопропиламина и 0,16 г (0,76 ммоль) 2-хлоризоникотиноилхлорида, растворенного в 5 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Затем добавляли 5 мл метанола. Растворитель досуха упаривали, остаток переносили в этилацетат и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат/гексан 1:1) с получением 0,308 г (89%) трет-бутилового эфира 4-{2-[(2-хлорпиридин-4-карбонил)амино]-4-метоксибензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде желтого пенистого вещества. ES-MS m/e (%): 501 ([М+Н]+, 100). б) Трет-бутиловый эфир 4-{4-метокси-2-[(2-морфолин-4-илпиридин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты 0,30 г (0,60 ммоль) трет-бутилового эфира 4-{2-[(2-хлорпиридин-4-карбонил)амино]-4-метоксибензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты нагревали при 130°С в течение 24 часов в 1 мл морфолина и 0,39 г (1,2 ммоль) карбоната цезия. Морфолин удаляли в вакууме. Остаток обрабатывали этилацетатом и затем подвергали колоночной хроматографии (этилацетат) с получением 0,15 г (45%) трет-бутилового эфира 4-{4-метокси-2-[(2-морфолин-4-илпиридин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде желтого пенистого вещества. ES-MS m/e (%): 552 ([М+Н]+, 100). в) Трет-бутиловый эфир 4-{4-метокси-2-[(2-морфолин-4-илпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты К раствору 0,15 г (0,27 ммоль) трет-бутилового эфира 4-{4-метокси-2-[(2-морфолин-4-илпиридин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 6,0 мл метанола и добавляли 6,0 мл ТГФ 50 мг Pd/C (10%). Реакционную смесь гидрировали при 60°С в течение 6 часов, затем отфильтровывали и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат) с получением 0,083 г (55%) трет-бутилового эфира 4-{4-метокси-2-[(2-морфолин-4-илпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты в виде желтого пенистого вещества. ES-MS m/e (%): 554 ([М+Н]+, 100). г) Хлоргидрат N-(4-метокси-7-пиперидин-4-илбензотиазол-2-ил)-2-морфолин-4-илизоникотинамида 1:2 Трет-бутиловый эфир 0,08 г (0,14 ммоль) 4-{4-метокси-2-[(2-морфолин-4-илпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты растворяли в 2 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме и переносили в 3 мл изопропанола. Полученную суспензию отфильтровывали и продукт с фильтра смывали диэтиловым эфиром и высушивали в вакууме. Получали 54 мг (71%) хлоргидрата N-(4-метокси-7-пиперидин-4-илбензотиазол-2-ил)-2-морфолин-4-илизоникотинамида 1:2 в виде желтого твердого вещества. Тпл: 260-270°С (разруш.). д) N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-морфолин-4-илизоникотинамид К раствору 0,05 г (0,095 ммоль) хлоргидрата N-(4-метокси-7-пиперидин-4-илбензотиазол-2-ил)-2-морфолин-4-илизоникотинамида 1:2 в 3 мл ТГФ добавляли 0,029 мл триэтиламина. По каплям при 0°С добавляли 0,011 мл (0,11 ммоль) уксусного ангидрида и перемешивали в течение 1 часа. Затем добавляли смесь 5 мл насыщенного водного бикарбоната натрия и 10 мл воды. Смесь экстрагировали три раза 15 мл этилацетата, объединенные органические фазы высушивали над сульфатом натрия и упаривали досуха в вакууме. Получали 0,031 г (66%) N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-морфолин-4-илизоникотинамида в виде белого твердого вещества. Тпл: 231-233°С. Пример 21 N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метоксиизоникотинамид а) Трет-бутиловый эфир 4-{2-[(2-хлор-6-метоксипиридин-4-карбонил)амино]-4-метоксибензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты К раствору 0,35 г (0,97 ммоль) трет-бутилового эфира 4-(2-амино-4-метоксибензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 15 мл ТГФ добавляли 0,33 мл этилдиизопропиламина и 0,23 г (0,96 ммоль) хлорида 2-хлор-6-метоксипиридин-4-карбоновой кислоты, растворенного в 10 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре в течение 72 часов. Затем добавляли 5 мл метанола. Растворитель удаляли, остаток переносили в дихлорметан и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат/гексан 1:1) с получением 0,404 г (87%) трет-бутилового эфира 4-{2-[(2-хлор-6-метоксипиридин-4-карбонил)амино]-4-метоксибензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде светло-желтого пенистого вещества. ES-MS m/e (%): 531 ([М+Н]+, 100). б) Трет-бутиловый эфир 4-{4-метокси-2-[(2-метоксипиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты К раствору 0,39 г (0,73 ммоль) трет-бутилового эфира 4-{2-[(2-хлор-6-метоксипиридин-4-карбонил)амино]-4-метоксибензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 16,0 мл метанола и 16,0 мл ТГФ добавляли 100 мг Pd/C (10%) и 0,15 мл триэтиламина. Реакционную смесь гидрировали при 60°С в течение 6 часов, затем отфильтровывали и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат/гексан 1:1) с получением 0,110 г (30%) трет-бутилового эфира 4-{4-метокси-2-[(2-метоксипиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты в виде белого пенистого вещества. ES-MS m/e (%): 499 ([М+Н]+, 100). в) Хлоргидрат 2-метокси-N-(4-метокси-7-пиперидин-4-илбензотиазол-2-ил)изоникотинамид 1:2 0,10 г (0,20 ммоль) трет-бутилового эфира 4-{4-метокси-2-[(2-метоксипиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты растворяли в 2 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме и переносили в 3 мл изопропанола. Полученную суспензию отфильтровывали и продукт с фильтра смывали диэтиловым эфиром и высушивали в вакууме. Получали 0,075 г (86%) хлоргидрата 2-метокси-N-(4-метокси-7-пиперидин-4-илбензотиазол-2-ил)изоникотинамида 1:2 в виде желтого твердого вещества. Тпл: 305-310°С. г) N-[7-(1-Ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метоксиизоникотинамид К раствору 0,07 г (0,16 ммоль) хлоргидрата 2-метокси-N-(4-метокси-7-пиперидин-4-илбензотиазол-2-ил)изоникотинамида 1:2 в 4 мл ТГФ добавляли 0,049 мл триэтиламина. По каплям при 0°С добавляли 0,018 мл (0,11 ммоль) уксусного ангидрида и перемешивали в течение 1 часа. Затем добавляли смесь 5 мл насыщенного водного бикарбоната натрия и 10 мл воды. Смесь экстрагировали три раза 15 мл этилацетата, объединенные органические фазы высушивали над сульфатом натрия и досуха упаривали в вакууме. Получали 0,036 г (51%) N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метоксиизоникотинамида в виде белого твердого вещества. Тпл: 242-244°С. Пример 22 Метиловый эфир (7-циклогекс-1-енил-4-метоксибензотиазол-2-ил)карбаминовой кислоты К перемешиваемому раствору 100 мг (0,27 ммоль) метилового эфира (7-йодо-4-метоксибензотиазол-2-ил)карбаминовой кислоты в 3 мл диоксана добавляли 0,2 г (0,54 ммоль) три-н-бутил-(1-циклогекс-1-енил)-станнана, 5,0 мг (0,009 ммоль) бис(дибензилиденацетон)палладия и 10 мг (0,043 ммоль) трифурилфосфина. Смесь нагревали при 100°С в течение 16 часов и затем выливали в воду и экстрагировали три раза этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (этилацетат/гексан 1:4) приводила к получению 16 мг (18%) метилового эфира (7-циклогекс-1-енил-4-метоксибензотиазол-2-ил)карбаминовой кислоты в виде белого твердого вещества; Тпл: 164-173°С. Пример 23 N-(7-Циклогексил-4-метоксибензотиазол-2-ил)-4-фторбензамид а) 4-Циклогекс-1-енил-1-метокси-2-нитробензол К перемешиваемому раствору 2,1 г (0,0091 моль) 4-бром-2-нитроанизола в 50 мл диоксана добавляли 1,05 г (0,00091 моль) тетракис(трифенилфосфин)палладия, 4,03 г (0,011 моль) три-н-бутил-(1-циклогекс-1-енил)станнана и 18,3 мл 2М водного раствора Na2СО3. Смесь нагревали в течение 16 часов при кипячении с обратным холодильником и затем выливали в воду. После экстрагирования дихлорметаном, высушивания объединенных органических фаз над сульфатом натрия и удаления растворителя сырой продукт подвергали колоночной хроматографии (этилацетат/гексан 1:10) с получением 1,57 г 4-циклогекс-1-енил-1-метокси-2-нитробензола в виде желтого жидкого вещества. EI-MS m/e (%): 233 ([М]+, 100). б) 5-Циклогексил-2-метоксифениламин К раствору 0,87 г (0,37 ммоль) 5-циклогекс-1-енил-1-метокси-2-нитробензола в 2,0 мл этанола добавляли 3,0 мг Pd/C (10%). Эту реакционную смесь гидрировали при 40°С в течение 2 часов, затем отфильтровывали и досуха упаривали в вакууме с получением 0,072 г 5-циклогексил-2-метоксифениламина (90%) в виде светло-коричневого твердого вещества. ES-MS m/e (%): 206 ([М+Н]+, 100). в) (5-Циклогексил-2-метоксифенил)тиомочевина 1,3 г (0,0063 моль) 5-циклогексил-2-метоксифениламины и 2,45 г (0,0252 моль) тиоизоцианата натрия растворяли в смеси 12 мл воды и 2 мл конц. HCl. Реакционную смесь нагревали при кипячении с обратным холодильником в течение 16 часов и затем выливали в смесь воды и дихлорметана. Водную фазу экстрагировали дихлорметаном, промывали соляным раствором, высушивали над сульфатом натрия и упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат/гексан 1:4->1:1), получая 1,0 г (60%) (5-циклогексил-2-метоксифенил)тиомочевины в виде желтого пенистого вещества. ES-MS m/e (%): 265 ([M+H]+, 100). г) 7-Циклогексил-4-метоксибензотиазол-2-иламин К раствору 0,9 г (0,0034 моль) (5-циклогексил-2-метоксифенил)тиомочевины в 18 мл хлороформа добавляли 0,2 мл (0,0041 моль) брома, растворенного в 4,5 мл хлороформа и нагревали при кипячении с обратным холодильником в течение 16 часов. Реакционную смесь растворяли в дихлорметане, экстрагировали насыщенным водным карбонатом натрия и соляным раствором, высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток перекристаллизовывали из этилацетат/диэтилового эфира с получением 0,61 г (68%) 7-циклогексил-4-метоксибензотиазол-2-иламина в виде почти белого твердого вещества; Тпл: 199-200°С. д) N-(7-Циклогексил-4-метоксибензотиазол-2-ил)-4-фторбензамид К раствору 0,05 г (0,19 ммоль) 7-циклогексил-4-метоксибензотиазол-2-иламина в 2 мл ТГФ добавляли 0,1 мл этилдиизопропиламина и 0,027 мл (0,23 ммоль) 4-фторбензоилхлорида. Реакционную смесь нагревали при 70°С в течение 2 часов. Растворитель удаляли, остаток переносили в дихлорметан и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат/гексан 1:9, 1:4) с получением 0,01 г (14%) N-(7-циклогексил-4-метоксибензотиазол-2-ил)-4-фторбензамида в виде светло-желтого твердого вещества; Тпл: 192-195°С. Пример 24 N-(7-Циклогексил-4-метоксибензотиазол-2-ил)-4-{[(2-метоксиэтил)метиламино]метил}бензамид а) 4-Хлорметил-N-(7-циклогексил-4-метоксибензотиазол-2-ил)бензамид К раствору 0,1 г (0,38 ммоль) 7-циклогексил-4-метоксибензотиазол-2-иламин в 3 мл ТГФ добавляли 0,2 мл этилдиизопропиламина и 0,0865 г (0,46 ммоль) 4-хлорметилбензоилхлорида, растворенного в 1 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Растворитель удаляли, остаток переносили в дихлорметан и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток обрабатывали этиловым эфиром, отфильтровывали и высушивали с получением 0,11 г (68%) 4-хлорметил-N-(7-циклогексил-4-метоксибензотиазол-2-ил)бензамида в виде светло-желтого пенистого вещества. ES-MS m/e (%): 415 ([М+Н]+, 100). б) N-(7-Циклогексил-4-метоксибензотиазол-2-ил)-4-{[(2-метоксиэтил)метиламино]метил}бензамид К раствору 0,095 г (0,23 ммоль) 4-хлорметил-N-(7-циклогексил-4-метоксибензотиазол-2-ил)бензамида в 1 мл ТГФ добавляли 0,16 г (1,83 ммоль) N-(2-метоксиэтил)метиламина. Реакционную смесь нагревали при 70°С в течение 2 часов. Растворитель удаляли, остаток переносили в этилацетат и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (дихлорметан/метанол 19:1) с получением 0,087 г (81%) N-(7-циклогексил-4-метоксибензотиазол-2-ил)-4-{[(2-метоксиэтил)метиламино]метил}бензамида в виде светло-желтого пенистого вещества. ES-MS m/e (%): 468 ([M+H]+, 100). Пример 25 N-(7-Циклогексил-4-метоксибензотиазол-2-ил)-2-пирролидин-1-илметилизоникотинамид а) 2-Хлорметил-N-(7-циклогексил-4-метоксибензотиазол-2-ил)изоникотинамид К раствору 0,195 г (1,0 ммоль) 7-циклогексил-4-метоксибензотиазол-2-иламина в 5 мл ТГФ добавляли 0,15 мл этилдиизопропиламина и 0,2 г (1,20 ммоль) хлорида 4-(2-хлорметил)изоникотиновой кислоты, растворенного в 5 мл ТГФ. Реакционную смесь перемешивали при 70°С в течение 16 часов. Растворитель удаляли, остаток переносили в дихлорметан и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и упаривали в вакууме. Остаток подвергали колоночной хроматографии (дихлорметан/метанол 40:1) с получением 0,137 г (35%) 2-хлорметил-N-(7-циклогексил-4-метоксибензотиазол-2-ил)изоникотинамида в виде темно-коричневого твердого вещества. ES-MS m/e (%): 416 ([М+Н]+, 100). б) N-(7-Циклогексил-4-метоксибензотиазол-2-ил)-2-пирролидин-1-илметилизоникотинамид К раствору 0,13 г (0,31 ммоль) 2-хлорметил-N-(7-циклогексил-4-метоксибензотиазол-2-ил)изоникотинамида в 1 мл ТГФ добавляли 0,1 мл (1,3 ммоль) пирролидина. Реакционную смесь нагревали при 70°С в течение 3 часов. Растворитель удаляли, остаток переносили в дихлорметан и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (дихлорметан/метанол 19:1->9:1) и последующая кристаллизация из метанол/этилацетат/диэтиловый эфир приводила к получению 0,026 г (18%) N-(7-циклогексил-4-метоксибензотиазол-2-ил)-2-пирролидин-1-илметилизоникотинамида в виде желтого твердого вещества. ES-MS m/e (%): 451 ([M+H]+, 100). Пример 26 Хлоргидрат (4-метокси-7-пиперидин-4-илбензотиазол-2-ил)амида морфолин-4-карбоновой кислоты Трет-бутиловый эфир 4-{4-метокси-2-[(морфолин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты К раствору 0,13 г (0,274 ммоль) трет-бутилового эфира 4-{4-метокси-2-[(морфолин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 6,0 мл метанола и 6,0 мл тетрагидрофурана добавляли 80,0 мг Pd/C (10%). Реакционную смесь гидрировали при 60°С в течение 8 часов, затем отфильтровывали и досуха упаривали. Остаток подвергали колоночной хроматографии на силикагеле (этилацетат) с получением 0,048 г (37%) трет-бутилового эфира 4-{4-метокси-2-[(морфолин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты в виде бесцветного пенистого вещества. ES-MS m/e (%): 477 ([М+Н]+, 100). Хлоргидрат (4-метокси-7-пиперидин-4-илбензотиазол-2-ил)амида морфолин-4-карбоновой кислоты (1:1) 0,45 г (0,094 ммоль) трет-бутилового эфира 4-{4-метокси-2-[(морфолин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты растворяли в 2 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме и переносили в 5 мл изопропанола. Полученную суспензию отфильтровывали и продукт с фильтра смывали диэтиловым эфиром и высушивали в вакууме. Получали 26 мг (67%) хлоргидрата (4-метокси-7-пиперидин-4-илбензотиазол-2-ил)амида морфолин-4-карбоновой кислоты (1:1) в виде белого твердого вещества. Тпл: 314-315°С. Пример 27 Хлоргидрат N-(4-метокси-7-пиперидин-4-илбензотиазол-2-ил)-2-метилизоникотинамид Трет-бутиловый эфир 4-{4-метокси-2-Г(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты К раствору 0,35 г (0,97 ммоль) трет-бутилового эфира 4-(2-амино-4-метоксибензотиазол-7-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 20 мл ТГФ добавляли 0,365 мл этилдиизопропиламина и 0,2 г (1,10 ммоль) хлорида 4-(2-хлорметил)изоникотиновой кислоты, растворенной в 10 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре в течение 72 часов. Затем добавляли 5 мл метанола. Растворитель досуха упаривали, остаток переносили в дихлорметан и промывали водой и соляным раствором. Органическую фазу высушивали над сульфатом натрия и досуха упаривали в вакууме. Остаток подвергали колоночной хроматографии (этилацетат) с получением 0,32 г (69%) трет-бутилового эфира 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в виде темно-коричневого твердого вещества. ES-MS m/e (%): 481 ([М+Н]+, 100). Трет-бутиловый эфир 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты К раствору 0,30 г (0,62 ммоль) трет-бутилового эфира 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты в 15,0 мл метанола и 15,0 мл ТГФ добавляли 160,0 мг Pd/C (10%). Реакционную смесь гидрировали при 60°С в течение 10 часов, затем отфильтровывали и досуха упаривали в вакууме. Остаток обрабатывали диэтиловым эфиром с получением 0,15 г (53%) трет-бутилового эфира 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты в виде белого твердого вещества. Тпл: 155-157°С. Хлоргидрат N-(4-метокси-7-пиперидин-4-ил-бензотиазол-2-ил)-2-метилизоникотинамида (1:2) 0,15 г (0,31 ммоль) трет-бутилового эфира 4-{4-метокси-2-[(2-метилпиридин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты растворяли в 4 мл 2,5М HCl/MeOH и нагревали при кипячении с обратным холодильником в течение 1,5 часов. Реакционную смесь упаривали в вакууме и переносили в 5 мл изопропанола. Полученную суспензию отфильтровывали и продукт с фильтра смывали диэтиловым эфиром и высушивали в вакууме. Получали 80 мг (57%) хлоргидрата N-(4-метокси-7-пиперидин-4-ил-бензотиазол-2-ил)-2-метилизоникотинамида (1:2) в виде белого твердого вещества. Тпл: 272-277°С. Аналогично Примеру 3 был получен: Пример 28 N-[4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-6-метилникотинамид Из 6-метилникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламином в диоксане и ДМФА. ES-MS m/e (%): 384 (М+Н+, 100). Пример 29 Метиловый эфир 4-[2-(4-фторбензоиламино)-4-метоксибензотиазол-7-ил]пиперидин-1-карбоновой кислоты К суспензии 0,1 г (0,24 ммоль) хлоргидрата 4-фтор-N-[4-метокси-7-пиперидин-4-илбензотиазол-2-ил]бензамида (1:1) в 3 мл ТГФ добавляли 0,036 мл триэтиламина. По каплям при 0°С добавляли 0,020 мл (0,26 ммоль) метилового эфира хлормуравьиной кислоты и перемешивали в течение 1 часа. Затем добавляли смесь 5 мл насыщенного водного бикарбоната натрия и 10 мл воды. Смесь экстрагировали три раза 15 мл этилацетата, объединенные органические фазы высушивали над сульфатом натрия и упаривали досуха в вакууме. Получали 0,080 г (76%) метилового эфира 4-[2-(4-фторбензоиламино)-4-метоксибензотиазол-7-ил]пиперидин-1-карбоновой кислоты в виде белого твердого вещества. Тпл: 238-239°С. Пример 30 Метиловый эфир 4-{4-метокси-2-[(морфолин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты К суспензии 0,05 г (0,12 ммоль) хлоргидрата (4-метокси-7-пиперидин-4-илбензотиазол-2-ил)амида морфолин-4-карбоновой кислоты (1:1) в 3 мл ТГФ добавляли 0,019 мл триэтиламина. По каплям при 0°С добавляли 0,011 мл (0,13 ммоль) метилового эфира хлормуравьиной кислоты и перемешивали в течение 1 часа. Затем добавляли смесь 5 мл насыщенного водного бикарбоната натрия и 10 мл воды. Смесь экстрагировали три раза 15 мл этилацетата, объединенные органические фазы высушивали над сульфатом натрия и досуха упаривали в вакууме. Получали 0,037 г (70%) метилового эфира 4-{4-метокси-2-[(морфолин-4-карбонил)амино]бензотиазол-7-ил}пиперидин-1-карбоновой кислоты в виде белого твердого вещества. Тпл: 179-185°С. Пример 31 2-Метокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид К перемешиваемому раствору 0,09 мл (2,23 ммоль) метанола в 5 мл диоксана при комнатной температуре добавляли 49 мг (1,12 ммоль) гидрида натрия (55% дисперсия в минеральном масле) и смесь нагревали при 50°С в течение 1 часа. Затем добавляли 100 мг (0,22 ммоль) 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида и смесь нагревали при 50°С в течение 16 часов. Реакционную смесь затем охлаждали до комнатной температуры и выливали в воду. Смесь экстрагировали три раза дихлорметаном и объединенные органические фазы высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (этилацетат) с последующим растиранием в эфире и гексане приводила к получению 60 мг (67%) 2-метокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида в виде белого кристаллического твердого вещества. ES-MS m/e (%): 398 ([М-Н]–, 100). Аналогичным способом был получен: Пример 32 2-Этокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид Из 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида с гидридом натрия и этанолом в диоксане и ДМФА. ES-MS m/e (%): 414 (M+H+, 100). Пример 33 2-Этил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид а) N-[4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-винилизоникотинамид К перемешиваемому раствору 200 мг (0,45 ммоль) 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида в 10 мл ДМФА добавляли 283 мг (0,89 ммоль) винилтри-н-бутилолова, 38 мг (0,05 ммоль) хлорида бис(трифенилфосфин)палладия (II), 70 мг (0,27 ммоль) трифенилфосфина, 151 мг (3,57 ммоль) хлорида лития и 10 мг (0,04 ммоль) 2,6-ди-трет-бутил-пара-крезола. Смесь нагревали при 100°С в течение 48 часов и затем выливали в воду и экстрагировали три раза дихлорметаном. Объединенные органические фазы высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (гексан, затем 1/1 этилацетат/гексан) с последующим растиранием в гексан/дихлорметане приводила к получению 100 мг (57%) N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-винилизоникотинамида в виде белого кристаллического твердого вещества. ES-MS m/e (%): 396 (М+Н+, 100). б) 2-Этил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид К перемешиваемому раствору 90 мг (0,23 ммоль) N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-винилизоникотинамида в 10 мл метанола и 10 мл дихлорметана на кончике шпателя добавляли 10% палладия на угле и смесь затем перемешивали в течение 16 часов при комнатной температуре в атмосфере водорода. Затем смесь отфильтровывали, промывали дихлорметаном и фильтрат упаривали в вакууме и обрабатывали эфиром, получая 80 мг (88%) 2-этил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида в виде желтого твердого вещества. ES-MS m/e (%): 398 (М+Н+, 100). Аналогичным способом был получен: Пример 34 N-[4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-пропилизоникотинамид Из 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида с аллилтри-н-бутилоловом, хлоридом бис(трифенилфосфин)палладия (II), трифенилфосфином, хлоридом лития и 2,6-ди-трет-бутил-пара-крезолом в ДМФА, затем гидрированием палладием на угле в дихлорметане и метаноле. ES-MS m/e (%): 412 (М+Н+, 100). Аналогично Примеру 31 был получен: Пример 35 2-Изопропокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид Из 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида с гидридом натрия и изопропанолом в диоксане и ДМФА. ES-MS m/e (%): 414 (М+Н+, 100). Аналогично Примеру 33 был получен: Пример 36 2-Изопропил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид Из 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида с изопренилтри-н-бутилоловом, хлоридом бис(трифенилфосфин)палладия (II), трифенилфосфином, хлоридом лития и 2,6-ди-трет-бутил-пара-крезолом в ДМФА, затем гидрированием палладием на угле в дихлорметане и метаноле. ES-MS m/e (%): 412 (М+Н+, 100). Аналогично Примеру 1 был получен: Пример 37 Метиловый эфир [7-(5,6-дигидро-4Н-пиран-2-ил)-4-метоксибензотиазол-2-ил]карбаминовой кислоты Из метилового эфира (7-йодо-4-метоксибензотиазол-2-ил)карбаминовой кислоты с трибутил-(5,6-дигидро-4Н-пиран-2-ил)станнаном, бис(дибензилиденацетон)палладием, трифурилфосфином и триэтиламином в диоксане. ES-MS m/e (%): 321 (М+Н+, 100). Аналогично Примеру 2 был получен: Пример 38 Метиловый эфир [4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]карбаминовой кислоты Из метилового эфира [7-(5,6-дигидро-4Н-пиран-2-ил)-4-метоксибензотиазол-2-ил]карбаминовой кислоты гидрированием палладием на угле в дихлорметане, метаноле и триэтиламине. ES-MS m/e (%): 323 (М+Н+, 100). Пример 39 2-Бром-N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]изоникотинамид а) 4-Метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-иламин К раствору 2,60 г (8,06 ммоль) метилового эфира [4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]карбоновой кислоты в 100 мл этиленгликоля добавляли 100 мл 2N NaOH и смесь нагревали при 100°С в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь выливали в воду и экстрагировали три раза дихлорметаном. Объединенные органические фазы высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (ацетон/гексан 1/4-1/2) приводила к получению 1,70 г (80%) 4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-иламина в виде белого твердого вещества. ES-MS m/e (%): 265 (М+Н+, 100). б) 2-Бром-N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]изоникотинамид К перемешиваемому раствору 0,99 г (4,92 ммоль) 2-бромизоникотиновой кислоты в 40 мл ТГФ добавляли 2,16 г (5,67 ммоль) HATU и 0,97 мл (5,67 ммоль) N-этилдиизопропиламина и продолжали перемешивание при комнатной температуре в течение 1 часа. Затем добавляли раствор 1,00 г (3,78 ммоль) 4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-иламина в 20 мл диоксана и 4 мл ДМФА и продолжали перемешивание при комнатной температуре в течение 48 часов. Реакционную смесь затем выливали в водный раствор бикарбоната натрия и экстрагировали три раза дихлорметаном. Объединенные органические фазы промывали 1М соляной кислотой, затем высушивали над сульфатом натрия и упаривали в вакууме. Ускоренная хроматография (ацетон/гексан 1/4) с последующим растиранием в эфире приводила к получению 500 мг (29%) 2-бром-N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]изоникотинамида в виде светло-желтого кристаллического твердого вещества. ES-MS m/e (%): 450 (M{81Br}+H+, 100), 448 (M{79Br}+H+, 80). Аналогичным способом были получены: Пример 40 4-Фтор-N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]бензамид Из 4-фторбензойной кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-иламином в диоксане и ДМФА. ES-MS m/e (%): 387 (М+Н+, 100). Пример 41 N-[4-Метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]-2-метилизоникотинамид Из хлоргидрата 2-метилизоникотиновой кислоты, HATU и N-диэтилизопропиламина в ТГФ, затем обработкой 4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-иламином в диоксане и ДМФА. ES-MS m/e (%): 384 (М+Н+, 100). Аналогично Примеру 6 был получен Пример 42 N-[4-Метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]-2-морфолин-4-илизоникотинамид Из 2-бром-N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]изоникотинамида с карбонатом цезия и морфолином в NMP. ES-MS m/e (%): 455 (М+Н+, 100). Пример 43 N-[4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-пирролидин-1-илметилизоникотинамид Указанное соединение получали из 2-хлорметил-N-[7-(тетрагидропиран-4-ил)-4-метоксибензотиазол-2-ил]изоникотинамида (полученного из 4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламина и хлорида 4-(2-хлорметил)изоникотиновой кислоты, как описано для 2-хлорметил-N-(7-циклогексил-4-метоксибензотиазол-2-ил)изоникотинамида) и пирролидина, как описано для N-(7-циклогексил-4-метоксибензотиазол-2-ил)-2-пирролидин-1-илметилизоникотинамида, и получали в виде светло-желтого твердого вещества (выход 62%), Тпл. 200-202°С. MS: m/e=453 (M+H+). Пример 44 [4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]амид морфолин-4-карбоновой кислоты К раствору 4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-иламина (265 мг, 1,0 ммоль) в дихлорметане (15 мл) последовательно добавляли пиридин (0,24 мл, 3,0 ммоль) и фенилхлорформат (0,15 мл, 1,2 ммоль) и полученный раствор перемешивали в течение 45 минут при температуре окружающей среды. Затем добавляли морфолин (313 мг, 3,6 ммоль) и смесь перемешивали при температуре окружающей среды в течение 15 минут и при 40°С в течение 2,5 часов. После охлаждения до температуры окружающей среды добавляли насыщенный водный карбонат натрия (15 мл), органические фазы выделяли, высушивали и растворитель удаляли в вакууме. Ускоренная хроматография (силикагель, элюент: метанол, содержащий дихлорметан (градиент от 0 до 5%)) приводила к получению указанного в заголовке соединения в виде белого кристаллического вещества (выход 21%), Тпл. 217-220°С. MS: m/e=378 (М+Н+). Следуя методике Примера 44, было получено соединение Примера 45. Пример 45 [4-Метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]амид 4-гидроксипиперидин-1-карбоновой кислоты Указанное в заголовке соединение было получено, используя 4-гидроксипиперидин, в виде светло-желтого твердого вещества (выход 80%), Тпл. 106-109°С. MS: m/e=392 (M+H+). Аналогично Примеру 6 были получены: Пример 46 2-(2-Метоксиэтиламино)-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид Из 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида с карбонатом цезия и 2-метоксиэтиламином. ES-MS m/e (%): 443 (М+Н+, 100). Пример 47 2-[(2-Метоксиэтил)метиламино]-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид Из 2-бром-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамида с карбонатом цезия и N-(2-метоксиэтил)метиламином. ES-MS m/e (%): 457 (M+H+, 100).
Формула изобретения
1. Соединения общей формулы
в которой R1 представляет собой 3,6-дигидро-2Н-пиран-4-ил, 5,6-дигидро-4Н-пиран-3-ил, 5,6-дигидро-4Н-пиран-2-ил, тетрагидропиран-2,3- или 4-ил, циклогекс-1-енил, циклогексил или представляет собой 1,2,3,6-тетрагидропиридин-4-ил или пиперидин-4-ил, которые необязательно замещены -С(O)СН3 или -С(O)ОСН3 в 1 положении атома N; R2 представляет собой низший алкил, пиперидин-1-ил, необязательно замещенный гидрокси, или представляет собой фенил, необязательно замещенный -(CH2)n-N(R’)-C(O)-(CH2)n-NR’2, -(СН2)n-галогеном, низшим алкилом или -(CH2)n-N(R’)-(CH2)n-O-низшим алкилом, или представляет собой морфолинил или пиридинил, который необязательно замещен галогеном, -N(R’)-(CH2)n-О-низшим алкилом, низшим алкилом, низшим алкокси, морфолинилом или -(СН2)n-пирролидинилом; n обозначает 0, 1 или 2; R’ представляет собой водород или низший алкил; и их фармацевтически приемлемые кислотно-аддитивные соли. 2. Соединения формулы I по п.1, в которой R1 представляет собой 3,6-дигидро-2Н-пиран-4-ил. 3. Соединения формулы I по п.2, где соединение представляет собой метиловый эфир [7-(3,6-дигидро-2Н-пиран-4-ил)-4-метоксибензотиазол-2-ил]карбаминовой кислоты. 4. Соединения по п.1, где R’ представляет собой тетрагидропиран-4-ил. 5. Соединения по п.4, где соединение представляет собой 4-фтор-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]бензамид, N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-6-метилникотинамид, 2-метокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил] изоникотинамид, 2-этокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид, 2-этил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид, N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-пропилизоникотинамид, 2-изопропокси-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид, 2-изопропил-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид, N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]-2-пирролидин-1-илметилизоникотинамид, [4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]амид морфолин-4-карбоновой кислоты, [4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]амид 4-гидроксипиперидин-1-карбоновой кислоты, 2-(2-метоксиэтиламино)-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид или 2-[(2-метоксиэтил)метиламино]-N-[4-метокси-7-(тетрагидропиран-4-ил)бензотиазол-2-ил]изоникотинамид. 6. Соединения по п.1, где R1 представляет собой тетрагидропиран-2-ил. 7. Соединения по п.6, где соединение представляет собой 2-бром-N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]изоникотинамид, 4-фтор-N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]бензамид, N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]-2-метилизоникотинамид или N-[4-метокси-7-(тетрагидропиран-2-ил)бензотиазол-2-ил]-2-морфолин-4-илизоникотинамид. 8. Соединения по п.1, где R1 представляет собой 1,2,3,6-тетрагидропиридин-4-ил, замещенный -С(O)СН3 в 1 положении атома N. 9. Соединения по п.8, где соединение представляет собой N-[7-(1-ацетил-1,2,3,6-тетрагидропиридин-4-ил)-4-метоксибензотиазол-2-ил]-4-фторбензамид. 10. Соединения по п.1, где R1 представляет собой пиперидин-4-ил, замещенный по атому N группой -С(O)СН3. 11. Соединения по п.10, где соединение представляет собой N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-фторбензамид, [7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]амид морфолин-4-карбоновой кислоты, N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метилизоникотинамид, N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-{[(2-метоксиэтил)метиламино]метил}бензамид, N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-4-метилбензамид, N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-морфолин-4-илизоникотинамид или N-[7-(1-ацетилпиперидин-4-ил)-4-метоксибензотиазол-2-ил]-2-метоксиизоникотинамид. 12. Соединения по п.1, где R1 представляет собой циклогекс-1-енил. 13. Соединения по п.12, где соединение представляет собой метиловый эфир (7-циклогекс-1-енил-4-метоксибензотиазол-2-ил)карбаминовой кислоты. 14. Соединения по п.1, где R1 представляет собой циклогексил. 15. Соединения по п.14, где соединение представляет собой N-(7-циклогексил-4-метоксибензотиазол-2-ил)-4-фторбензамид, N-(7-циклогексил-4-метоксибензотиазол-2-ил)-4-{[(2-метоксиэтил)метиламино]метил}бензамид или N-(7-циклогексил-4-метоксибензотиазол-2-ил)-2-пирролидин-1-илметилизоникотинамид. 16. Лекарственное средство, обладающее сродством к аденозиновому рецептору A2A, содержащее одно или несколько соединений по любому из пп.1-15 и фармацевтически приемлемые эксципиенты. 17. Лекарственное средство по п.16 для лечения заболеваний, связанных с аденозиновым рецептором.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||