|
|
(21), (22) Заявка: 2003101111/04, 13.06.2001
(24) Дата начала отсчета срока действия патента:
13.06.2001
(30) Конвенционный приоритет:
15.06.2000 US 60/211,724
(43) Дата публикации заявки: 27.08.2004
(46) Опубликовано: 20.02.2007
(56) Список документов, цитированных в отчете о
поиске:
WO 99/26943 A1, 03.06.1999. SU 1781220 A1, 15.12.1992. SU 682132 A, 25.08.1979.
(85) Дата перевода заявки PCT на национальную фазу:
15.01.2003
(86) Заявка PCT:
US 01/19025 (13.06.2001)
(87) Публикация PCT:
WO 01/96330 (20.12.2001)
Адрес для переписки:
103064, Москва, ул. Казакова,16, НИИР Канцелярия “Патентные поверенные Квашнин, Сапельников и партнеры”, Квашнину В.П.
|
(72) Автор(ы):
ЧАКАЛАМАННИЛ Сэмюэл (US),
ЧЕЛЛИА Мариаппан (US),
КСИА Ян (US)
(73) Патентообладатель(и):
ШЕРИНГ КОРПОРЕЙШН (US)
|
(54) ПРОИЗВОДНЫЕ НОР-СЕКО ХИМБАЦИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ НА ИХ ОСНОВЕ
(57) Реферат:
Изобретение относится к соединениям, представляемым структурной формулой
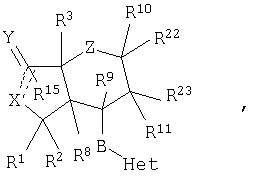
или его фармацевтически приемлемой соли, где Z представляет -(СН2)n-; двойной пунктир представляет двойную связь; n означает 0-2; R1 и R2 независимо выбираются из группы, включающей Н, алкил с 1-6 атомами углерода; R3 означает Н, гидрокси-, алкокси-группу с 1-6 атомами углерода, -C(O)OR17 или алкил с 1-6 атомами углерода; Het означает моноциклическую гетероароматическую группу из 6 атомов, включающую 5 углеродных атомов и 1 гетероатом, в качестве которого выбирают N, где Het соединяется с В через кольцевой атом углерода и где Het-группа имеет 1 заместитель W, независимо выбираемый из группы, включающей Br, гетероциклоалкил, представляющий собой группу, состоящую из 4 атомов углерода и 1 гетероатома, выбранного из N; гетероциклоалкил, представляющий собой группу, состоящую из 4 атомов углерода и 1 гетероатома, выбранного из N, замещенный ОН-замещенным алкилом с 1-6 атомами углерода или=O; R21-арил-NH-; -C(=NOR17)R18; R21-арил; R41-гетероарил, представляющий собой группу, состоящую из 5-6 атомов, включающую 3-5 атомов углерода и 1-4 гетероатома, независимо выбираемых из группы N, S и О; R8 и R10 независимо выбирают из группы, включающей R1; R9 означает Н; R11 выбирают из группы, включающей R1 и -СН2OBn, где Вп означает бензил; В означает -(CH2)n4CR12=CR12a(CH2)n5, n4 и n5 означают независимо 0, а R12 и R12a независимо выбираются из группы, включающей Н, алкил с 1-6 атомами углерода; Х означает -O-; Y означает=O; R15 отсутствует; поскольку двойной пунктир представляет простую связь; R16 означает низший алкил с 1-6 атомами углерода; R17 и R18 независимо выбираются из группы, включающей Н, алкил с 1-6 атомами углерода; R21 означает 1-3 заместителя, независимо выбираемых из группы, включающей водород, -CN, -CF3, галоген, алкил с 1-6 атомами углерода и т.д.; R22 независимо выбирается из группы, включающей водород, R24-алкил с 1-10 атомами углерода, R25-арил и т.д.; R23 независимо выбирается из группы, включающей водород, R24-алкил с 1-10 атомами углерода, R25-арил и -СН2OBn; R24 означает 1-3 заместителя, независимо выбираемых из группы, включающей водород, галоген, -ОН, алкокси-группу с 1-6 атомами углерода; R25 означает водород; R41 означает 1-4 заместителя, независимо выбираемых из группы, включающей водород, алкил с 1-6 атомами углерода и т.д. Изобретение относится к фармацевтической композиции, обладающей ингибирующей активностью в отношении рецепторов, активируемых протеазой (ПАР), включающей эффективное количество производного нор-секо химбацина формулы (I) и фармацевтически приемлемый наполнитель. Также изобретение относится к способам ингибирования тромбиновых и каннабиноидных рецепторов, включающих введение млекопитающему активного вещества, в качестве которого вводят производное нор-секо химбацина формулы (I) в эффективном количестве. Технический результат – производные нор-секо химбацина, в качестве антагонистов тромбинового рецептора. 4 н. и 4 з.п. ф-лы, 1 табл., 18 пр.
Предшествующий уровень техники
Настоящее изобретение относится к производным нор-секо химбацина, используемым в качестве антагонистов тромбинового рецептора при лечении заболеваний, связанных с тромбозом, атеросклерозом, рестенозом, гипертензией, стенокардией, аритмией, сердечной недостаточностью, мозговой ишемией, инсультом, нейродегенеративными заболеваниями и раком. Антагонисты тромбинового рецептора также известны как антагонисты рецептора, активируемого протеазой (ПАР). Соединения согласно изобретению также связываются с каннабиноидными (СВ2) рецепторами и используются при лечении ревматоидного артрита, системной эритематозной волчанки, множественного склероза, диабета, остеопороза, почечной ишемии, мозгового инсульта, мозговой ишемии, нефрита, воспалительных заболеваний легких и желудочно-кишечного тракта и заболеваний дыхательных путей, таких как реверсивная обструкция дыхательных путей, хроническая астма и бронхит. Изобретение также относится к фармацевтическим композициям, содержащим указанные соединения.
Известно, что тромбин обладает рядом активностей в различных типах клеток, а рецепторы тромбина присутствуют в таких типах клеток как человеческие тромбоциты, клетки гладкой мускулатуры сосудов, эндотелиальные клетки и фибробласты. Поэтому ожидается, что антагонисты тромбинового рецептора будут полезны при лечении тромбических, воспалительных, атеросклеротических и фибропролиферативных заболеваний, а также других заболеваний, в которых тромбин и его рецептор играют патологическую роль.
Пептиды антагониста тромбинового рецептора были идентифицированы на основании исследований “структура-активность”, включавших замены аминокислот в рецепторах тромбина. В работе Bematowicz et al, J. Med. Chem., 39 (1996), стр. 4879-4887, в качестве мощных антагонистов тромбинового рецептора описаны тетра- и пентапептиды, например N-транс-циннамоил-п-фторPhe-п-гуанидиноPhe-Leu-Arg-NH2 и N-транс-циннамоил-п-фторPhe-п-гуанидиноPhe-Leu-Arg-Arg-NH2. Пептидные антагонисты тромбинового рецептора также описаны в WO 94/03479, опубликованной 17 февраля 1994года.
Каннабиноидные рецепторы принадлежат к суперсемейству рецепторов, связанных с G-белком. Они классифицируются как преимущественно нейронные CB1 рецепторы и преимущественно периферийные СВ2 рецепторы. Эти рецепторы проявляют свою биологическую активность путем регулирования потоков аденилатциклазы и Са2+ и К+. В то время как действие рецепторов CB1 преимущественно связывают с центральной нервной системой, предполагают, что рецепторы СВ2 обладают периферийной активностью, связанной с бронхиальным сжатием, иммуномодулированием и воспалением. Таким образом, ожидается, что агент, селективно связывающийся с рецептором СВ2, будет иметь терапевтическую ценность при лечении заболеваний, связанных с ревматоидным артритом, системной эритематозной волчанкой, множественным склерозом, диабетом, остеопорозом, почечной ишемией, мозговым инсультом, мозговой ишемией, нефритом, воспалительными заболеваниями легких и желудочно-кишечного тракта и заболеваниями дыхательных путей, такими как реверсивная обструкция дыхательных путей, хроническая астма и бронхит (R.G. Pertwee, Curr. Med. Chem. (5(8), (1999), 635).
Химбацин, пиперидиновый алкалоид формулы
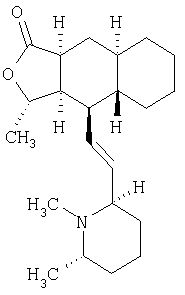
был идентифицирован как антагонист мускаринового рецептора. Полный синтез (+)-химбацина описан в работе Chackalamannil et al, J. Am. Chem Soc., 118 (1996), стр. 9812-9813.
Трициклические химбацин-связанные соединения были описаны как антагонисты тромбинового рецептора в патенте США 6063847.
Краткое содержание изобретения
Настоящее изобретение относится к антагонистам тромбинового рецептора, представленным формулой I
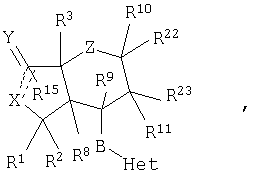
или фармацевтически приемлемым солям этих соединений, где:
Z представляет -(CH2)n-; 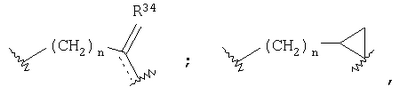 где R10 отсутствует; где R10 отсутствует;
или 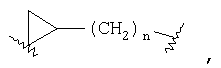 где R3 отсутствует; где R3 отсутствует;
одинарный пунктир представляет необязательную двойную связь;
двойной пунктир представляет необязательную простую связь;
n означает 0-2;
R1 и R2 независимо выбираются из группы, включающей: Н, алкил с 1-6 атомами углерода, фторозамещенный алкил с 1-6 атомами углерода, дифторозамещенный алкил с 1-6 атомами углерода, трифторозамещенный алкил с 1-6 атомами углерода, циклоалкил с 3-7 атомами углерода, алкенил с 2-6 атомами углерода, арилзамещенный алкил с 1-6 атомами углерода, арилзамещенный алкенил с 2-6 атомами углерода, гете-роарилзамещенный алкил с 1-6 атомами углерода, гетероарилзамещенный алкенил с 2-6 атомами углерода, гидроксизамещенный алкил с 1-6 атомами углерода, алкил с 1-6 атомами углерода, замещенный алкокси-группой с 1-6 атомами углерода, амино-замещенный алкил с 1-6 атомами углерода, арил- и тиозамещенный алкил с 1-6 атомами углерода, или R1 и R2 вместе образуют группу =O;
R3 означает Н, гидрокси-, алкокси-группа с 1-6 атомами углерода, -NR18R19, -SOR16, -SO2R17, -C(O)OR17, -C(O)NR18R19, алкил с 1-6 атомами углерода, галоген, фторзамещенный алкил с 1-6 атомами углерода, дифторзамещенный алкил с 1-6 атомами углерода, трифторзамещенный алкил с 1-6 атомами углерода, циклоалкил с 3-7 атомами углерода, алкенил с 2-6 атомами углерода, арилзамещенный алкил с 1-6 атомами углерода, арилзамещенный алкенил с 2-6 атомами углерода, гетероарилзамещенный алкил с 1-6 атомами углерода, гетероарилзамещенный алкенил с 2-6 атомами углерода, гидроксизамещенный алкил с 1-6 атомами углерода, аминозамещен-ный алкил с 1-6 атомами углерода, арил, тиозамещенный алкил с 1-6 атомами углерода, алкил с 1-6 атомами углерода, замещенный алкокси-группой с 1-6 атомами углерода или алкил с 1-6 атомами углерода, замещенный алкиламино-группой с 1-6 атомами углерода;
R34 означает (Н, R3), (H, R43), =O или =NOR17, если необязательная двойная связь отсутствует; R34 означает R44, если двойная связь присутствует;
Het означает моно-, би- или трициклическую гетероароматическую группу из 5-14 атомов, включающую 1-13 углеродных атомов и 1-4 гетероатома, независимо выбираемых из группы, включающей N, О и S, где кольцевой атом азота может образовывать N-оксид или четверичную группу с алкильной группой из 1-4 атомов углерода, где Het соединяется с В через кольцевой атом углерода и где Het-группа имеет 1-4 заместителя, W, независимо выбираемых из группы, включающей Н, алкил с 1-6 атомами углерода; фторозамещенный алкил с 1-6 атомами углерода; дифторзамещенный алкил с 1-6 атомами углерода; трифторзамещенный алкил с 1-6 атомами углерода; циклоалкил с 3-7 атомами углерода; гетероциклоалкил; гетероциклоалкил, замещенный алкилом с 1-6 атомами углерода, алкенилом с 2-6 атомами углерода, ОН-замещенным алкилом с 1-6 атомами углерода или =O; алкенил с 2-6 атомами углерода; R21-арилзамещенный алкил с 1-6 атомами углерода; R21-арилзамещенный алкенил с 2-6 атомами углерода; R21-арилокси; R21-арил-NH-; гетероарилзамещенный алкил с 1-6 атомами углерода; гетероарилзамещенный алкенил с 2-6 атомами углерода; гетероарилокси-; гетероарил-NH-; гидроксизамещенный алкил с 1-6 атомами углерода; дигидроксизамещенный алкил с 1-6 атомами углерода; аминозамещенный алкил с 1-6 атомами углерода; алкил с 1-6 атомами углерода, замещенный алкиламино-группой с 1-6 атомами углерода; ди-(алкил с 1-6 атомами углерода)-аминозамещенный алкил с 1-6 атомами углерода; тиозамещенный алкил с 1-6 атомами углерода; алкокси-группа с 1-6 атомами углерода; алкенилокси-группа с 2-6 атомами углерода; галоген; -NR4R5; -CN; -ОН; -COOR17; -COR16; -OSO2CF3; -СН2ОСН2CF3; алкилтио-группа с 1-6 атомами углерода; -C(O)NR4R5; -OCHR6-фенил; феноксиалкил с 1-6 атомами углерода; -NHCOR16; -NHSO2R16; бифенил; -C(R6)COOR7; -OC(R6)2C(O)NR4R5; алкокси-группа с 1-6 атомами углерода; -C(=NOR17)R18; алкокси-группа с 1-6 атомами углерода, имеющая следующие заместители: алкил с 1-6 атомами углерода, амино-группа, -ОН, -COOR17, -NHCOOR17, -CONR4R5, арил, арил, замещенный 1-3 заместителями, независимо выбираемыми из группы, включающей галоген, -CF3, алкил с 1-6 атомами углерода, алкокси-группу с 1-6 атомами углерода и -COOR17, арил, в котором соседние атомы углерода образуют кольцо с метилендиокси-группой, -C(O)NR4R5 или гетероарил;
R21 – арил; арил, в котором соседние атомы углерода образуют кольцо с метилендиокси-группой;
R41 – гетероарил; и гетероарил, в котором соседние атомы углерода образуют кольцо с алкилен-группой с 3-5 атомами углерода или с метилендиокси-группой;
R4 и R5 независимо выбираются из группы, включающей Н, алкил с 1-6 атомами углерода, фенил, бензил и циклоалкил с 3-7 атомами углерода, или R4 и R5 вместе представляют -(СН2)4-, -(СН2)5– или -(CH2)4NR7-CH2)2– и образуют кольцо с атомом азота, к которому они присоединены;
R6 независимо выбирается из группы, включающей Н, алкил с 1-6 атомами углерода, фенил, циклоалкил с 3-7 атомами углерода, алкил с 1-6 атомами углерода, замещенный циклоалкилом с 3-7 атомами углерода, алкил с 1-6 атомами углерода, замещенный алкокси-группой с 1-6 атомами углерода, гидрокси-алкил с 1-6 атомами углерода, и амино-алкил с 1-6 атомами углерода;
R7 означает Н или алкил с 1-6 атомами углерода;
R8, R10 и R11 независимо выбираются из группы, включающей Н, R1 и -OR1, при условии, что, когда присутствует необязательная двойная связь, R10 отсутствует;
R9 означает Н, ОН, алкокси-группа с 1-6 атомами углерода, галоген или галоалкил с 1-6 атомами углерода;
В означает -(CH2)n3, -CH2-O-,-CH2S-, -CH2NR6-, -C(O)NR6-, -NR6(CO)-, 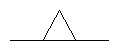 , цис- или транс -(CH2)n4CR12=CR12a(CH2)n5 или -(СН2)n4С , цис- или транс -(CH2)n4CR12=CR12a(CH2)n5 или -(СН2)n4С С(СН2)n5-, где n3 – 0-5, n4 и n5 -независимо 0-2, а R12 и R12a независимо выбираются из группы, включающей Н, алкил с 1-6 атомами углерода и галоген; С(СН2)n5-, где n3 – 0-5, n4 и n5 -независимо 0-2, а R12 и R12a независимо выбираются из группы, включающей Н, алкил с 1-6 атомами углерода и галоген;
Х означает -О- или -NR6-, когда двойной пунктир представляет простую связь, или Х -Н, -ОН или -NHR20, когда связь отсутствует;
Y означает =O, =S, (Н, Н), (Н, ОН) или (Н, алкокси-группа с 1-6 атомами углерода), когда двойной пунктир представляет простую связь, или, при отсутствии связи, Y означает =O, =NOR17, (Н, Н), (Н, ОН), (Н, SH), (Н, алкокси-группа с 1-6 атомами углерода) или (Н, -NHR45);
R15 отсутствует, когда двойной пунктир представляет простую связь; R15 означает Н, алкил с 1-6 атомами углерода, -NR18R19 или -OR17, когда связь отсутствует; или Y – 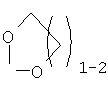 или или 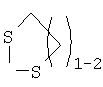 и R15 -Н или алкил с 1-6 атомами углерода; и R15 -Н или алкил с 1-6 атомами углерода;
R16 означает низший алкил с 1-6 атомами углерода, фенил или бензил;
R17, R18 и R19 независимо выбираются из группы, включающей Н, алкил с 1-6 атомами углерода, фенил, бензил;
R20 означает Н, алкил с 1-6 атомами углерода, фенил, бензил, -C(O)R6 или -SO2R6;
R21 означает 1-3 заместителя, независимо выбираемых из группы, включающей водород, -CF3, -OCF3, галоген, -NO2, алкил с 1-6 атомами углерода, алкокси-группу с 1-6 атомами углерода, аминогруппу, замещенную алкилом с 1-6 атомами углерода, аминогруппу, замещенную двумя алкил-группами с 1 -6 атомами углерода, аминоал-кил с 1-6 атомами углерода, алкил с 1-6 атомами углерода, замещенный (алкил с 1-6 атомами углерода)амино-группой, ди-(алкил с 1-6 атомами углерода)аминозамещенный алкил с 1-6 атомами углерода, гидроксиалкил с 1-6 атомами углерода, -COOR17, -COR17, -NHCOR16, -NHSO2R16, -NHSO2CH2CF3, гетероарил или -C( NOR17)R18; NOR17)R18;
R22 и R23 независимо выбираются из группы, включающей водород, R24-алкил с 1-10 атомами углерода, R24-алкенил с 2-10 атомами углерода, R24-алкинил с 2-10 атомами углерода, R27-гетероциклоалкил, R25-арил, R25-арилзамещенный алкил с 1-6 атомами углерода, R29-циклоалкил с 3-7 атомами углерода, R29-циклоалкенил с 3-7 атомами углерода, -ОН, -OC(O)R30, -C(O)OR30, -C(O)R30, -C(O)NR30R31, -NR30R31, -NR30C(O)R31, -NR30C(O)NR31R32, -NHSO2R30, -OC(O)NR30R31, R24-алкокси-группу с 1-10 атомами углерода, R24-алкенилокси-группу с 2-10 атомами углерода, R24-алкинилокси-группу с 2-10 атомами углерода, R27-гетероциклоалкилокси-группу,
R29-циклоалкилокси-группу с 3-7 атомами углерода, R29-циклоалкенилокси-группу с 3-7 атомами углерода, R29-циклоакил с 3-7 атомами углерода)-NH-,-NHSO2NHR16 и -CH(=NOR17);
или R22 и R10 вместе с атомом углерода, к которому они присоединены, или R23 и R11 вместе с атомом углерода, к которому они присоединены, независимо образуют R42-замещенное карбоциклическое кольцо из 3-10 атомов, или R42-замещенное гетероциклическое кольцо из 4-10 атомов, где 1-3 кольцевых атома независимо выбираются из группы, включающей -О-, -NH-и -SO0-2-, при условии, что, когда R22 и R10 образуют кольцо, необязательная двойная связь отсутствует;
R24 означает 1, 2 или 3 заместителя, независимо выбираемых из группы, включающей водород, галоген, -ОН, алкокси-группу с 1-6 атомами углерода, R35-арил, (алкил с 1-10 атомами углерода)-С(О)-, (алкенил с 2-10 атомами углерода)-С(О)-, (алкинил с 2-10 атомами углерода)-С(О)-, гетероциклоалкил, R26-циклоалкил с 3-7 атомами углерода, R26-циклоалкенил с 3-7 атомами углерода, -OC(O)R30, -C(O)OR30, -C(O)R30, -C(O)NR30R31, -NR30R31, -NR30C(O)R31, -NR30C(O)NR31R32, -NHSO2R30, -OC(O)NR30R31, R24-алкенилокси-группу с 2-10 атомами углерода, R24-алкинилокси-группу с 2-10 атомами углерода, R27-гетероциклоалкилокси-группу, R29-циклоалкилокси-группу с 3-7 атомами углерода, R29-алкенилокси-группу, замещенную циклом с 3-7 атомами углерода, R29-(циклоалкил с 3-7 атомами углерода)-NH-, -NHSO2NHR16 и -CH(=NOR17);
R25 означает 1, 2 или 3 заместителя, независимо выбираемых из группы, включающей водород, гетероциклоалкил, галоген, -COOR36, -CN, -C(O)NR37R38, -NR39C(O)R40, -OR36, циклоалкил с 3-7 атомами углерода, (циклоалкил с 3-7 атомами углерода)-(алкил с 1-6 атомами углерода), (алкил с 1-6 атомами углерода)(циклоалкил с 3-7 атомами углерода)-(алкил с 1-6 атомами углерода), (галоалкил с 1-6 атомами углерода)(циклоалкил с 3-7 атомами углерода)(алкил с 1-6 атомами углерода), гидроксиалкил с 1-6 атомами углерода, алкил с 1-6 атомами углерода, замещенный алкокси-группой с 1-6 атомами углерода, и R41-гетероарил; или две R25-группы на соседних кольцевых атомах углерода образуют слитую метилендиокси-группу;
R26 означает 1, 2, или З заместителя, независимо выбираемых из группы, включающей водород, галоген и алкокси-группу с 1-6 атомами углерода;
R27 означает 1, 2 или 3 заместителя, независимо выбираемых из группы, включающей водород, R28-алкил с 1-10 атомами углерода, R28-алкенил с 2-10 атомами углерода, R28-алкинил с 2-10 атомами углерода,
R28 означает водород, -ОН или алкокси-группу с 1-6 атомами углерода;
R29 означает 1, 2 или 3 заместителя, независимо выбираемых из группы, включающей водород, алкил с 1-6 атомами углерода, -ОН, алкокси-группу с 1-6 атомами углерода и галоген;
R30, R31 и R32 независимо выбираются из группы, включающей водород, алкил с 1-10 атомами углерода, алкил с 1-10 атомами углерода, замещенный алкокси-группой с 1-6 атомами углерода, R25-арил-алкил с 1-6 атомами углерода, R33-циклоалкил с 3-7 атомами углерода, R34-циклоалкил с 3-7 атомами углерода)(алкил с 1-6 атомами углерода), R25-арил, гетероциклоалкил, гетероарил, гетероциклоалкил-замещенный алкил с 1-6 атомами углерода и гетероарил-замещенный алкил с 1-6 атомами углерода;
R33 – водород, алкил с 1-6 атомами углерода, ОН-алкил с 1-6 атомами углерода или алкокси-группа с 1-6 атомами углерода;
R35 – 1-4 заместителя, независимо выбираемых из группы, включающей водород, алкил с 1-6 атомами углерода, -ОН, галоген, -CN, алкокси-группу с 1-6 атомами углерода, тригалоалкокси-группу с 1-6 атомами углерода, (алкил с 1-6 атомами углерода)-замещенную аминогруппу, ди(алкил с 1-6 атомами углерода)-замещенную аминогруппу, -OCF3, ОН-(алкил с 1-6 атомами углерода), -СНО, -С(O)(алкил с 1-6 атомами углерода)аминогруппу, -С(O)ди(алкил с 1-6 атомами углерода)аминогруппу, -NH2, -NHC(O)(алкил с 1-6 атомами углерода) и -N(алкил с 1-6 атомами углерода)С(O)(алкил с 1-6 атомами углерода);
R36 – водород, алкил с 1-6 атомами углерода, галоалкил с 1-6 атомами углерода, ди-галоалкил с 1-6 атомами углерода или трифторалкил с 1-6 атомами углерода,
R37 и R38 независимо выбираются из группы, включающей водород, алкил с 1-6 атомами углерода, арил-(алкил с 1-6 атомами углерода), фенил и циклоалкил с 3-15 атомами углерода, или R37 и R38 вместе представляют собой -(СН2)4-, -(СН2)5-или -(CH2)2-NR39-(CH2)2– и образуют кольцо с атомом азота, к которому они присоединены;
R39 и R40 независимо выбираются из группы, включающей водород, алкил с 1-6 атомами углерода, арил-(алкил с 1-6 атомами углерода), фенил и циклоалкил с 3-15 атомами углерода, или R39 и R40 в группе -NR39C(O)R40 вместе с атомами углерода и азота, к которым они присоединены, образуют циклический лактам, включающий 5-8 кольцевых членов;
R41 -1-4 заместителя, независимо выбираемые из группы, включающей водород, алкил с 1-6 атомами углерода, алкокси-группу с 1-6 атомами углерода, (алкил с 1-6 атомами углерода)-замещенную аминогруппу, ди(алкил с 1-6 атомами углерода)-замещенную аминогруппу, -OCF3, ОН-алкил с 1-6 атомами углерода, -СНО и фенил;
R42 – 1-3 заместителя, независимо выбираемые из группы, включающей водород, -ОН, алкил с 1 -6 атомами углерода и алкокси-группу с 1 -6 атомами углерода;
R43 – -NR30R31, -NR30C(O)R31, -NR30C(O)NR31R32, -NHSO2R30 или -NHCOOR17;
R44 – H, алкокси-группа с 1-6 атомами углерода, -SOR16, -SO2R17, -C(O)OR17, – C(O)NR18R19, алкил с 1-6 атомами углерода, галоген, фторалкил с 1-6 атомами углерода, дифторалкил с 1-6 атомами углерода, трифторалкил с 1-6 атомами углерода, циклоалкил с 3-7 атомами углерода, алкенил с 2-6 атомами углерода, арил(алкил с 1-6 атомами углерода), арил(алкенил с 2-6 атомами углерода), гетероарил(алкил с 1-6 атомами углерода), гетероарил(алкенил с 2-6 атомами углерода), гидроксиалкил с 1-6 атомами углерода, амино(алкил с 1-6 атомами углерода), арил, тио(алкил с 1-6 атомами углерода), алкил с 1-6 атомами углерода, замещенный алкокси-группой с 1-6 атомами углерода или (алкил с 1-6 атомами углерода)амино(алкил с 1-6 атомами углерода); и
R45 – H, алкил с 1-6 атомами углерода, -COOR16 или -SO2.
R2, R8, R10 и R11 каждый предпочтительно означают водород. R3 предпочтительно означает водород, ОН, алкокси-группу с 1-6 атомами углерода, -NHR18 или алкил с 1-6 атомами углерода. Переменная n предпочтительно представляет ноль. R9 – предпочтительно H, ОН или алкокси-группа. R1 – предпочтительно алкил с 1-6 атомами углерода, более предпочтительно – метил. Двойная пунктирная линия предпочтительно представляет простую связь; Х – предпочтительно -О-, a Y – предпочтительно =0 или (H, ОН). В – предпочтительно транс -СН=СН-. Het – предпочтительно пиридил, замещенный пиридил, хинолил или замещенный хинолил. Предпочтительными заместителями (W) в Het группе являются R21-арил, R41-гетероарил или алкил. Более предпочтительными являются соединения, в которых Het группа представляет 2-пиридил, замещенный по 5 положению R21-арилом, R41-гетероарилом или алкилом, или 2-пиридил, замещенный по 6 положению алкилом. R34 – предпочтительно (Н,Н) или (Н,ОН).
R22 и R23 предпочтительно выбираются из группы, включающей: ОН, алкил с 1-10 атомами углерода, алкенил с 2-10 атомами углерода, алкинил с 2-10 атомами углерода, трифтор-алкил с 1-10 атомами углерода, трифтор-алкенил с 2-10 атомами углерода, трифтор-алкинил с 2-10 атомами углерода, циклоалкил с 3-7 атомами углерода, R25-арил, R25-арил-алкил с 1-6 атомами углерода, R25-арилгидрокси-алкил с 1-6 атомами углерода, R25-арил-алкокси-алкил с 1-6 атомами углерода, (циклоалкил с 3-7 атомами углерода)-(алкил с 1-6 атомами углерода), алкокси-группу с 1-10 атомами углерода, (циклоалкил с 3-7 атомами углерода)-окси-группу, алкил с 1-6 атомами углерода, замещенный алкокси-группой с 1-6 атомами углерода, ОН-алкил с 1-6 атомами углерода, трифторалкокси-группу с 1-10 атомами углерода и R27-гетероциклоалкил-алкил с 1-6 атомами углерода. Наиболее предпочтительными являются соединения, в которых R22 и R23 независимо выбираются из группы, включающей алкил с 1-10 атомами углерода и ОН-алкил с 1-6 атомами углерода.
Соединения-антагонисты тромбинового рецептора по настоящему изобретению обладают антитромбической, антиатеросклеротической, антирестенозной, антикоагуляторной активностью и способностью препятствовать агрегации тромбоцитов. Связанными с тромбозом заболеваниями, которые можно лечить соединениями по настоящему изобретению, являются: тромбоз, атеросклероз, рестеноз, гипертензия, стенокардия, аритмия, сердечная недостаточность, инфаркт миокарда, гломерулонефрит, тромбический и тромбоэмболический удар, заболевания периферийных сосудов, другие сердечно-сосудистые заболевания, мозговая ишемия, воспалительные нарушения и рак, а также другие заболевания, в которых тромбин и его рецептор играют патологическую роль.
Соединения изобретения, которые связываются с каннабиноидными (СВ2) рецепторами, применимы при лечении ревматоидного артрита, системной эритематозной волчанки, множественного склероза, диабета, остеопороза, почечной ишемии, инсульта, мозговой ишемии, нефрита, воспалительных заболеваний легких и желудочно-кишечного тракта, и заболеваний дыхательных путей, таких как реверсивная обструкция дыхательных путей, хроническая астма и бронхит.
Это изобретение также относится к способу использования соединения формулы I при лечении тромбоза, агрегации тромбоцитов, коагуляции, рака, воспалительных или респираторных заболеваний, включающего введение соединения формулы I млекопитающему, нуждающемуся в таком лечении. В частности, настоящее изобретение относится к способу использования соединения формулы I при лечении тромбоза, атеросклероза, рестеноза, гипертензии, стенокардии, аритмии, сердечной недостаточности, инфаркта миокарда, гломерулонефрита, тромбического удара, тром-боэмболического удара, заболеваний периферийных сосудов, мозговой ишемии, рака, ревматоидного артрита, системной эритематозной волчанки, множественного склероза, диабета, остеопороза, почечной ишемии, инсульта, мозговой ишемии, нефрита, воспалительных заболеваний легких и желудочно-кишечного тракта, реверсивной обструкции дыхательных путей, хронической астмы или бронхита. Предполагается, что соединение этого изобретения может быть применимо при лечении более чем одного из приведенных заболеваний.
В другом аспекте, изобретение относится к фармацевтической композиции, включающей терапевтически эффективное количество соединения формулы I в фармацевтически приемлемом носителе.
Подробное описание изобретения
Если не определено иначе, термин “алкил” или “низший алкил” означает неразветвленные или разветвленные алкильные цепи из 1-6 атомов углерода, аналогично, термин “алкокси” относится к алкокси группам, включающим 1-6 атомов углерода.
Фторалкил, дифторалкил и трифторалкил означают алкильные цепи, в которых концевой атом углерода замещен 1, 2 или 3 атомами фтора, например, -CF3, -СН2CF3, -CH2CHF2 или -CH2CH2F. Галоалкил означает алкильную цепь, замещенную 1-3 галоатомами.
Термин “алкенил” означает неразветвленные или разветвленные цепи атомов углерода, имеющие в цепи одну или более двойных связей, сопряженных или несопряженных. Аналогично, термин “алкинил” означает неразветвленные или разветвленные цепи атомов углерода, имеющие одну или более тройных связей в цепи. В том случае, когда алкильная, алкенильная или алкинильная цепь соединяет две другие переменные и таким образом является двухвалентной, используют термины “алкилен”, “алкенилен” и “алкинилен”. Если не определено иначе, алкенильные и алкинильные цепи включают 1-6 атомов углерода.
Замещение алкильных, алкенильных и алкинильных цепей зависит от длины цепи и размера и природы заместителя. Специалистам в данной области техники будет понятно, что, в то время как более длинные цепи могут нести множественные заместители, более короткие алкильные цепи, например, метил или этил, могут иметь несколько заместителей – галогеновых атомов, в других случаях, вероятно, они могут иметь только один или два заместителя, отличных от водорода. Более короткие ненасыщенные цепи, например, этенил или этинил, обычно являются незамещенными, или заместители ограничены одной или двумя группами в зависимости от числа доступных углеродных связей.
“Циклоалкил” означает насыщенное углеродное кольцо из 3-7 атомов углерода, а “циклоалкилен” означает соответствующее двухвалентное кольцо, в котором места соединения с другими группами включают все позиционные и стереоизомеры. “Циклоалкенил” означает углеродное кольцо из 3 -7 атомов, содержащее одну или более ненасыщенных связей, но не являющееся ароматическим.
“Гетероциклоалкил” означает насыщенные кольца из 5 или 6 атомов, включающие 4-5 атомов углерода и 1 или 2 гетероатома, выбираемых из группы, включающей: -O-, -S-и -NR7-, связанные с остальной частью молекулы через атом углерода. Примерами гетероциклоалкильных групп являются 2-пирролидинил, тетрагидротиофен-2-ил, тетрагидро-2-фуранил, 4-пиперидинил, 2-пиперазинил, тетрагидро-4-пиранил, 2-морфолинил и 2-тиоморфолинил.
“Галоген” относится к фтор-, хлор-, бром- или йод-радикалам.
В случае, когда R4 и R5 связаны и образуют кольцо с атомом азота, к которому они присоединены, получаются следующие кольца: 1-пирролидинил, 1-пиперидинил и 1-пиперазинил, где пиперазинильное кольцо может быть замещено группой R7 по атому азота в 4 положении.
“Дигидрокси-алкил с 1-6 атомами углерода” относится к алкильной цепи, замещенной двумя гидроксильными группами по двум различным атомам углерода.
“Арил” означает фенил, нафтил, инденил, тетрагидронафтил или инданил.
“Гетероарил” означает отдельное кольцо или слитую с бензольным кольцом гетероароматическую группу из 5-10 атомов, включающую 2-9 атомов углерода и 1-4 гетероатома, независимо выбираемых из группы, включающей из N, О и S, при условии, что кольца не содержат прилегающих атомов кислорода и/или серы. Также сюда включаются N-оксиды кольцевых атомов азота, а также соединения, в которых кольцевой атом азота замещен алкильной группой с 1-4 атомами углерода с образованием четвертичного амина. Примерами гетероарильных групп из одного кольца являются пиридил, оксазолил, изоксазолил, оксадиазолил, фуранил, пирролил, тиенил, имидазолил, пиразолил, тетразолил, тиазолил, изотиазолил, тиадиазолил, пиразинил, пиримидил, пиридазинил и триазолил. Примерами гетероарильных групп, слитых с бензольным кольцом, являются индолил, хинолил, изохинолил, фталазинил, бензотиенил (т.е. тионафтенил), бензимидазолил, бензофуранил, бензоксазолил и бензофуразанил. Также сюда включаются все позиционные изомеры, например, 2-пиридил, 3-пиридил и 4-пиридил. W-замещенный гетероарил относится к таким группам, в которых кольцевые атомы углерода, которые могут быть замещены, имеют заместителей, определенных выше, или в которых прилежащие атомы углерода образуют кольцо с алкиленовой или метилендиокси-группой, или в которых атом азота в кольце Het может быть замещен R21-арилом или необязательно замещен алкильным заместителем, определенным в W.
Термин “Het” означает отдельное кольцо и группы, слитые с бензольным кольцом, как описано выше, а также трициклические группы, такие как бензохинолинил (например, 1,4 или 7,8) или фенантролинил (например, 1,7; 1,10; или 4,7). Het группы соединены с группой В через кольцевой атом углерода, например, Het-2-пиридил, 3-пиридил или 2-хинолил.
Примерами гетероарильных групп, в которых прилегающие атомы углерода образуют кольцо с алкиленовой группой, являются 2,3-циклопентенопиридин, 2,3-циклогексенопиридин и 2,3-циклогептенопиридин.
Термин “необязательная двойная связь” относится к связи, обозначенной одинарным пунктиром в среднем кольце структуры, приведенной для формулы I. Термин “необязательная простая связь” относится к связи, обозначенной в структуре формулы I двойным пунктиром между Х и атомом углерода, к которому присоединены Y и R15.
Описанные выше утверждения, в которых, например, указано, что R4 и R5 независимо выбираются из группы заместителей, означают, что R4 и R5 выбираются независимо, а также, что если переменные R4 и R5 встречаются в молекуле более одного раза, то эти заместители выбираются независимо. Специалистам в данной области техники будет понятно, что размер и природа заместителя(ей) влияют на число возможных заместителей.
В соединениях настоящего изобретения присутствует по крайней мере один асимметричный атом углерода, и поэтому все изомеры, включая диастереомеры и изомеры вращения, рассматриваются как составная часть этого изобретения. Изобретение включает (+) -и (-) -изомеры как в чистом виде, так и в виде смеси, включая рацемические смеси. Изомеры могут быть получены при использовании традиционных методов, либо путем взаимодействия оптически чистых или оптически обогащенных исходных материалов, либо путем разделения изомеров соединения формулы I.
Типичные предпочтительные соединения настоящего изобретения имеют следующую стереохимию:
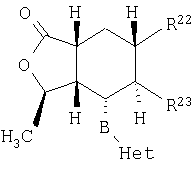
причем соединения точно с такой стереохимией являются более предпочтительными.
Специалистам в данной области техники будет понятно, что для некоторых соединений формулы I один изомер будет обладать большей фармакологической активностью, чем другие изомеры.
Соединения изобретения с основной группой могут образовывать фармацевтически приемлемые соли с органическими и неорганическими кислотами. Примерами кислот, подходящих для солеобразования, являются соляная, серная, фосфорная, уксусная, лимонная, щавелевая, малоновая, салициловая, яблочная, фумаровая, янтарная, аскорбиновая, малеиновая, метансульфоновая и другие минеральные и карбоновые кислоты, хорошо известные специалистам в данной области техники. Соль получают взаимодействием свободного основания с достаточным количеством требуемой кислоты. Свободное основание можно восстановить обработкой соли подходящим разбавленным водным основным раствором, таким как разбавленный водный раствор карбоната натрия. Свободное основание несколько отличается от его соответствующей соли по определенным физическим свойствам, таким как растворимость в полярных растворителях, но в остальном для целей изобретения соль эквивалентна соответствующему свободному основанию.
Некоторые соединения изобретения являются кислыми (например, те соединения, в которых есть карбоксильная группа). Эти соединения образуют фармацевтически приемлемые соли с неорганическими и органическими основаниями. Примерами таких солей являются соли натрия, калия, кальция, алюминия, лития, золота и серебра. Также сюда включаются соли, образованные с фармацевтически приемлемыми аминами, такими как аммиак, алкиламины, гидроксиалкиламины, N-метилглюкамины и подобные.
Соединения настоящего изобретения, как правило, получают при использовании процессов, известных в данной области техники, например, процессов, описанных ниже.
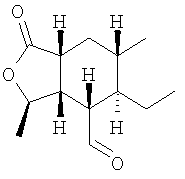
Соединения формулы IA, где n означает 0, необязательная двойная связь отсутствует, простая связь присутствует между Х и атомом углерода, с которым связан Y, Х – -О-, Y – =O, В – -СН=СН-, Het означает W-замещенный пиридил, R3, R8, R9, R10 и R11 каждый – водород, a R1 и R2 соответствуют определениям выше, можно получить путем конденсации альдегида формулы II, где переменные соответствуют определениям выше, с фосфонатом формулы III, где W соответствуют определениям выше:
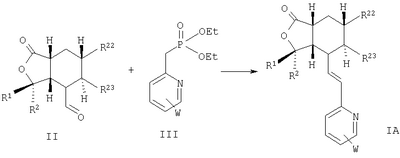
Аналогичные процессы могут быть использованы для получения соединений, включающих другие необязательно замещенные Het группы. Специалистам в данной области техники будет понятно, что процессы одинаково применимы для получения оптически активных или рацемических соединений.
Соединения формулы IA могут быть превращены в соответствующие соединения, в которых R3 означает ОН, путем обработки реактивом Дэвиса ((1S)-(+)-(10-камфорсульфонил)-оксазиридин) и LHMDS (бис(триметилсилил)амид лития).
Альдегиды формулы II могут быть получены из диеновых кислот, например, соединения формулы IIa, где R1 означает Н, а R2 означает метил, могут быть получены согласно следующей реакционной схеме.
Схема I:
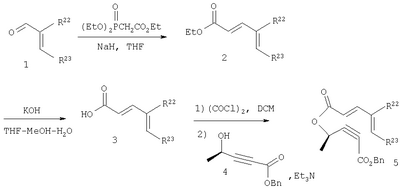
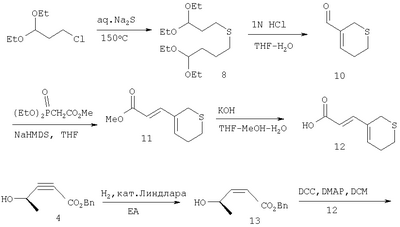
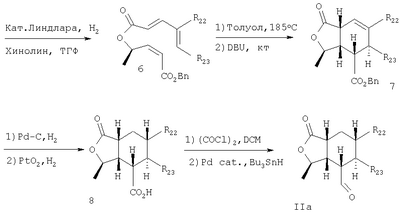 Алкин формулы 4, полученный известными методами, этерифицируют с диеновой кислотой формулы 3 в нормальных условиях с образованием эфира 5. Избирательное восстановление тройной связи соединения 5 при использовании катализатора Линдлара в атмосфере водорода дает промежуточное соединение 6, которое при термической циклизации при температуре около 185°С с последующей обработкой основанием дает промежуточное соединение 7. Эфир 7 подвергают гидрированию в присутствии оксида платины для получения промежуточной насыщенной карбоновой кислоты, обработка которой хлорангидридом щавелевой кислоты дает соответствующий хлорангидрид кислоты, который превращают в альдегид IIa восстановлением при использовании гидрида трибутилолова в присутствии палладиевого катализатора. Алкин формулы 4, полученный известными методами, этерифицируют с диеновой кислотой формулы 3 в нормальных условиях с образованием эфира 5. Избирательное восстановление тройной связи соединения 5 при использовании катализатора Линдлара в атмосфере водорода дает промежуточное соединение 6, которое при термической циклизации при температуре около 185°С с последующей обработкой основанием дает промежуточное соединение 7. Эфир 7 подвергают гидрированию в присутствии оксида платины для получения промежуточной насыщенной карбоновой кислоты, обработка которой хлорангидридом щавелевой кислоты дает соответствующий хлорангидрид кислоты, который превращают в альдегид IIa восстановлением при использовании гидрида трибутилолова в присутствии палладиевого катализатора.
Диеновые кислоты формулы 3 коммерчески доступны или легко получаемы.
Альдегиды формулы II также можно получить размыканием тиопиранового кольца, например, соединения формулы IIa, как описано выше, можно получить согласно следующей реакционной схеме.
Схема 2:
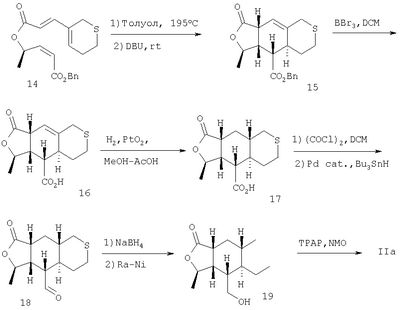
Алкин формулы 4 восстанавливают до алкена 13 при использовании катализатора Линдлара в атмосфере водорода. Алкен 13 этерифицируют диеновой кислотой формулы 12 в нормальных условиях, получают сложный эфир 14. После тепловой циклизации приблизительно при 185°С с последующей обработкой основанием получают промежуточное соединение 15. Сложный эфир 15 преобразуют в промежуточную карбоновую кислоту и восстанавливают двойную связь гидрированием в присутствии платинового катализатора. Затем кислоту обрабатывают хлорангидридом щавелевой кислоты, получают соответствующий хлорангидрид кислоты, который превращают в альдегид 18 восстановлением при использовании гидрида трибутилолова в присутствии палладиевого катализатора. Альдегидный фрагмент соединения 18 обрабатывают восстанавливающим агентом типа NaBH4, а серосодержащее кольцо затем размыкают обработкой реактивом типа никеля Ренея, получить спирт 19. Затем спирт окисляют до альдегида, IIa, при использовании перрутената тетрапро-пиламмония (ТРАР) в присутствии 4-метилморфолин N-оксида (NMO).
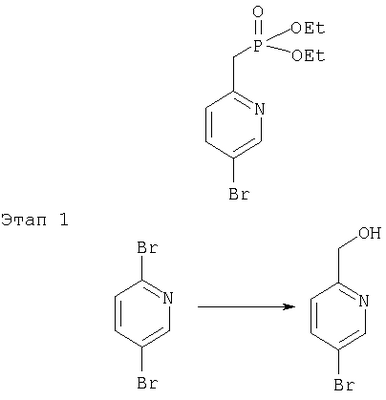
Фосфонаты формулы III, в которых W-арил или R21-арил, можно получить при использовании процесса, аналогичного описанному ниже для получения трифторме-тилфенил-замещенного соединения, IIIa.
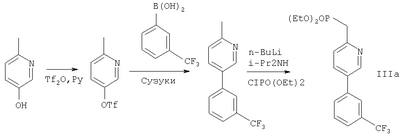
Коммерчески доступное производное гидроксипиридина при использовании триф-латного ангидрида преобразуют в соответствующий трифлат, который затем соединяют с коммерчески доступной бороновой кислотой в присутствии Pd(0) в условиях Сузуки. Полученный продукт преобразуют в фосфонат путем обработки n-бутиллитием с последующим гашением диэтилхлорфосфонатом.
Иначе соединения формулы I, в которых W является необязательно замещенным арилом, можно получить из соединений формулы I, в которых W означает -ОН, при использовании трифлатного промежуточного продукта. Например, 3-гидрокси-6-метилпиридин обрабатывают триизопропилсилил хлоридом, полученное соединение с защищенной ОН-группой превращают в фосфонат, как описано выше при получении промежуточного продукта IIIa. Затем триизопропилсилил-защищенный промежуточный продукт вводят в реакцию с промежуточным продуктом II и удаляют защитную группу в стандартных условиях. Затем полученное соединение формулы I, в котором W-ОН, обрабатывают трифлатным ангидридом при комнатной температуре в растворителе типа СН2Cl2; затем трифлат вводят в реакцию с необязательно замещенной арилбороновой кислотой, например, необязательно замещенной фенилбороновой кислотой, в растворителе типа толуола, в присутствии Pd(PPh3)4 и основания типа K2СО3 при повышенных температурах и в инертной атмосфере.
Соединения формулы I, в которых W – замещенная гидроксильная группа (например, бензилокси), можно получить из соединений формулы I, в которых W – гидрокси-группа, путем нагревания с обратным холодильником в подходящем растворителе, таком как ацетон, с галоген-замещенным соединением, таким как необязательно замещенный бензил бромид, в присутствии основания типа К2СО3.
Соединения формулы I, в которых группа Het замещена W через атом углерода (например, в которых W-алкил, алкенил или арилалкил) или атом азота (т.е. -NR4R5), можно получить как показано на Схеме 3, при использовании в качестве промежуточного продукта соединения формулы I, в котором W означает хлоралкил. Соединения формулы I, в которых W – полярная группа, такая как гидроксиалкил, дигидроксиалкил, -СООН, диметиламино и -СОН, можно получить как показано на Схеме 4, где исходным является соединение формулы I, в котором W – алкенил. На следующих Схемах 3 и 4 приведены хорошо известные условия реакции для получения различных W-замещенных соединений, в которых Х – -О-, Y -=O, R15 отсутствует, R1-метил, R2, R3, R9, R10 и R11 каждый -Н, В – -СН=СН-, a Het – 2-пиридил.
Схема 3
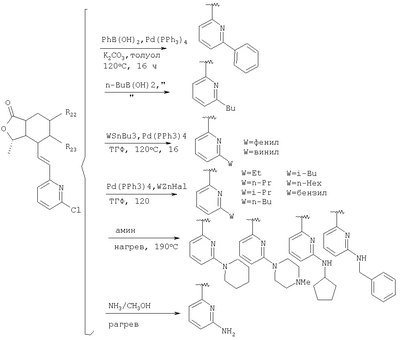
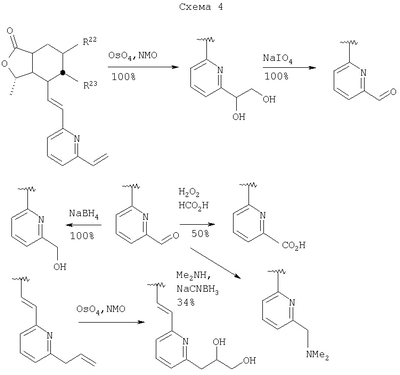
Специалистам в данной области техники будет понятно, что реакции, аналогичные приведенным на схемах, можно проводить и с другими соединениями формулы I, в том случае если присутствующие заместители устойчивы к описанным условиям реакции.
Соединения формулы I, в которых необязательная простая связь (представленная двойным пунктиром) отсутствует, Х означает ОН, Y означает ОН, R15 означает Н, а оставшиеся переменные соответствуют определениям выше, можно получить обработкой восстанавливающим агентом типа LAH (литийалюмогидрид) соответствующих соединений, в которых необязательная простая связь присутствует, Х означает -О-, Y означает =O, а R15 отсутствует.
Соединения формулы I, в которых необязательная простая связь присутствует, Х означает -О-, Y означает (Н, ОН), R15 отсутствует, а оставшиеся переменные соответствуют определениям выше, можно получить обработкой реагентом типа DIBAL (гидрид диизобутилалюминия) соответствующих соединений, в которых необязательная простая связь присутствует, Х – -О-, Y -=O и R15 отсутствует. Полученные соединения, в которых Y означает (Н, ОН) можно перевести в соответствующие соединения, в которых Y означает (Н, алкокси) реакцией гидрокси-соединения с соответствующим алканолом в присутствии реактива типа BF3 OEt2. Соединение, в котором Y означает (Н, ОН), можно также превратить в соответствующее соединение, в котором Y означает (Н, Н), обработкой гидрокси-соединения BF3 OEt2. Соединение, в котором Y означает (Н, ОН), можно также превратить в соответствующее соединение, в котором Y означает (Н, Н), обработкой гидрокси-соединения BF3 OEt2 и Et3SiH в инертном растворителе типа СН2Cl2 при низкой температуре. OEt2 и Et3SiH в инертном растворителе типа СН2Cl2 при низкой температуре.
Соединения формулы I, в которых R9 – Н, могут быть преобразованы в соответствующие соединения, в которых R9-гидрокси, путем нагревания с окислителем типа SeO2.
Соединения формулы IB, в которых R2 – Н, R3 – Н или ОН, a W1 – R21-арил, R41 – гетероарил, амино или гидроксиамино производное, можно получить из соединений формулы IA, в которых W – 5-бром-(соединения формулы 23 или 24), при использовании ряда стандартных химических превращений, например реакции Сузуки, присоединения Штилля и аминирования Бухвальда. На Схеме 5 представлен процесс для 2,5-дибромпиридина:
Схема 5:
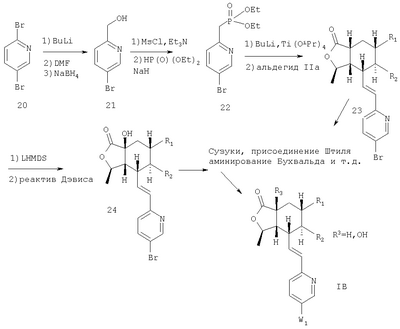
Фосфонат 22 получают из известного спирта 21 в два этапа: спирт обрабатывают СН3SO2Cl, получают мезилат, который затем замещают диэтилфосфитом натрия и получают соединение 22. Промежуточный продукт 23 можно также  -гидроксилировать при использовании реактива Дэвиса, чтобы получить спирт 24. И 23, и 24 можно преобразовать в различные аналоги, как показано на Схеме 6: -гидроксилировать при использовании реактива Дэвиса, чтобы получить спирт 24. И 23, и 24 можно преобразовать в различные аналоги, как показано на Схеме 6:
Схема 6:
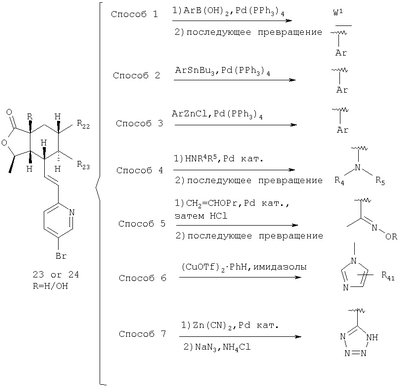
Как показано на Схеме 6, бромид (23 или 24) можно соединить с бороновыми кислотами в условиях палладиевого катализа (способ 1). Если у бороновой кислоты есть функциональная группа, ее можно затем преобразовать. Аналогично можно соединять соединения арилолова (способ 2), арил-цинковые соединения (способ 3) и амины (способ 4). По реакции Хека с виниловыми эфирами можно ввести кето-группу, которая может быть затем функционализирована (способ 5). Имидазолы можно соединять при использовании трифлата меди (I) в качестве катализатора (способ 6). Бромид можно также превратить в цианид, который может быть впоследствии преобразован, например, в тетразол (способ 7).
При использовании реакции Дильса-Альдера, как показано на Схеме 7, можно соединить ряд диеновых кислот 3 со спиртом 25, а сложный эфир 26 можно подвергнуть тепловой циклизации и получить продукт Дильса-Альдера IC:
Схема 7:
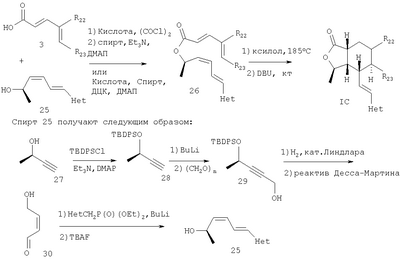
Спирт 25 получают из легко доступного (R)-(+)-3-бутин-2-ола 27. Спирт защищают в виде его TBDPS эфира (трет-бутилдифенилсилил эфира), алкин депротонируют и обрабатывают параформальдегидом, получают спирт 29. Алкин восстанавливают до цис-алкена при использовании катализатора Линдлара в присутствии хинолина, аллиловый спирт окисляют, получают альдегид 30, который преобразуют в спирт 25.
Соединения формулы ID, в которых R – -СН2ОС(O)СН3 или его производное, R23-этил, R2 означает Н, а оставшиеся переменные соответствуют определениям для IA, можно получить из соответствующего тетрагидропиран-аналога путем размыкания кольца. Соединения формулы ID можно превратить в другие соединения формулы I, например, соединения формулы IE, в которых R22 означает -СН2ОН, используя хорошо известные методы. Реакция приведена на Схеме 8.
Схема 8:
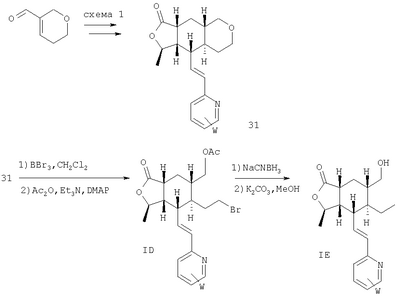
Аналог тетрагидропирана 31 можно получить из 3-формил-5,6-дигидро-2Н-пирана (известное соединение), используя процедуру, аналогичную приведенной в Схеме 1. Кольцо можно региоселективно разомкнуть при использовании BBr3, а этиловый спирт можно защитить преобразованием в ацетат ID. После восстановления бромида NaCNBH3 с последующим ацетатным снятием защиты получают спирт IE.
Исходные соединения для описанных выше процессов или являются коммерчески доступными, известными в данной области техники, или получаются при использовании процессов, хорошо известных в данной области техники.
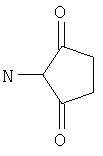
Реактивные группы, не участвующие в описанных выше процессах, могут быть защищены в течение реакций обычными защитными группами, которые могут быть удалены после реакции стандартными способами. В следующей Таблице А приведены некоторые типичные защитные группы:
| Таблица А |
| Защищаемая группа |
Защищаемая группа и Защитная группа |
| -СООН |
-COOлакил, -СООбензил-СООфенил |
 |
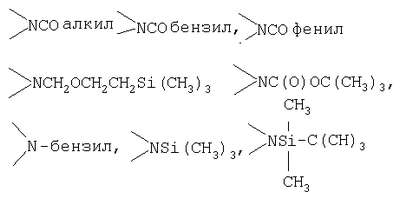 |
| -NH2 |
 |
| -ОН |
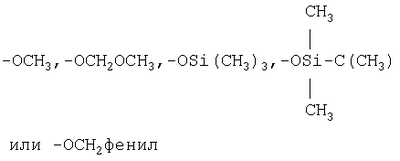 |
Настоящее изобретение также относится к фармацевтической композиции, включающей соединение формулы I этого изобретения и фармацевтически приемлемый носитель. Соединения формулы I могут применяться в любой обычной дозировочной форме для орального применения, такой как капсулы, таблетки, порошки, облатки, суспензии или растворы. Составы и фармацевтические композиции могут быть получены при использовании традиционных фармацевтически приемлемых наполнителей и добавок и обычных способов. Такие фармацевтически приемлемые наполнители и добавки включают нетоксичные совместимые наполнители, связующие компоненты, дезинтегрирующие агенты, буферы, консерванты, антиоксиданты, смазочные вещества, вкусовые добавки, загущающие агенты, красители, эмульгаторы и подобные.
Суточная доза соединения формулы I для лечения заболевания или состояния, указанного выше – приблизительно от 0,001 до 100 мг/кг массы тела в сутки, предпочтительно приблизительно от 0,001 до 10 мг/кг. Таким образом, для средней массы тела 70 кг уровень дозировки составляет приблизительно от 0,1 до 700 мг лекарственного средства в сутки, в однократной дозе или 2-4 дробных дозах. Точная доза, однако, определяется лечащим врачом и зависит от силы применяемого соединения, возраста, массы, состояния и реакции пациента.
Далее приведены примеры получения исходных материалов и соединений формулы I. В процедурах используются следующие сокращения: комнатная температура (кт), тетрагидрофуран (THF, ТГФ), диэтиловый эфир (Et2O), метил (Me), этил (Et), этил-ацетат (EtO2Ас), диметилформамид (DMF, ДМФ), 4-диметиламинопиридин (DMAP, ДМАП), 1,8-диазабицикло [5.4.0]ундец-7-ен (DBU), 1,3-дициклогексилкарбодиимид (ДСС.ДЦК).
Процесс 1
Этап 1:
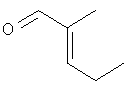
См. J. Org. Chem., 59 (17) (1994), стр. 4789.
Этап 2:
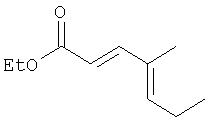
К суспензии 60 % NaH (7,42 г, 185,5 ммоль, 1,3 экв.) в 300 мл ТГФ при 0°С добавляли по каплям триэтилфосфоноацетат (37 мл, 186,5 ммоль, 1,3 экв.) и смесь перемешивали при 0°С 30 мин. Добавляли продукт Этапа 1 (14,0 г, 142,7 ммоль) и смесь перемешивали при 0°С 30 мин. Реакцию останавливали добавлением водного раствора NH4Cl (500 мл), ТГФ упаривали и водную фазу экстрагировали 3×200 мл Et2O, объединенный органический слой промывали солевым раствором (300 мл), сушили над MgSO4, фильтровали и упаривали, получали неочищенную смесь, которую хроматографировали (5% Et2O-гексан), получали 18,38 г (выход 77%) жидкости.
1Н ЯМР (400 МГц, CDCl3) 7,29 (d, 1Н, J=15,4), 5.86 (t, 1H, J=7,4), 5,76 (d, 1H, J=15,4), 4,18 (q, 2H, J=7,2), 2,22-2,15 (m, 2H), 1,74 (d, 3H, J=0,7), 1,27 (t, 3H, J=7,2), 1.00(t,3H,J=7,7)
13С ЯМР(100МГц,CDCl3) 167,29, 149,38, 143.45, 132,04, 115,39, 60,08,22,14, 14,42, 13,58, 12,05
МС: 169 (МН+)
Этап 3:
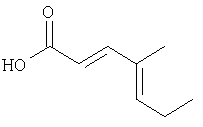
К раствору продукта Этапа 2 (6,4 г, 38 ммоль) в ТГФ и МеОН (40 мл каждого) добавляли раствор КОН (6,4 г, 114 ммоль, 3 экв.) в Н2О (40 мл). Смесь перемешивали при комнатной температуре 2 часа, охлаждали до 0°С и добавляли Н2O (100 мл), и 1н.HCl (150 мл). Смесь экстрагировали EtOAc (3×100, мл), объединенный органический слой промывали H2О (150 мл) и солевым раствором (150 мл), сушили над MgSO4, фильтровали и упаривали, получали 5,26 г (выход 99%) кристаллического твердого вещества.
1Н ЯМР (400 МГц,CDCl3) 7.40 (d, 1Н, J=16), 5.95 (t, 1H, J=7.2), 5.79 (d, 1H, J=16), 2.26-2.19 (m, 2H), 1.78 (s, 3H), 1.04 (t, 3H, J= 7.6)
Этап 4:
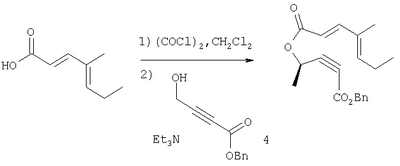
К раствору продукта Этапа 3 (2,0 г, 14,3 ммоль) в CH2Cl2 (70 мл) добавляли последовательно хлорангидрид щавелевой кислоты (2,5 мл, 28,7 ммоль, 2 экв.) и ДМФ (33 мкл, 3% мол). Смесь перемешивали при комнатной температуре 1 час, затем упаривали растворитель, получали неочищенный хлорангидрид кислоты, который растворяли в CH2Cl2 (70 мл) и охлаждали до 0°С. Добавляли ДМАП (175 мг, 1,43 ммоль, 0,1 экв.) и раствор спирта 4 (2,62 г, 12,8 ммоль, 0,9 экв.) в CH2Cl2 (5 мл), затем Et2N (4 мл, 28,7 ммоль, 2 экв.). Смесь перемешивали при 0°С 2 часа, разбавляли Et2O (200 мл), промывали водным раствором NaHCO3 и солевым раствором (200 мл каждого) и сушили над MgSO4. Раствор фильтровали, концентрировали, полученный остаток хроматографировали (5% EtOAc – гексан), получали 3,56 г (85 %) светло-желтого смолистого вещества.
1Н ЯМР (400 МГц, CDCl3) 7.38-7.33 (m, 6H), 5.93 (t, 1H, J=7.4), 5.77 (d, 1H, J=15.6), 5.62 (q, 1H, J=6.2), 5.20 (s, 2H), 2.25-2.18 (m, 2H), 1.76 (d, 3H. J=0.4), 1.58 (d. 3H, J=6.2),1.03(t,3H,J=7.4)
Этап 5:
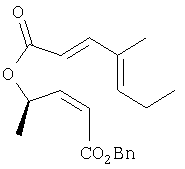
К раствору продукта Этапа 4 (3,19 г, 9,8 ммоль) в ТГФ (50 мл) добавляли катализатор Линдлара (320 мг, 10 масс.%) и хинолин (230 мкл, 2,0 ммоль, 0,2 экв.). Суспензию перемешивали при 1 атм. Н2 до превращения исходного материала. Раствор фильтровали через целит и упаривали. Смолу растворяли в EtOAc (250 мл) и промывали 1н.HCl (3×100 мл) и солевым растворома (100 мл). Раствор сушили над MgSO4, фильтровали и упаривали, получали 3,17 г неочищенного алкена, который непосредственно использовался на следующем этапе.
Этап 6:
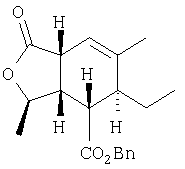
Раствор продукта Этапа 5 (3,15 г, 9,6 ммоль) в м-ксилоле (100 мл) нагревали при 185°С 10 час. Раствор охлаждали до комнатной температуры и перемешивали 1 час с DBU (290 мкл, 1,94 ммоль, 0,2 экв.). Растворитель упаривали, неочищенный продукт хроматографировали (10% EtOAc – гексан), получали 1,1 г (35 %) ехо продукта.
1Н ЯМР (400 МГц, CDCl3) 7.38-7.34 (m, 5H), 5.45 (br s, 1H), 5.14 (ABq, J=12.0, 22.8, 2H), 4.52 (dq, J=6.1, 8.1, 1H), 3.26-3.23 (m, 1H), 2.87 (dd, J=9.4, 4.6, 1H), 2.62 (dt, J=8.1, 4.5, 1H), 2.54 (br s, 1H), 1.71 (t, J=1.2, 3H), 1.69-1.60 (m, 1H), 1.50-1.44 (m, 1H), 1.20 (d, J=6.4, 3H), 0.77 (t, J=7.4, 3H)
13С ЯМР (100 МГц, CDCl3) 175.25, 173.04, 137.86, 135.00, 128.38, 128.34, 128.30, 116.54, 76.64, 66.70, 42.85, 42.14, 41.40, 37.27, 22.52, 21.65, 20.44, 8.98 [ ]22 D=-64.4(c 1,CH2Cl2) ]22 D=-64.4(c 1,CH2Cl2)
МСВР: 329.1754, вычисленный 329.1753
Этап 7:
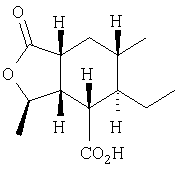
К раствору продукта Этапа 6 (1,35 г, 4,1 ммоль) в EtOAc (30 мл) добавляли 10%-ый Pd-C (140 мг, 10 %вес) и суспензию перемешивали под баллоном с Н2 5 часов. Смесь фильтровали через целит, концентрировали. Неочищенный материал растворяли в МеОН (30 мл), добавляли PtO2 (100 мг) и смесь встряхивали в сосуде Парра при 50 фунт/дюйм2 Н2 в течение 2 дней. Смесь фильтровали через целит и упаривали, получали 980 мг (99 %) кислоты в виде пены.
1Н ЯМР (400 МГц, CDCl3) 4.73-4.66 (m, 1H), 2.71 (dd, J=11.8, 5.4, 1H), 2.68-2.62 (m, 1H), 2.53 (dt, J=10.0, 6.4, 1H), 1.92 (ddd, J= 13.4, 6.0, 2.6, 1H), 1.63-1.57 (m, 1H), 1.52-1.20 (неразрешенный m, 3H), 1.30 (d, J=5.9, 3H), 0.96 (d, J=6.6, 3H), 0.93-0.89 (m, 1H), 0.80 (t, J=7.5, 3H)
МС:319.1 (МН+ ДМСО)
Этап 8:
К раствору продукта Этапа 7 (490 мг, 2,04 ммоль) в CH2Cl2 (20 мл) последовательно добавляли хлорангидрид щавелевой кислоты (360 мкл, 4,13 ммоль, 2 экв.) и 1 каплю ДМФ. Раствор перемешивали при комнатной температуре 1 час, удаляли растворитель, получали неочищенный хлорангидрид кислоты, который растворяли в толуоле (20 мл) и охлаждали до 0°С. К этому раствору добавляли Pd(PPh3)4 (236 мг, 0,20 ммоль, 0,1 экв.), затем Bu3SnH (825 мкл, 3,07 ммоль, 1,5 экв.). Смесь перемешивали 3 часа при 0°С, концентрировали и хроматографировали (25% EtOAc – гексан), получали 220 мг целевого соединения (48 %) в виде смолы.
1Н ЯМР (400 МГц, CDCl3) 9.72 (d, J=3.6, 1H), 4.70 (dq, J=5.7, 9.5, 1H), 2.71-2.64 (m, 2Н), 2.56-2.51 (m, 1H), 1.98 (ddd, J=13.5, 6.1, 2.9, 1H), 1.68-1.59 (m, 3H), 1.52-1.37 (m, 1H), 1.36 (d, J=5.9, 3H), 1.32-1.20 (m, 1H), 1.00 (d, J=6.2, 3H), 0.80 (d, J=7.3, 3Н)
Процесс 2
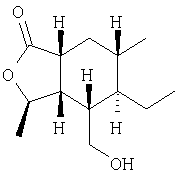
Этап 1:
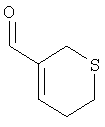
Тиопиран энал получали согласно процедуре, описанной McGinnis and Robinson, J. Chem. Soc., 404 (1941), 407.
Этап 2:
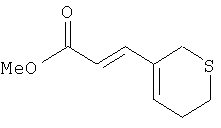
К суспензии 60% NaOH (6,3 г, 158 ммоль, 1,3 экв.) в ТГФ (200 мл) при 0°С добавляли метилдиэтилфосфоноацетат (29 мл, 158 ммоль, 1,3 экв.) и перемешивали реакционную смесь при 0°С 30 минут. Затем раствор переносили в раствор продукта Этапа 1 (15.6 г, 122 ммоль) в ТГФ (100 мл) и перемешивали при 0°С 1 час. Реакцию останавливали добавлением водного раствора NH4Cl (500 мл) и упаривали ТГФ. Водную фазу экстрагировали Et2O (3×200 мл) и объединенный органический слой промывали Н2O и солевым раствором (200 мл каждого). Раствор сушили над MgSO4, концентрировали и полученный остаток хроматографировали (5% EtOAc – гексан), получали 13,0 г (58%) маслянистого вещества.
1Н ЯМР (400 МГц, CDCl3) 7.26 (d, J=15.9 Гц, 1Н), 6.26 (t, J=4.4 Гц, 1Н), 5.78 (dd, J -15.9, 0.6 Гц, 1Н), 3.75 (s, 3H), 3.25-3.23 (m, 2H), 2.71 (t, J=5.8 Гц, 2Н), 2.57-2.53 (m, 2H).
Этап 3:
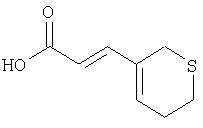
К раствору продукта Этапа 2 (13,0 г, 70,6 ммоль) в ТГФ и МеОН (50 мл каждого) добавляли раствор КОН (11,9 г, 212 ммоль, 3,0 экв.) в Н2O (50 мл). Реакционную смесь перемешивали при комнатной температуре 1 час, разбавляли Н2О (100 мл) и подкисляли 1 н. HCl. Водную фазу экстрагировали EtOAc (3×200 мл) и объединенный органический слой промывали Н2O и солевым раствором (300 мл каждого). Раствор сушили над MgSO4, фильтровали и упаривали, получали 11,66 г (97%) светло-желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) 7.34 (d, J=15.6 Гц, 1H), 6.32 (t, J=4.4 Гц, 1Н), 5.78 (d, J=15.6 Гц, 1H), 3.26 (d,J=1.6 Гц, 2Н), 2.72 (t, J=5.8 Гц, 2Н), 2.59-2.55 (m, 2H).
Этап 4:
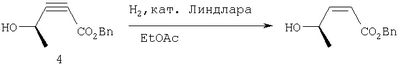
К раствору 4 (5,2 г) в EtOAc (120 мл) добавляли катализатор Линдлара (520 мг) и перемешивали суспензию при 1 атм. H2. Через 45 минут добавляли следующую порцию катализатора (500 мг) и перемешивали реакционную смесь еще 30 минут. Смесь фильтровали через слой целита и упаривали, получали 5,2 г (99%) требуемого алкена.
1Н ЯМР (400 МГц, CDCl3) 7.38-7.26 (m, 5H), 6.32 (dd, J=11.9, 6.6 Гц, 1H), 5.86 (d, J=12.0 Гц, 1H), 5.18 (s, 2H), 5.12-5.07 (m, 1H), 3.20 (br s, 1H), 1.34 (d, J=6.6 Гц, 3Н).
Этап 5:
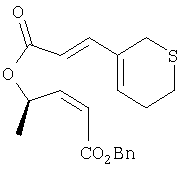
К раствору продукта Этапа 3 (2,45 г, 14,39 ммоль) в СН2Cl2 (60 мл) при 0°С добавляли последовательно ДЦК (3,27 г, 15,85 ммоль, 1,1 экв.) и ДМАП (352 мг, 2,88 ммоль, 0,2 экв.) и перемешивали реакционную смесь при 0°С 30 минут. Добавляли раствор 3,27 г (15,85 ммоль, 1,1 экв.) спирта из Этапа 4 в 10 мл CH2Cl2 и перемешивали 5 часов при 0°С и 1 час при комнатной температуре. Раствор разбавляли 350 мл Et2O и промывали 2×200 мл водного раствора лимонной кислоты, 200 мл водного раствора NaHCO3 и 200 мл солевого раствора. Раствор сушили над MgSO4, фильтровали, концентрировали и полученный остаток хроматографировали (6% EtOAc – гексан), получали 2,1 г (41%) смолы.
1Н ЯМР (400 МГц, CDCl3) 7.38-7.32 (m, 5H), 7.45 (d, J=16.0 Гц, 1H), 6.38-6.34 (m, 1H), 6.26 (t, J=4.6 Гц, 1H), 6.21 (d, J=11.6 Гц, 1H), 6.19 (d, J=11.2 Гц, 1H), 5.85 (dd, J=11.6, 1.2 Гц, 1H), 5.76 (d, J=16.0 Гц, 1H), 5.18 (d, J=1.2 Гц, 2H), 3.24 (d, J=2.0 Гц, 2H), 2.71 (t, 2H, J=5.6 Гц, 2H), 2.56-2.52 (m, 2H), 1.41 (d, J=6.4 Гц, 3H)
Этап 6:
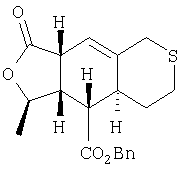
Раствор продукта Этапа 5 (2,1 г, 5,85 ммоль) в м-ксилоле (50 мл) нагревали при 200°С 6 часов в герметичном сосуде. Раствор охлаждали до комнатной температуры и перемешивали с DBU (178 мкл, 1,19 ммоль, 0,2 экв.) 1 час, концентрировали и хроматографировали (15% EtOAc – гексан), получали 1,44 г (69%) требуемого ехо продукта.
1Н ЯМР (400 МГц, CDCl3) 7.39-7.35 (m, 5Н), 5.46 (br s, 1H), 5.16 (ABq, J=21.6, 12.0 Гц, 2Н), 4.42 (dq, J=9.2, 6.0 Гц, 1H), 3.36-3.33 (m, 2H), 3.08 (dd, J=14.4, 2.4 Гц, 1H), 2.85 (ddd, J= 13.9, 12.4, 2.5 Гц, 1H), 2.72-2.57 (m, 4H), 2.27-2.21 (m, 1H), 1.47-1.25 (m, lH),1.12(d,J=6.4Гц,3H)
Этап 7:
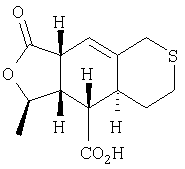
К раствору продукта Этапа 6 (750 мг, 2?09 ммоль) в CH2Cl2 (10 мл) при -78°С добавляли BBr3 в СН2Cl2 (4,2 мл 1М раствора). Раствор перемешивали 30 минут при -78°С и 30 минут при 0°С, затем вливали в водный раствор К2СО3 (100 мл). Водную фазу промывали Et2O (2×50 мл) и вновь экстрагировали органический слой водным раствором К2СО3 (50 мл). Объединенную водную фазу подкисляли 1 н. HCl и экстрагировали EtOAc (3×50мл). Слой EtOAc промывали солевым раствором (50 мл), сушили над MgSO4, фильтровали и упаривали, получали 500 мг (89%) кислоты.
1Н ЯМР (400 МГц, CDCl3) 5.50 (br s, 1H), 4.47 (dq, J=9.6, 6.0 Гц, 1H), 3.43-3.39 (m, 1H), 3.36 (d, J=15.6 Гц, 1H), 3.10 (dd, J= 14.0, 2.4 Гц, 1H), 2.91-2.84 (m, 1H), 2.82-2.77 (m, 1H), 2.70 (dd, J=10.6, 4.2 Гц, 1H), 2.69-2.63 (m, 1H), 2.57-2.52 (m, 1H), 2.34-2.29 (m, 1H), 1.53-1.42 (m, 1H), 1.34 (d, J=6.0 Гц, 3H).
Этап 8:
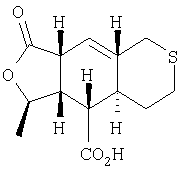
К раствору продукта Этапа 7 (500 мг, 1,86 ммоль) в МеОН (30 мл) добавляли АсОН (3 мл) и PtO2 (250 мг) и встряхивали суспензию при 40 фунт/дюйм2 H2 в сосуде Парра в течение 1,5 дня. Катализатор отфильтровывали через слой целита, раствор концентрировали и полученный остаток растворяли в смеси AcOH-MeOH-CH2Cl2 (0.5:2:97.5 об./об./об.) и фильтровали через короткую колонку с SiO2, получали 400 мг (79%) восстановленного продукта в виде смолы, которая при стоянии затвердевала.
1H ЯМР (400 МГц, CDCl3) 4.68 (dq, J=9.4, 5.9 Гц, 1H), 2.76-2.69 (m, 2H), 2.60-2.55 (m, 3H), 2.49 (d, J=11.6 Гц, 1H), 2.10 (br s, 1H), 1.93 (ddd, J=13.5, 6.0, 2.7 Гц, 1H), 1.60-1.48 (m, 2H), 1.45-1.19 (m, 3H), 1.33 (d, J=5.6 Гц, 3H).
Этап 9:
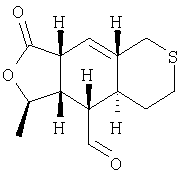
К раствору продукта Этапа 8 (97 мг, 0,36 ммоль) в CH2Cl2 (4 мл) добавляли последовательно хлорангидрид щавелевой кислоты (94 мкл) и 1 каплю ДМФ. Раствор перемешивали 1 час при комнатной температуре и концентрировали, получали неочищенный хлорангидрид кислоты, который растворяли в толуоле (3 мл) и охлаждали до 0°С. Последовательно добавляли Pd(PPh3)4 (42 мг, 0,04 ммоль, 0,1 экв.) и Bu3SnH (94 мкл). Реакционную смесь перемешивали при 0°С 3 часа, концентрировали и хро-матографировали (25% EtOAc – гексан), получали 73 мг (80%) альдегида в виде белого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) 9.75 (d, J=2.8 Гц, 1H), 4.62 (dq, J=9.7, 6.0 Гц, 1H), 2.8-2.70 (m, 2H), 2.65-2.55 (m, 3H). 2.50 (d, J=7.2 Гц), 2.10 (ddd, J=13.2, 6.4, 3.0 Гц, 1Н), 1.94 (ddd, J=13.6, 6.0, 3.0 Гц, 1H), 1.69 (dq, J=10.9 Гц, 3.00 Гц, 1Н), 1.58-1.48 (m, 1H), 1.42-1.20 (m, 3H), 1.33(d, J=6.4 Гц, 3H).
Этап 10:
К раствору продукта Этапа 9 (90 мг, 0,35 ммоль) в МеОН (10 мл) (4:1 об./об.) при 0°С добавляли избыток NaBH4 и реакционную смесь перемешивали 15 минут при 0°С. Реакцию останавливали водным раствором NH4Cl (50 мл) и экстрагировали EtOAc (3×20 мл). Объединенный органический слой промывали солевым раствором (50 мл), сушили над MgSO4 и концентрировали, получали неочищенный спирт. Раствор спирта в МеОН-ТГФ (6 мл, 1:1 об./об.) добавляли в колбу с избытком никеля Ренея, промытого диоксаном и ТГФ. Суспензию нагревали с обратным холодильником 3 часа, охлаждали, фильтровали, концентрировали и хроматографировали (25% EtOAc – гексан), получали 54 мг (67%) целевого соединения в виде смолы.
1Н ЯМР (400 МГц, CDCl3) 4.70 (dq, J=9.7, 5.9 Гц, 1Н), 3.73 (dd, J=10.5, 3.4 Гц, 1Н), 3.62 (dd, J=10.5, 7.6 Гц, 1Н), 2.60-2.53 (m, 1H), 2.46 (ddd, J == 9.6, 7.2, 5.2 Гц, 1Н), 1.90 (ddd, J= 13.5, 6.1, 3.1 Гц, 1Н). 1.87-1.81 (т,1Н), 1.77 (brs. 1H), 1.66-1.59 (m.lH), 1.50 (d, J=6.0 Гц, 3H), 1.48-1.36 (m, 2Н), 1.25-1.14 (m, 2H), 0.93 (d, J=6.6 Гц, 3H), 0.78 (d, J=7.5 Гц, 3H)
13С ЯМР (100 МГц, CDCl3) 178.58, 77.63, 61.79, 45.10, 42.49, 39.37, 38.65, 33.44, 31.96,21.39,19.91,19.74,7.26.
Процесс 3
Получено согласно процедуре, описанной в работе Wang et. al. Tet. Lett, 41, (2000), р.4335-4338.
Этап 2:
К раствору продукта Этапа 1 (20 г, 106 ммоль) и Et3Н (17,8 мл, 128 ммоль, 1,2 экв.) в CH2Cl2 (300 мл) при -30°С медленно добавляли СН3SO2Cl (9,1 мл, 118 ммоль, 1,1 экв.). Взвесь перемешивали 1 час, пока она нагревалась до 0°С. Реакционную смесь разбавляли водным раствором NaHCO3 (500 мл) и отделяли органический слой.
Водный слой экстрагировали Et2O (2×200 мл) и объединенный органический слой промывали водным раствором NaHCO3 (2×300 мл) и солевым раствором (300 мл).
Раствор сушили над MgSO4, фильтровали и упаривали, получали неочищенный мезилат, который непосредственно использовали на следующем этапе.
1Н ЯМР: 8.67 (d, J=2.0 Гц, 1H), 7.89 (dd, J=8.4, 2.4 Гц, 1Н), 7.33 (d, J=8.4 Гц. 1Н), 5.28(s,2H),3.10(s,3H).
Этап 3:
К суспензии 60% NaH (8,5 г, 212 ммоль, 2,0 экв.) в ТГФ (500 мл) при комнатной температуре по каплям добавляли диэтилфосфит (27,1 мл, 213 ммоль, 2 экв.) и реакционную смесь перемешивали 1 час. К этому мутному раствору добавляли раствор продукта Этапа 2 в ТГФ (125 мл) и перемешивали реакционную смесь перемешивали при комнатной температуре 1 час. Реакцию останавливали добавлением H2O (500 мл), упаривали ТГФ и экстрагировали водный слой EtOAc (4×150 мл). Объединенный органический слой промывали водным раствором К2СО3 (2×300 мл), солевым раствором (300 мл), сушили над MgSO4, фильтровали, упаривали, а неочищенный продукт хроматографировали (5:95 СН3ОН – СН2Cl2, получали 31,7 г (97%) маслянистого вещества.
1Н ЯМР: 8.59 (d, J=2.0 Гц, 1H), 7.76 (dd, J=8.2, 2.1 Гц, 1H), 7.29 (dd, J=8.2, 2.2 Гц, 1H), 4.12-4.05 (m, 4 Н), 3.36 (d, J=22.0 Гц, 2Н), 1.27 (t, J=7.0 Гц, 6Н)
Процесс 4
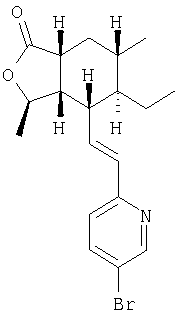
К раствору продукта Процесса 3 (15 г, 49 ммоль, 1,5 экв.) в ТГФ (100 мл) при 0°С добавляли 1М LHMDS в ТГФ (49 мл, 49 ммоль, 1,5 экв.) и раствор перемешивали 30 минут. К нему последовательно добавляли Ti(OPr)4 (14,4 мл, 49 ммоль, 1,5 экв.) и раствор продукта Процесса 1 (7,3 г, 32 ммоль) в ТГФ (30 мл) и реакционную смесь перемешивали при комнатной температуре 45 минут. Раствор разбавляли водным раствором тартрата калия натрия (300мл) и упаривали ТГФ. Взвесь экстрагировали EtOAc (4×100 мл) и объединенный органический слой промывали солевым раствором (100 мл), сушили над MgSO4, фильтровали, концентрировали и полученный неочищенный продукт хроматографировали (15:85 EtOAc -гексан), получали 11,8 г (96%) пены.
1Н ЯМР: 8.58 (d, J=2.4 Гц, 1H), 7.74 (dd, J=8.4, 2.8 Гц, 1Н), 7.09 (d, J=8.4 Гц, 1Н), 6.55 (dd, J=15.6, 10.0 Гц, 1H), 6.45 (d, J=16.0 Гц, 1H), 4.75-4.68 (m, 1H), 2.69-2.56 (m, 2H), 2.32 (dt,J=10.1, 6.5 Гц, 1H), 1.98 (ddd, J= 13.4, 6.6, 2.8 Гц, 1H), 1.67-1.59 (m, 1H), 1.47-1.39 (m, 2H), 1.37 (d, J=5.9 Гц, 3H), 1.31-1.20 (m, 2H), 0.98 (d, J=6.2 Гц, 3H),0.73(t,J=7.5 Гц,3H)
Процесс 5
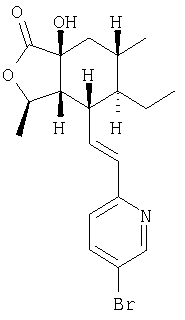
К раствору продукта Процесса 4 (7,2 г, 19 ммоль) в ТГФ (100 мл) при -78°С добавляли 1М LHMDS в ТГФ (23 мл, 23 ммоль, 1.2 экв.). Раствор перемешивали 30 минут при -78°С, 30 минут при 0°С и снова охлаждали до -78°С. К этому раствору добавляли раствор (1S)-(+)-(10-камфорсульфонил)оксазиридина (6,0 г, 26 моль, 1,4 экв.) в ТГФ (50 мл) и смесь перемешивали 1 час при -78°С и 1,5 часа при 0°С. К раствору добавляли водный раствор NH4Cl (300 мл), упаривали ТГФ и экстрагировали водный слой EtOAc (4×100 мл). Объединенный органический слой промывали солевым раствором (100 мл), сушили над MgSO4, фильтровали, концентрировали и неочищенный продукт хроматографировали (15:20:65 EtOAc-СН2Cl2-гексан), получали 6,4 г (85%) пены.
1Н ЯМР: 8.56 (d, J=2.0 Гц, 1H), 7.72 (dd, J=8.4 Гц, 1H), 7.07 (d, J=8.4 Гц, 1H), 6.56 (dd, J=15.6, 9.8 Гц, 1H), 6.48 (d, J=15.6 Гц, 1H), 4.62-4.55 (m, 1H), 3.72 (br s, 1H), 2.80-2.74 (m, 1H). 2.28 (dd, J=9.6, 5.6 Гц, 1H), 1.81-1.78 (m, 2H), 1.63-1.58 (m, 1H), 1.44-1.27 (m, 3H), 1.37 (d, J=6.0 Гц, 3H), 0.94 (d, J=6.4 Гц, 3H), 0.73 (t, J=7.5 Гц, 3H)
Процесс 6
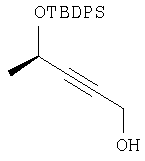
Этап 1:
К раствору (R)-(+)-3-бутин-2-ола (5 мл, 64 ммоль) в СН2Cl2 (100 мл) при комнатной температуре добавляли ДМАП (780 мг, 6.4 ммоль, 0.1 экв.), трет-бутилхлордифенилсилан (17,4 мл, 67 ммоль, 1,05 экв.) и Et3N (9,8 мл, 70 ммоль, 1,1 экв.). Реакционную смесь перемешивали в течение ночи, разбавляли Et20 (400 мл), промывали 1н.HCl (2×200 мл), водным раствором NaHCO3 (200 мл), солевым раствором (200 мл), сушили над MgSO4, фильтровали и упаривали, получали 20 г маслянистого вещества, которое использовали непосредственно на следующем этапе.
Этап 2:
К раствору продукта Этапа 1 в ТГФ (200 мл) при -78°С добавляли 2,5М BuLi в гексане (30,4 мл, 76 ммоль, 1,1 экв.), раствор перемешивали 1 час и добавляли твердый параформальдегид (4,15 г, 138 ммоль, 2,0 экв.). Реакционную смесь перемешивали 15 минут при -78°С, 1 час при комнатной температуре, затем останавливали реакцию добавлением водного раствора NH4Cl (500 мл). Упаривали ТГФ и водную фазу экстрагировали EtOAc (3×200 мл). Объединенный органический слой промывали H2O (2×300 мл) и солевым раствором (300 мл), сушили над MgSO4, фильтровали, упаривали и неочищенный продукт хроматографировали (10% EtOAc – гексан), получали 16,5 г (71%) смолы.
1Н ЯМР: 7.77-7.74 (m, 2H), 7.71-7.68 (m, 2H), 7.46-7.36 (m, 6H), 4.53 (tq, J=1.8, 6.5 Гц, 1H), 4.08 (dd, J=6.2, 1.8 Гц), 2.82 (d, J=6.4 Гц, 3H), 1.07 (s, 9H)
Пример 1
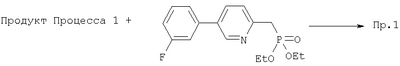
К раствору фосфоната (650 мг, 2,01 ммоль, 2 экв.) в ТГФ (8 мл) при 0°С добавляли BuLi в гексанах (790 мкл 2 М раствора, 2,0 ммоль, 2 экв.), смесь перемешивали 10 минут, затем добавляли Ti(OPr)4 (590 мкл, 2,0 ммоль, 2 экв.) и перемешивали раствор при комнатной температуре 10 минут. Добавляли раствор продукта Процесса 1 (220 мг, 0,98 ммоль) в ТГФ (3 мл) и перемешивали реакционную смесь при комнатной температуре 1,5 часа. К раствору добавляли водный раствор сегнетовой соли (100 мл) и упаривали ТГФ. Водную фазу экстрагировали EtOAc (3×30 мл) и объединенный органический слой промывали солевым раствором (50 мл). Раствор сушили над MgSO4, концентрировали и полученный остаток хроматографировали (20% EtOAc – гексан), получали целевое соединение (240 мг, 62%) в виде смолы.
1Н ЯМР (400 МГц, CDCl3) 8.78 (d, J=2.0, 1Н). 7.82 (dd, J -2.4, 8.0, 1Н), 7.44 (dt, J=5.7, 8.1, 1Н), 7.36 (dt, J=1.2, 7.7, 1Н), 7.30-7.25 (m, 2Н), 7.09 (ddt, J=2.5, 1.0, 8.4, 1Н), 6.61 (dd,J= 15.3, 8.6, 1H), 6.56 (d,J=15.3, 1H), 4.78-4.71 (т,1Н), 2.71-2.61 (m, 2H), 2.36 (dt,J= 10.0, 6.4, 1H), 1.99 (ddd, J= 13.5, 6.1, 2.9. 1H), 1.68-1.61 (m,1H), 1.51-1.44 (m, 2H), 1.42 (d. J=5.9, 3H), 1.39-1.22 (m, 2H), 0.99 (d, J=6.6, 3H), 0.76 (t, J=7.5. 3H)
FAB MCBP (масс-спектрометрия высокого разрешения с бомбардировкой ускоренными атомами): 394.2184, вычисленный: 394.2182
Вычисленные данные анализа для C25H28FNO2·HCl: С, 69.84; Н, 6.80; N, 3.26. Полученные: С, 71.00, Н, 6.96; N. 3.19.
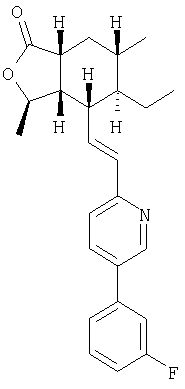
При использовании аналогичных процедур с соответствующим фосфонатом получали соединение 1А:
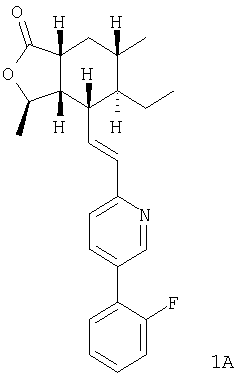
1Н ЯМР (400 МГц, CDCl3) 8.73 (bs, 1H), 7.84 (dt, J=2.0, 8.0, 1H), 7.44 (dt, J=1.7, 7.7, 1H), 7.40-7.34 (m, 1H), 7.30 (d, J=8.0, 1H), 7.25 (dt, J=7.6, 1.1, 1H), 7.18 (ddd, J=10.6, 8.4, 1.2, 1H), 6.62 (dd, J=15.1, 8.6, 1H), 6.56 (d, J=15.1, 1H), 4.79-4.72 (m, 1H), 2.71-2.61 (m, 2H), 2.36 (dt, J=10.0, 6.5, 1H), 1.99 (ddd, J=13.5, 6.1, 2.9, 1H), 1.70-1.57 (m, 1H), 1.51-1.44 (m, 2H), 1.42 (d, J=5.9, 3H), 1.39-1.22 (m, 2H), 0.99 (d, J=6.6, 3H), 0.76 (t, J -7.3, 3H)
FAB MCBP: 394.2184, вычисленный: 394.2182.
Пример 2
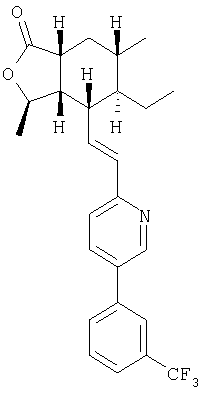
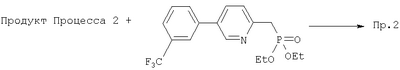
К раствору продукта Процесса 2 (50 мг, 0,22 ммоль) в CH2Cl2 (3 мл) добавляли NMO (78 мг, 0,67 ммоль, 3 экв.) и 4 Å молекулярные сита (около 50 мг). После перемешивания в течение 10 минут добавляли ТРАР (8 мг, 0,02 ммоль, 0,1 экв.) и продолжали перемешивание еще 40 минут. Реакционную смесь разбавляли Et2O (20 мл), фильтровали через целит и концентрировали. Остаток фильтровали через короткую колонку с SiO2 используя в качестве элюента 30% EtOAc – гексан, получали 38 мг альдегида.
В другую колбу с фосфонатом (210 мг, 0,56 ммоль, 3,3 экв.) в ТГФ (1,5 мл) при 0°С добавляли 2 М раствор BuLi в гексанах (224 мкл, 0,56 ммоль, 3,3 экв.) и перемешивали реакционную смесь 20 минут. Добавляли раствор указанного выше альдегида в 1,5 мл ТГФ и перемешивали смесь 1 час при 0°С. Раствор разбавляли EtOAc (20 мл), промывали Н2О (2×20 мл) и солевым раствором (20 мл), сушили над MgSO4, фильтровали, концентрировали и очищали препаративной ТСХ (25% EtOAc – гексан), получали 9 мг целевого соединения.
1Н ЯМР (400 МГц, CDCl3) 8.79 (d, J=2.4 Гц, 1Н), 7.85 (dd, J=8.4, 2.6 Гц, 1Н). 7.81 br s, 1H), 7.76 (d, J=7.2 Гц, 1H), 7.67-7.58 (m, 2H), 7.31 (d, J=7.6 Гц, 1Н), 6.63 (dd, J=15.6, 9.2 Гц, 1H), 6.57 (d, J -15.6 Гц, 1H), 4.79-4.72 (m, 1H), 2.71-2.61 (m, 2H), 2.37 (dt, J=10.0, 6.4 Гц, 1Н), 2.00 (ddd, J=13.5, 6.3, 2.7 Гц, 1H), 1.64-1.56 (m, 1H), 1.51-1.23 (m 4H), 1.42 (d, J=6.2 Гц, 3H). 1.00 (d, J=6.6 Гц, 3H), 0.77 (t, J=7.5 Гц, 3H)
FAB MCBP: 446.2306 (МН+), вычисленный: 446.2280.
При использовании аналогичных процедур были получены также следующие соединения:
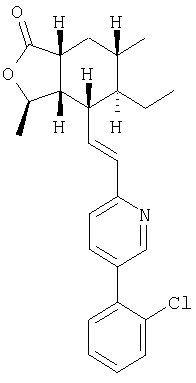
Пример 3
1Н ЯМР (400 МГц, CDCl3) 8.62 (d, J=2.0 Гц, 1Н), 7.76 (dd, J=8.0, 2.4 Гц, 1Н), 7.51-7.48 (m, 1H), 7.37-7.26 (m, 4H), 6.65-6.55 (m, 2Н), 4.78-4.71 (m, 1H), 2.71-2.61 (m, 2H), 2.36 (dt, J=10.0. 6.4 Гц, 1H), 1.99 (ddd, J=13.7, 6.3, 2.9 Гц, 1H), 1.68-1.61 (m, 1H), 1.50-1.45 (m, 2H), 1.43 (d, J=5.6 Гц. 3H), 1.33-1.25 (m, 2H), 0.99 (d, J=6.4 Гц, 3H), 0.76 (t, J=7.4 Гц, 3H)
[ ]20 D+13.2°(с 0.5, МеОН); ]20 D+13.2°(с 0.5, МеОН);
FAB MCBP: 410.1891 (МН+), вычисленный: 410.1887
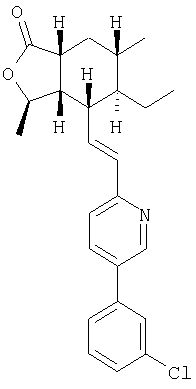
Пример 4
1Н ЯМР (400 МГц, CDCl3) 8.75 (d, J=2.0 Гц, 1H), 7.80 (dd, J=8.2, 2.0 Гц, 1H), 7.54 (br s, 1H), 7.46-7.34 (m, 3H), 7.29 (d, J=8.0 Гц, 1H), 6.61 (dd, J=15.3, 9.0 Гц, 1H), 6.56 (d, J=15.3 Гц, 1H), 4.78-4.71 (m, 1H), 2.70-2.60 (m, 2H), 2.31 (dt, J=10.1, 6.5 Гц, 1H), 1.98 (ddd, J=13.5, 6.4, 2.9 Гц, 1H), 1.71-1.64 (m, 1H), 1.49-1.43 (m, 2H), 1.40 (d, J=6.0 Гц, 3H), 1.33-1.21 (m, 2H), 0.99 (d, J=6.4 Гц, 3H), 0.75 (t, J=7.4 Гц, 3H) <76504-097-А-Н в 2А>
[ ]20 D=+23.1°(с 0.5, МеОН) ]20 D=+23.1°(с 0.5, МеОН)
FAB MCBP: 410.1887 (МН+), вычисленный: 410.1887
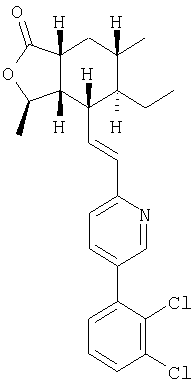
Пример 5
1Н ЯМР (400 МГц, CDCl3) 8.58 (d, J=2.0 Гц, 1Н), 7.72 (dd, J=8.0, 2.0 Гц, 1Н), 7.50 (dd, J=8.0, 1.6 Гц, 1H), 7.31-7.21 (m, 3H), 6.63 (dd, J=15.5, 8.8 Гц, 1H), 6.57 (d, J=15.5 Гц, 1H), 4.78-4.71 (m, 1H), 2.71-2.61 (m, 2H), 2.36 (dt, J=10.0, 6.4 Гц, 1H), 1.99 (ddd, J=13.6, 6.4. 2.8 Гц, 1H), 1.68-1.61 (m, 1H), 1.50-1.45 (m, 2H), 1.43 (d, J=6.0 Гц, 3H), 1.35-1.22 (m, 2H), 0.99 (d, J=6.4 Гц, 3H), 0.76 (t, J=7.4 Гц, 3H)
[ ]20 D=+5.8°(с 0.4, МеОН) ]20 D=+5.8°(с 0.4, МеОН)
FAB MCBP: 444.1491 (MH+), вычисленный: 444.1497.
Пример 6
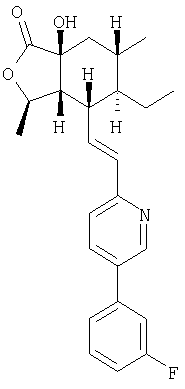
К раствору продукта Примера 1 (540 мг, 1,37 ммоль) в ТГФ (8 мл) при -78°С добавляли 1М раствор LHMDS в ТГФ (1,65 мл, 1,65 ммоль, 1,2 экв.). Раствор перемешивали 15 минут при -78°С и 30 минут при 0°С. Раствор снова охлаждали до -78°С и добавляли раствор (1S)-(+)-(10-камфорсульфонил)оксазиридина (475 мг, 2,10 ммоль, 1,5 экв.) в ТГФ (4 мл). Реакционную смесь перемешивали при -78°С 15 минут, затем оставляли медленно нагреваться до комнатной температуры. К смеси добавляли водный раствор NH4Cl (100 мл) и экстрагировали EtOAc (3×30 мл). Объединенный органический слой промывали 30 мл солевого раствора, сушили над MgSO4, концентрировали и хроматографировали (15:20:65 EtOAc:СН2Cl2-гексаны), получали 390 мг (69%) смолы.
1Н ЯМР: 8.78 (d, J=2.4 Гц, 1H), 7.82 (dd, J=8.2, 2.6 Гц, 1H), 7.44 (dt, J=6.0, 8.0 Гц, 1H), 7.37-7.35 (m, 1H), 7.29-7.25 (m, 2H), 7.09 (ddt, J=1.0, 2.4. 8.3 Гц, 1Н), 6.67-6.58 (m, 2H), 4.67-4.60 (m, 1H), 2.85-2.79 (m, 2H), 2.32 (dq, J=1.5, 5.7 Гц, 1Н), 1.89-1.82 (m, 1H), 1.79-1.75 (m, 1H), 1.70-1.61 (m, 2H), 1.54-1.46 (m, 1H), 1.45 (d, J=6.0 Гц, 3H), 1.43-1.32 (m, 1H), 0.99 (d, J=6.6 Гц, 3H), 0.78 (t, J=7.5 Гц, 3H).
Процесс присоединения Сузуки иллюстрируется нагреванием раствора бромида из Процесса 4 или 5 с бороновой кислотой (от 1,0 до ,.0 экв.), К2СО3 (4 экв.) и Pd(PPh3)4 (от 5 до 10%мол.) в смеси толуола:EtOH:Н2O (4:2:1, об./об./об.) при 100°С до завершения реакции. Реакционную смесь разбавляют Н2O, экстрагируют EtOAc и промывают органический слой солевым раствором, сушат над MgSO4, фильтруют, концентрируют и очищают хроматографией, получают требуемые соединения.
При использовании вышеописанного процесса присоединения Сузуки были получены следующие соединения:
Пример 7
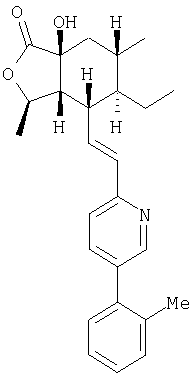
1Н ЯМР: 8.54 (dd, J=2.2, 0.6 Гц, 1H), 7.62 (dd, J=8.0, 2.2 Гц, 1H), 7.31-7.25 (m, 4H), 7.22-7.20 (m, 1H), 6.65-6.56 (m, 1H), 4.67-4.60 (m, 1H), 3.20 (br s, 1H), 2.89-2.80 (m, 1H), 2.34 (ddd, J=10.1, 5.7, 1.5 Гц, 1H), 2.30 (s, 3H), 1.91-1.77 (m, 2H), 1.70-1.64 (m, 1H), 1.55-1.43 (m, 2H), 1.45 (d, J=6.0 Гц, 3H), 1.39-1.25 (m, 1H), 0.98 (d, J=6.50 Гц, 3H), 0.79 (t, J=7.5 Гц, 3H)
ПРИМЕР 8
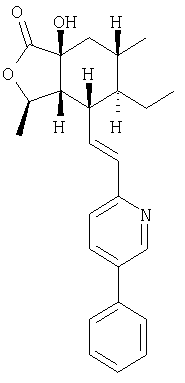
1Н ЯМР: 8.80 (d, J=2.0 Гц, 1Н), 7.84 (dd, J=8.2, 2.2 Гц, 1H), 7.58 (d, J=7.6 Гц, 2Н), 7.47 (t, J=7.4 Гц, 2Н), 7.39 (t, J=7.2 Гц, 1H), 7.29 (d, J=8.0 Гц, 1H), 6.65-6.55 (m, 2H), 4.67-4.60 (m, 1H), 3.56 (br s, 1H), 2.87-2.81 (m, 1H), 2.34 (dd, J=9.6, 5.6 Гц, 1Н), 1.87-1.80 (m, 2H), 1.70-1.63 (m, 1H), 1.53-1.33 (m, 3H), 1.44 (d, J=6.0 Гц, 3H), 0.98 (d, J=6.5 Гц, 3H), 0.79 (t, J=7.4 Гц, 3H).
Также при использовании процесса присоединения Сузуки с соответствующими реагентами были получены следующие структуры:
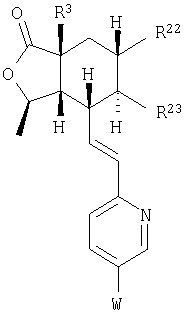
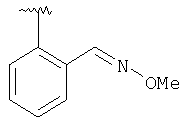
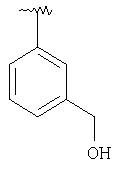
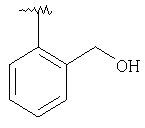
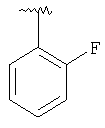
где R3, R22, R23 и W определены в следующей таблице (Me – метил, Et – этил и Ph – фенил):
| Пример |
R3 |
R22 |
R23 |
W |
Аналитические данные |
| 8В |
Н |
Me |
Et |
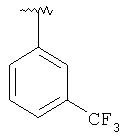 |
MCBP (МН+) 444.2165 |
| 8С |
Н |
Me |
Et |
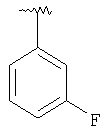 |
MCBP (MH+) 394.2184 |
| 8D |
Н |
Me |
Et |
 |
MCBP (МН+) 394.2184 |
| 8Е |
Н |
Me |
Et |
 |
MCBP (MH+) 410.1891 |
| 8F |
Н |
Me |
Et |
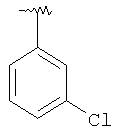 |
MCBP (МН+) 410.1887 |
| 8G |
Н |
Me |
Et |
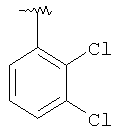 |
MCBP (MH+) 444.1491 |
| 8Н |
Н |
Н |
Ph |
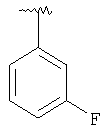 |
MCBP (MH+) 428.2026 |
| 8I |
Н |
Н |
Ph |
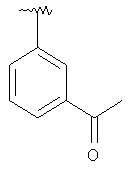
 |
MCBP (MH+) 428.2027 |
| 8J |
Н |
Me |
Et |
 |
MCBP (MH+) 418.2381 |
| 8К |
Н |
Me |
Et |
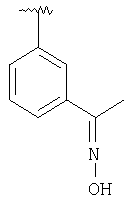 |
MCBP (MH+) 433.2490 |
| 8L |
Н |
Me |
Et |
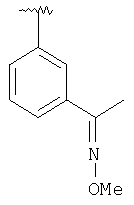 |
MCBP (MH+) 447.2648 |
| 8М |
Н |
Me |
Et |
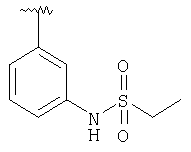 |
MCBP (MH+) 483.2319 |
| 8N |
Н |
Me |
Et |
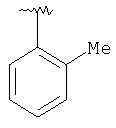 |
MCBP (MH+) 390.2441 |
| 😯 |
Н |
Me |
Et |
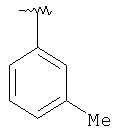 |
MCBP (MH+) 390.2437 |
| 8Р |
Н |
Me |
Et |
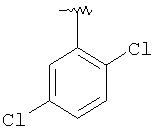 |
MCBP (MH+) 444.1490 |
| 8Q |
Me |
Me |
Et |
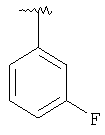 |
MCBP (MH+) 408.2346 |
| 8R |
ОН |
Me |
Et |
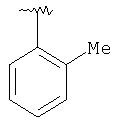 |
MCBP (MH+) 406.2380 |
| 8S |
OH |
Me |
Et |
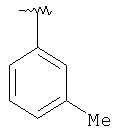 |
MCBP (MH+) 406.2376 |
| 8T |
OH |
Me |
Et |
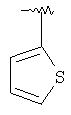 |
MCBP (MH+) 398.1788 |
| 8U |
OH |
Me |
Et |
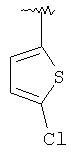 |
MCBP (MH+) 432.1392 |
| 8V |
OH |
Me |
Et |
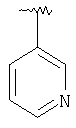 |
MCBP (MH+) 393.2181 |
| 8W |
OH |
Me |
Et |
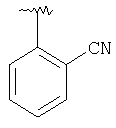 |
MCBP (MH+) 417.2178 |
| 8X |
OH |
Me |
Et |
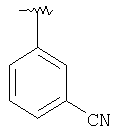 |
MCBP (MH+) 417.2178 |
| 8Z |
OH |
Me |
Et |
 |
MCBP (MH+) 434.2330 |
| 8AA |
OH |
Me |
Et |
 |
MCBP (MH+) 449.2440 |
| 8AB |
OH |
Me |
Et |
 |
MCBP (MH+) 463.2599 |
| 8AC |
OH |
Me |
Et |
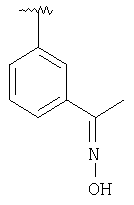 |
MCBP (MH+) 435.2275 |
| 8AD |
OH |
Me |
Et |
 |
MCBP (MH+) 449.2446 |
| 8AE |
OH |
Me |
Et |
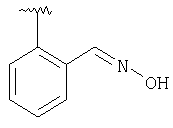 |
MCBP (MH+) 435.2279 |
| 8AF |
OH |
Me |
Et |
 |
MCBP (MH+) 449.2442 |
| 8AG |
OH |
Me |
Et |
 |
MCBP (MH+) 422.2332 |
| 8AH |
OH |
Me |
Et |
 |
MCBP (MH+) 422.2332 |
| 8AI |
H |
H |
Et |
 |
MCBP (MH+) 380.2028 |
| 8AJ |
H |
Ph |
Me |
 |
MC (MH+) 442.1 |
| 8AK |
H |
Ph |
Me |
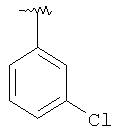 |
MC (MH+) 458.1 |
| 8AL |
OH |
Me |
Et |
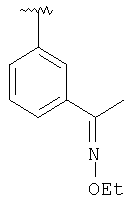 |
MCBP (MH+) 463.2589 |
| 8AM |
OH |
Me |
Et |
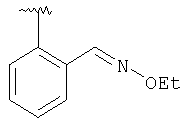 |
MCBP (MH+) 463.2593 |
| 8AN |
OH |
Me |
Et |
 |
MCBP(MH+) 477.2750 |
| 8АО |
ОН |
Me |
Et |
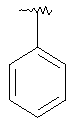 |
MCBP (MH+) 392.2227 |
| SAP |
ОН |
Me |
Et |
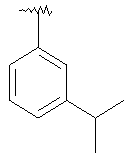 |
MCBP (MH+) 434.2695 |
| 8AQ |
ОН |
Me |
Et |
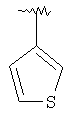 |
MCBP (MH+) 398.1788 |
| 8AR |
ОН |
Me |
Et |
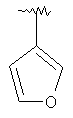 |
MCBP (MH+) 382.2020 |
| 8AS |
ОН |
Me |
Et |
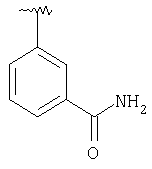 |
MCBP (MH+) 435.2282 |
| 8AT |
ОН |
Me |
Et |
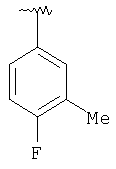 |
MCBP (MH+) 424.0945 |
| 8AU |
ОМе |
Me |
Et |
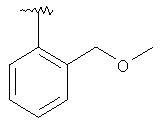 |
MC (MH+) 450.1 |
| 8AV |
ОН |
Me |
Et |
 |
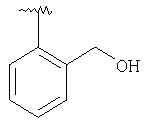
MC (MH+) 436.1 |
| 8AW |
ОМе |
Me |
Et |
 |
MC (MH+) 436.1 |
| 8AX |
ОН |
Me |
Et |
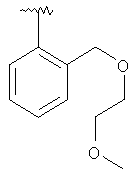 |
MCBP (MH+) 480.2752 |
| 8AY |
ОН |
Me |
Et |
 |
MCBP (MH+) 436.2489 |
| 8AZ |
ОН |
Me |
Et |
 |
MCBP (MH+) 434.2325 |
| 8ВА |
ОН |
Me |
Et |
 |
MCBP (MH+)436.2489 |
| 8ВВ |
ОН |
Н |
Et |
 |
MC (MH+) 392.2 |
| ВВС |
ОН |
Н |
Et |
 |
MC (MH+) 396.3 |
| 8BD |
ОН |
Н |
Et |
 |
MC (MH+) 368.4 |
| 8ВЕ |
ОН |
Me |
Et |
 |
MCBP (MH+) 408.2169 |
| 8BF |
ОН |
Me |
Et |
 |
MCBP (MH+) 456.1941 |
| 8BG |
ОН |
Н |
Me |
 |
MCBP (MH+) 382.1813 |
| 8ВН |
ОН |
Н |
Me |
 |
MCBP (MH+) 389.1863 |
| 8BI |
ОН |
Н |
Me |
 |
MCBP (MH+) 365.1871 |
| 8BJ |
ОН |
Me |
Et |
 |
MCBP (MH+) 440.2243 |
| 8ВК |
ОН |
Н |
Me |
 |
MCBP (MH+) 378.2064 |
| 8BL |
ОН |
Н |
Me |
 |
MCBP (MH+) 364.1919 |
| 8ВМ |
ОН |
Me |
Et |
 |
MCBP (MH+) 449.2435 |
| 8BN |
ОН |
Me |
Et |
 |
MCBP (MH+) 463.2604 |
| 8ВО |
ОН |
Me |
Et |
 |
MCBP (MH+) 477.2751 |
| 8ВР |
ОН |
Me |
Et |
 |
MCBP (MH+) 450.2640 |
Пример 9
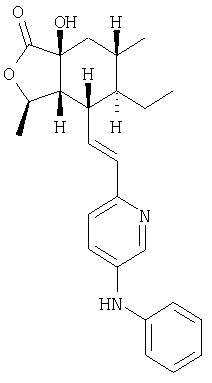
К продукту Процесса 5 (0,127 ммоль) в безводном толуоле (5 мл) добавляли анилин (0,254 ммоль, 2 экв.), фосфат калия (0,380 ммоль, 3 экв.), ацетат палладия (6,5% мол) и 2-(дициклогексилфосфино)бифенил (13% мол). Через реакционную смесь пропускали N2 в течение 2 минут, затем нагревали до 120°С в герметичном сосуде. Через 16 часов реакционную смесь охлаждали до комнатной температуры, вливали в воду и экстрагировали Et2O (3х). Объединенный экстракт промывали солевым раствором, сушили над MgSO4, фильтровали и упаривали досуха. После очистки флэш-хроматографией (2-5% СН3ОН в CH2Cl2) получали требуемый продукт с выходом 66%.
1Н ЯМР: 8.31 (d, J=2.8 Гц, 1Н), 7.40 (dd, J=2.8, 8.5 Гц, 1Н), 7.30-7.26 (m, 2H), 7.15 (d, J=8.5 Гц, 1H), 7.07 (dd, J=0.9, 8.5 Гц, 1Н), 6.97 (t, J=7.4 Гц, 1Н), 6.50 (d, J=15.6 Гц, 1H), 6.25 (dd, J=10.4, 15.6 Гц, 1H), 6.14 (s, 1H), 4.60-4.56 (m, 1H), 4.43 (br s, 1H), 2.79-2.76 (m, 1H), 2.31 (dd, J=5.6, 9.2 Гц, 1H), 1.91-1.79 (m, 2H), 1.65-1.58 (m, 1H), 1.41-1.35 (m, 2H), 1.39 (d, J=6.0 Гц, 3H), 1.31-1.25 (m, 1H), 0.95 (d, J=6.4 Гц, 3H), 0.77 (t, J=7.4 Гц, 3H)
При использовании аналогичных процедур были получены соединения формулы
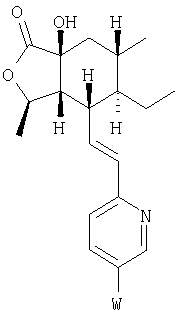
где W определено в таблице:
| Пример |
W |
Аналитические данные |
| 9А |
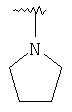 |
МСВР (МН+) 385.2490 |
| 9В |
 |
МСВР (МН+) 415.2601 |
| 9С |
 |
МСВР (МН+) 414.2593 |
| 9D |
 |
МСВР (MH+) 399.2278 |
Пример 10
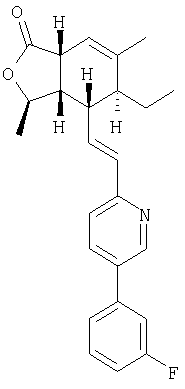
Этапы 1-3:
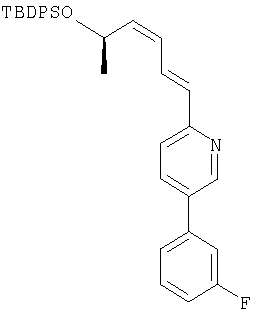
Этап 1: Суспензию алкина Процесса 6 (3,1 г, 9,2 ммоль), хинолина (215 мкл, 1,8 ммоль, 0,2 экв.) и катализатора Линдлара (310 мг, 10 масс.%) в EtOAc (50 мл) перемешивали при 1 атм. Н2 (баллон), прохождение реакции отслеживали методом ЯМР. После завершения реакции смесь фильтровали через слой целита, промывали 1 н. HCl и солевым раствором, сушили над MgSO4, фильтровали и упаривали, получали 3.4 г смолы, которую непосредственно использовали на следующем этапе.
Этап 2: К смеси продукта Этапа 1 и NaHCO3 (1,54 г, 18,3 ммоль, 2 экв.) в СН2Cl2 (30 мл) при комнатной температуре добавляли реагент Десса-Мартина (4,28 г, 10,1 ммоль, 1,1 экв.) и перемешивали 1 час. Реакционную смесь разбавляли Et2O (60 мл) и раствором Na2S2O3·5Н2O (4,55 г, 18,3 ммоль, 2 экв.) и NaHCO3 (1,54 г, 18,3 ммоль, 2 экв.) в Н20 (100мл) и тщательно перемешивали до разделения двух слоев. Отделяли органический слой, а водный слой экстрагировали Et2O (2×50 мл). Объединенный органический слой промывали водным раствором Na2S2O3/NaHCO3 (100 мл), солевым раствором (100 мл), сушили над MgSO4, фильтровали и упаривали, получали 3,5 г альдегида, который непосредственно использовали на следующем этапе.
Этап 3:
К раствору фосфоната формулы 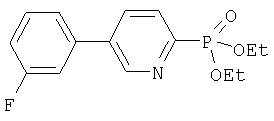 (3,9 г, 12,1 ммоль, 1,3 экв.) в ТГФ (30 мл) при 0°С добавляли 60% NaH в минеральном масле (480 мг, 12,0 ммоль, 1,3 экв.) и перемешивали смесь 20 минут. Добавляли раствор продукта Этапа 2 в ТГФ (15 мл) и после перемешивания в течение 1 часа при 0°С реакционную смесь разбавляли водным раствором NH4Cl (200 мл). Упаривали ТГФ и экстрагировали водный слой EtOAc (3×75 мл). Объединенный органический слой промывали солевым раствором (100 мл), сушили над MgSO4, фильтровали, упаривали и хроматогра-фировали остаток (5% EtOAc – гексан), получали 4,0 г (87%) смолы. (3,9 г, 12,1 ммоль, 1,3 экв.) в ТГФ (30 мл) при 0°С добавляли 60% NaH в минеральном масле (480 мг, 12,0 ммоль, 1,3 экв.) и перемешивали смесь 20 минут. Добавляли раствор продукта Этапа 2 в ТГФ (15 мл) и после перемешивания в течение 1 часа при 0°С реакционную смесь разбавляли водным раствором NH4Cl (200 мл). Упаривали ТГФ и экстрагировали водный слой EtOAc (3×75 мл). Объединенный органический слой промывали солевым раствором (100 мл), сушили над MgSO4, фильтровали, упаривали и хроматогра-фировали остаток (5% EtOAc – гексан), получали 4,0 г (87%) смолы.
1Н ЯМР: 8.75 (d, J=2.0 Гц, 1H), 7.76 (dd, J=8.0, 2.4 Гц, 1H), 7.73-7.66 (m, 4H), 7.47-7.26 (m, 9H), 7.19 (d, J=8.0 Гц, 1Н), 7.09 (ddt, J=1.1, 2.5, 8.4 Гц, 1Н), 7.00 (ddd, J=15.3, 11.5, 1.1 Гц, 1H), 6.52 (d, J=15.2 Гц, 1H), 6.05-5.99 (m, 1H), 5.74-5.69 (m, 1H), 4.93-4.86 (m, 1H), 1.28 (d, J=6.4 Гц, 3H), 1.06 (s, 3H)
Этап 4:
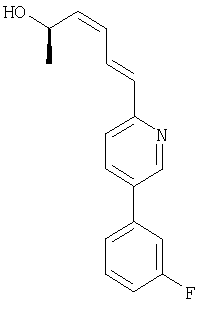
К раствору силилового эфира (4,0 г, 7,88 ммоль) в ТГФ (30 мл) при 0°С добавляли 1М раствор TBAF в ТГФ (11,8 мл, 11,8 ммоль, 1,5 экв.) и перемешивали реакционную смесь при комнатной температуре 6 часов. Смесь разбавляли водным раствором NH4Cl (150 мл), упаривали ТГФ и экстрагировали водный слой EtOAc (3×60 мл). Объединенный органический слой промывали Н2О (50 мл), солевым раствором (50 мл), сушили над MgSO4, фильтровали, упаривали и хроматографировали остаток (30% EtOAc – гексан), получали 2,0 г (94%) смолы.
1Н ЯМР: 8.80 (d, J=2.0 Гц, 1Н), 7.81 (dd, J=8.0, 2.4 Гц, 1Н), 7.64 (ddd, J=15.1, 11.5, 1.1 Гц, 1Н), 7.44 (dt, J= 5.6, 7.9 Гц, 1Н), 7.38-7.33 (m, 2H), 7.30-7.26 (m, 1H), 7.09 (ddt, J=1.0, 2.5, 8.3 Гц, 1H), 6.67 (d, J=7.6 Гц, 1H), 6.24 (t, J=11.2 Гц, 1H), 5.70-5.65 (m, 1H), 5.07-5.00 (m, 1H), 1.35 (d, J=6.4 Гц, 3H)
Этап 5:
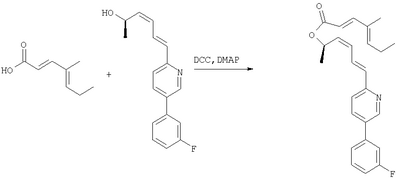
К раствору спирта Этапа 4 (110 мг, 0,41 ммоль) и кислоты (85 мг, 0,61 ммоль, 1,5 экв.) в СН2Cl2 (2 мл) добавляли ДЦК (130 мг, 0,63 ммоль, 1,5 экв.) и ДМАП (10 мг, 0,08 ммоль, 0,2 экв.) и перемешивали при 0°С до завершения реакции. Реакционную смесь разбавляли Et2O (50 мл), промывали водным раствором NaHCO3 (2×20 мл) и солевым раствором (20 мл), сушили над MgSO4, фильтровали, концентрировали и остаток хроматографировали (10% EtOAc – гексан), получали 135 мг (84%) смолы.
1Н ЯМР: 8.79 (d, J=2.4 Гц, 1H), 7.81 (dd, J=8.0, 2.4 Гц, 1H), 7.67 (ddd, J=15.3, 11.5. 1.2 Гц, 1H), 7.47-7.27 (m, 5H), 7.15 (ddt, J=2.0, 1.0, 8.3 Гц, 1H), 6.71 (d, J=15.6 Гц, 1H), 6.29 (dt, J=0.8, 11.4Гц, 1H), 6.11-6.00 (m, 1H), 5.88 (t, J= 7.6 Гц, 1H), 5.63 (t, J=10.0 Гц, 1H), 2.24-2.16 (m, 2H), 7.76 (d, J=0.8 Гц, 3H), 1.43 (d, J=6.4 Гц, 3H), 1.00 (t, J=7.6 Гц, 3H)
Этап 6:
Раствор тетраена Этапа 5 (130 мг) в толуоле (10 мл) перемешивали в герметичном сосуде при 185°С в течение 7 часов, охлаждали до комнатной температуры и перемешивали с 10 мкл DBU в течение 3 часов. Раствор концентрировали и очищали препаративной хроматографией, получали 63 мг (49%) смолы.
1Н ЯМР: 8.72 (d, J= 2.0 Гц, 1H), 7.77 (dd, J -8.4, 2.4 Гц, 1H), 7.41 (dt, J=6.0, 8.0 Гц, 1H), 7.36-7.31 (m, 2H), 7.26-7.22 (m, 1H), 7.06 (ddt, J=1.0, 2.7, 8.3 Гц, 1H), 6.66 (d, J=16.0 Гц, 1H), 6.47 (dd, J=15.8, 9.8 Гц, 1H), 5.62-561 (m, 1H), 4.55 (dq, J=4.0, 6.4 Гц, 1H), 3.27-3.24 (m, 1H), 2.80-2.75 (m, 1H), 2.56-2.52 (m, 1H), 2.02-1.97 (m, 1H), 1.78 (d, J=1.5 Гц, 3H), 1.69-1.59 (m, 1H), 1.50-1.45 (m, 1H), 1.41 (d, J=6.4 Гц, 3H), 0.92 (t, J=7.4 Гц, 3H)
При использовании аналогичных процедур были получены соединения следующей структуры
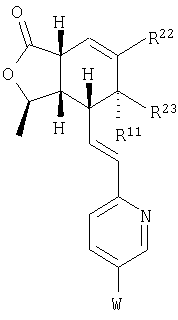
где R11, R22, R23 и W определены в таблице (Me – метил, Et – этил, Bn – бензил):
| Пример |
R22 |
R23 |
R11 |
W |
МСВР (МН+) |
| 10А |
Н |
H |
H |
 |
350.1565 |
| 10В |
Me |
-CH2OBn |
H |
 |
484.2299 |
| 10С |
Me |
H |
-CH2OBn |
 |
484.2294 |
| 10D |
Me |
H |
Et |
 |
392.2021 |
| 10Е |
Me |
Me |
H |
 |
378.1870 |
| 10F |
Me |
H |
Me |
 |
378.1870 |
| 10G |
Me |
H |
H |
 |
364.1714 |
| 10Н |
Me |
-CH2OH |
H |
 |
394.1821 |
Пример 11
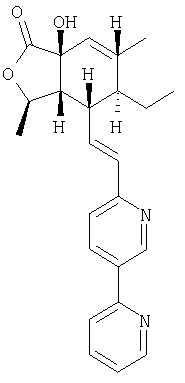
Через раствор соединения Процесса 4 (100 мг), 2(три-н-бутилстаннил)пиридина (292 мг) и Pd(PPh3)4 (31 мг) в толуоле (5 мл) в герметичном сосуде пропускали N2 и нагревали раствор при 120°С в течение ночи. Реакционную смесь разбавляли водным раствором NH4Cl, экстрагировали EtOAc, сушили над MgSO4, фильтровали, концентрировали и хроматографировали остаток (2% СН3ОН -СН2Cl2), получали 83 мг смолы.
Смолу растворяли в ТГФ (5 мл), охлаждали до -78°С, добавляли 1М раствор LHMDS в ТГФ (290 мкл), перемешивали при 0°С 1 час, затем охлаждали до – 78°С. К смеси добавляли раствор (18)-(+)-(10-камфорсульфонил)оксазиридина (76 мг) в ТГФ. После перемешивания в течение 1,5 часа реакцию останавливали добавлением водного раствора NH4Cl и экстрагировали EtOAc. Органический слой промывали солевым раствором, сушили над MgSO4, фильтровали, концентрировали и остаток очищали препаративной ТСХ, получали 20 мг целевого соединения. МСВР: 393.2185 (МН+), вычисленный: 393.2178.
При использовании аналогичных процедур были получены также и следующие соединения:
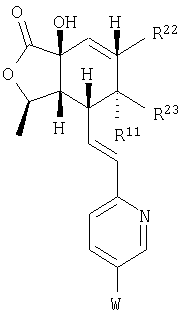
где W определено в таблице:
| Пример |
W |
МСВР (МН+) |
| 11А |
 |
394.2127 |
| 11В |
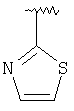 |
399.1750 |
Пример 12
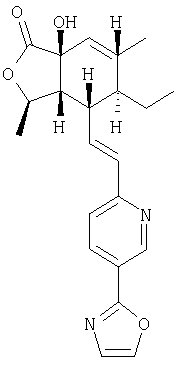
Этап 1: К раствору оксазола (75 мкл, 1,1 ммоль) в ТГФ (2 мл) при -78°С добавляли раствор 2,5М BuLi в гексанах (465 мкл, 1,2 ммоль, 2,2 экв.) и реакционную смесь перемешивали 30 минут. Добавляли 0,5М раствор ZnCl2 в Et2O (4,3 мл, 2,2 ммоль, 4 экв.) и перемешивали смесь 30 минут при -78°С и 30 минут при 0°С.
Этап 2: Отдельно к суспензии Pd(PPh3)2Cl2 (37 мг, 0,05 ммоль) в ТГФ при 0°С добавляли 2,5М раствор BuLi в гексанах (43 мкл, 0,11 ммоль) и перемешивали суспензию 20 минут. Этот раствор добавляли к цинкату Этапа 1, затем добавляли продукт Процесса 4 (200 мг, 0,5 ммоль) и смесь нагревали с обратным холодильником в течение ночи. Смесь охлаждали, разбавляли водным раствором NH4Cl (60 мл) и экстрагировали EtOAc (3×20 мл). Объединенный органический слой промывали солевым раствором (20 мл), сушили над MgSO4, фильтровали, упаривали и очищали препаративной ТСХ, получали 29 мг смолы. МСВР: 367.2025 (MH+), вычисленный 367.2022
Пример 13
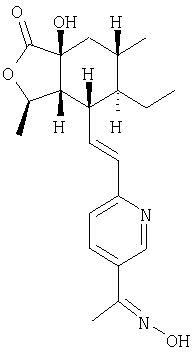
Этап 1: Раствор продукта Процесса 5 (60 мг, 0,15 ммоль), Et3N (26 мкл, 0,19 ммоль, 1,2 экв.), бис(дифенилфосфино)пропана (3 мг, 7 мкмоль, 5%мол), Pd(OAc)2 (1,7 мг, 7.6 мкмоль, 5%мол) и винил н-пропилового эфира (85 мкл, 0.76 ммоль, 5 экв.) в ДМФ (1,5 мл) нагревали в герметичном сосуде 2 часа при 100°С, охлаждали до комнатной температуры и перемешивали с 2 н. HCl (2 мл) в течение 2 часов. Реакционную смесь разбавляли водным раствором NaHCO3, экстрагировали EtOAc, сушили над MgSO4, фильтровали, концентрировали и остаток очищали препаративной ТСХ, получали 25 мг кетона.
Этап 2: Раствор продукта Этапа 1 (13 мг, 36 мкмоль) и гидроксиламин гидрохлорида (8 мг, 0,12 ммоль) в пиридине (0,5 мл) перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли водным раствором NH4Cl (30 мл) и экстрагировали EtOAc (2×10 мл), объединенный органический слой промывали солевым раствором (10 мл), сушили над MgSO4, фильтровали, концентрировали и остаток очищали препаративной ТСХ, получали 13 мг целевого соединения в виде смолы.
МСВР: 373.2113 (МН+), вычисленный 373.2127.
При использовании аналогичных процедур было получено следующее соединение:
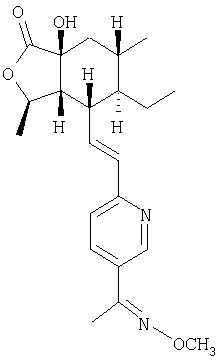
Пр. 13-2: МСВР: 387.2300 (МН+)
Пример 14
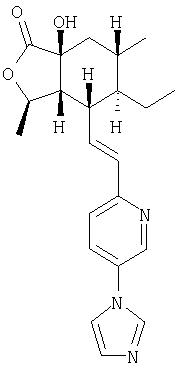
Через смесь продукта Процесса 5 (100 мг, 0,25 ммоль), имидазола (35 мг, 0,51 ммоль, 2,0 экв.), комплекса бензола и трифторметансульфоната меди (I) (13 мг, 0,026 ммоль, 0,1 экв.), 1,10-фенантролина (46 мг, 0,26 ммоль, 1 экв.), дибензилиденацетона (56 мг, 0,026 ммоль, 0,1 экв.) и Cs2CO3 (125 мг, 0,38 ммоль, 1,5 экв.) в м-ксилоле (3 мл) в герметичном сосуде пропускали аргон и нагревали при 130°С в течение ночи. Смесь охлаждали до комнатной температуры, разбавляли водным раствором NH4Cl (40 мл) и экстрагировали СН2Cl2 (3×10 мл). Объединенный органический слой промывали солевым раствором (10 мл), сушили над MgSO4, фильтровали, концентрировали и остаток очищали препаративной ТСХ, получали 43 мг (44%) целевого соединения.
МСВР: 382.2133 (МН+), вычисленный: 382.2131
При использовании аналогичной процедуры было получено следующее соединение:
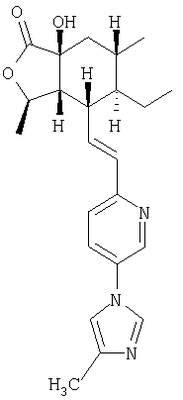
Пр. 14-2: МСВР: 396.2286 (MH+)
Пример 15
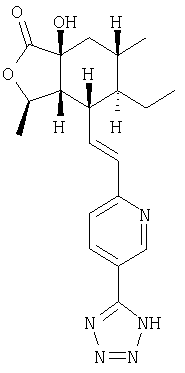
Через смесь продукта Процесса 5 (1,0 г, 2,54 ммоль), Zn(CN)2 (300 мг, 2,56 ммоль, 1 экв.), Pd2(dba)3 (трис(дибензилиденацетон)дипалладий (0)) (116 мг, 0,13 ммоль, 5%мол) и дифенилфосфиноферроцина (170 мг, 0,31 ммоль, 12% мол) в ДМФ (10 мл) и H2O (100 мкл, 1 об.%) в герметичном сосуде пропускали аргон и нагревали при 120°С в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc (150 мл) и промывали Н2О (3×50 мл), солевым раствором (50 мл), сушили над MgSO4, фильтровали, упаривали и неочищенный продукт хроматографировали (30% EtOAc – гексан), получали 800 мг (93%) арилцианида.
Смесь арилцианида (100 мг, 0,29 ммоль), NaN3 (115 мг, 1,77 ммоль, 6 экв.) и NH4Cl (95 мг, 1,78 ммоль, 6 экв.) в ДМФ (2 мл) в герметичном сосуде нагревали при 120°С в течение ночи. Смесь охлаждали до комнатной температуры, разбавляли H2O (10 мл), экстрагировали Ch2Cl2, концентрировали и неочищенный продукт подвергали препаративной ТСХ, получали 50 мг целевого соединения в виде твердого вещества.
МСВР: 384.2033 (MH+), вычисленный: 384.2036.
Пример 16
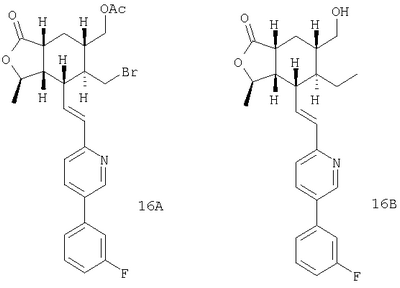
Этап 1:
К раствору соединения 31а (где W – 3-фторфенил) (480 мг, 1,2 ммоль) в CH2Cl2 добавляли 1М раствор BBr3 в Ch2Cl2 (11,7 мл, 11,7 ммоль, 10 экв.) и реакционную смесь нагревали с обратным холодильником 2,5 часа, затем разбавляли водным раствором NaHCO3 (100 мл). После перемешивания в течение 30 минут отделяли органический слой, а водный слой экстрагировали СН2Cl2 (2×40 мл). Объединенный органический слой промывали водным раствором NaHCO3 (100 м), солевым раствором (100 мл), сушили над MgSO4, фильтровали и упаривали, получали неочищенный спирт.
Неочищенный спирт растворяли в СН2Cl2 (12 мл), охлаждали до 0°С и последовательно добавляли Ас2О (225 мкл, 2,4 ммоль, 2 экв.), ДМАП (27 мг, 0,24 ммоль, 0,2 экв.) и Et3N (0,5 мл, 3,6 ммоль, 3 экв.). После перемешивания в течение 2 часов реакционную смесь разбавляли EtOAc (80 мл), промывали водным раствором NaHCO3 (2×50 мл) и солевым раствором. Раствор сушили над MgSO4, фильтровали, упаривали и остаток хроматографировали (40% EtOAc – гексан), получали 350 мг (56%) соединения Примера 16-А в виде белой пены.
МСВР: 530.1336, вычисленный: 530.1342
Этап 2:
Смесь соединения Примера 16-А (53 мг, 0,1 экв.), NaCNBH3 (32 мг, 0,5 ммоль, 5 экв.) в НМРА (гексаметилфосфорамид) (1 мл) перемешивали 4 часа при 80°С, охлаждали до комнатной температуры, разбавляли Н2О (30 мл) и экстрагировали EtOAc (3×15 мл). Объединенный органический слой промывали солевым раствором (20 мл), сушили над MgSO4, фильтровали, концентрировали и очищали препаративной ТСХ, получали 27 мг смолы. К этому продукту добавляли раствор К2СО3 (32 мг) в смеси СН3ОН-Н2О (2 мл, 9:1 об./об.) и раствор перемешивали 1 час при комнатной температуре. Смесь разбавляли Н2O (30 мл), экстрагировали EtOAc (3×10 мл), объединенный органический слой промывали солевым раствором (10 мл), сушили над MgSO4, фильтровали, концентрировали и фильтровали через короткую колонку с SiO2, получали 17 мг (72%) соединения Примера 16-В в виде смолы.
МСВР: 410.2126, вычисленный: 410.2131.
При использовании аналогичной процедуры были получены соединения следующей структуры
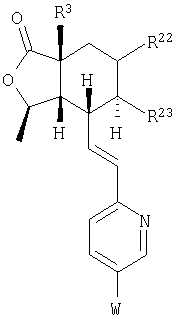
где R3, R22, R23 и W определены в таблице (Me – метил, Et – этил):
| Ex. |
R3 |
R22 |
R23 |
W |
MCBP (MH+) |
| 16С |
H |
-СН2OH |
Et |
 |
410.2138 |
| 16D |
Н |
-CH=N-OH |
Et |
 |
423.2090 |
| 16Е |
H |
-CH=N-OMe |
Et |
 |
437.2235 |
| 16F |
Н |
-CH=N-OEt |
Et |
 |
451.2396 |
| 16G |
он |
-СН2OH |
Et |
 |
426.2075 |
Следующие составы являются примерами некоторых дозировочных форм настоящего изобретения. В каждом из них термин “действующее вещество” означает соединение формулы I.
ПРИМЕР А – Таблетки
| № |
Ингредиент |
мг/таблетка |
мг/таблетка |
| 1 |
Действующее вещество |
100 |
500 |
| 2 |
Лактоза USP |
122 |
113 |
| 3 |
Кукурузный крахмал, пищевого качества, в виде 10% пасты в очищенной воде |
30 |
40 |
| 4 |
Кукурузный крахмал, пищевого качества |
45 |
40 |
| 5 |
Стеарат магния |
3 |
7 |
| |
Всего |
300 |
700 |
Способ получения
Перемешивают Компоненты № 1 и 2 в подходящем смесителе в течение 10-15 минут. Гранулируют смесь с Компонентом № 3. При необходимости пропускают через грубое сито (например, 1/4″, 0,63 см). Сушат влажные гранулы. При необходимости просеивают высушенные гранулы, смешивают их с Компонентом №4 и перемешивают в течение 10-15 минут. Добавляют Компонент №5 и перемешивают 1-3 минуты. Прессуют смесь до определенного размера и массы на подходящей таблетировочной машине.
ПРИМЕР В – Капсулы
| № |
Ингредиент |
мг/таблетка |
мг/таблетка |
| 1 |
Действующее вещество |
100 |
500 |
| 2 |
Лактоза USP |
106 |
123 |
| 3 |
Кукурузный крахмал, пищевого качества |
40 |
70 |
| 4 |
Стеарат магния NF |
4 |
7 |
| |
Всего |
250 |
700 |
Способ получения
Перемешивают Компоненты №1, 2 и 3 в подходящем блендере в течение 10-15 минут. Добавляют Компонент №4 и перемешивают 1-3 минуты. На инкапсулирующей машине заполняют смесью подходящие капсулы из твердого желатина, состоящие из двух частей.
Активность соединений формулы I можно определить следующими методиками.
Методика тестирования антагонистов тромбинового рецептора In Vitro:
Получение [3H]haTRAP (TRAP – пептид, активирующий тромбиновый рецептор)
A(pF-F)R(ChA)(hR)(I2-Y)-NH2 (1,03 мг) и 10% Pd/C (5,07 мг) суспендировали в ДМФ (250 мкл) и диизопропилэтиламине (10 мкл). Сосуд присоединяли к тритиевой линии, замораживали жидким азотом и вакуумировали. Затем в колбу добавляли газообразный тритий (342 мКи) и перемешивали 2 часа при комнатной температуре. После завершения реакции удаляли избыток трития, а раствор пептида разбавляли ДМФ (0,5 мл) и фильтровали для удаления катализатора. ДМФ раствор неочищенного пептида разбавляли водой и лиофилизировали для удаления лабильного трития. Твердый пептид снова растворяли в воде и повторяли процесс лиофилизации. Тритий-содержащий пептид ([3H]haTRAP) растворяли в 0,5 мл 0,1% водного раствора ТФУ и очищали ВЭЖХ в следующих условиях: колонка, Vydac С 18, 25 см × 9,4 мм I.D.; подвижная фаза, (А) 0,1% ТФУ в воде, (В) 0,1% ТФУ в СН3CN; градиент, (А/В) от 100/0 до 40/60 в течение 30 минут; скорость потока 5 мл/мин; детекция, УФ 215 нм. Радиохимическая чистота [3H]haTRAP составляла 99% по данным ВЭЖХ. Была получена доза 14.9 мКи со специфической активностью 18,4 Ки/ммоль.
Получение мембран тромбоцитов
Мембраны тромбоцитов получали модифицированным методом Natarajan et al (Nata-rajan et al, Int. J. Pepide Protein Res. 45:145-151 (1995)) из 20 единиц концентратов тромбоцитов, полученных из Центра Крови North Jersey Blood Center (East Orange, NJ) в течение 48 часов после сбора. Все этапы проводили при 4°С в условиях биологической безопасности. Тромбоциты центрифугировали при 100×g 20 минут при 4°С для удаления эритроцитов. Супернатант декантировали и центрифугировали 15 минут при 3000×g для осаждения тромбоцитов. Тромбоциты ресуспендировали в 5мМ Трис-HCl, рН 7.5, 5мМ ЭДТА до конечного объема приблизительно 200 мл и центрифугировали при 4400×g в течение 10 мин. Эту стадию повторяли ещё дважды. Тромбоциты ресуспендировали в 5 мМ Tris-HCl, ph 7,5, 5 мМ ЭДТА до конечного объёма приблизительно 30 мл и гомогенизировали 20 ударами в гомогенизаторе Доунса. Мембраны осаждали при 41000×g, ресуспендировали в 40-50 мл 20мМ Трис-HCl, рН 7,5, 1мМ ЭДТА, 0,1мМ дитиотрейтола и аликвоты по 10 мл замораживали в жидком N2 и хранили при -80°С. Для завершения приготовления мембран аликвоты размораживали, объединяли и гомогенизировали 5 ударами в гомогенизаторе Доунса. Мембраны осаждали и промывали три раза в 10мМ триэтаноламин – HCl, рН 7.4, 5 мМ ЭДТА и ресуспендировали 20-25 мл 50мМ Трис-HCl, рН 7.5, 10 мМ MgCl2, 1мМ EGTA и 1% ДМСО. Аликвоты мембран замораживали в жидком N2 и хранили при – 80°С. Мембраны были стабильны по крайней мере 3 месяца. Из 20 единиц концентратов обычно получали 250 мг мембранного белка. Концентрацию белка определяли методом Lowry (Lowry et al, J. Biol. Chem., 193:265-275 (1951)).
Высокопроизводительное исследование связывания тромбинового рецептора с радиолигандом
Антагонисты тромбинового рецептора проверяли модифицированным исследованием связывания тромбинового рецептора с радиолигандом, описанным Ahn et al. (Ahn et al, Mol. Pharmacol., 51:350-356 (1997)). Исследование проводили в 96-луночных планшетах Nunc (Cat. No. 269620) в конечном объеме 200 мкл. Мембраны тромбоцитов и [3H]haTRAP разводили до 0,4 мг/мл и 22,2 нМ, соответственно, в буфере для связывания (50 мМ Трис-HCl, рН 7.5, 10мМ MgCl2 1 мМ ЭГТА, 0,1% БСА). Исходные растворы (10 мМ в 100% ДМСО) исследуемых соединений далее разводили 100% ДМСО. Если не указано иначе, в каждую лунку добавляли 10 мкл разведенного раствора соединений и 90 мкл радиолиганда (конечная концентрация 10нМ в 5% ДМСО) и инициировали реакцию добавлением 100 мкл мембран (40 мкг белка/лунку). Значимого ингибирования связывания 5% ДМСО не наблюдалось. Соединения исследовали в трех концентрациях (0,1, 1 и 10 мкМ). Планшеты накрывали и аккуратно встряхивали на шейкере Lab-Line Titer Plate Shaker в течение 1 часа при комнатной температуре. Фильтровальные планшеты Packard UniFilter GF/C замачивали по крайней мере 1 час в 0,1% полиэтиленимине. Инкубированные мембраны собирали при использовании Packard FilterMate Universal Harvester и быстро промывали 4 раза 300 мкл ледяного раствора (50мМ Трис-HCl, рН 7,5, 10 мМ MgCl2, 1мМ ЭГТА). В каждую лунку добавляли сцинтилляционную смесь MicroScint 20 (25 мкл) и планшеты учитывали на сцинтилляционном счетчике Packard TopCount Microplate Scintillation Counter. Специфическое связывание определяли как разницу между тотальным связыванием и неспецифическим связыванием, наблюдаемым в присутствии избытка (50 мкМ) немеченого haTRAP. % ингибирования соединением связывания [3H]haTRAP с тромбиновыми рецепторами вычисляли согласно следующему соотношению:

Материалы
A(pF-F)R(ChA)(hR)Y-NH2 и A(pF-F)R(ChA)(hR)(I2-Y)-NH2 были синтезированы AnaSpec Inc. (San Jose, CA). Чистота этих пептидов составляла >95%. Газообразный тритий (97%) приобретали в IN/US Systems Inc. Trisorber. Сцинтилляционую смесь MicroScint 20 приобретали в Packard Instrument Co.
Протокол для агрегации тромбоцитов Ex vivo в цельной крови обезьян Cynomolgus Введение препарата и сбор крови
Обезьян Cynomolgus в сознании помещают в кресло и оставляют успокоиться в течение 30 минут. В плечевую вену вводят катетер с иглой для введения исследуемых препаратов. Другой катетер с иглой вводят в другую плечевую или подкожную вену и используют для отбора образцов крови. В тех случаях, когда соединение вводят перорально, используют только один катетер. Контрольный образец крови (1-2 мл) отбирают в вакуумируемые пробирки с ингибитором тромбина CVS 2139 (100 мкг/0.1 мл физиологического раствора) в качестве антикоагулянта. Затем в течение 30 минут внутривенно вводят препарат. Образцы крови (1 мл) отбирают на 5, 10, 20, 30 минуте во время и 30, 60, 90 минуте после окончания введения. В экспериментах с пероральным введением препарата животным его дозируют при помощи мерной канюли. Образцы крови отбирают на 0, 30, 60, 90, 120, 180, 240, 300, 360 минуте после введения. 0,5 мл крови используют для агрегации полной крови, а другие 0,5 мл – для определения концентрации препарата или его метаболитов в плазме. Агрегацию проводят сразу после отбора образца крови как описано ниже.
Агрегация цельной крови
Образец крови 0,5 мл добавляют к 0.5 мл физиологического раствора и нагревают до 37°С в агрегометре цельной крови Chronolog. Одновременно импедансный электрод нагревают до 37°С в физиологическом растворе. Образец крови с мешалкой помещают в блок нагрева, в образец помещают импедансный электрод и запускают программу. Выполняют программу до стабилизации базовой линии и затем проводят калибровочную 20  проверку. 20 проверку. 20  равняются 4 блокам на графике, выдаваемом компьютерной программой. Пипеткой с переменным объемом (5-25 мкл) добавляют агонист (ha TRAP) и записывают кривую агрегирования в течение 10 мин. Записывают величину максимума агрегации через 6 минут после добавления агониста. равняются 4 блокам на графике, выдаваемом компьютерной программой. Пипеткой с переменным объемом (5-25 мкл) добавляют агонист (ha TRAP) и записывают кривую агрегирования в течение 10 мин. Записывают величину максимума агрегации через 6 минут после добавления агониста.
Процедура агрегации тромбоцитов In vitro
Изучение агрегации тромбоцитов проводили согласно методу Bednar et al. (Bednar, В., Condra, С., Gould, R.J., ad Connolly, T.M., Throm. Res., 77:453-463 (1995)). Кровь получали от здоровых людей, не принимавших аспирин по крайней мере 7 дней, путем венопункции при использовании ACD в качестве антикоагулянта. Плазму, богатую тромбоцитами, получали центрифугированием при 100×g в течение 15 минут при 15°С. Тромбоциты осаждали при 3000×g и дважды промывали в буферном физиологическом растворе с добавлением 1 мМ ЭГТА и 20 мкг/мл апиразы для ингибирования агрегации. Агрегацию проводили при комнатной температуре в буферном физиологическом растворе с добавлением 0,2 мг/мл человеческого фибриногена. Исследуемые соединения и тромбоциты предварительно инкубировали в 96-луночных планшетах с плоским дном в течение 60 минут. Агрегацию инициировали добавлением 0,3 мкМ haTRAP или 0,1 ед/мл тромбина и быстрым встряхиванием смеси на шейкере Lab Line Titer Plate Shaker (скорость 7). Процент агрегации отслеживали по возрастанию пропускания света при 405 нм в приборе Spectromax Plate Reader.
Противоопухолевая процедура In vivo
Исследования на модели рака молочной железы человека в голых мышах проводили согласно процедуре, описанной S. Even-Ram et al., Nature Medicine. 4, 8 (1988), стр.909-914.
Исследование связывания с каннабиноидным рецептором СВ2
Связывание с человеческим каннабиноидным рецептором СВ2 проводили согласно методу Showalter, et al (1996, J. Pharmacol Exp Ther. 278(3), 989-99) с минимальными модификациями. Все исследования проводили в конечном объеме 100 мкл. Исследуемые соединения ресуспендировали до 10 мМ в ДМСО, затем последовательно разводили в растворе (50 мМ Трис, рН 7.1, 3 мМ MgCl2 1 мМ ЭДТА, 50% ДМСО). Аликвоты (10 мкл) каждого разведенного образца переносили в отдельные лунки 96-луночного планшета для микротитрования. Мембраны из клеток CHO/Ki, трансформированных человеческим СВ2 (Receptor Biology, Inc), ресуспендировали в буфере для связывания (50 мМ Трис, рН 7,1, 3 мМ MgCl2, 1мМ ЭДТА, 0,1% бычьего сывороточного альбумина, свободного от жирных кислот), затем добавляли в реакцию связывания (15 мкг в 50 мкл на исследование). Реакции инициировали добавлением [3Н] СР-55,940, разведенного в буфере для связывания (специфическая активность = 180 Ки/ммоль; New England Nuclear, Boston, Mass.). Конечная концентрация лиганда в реакции связывания составляла 0,48 нМ, После инкубации при комнатной температуре в течение 2 часов мембраны собирали фильтрованием через предварительно обработанные (0,5% полиэтиленимин; Sigma P-3143) фильтровальные планшеты GF-С (Unifilter-96, Packard) при использовании 96-луночного прибора для сбора клеток TomTec Mach 3U (Hamden, Ct). Планшеты 10 раз промывали в 100 мкл буфера для связывания и оставляли мембраны сохнуть на воздухе. Радиоактивность на мембранах определяли после добавления сцинтилляционной жидкости Packard Omniscint 20 при использовании сцинтилляционного и люминесцентного счетчика для планшетов TopCount Microplate Scintillation and Luminescence Counter (Packard, Meriden, Ct). Нелинейный регрессионный анализ проводили при использовании программы Prism 20b (GraphPad Software, San Diego, Ca).
При использовании описанных выше методик исследования было обнаружено, что для представительных соединений формулы I величина IC50 по отношению к тромбиновому рецептору (т.е. концентрация, при которой наблюдалось 50% ингибирование тромбинового рецептора) составляла от 1 до 1000 нМ, предпочтительно 1-100 нМ, наиболее предпочтительно 1-20 нМ. Величина Ki для СВ2 составляла от 1 до 1000 нМ, предпочтительно 1-200 нМ, наиболее предпочтительно 1-100 нМ.
| Таблица 1 |
| Пример № |
Активность, Ki (нмоль) |
| 1 |
6 |
| 1A |
7 |
| 2 |
10 |
| 3 |
8,5 |
| 4 |
10 |
| 5 |
4 |
| 6 |
10 |
| 7 |
12 |
| 8 |
2 |
| 8В |
10 |
| 8С |
6 |
| 8D |
7 |
| 8Е |
9,5 |
| 8F |
10 |
| 8G |
4 |
| 8J |
11 |
| 8К |
19 |
| 8L |
7 |
| 8М |
20 |
| 8N |
7 |
| 😯 |
17 |
| 8Р |
190 |
| 8Q |
8 |
| 8R |
12 |
| 8S |
13 |
| 8Т |
7 |
| 8U |
31 |
| 8V |
23 |
| 8W |
8 |
| 8Х |
7 |
| 8Z |
10 |
| 8АА |
16 |
| 8АВ |
14 |
| 8АС |
20 |
| Пример № |
Активность, Ki (нмоль) |
| 8AD |
12 |
| 8АЕ |
9 |
| 8AF |
19 |
| 8AG |
63 |
| 8АН |
111 |
| 8АI |
15 |
| 8AJ |
143 |
| 8АК |
307 |
| 8AL |
6 |
| 8АМ |
5 |
| 8AN |
3 |
| 8АО |
2 |
| 8АР |
3 |
| 8AQ |
2 |
| 8AR |
3 |
| 8AS |
150 |
| 8АТ |
161 |
| 8AU |
30 |
| 8AV |
23 |
| 8AW |
50 |
| 8АХ |
190 |
| 8AY |
12 |
| 8AZ |
8 |
| 8ВА |
66 |
| 8ВВ |
6 |
| 8ВС |
3 |
| 8ВС |
3 |
| 8BD |
27 |
| 8ВЕ |
27 |
| 8BF |
50 |
| 8BG |
3 |
| 8ВН |
17 |
| 8ВI |
130 |
| 8BJ |
22 |
| 8ВК |
14 |
| Пример № |
Активность, Ki (нмоль) |
| 8BL |
15 |
| 8ВМ |
110 |
| 8BN |
20 |
| 8ВО |
52 |
| 8ВР |
20 |
| 9 |
230 |
| 9А |
24 |
| 9С |
170 |
| 9D |
100 |
| 10 |
10 |
| 10В |
250 |
| 10D |
200 |
| 10Е |
21 |
| 10F |
777 |
| 11 |
24 |
| 11А |
78 |
| 11В |
57 |
| 12 |
135 |
| 14 |
700 |
| 14-2 |
379 |
| 16А |
125 |
| 16В |
25 |
| 16С |
15 |
| 16D |
28 |
| 16Е |
12 |
| 16F |
34 |
| 16G |
28 |
Формула изобретения
1. Производное нор-секо химбацина, представляемое структурной формулой (I)
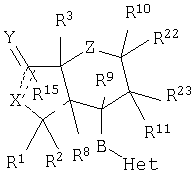
или его фармацевтически приемлемая соль, где
Z представляет -(СН2)n-;
двойной пунктир представляет простую связь;
n означает 0-2;
R1 и R2 независимо выбираются из группы, включающей Н и алкил с 1 -6 атомами углерода;
R3 означает Н, гидрокси-, алкоксигруппу с 1-6 атомами углерода, -C(O)OR17 или алкил с 1-6 атомами углерода;
Het означает моноциклическую гетероароматическую группу из 6 атомов, включающую 5 углеродных атомов и 1 гетероатом, в качестве которого выбирают N, где Het соединяется с В через кольцевой атом углерода и где Het-группа имеет 1 заместитель, W, независимо выбираемый из группы, включающей Br, гетероциклоалкил, представляющий собой группу, состоящую из 4 атомов углерода и 1 гетероатома, выбранного из N; гетероциклоалкил, представляющий собой группу, состоящую из 4 атомов углерода и 1 гетероатома, выбранного из N, замещенный ОН-замещенным алкилом с 1-6 атомами углерода или =O, R -арил-NH-; -C(=NOR17)R18; R21-арил; R41 – гетероарил, представляющий собой группу, состоящую из 5-6 атомов, включающую 3-5 атомов углерода и 1-4 гетероатома, независимо выбираемых из группы N, S и О;
R8 и R10 независимо выбирают из группы, включающей R1;
R9 означает Н;
R11 выбирают из группы, включающей R1 и -СН2OBn, где Bn означает бензил;
В означает -(CH2)n4CR12=CR12a(CH2)n5, где n4 и n5 означают независимо О, а R12 и R12a независимо выбираются из группы, включающей Н, алкил с 1-6 атомами углерода;
Х означает -O-;
Y означает =O;
R15 отсутствует, поскольку двойной пунктир представляет простую связь;
R16 означает низший алкил с 1-6 атомами углерода;
R17 и R18 независимо выбираются из группы, включающей Н, алкил с 1-6 атомами углерода;
R21 означает 1-3 заместителя, независимо выбираемых из группы, включающей водород, -CN, -CF3, галоген, алкил с 1-6 атомами углерода, алкоксигруппу с 1-6 атомами углерода, гидроксиалкил с 1-6 атомами углерода, -COR17, -NHSO2R16 или -C(=NOR17)R18;
R22 независимо выбирается из группы, включающей водород, R24-алкил с 1-10 атомами углерода, R25-арил, -CH=N-OH, -CH=N-OMe и -CH=N-OEt;
R23 независимо выбираются из группы, включающей водород, R24-алкил с 1-10 атомами углерода, R25-арил и -СН2OBn, где Bn означает бензил;
R24 означает 1, 2 или 3 заместителя, независимо выбираемых из группы, включающей водород, галоген, -ОН, алкоксигруппу с 1-6 атомами углерода,
R25 означает водород;
R41 означает 1-4 заместителя, независимо выбираемых из группы, включающей водород, галоген, алкил с 1-6 атомами углерода, алкокси-группу с 1-6 атомами углерода, (алкил с 1-6 атомами углерода)-замещенную аминогруппу, ди(алкил с 1-6 атомами углерода)-замещенную аминогруппу, -OCF3, ОН-алкил с 1-6 атомами углерода, -СНО и фенил.
2. Производное нор-секо химбацина по п.1, где n означает 0; R1 означает алкил с 1-6 атомами углерода; R2, R8, R10 и R11 каждый означает водород;
R9 означает Н; R3 означает водород, ОН, алкоксигруппу с 1-6 атомами углерода или алкил с 1 -6 атомами углерода.
3. Производное нор-секо химбацина по любому из п.1 или 2, где В означает -СН=СН-; Het означает пиридил, W-замещенный пиридил; и W означает R21-арил или R41-гетероарил, представляющий собой группу, состоящую из 5-6 атомов, включащую 3-5 атомов углерода и 1-4 гетероатома, независимо выбираемых из группы N, S и О.
4. Производное нор-секо химбацина по любому из п.1, 2 или 3, где R и R23 независимо выбираются из группы, включающей алкил с 1-6 атомами углерода, R25арил и ОН-алкил с 1-6 атомами углерода.
5. Производное нор-секо химбацина по п.1, выбираемое из группы, включающей соединения формулы
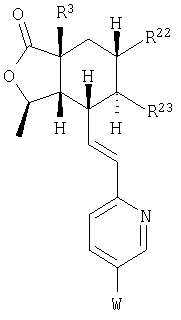
где R3, R22, R23 и W определены в следующей таблице (Me – метил, Et этил и Ph – фенил):
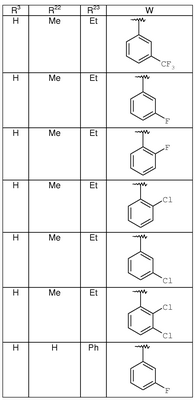
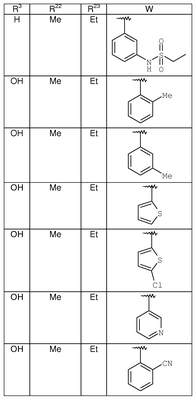
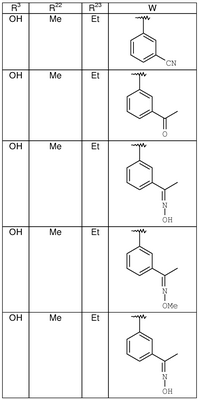
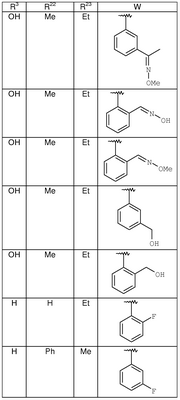
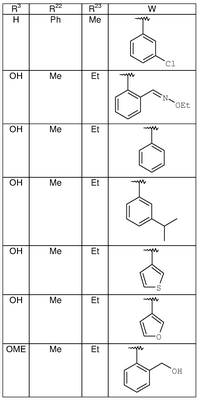
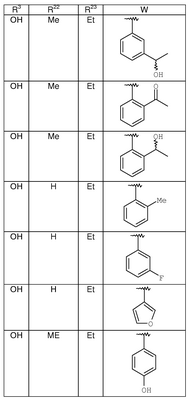
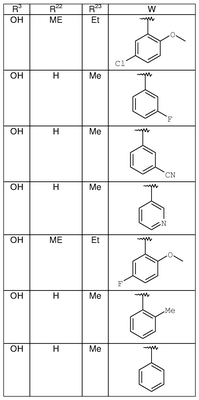
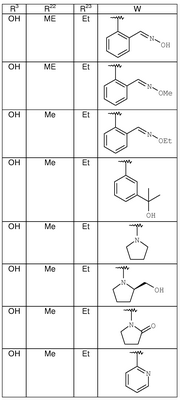
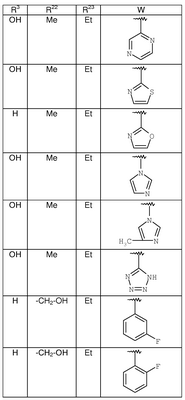
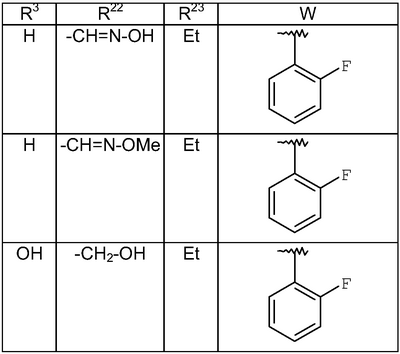
и соединения формулы
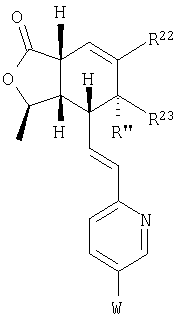
где R11, R22, R23 и W определены в таблице (Me – метил, Et – этил, Bn – бензил):
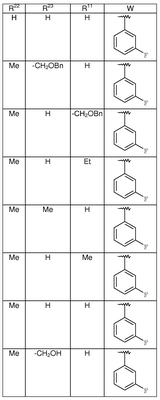
6. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении рецепторов, активируемых протеазой (ПАР), отличающаяся тем, что включает эффективное количество производного нор-секо химбацина формулы (I) по любому из пп.1-5 и фармацевтически приемлемый наполнитель.
7. Способ ингибирования тромбиновых рецепторов, включающий введение млекопитающему активного вещества в эффективном количестве, отличающийся тем, что в качестве активного вещества вводят производное нор-секо химбацина формулы (I) по любому из пп.1-5.
8. Способ ингибирования каннабиноидных рецепторов, включающий введение млекопитающему активного вещества в эффективном количестве, отличающийся тем, что в качестве активного вещества вводят производное нор-секо химбацина формулы (I) по любому из пп.1-5.
TK4A – Поправки к публикациям сведений об изобретениях в бюллетенях “Изобретения (заявки и патенты)” и “Изобретения. Полезные модели”
Напечатано: (57) 1. …или = O, R – арил -NH-;
Следует читать: (57) 1. …или = O, R21 – арил-NH-;
Номер и год публикации бюллетеня: 5-2007
Код раздела: FG4A
Извещение опубликовано: 20.07.2007 БИ: 20/2007
TK4A – Поправки к публикациям сведений об изобретениях в бюллетенях “Изобретения (заявки и патенты)” и “Изобретения. Полезные модели”
Напечатано: 4. … по любому из п. 1, 2 или 3, где R и R23 … выбираются …
Следует читать: 4. … по любому из п. 1, 2 или 3, где R22 и R23 … выбираются …
Номер и год публикации бюллетеня: 5-2007
Код раздела: FG4A
Извещение опубликовано: 20.07.2007 БИ: 20/2007
TZ4A – Поправки к описаниям изобретений
Часть описания, где обнаружена ошибка: Текст опис.,стр.59, табл. 1
Напечатано: Пример 3Активность 8,5
Следует читать: Пример 3Активность 9,5
Номер и год публикации бюллетеня: 5-2007
Извещение опубликовано: 20.07.2007 БИ: 20/2007
|
|