Патент на изобретение №2293731
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ПИРИДИНА И ПИРИМИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ
(57) Реферат:
Изобретение относится к новьм соединениям формулы (I) и их фармацевтически приемлемым солям, обладающим свойствами ингибитора дипептидилпептидазы IV(DPP IV), которые могут найти применение, например, при лечении диабета типа II. В соединениях формулы (I) Х означает N или C-R5, R1 и R2 независимо означают водород, С1-6-алкил, R3 означает насыщенный или ароматический 5-7-членный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота, серы и кислорода, возможно конденсированный с 1-2 бензольными кольцами, насыщенный или ароматический 5-7-членный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота, серы и кислорода, возможно конденсированный с 1-2 бензольными кольцами, независимо моно-, ди- или тризамещенный C1-6-алкилом, C1-6-алкокси, перфтор-С1-6-алкилом или галогеном; фенил; нафтил; фенил или нафтил, независимо моно-, ди- или тризамещенный галогеном, C1-6-алкилом, C1-6-алкокси или перфтор-С1-6-алкилом, R4 означает (низший) алкил, (низший) алкокси, (низший) алкилтио, насыщенный или ароматический 5-7-членный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота, серы и кислорода, возможно конденсированный с 1-2 бензольными кольцами, насыщенный или ароматический 5-7-членный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота, серы и кислорода, возможно конденсированный с 1-2 бензольными кольцами, независимо моно-, ди- или тризамещенный C1-6-алкилом, C1-6-алкокси, перфтор-С1-6-алкилом или галогеном; фенил; нафтил; фенил или нафтил, независимо моно-, ди- или тризамещенный галогеном, C1-6-алкилом, C1-6-алкокси, амино или перфтор-С1-6-алкилом; 4-фторфенилокси-С1-6-алкил или С3-С6циклоалкил, R5 означает водород или C1-6-алкил. Изобретение также относится к способам получения соединений формулы (I), фармацевтическим композициям и применению для получения лекарственных средств для лечения и/или профилактики заболеваний, ассоциируемых c(DPP IV). 5 н. и 16 з.п. ф-лы.
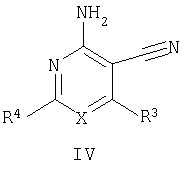
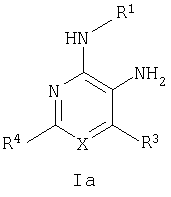
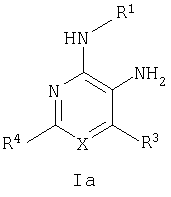
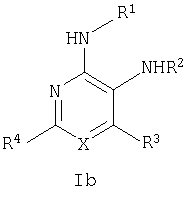
Настоящее изобретение относится к производным пиридина и пиримидина, к их получению и их применению в качестве лекарственных средств. Изобретение прежде всего относится к соединениям формулы (I)
где Х означает N или C-R5, R1 и R2 независимо означают водород или (низш.)алкил, R3 означает гетероциклил, гетероциклил, независимо моно- или тризамещенный (низш.)алкилом, перфтор(низш.)алкилом, амино, (низш.)алкокси или галогеном, арил или арил, независимо моно-, ди- или тризамещенный галогеном, (низш.)алкилом, амино, (низш.)алкокси или перфтор(низш.)алкилом, R4 означает (низш.)алкил, (низш.)алкокси, (низш.)алкилтио, гетероциклил, гетероциклил, независимо моно-, ди- или тризамещенный (низш.)алкилом, (низш.)алкокси, перфтор(низш.)алкилом, амино или галогеном, арил или арил, независимо моно-, ди- или тризамещенный (низш.)алкилом, (низш.)алкокси, галогеном, амино или перфтор(низш.)алкилом; арилокси(низш.)алкил или циклоалкил, R5 означает водород или (низш.)алкил, и к их фармацевтически приемлемым солям. Фермент дипептидилпептидаза IV (ЕС.3.4.14.5, сокращенно DPP-IV) принимает участие в регуляции активности ряда гормонов. DPP-IV прежде всего эффективно и быстро гидролизует глюкагон-подобный пептид 1 (GLP-1), который является одним из наиболее активных стимуляторов продуцирования и секреции инсулина. При ингибировании DPP-IV происходит стимуляция действия эндогенного GLP-1 и повышение концентрации инсулина в плазме (крови). У пациентов с нарушенной толерантностью к глюкозе и сахарным диабетом типа 2 при повышении концентрации инсулина в плазме снижается интенсивность гипергликемии и, соответственно, снижается риск повреждения ткани. Поэтому ингибиторы DPP-IV предлагается использовать в качестве перспективных лекарственных средств для лечения нарушенной толерантности к глюкозе и сахарного диабета типа 2 (например, Vilhauer, WO 98/19998). Другие документы, относящиеся к уровню техники, включают WO 99/38501, DE 19616486, DE 19834591, WO 01/40180, WO 01/55105, US 6110949, WO 00/34241 и US 6011155. Нами разработаны новые ингибиторы DPP-IV, которые чрезвычайно эффективно снижают уровень глюкозы в плазме (крови). Следовательно, соединения по настоящему изобретению могут применяться для лечения и/или профилактики диабета, прежде всего инсулин-независимого сахарного диабета и/или нарушенной толерантности к глюкозе, а также других состояний, при которых лечебное действие оказывается благодаря усилению действия пептида, обычно инактивируемого ферментом DPP-IV. Неожиданно установлено, что соединения по настоящему изобретению могут также применяться для лечения и/или профилактики заболевания пищеварительного тракта, неспецифического язвенного колита, болезни Крона и/или метаболического синдрома. Кроме того, соединения по настоящему изобретению можно использовать в качестве мочегонных агентов и для лечения и/или профилактики гипертензии. Неожиданно оказалось, что соединения по настоящему изобретению проявляют улучшенные терапевтические и фармакологические свойства по сравнению с другими известными ингибиторами DPP-IV, известными в данной области техники, например, в контексте фармакокинетических свойств и биодоступности. Если не указано иное, термины, используемые в описании, имеют следующие значения. Термин «низш.», используемый в описании, означает группу, содержащую от одного до шести, предпочтительно от одного до четырех, атомов углерода. Термин «галоген» означает фтор, хлор, бром и иод, предпочтительно фтор, бром и хлор, наиболее предпочтительно хлор. Термин «алкил», используемый отдельно или в комбинации с другими группами, означает разветвленный или прямой одновалентный насыщенный алифатический углеводородный радикал, содержащий от 1 до 20, предпочтительно от 1 до 16, атомов углерода, более предпочтительно от 1 до 10 атомов углерода. Термин «(низш.)алкил», используемый отдельно или в комбинации с другими группами, означает разветвленный или прямой одновалентный алкильный радикал, содержащий от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода. Примеры (низш.)алкильных радикалов включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, 3-метилбутил, н-гексил, 2-этилбутил и т.п. Предпочтительны метил и этил, наиболее предпочтителен метил. Термин «перфтор(низш.)алкил» означает группу (низш.)алкил, в которой все атомы водорода заменены фтором. Предпочтительными перфтор(низш.)алкильными группами являются трифторметил, пентафторэтил и гептафторпропил, наиболее предпочтителен трифторметил. Термин «алкокси» означает группу R’-O-, где R’ означает алкил. Термин «(низш.)алкокси» означает группу R’-O-, где R’ означает (низш.)алкил. Примерами (низш.)алкоксигрупп являются, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и гексилокси, предпочтительно метокси. Термин «(низш.)алкилтио» означает группу R’-S-, где R’ означает (низш.)алкил, указанный выше. Термин «циклоалкил» означает одновалентный карбоциклический радикал, содержащий от 3 до 6, предпочтительно от 3 до 5, атомов углерода. Примеры циклоалкильных радикалов включают циклопропил, циклобутил, циклопентил и циклогексил, предпочтительно циклопропил. Термин «гетероциклил» означает насыщенный, ненасыщенный или ароматический одновалентный 5-7-членный моноциклический, 9-членный бициклический или 13-членный трициклический радикал, содержащий по меньшей мере один гетероатом, выбранный из атомов азота, серы и кислорода, или их комбинацию. Примеры гетероциклильных остатков включают пиридил, пиримидинил, фурил, тиенил, индолил, бензо[1,3]диоксолил, бензофуранил, бензотиофенил, дибензофуранил, оксазолил, имидазолил, тиазолил, изоксазолил, пиразолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, оксатриазолил, тиатриазолил, пиридазил, пиримидинил, пиразинил, пирролидинил, азепанил и морфолино. Указанные гетероциклильные остатки независимо моно-, ди- или тризамещены группой галоген, амино, перфтор(низш.)алкил, (низш.)алкил или (низш.)алкокси, предпочтительно (низш.)алкил или (низш.)алкокси. Термин “арил” означает ароматический одновалентный моно- или поликарбоциклический радикал, такой как фенил и нафтил, предпочтительно фенил, необязательно и независимо моно-, ди- или тризамещеный группами (низш.)алкил, (низш.)алкокси, галоген, амино или перфтор(низш.)алкил, предпочтительно (низш.)алкил, (низш.)алкокси и галоген. Термин «арилокси(низш.)алкил» означает остаток арил, указанный выше, присоединенный к (низш.)алкиленовой группе через окси-радикал, т.е. арил-O-R, где R означает (низш.)алкилен. Термин «фармацевтически приемлемые соли» включает соли соединений формулы (I) и неорганических или органических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, фумаровая кислота, янтарная кислота, винная кислота, метансульфоновая кислота, салициловая кислота, паратолуолсульфоновая кислота и т.п., которые являются нетоксичными в организме пациента. Предпочтительными солями являются формиаты, малеаты, цитраты, гидрохлориды, гидробромиды, метансульфонаты, наиболее предпочтительны гидрохлориды. В одном варианте настоящего изобретения R1 означает (низш.)алкил, предпочтительно метил и изопропил. В предпочтительном варианте R1 означает водород. В другом варианте настоящего изобретения R2 означает (низш.)алкил, предпочтительно метил. В предпочтительном варианте R2 означает водород. В еще одном варианте настоящего изобретения Х означает N, в другом варианте Х означает C-R5, предпочтительно Х означает N. В одном варианте R3 означает гетероциклил, такой как пиридил, пиримидинил, фурил, тиенил, индолил, бензо[1,3]диоксолил, бензофуранил, бензотиофенил, дибензофуранил, оксазолил, имидазолил, тиазолил, изоксазолил, пиразолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, оксатриазолил, тиатриазолил, пиридазил, пиразинил, пирролидинил, азепанил и морфолино, причем гетероциклильные остатки необязательно и независимо моно-, ди- или тризамещены группой (низш.)алкил, (низш.)алкокси, перфтор(низш.)алкил, амино или галоген, предпочтительно (низш.)алкил, (низш.)алкокси или галоген. Предпочтительными гетероциклильными остатками R являются незамещенный тиенил и незамещенный бензо[1,3]диоксолил. В предпочтительном варианте R означает арил, предпочтительно фенил, необязательно и независимо орто-, мета- и/или пара-, предпочтительно орто- и паразамещенный группой (низш.)алкил, (низш.)алкокси, галоген, амино или перфтор(низш.)алкил, предпочтительно группами галоген, (низш.)алкил, перфтор(низш.)алкил или (низш.)алкокси. Наиболее предпочтительным остатком R3 является 2,4-дихлорфенил. В еще одном варианте R4 означает арил, такой как фенил или нафтил, предпочтительно фенил. Фенильный остаток R4 необязательно и независимо орто-, мета- и/или паразамещен группой галоген, амино, (низш.)алкил, перфтор(низш.)алкил или (низш.)алкокси, предпочтительно галоген, такой как фтор, (низш.)алкил, такой, как метил, или (низш.)алкокси, такой как метокси. Нафтильный остаток R4 предпочтительно незамещен или монозамещен группой (низш.)алкокси, такой как метокси. В другом варианте R4 означает (низш.)алкокси, предпочтительно метокси. В еще одном варианте R4 означает (низш.)алкил, предпочтительно метил и изопропил. В другом варианте R4 означает циклоалкил, предпочтительно циклопропил. В еще одном варианте R4 означает (низш.)алкилтио, предпочтительно метилтио. В другом варианте R4 означает гетероциклил. Предпочтительными гетероциклильными остатками R4 являются пиридил, пиримидинил, фурил, тиенил, индолил, бензо[1,3]диоксолил, бензофуранил, бензотиофенил, дибензофуранил, оксазолил, имидазолил, тиазолил, изоксазолил, пиразолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, оксатриазолил, тиатриазолил, пиридазил, пиримидинил, пиразинил, пирролидинил, азепанил и морфолино. Более предпочтительны пиридил, тиенил, индолил, бензо[1,3]диоксолил, бензофуранил, бензотиофенил, дибензофуранил, пирролидинил, азепанил и морфолино. Указанные гетероциклильные остатки необязательно моно-, ди- или тризамещены, предпочтительно и независимо моно- или дизамещены галогеном, амино, перфтор(низш.)алкилом, (низш.)алкилом или (низш.)алкокси, предпочтительно (низш.)алкил или (низш.)алкокси. В еще одном варианте R4 означает арилокси(низш.)алкил, предпочтительно фенокси(низш.)алкил, где фенильная группа замещена галогеном, наиболее предпочтительно 4-фторфеноксиметил. В другом варианте настоящего изобретения R5 означает (низш.)алкил, предпочтительно метил. В еще одном варианте R5 означает водород. Предпочтительными соединениями по настоящему изобретению являются соединения формулы I, где Х означает N, R1 и R2 означают водород, R3 означает арил, указанный выше, предпочтительно фенил, независимо орто- и паразамещенный группой (низш.)алкил, (низш.)алкокси, галоген, амино или перфтор(низш.)алкил, наиболее предпоятительно 2,4-дихлорфенил, а R4 означает алкокси, предпочтительно метокси, алкилтио, предпочтительно метилтио, арил, предпочтительно фенил, необязательно и независимо орто-, мета- и/или паразамещенный, как указано выше, предпочтительно галогеном, таким как фтор, (низш.)алкилом, таким как метил, или (низш.)алкокси, таким как метокси, или гетероциклил, как указано выше, предпочтительно пирролидинил или азепанил. Предпочтительным вариантом настоящего изобретения являются соединения формулы (I), а также фармацевтически приемлемые соли соединений формулы (I). Предпочтительными соединениями общей формулы (I) являются соединения, выбранные из группы, включающей 5-аминометил-4-(2,4-дихлорфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-фенил-6-пара-толилпиримидин-4-иламин, 5-аминометил-4-(2,4-дихлорфенил)-2-(3-метоксифенил)пиримидин-4-иламин, 5-аминометил-2-фенил-6-орто-толилпиримидин-4-иламин, 5-аминометил-6-(2,4-дифторфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-мета-толилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,4,5-триметоксифенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-диметилфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,5-диметоксифенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3-фторфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-фторфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-метокси-1-метил-1Н-индол-6-ил)пиримидин-4-иламин, 5-аминометил-2-бензофуран-2-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(1Н-индол-2-ил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-мета-толилпиримидин-4-иламин, 2-(4-амино-3-метоксифенил)-5-аминометил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-2-азепан-1-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,4-дифторфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-пирролидин-1-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-метилсульфанилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,4-диметоксифенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-тиофен-2-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(2-фторфенил)пиримидин-4-иламин, 5-аминометил-2-(4-хлорфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-метоксипиримидин-4-иламин, 5-аминометил-2-циклопропил-6-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-пара-толилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-метоксифенил)пиримидин-4-иламин, 5-аминометил-2-бензо[1,3]диоксол-5-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3-трифторметилфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-морфолин-4-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-трифторметилфенил)пиримидин-4-иламин, 5-аминометил-2-(3-хлорфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-метилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-нафталин-2-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-нафталин-1-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3-метоксифенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,5-дифторфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(2-метоксифенил)пиримидин-4-иламин, 5-аминометил-6-(4-этилфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-изопропилпиримидин-4-иламин, 5-аминометил-2-(2-хлор-4-фторфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-2-бензо[b]тиофен-2-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(6-метоксинафталин-2-ил)пиримидин-4-иламин, 5-аминометил-2-фенил-6-мета-толилпиримидин-4-иламин, 5-аминометил-6-(4-хлорфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-фенил-6-(4-трифторметилфенил)пиримидин-4-иламин, 5-аминометил-6-(2-метоксифенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-орто-толилпиримидин-4-иламин, 5-аминометил-2-(3,5-бис-трифторметилфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-фторфеноксиметил)пиримидин-4-иламин, 5-аминометил-6-(2-хлорфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2-бромфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-дибензофуран-2-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-бис-трифторметилфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2-фтор-4-метоксифенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-диметоксифенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-(1Н-индол-2-ил)-6-фенилпиримидин-4-иламин, 5-аминометил-6-бензо[1,3]диоксол-5-ил-2-циклопропилпиримидин-4-иламин, 5-аминометил-6-(2-фторфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-фенил-6-(2-трифторметилфенил)пиримидин-4-иламин, 5-аминометил-2-бензофуран-2-ил-6-фенилпиримидин-4-иламин, 5-аминометил-6-(4-фторфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-(3,4-диметоксифенил)-6-фенилпиримидин-4-иламин, 5-аминометил-6-фенил-2-пиридин-4-илпиримидин-4-иламин, 5-аминометил-6-(3-хлорфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-фенил-2-тиофен-2-илпиримидин-4-иламин, 5-аминометил-6-(3-фторфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2,6-дифенилпиримидин-4-иламин, 5-аминометил-6-(4-метоксифенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-фенил-6-тиофен-3-илпиримидин-4-иламин, 5-аминометил-6-(3 -метоксифенил)-2-фенилпиримидин-4-иламин, 6-(2,4-дихлорфенил)-5-метиламинометил-2-фенилпиримидин-4-иламин, 3-аминометил-4-(2,4-дихлорфенил)-6-фенилпиридин-2-иламин, 3-аминометил-4-(2,4-дихлорфенил)-5-метил-6-фенилпиридин-2-иламин, [5-аминометил-6-(4-хлорфенил)-2-пиридин-3-илпиримидин-4-ил]-метиламин, 5-аминометил-6-бензо[1,3]диоксол-5-ил-2-(4-метоксифенил)пиримидин-4-иламин, 5-аминометил-6-бензо[1,3]диоксол-5-ил-2-фенилпиримидин-4-иламин, [5-аминометил-6-(4-хлорфенил)-2-пиридин-3-илпиримидин-4-ил]-изопропиламин, (5-аминометил-2,6-дифенилпиримидин-4-ил)-метиламин, 3-аминометил-4-(4-хлорфенил)-5-метил-6-фенилпиридин-2-иламин, 3-аминометил-4-(4-хлорфенил)-6-фенилпиридин-2-иламин, 3-аминометил-4,6-бис-(4-фторфенил)-пиридин-2-иламин, и 3-аминометил-4-бензо[1,3]диоксол-5-ил-6-фенилпиридин-2-иламин, и фармацевтически приемлемые соли указанных соединений. Соединения формулы (I), в которых Х означает C-R5, R5 означает (низш.)алкил, а R3 означает орто-замещенный фенил, могут существовать в форме оптически чистых энантиомеров или рацематов. Изобретение включает все указанные формы. Предполагается, что соединения общей формулы (I) по настоящему изобретению можно модифицировать по функциональным группам с образованием производных, которые могут превращаться в исходные соединения in vivo. Соединения по настоящему изобретению получают, как показано ниже на схемах I и II. Схема I Схема II Настоящее изобретение также относится к способу получения соединений формулы I. Указанный способ включает восстановление нитрилов формулы IV, IVa, IX и IXa с образованием аминов формулы Ia и Ic, соответственно. Восстановление проводят известными методами. Например, восстановление можно проводить гидридом металла, таким как литийалюминийгидрид, в инертном растворителе. Нитрилы формулы IV и IVa являются известными соединениями или их можно получить из арилиденмалононитрилов формулы V и амидинов формулы VII известными методами. Например, реакцию можно проводить в присутствии основания, такого как карбонат калия в инертном растворителе, таком как метанол. Нитрилы формулы IX и IXa являются известными соединениями или их можно получить известными способами. Одним из таких способов является взаимодействие арилиденмалононитрилов формулы V с кетонами формулы X. Например, реакцию можно проводить при нагревании в смеси с ацетатом аммония в инертном растворителе, таком как метанол. Арилиденмалононитрилы формулы V являются известными соединениями или их можно получить известными способами, например, по реакции ароматических альдегидов VI с малононитрилом в присутствии основания, такого как пиперидин. Амидины формулы VII являются известными соединенями или их можно получить известными способами. Например, амидины формулы VII получают из нитрилов формулы VIII способом, известным как реакция Пиннера. Соединения формул Ib и Id можно получить из соответствующих соединений формулы Ia и Ic соответственно известным методом алкилирования (например, см. Bar-Haim G., Kol M., Tetrahedron Lett., 39, 2663 (1998)). Кроме того, изобретение относится к соединениям формулы (I), указанным выше, полученным способом, описанным выше. Как указано выше, соединения формулы (I) по настоящему изобретению можно использовать в качестве лекарственных средств для лечения и/или профилактики заболеваний, ассоциированных с DPP IV, таких как диабет, прежде всего инсулин-независимый сахарный диабет, нарушенная толерантность к глюкозе, заболевание пищеварительного тракта, неспецифический язвенный колит, болезнь Крона, ожирение и/или метаболический синдром, предпочтительно инсулин-незавимый сахарный диабет и/или нарушенная толерантность к глюкозе. Кроме того, соединения по настоящему изобретению можно использовать в качестве мочегонных агентов или для лечения и/или профилактики гипертензии. Изобретение также относится к фармацевтическим композициям, включающим соединение, указанное выше, и фармацевтически приемлемый носитель и/или адъювант. Кроме того, изобретение относится к вышеуказанным соединениям для применения в качестве терапевтически активных веществ, прежде всего в качестве терапевтически активных веществ для лечения и/или профилактики заболеваний, ассоциированных с DPP IV, таких как диабет, прежде всего инсулин-независимый сахарный диабет, нарушенная толерантность к глюкозе, заболевание пищеварительного тракта, неспецифический язвенный колит, болезнь Крона, ожирение и/или метаболический синдром, предпочтительно для применения в качестве терапевтически активных веществ для лечения и/или профилактики инсулин-незавимого сахарного диабета и/или нарушенной толерантности к глюкозе. Кроме того, изобретение относится к соединениям, указанным выше, для применения в качестве мочегонных агентов или для применения в качестве терапевтически активных веществ для лечения и/или профилактики гипертензии. В другом варианте изобретение относится к способу лечения и/или профилактики заболеваний, ассоциированных с DPP IV, таких как диабет, прежде всего инсулин-независимый сахарный диабет, нарушенная толерантность к глюкозе, заболевание пищеварительного тракта, неспецифический язвенный колит, болезнь Крона, ожирение и/или метаболический синдром, предпочтительно лечения и/или профилактики инсулин-незавимого сахарного диабета и/или нарушенной толерантности к глюкозе, причем указанный способ включает введение соединения, указанного выше, человеку или животному. Кроме того, изобретение относится к способу лечения и/или профилактики, указанному выше, где заболевание означает гипертензию или где лечебное действие достигается благодаря применению мочегонного агента. Кроме того, изобретение относится к применению вышеуказанных соединений для лечения и/или профилактики заболеваний, ассоциированных с DPP IV, таких как диабет, прежде всего инсулин-независимый сахарный диабет, нарушенная толерантность к глюкозе, заболевание пищеварительного тракта, неспецифический язвенный колит, болезнь Крона, ожирение и/или метаболический синдром, предпочтительно инсулин-незавимиый сахарный диабет и/или нарушенная толерантность к глюкозе. Кроме того, изобретение относится к применению, указанному выше, где заболевание означает гипертензию, или к применению в качестве мочегонного агента. Кроме того, изобретение относится к применению вышеуказанных соединений для получения лекарственных средств, предназначенных для лечения и/или профилактики заболеваний, ассоциированных с DPP IV, таких как диабет, прежде всего инсулин-независимый сахарный диабет, нарушенная толерантность к глюкозе, заболевание пищеварительного тракта, неспецифический язвенный колит, болезнь Крона, ожирение и/или метаболический синдром, предпочтительно для лечения и/или профилактики инсулин-незавимого сахарого диабета и/или нарушенной толерантности к глюкозе. Такие лекарственные средства включают соединение, указанное выше. Кроме того, изобретение относится к применению указанному выше, где заболевание означает гипертензию, или к применению для получения мочегонных агентов. В связи с вышеуказанными способами и применениями предпочтительными заболеваниями являются: диабет, прежде всего инсулин-независимый сахарный диабет, нарушенная толерантность к глюкозе, ожирение и/или метаболический синдром, предпочтительно инсулин-независимый сахарный диабет и/или нарушенная толерантность к глюкозе. Соединения формулы (I) получают по нижеописанным методам, по методам, приведенным в примерах, или аналогичными методами. Оптимальные условия отдельных стадий реакции известны специалисту в данной области. Исходные материалы являются коммерческими препаратами или их получают аналогично тому, как описано ниже, указано в примерах, или известными методами. Активность соединений формулы (I) определяют по следующей методике. Активность ингибиторов DPP-IV определяют при использовании нативного DPP-IV человека, выделенного из плазмы (крови) человека, или рекомбинантного DPP-IV человека. Обработанную цитратом плазму (крови) человека, полученную от различных доноров, объединяют, фильтруют через мембрану с диаметром пор 0,2 мкм в стерильных условиях, аликвотные части объемом 1 мл быстро замораживают и хранят при -120°С до проведения анализа. При колориметрическом анализе в качестве источника фермента DPP-IV используют от 5 до 10 мкл плазмы (крови) человека, а при флуориметрическом анализе 1,0 мкл плазмы (крови) человека, при этом общий объем смеси для анализа составляет 100 мкл кДНК, кодирующую аминокислотную последовательность DPP-IV (31-766), не содержащую N-концевого фрагмента и трансмембранного домена, клонируют в дрожжах (pichia pastoris). DPP-IV человека экспрессируют и выделяют из культуральной среды хроматографией на колонке, включая гель-проникающую, анионо- и катионообменную хроматографию. Степень очистки полученного препарата фермента по результатам электрофореза в ДДС-ПААГ при окрашивании кумаси составляет >95%. При колориметрическом анализе DPP-IV в качестве источника фермента используют 20 нг рекомбинантного DPP-IV человека, а при флуориметрическом анализе 2 нг рекомбинантного DPP-IV человека в общем объеме 100 мкл. При флуорогенном анализе в качестве субстрата используют H-Ala-Pro-7-амидо-4-трифторметилкумарин (фирма Calbiochem, кат. №125510). Исходный 20 мМ раствор субстрата в 10% ДМФА/Н2О хранят при -20°С. При определении IC50 конечная концентрация субстрата составляет 50 мкМ. При определении кинетических параметров, таких как Кm, Vmax, Кi, концентрация субстрата составляет от 10 до 500 мкМ. При колориметрическом анализе в качестве субстрата используют Н-Ala-Pro-pNA·HCl (фирма Bachem L-1115). Исходный 10 мМ раствор субстрата в 10% MeOH/H2O хранят при -20°С. При определении IC50 конечная концентрация субстрата составляет 200 мкМ. При определении кинетических параметров, таких как Km, Vmax, Ki, концентрация субстрата составляет от 100 до 2000 мкМ. Флуоресценцию измеряют на спектрофлуориметре LS 50В (фирма Perkin Elmer) при волне возбуждения 400 нм и волне испускания 505 нм, причем измерение проводят каждые 15 с в течение от 10 до 30 мин. Константы исходной скорости рассчитывают методом оптимальной линейной регрессии. Поглощение pNA, высвождающегося из колориметрического субстрата, определяют на спектрофотометре SrectraCount (фирма Packard) при 405 нм, причем измерение проводят каждые 2 мин в течение от 30 до 100 мин. Константы исходной скорости рассчитывают методом оптимальной линейной регрессии. Активность DPP-IV определяют в 96-луночных планшетах при 37°С в объеме реакционной смеси 100 мкл. Буферный раствор для анализа включает 50 мМ трис/HCl, рН 7,8, содержащий 0,1 мг/мл БСА и 100 мМ NaCl. Анализируемые соединения растворяют в 100% ДМСО и разбавляют до требуемой концентрации в 10% ДМСО/Н2О. Конечная концентрация ДМСО в реакционной смеси составляет 1% (об./об.). При этой концентрации инактивация фермента под действием ДМСО составляет<5%. Соединения анализируют с использованием предварительной инкубации с ферментом (37°С, 10 мин) и без предварительной инкубации. Реакцию инициируют добавлением субстрата с последующим перемешиванием. Величины IC50 анализируемых соединений рассчитывают методом нелинейной регрессии по результатам ингибирования DPP-IV по меньшей мере при пяти различных концентрациях анализируемого соединения. Кинетические параметры ферментативной реакции рассчитывают по меньшей мере при пяти различных концентрацих субстрата и по меньшей мере при пяти различных концентрациях анализируемого соединения. Как показано в таблице, предпочтительные соединения по настоящему изобретению характеризуются значениями IC50 от 1 нМ до 10 мкМ, более предпочтительно 1-100 нМ.
Соединения формулы (I) и/или их фармацевтически приемлемые соли могут использоваться в качестве лекарственных средств, например в форме фармацевтических препаратов для энтерального, парентерального или местного введения. Соединения можно вводить, например, пероральным способом, например, в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректальным способом в форме суппозиториев, парентеральным способом, например, в форме инъекционных растворов или растворов для вливания, местным способом, например, в форме мазей, кремов или масел. Препочтителен пероральный способ. Фармацевтические препараты получают известным способом, например, переработкой указанных соединений формулы I и/или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически ценными соединениями, в смеси с пригодными, нетоксичными, инертными и терапевтически приемлемыми твердыми или жидкими носителями и при необходимости фармацевтическими адъювантами, в готовую галеновую форму. Пригодные носители включают как неорганические, так и органические материалы. Так, например, при получении таблеток, таблеток с покрытием, драже и твердых желатиновых капсул в качестве носителей используются лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры и полутвердые или жидкие полиолы (причем в зависимости от природы активного соединения в случае мягких желатиновых капсул обычно не требуется никаких носителей). Пригодными носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар и т.п. Пригодными носителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Пригодными носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры и полужидкие или жидкие полиолы. Пригодными носителями для препаратов местного применения являются глицериды, полусинтетические и синтетические глицериды, гидрогенированные масла, жидкие воски, вазелин, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы. В качестве фармацевтических адъювантов используются различные стабилизаторы, консерванты, смачивающие и эмульгирующие агенты, агенты, улучшающие консистенцию, ароматизаторы, соли для регуляции осмотического давления, буферные вещества, солюбилизирующие агенты, красители, маскирующие агенты и антиоксиданты. Дозы соединения формулы I могут варьировать в зависимости от излечиваемого заболевания, возраста и относительного состояния здоровья пациента, способа введения, и должны соответствовать индивидуальным требованиям в каждом конкретном случае. Для взрослых пациентов суточная доза составляет от приблизительно 1 до 1000 мг, предпочтительно от приблизительно 1 до 100 мг. В зависимости от тяжести заболевания и конкретного фармакокинетического профиля соединение можно вводить в виде одной или нескольких стандартных доз, например от 1 до 3 стандартных доз. Фармацевтические препараты обычно содержат приблизительно 1-500 мг, предпочтительно 1-100 мг соединения формулы I. Изобретение иллюстрируется следующими примерами, не ограничивающими его объем. Примеры Сокращения: МС масс-спектрометрия, КТ комнатная температура, ТГФ тетрагидрофуран, ТФУ трифторуксуная кислота, ЯМР спектроскопия ядерно-магнитного резонанса, ДМФА диметилформамид, ДМСО диметилсульфоксид, ДХМ дихлорметан. Пример 1 Синтез арилметилиденмалононитрилов. (схема I, способ 1) 2-(2,4-Дихлорбензилиден)малононитрил 2,4-Дихлорбензальдегид (30,00 г, 171 ммоль) и малононитрил (13,59 г, 206 ммолей) суспендировали в 1-бутаноле (350 мл) в атмосфере аргона и перемешивали в течение 15 мин. Затем при КТ добавляли 8 капель пиперидина и перемешивали в течение еще 3 ч, после чего добавляли диэтиловый эфир. Осадок отделяли фильтрованием, промывали диэтиловым эфиром и гексаном, при этом получали указанное в заголовке соединение в виде бесцветного твердого вещества (35,34 г, 92%). МС: m/е 222,8 (М+). 1H ЯМР (300 МГц, ДМСО-d6, 25°С): Следующие метилиденмалононитрилы получали аналогично тому, как описано выше: 2-(4-трифторметилбензилиден)малононитрил получали из 4-трифторметилбензальдегида в виде твердого вещества (1,35 г, 48%), МС: m/е 222,9 (М+), 2-(2-метилбензилиден)малононитрил получали из орто-толилальдегида в виде твердого вещества (1,99 г, 73%), МС: m/е 168,8 (М+), 2-(3-метоксибензилиден)малононитрил получали из мета-анисового альдегида в виде твердого вещества (1,71 г, 55%), МС: m/е 184,7 (М+), 2-(2,4-диметоксибензилиден)малононитрил получали из 2,4-диметоксибензальдегида в виде твердого вещества (2,48 г, 96%), МС: m/е 214,8 (М+), 2-(2,4-диметилбензилиден)малононитрил получали из 2,4-диметилбензальдегида в виде твердого вещества (1,75 г, 63%), МС: m/е 182,8 (М+), 2-(2-фтор-4-метоксилбензилиден)малононитрил получали из 2-фтор-4-метоксилбензальдегида в виде твердого вещества (1,56 г, 64%), МС: m/е 202,7 (М+), 2-(2,4-дифторбензилиден)малононитрил получали из 2,4-дифторбензальдегида в виде твердого вещества (2,38 г, 96%), МС: m/е 190,7 (М+), 2-(4-фторбензилиден)малононитрил получали из 4-фторбензальдегида в виде твердого вещества (1,87 г, 84%), МС: m/е 172,8 (М+), 2-(2-бромбензилиден)малононитрил получали из 2-бромбензальдегида в виде твердого вещества (1,59 г, 57%), МС: m/е 233,8 (М+), 2-(2,4-бис-трифторметилбензилиден)малононитрил получали из 2,4-бис(трифторметил)бензальдегида в виде твердого вещества (1,10 г, 92%), МС: m/е 290,7 (М+), 2-(2-фторбензилиден)малононитрил получали из 2-фторбензальдегида в виде твердого вещества (1,55 г, 75%), МС: m/е 172,9 (М+), 2-тиофен-3-илметиленмалононитрил получали из 3-тиофенкарбальдегида в виде твердого вещества (0,4 г, 21%), 2-(3-фторбензилиден)малононитрил получали из 3-фторбензальдегида в виде твердого вещества (1,72 г, 83%), МС: m/е 160,8 (М+), 2-(3-метилбензилиден)малононитрил получали из мета-толилальдегида в виде твердого вещества (0,74 г, 37%), МС: m/е 168,7 (М+), 2-(2-трифторметилбензилиден)малононитрил получали из 2-трифторметилбензальдегида в виде твердого вещества (2,20 г, 83%), МС: m/е 222,8 (М+), 2-бензо[1,3]диоксол-5-илметиленмалононитрил получали из пипероналя в виде твердого вещества (19,4 г, 98%), МС: m/е 189,8 (М+), 2-(4-метилбензилиден)малононитрил получали из 4-метилбензальдегида в виде твердого вещества, МС: m/е 168,9 (М+), 2-(4-хлорбензилиден)малононитрил получали из 4-хлорбензальдегида в виде твердого вещества, МС: m/е 188,7 (М+), 2-(2-метоксибензилиден)малононитрил получали из 2-метоксибензальдегида в виде твердого вещества, МС: m/е 184,8 (М+), 2-(2-хлорбензилиден)малононитрил получали из 2-хлорбензальдегида в виде твердого вещества, МС: m/е 188,9 (М+), 2-(3-хлорбензилиден)малононитрил получали из 3-хлорбензальдегида в виде твердого вещества, МС: m/е 188,9 (М+), 2-(4-метоксибензилиден)малононитрил получали из 4-метоксибензальдегида в виде твердого вещества, МС: m/е 184,7 (М+), 2-тиофен-3-илметиленмалононитрил получали из 3-тиофенкарбальдегида в виде твердого вещества, МС: m/е 160,8 (М+), 2-(3-метоксибензилиден)малононитрил получали из 3-метоксибензальдегида в виде твердого вещества, МС: m/е 184,8 (М+). Пример 2 Синтез бензамидинов (схема I, способ 2) 3,5-Диметоксибензамидин Через охлажденный (-15°С) раствор 3,5-диметоксибензонитрила (1,50 г, 9,20 ммоля) в течение 30 мин пропускали сухой HCl, а затем реакционую смесь выдерживали в холодильнике в течение ночи. Растворитель выпаривали, остаток в виде твердого вещества белого цвета растворяли в этаноле, добавляли 9,2 мл 2 М раствора аммиака в метаноле и реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали, остаток очищали хроматографией на силикагеле (элюент: МеОН, ДХМ), при этом получали указанное в заголовке соединение (1,21 г, 71%). МС: m/е 181,2 (М+Н+). 1H ЯМР (300 МГц, ДМСО-d6, 25°С): Следующие бензамидины получали аналогично тому, как описано выше: 3-трифторметилбензамидин получали из 3-трифторметил-бензонитрила в виде твердого вещества (1,14 г, 69%), МС: m/е 189,2 (М+Н+), 2-метоксибензамидин получали из 2-метоксибензонитрила в виде твердого вещества (113 мг, 7%), МС: m/e 151,2 (М+Н+), 3,4,5-триметоксибензамидин получали из 3,4,5-триметоксибензальдегида в виде твердого вещества, МС: m/e 211,3 (М+Н+), 3,4-диметоксибензамидин получали из 3,4-диметоксибензальдегида в виде твердого вещества, МС: m/e 181,2 (М+Н+), тиофен-2-карбоксамидин получали из тиофен-3-карбонитрила в виде твердого вещества, МС: m/e 127,1 (М+Н+), 2-фторбензамидин получали из 2-фторбензонитрила в виде твердого вещества, МС: m/e 139,2 (М+Н+), 4-хлорбензамидин получали из 4-хлорбензонитрила в виде твердого вещества, МС: m/e 154,2 (М+Н+), 4-метилбензамидин получали из 4-метилбензонитрила в виде твердого вещества, МС: m/e 135,1 (М+Н+), 4-метоксибензамидин получали из 4-метоксибензонитрила в виде твердого вещества, МС: m/e 151,3 (М+Н+), бензо[1,3]диоксол-5-карбоксамидин получали из бензо[1,3]диоксол-5-карбонитрила в виде твердого вещества, МС: m/e 165,2 (М+H+), нафталин-1-карбоксамидин получали из нафталин-1-карбонитрила в виде твердого вещества, МС: m/e 171,2 (М+Н+), 3-метоксибензамидин получали из 3-метоксибензонитрила в виде твердого вещества, МС: m/e 151,3 (М+Н+), 2-хлор-4-фторбензамидин получали из 3-хлор-4-фторбензонитрила в виде твердого вещества, МС: m/e 173,1 (М+Н+), 2-метилбензамидин получали из 2-метилбензонитрила в виде твердого вещества, МС: m/e 134,1 (М+Н+), 1Н-индол-2-карбоксамидин получали из 1H-индол-2-карбонитрила в виде твердого вещества, МС: m/е 160,2 (М+Н+), бензофуран-2-карбоксамидин получали из бензофуран-2-карбонитрила в виде твердого вещества, МС: m/е 161,3 (М+Н+), изоникотинамидин получали из 4-цианопиридина в виде твердого вещества, МС: m/е 122,2 (М+Н+). Пример 3 (схема I, способ 3) Синтез 4-аминопиримидин-3-карбонитрилов 4-Амино-6-(2,4-дихлофенил)-2-фенилпиримидин-5-карбонитрил К суспензии 2-(2,4-дихлорбензилиден)малононитрила (4 г, 17,9 ммоля) в метаноле добавляли карбонат калия (4,34 г, 31,4 ммоля) и бензамидин (2,59 г, 21,5 ммоля), полученную смесь желтого цвета перемешивали при комнатной температуре в течение 1 ч, а затем кипятили с обратным холодильником в течение 2 ч. Затем смесь охлаждали, растворитель удаляли при пониженном давлении, а остаток переносили в этилацетат/лед. Органическую фазу отделяли, промывали водой и сушили над сульфатом натрия. Растворитель выпаривали, остаток оранжевого цвета переносили в ацетон, добавляли 1,91 г перманаганата калия и перемешивали в течение 90 мин. Реакционную смесь фильтровали через декалит и упаривали. Остаток очищали экспресс-хроматографией на силикагеле (элюент: EtOAc/гексан), при этом получали указанное в заголовке соединение в виде твердого вещества (2,63 г, 43%). МС: m/е 340,8 (М+). 1H ЯМР (300 МГц, ДМСО-d6, 25°С): Следующие 4-аминопиримидин-5-карбонитрилы получали аналогично тому, как описано выше: 4-амино-6-бензо[1,3]диоксол-5-ил-2-фенилпиримидин-5-карбонитрил получали из 2-бензо[1,3]диоксол-5-илметиленмалононитрила в виде твердого вещества (629 мг, 23%), МС: m/е 315,9 (М+), 4-амино-6-бензо[1,3]диоксол-5-ил-2-(4-метоксифенил)пиримидин-5-карбонитрил получали из 2-бензо[1,3]диоксол-5-илметиленмалононитрила и пара-метоксибензамидина в виде твердого вещества (78 мг, 26%), МС: m/е 346,2 (М+). 4-амино-2-фенил-6-(4-трифторметилфенил)пиримидин-5-карбонитрил получали из 2-(4-трифторметилбензилиден)малононитрила в виде твердого вещества (312 мг, 20%), МС: m/е 340,1 (М+), 4-амино-2-фенил-6-орто-толилпиримидин-5-карбонитрил получали из 2-(2-метилбензилиден)малононитрила в виде твердого вещества (700 мг, 22%), МС: m/е 286,8 (М+Н+), 4-амино-6-(3-метоксифенил)-2-фенилпиримидин-5-карбонитрил получали из 2-(3-метоксибензилиден)малононитрила в виде твердого вещества (391 мг, 15%), МС: m/е 301,8 (М+), 4-амино-2-фенил-6-мета-толилпиримидин-5-карбонитрил получали из 2-(3-метилбензилиден)малононитрила в виде твердого вещества (515 мг, 28%), МС: m/е 286,1 (М+), 4-амино-2-фенил-6-пара-толилпиримидин-5-карбонитрил получали из 2-(4-метилбензилиден)малононитрила в виде твердого вещества (3,13 г, 37%), МС: m/е 286,0 (М+), 4-амино-6-(2,4-дихлорфенил)-2-(3-метоксифенил)пиримидин-5-карбонитрил получали из 2-(2,4-дихлорбензилиден)малононитрила и 3-метоксибензамидина в виде твердого вещества (17 мг, 32%), МС: m/е 371,2 (М+Н+), 4-амино-6-(2,4-дифторфенил)-2-фенилпиримидин-5-карбонитрила получали из 2-(2,4-дифторбензилиден)малононитрила в виде твердого вещества (430 мг, 88%), 4-амино-6-(2,4-дихлорфенил)-2-мета-толилпиримидин-5-карбонитрил получали из 2-(2,4-дихлорбензилиден)малононитрила и 3-метилбензамидина в виде твердого вещества (150 мг, 87%), МС: m/е 308,1 (М+), 4-амино-6-(2,4-дихлорфенил)-2-(3,4,5-триметоксифенил)пиримидин-5-карбонитрил получали из 2-(2,4-дихлорбензилиден)малононитрила и 3,4,5-триметоксибензамидина в виде твердого вещества (1,4 г, 96%), МС: m/е 430,0 (М+). Пример 4 (схема I, способ 4) Синтез 5-аминометилпиримидин-4-иламинов 5-Аминометил-6-(2,4-дихлорфенил)-2-фенилпиримидин-4-иламин
К суспензии LiAlH4 в ТГФ (3 мл) атмосфере аргона медленно добавляли раствор 4-амино-6-(2,4-дихлофенил)-2-фенилпиримидин-5-карбонитрила (1,16 г, 0,34 ммоля) в ТГФ (6 мл) и реакционную смесь перемешивали при 40°С в течение 2 ч. Затем смесь охлаждали до -20°С и добавляли воду (0,6 мл). Через 15 мин добавляли этилацетат и смесь фильтровали через декалит. Органическую фазу отделяли, промывали водой и сушили над сульфатом натрия. Продукт очищали экспресс-хроматографией на силикагеле (элюент: метанол, дихлометан), при этом получали указанное в заголовке соединение в виде твердого вещества светло-желтого цвета (0,446 г, 40%). МС: m/е 344,2 (М+). 1H ЯМР (300 МГц, ДМСО-d6, 25°С): Пример 5 5-Аминометил-2-фенил-6-пара-толилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества (190 мг, 37%) из 4-амино-2-фенил-6-пара-толилпиримидин-5-карбонитрила аналогично способу, описанному в примере 4. МС: m/е 289,9 (М+). Пример 6 5-Аминометил-6-(2,4-дихлорфенил)-2-(3-метоксифенил)пиримидин 4-иламин
Указанное в заголовке соединение получали в виде твердого вещества (1,5 мг, 9%) из 4-амино-6-(2,4-дихлорфенил)-2-(3-метоксифенил)пиримидин-5-карбонитрила аналогично способу, описанному в примере 4. МС: m/е 374,9 (М+). Пример 7 5-Аминометил-2-фенил-6-орто-толилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества (62 мг, 31%) из 4-амино-2-фенил-6-орто-толилпиримидин-5-карбонитрила аналогично способу, описанному в примере 4. МС: m/е 290,8 (М+Н+). Пример 8 5-Аминометил-6-(2,4-дифторфенил)-2-фенилпиримидин 4-иламин
Указанное в заголовке соединение получали в виде твердого вещества (21 мг, 10%) из 4-амино-2-фенил-6-орто-толилпиримидин-5-карбонитрила аналогично способу, описанному в примере 4. МС: m/е 312,1 (М+). Пример 9 5-Аминометил-6-(2,4-дихлорфенил)-2-мета-толилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества (1,4 мг, 92%) из 4-амино-6-(2,4-дихлорфенил)-2-мета-толилпиримидин-5-карбонитрила аналогично способу, описанному в примере 4. МС: m/е 359,1 (М+Н+). Пример 10 5-Аминометил-6-(2,4-дихлорфенил)-2-(3,4,5-триметоксифенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества (164 мг, 12%) из 4-амино-6-(2,4-дихлорфенил)-2-(3,4,5-триметоксифенил)пиримидин-5-карбонитрила аналогично способу, описанному в примере 4. МС: m/е 434,9 (М+). Пример 11 Препаративный синтез 5-аминометилпиримидин-4-иламинов из арилметилиденмалононитрилов (схема I, способ 5) 5-Аминометил-6-(2,4-диметилфенил)-2-фенилпиримидин-4-иламин
Бензамидин (48 мг, 0,4 ммоля) и карбонат калия (97 мг, 0,7 ммоля) помещали в реакционный сосуд и суспендировали в 2 мл МеОН. Затем добавляли 2-(2,4-диметибензилиден)малононитрил (87 мг, 0,48 ммолей), реакционный сосуд закрывали и встряхивали при КТ в течение 30 мин, а затем при 60°С в течение 3 ч. Смесь охлаждали и фильтровали, фильтрат упаривали на вакуумной центрифуге (45°С). Остаток растворяли в 2 мл ацетона, добавляли 63 мг (0,4 ммоля) KMnO4 и смесь встряхивали при КТ в течение 2 ч. Затем смесь фильтровали и фильтрат упаривали на вакуумной центрифуге (45°С). Остаток растворяли в 1 мл ДМФА и очищали с использованием автоматизированной системы для препаративной ЖХВР (колонка YMC CombiPrep С18, 50×20 мм, элюент: градиент СН3CN/вода+0,1% ТФУ, от 5% до 95%, скорость элюирования 40 мл/мин, время 6,0 мин, Пример 12 5-Аминометил-6-(2,4-дихлорфенил)-2-(3,5-диметоксифенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3,5-диметоксибензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. MC: m/e 405,4 (М+Н+). Пример 13 5-Аминометил-6-(2,4-дихлорфенил)-2-(3-фторфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3-фторбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 362,9 (М+Н+). Пример 14 5-Аминометил-6-(2,4-дихлорфенил)-2-(4-фторфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 4-фторбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 362,9 (М+Н+). Пример 15 5-Аминометил-6-(2,4-дихлорфенил)-2-(4-метокси-1-метил-1Н-индол-6-ил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 4-метокси-1-метил-1H-индол-6-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 428,0 (М+Н+). Пример 16 5-Аминометил-2-бензофуран-2-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из бензофуран-2-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 385,3 (М+Н+). Пример 17 5-Аминометил-6-(2,4-дихлорфенил)-2-(1Н-индол-2-ил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 1Н-индол-2-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 383,9 (М+Н+). Пример 18 5-Аминометил-6-(2,4-дихлорфенил)-2-мета-толилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3-метилбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 359,1 (М+Н+). Пример 19 2-(4-Амино-3-метоксифенил)-5-аминометил-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 4-амино-3-метоксибензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 389,9 (М+Н+). Пример 20 5-Аминометил-2-азепан-1-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из азепан-1-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/e 366,0 (М+Н+). Пример 21 5-Аминометил-6-(2,4-дихлорфенил)-2-(3,4-дифторфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3,4-дифторбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/e 381,3 (М+Н+). Пример 22 5-Аминометил-6-(2,4-дихлорфенил)-2-пирролидин-1 -ил-пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из пирролидин-1-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 337,8 (М+). Пример 23 5-Аминометил-6-(2,4-дихлорфенил)-2-метилсульфанилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-метилизотиомочевины и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 315,2 (М+). Пример 24 5-Аминометил-6-(2,4-дихлорфенил)-2-(3,4-диметоксифенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3,4-диметоксибензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 405,3 (М+Н+). Пример 25 5-Аминометил-6-(2,4-дихлорфенил)-2-тиофен-2-илпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из тиофен-2-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 351,2 (М+Н+). Пример 26 5-Аминометил-6-(2,4-дихлорфенил)-2-(2-фторфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-фторбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 363,0 (М+Н+). Пример 27 5-Аминометил-2-(4-хлорфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 4-хлорбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 377,8 (М+). Пример 28 5-Аминометил-6-(2,4-дихлорфенил)-2-метокси-пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-метилизомочевины и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 337,8 (М+). Пример 29 5-Аминометил-2-циклопропил-6-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из циклопропанкарбоксамидина и 2-бензилиденмалононитрила аналогично способу, описанному в примере 11. МС: m/е 240,1 (М+). Пример 30 5-Аминометил-6-(2,4-дихлорфенил)-2-пара-толилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 4-метилбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 358,2 (М+). Пример 31 5-Аминометил-6-(2,4-дихлорфенил)-2-(4-метоксифенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 4-метоксибензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 375,3 (М+Н+). Пример 32 5-Аминометил-2-бензо[1,31диоксол-5-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из бензо[1,3]диоксол-5-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/e 388,2 (М+). Пример 33 5-Аминометил-6-(2,4-дихлорфенил)-2-(3-трифторметилфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3-трифторметилбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/e 412,9 (М+Н+). Пример 34 5-Аминометил-6-(2,4-дихлорфенил)-2-морфолин-4-ил-пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из морфолин-4-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/e 353,9 (М+). Пример 35 5-Аминометил-6-(2,4-дихлорфенил)-2-(4-трифторметилфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 4-трифторметилбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 412,9 (М+Н+). Пример 36 5-Аминометил-2-(3-хлорфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3-хлорбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 378,8 (М+Н+). Пример 37 5-Аминометил-6-(2,4-дихлорфенил)-2-метилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из ацетамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 282,9 (М+Н+). Пример 38 5-Аминометил-6-(2.4-дихлорфенил)-2-нафталин-2-ил-пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из нафталин-2-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 394,9 (М+Н+). Пример 39 5-Аминометил-6-(2,4-дихлорфенил)-2-нафталин-1-ил-пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из нафталин-1-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 395,3 (М+Н+). Пример 40 5-Аминометил-6-(2,4-дихлорфенил)-2-(3-метоксифенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3-метоксибензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 374,8 (М+). Пример 41 5-Аминометил-6-(2,4-дихлорфенил)-2-(3,5-дифторфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3,5-дифторбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 380,9 (М+Н+). Пример 42 5-Аминометил-6-(2,4-дихлорфенил)-2-(2-метоксифенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-метоксибензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 374,8 (М+Н+). Пример 43 5-Аминометил-6-(4-этилфенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(4-этилбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 304,8 (М+Н+). Пример 44 5-Аминометил-6-(2,4-дихлорфенил)-2-изопропилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из изобутирамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 311,2 (М+Н+). Пример 45 5-Аминометил-2-(2-хлор-4-фторфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-хлор-4-фторбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 396,8 (М+). Пример 46 5-Аминометил-2-бензо[b]тиофен-2-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из бензо[b]тиофен-2-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 400,9 (М+Н+). Пример 47 5-Аминометил-6-(2,4-дихлорфенил)-2-(6-метокси-нафталин-2-ил)пиримидин-4-иламин Указанное в заголовке соединение получали в виде твердого вещества из 6-метоксинафталин-2-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 425,0 (М+Н+). Пример 48 5-Аминометил-2-фенил-6-мета-толилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 4-амино-2-фенил-6-мета-толилпиримидин-5-карбонитрила аналогично способу, описанному в примере 11. МС: m/е 291,2 (М+Н+). Пример 49 5-Аминометил-6-(4-хлорфенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(4-хлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 311,0 (М+Н+). Пример 50 5-Аминометил-2-фенил-6-(4-трифторметилфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(4-трифторметилбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 344,0 (М+). Пример 51 5-Аминометил-6-(2-метоксифенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(2-метоксибензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 306,8 (М+). Пример 52 5-Аминометил-6-(2,4-дихлорфенил)-2-орто-толилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-метилбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 358,9 (М+Н+). Пример 53 5-Аминометил-2-(3,5-бис-трифторметилфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3,5-бис-трифторметилбензамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 481,2 (М+Н+). Пример 54 5-Аминометил-6-(2,4-дихлорфенил)-2-(4-фторфеноксиметил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(4-фторфенокси)ацетамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 392,8 (М+Н+). Пример 55 5-Аминометил-6-(2-хлорфенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(2-хлор-бензилиден)малононитрила аналогично способу, описанному в примере 11. MC: m/е 311,0 (М+). Пример 56 5-Аминометил-6-(2-бромфенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(2-бром-бензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 354,8 (М+). Пример 57 5-Аминометил-2-дибензофуран-2-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из дибензофуран-2-карбоксамидина и 2-(2,4-дихлорбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/e 434,9 (М+). Пример 58 5-Аминометил-6-(2,4-бис-трифторметилфенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(2,4-бис-трифторметилбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/e 413,0 (М+Н+). Пример 59 5-Аминометил-6-(2-фтор-4-метоксифенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(2-фтор-4-метоксибензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/e 324,8 (М+). Пример 60 5-Аминометил-6-(2,4-диметоксифенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(2,4-диметоксибензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/e 336,8 (М+). Пример 61 5-Аминометил-2-(1Н-индол-2-ил)-6-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 1Н-индол-2-карбоксамидина и 2-бензилиденмалононитрила аналогично способу, описанному в примере 11. МС: m/е 315,8 (М+Н+). Пример 62 5-Аминометил-6-бензо[1,3]диоксол-5-ил-2-циклопропилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из циклопропилкарбоксамидина и 2-бензо[1,3]диоксол-5-илметиленмалононитрила аналогично способу, описанному в примере 11. МС: m/е 284,7 (М+Н+). Пример 63 5-Аминометил-6-(2-фторфенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(2-фторбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 294,9 (М+Н+). Пример 64 5-Аминометил-2-фенил-6-(2-трифторметилфенил)пиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(2-трифторметилбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 345,1 (М+Н+). Пример 65 5-Аминометил-2-бензофуран-2-ил-6-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из бензофуран-2-карбоксамидина и 2-бензилиденмалононитрила аналогично способу, описанному в примере 11. МС: m/е 316,7 (М+Н+). Пример 66 5-Аминометил-6-(4-фторфенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(4-фтор-бензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 294,8 (М+Н+). Пример 67 5-Аминометил-2-(3,4-диметоксифенил)-6-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 3,4-диметоксибензамидина и 2-бензилиденмалононитрила аналогично способу, описанному в примере 11. МС: m/е 336,8 (М+H+). Пример 68 5-Аминометил-6-фенил-2-пиридин-4-илпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из изоникотинамидина и 2-бензилиденмалононитрила аналогично способу, описанному в примере 11. МС: m/е 278,0 (М+Н+). Пример 69 5-Аминометил-6-(3-хлорфенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(3-хлорбензилиден)малононитрила аналогично способу, описанному в примере 11. MC: m/e 31,0 (M+H+). Пример 70 5-Аминометил-6-фенил-2-тиофен-2-илпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из тиофен-2-карбоксамидина и 2-бензилиденмалононитрила аналогично способу, описанному в примере 11. МС: m/е 282,8 (М+Н+). Пример 71 5-Аминометил-6-(3-фторфенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(3-фторбензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 294,8 (М+Н+). Пример 72 5-Аминометил-2,6-дифенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-бензилиденмалононитрила аналогично способу, описанному в примере 11. МС: m/е 276,9 (М+Н+). Пример 73 5-Аминометил-6-(4-метоксифенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-(4-метоксибензилиден)малононитрила аналогично способу, описанному в примере 11. МС: m/е 306,9 (М+Н+). Пример 74 5-Аминометил-2-фенил-6-тиофен-3-илпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 2-тиофен-3-илметиленмалононитрила аналогично способу, описанному в примере 11. МС: m/е 283,0 (М+Н+). Пример 75 5-Аминометил-6-(3-метоксифенил)-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали в виде твердого вещества из 4-амино-6-(3-метоксифенил)-2-фенилпиримидин-5-карбонитрила аналогично способу, описанному в примере 11. МС: m/е 307,2 (М+Н+). Пример 76 (схема I, способ 6) 6-(2,4-Дихлорфенил)-5-метиламинометил-2-фенилпиримидин-4-иламин
К раствору 4-амино-6-(2,4-дихлорфенил)-2-фенилпиримидин-5-карбонитрила (60 мг, 0,174 ммоля) в ТГФ (1 мл) в атмосфере аргона добавляли 9-BBN (0,348 мл 0,5 М раствора в гексане, 0,174 ммоля) и смесь перемешивали при КТ в течение 2,5 ч. Затем добавляли трет-бутилат калия (20 мг, 0,174 ммоля), а через 10 мин добавляли по каплям иодистый метил. Смесь перемешивали в течение ночи, затем добавляли этаноламин (11 мг, 0,174 ммоля) и смесь нагревали при 50°С в течение 3 ч. Смесь охлаждали, фильтровали и фильтрат упаривали. Остаток растворяли в 1 мл ДМФА и очищали с использованием автоматизированной системы для препаративной ЖХВР (колонка YMC CombiPrep C18, 50×20 мм, элюент: градиент СН3CN/вода+0,1% ТФУ, от 5% до 95%, скорость элюирования 40 мл/мин, время 6,0 мин, Пример 77 Синтез 2-аминоникотинонитрилов (схема II, способ 7) 2-Амино-4-(2,4-дихлорфенил)-6-фенилникотинонитрил Смесь 2-(2,4-дихлорбензилиден)малононитрила (1,125 г, 5 ммолей), ацетофенона (601 мг, 5 ммолей), ацетат аммония (578 мг, 7,5 ммолей) и толуола (5 мл) кипятили с обратным холодильником при перемешивании в течение 3 ч. Затем смесь охлаждали до комнатной температуры, переносили в этилацетат, экстрагировали насыщенным раствором NaHCO3, водой, насыщенным раствором NaCl и сушили над Na2SO4. Растворитель выпаривали, остаток очищали хроматографией на колонке с силикагелем (элюент: гексан, этилацетат), при этом получали указанное в заголовке соединение (600 мг, 35%). МС: m/е 339,5 (М+Н+). 1H ЯМР (300 МГц, CDCl3, 25°С): Следующий 2-аминоникотинонитрил получали аналогично тому, как описано выше: 2-амино-4-(2,4-дихлорфенил)-5-метил-6-фенилникотинонитрил получали из пропиофенона в виде твердого вещества (425 мг, 24%). МС: m/е 353,9 (М+Н+). Пример 78 Синтез 3-аминометилпиридин-2-иламинов (схема II, способ 8) 3-Аминометил-4-(2,4-дихлорфенил)-6-фенилпиридин-2-иламин
К суспензии LiAlH4 (324 мг, 8,52 ммоля)в ТГФ (2 мл) в атмосфере аргона медленно добавляли раствор 2-амино-4-(2,4-дихлорфенил)-6-фенилникотинонитрила (580 мг, 1,71 ммоля) в ТГФ (2 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Затем реакционную смесь охлаждали до -20°С и добавляли воду (0,4 мл). Через 15 мин добавляли этилацетат и смесь фильтровали через декалит. Органическую фазу отделяли, промывали водой и сушили над сульфатом натрия. Продукт очищали экспресс-хроматографей на силикагеле (элюент: метанол, дихлорметан), при этом получали указанное в заголовке соединение в виде твердого вещества светло-желтого цвета (36 мг, 6%). МС: m/е 343,8 (М+Н+). 1H ЯМР (300 МГц, CDCl3, 25°С): Пример 79 3-Аминометил-4-(2,4-дихлорфенил)-5-метил-6-фенилпиридин-2-иламин
Указанное в заголовке соединение получали в виде твердого вещества (22 мг, 9%) из 2-амино-4-(2,4-дихлорфенил)-5-метил-6-фенилникотинонитрила аналогично способу, описанному в примере 78. МС: m/е 357,9 (M+). Пример 80 Препаративное восстановление карбонитрилов с образованием аминометил-соединений (схемы I и II, способ 9) [5-Аминометил-6-(4-хлорфенил)-2-пиридин-3-илпиримидин-4-ил]метиламин
Препаративное восстановление карбонитрилов с образованием аминометил-соединений 4-(4-Хлорфенил)-6-(диметиламино)-2-(3-пиридинил)-5-пиримидикарбонил (фирма Bionet) (50 мг, 0,155 ммолей) растворяли в ТГФ (1 мл) и добавляли в колбу с охлаждаемой (0°С) суспензией 100 мг литийалюминийгидрида в 1 мл ТГФ. Реакционную смесь встряхивали при КТ в течение 2 ч, а затем при 40°С в течение 4 ч. Смесь охлаждали, осторожно добавляли воду и смесь фильтровали. Фильтрат упаривали на вакуумной центрифуге (45°С). Остаток растворяли в 1 мл ДМФА и очищали с использованием автоматизированной системы для препаративной ЖХВР (колонка YMC CombiPrep С 18, 50×20 мм, элюент: градиент СН3CN/вода +0,1% ТФУ, от 5% до 95%, скорость элюирования 40 мл/мин, время 6,0 мин, Пример 81 5-Аминометил-6-бензо[1,3]диоксол-5-ил-2-(4-метоксифенил)пиримидин-4-иламин
Указанное в заголовке соединение получали из 4-амино-6-бензо[1,3]диоксол-5-ил-2-(4-метоксифенил)пиримидин-5-карбонитрила аналогично способу, описанному в примере 80. МС: m/е 351,0 (М+Н+). Пример 82 5-Аминометил-6-бензо[1,3]диоксол-5-ил-2-фенилпиримидин-4-иламин
Указанное в заголовке соединение получали из 4-амино-6-бензо[1,3]диоксол-5-ил-2-фенилпиримидин-5-карбонитрила аналогично способу, описанному в примере 80. МС: m/е 321,0 (М+Н+). Пример 83 [5-Аминометил-6-(4-хлорфенил)-2-пиридин-3-илпиримидин-4-ил]изопропиламин
Указанное в заголовке соединение получали из 4-(4-хлорфенил)-6-(изопропиламино)-2-(3-пиридинил)-5-пиримидинкарбонитрила аналогично способу, описанному в примере 80. МС: m/е 354,1 (М+Н+). Пример 84 (5-Аминометил-2,6-дифенилпиримидин-4-ил)метиламин
Указанное в заголовке соединение получали из 4-(метиламино)-2,6-дифенил-5-пиримидинкарбонитрила (фирмы Bionet) аналогично способу, описанному в примере 80. МС: m/е 290,9 (М+Н+). Пример 85 3-Аминометил-4-(4-хлорфенил)-5-метил-6-фенилпиридин-2-иламин
Указанное в заголовке соединение получали из 2-амино-4-(4-хлорфенил)-5-метил-6-фенилникотинонитрила (фирмы Bionet) аналогично способу, описанному в примере 80. МС: m/е 323,9 (М+Н+). Пример 86 3-Аминометил-4-(4-хлорфенил)-6-фенилпиридин-2-иламин
Указанное в заголовке соединение получали из 2-амино-4-(4-хлорфенил)-6-фенилникотинонитрила (фирмы Bionet) аналогично способу, описанному в примере 80. МС: m/е 310,3 (М+Н+). Пример 87 3-Аминометил-4,6-бис-(4-фторфенил)пиридин-2-иламин
Указанное в заголовке соединение получали из 2-амино-4,6-бис-(4-фторфенил)никотинонитрила аналогично способу, описанному в примере 80. MC: m/е 311,9 (М+Н+). Пример 88 (схема II, способ 10) 3-Аминометил-4-бензо[1,3]диоксол-5-ил-6-фенилпиридин-2-иламин
4-Бензо[1,3]диоксол-5-илметиленмалононитрил (79 мг, 0,4 ммоля), бензофенон (48 мг, 0,4 ммоля), ацетат аммония (78 мг, 1,2 ммоля) и толуол (4 мл) помещали в реакционный сосуд и встряхивали при 118°С в течение ночи. Затем смесь охлаждали и фильтровали, раствор упаривали на вакуумной центрифуге (45°С), остаток очищали с использованием автоматизированной системы для препаративной ЖХВР (колонка YMC CombiPrep C18, 50×20 мм, элюент: градиент СН3CN/вода+0,1% ТФУ, от 5% до 95%, скорость элюирования 40 мл/мин, время 6,0 мин, Примеры галеновых препаратов Пример А Таблетки с покрытием следующего состава получали стандартным способом:
Активное соединение просеивали и смешивали с микрокристаллической целлюлозой, затем смесь гранулировали в смеси с раствором поливинилпирролидона в воде. Гранулят смешивали с натрий гликолятом крахмала и стеаратом магния, прессовали для образования ядер таблеток массой 120 или 350 мг соответственно. Ядра покрывали водным раствором/суспензией вышеуказанного состава. Пример Б Капсулы следующего состава получали стандартным способом:
Компоненты просеивали, смешивали и смесью заполняли капсулы размера 2. Пример В Растворы для инъекций следующего состава получали стандартным способом:
Активный компонент растворяли в смеси полиэтиленгликоля 400 и части объема воды для инъекции. Добавляли уксусную кислоту до рН 5,0 и доводили до 1,0 мл добавлением остального количества воды. Раствор фильтровали, разливали во флаконы и стерилизовали. Пример Г Мягкие желатиновые капсулы следующего состава получали стандартным способом: Состав капсулы
Желатиновая капсула
Активный компонент растворяли в теплой расплавленной смеси других ингредиентов и смесь разливали в мягкие желатиновые капсулы пригодного размера. Заполненные мягкие желатиновые капсулы обрабатывали стандартным способом. Пример Д Пакетики следующеего состава получали стандартным способом:
Активный компонент смешивали с лактозой, микрокристаллической целлюлозой и натриевой солью карбоксиметилцеллюлозы, гранулировали в смеси с раствором поливинилпирролидона в воде. Гранулят смешивали со стеаратом магния и ароматизаторами, а затем расфасовывали в пакетики.
Формула изобретения
1. Соединения формулы (I)
где Х означает N или C-R5, R1 и R2 независимо означают водород, С1-6-алкил, R3 означает насыщенный или ароматический 5-7-членный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота, серы и кислорода, возможно конденсированный с 1-2 бензольными кольцами, насыщенный или ароматический 5-7-членный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота, серы и кислорода, возможно конденсированный с 1-2 бензольными кольцами, независимо моно-, ди или тризамещенный C1-6-алкилом, C1-6-алкокси, перфтор-C1-6-алкилом или галогеном; фенил; нафтил; фенил или нафтил, независимо моно-, ди- или тризамещенный галогеном, C1-6-алкилом, C1-6-алкокси или перфтор-C1-6-алкилом, R4 означает (низший) алкил, (низший) алкокси, (низший) алкилтио, насыщенный или ароматический 5-7-членный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота, серы и кислорода, возможно конденсированный с 1-2 бензольными кольцами, насыщенный или ароматический 5-7-членный гетероциклил, содержащий 1-2 гетероатома, выбранных из азота, серы и кислорода, возможно конденсированный с 1-2 бензольными кольцами, независимо моно-, ди- или тризамещенный C1-6-алкилом, C1-6-алкокси, перфтор-C1-6-алкилом или галогеном; фенил; нафтил; фенил или нафтил, независимо моно-, ди- или тризамещенный галогеном, C1-6-алкилом, C1-6-алкокси, амино или перфтор-C1-6-алкилом; 4-фторфенилокси-С1-6-алкил или С3-С6циклоалкил, R5 означает водород или C1-6-алкил, кроме соединения, где R4– СН3О, R3-Ph, R1, R2-H, X-N, и их фармацевтически приемлемые соли. 2. Соединения по п.1, где R1 означает водород. 3. Соединения по п.1, где R2 означает водород. 4. Соединения по п.1, где Х означает N. 5. Соединения по п.1, где R3 означает гетероциклил, выбранный из группы, включающей пиридил, пиримидинил, фурил, тиенил, индолил, бензо[1,3]диоксолил, бензофуранил, бензотиофенил, дибензофуранил, оксазолил, имидазолил, тиазолил, изоксазолил, пиразолил, изотиазолил, пиридазил, пиримидинил, пиразинил, пирролидинил, азепанил и морфолино, причем указанный гетероциклил необязательно и независимо моно-, ди- или тризамещен галогеном, перфтор-C1-6-алкилом, C1-6-алкилом или C1-6-алкокси. 6. Соединения по п.5, где R3 означает незамещенный тиенил или незамещенный бензо[1,3]диоксолил. 7. Соединения по п.1, где R3 означает фенил, необязательно и независимо орто-, мета или пара-замещенный C1-6-алкилом, C1-6-алкокси, галогеном или перфтор-C1-6-алкилом. 8. Соединения по п.7, где R3 означает 2,4-дихлорфенил. 9. Соединения по п.1, где R4 означает фенил, необязательно и независимо орто-, мета- и/или паразамещенный галогеном, амино, C1-6-алкилом, перфтор-C1-6-алкилом или C1-6-алкокси. 10. Соединения по п.1, где R4 означает C1-6-алкокси. 11. Соединения по п.1, где R4 означает C1-6-алкилтио. 12. Соединения по п.1, где R4 означает гетероциклический остаток, выбранный из группы, включающей пиридил, тиенил, индолил, бензо[1,3]диоксолил, бензофуранил, бензотиофенил, дибензофуранил, пирролидинил, азепанил и морфолино, причем указанный гетероциклил необязательно и независимо моно-, ди- или тризамещен галогеном, амино, перфтор-C1-6-алкилом, C1-6-алкилом или C1-6-алкокси. 13. Соединение по п.1, где Х означает N, R1 и R2 означают водород, R3 означает 2,4-дихлорфенил, а R4 означает метокси, метилтио, гетероциклический остаток, выбранный из пирролидинила и азепанила, или фенильный остаток, необязательно и независимо орто-, мета- и/или паразамещенный фтором, метилом или метокси. 14. Соединение по п.1, где Х означает N или C-R5, R1 означает водород или C1-6-алкил, R2 означает водород или C1-6-алкил, R3 означает незамещенный тиенил, незамещенный бензо[1,3]диоксолил, или фенил, независимо орто-, мета- и/или паразамещенный C1-6-алкилом, C1-6-алкокси, галогеном или перфтор-C1-6-алкилом, R4 означает низший алкил, низший алкокси, низший алкилтио, Сз-С6циклоалкил, гетероциклил, выбранный из ряда пиридил, тиенил, индолил, бензо[1,3]диоксолил, бензофуранил, бензотиофенил, дибензофуранил, пирролидинил, азепанил и морфолино, причем указанный гетероциклильный остаток независимо моно- или дизамещен C1-6-алкилом или C1-6-алкокси, нафтил, монозамещенный C1-6-алкокси, фенил, независимо орто-, мета- и/или паразамещенный галогеном, амино, C1-6-алкилом, перфтор-С1-6-алкилом или C1-6-алкокси; или 4-фторфенилокси-С1-6-алкил, а R5 означает водород или C1-6-алкил. 15. Соединения по п.1, выбранные из группы, включающей 5-аминометил-6-(2,4-дихлорфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-фенил-6-п-толилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3-метоксифенил)пиримидин-4-иламин, 5-аминометил-2-фенил-6-о-толилпиримидин-4-иламин, 5-аминометил-6-(2,4-дифторфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-м-толилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,4,5-триметоксифенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-диметилфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,5-диметоксифенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3-фторфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-фторфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-метокси-1-метил-1Н-индол-6-ил)пиримидин-4-иламин, 5-аминометил-2-бензофуран-2-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(1Н-индол-2-ил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-м-толилпиримидин-4-иламин, 2-(4-амино-3-метоксифенил)-5-аминометил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-2-азепан-1-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,4-дифторфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-пирролидин-1-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-метилсульфанилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,4-диметоксифенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-тиофен-2-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(2-фторфенил)пиримидин-4-иламин, 5-аминометил-2-(4-хлорфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-метоксипиримидин-4-иламин, 5-аминометил-2-циклопропил-6-фенилпиримидин-4-иламин 5-аминометил-6-(2,4-дихлорфенил)-2-п-толилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-метоксифенил)пиримидин-4-иламин, 5-аминометил-2-бензо[1,3]диоксол-5-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3-трифторметилфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-морфолин-4-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-трифторметилфенил)пиримидин-4-иламин, 5-аминометил-2-(3-хлорфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-метилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-нафталин-2-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-нафталин-1-илпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3-метоксифенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(3,5-дифторфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(2-метоксифенил)пиримидин-4-иламин, 5-аминометил-6-(4-этилфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-изопропилпиримидин-4-иламин, 5-аминометил-2-(2-хлор-4-фторфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-2-бензо[b]тиофен-2-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(6-метоксинафталин-2-ил)пиримидин-4-иламин, 5-аминометил-2-фенил-6-м-толилпиримидин-4-иламин, 5-аминометил-6-(4-хлорфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-фенил-6-(4-трифторметилфенил)пиримидин-4-иламин, 5-аминометил-6-(2-метоксифенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-о-толилпиримидин-4-иламин, 5-аминометил-2-(3,5-бис-трифторметилфенил)-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-дихлорфенил)-2-(4-фторфеноксиметил)пиримидин-4-иламин, 5-аминометил-6-(2-хлорфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2-бромфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-дибензофуран-2-ил-6-(2,4-дихлорфенил)пиримидин-4-иламин, 5-аминометил-6-(2,4-бис-трифторметилфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2-фтор-4-метоксифенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-(2,4-диметоксифенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-(1Н-индол-2-ил)-6-фенилпиримидин-4-иламин, 5-аминометил-6-бензо[1,3]диоксол-5-ил-2-циклопропилпиримидин-4-иламин, 5-аминометил-6-(2-фторфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-фенил-6-(2-трифторметилфенил)пиримидин-4-иламин, 5-аминометил-2-бензофуран-2-ил-6-фенилпиримидин-4-иламин, 5-аминометил-6-(4-фторфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-(3,4-диметоксифенил)-6-фенилпиримидин-4-иламин, 5-аминометил-6-фенил-2-пиридин-4-илпиримидин-4-иламин, 5-аминометил-6-(3-хлорфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-6-фенил-2-тиофен-2-илпиримидин-4-иламин, 5-аминометил-6-(3-фторфенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2,6-дифенилпиримидин-4-иламин, 5-аминометил-6-(4-метоксифенил)-2-фенилпиримидин-4-иламин, 5-аминометил-2-фенил-6-тиофен-3-илпиримидин-4-иламин, 5-аминометил-6-(3-метоксифенил)-2-фенилпиримидин-4-иламин, 6-(2,4-дихлорфенил)-5-метиламинометил-2-фенилпиримидин-4-иламин, 3-аминометил-4-(2,4-дихлорфенил)-6-фенилпиридин-2-иламин, 3-аминометил-4-(2,4-дихлорфенил)-5-метил-6-фенилпиридин-2-иламин, [5-аминометил-6-(4-хлорфенил)-2-пиридин-3-илпиримидин-4-ил]-метиламин, 5-аминометил-6-бензо[1,3]диоксол-5-ил-2-(4-метоксифенил)пиримидин-4-иламин, 5-аминометил-6-бензо[1,3]диоксол-5-ил-2-фенилпиримидин-4-иламин, [5-аминометил-6-(4-хлорфенил)-2-пиридин-3-илпиримидин-4-ил] -изопропиламин, (5-аминометил-2,6-дифенилпиримидин-4-ил)-метиламин, 3-аминометил-4-(4-хлорфенил)-5-метил-6-фенилпиридин-2-иламин, 3-аминометил-4-(4-хлорфенил)-6-фенилпиридин-2-иламин, 3-аминометил-4,6-бис-(4-фторфенил)-пиридин-2-иламин, и 3-аминометил-4-бензо[1,3]диоксол-5-ил-6-фенилпиридин-2-иламин, и фармацевтически приемлемые соли указанных соединений. 16. Способ получения соединений формулы (I) по любому из пп.1-15, где R2 означает водород, включающий восстановление нитрила общей формулы (IVa) или (IV):
где Х означает N или C-R5, R1, R3, R4 и R5 имеют значения, указанные в пп.1-15, с образованием амина формулы (Ia):
где Х имеет значения, указанные выше, R1, R3 и R4 имеют значения, указанные в пп.1-15. 17.Способ получения соединений формулы (I) по любому из пп.1-15, где R2 означает C1-6-алкил, включающий алкилирование амина общей формулы (Ia):
где Х означает N или C-R5, R1, R3, R4 и R5 имеют значения, указанные в пп.1-15, с образованием соединения (Ib):
где X и R2 имеют значения, указанные выше, a R1, R3 и R4 имеют значения, указанные в пп.1-15. 18. Фармацевтические композиции, обладающие свойствами ингибитора дипептидилпептидазы IV(DPP IV), включающие соединения по любому из пп.1-15 и фармацевтически приемлемый носитель или адъювант. 19. Соединения по п.1, обладающие свойствами ингибитора дипептидилпептидазы IV(DPP IV). 20. Соединения по п.1, для получения лекарственных средств, пригодных для применения при лечении и/или профилактики заболеваний, ассоциированных с DPP IV. 21. Применение соединений по любому из пп.1-15 для лечения и/или профилактики заболеваний, ассоциированных с DPP IV, таких как диабет типа II.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

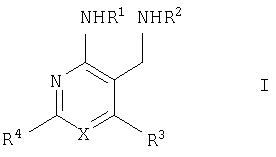
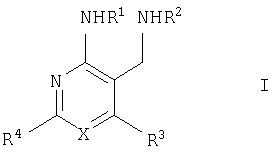
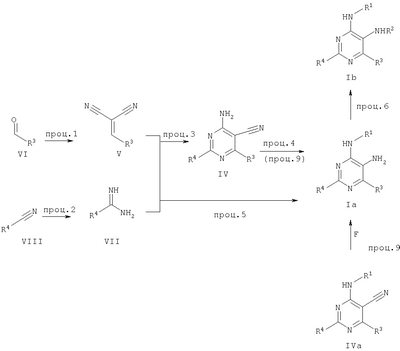
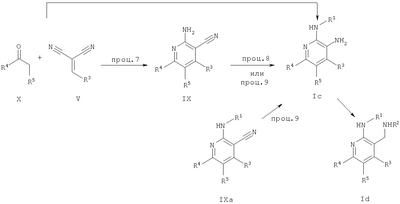
 7,45 (m, 1Н), 7,59 (m, 1Н), 8,18 (m, 2Н).
7,45 (m, 1Н), 7,59 (m, 1Н), 8,18 (m, 2Н).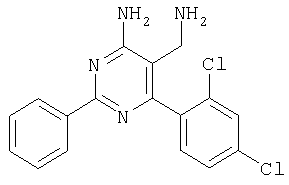
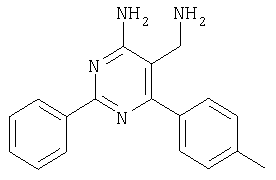
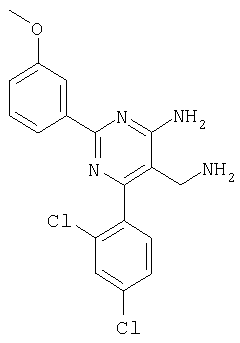
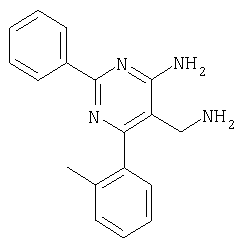
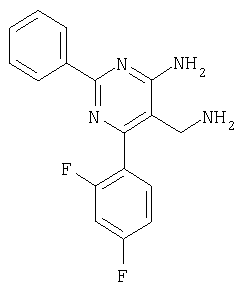
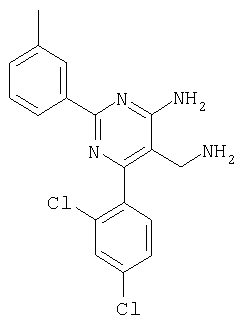
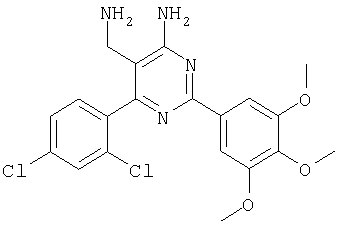
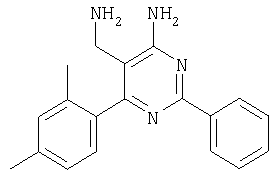
 230 нм). Полученное промежуточное соединение (22 мг) растворяли в ТГФ (1 мл) и при охлаждении (0°С) в атмосфере аргона добавляли в реакционный сосуд с суспензией 100 мг литийалюминийгидрида в 1 мл ТГФ. Реакционную смесь встряхивали при КТ в течение 2 ч, а затем при 40°С в течение 4 ч. После охлаждения к смеси осторожно добавляли воду и смесь фильтровали. Фильтрат упаривали на вакуумной центрифуге (45°С). Остаток растворяли в 1 мл ДМФА и очищали с использованием системы для препаративной ЖХВР (колонка YMC CombiPrep C18, 50×20 мм, элюент: градиент СН3CN/вода +0,1% ТФУ, от 5% до 95%, скорость элюирования 40 мл/мин, время 6,0 мин,
230 нм). Полученное промежуточное соединение (22 мг) растворяли в ТГФ (1 мл) и при охлаждении (0°С) в атмосфере аргона добавляли в реакционный сосуд с суспензией 100 мг литийалюминийгидрида в 1 мл ТГФ. Реакционную смесь встряхивали при КТ в течение 2 ч, а затем при 40°С в течение 4 ч. После охлаждения к смеси осторожно добавляли воду и смесь фильтровали. Фильтрат упаривали на вакуумной центрифуге (45°С). Остаток растворяли в 1 мл ДМФА и очищали с использованием системы для препаративной ЖХВР (колонка YMC CombiPrep C18, 50×20 мм, элюент: градиент СН3CN/вода +0,1% ТФУ, от 5% до 95%, скорость элюирования 40 мл/мин, время 6,0 мин, 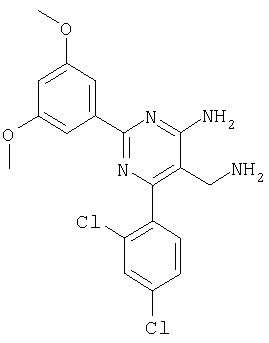
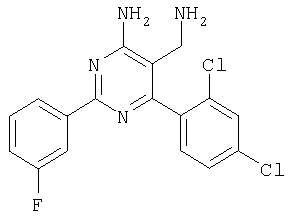
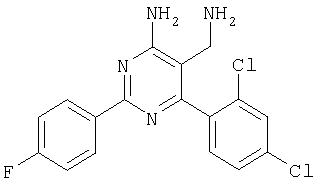
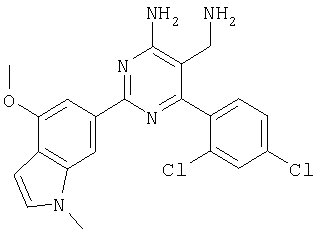
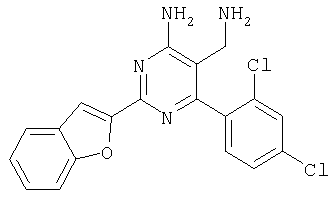
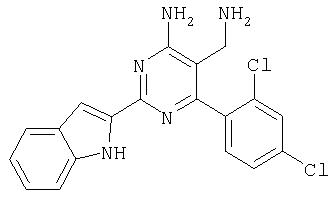
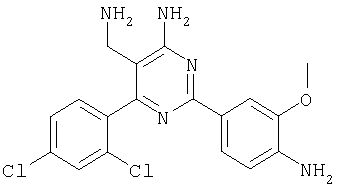
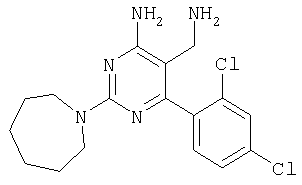
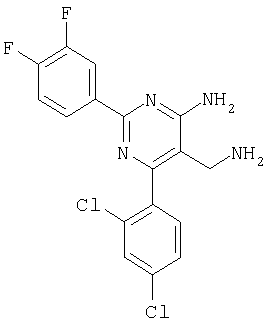
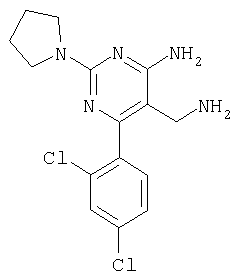
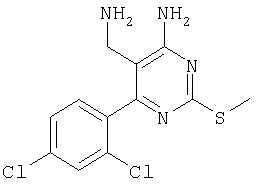
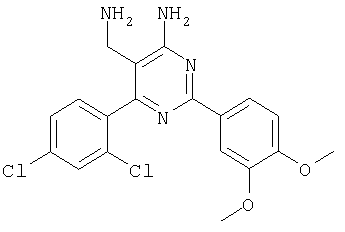
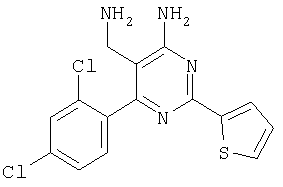
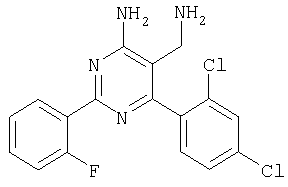
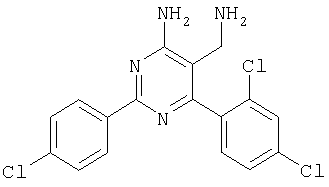
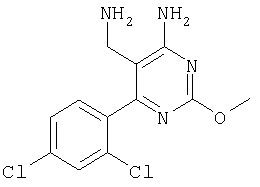
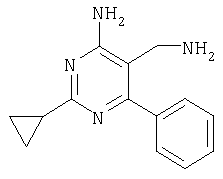
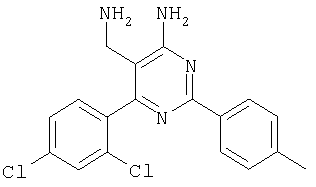
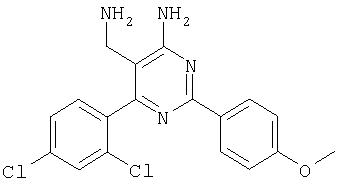
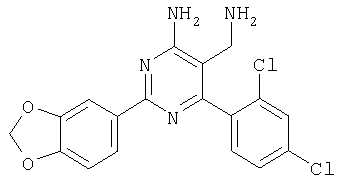
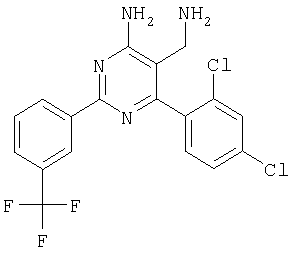
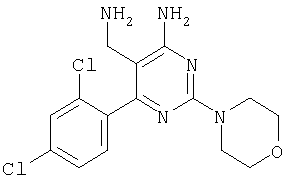
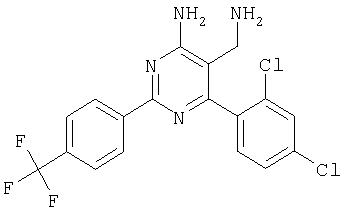
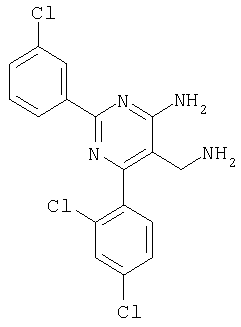
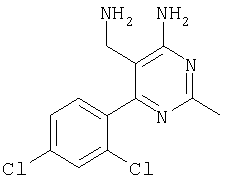
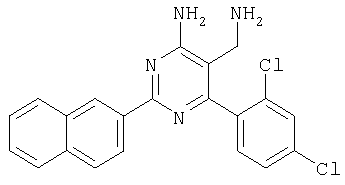
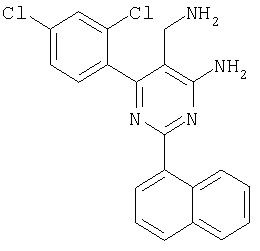
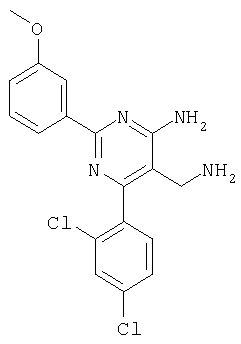
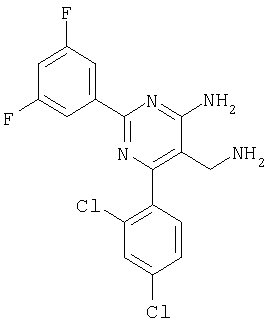
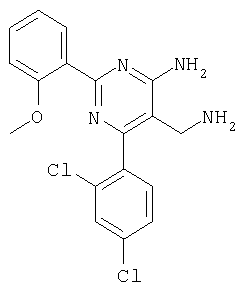
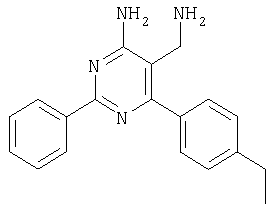
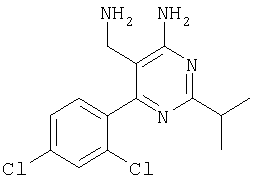
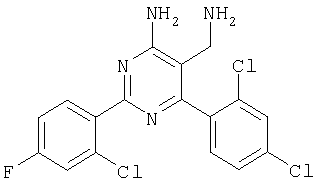
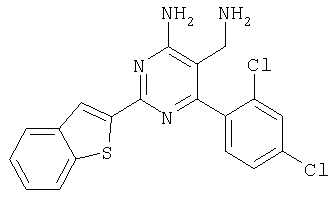
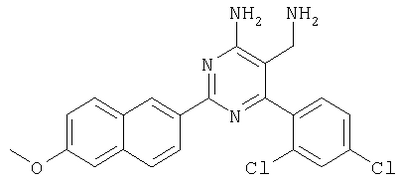
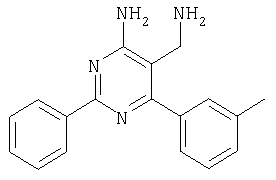
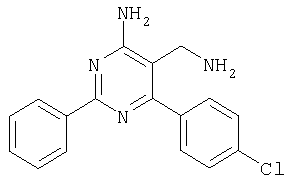
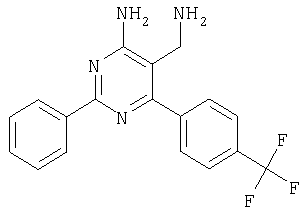
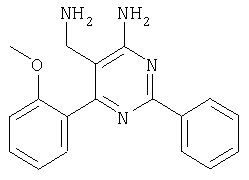
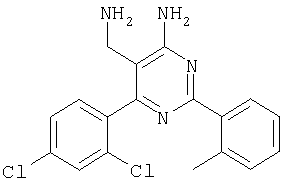
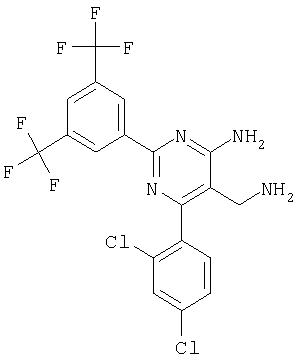
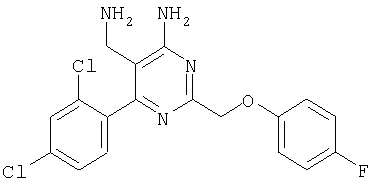
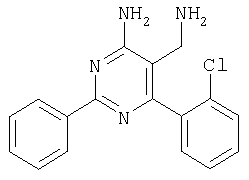
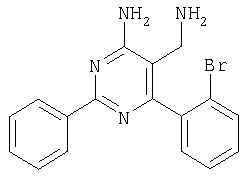
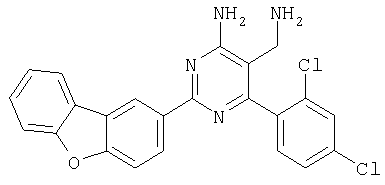
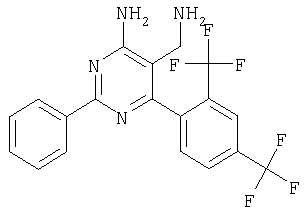
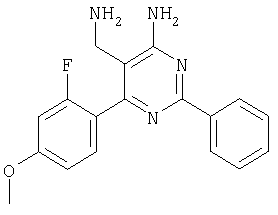
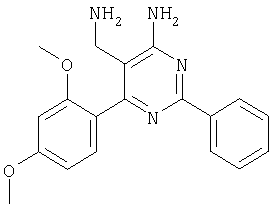
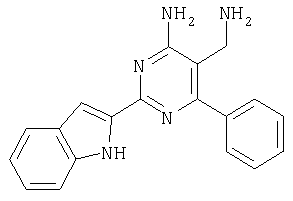
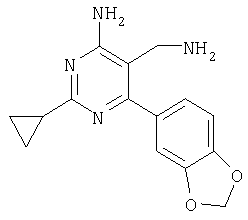
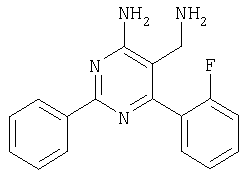
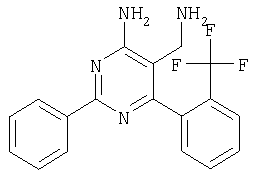
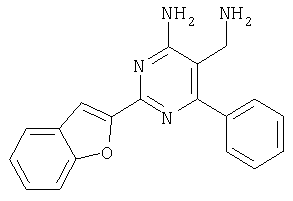
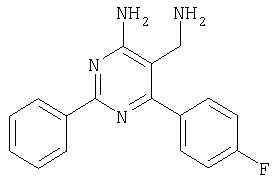
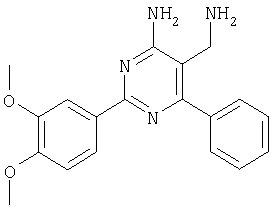
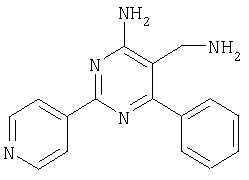
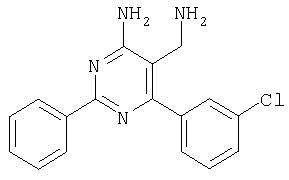
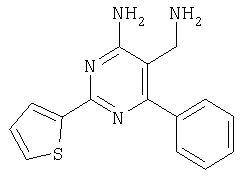
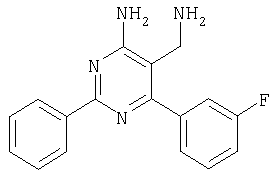
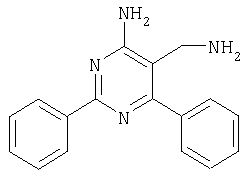
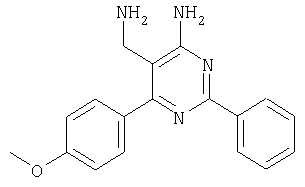
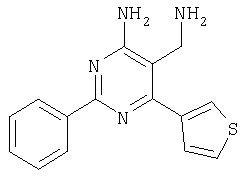
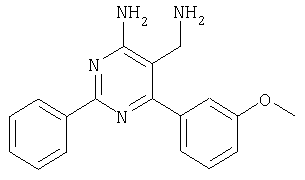
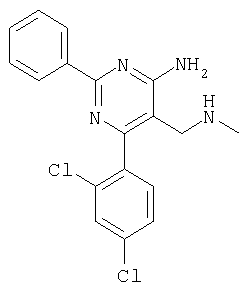
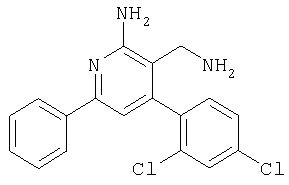
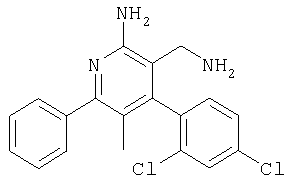
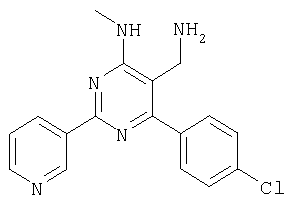
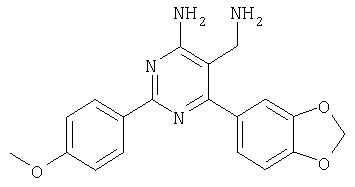
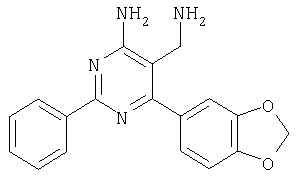
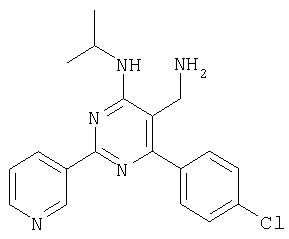
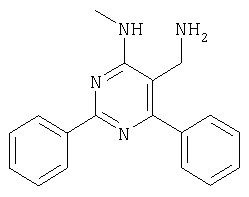
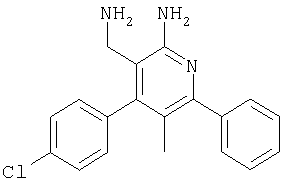
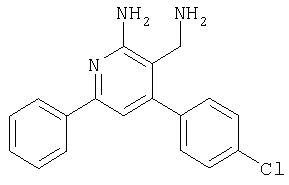
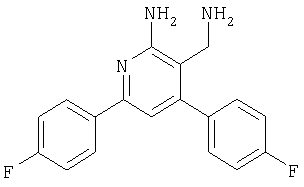
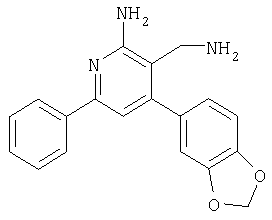
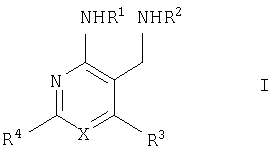
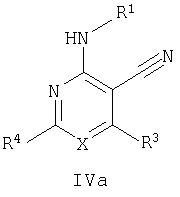 или
или