|
(21), (22) Заявка: 2002117053/04, 13.11.2000
(24) Дата начала отсчета срока действия патента:
13.11.2000
(30) Конвенционный приоритет:
25.11.1999 DE 19956786.7
(43) Дата публикации заявки: 20.01.2004
(46) Опубликовано: 20.02.2007
(15) Информация о коррекции:
Версия коррекции № 1 (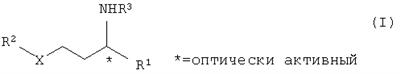
где R1 замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил, R2 замещенный или незамещенный, разветвленный или неразветвленный (С1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил, R3 водород, гидроксил, замещенный или незамещенный, разветвленный или неразветвленный (С1-С10)-алкил, Х=кислород или NH. Способ включает следующие стадии: а) взаимодействие соединений общей формулы II
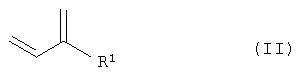
с соединениями формулы R2-XH (III) в присутствии основания с получением соединений общей формулы IV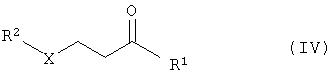
б) взаимодействие реакционного раствора соединений общей формулы IV с соединениями
общей формулы NH2R3 (V), с получением соединений общей формулы VI
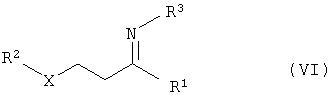
в) гидрирование соединений общей формулы VI с получением соединений общей формулы VII 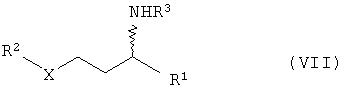
в присутствии катализатора гидрирования, в частности катализаторов на основе Ni, Co, Pt, Pd, Ru или Rh, г) расщепление рацематов соединений общей формулы VII с получением соединений общей формулы I оптически активной карбоновой кислотой или сложными эфирами общей формулы VIII
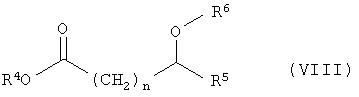
в присутствии липазы или эстеразы. Изобретение также относится к новым оптически активным амидам формулы VIII и способу получения соединений формулы VII. Способ позволяет проводить процесс с высокой энантиоселективностью при расщеплении рацематов при использовании малых количеств исходных продуктов и катализатора в широком диапазоне условий реакции. 3 н. и 16 з.п. ф-лы.
(56) (продолжение):
CLASS=”b560m”no.19, ref.6199d;. ANDRES C. et al. Stereoselective ring opening of chiral oxazolidines by Reformasky reagents:an enantioselecive entry to beta amino esters. Tetrahedron Letters. 1992, Bd.33, no.20, s.2895-2898. BESSE P. et al. Stereoselective chemoenzymatic synthesis of both enantiomers of protected 4-amino-2-pentanone. Tetrahedron Assimetry. 1999, Bd.10, no.4, s.2213-2224. DE 247144 C, 21.01.1911. DE 723498 C(I.G.Farbenfabriken AG.),18.06.1942. [OnLine] DATABASE CROSSFIRE BEILSTEIN: соединения с регистрационными номерами (BRN) 8253393, 1746407, 1734381, 2231657, 7174696, 1732216, 1732706, 5561939, 17195613, 4304559, 1919664.
Изобретение относится к способу получения оптически активных аминов. Далее изобретение относится к способу получения рацемических аминов, расщепление рацематов которых может быть осуществлено оптически активными карбоновыми кислотами или ферментами. Изобретение относится также и к рацемическим и оптически активным аминам, а также к оптически активным амидам.
Расщепление рацематов аминов посредством катализируемой ферментами реакции взаимодействия со сложными эфирами так же известно, как и классическое химическое расщепление рацематов посредством образования диастереомерных солей оптически активными карбоновыми кислотами (см. публикацию Advanced Organic Chemistry, Reactions, Mechanisms and Structure, Jerry March, Fourth Edition, John Wiley & Sons, Inc., 1992.) ISBN 0-471-60180-2). Так, например, авторы Kitaguchi и др. (в публикации J. Amer. Chem. Soc. 111, 3094-3095,1989) описывают расщепление рацематов аминов трифторэтилбутаратом при катализе субтилизином. Энантиоселективность этой реакции, однако, сильно зависит от растворителя. Даже при самом пригодном из описанных растворителей (3-метил-3-пентаноле) достигается только средняя селективность.
В международной заявке WO 91/19002 описывается способ хирального обогащения асимметричных первичных аминов, при котором амины подвергают реакции взаимодействия с этилацетатом или этилбутаратом при катализе субтилизином. Полученные при этом избытки энантиомеров являются, однако, неудовлетворительными, кроме того, требуется продолжительное время реакции от одной до нескольких недель. Авторы Gotor и др. (см. публикацию J. Chem. Soc. Chem. Commun. стр.957-958, 1988) описывают энантиоселективное ацилирование 2-амино-бутан-1-ола этиленацетатом при катализе липазой поджелудочной железы свиньи (PPL). При этом применяемый сложный эфир (этилацетат) используется как растворитель. При применении других растворителей, соответственно других ферментов не получают удовлетворительные результаты.
Авторами Brieva и др. (J. Chem. Soc. Chem. Commun., 1386-1387. 1990) описывается энантиоселективный синтез амидов из рацемических первичных аминов посредством реакции взаимодействия 2-хлорпропионата при катализе субтилизином в гексане или Candida cylindracea в 3-метил-3-пентаноле.
Авторы Quiros и др. (см. публикацию Tetrahedron: Asymmetry 4, 1105-1112, 1993) описывают катализированный липазой синтез оптически активных амидов из рацемических, замещенных  -галогеном сложных этиловых эфиров пропионовой кислоты и первичных аминов. Достигаемая при этой реакции взаимодействия энантиоселективность не является удовлетворительной. -галогеном сложных этиловых эфиров пропионовой кислоты и первичных аминов. Достигаемая при этой реакции взаимодействия энантиоселективность не является удовлетворительной.
Авторы Asensio и др. (в публикации Tetrahedron Letters 32, стр.4197-4198, 1991) описывают катализируемое липазой энантиоселективное ацилирование вторичных аминов. Эта реакция происходит, однако, только при амине энантиоселективно и только со средним успехом. Другие амины вообще не проявляют энантиоселективности.
В патенте США 5057607 описывается N-ацилирование 3-амидо-азет-дионовых соединений с помощью G-амидазы пенициллина. G-амидаза пенициллина имеет, однако, только очень ограниченный субстратный спектр, так что она может применяться только для получения  -лактама. -лактама.
В заявке WO 95/08636 описывается способ расщепления рацематов первичных и вторичных аминов посредством катализированного ферментом ацилирования. Другими источниками, описывающими способ катализированного ферментом расщепления рацематов аминов, являются, например, заявки WO 96/23894, WO 97/20946, WO 97/2871, WO 97/46698 и WO 98/03465.
В приведенных публикациях описаны различные способы расщепления рацематов аминов. В качестве продукта расщепления рацематов наряду с целевым продуктом также образуется 50% нежелательного энантиомера. Для промышленного применения этих способов важным является то, что эти нежелательные энантиомеры могут быть рацемизированы и могут возвращаться в процесс расщепления рацематов, или же что этот сначала нежелательный энантиомер является также применяемым для химического синтеза продуктом и вместе с этим ценным продуктом. При ферментативном расщеплении рацематов один из энантиомеров имеется в форме амида. Если этот амид является ценным продуктом, то он должен расщепляться с сохранением стереоцентра. Подобный способ расщепления оптически активных амидов с сохранением стереоцентра описывается в патенте US 5905167.
Существенной проблемой для технического расщепления рацематов оптически активных, функционализированных аминов, таких как аминоспирты, является до сих пор наличие рацемического аминоспирта, который применяется в качестве исходного продукта для расщепления рацематов. Для обеспечения экономичности способа требуется разработка простого, надежного и недорогого синтеза с получением рацемического функционализированного амина. Авторами Murata и др. (см. публикацию J. Chem. Soc. Jpn, Ind. Chem. Sect. 56, 1953: 628, Chem. Abstr. 49,1955, 7517g) предлагается способ получения1-бензилокси-3-бутанона из 3-бутен-2-она с применением 3 эквивалентов бензилспирта и 0,04 мол. % Na-метанолята. Недостатком при этом методе является то, что избыточный бензотоловый спирт должен отделяться на другой стадии способа. Кроме того, при осуществлении способа часто имеет место обратное расщепление продукта в исходные материала, т.е. не имеется требуемая для технического применения способа надежность.
Известные до сих пор способы для расщепления рацематов и получения рацемических, функционализированных аминов имеют тот недостаток, что они не обладают требуемой для технического использования простотой и надежностью процесса и вместе с этим могут осуществляться только при очень специальных условиях. Кроме того, они требуют значительных количеств исходных материалов для синтеза рацемического исходного продукта, так что основанный на них способ не является экономичным.
Задачей изобретения поэтому является разработка способа синтеза рацемических аминов, таких как аминоспиртов, а также основанного на этом способа расщепления рацематов рацемических аминов, который обеспечивает высокую надежность процесса при высокой энантиоселективности при расщеплении рацематов и который может применяться в широком диапазоне условий реакции и при этом может осуществляться с малыми количествами исходного продукта и катализатора, так что затраты на общий способ могут быть снижены.
Эта задача решается способом получения соединений общей формулы I
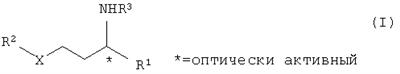
отличающимся тем, что он включает следующие стадии:
а) взаимодействие соединений общей формулы II
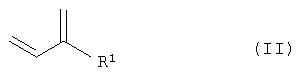
с соединениями формулы R2-XH (III) в присутствии основания с получением соединений общей формулы IV
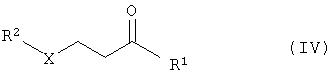
б) взаимодействие реакционного раствора соединений общей формулы IV с соединениями общей формулы NH2R3 (V) с получением соединений общей формулы VI
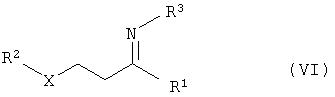
в) гидрирование соединений общей формулы с получением соединений общей формулы VII
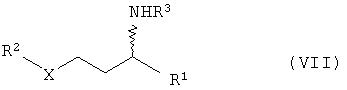
в присутствии катализатора гидрирования,
г) расщепление рацематов соединений общей формулы VII с получением соединений общей формулы 1 оптически активной карбоновой кислотой или сложными эфирами общей формулы VIII
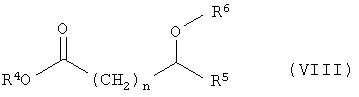
в присутствии липазы или эстеразы, причем заместители в формулах I, II, III, IV, V, VI, VII и VIII имеют следующее значение:
R1 означает незамещенный или замещенный, разветвленный или неразветвленный С1-С10алкил-, С2-С10алкенил-, С2-С10алкинил-, арилалкил-, арил-, гетарилалкил- или гетарил,
R2 означает незамещенный или замещенный, разветвленный или неразветвленный С1-С10алкил-, С3-С10алкенил-, С3-С10алкинил-, арилалкил-, арил-, гетарилалкил- или гетарил,
R3 означает водород, гидрокси-, незамещенный или замещенный, разветвленный или неразветвленный С1-С10алкил-, С3-С10алкенил- или C3-С10алкинил,
R4 означает незамещенный или замещенный, разветвленный или неразветвленный С1-С10алкил,
R5 означает водород, незамещенный или замещенный, разветвленный или неразветвленный С1-С10алкил,
R6 означает водород, незамещенный или замещенный, разветвленный или неразветвленный С1-С10алкил- или замещенный или незамещенный фенил,
Х=кислород или азот, предпочтительно кислород
n=0 или 1.
R1 означает в соединениях формул I, II, IV, VI, VII и IX замещенный или незамещенный, разветвленный или неразветвленный С1-С10алкил-, С2-С10алкенил-, С2-С10алкинил-, арилалкил-, арил-, гетарилалкил- или гетарил-. Предпочтительными остатками R1 IX являются замещенный или незамещенный, разветвленный или неразветвленный С1-С10алкил- или арил.
В качестве алкильных остатков следует привести замещенные или незамещенные, разветвленные или неразветвленные С1-С10-алкильные цепи, как например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил. Предпочтительными остатками являются метил, этил или пропил.
В качестве алкенильных остатков следует привести разветвленные или неразветвленные С2-С10-алкенильные цепи, как например, этенил, пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-метилпропенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-метил-1-бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил, 1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1-этил-1-пропенил, 1-этил-2-пропенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2-метил-1-пентенил, 3-метил-1-пентенил, 4-метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил,3-метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-1-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-1-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-1-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-1-бутенил, 3,3-диметил-2-бутенил, 1-этил-1-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил-2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-1-пропенил, 1-этил-2-метил-2-пропенил, 1-гептенил, 2-гептенил, 3-гептенил, 4-гептенил, 5-гептенил, 6-гептенил, 1-октенил, 2-октенил, 3-октенил, 4-октенил, 5-октенил, 6-октенил, 7-октенил, ноненил или декенил.
В качестве алкинильных остатков следует привести разветвленные или неразветвленные С2-С10-алкинильные цепи, как например, этинил, проп-1-ин-1-ил, проп-2-ин-1-ил, н-бут-1-ин-1-ил, н-бут-1-ин-3-ил, н-бут-1-ил-4-ил, н-бут-2-ил-1-ил, н-пент-1-ил-1-ил, н-пент-1-ил-3-ил, н-пент-1-ил-4-ил, н-пент-1-ил-5-ил, н-пент-2-ин-1-ил, н-пент-2-ин-4-ил, н-пент-2-ил-5-ил, 3-метил-бут-1-ин-3-ил, 3-метил-бут-1-ин-4-ил, н-гекс-1-ин-1-ил, н-гекс-1-ин-3-ил, н-гекс-1-ин-4-ил, н-гекс-1-ин-5-ил, н-гекс-1-ин-6-ил, н-гекс-2-ин-1-ил, н-гекс-2-ин-4-ил, н-гекс-2-ин-5-ил, н-гекс-2-ин-6-ил, н-гекс-3-ин-1-ил, н-гекс-3-ин-2-ил, 3-метил-пент-1-ин-1-ил, 3-метил-пент-1-н-3-ил, 3-метил-пент-1-ин-4-ил, 3-метил-пент-1-ин-5-ил, 4-метил-пент-1-н-1-ил, 4-метил-пент-2-ин-4-ил или 4-метил-пент-2-ин-5-ил.
Предпочтительно многократные связи алкенильных или алкинильных остатков не должны иметься в  -положении относительно карбонилуглерода, так как вследствие этого имеет место негативное влияние на селективность реакции [стадия способа (а)] и, в случае необходимости, требуется очистка реактора. Смещающие электроны и/или объемные остатки, такие как трет-бутил, могут положительно влиять на селективность. -положении относительно карбонилуглерода, так как вследствие этого имеет место негативное влияние на селективность реакции [стадия способа (а)] и, в случае необходимости, требуется очистка реактора. Смещающие электроны и/или объемные остатки, такие как трет-бутил, могут положительно влиять на селективность.
В качестве заместителей вышеприведенных остатков R1 пригодны, кроме кетонов или альдегидов, в принципе все заместители, например, один или несколько таких заместителей, как галоген, такой, как фтор, амино, гидрокси, алкил, циклоалкил, арил, алкилокси, бензилокси, фенил или бензил.
В качестве арилалкильных остатков следует привести разветвленные или неразветвленные фенил-(С1-С5-алкил)-остатки или нафтил-(С1-С5-алкил)-остатки, такие как фенилметил, фенилэтил, фенилпропил, фенил-1-метил-этил, фенилбутил, фенил-1-метилпропил, фенил-2-метил-пропил, фенил-1,1-диметилэтил, фенилпентил, фенил-1-метил-бутил, фенил-2-метилбутил, фенил-3-метилбутил, фенил-2,2-диметил-пропил, фенил-1-этилпропил, нафтилметил, нафтилэтил, нафтилпропил, нафтил-1-метилэтил, нафтилбутил, нафтил-1-метилпропил, нафтил-2-метилпропил, нафтил-1,1-диметилэтил, нафтилпентил, нафтил-1-метилбутил, нафтил-2-метилбутил, нафтил-3-метилбутил, нафтил-2,2-диметилпропил, или нафтил-1-этилпропил, а также их изомерные или стереомерные формы. Предпочтительными остатками являются неразветвленные или разветвленные фенил-(С1-С5алкил)-остатки, такие, как фенилметил, фенилэтил или фенилпропил.
В качестве арильных остатков следует привести, например, фенил, метоксифенил или нафтил, или ароматические кольца или кольцевые системы, имеющие от 6 до 18 атомов углерода в кольцевой системе, а также до 24 других атомов углерода, которые могут образовывать другие неароматические кольца или кольцевые системы, имеющие от 3 до 8 атомов углерода в кольце, которые в случае необходимости могут быть замещены одним или несколькими такими остатками, как галоген, например фтор, амино, гидрокси, алкил, алкилокси или другими остатками. Предпочтителен при этом необязательно замещенный фенил, метоксифенил или нафтил.
В качестве гетарил(алкильных) остатков следует назвать, например, такие гетарилалкильные остатки, которые содержат один или несколько атомов азота, серы и/или кислорода в кольце или кольцевой системе и связаны с разветвленной или неразветвленной С1-С5-алкиленовой цепью, такой как метилен, этилен, н-пропилен, 1-метилэтилен, н-бутилен, 1-метилпропилен, 2-метилпропилен, 1,1-диметилэтилен, п-пентилен, 1-метилбутилен, 2-метилбутилен, 3-метилбутилен, 2,2-диметилпропилен или 1-этилпропилен.
В качестве гетарильных остатков следует привести простые или конденсированные ароматические кольцевые системы с одним или несколькими гетероароматическими 3- до 7-членными кольцами, которые могут содержать один или несколько гетероатомов, таких как N, О или S, и необязательно могут быть замещены одним или несколькими остатками, такими как галоген, такой как фтор, амино, гидрокси, тио, алкил, алкилокси или другие ароматические или другие насыщенные или ненасыщенные неароматические кольца или кольцевые системы.
R2 означает в соединениях формул I, III, IV, VI, VII и IX замещенный или незамещенный, разветвленный или неразветвленный С1-С10алкил-, С2-С10алкенил-, С2-С10алкинил-, арилалкил-, арил-, гетарилалкил- или гетарил-. Предпочтительными остатками для R1 являются замещенный или незамещенный, разветвленный или неразветвленный С1-С10алкил- или арилалкил-.
В качестве алкильных остатков следует привести замещенные или незамещенные, разветвленные или неразветвленные С1-С10-алкильные цепи, как например метил, этил, п-пропил, 1-метилэтил, н-бутил, 1-метил-пропил-, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метил-пропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил. Предпочтительными остатками являются метил, этил или пропил.
В качестве алкенильных остаков следует привести разветвленные или неразветвленные С3-С10-алкенильные цепи, как например, 2-пропенил, 2-бутенил, 3-бутенил, 2-метилпропенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-2-пропенил, 1-этил-2-пропенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-2-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-2-пропенил, 2-гептенил, 3-гептенил, 4-гептенил, 5-гептенил, 6-гептенил, 2-октенил, 3-октенил, 4-октенил, 5-октенил, 6-октенил, 7-октенил, ноненил или декенил. Предпочтительными остатками являются 2-пропенил или 2-бутенил.
В качестве алкинильных остатков следует назвать разветвленные или неразветвленные С3-С10-алкинильные цепи, как например, проп-2-ин-1-ил, н-бут-1-ин-3-ил, п-бут-1-ин-4-ил, н-пент-1-ин-3-ил, н-пент-1-ин-4-ил, н-пент-1-ин-5-ил, н-пент-2-ин-1-ил, н-пент-2-ин-4-ил, н-пент-2-ин-5-ил, 3-метил-бут-1-ин-3-ил, 3-метил-бут-1-ин-4-ил, н-гекс-1-ин-3-ил, н-гекс-1-ин-4-ил, н-гекс-1-ин-5-ил, н-гекс-1-ин-6-ил, н-гекс-2-ин-1-ил, н-гекс-2-ин-4-ил, н-гекс-2-ин-5-ил, н-гекс-2-ин-6-ил, н-гекс-3-ин-1-ил, н-гекс-3-ин-2-ил, 3-метил-пент-1-ин-3-ил, 3-метил-пент-1-ин-4-ил, 3-метил-пент-1-ин-5-ил, 4-метил-пент-2-ин-4-ил или 4-метил-пент-2-ин-5-ил. Предпочтительным остатком является проп-2-ин-1-ил.
В качестве заместителей вышеприведенных остатков для R2 принципиально пригодны все возможные заместители, например, один или несколько таких заместителей, как галоген, например, фтор, амино, гидрокси, алкил, циклоалкил, арил, алкилокси, бензилокси, фенил или бензил.
В качестве арилалкильных остатков пригодны фенил-(С1-С5алкил)- или нафтил-(С1-С5алкил)-остатки с разветвленными или неразветвленными цепями, например фенилметил, фенилэтил, фенилпропил, фенил-1-метилэтил, фенилбутил, фенил-1-метилпропил, фенил-2-метилпропил, фенил-1,1-диметилэтил, фенилпентил, фенил-1-метилбутил, фенил-2-метилбутил, фенил-3-метилбутил, фенил-2,2-диметилпропил, фенил-1-этилпропил, нафтилметил, нафтилэтил, нафтилпропил, нафтил-1-метилэтил, нафтилбутил, нафтил-1-метилпропил, нафтил-2-метил-пропил, нафтил-1,1-диметилэтил, нафтилпентил, нафтил-1-метилбутил, нафтил-2-метилбутил, нафтил-3-метилбутил, нафтил-2,2-диметил-пропил, или нафтил-1-этилпропил, а также их изомерные или стереоизомерные формы. Предпочтительными остатками являются фенилметил-, фенилэтил- или нафтилметил.
В качестве арильных остатков следует назвать, например, фенил, метоксифенил или нафтил, или ароматические кольца, или кольцевые системы, имеющие от 6 до 18 атомов углерода в кольцевой системе, а также до 24 других атомов углерода, которые могут образовывать другие неароматические кольца или кольцевые системы, имеющие от 3 до 8 С-атомов в кольце, которые необязательно могут быть замещены одним или несколькими остатками, такими как галоген, например фтор, амино, гидрокси, алкил, алкилокси или другие остатки. Предпочтительны при этом необязательно замещенные фенил, метоксифенил или нафтил.
В качестве гетарил(алкил)-остатков пригодны, например, гетарилалкильные остатки, которые содержат один или несколько атомов азота, серы и/или кислорода в кольце или в кольцевой системе и связаны с одной или несколькими разветвленными или нераэветвленными С1-С5-алкиленовыми цепями, например, такими как метилен, этилен, н-пропилен, 1-метил-этилен, н-бутилен, 1-метилпропилен, 2-метилпропилен, 1,1-диметил-этилен, н-пентилен, 1-метилбутилен, 2-метилбутилен, 3-метилбутилен, 2,2-диметилпропилен или 1-этилпропилен.
В качестве гетарильных остатков следует привести простые или конденсированные ароматические кольцевые системы с одним или несколькими гетероароматическими от 3- до 7-членными кольцами, которые могут содержать один или несколько гетероатомов, таких как N, О или S, и которые необязательно могут быть замещены одним или несколькими остатками, такими как галоген, например фтор, амино, гидрокси, тио, алкил, алкилокси или другими ароматическими или другими насыщенными или ненасыщенными неароматическими кольцами или кольцевыми системами.
R3 означает в соединениях формул I, V, VI, VII и IX водород, гидрокси-, замещенный или незамещенный, разветвленный ли неразветвленный С1-С10алкил-, С3-С10-алкенил- или С3-С10-алкинил-. Предпочтительными остатками являются водород или гидроксил.
В качестве алкильных остатков следует привести замещенные или незамещенные, разветвленные или неразветвленные С1-С10-алкильные цепи, например метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил. Предпочтительными остатками являются метил, этил или пропил.
В качестве алкенильных остатков следует привести разветвленные или неразветвленные С3-С10-алкенильные цепи, например пропенил, 2-бутенил, 3-бутенил, 2-метилпропенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-2-пропенил, 1-этил-2-пропенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-2-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-2-пропенил, 2-гептенил, 3-гептенил, 4-гептенил, 5-гептенил, 6-гептенил, 2-октенил, 3-октенил, 4-октенил, 5-октенил, 6-октенил, 7-октенил, ноненил или декенил.
В качестве алкинильных остатков пригодны разветвленные или неразветвленные С3-С10-алкинильные цепи, как например, проп-2-ин-1-ил, н-бут-1-ин-3-ил, н-бут-1-ин-4-ил, н-бут-2-ин-1-ил, н-пент-1-ин-3-ил, н-пент-1-ин-4-ил, н-пент-1-ин-5-ил, н-пент-2-ин-1-ил, н-пент-2-ин-4-ил, н-пент-2-ин-5-ил, 3-метил-бут-1-ин-3-ил, 3-метил-бут-1-ин-4-ил, н-гекс-1-ин-3-ил, н-гекс-1-ин-4-ил, н-гекс-1-ин-5-ил, н-гекс-1-ин-6-ил, н-гекс-2-ин-1-ил, н-гекс-2-ин-4-ил, н-гекс-2-ин-5-ил, н-гекс-2-ин-6-ил, н-гекс-3-ин-1-ил, н-гекс-3-ин-2-ил, 3-метил-пент-1-ин-3-ил, 3-метил-пент-1-ин-4-ил, 3-метил-пент-1-ин-5-ил, 4-метил-пент-2-ин-4-ил или 4-метил-пент-2-ин-5-ил.
В качестве заместителей вышеприведенных остатков R3 в принципе пригодны все заместители, например один или несколько таких заместителей, как галоген, например фтор, амино, гидрокси, алкил, циклоалкил, арил, алкилокси, бензилокси, фенил или бензил.
R4 означает в соединениях формул VIII замещенный или незамещенный, разветвленный или неразветвленный С1-С10алкил.
В качестве алкильных остатков следует привести замещенные или незамещенные, разветвленные или неразветвленные С1-С10-алкильные цепи, как например, метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метил-бутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил. 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил. Предпочтение отдается при этом таким остаткам, как метил, этил, 1-метилэтил, пропил, бутил или пентил.
В качестве заместителей приведенных остатков для R4 в принципе пригодны все заместители, например один или несколько таких заместителей, как галоген, например, фтор, хлор или бром, циано, нитро, амино, гидрокси, алкил, циклоалкил, арил, алкилокси, бензилокси, фенил или бензил. Предпочтительными заместителями являются при этом галоген, например хлор или бром, циано, бензилокси, С1-С4алкил- или гидрокси.
R5 означает в соединениях формул VIII и IX водород, замещенный или незамещенный, разветвленный или неразветвленный С1-С10-алкил-.
В качестве алкильных остатков следует привести замещенные или незамещенные, разветвленные или неразветвленные С1-С10-алкильные цепи, например такие, как метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метил-бутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил. Предпочтительными остатками являются водород, метил, этил или пропил.
В качестве заместителей вышеприведенных остатков для R5 пригодны в принципе все заместители, например один или несколько таких заместителей, как галоген, например фтор, хлор или бром, циано, нитро, амино, гидрокси, алкил, циклоалкил, арил, алкилокси, бензилокси, фенил или бензил.
R6 означает в соединениях формул VIII и IX водород, замещенный или незамещенный, разветвленный или неразветвленный С1-С10алкил- или замещенный или незамещенный фенил.
В качестве алкильных остатков пригодны при этом замещенные или незамещенные, разветвленные или неразветвленные С1-С10алкильные цепи, например такие, как метил, этил, н-пропил, 1-метилэтил, н-бутил, 1-метилпропил-, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, н-гептил, н-октил, н-нонил или н-децил. Предпочтительными остатками являются метил, этил или пропил.
В качестве заместителей вышеприведенных остатков для R6 пригодны в принципе все заместители, например один или несколько таких заместителей, как галоген, например фтор, хлор или бром, циано, нитро, амино, гидрокси, алкил, циклоалкил, арил, алкилокси, бензилокси, фенил или бензил.
Далее изобретение относится к способу получения соединений общей формулы VII

отличающемуся тем, что он включает следующие стадии:
а) взаимодействие соединений общей формулы II
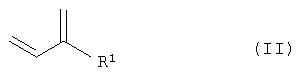
с соединениями формулы R2-XH (III) в присутствии основания с получением соединений общей формулы IV

б) взаимодействие реакционной смеси соединений формулы IV с соединением общей формулы NH2R3 (V) с получением соединений общей формулы VI

в) гидрирование соединения общей формулы VI с получением соединений общей формулы VII в присутствии катализатора гидрирования, причем заместители в формулах II, III, IV, V, VI и VII имеют приведенные в п.1 формулы изобретения значения.
Схема I показывает способ по изобретению для лучшей обзорности как пример осуществления. Стадии (а) до (г) соответствуют способу получения функционализированных оптически активных аминов, например, оптически активных аминоспиртов или оптически активных диаминов. Стадии способа (а) до (в) соответствуют способу получения функционализированных, рацемических аминов, которые после этого могут подвергаться реакции расщепления рацематов. На схеме I это расщепление рацематов показано на примере ферментативного расщепления рацематов. Оно может осуществляться также и другими способами расщепления рацематов, как например классическим расщеплением рацематов диастереомерными солями или хроматографическими способами. Показанные на схеме I заместители имеют вышеприведенное значение. Схема показывает, кроме того, оптимальную возможность нейтрализации полученного на стадии (а) реакционного раствора перед взаимодействием с соединениями общей формулы NH2R3 (V). Если соединения общей формулы R2-XH (III) применяют с большим избытком в пересчете на реагент (II), то нейтрализация реакционного раствора требуется перед следующей реакцией взаимодействия, так как иначе при объединении избыточного соединения R2-XH может возникать нежелательное обратное расщепление продукта реакции. Это приводит к потерям выхода целевого продукта и требует очистки продукта. При применении предпочтительных для изобретения количеств соединения (III) от 0,5 до 2,5 эквивалентов, предпочтительно от 0,5 до 2,0; особенно предпочтительно от 0,7 до 1,5; и в частности от 0,9 до 1,1 эквивалентов в пересчете на реагент (II) не требуется объединения и нейтрализации реакционного раствора перед стадией (б). Она, однако, может предпочтительно осуществляться в зависимости от исходного продукта, чтобы повысить надежность способа. Для нейтрализации могут применяться все возможные минеральные кислоты, такие как HCl, Н2SO4 или H3PO4, или органические кислоты, как например низкие алифатические карбоновые кислоты, такие как муравьиная кислота. Предпочтительно применяют ортофосфорную кислоту.
В качестве основания для способа по изобретению на стадии (а) пригодны в принципе все основания, которые могут катализировать присоединение соединения (III) к системе по Мохаэлю соединения (II), такие, как NaOH, KOH, третичные амины или алкоголяты щелочных и щелочноземельных металлов. В качестве предпочтительных оснований следует привести, например, такие алкоголяты щелочных и щелочноземельных металлов, как метанолят натрия, этанолят натрия, бутанолят натрия, трет-бутанолят натрия, трет-бутанолят калия или сильные основные амины, такие как диазабициклоундецен. Основание как катализатор применяют в концентрации от 0,001 до 10 мол.%, предпочтительно от 0,01 до 5 мол. %, особенно предпочтительно от 0,3 до 0,5 мол. % в пересчете на применяемое соединение (III).
Стадия (а) способа может проводиться в присутствии инертного при условиях реакции, апротонного растворителя. Примерами такого растворителя являются углеводороды, такие, как гексан, циклогексан, бензол или толуол или простые эфиры, например метил-трет-бутиловый эфир, диэтиловый спирт, дибутиловый эфир или тетрагидрофуран. Предпочтительно реакцию проводят в отсутствии растворителя.
Реакцию [стадию (а) способа] проводят предпочтительно при температуре от -30 до +50°С, преимущественно от -5 до +10°С.
Предпочтительными соединениями общей формулы (V) являются аммиак, первичные и вторичные алифатические амины и гидроксиламин. Предпочтительно стадия (б) способа по изобретению проводится с гироксиламином, который применяется как водный раствор или как водный раствор своей соли, как например гидроксиламин гидрохлорид, гидроксиламин-сульфат. В случае необходимости, как и другие соединения формулы (V), в присутствии основания, такого как натровый щелок или ацетат натрия. Предпочтительно применяют водный раствор свободного гидроксиламина. Реакцию можно осуществлять в инертном, протонном растворителе, таком как вода или спирт, такой, как метанол, этанол, пропанол, бутанол или изо-бутанол. Предпочтительно реакцию проводят в воде.
Реакцию [стадию (б)] проводят предпочтительно при температуре от 0 до +100°С, преимущественно от 20 до 40°С.
Гидрирование при способе по изобретению [стадию (в) способа] можно проводить с обычными катализаторами гидрирования, например, на базе Ni, Со, Hg, Ft, Pd, Ru или Rh. Обычный применяемый для гомогенного катализатор представляет собой, например, катализатор Вилкинсона. Гидрирование может осуществляться в гетерогенном или гомогенном катализе. Из экономических соображений и вследствие хорошей доступности в качестве катализатора предпочитают катализатор Ренея. Гидрирование проводят предпочтительно в инертном к условиям реакции растворителе. Подобные растворители представляют собой, например, углеводороды, такие, как гексан, циклогексан, бензол или толуол, простые эфиры, например метил-трет-бутиловый эфир, диэтиловый спирт, дибутиловый эфир или тетрагидрофуран. Или же спирты, такие, как метанол, этанол, пропанол, бутанол или изо-бутанол. Предпочтительно применяют в качестве растворителя тетрагидрофуран или метанол.
Схема I: способ получения оптически активных аминоспиртов
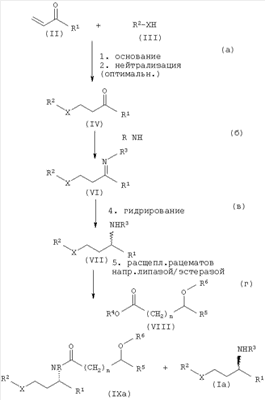
Реакцию [стадию (в) способа] проводят предпочтительно при температуре от 0 до +150°С, преимущественно от 50 до 100°С. Гидрирование обычно осуществляют при давлении в диапазоне от нормального давления до 300 бар. Предпочтительно реакцию проводят при давлении от 50 до 150 бар.
Расщепление рацематов может осуществляться как описано выше ферментативным расщеплением рацематов или классическим химическим расщеплением, также можно применять и хроматографические способы. Предпочтительным является при этом расщепление рацематов с помощью ферментов или диастереомерных солей, в частности предпочтение отдается ферментативному расщеплению рацематов.
Для отделения диастереомерными солями пригодны в принципе все оптически активные карбоновые соли. Предпочтительными оптически активными карбоновыми солями являются винная кислота, дибензоилвинная кислота, миндальная кислота, камфорная кислота, камфорсульфоновая кислота, п-гидроксиминдальная кислота, п-Cl-миндальная кислота, феноксипропионовая кислота, п-гидроксифеноксипропионовая кислота или молочная кислота. Предпочтительной для расщепления рацематов является миндальная кислота. Образование соли может осуществляться в инертном растворителе, таком, как например, углеводород, такой, как гексан, циклогексан, бензол или толуол; или в простом эфире, таком, как метил-трет-бутиловый эфир, диэтиловый спирт, дибутиловый эфир или тетрагидрофуран, или в спирте, например таком, как метанол, этанол, пропанол, изо-пропанол, бутанол или изо-бутанол. Для перекристаллизации используют целесообразным образом спирт, например метанол, этанол, пропанол, изо-пропанол, бутанол или изо-бутанол. Предпочтительно применяют изо-пропанол. Для улучшения кристаллизации раствор может охлаждаться. В том случае, если образовавшаяся соль выпадает, нагреванием она возвращается в раствор и медленно при охлаждении снова выкристаллизовывается. В том случае, если требуется, кристаллизацию можно проводить несколько раз.
Расщепление рацематов функционализированных аминов может проводиться с помощью ферментов, таких, как эстераза или липаза.
В качестве липазы и эстеразы для способа по изобретению пригодны в принципе все получаемые из растений, животных или микроорганизмов эстеразы и липазы. Преимущество дает применение микробиологических липаз, которые можно выделять, например, из эукариотических организмов, таких, как грибы или дрожжи или прокариотических организмов, таких, как бактерии. Особенно хорошо пригодны бактериальные липазы из Bacillus или Pseudomonas, например Amano P или липаза из Pseudomonas spec. DSM 8246 или липазы из грибов, таких, как Aspergillus или из дрожжей, таких, как Candida или Yerrowia. Другими пригодными липазами являются поставляемые фирмой Novo Nordisk ферменты, в частности липазы SP 523, SP 524, SP 525, SP 526 и Novozym® 435, получаемые из дрожжей, например из Candida antarctica. Другими примерами могут быть поставляемые фирмой Roche Mollecullar Biochemicalls (Roche Diagnostic GmbH, Penzberg) липазы Chirazyme L1, L2, L3, L4, L5, L6, L7 и L8.
Липазы могут применяться в нативной или иммобилизированной форме. Иммобилизированные липазы могут быть микрокапсулированы, эмульгированы предполимеризатами и полимеризированы, сшиты бифункциональными веществами (олигомерами, альдегидами и т.п.) или связаны с органическими или неорганическими несущими материалами, например, такими, как целит, леватит, цеолит, полисахариды, полиамиды или полистирольные смолы. Особенно предпочтительны липазы Novozym*435 и Chirazyme L2.
Реакция с эстеразами или липазами проводится в общем при атмосферном давлении. В случае необходимости, под инертным газом, например, азотом или аргоном. Она может осуществляться также и при повышенном давлении.
Температура при взаимодействии рацемических аминов формулы VII с пригодными для расщепления рацематов сложными эфирами, которые в  -положении к карбонилуглероду имеют атом кислорода, специально со сложными эфирами общей формулы VIII -положении к карбонилуглероду имеют атом кислорода, специально со сложными эфирами общей формулы VIII

обычно составляет от 0 до 90°С, предпочтительно от 10 до 60°С, особенно предпочтительно от 20 до 50°С. Заместители предпочтительных сложных эфиров формулы VIII имеют вышеприведенное значение.
Взаимодействие сложного эфира с рацемическим, функционализированным амином, то есть с соответствующим аминоспиртом или диамином при ферментативном катализе проводят обычно при комнатной температуре. Время реакции составляет в зависимости от исходного вещества от 1 до 48 часов. Вторичные аминоспирты, соответственно диамины, как правило, требуют более продолжительного времени реакции, чем первичные амины и диамины. Меньшая реакционная способность вторичных аминов может компенсироваться более высоким количеством катализатора по сравнению с первичными аминами.
На моль рацемического амина применяют предпочтительно от 0,5 до 2,0 моль, предпочтительно от 0,5 до 1 моля сложного эфира. Требуемое количество фермента зависит от активности препаративной формы фермента и от реакционной способности амина и может легко определяться посредством предварительных опытов. Как правило, применяют от 0,1 до 10 мас.%. предпочтительно от 1 до 5 мас.% иммобилизированной препаративной формы фермента (в пересчете на рацемический амин). Novozym® 435 имеет активность прибл. 7000 PL U/г – 10000 PL U/г (PL U=пропиллауратных единиц, единицы в пересчете на пропиллаурат как субстрат).
Подаваемое количество фермента зависит от вида фермента и от активности препаративной формы фермента. Оптимальное для реакции количество фермента может легко определяться простыми предварительными опытами.
Ход реакции можно легко прослеживать обычными методами, например газохроматографией или жидкостной хроматографией высокого давления. Если желаемый выход, как правило 50%, достигнут, реакцию заканчивают предпочтительно удалением катализатора, например отфильтровкой фермента. Реакцию можно останавливать также и посредством добавки разрушающих фермент веществ, таких, как кислоты или щелочи или посредством нагрева. При непрерывном режиме реакцию взаимодействия можно регулировать через нагрузку фермента, т.е. количества амина, которое в единицу времени прокачивают через реактор фермента. Способ может проводиться предпочтительно непрерывно, однако он может проводиться периодически или полунепрерывно.
Расщепление рацематов, катализированное ферментом, может осуществляться как в протонном или апротонном растворителе, так и без растворителя. Подходящими растворителями могут быть, например, углеводороды, такие, как гексан, циклогексан или толуол, простой эфир, например диэтиловый спирт, диоксан, метил-трет-бутиловый эфир, трет-амилметиловый эфир или тетрагидрофуран, нитрилы, такие, как ацетонитрил, бутиронитрил, спирты, такие, трет-бутанол, 3-метил-3-пентанол, и галогенированные углеводороды, например метиленхлорид.
Реакция проходит особенно хорошо тогда, когда растворитель и исходные вещества являются по возможности безводными. Преимуществом для расщепления рацематов является то, что растворители и исходные вещества амин и сложный эфир осушены. Это может осуществляться известным специалисту в данной области методом, например азеотропной сушкой или сушкой такими осушающими средствами, как сульфат натрия, сульфат магния, гидроокись калия, фосфорпентоксид, молекулярное сито, силикагель или окись алюминия.
В конце катализированного ферментом расщепления рацематов имеется смесь из ацилированного энантиомера амина общей формулы IX
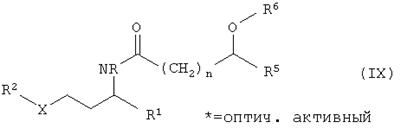
непревращенного энантиомера амина, высвободившегося при ацилировании из сложного эфира спирта, и возможно, примененного в избытке сложного эфира. Для разделения этой смеси пригодны в особенности дистиллятивные и экстрактивные способы. Так, например, низкокипящие амины могут непосредственно отгоняться из реакционной смеси. Амид может быть затем отделен от спирта и, в случае необходимости, от сложного эфира отгонкой или экстракцией и потом может гидрализироваться обычным образом, например кипячением с натровым и калиевым щелоком с рацемизированием или же без рацемизирования (см. патент US 5905167). Патент US 5905167 описывает в столбцах 2 до 5 и в примере 2 способ расщепления амидов с получением стереоцентров. Образовавшийся при гидролизе второй энантиомер амина может отделяться от имеющейся в форме соли карбоновой кислоты дистилляцией или экстракцией. Это происходит предпочтительно экстракцией, причем в качестве агента экстракции применяется простой эфир, например диэтиловый спирт, метил-трет-бутиловый эфир и дибутиловый эфир, галогенированные углеводороды, например дихлорметан или трихлорэтилен или углеводороды, например пентан, гексан, циклогексан, бензол, толуол и ксилол. Предпочтительной формой проведения выделения амина является перегонка с водяным паром. Особенно пригодная форма выполнения изобретения состоит в том, что расщепление проводят при такой высокой температуре, что полученный продукт реакции (амин) перегоняется с водяным паром и сразу удаляется из реакционной смеси, в то время как кислота, которая при щелочных условиях диссоциирована, остается в реакционной смеси. Таким образом могут перерабатываться амины в способах по изобретению.
Полученный свободный амин может применяться в качестве ценного продукта для дальнейшего синтеза или же после рацемизирования может возвращаться в процесс на стадию (г). Также и непосредственно расщепленный при рацемизировании амид может возвращаться на эту стадию процесса. Таким образом, теоретически весь рацемат может переводиться в желаемый энантиомер. Такое рацемизирование может осуществляться под такими же условиями, при которых получают амины или кетоны. (“восстановительное аминирование”). Образованная при гидролизе кислота может регенерироваться после подкисления раствора гидролиза предпочтительно экстракцией и согласно обычным способам этерифицикации и рекуперации.
Предпочтительно способы по изобретению пригодны для получения рацемических аминоспиртов общей формулы Ic, а также к их расщеплению рацематов посредством энантиоселективного ацилирования.
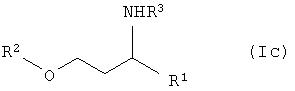
причем заместители имеют вышеприведенное значение.
Далее изобретение относится к соединениям формул I, VII и IX:
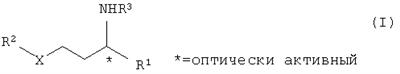
 
в которых заместители имеют приведенные выше значения. Предпочтительные соединения формул I, VII и IX представляют собой следующие соединения:
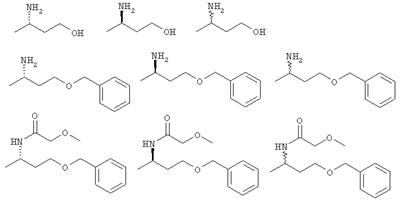
Способы по изобретению не только пригодны в качестве способов получения оптически активных первичных и вторичных функционализированных аминов, таких, как аминоспирты или диамины, но и могут быть компонентами сложного химического многостадийного синтеза, например, при получении лекарственных действующих веществ или средств защиты растений.
Следующие примеры служат для пояснения изобретения.
Примеры
Схема II: Способ получения R- и S-1-бензилокси-3-аминобутана (или рац. ВОВА)
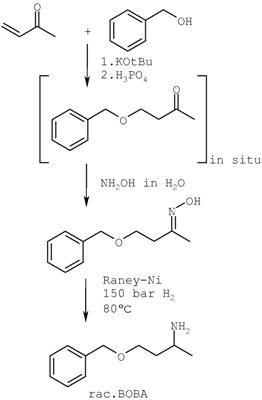
Пример 1: Стадии способа (а) и (б):
Синтез 1-бензилокси-3-бутаноноксима (схема III)
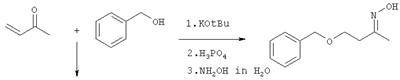
648 г (6.0 моль) бензилового спирта смешивают при 0°С с 2,6 г (24 ммоль) трет-бутанолята калия и перемешивают в течение 30 минут. В течение 30 минут прикапывают 441 г (6.3 моль) свежедистиллированного метилвинилкетона. Охлаждением температуру удерживают при 0-10°С. После окончания подачи реакционную смесь перемешивают еще в течение одного часа при 10°С. После этого прикапывают 2,8 г (24 ммоль) ортофосфорной кислоты (в качестве 85%-го водного раствора). Смесь нагревают до комнатной температуры (=23°С). По данным спектроскопии 1Н-ЯМР при реакции получают 1-бензилокси-3-бутанон (1Н-ЯМР: 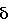 =2.05 (s; 3Н), 2.60 (t, J=7.0 Hz; 2H), 3.65 (t, J=7.0 Hz; 2H). 4.45 (s. 2H). 7.25 (m. 5H). =2.05 (s; 3Н), 2.60 (t, J=7.0 Hz; 2H), 3.65 (t, J=7.0 Hz; 2H). 4.45 (s. 2H). 7.25 (m. 5H).
К сырому 1-бензилокси-3-бутанону прикапывают при сильном перемешивании 471 г 51.7%-го водного раствора (7.37 моль) гидроксиламина таким образом, что температура реакции остается прибл. при 35°С. После этого реакционную смесь перемешивают еще 15 часов. На другой день отделяют верхнюю водную фазу, нижнюю органическую фазу загружают в 500 мл толуола и нагревают в водоотделителе до тех пор, пока больше не образуется воды. Растворитель и летучие компоненты отгоняют при 0.5 мм (температуры ванны: 100°C), в качестве остатка остается 1100 г (95%) 1-бензилокси-3-бутаноноксима в качестве E/Z-смеси.
Главный изомер (прибл. 65%):
1Н-ЯМР: 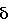 (=1.90 (s; 3Н), 2.50 (t. J=7.0 Hz; 2H), 3.65 (t. J=7.0 Hz; 2H), 4.50 (s, 2H), 7.30 (m. 5H), 9.30 (s, шир., 1Н). (=1.90 (s; 3Н), 2.50 (t. J=7.0 Hz; 2H), 3.65 (t. J=7.0 Hz; 2H), 4.50 (s, 2H), 7.30 (m. 5H), 9.30 (s, шир., 1Н).
Изомер малого количества (са. 35%):
1Н-ЯМР 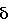 =1.95 (s; 3Н), 2.75 (t, J=7.0 Hz; 2H), 3.65 (t, J=7.0 Hz; 2H), 4.50 (s, 2H), 7.30 (m. 5H), 9.30 (s, шир., 1Н). =1.95 (s; 3Н), 2.75 (t, J=7.0 Hz; 2H), 3.65 (t, J=7.0 Hz; 2H), 4.50 (s, 2H), 7.30 (m. 5H), 9.30 (s, шир., 1Н).
Пример 2: Гидрирование с получением 1-бензилокси-3-аминобутана (рацемического ВОВА) [стадия способа (в), схема IV]

В автоклав подают 100 г никеля Ренея в 300 мл тетрагидрофурана и смешивают с раствором 850 г (4.4 моль) 1-бензилокси-3-бутаноноксима в 2.5 л тетрагидрофурана. В автоклаве устанавливают давление водорода в 100 бар и при перемешивании нагревают до 80°С. При этом начинается экзотермическая реакция, посредством последующей дозировки водородного газа давление удерживают постоянным. После окончания поглощения водорода давление повышают до 150 бар и перемешивают еще в течение 4 часов. После этого реакционную смесь охлаждают, мешалку выключают и декантируют катализатор. Слегка мутный реакционный раствор фильтруют над силикагелем и прозрачный фильтрат освобождают от растворителя в ротационном испарителе. Тяжелолетучий остаток фракционируют в вакууме масляного насоса и дистиллируют. При 1.3 мм/ 85-87°С продукт переходит в рацемический R- и S-1-бензилокси-3-аминобутан (ВОВА) в виде прозрачной жидкости.
Выход составляет 646 г (83%)
1Н-ЯМР: 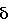 =1.05 (d. J=7 Hz; 3H). 1.35 (s, breit; 2H), 1.65 (mc; 2H), 3.10 (mc; 1H). 3.55 (mc; 2H), 4.50 (s. 2H), 7.30 (m. 5H), =1.05 (d. J=7 Hz; 3H). 1.35 (s, breit; 2H), 1.65 (mc; 2H), 3.10 (mc; 1H). 3.55 (mc; 2H), 4.50 (s. 2H), 7.30 (m. 5H),
Пример 3: Расщепление рацематов [стадия способа (г)]
А. Энантиомерная аналитика R- и S-1-бензилокси-3-аминобутана (ВОВА):
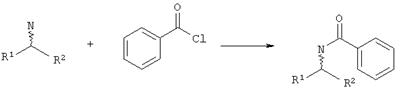
Дериватизация (схема V):
0.5 г амина растворяют в 25 мл диэтилового спирта. Раствор охлаждают до 0°С и за один раз добавляют 0.2 мл бензоилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и потом смешивают с 10 мл воды. Водную фазу отделяют и верхнюю органическую фазу промывают последовательно каждый раз посредством 10 мл 10%-ой соляной кислоты, водой и насыщенным раствором гидрокарбоната натрия. Реакционную смесь сушат над сульфатом натрия. Потом берут 1 мл раствора, разбавляют с помощью 5 мл н-гексана и анализируют жидкостной хроматографией высокого давления.
Схема V: Дериватизация
Колонна: Chiralcel OD
Daicel Chemical Industries, Ltd.
Температура: комнатная
Детектор: абсорбция при 214 нм
Впрыскиваемое количество: 20 мкл
Растворитель: н-гексан / изопропанол/этанол (300:50:0.8 об./об./об.)
Текучесть: 1.3 мл / мин (при прибл. 40 кг/см2)
Время удержания:
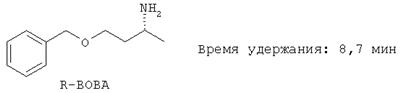
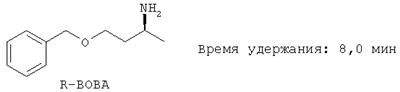
Пример 4: Расщепление рацематов посредством кристаллизации
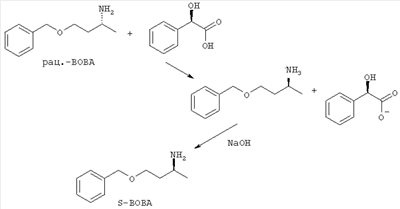
К раствору из 12.8 г (71.5 моль) рацемического R- и S-1-бензилокси-3-ами-нобутана(ВОВА) в 70 мл изопропанола прикапывают раствор из 2.15 г (35.6 ммоль) уксусной кислоты и 5.4 г (35.6 ммоль) D-миндальной кислоты в 50 мл изопропанола. Выпавший осадок нагревом снова возвращают в раствор и потом оставляют на выкристаллизацию.
Из пробы отсосанной соли высвобождают связанный амин посредством обработки натровым щелоком.
Согласно анализу ЖХВД S-1-бензилокси-3-аминобутан (S-BOBA) имел значение изомеров в 50.5%. После этого выпавшую соль еще раз перекристаллизовывают из 100 мл изопропанола. В заключение амин высвобождают из образовавшейся соли посредством обработки с помощью 10 мл 50%-ого натрового щелока, экстрагируют с помощью 50 мл простого эфира и экстракт концентрируют. Получают 2.2 г (34%) S-1-бензилокси-3-аминобутана (S-ВОВА).
Согласно анализу ЖХВД чистота энантиомеров составляет 90% изом.
Пример 5: Расщепление рацематов посредством катализированого ферментом расщепления рацематов
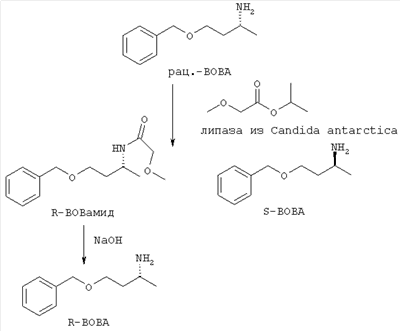
1500 г (8.43 моль) рацемического R- и S-1-бензилокси-3-аминобутана (рац. ВОВА) охлаждают до 0°С и смешивают с 523 г (3.96 моль) сложного изопропилового эфира метоксиуксусной кислоты. К реакционной смеси добавляют 75 г Novozym 435 и при перемешивании при комнатной температуре (ок. 23°С) нагревают. Через 15 часов отфильтровывают катализатор и промывают с помощью 1 л толуола. Фильтрат освобождают в вакууме от летучих компонентов и после этого реакционную смесь дистиллируют в тонкослойном испарителе (1.0 мбар, 180°С). В качестве дистиллята в голове колонны имеется S-1-бензилокси-3-аминобутан при (95-98°С), в качестве тяжелокипящего продукта имеется R-1-бензилокси-3-аминобутанамид в низе колонны.
Получают 802.5 г (53%) S-1-бензилокси-3-аминобутана (S-BOBA), который согласно анализу ЖХВД имеет оптическую чистоту в 90% изом.
В низе колонны имеется 964 г (45.5%) R-1-бензилокси-3-аминобутанамид (R-ВОВамида) (оптическая чистота 98% изом.).
R-ВОВамид, 1Н-ЯМР: 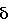 =1.20 (d, J=7 Hz; 3Н), 1.65 – 1.95 (mc; 2H), 3.15 (s; 3Н), 3.50-3.70 (mc; 2H), 3.75 и 3.85 (АВ-система. JAB=10.5 Hz; 2H), 4.20 (mc; 1H). 4.50 (s, 2H), 6.90 (s, шир.; 1H). 7.10-7.40 (m. 5H). =1.20 (d, J=7 Hz; 3Н), 1.65 – 1.95 (mc; 2H), 3.15 (s; 3Н), 3.50-3.70 (mc; 2H), 3.75 и 3.85 (АВ-система. JAB=10.5 Hz; 2H), 4.20 (mc; 1H). 4.50 (s, 2H), 6.90 (s, шир.; 1H). 7.10-7.40 (m. 5H).
Пример 6: Расщепление R-BOB-амида
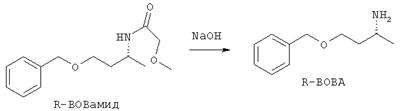
Смесь из 918 г (3.66 моль) R-ВОВамида и 900 г триэтаноламина смешивают при 120°С с 800 г (10 моль) 50%-ого натрового щелока и перемешивают в течение 3 часов при этой температуре. После охлаждения реакционную смесь разбавляют с помощью 1.5 л воды и три раза экстрагируют каждый раз посредством 1 л диэтилового спирта. Собранные экстракты промывают последовательно 1 л воды и 100 мл насыщенного раствора хлористого натрия, сушат над сульфатом натрия и потом концентрируют. В качестве остатка остается 625 г (95%) R-BOBA в виде слегка желтого масла.
Оптическая чистота согласно ЖХВД составляет 97% изом.
Формула изобретения
1. Способ получения соединений общей формулы I

где R1 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил,
R2 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил,
R3 – водород, гидроксил, замещенный или незамещенный,
разветвленный или неразветвленный (С1-С10)-алкил,
Х – кислород или NH,
отличающийся тем, что он включает следующие стадии:
а) взаимодействие соединений общей формулы II
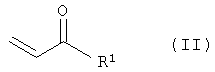
где R1 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил, с соединениями формулы
R2 – XH (III),
где R2 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил,
в присутствии основания с получением соединений общей формулы IV
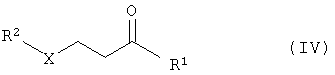
где R1 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил,
R2 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)- алкил, арилалкил, арил, гетарилалкил или гетарил, Х – кислород или NH,
б) взаимодействие реакционного раствора соединений общей формулы IV с соединениями общей формулы
NH2R3 (V),
где R3 – водород, гидроксил, замещенный или незамещенный, разветвленный или неразветвленный (С1-С10)-алкил, с получением соединений общей формулы VI
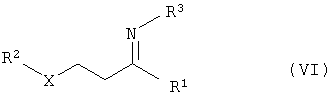
где R1 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-
алкил, арилалкил, арил, гетарилалкил или гетарил,
R2 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил,
R3 – водород, гидроксил, замещенный или незамещенный,
разветвленный или неразветвленный (С1-С10)-алкил,
Х – кислород или NH,
в) гидрирование соединений общей формулы VI с получением соединений общей формулы VII
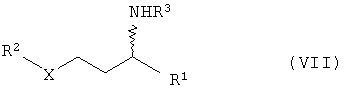
где R1 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил, R2 – замещенный или незамещенный, разветвленный или неразветвленный (C1-С10)-алкил, арилалкил, арил, гетарилалкил или гетарил, R3 – водород, гидроксил, замещенный или незамещенный, разветвленный или неразветвленный (С1-С10)-алкил, Х – кислород или NH,
в присутствии катализатора гидрирования,
г) расщепление рацематов соединений общей формулы VII с получением соединений общей формулы I оптически активной карбоновой кислотой или сложными эфирами общей формулы VIII
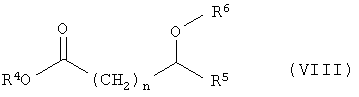
где R4 – замещенный или незамещенный, разветвленный или неразветвленный (С1-С10)-алкил,
R5 – водород, замещенный или незамещенный, разветвленный или неразветвленный (С1-С10)-алкил,
R6 – водород, замещенный или незамещенный, разветвленный или неразветвленный (С1-С10)-алкил или замещенный или незамещенный фенил,
n – 0 или 1,
в присутствии липазы или эстеразы.
2. Способ получения соединений общей формулы VII
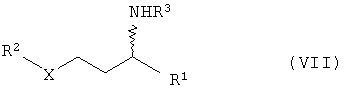
отличающийся тем, что он включает следующие стадии:
а) взаимодействие соединений общей формулы II
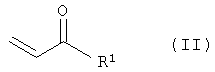
с соединениями формулы R2-XH (III) в присутствии основания, с получением соединений общей формулы IV

б) взаимодействие реакционного раствора соединений общей формулы IV с соединением общей формулы NH2R3 (V) с получением соединений общей формулы VI

в) гидрирование соединения общей формулы VI с получением соединений общей формулы VII в присутствии катализатора гидрирования, причем заместители в формулах II, III, IV, V, VI и VII имеют приведенные в п.1 значения.
3. Способ по п.1, отличающийся тем, что для расщепления рацематов в качестве оптически активной карбоновой кислоты применяют карбоновую кислоту, выбранную из группы, включающей винную кислоту, дибензоилвинную кислоту, миндальную кислоту, камфорную кислоту, камфорсульфоновую кислоту, п-гидроксиминдальную кислоту, п-Cl-миндальную кислоту, феноксипропионовую кислоту, п-гидроксифеноксипропионовую кислоту или молочную кислоту.
4. Способ по п.1, отличающийся тем, что при ферментативно катализированном расщеплении рацематов посредством сложного эфира на стадии 1 (г) получают смесь из оптически активного амина общей формулы I по п.1, где радикалы X, R1, R2 и R3 имеют указанные ниже значения, и оптически активного амида общей формулы IX
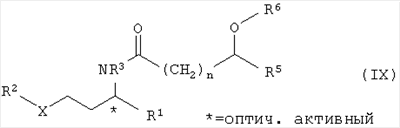
где заместители имеют следующие значения:
R1 – (С1-С6)-алкил,
R2 – фенил-(С1-С6)-алкил,
R3 – водород,
R5 – водород,
R6 – (С1-С6)-алкил,
Х – кислород или NH,
n=0,
которую отделяют и разделяют.
5. Способ по п.4, отличающийся тем, что амид расщепляют и получают образовавшийся при расщеплении свободный амин.
6. Способ по п.4, отличающийся тем, что полученный амид рацемизируют при условиях расщепления и возвращают на стадию (г) способа по п.1.
7. Способ по п.5, отличающийся тем, что полученный амин рацемизируют и возвращают на стадию (г) способа по п.1.
8. Способ по п.1 или 2, отличающийся тем, что стадию (а) ведут в присутствии инертного при условиях реакции апротонного растворителя.
9. Способ по п.1 или 2, отличающийся тем, что основание на стадии (а) применяют в диапазоне 0,001-10 мол.% в пересчете на применяемое количество соединения формулы III.
10. Способ по п.9, отличающийся тем, что на стадии (а) в качестве основания применяют алкоголяты щелочного или щелочноземельного металла или сильные основные амины.
11. Способ по п.1 или 2, отличающийся тем, что полученный на стадии (а) реакционный раствор нейтрализуют перед взаимодействием с соединением общей формулы (V).
12. Способ по п.1 или 2, отличающийся тем, что соединения формул IV, VI или VII после стадий (а) до (в) выделяют перед началом следующей стадии.
13. Способ по п.1 или 2, отличающийся тем, что в качестве соединения общей формулы NH2R3 применяют гидроксиламин.
14. Способ по п.12, отличающийся тем, что стадию (б) проводят в присутствии инертного при условиях реакции протонного растворителя.
15. Способ по п.1 или 2, отличающийся тем, что на стадии (в) применяют катализаторы гидрирования на основе Ni, Co, Pt, Pd, Ru или Rh.
16. Способ по п.14, отличающийся тем, что в качестве катализатора гидрирования применяют никель Ренея.
17. Способ по п.13 или 14, отличающийся тем, что гидрирование проводят в растворителе.
18. Способ по пп.14-16, отличающийся тем, что гидрирование проводят при давлении от нормального до 300 бар.
19. Соединения формулы IX

где заместители имеют следующие значения:
R1 – (С1-С6)-алкил,
R2 – фенил-(С1-С6)-алкил,
R3 – водород,
R5 – водород,
R6 – (С1-С6)-алкил,
Х – кислород или NH,
n=0.
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция в тексте описания и формулы изобретения
Извещение опубликовано: 27.06.2008 БИ: 18/2008
|
|