Патент на изобретение №2293334
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ ПЕРОКСИДОВ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ
(57) Реферат:
Изобретение относится к области медицины, к биохимическим исследованиям. Изобретение касается способа определения содержания пероксидных группировок в липидах, содержащихся в биологических жидкостях, включающего забор пробы анализируемой жидкости, экстрагирование органических составляющих биологических жидкостей ведут путем обработки их 3-х-кратным количеством хлороформа в качестве растворителя. После экстрагирования осуществляют испарение растворителя в токе инертного газа, затем гравиметрически определяют общее количество липидов, после чего проводят обработку ледяной уксусной кислотой до полного осаждения белка в виде хлопьев, затем в анализируемую смесь вводят смесь реагентов, состоящую из KJ+СН3СООН, реагенты которой берут из расчета на каждые 100 г KJ – 1,0-1,5 л СН3СООН для проведения окислительно-восстановительного взаимодействия с молекулами глобулированного белка до полного восстановления йода. Пробу помещают на 1,5-2 часа в темноту, затем титрометрическим методом определяют количество выделившегося йода, по которому определяют содержание пероксидных группировок в липидах. Заявленный существенно упрощает процедуру определения пероксидных группировок и сокращает ее длительность за счет исключения из процесса трудоемких операций и ядовитых веществ. 3 табл.
Изобретение относится к области медицины, конкретно к биохимическим исследованиям, и может быть использовано для определения суммарного содержания пероксидных группировок в урине и сыворотке крови доноров в зависимости от их возраста. Кроме того, оно может быть использовано для диагностики патологий, протекающих с изменением уровня пероксидного окисления липидов. Актуальность проблемы оценки гомеостаза организма животных заключается в изучении системы перекисного окисления липидов (ПОЛ) и антиоксидантной защиты (АОЗ). При нормальных метаблических процессах система ПОЛ-АОЗ находится в состоянии динамического равновесия и в зависимости от различных видов воздействия не нарушается. Свободнорадикальное, перекисное окисление липидов (ПОЛ) играет важную роль в регуляции нормальных метаболических процессов и в механизме развития целого ряда патологических состояний. В современной клинической практике существуют разнообразные способы оценки состояния здоровья населения. Для комплексной оценки состояния организма человека общий перечень диагностических способов составляет порядка 95 наименований, которые требуют больших материальных и временных затрат. Поэтому существует необходимость в быстрой оценке состояния гомеостаза организма человека. Известен способ определения пероксидных группировок в полимерных материалах, основанный на реакции восстановления пероксидной группировки иодид-ионом в уксуснокислой среде с последующим титриметрическим определением выделившегося йода тиосульфатом итрия. При проведении анализа KJ берется в избытке для образования устойчивого иона J3 – (1) (Кирюшкин С.Г., Шляпников Ю.А. О распределении концентрации гидроперекиси в окисленном пропилене, ВМС, 1976, т.14, №5, с.350-351). К недостаткам известного способа относится невозможность его использования по отношению к биологическим жидкостям, в состав которых входит как органическая, так и неорганическая составляющая. Кроме того, существует возможность присоединения выделившегося иода к ненасыщенным двойным связям. В качестве наиболее близкого по технической сущности и результату к заявляемому известен способ определения пероксидных соединений липидов в крови человека, включающий забор анализируемых проб, экстрагирование растворителем органических составляющих биологических жидкостей, качественная идентификация и расчет количественного содержания пероксидов. Способ осуществляется следующим образом. Предварительно липиды экстрагируются хлороформом. Затем в центрифужной пробирке из экстракта выпаривают растворитель, прибавляют 1,5 мл ацетилсалициловой кислоты (3,75 г на 100 мл растворителя) в смеси метанол: хлороформ (1:2 по объему) и 0,1 мл раствора трихлоруксусной кислоты (1,34 г на 100 г растворителя), удаляют кислород продуванием CO2 в течение 1 мин. Затем добавляют 0,1 мл насыщенного раствора KJ, содержащего 1 каплю 4 М раствора аммиака в 1 мл, нагревают раствор 5 мин при 70°С, пропускают над поверхностью СО2. По охлаждении прибавляют 0,1 мл раствора тиофлуоресцеина в этилацетате (с оптической плотностью при 500 нм, равной 0,50) и 5 мл водного раствора, содержащего 0,33 г/л KCN и 47,3 г/л К2СО3·10Н2О, встряхивают, центрифугируют, отделяют водный слой и измеряют оптическую плотность при 500 нм (Антоновский В.П. Бузлакова Н.М. Аналитическая химия органических пероксидных соединений. – М.: Химия, 1978 г., стр.57-58). Недостатком прототипа является не только длительность и трудоемкость операций, но и использование ядовитых химических веществ, таких, как цианистый калий и метанол. Задачей автора является разработка и упрощение способа определения пероксидных группировок за счет сокращения числа трудоемких операций, устранения использования ядовитых химических веществ и расширение возможностей использования различных биологических сред. Новый технический результат заключается в упрощении способа определения пероксидных группировок в биологических жидкостях за счет сокращения числа трудоемких операций пробоподготовки, материальных затрат и использования неядовитых химических веществ. Указанные задачи и новый технический результат обеспечивается тем, что в известном способе определения пероксидов в биологических жидкостях, включающем забор анализируемых проб, экстрагировании растворителем органических составляющих биологических жидкостей, качественную идентификацию и расчет количественного содержания пероксидов, в соответствии с предлагаемым способом экстрагирования органических составляющих биологических жидкостей ведут путем обработки их 3-х-кратным количеством хлороформа в качестве растворителя, после экстрагирования осуществляют испарение при нормальных условиях и температуре в токе инертного газа, после чего проводят обработку уксусной кислотой до полного осаждения белка в виде хлопьев, затем в анализируемую смесь вводят смесь реагентов, состоящую из KJ+СН3СООН, реагенты которой берут из расчета на каждые 100 г KJ 1,0-1,5 л СН3СООН для проведения окислительно-восстановительного взаимодействия с молекулами глобулированного белка до полного восстановления йода, после чего идентифицируют наличие пероксидов косвенно титрометрическим методом, определяя сначала количество выделившегося йода, а затем путем пересчета по соответствующим математическим зависимостям и количество пероксидов. Предлагаемый способ поясняется следующим образом. Проводят забор свежесобранной утренней урины или сыворотки крови. В делительной воронке экстрагируют 3-х-кратным количеством хлороформа (ТУ 6-09-4263-76) органическую составляющую биологической жидкости. Экстракт испаряют при нормальных условиях и температуре в токе инертного газа. Сухой остаток обрабатывают ледяной уксусной кислотой СН3СООН ГОСТ 61-75 для свертывания белка в виде хлопьев. Готовят реакционную смесь, состоящую из KJ ГОСТ 4232-74 и СН3СООН ГОСТ 61-75 в соотношении 100 г KJ и 1,5 л СН3СООН. Для проведения окислительно-восстановительной реакции взаимодействия молекул глобулированного белка реакционную смесь приливают к раствору органической составляющей биологической жидкости. Через 1,5-2 часа после прохождения реакции выделившейся йод оттитровывают 0,01 N раствором Na2S2О3 ТУ 6-09-25-40-72 для определения количества йода с последующим пересчетом по соответствующим математическим зависимостям на количество пероксида. Сущность предлагаемого изобретения заключается в следующем. Проводят забор свежесобранной утренней урины в количестве 15 мл или 5 мл крови. Кровь центрифугируют 10 мин при 2000 об/мин для отделения сыворотки от эритроцитов. Из 6 мл свежесобранной урины или 0,5 мл сыворотки крови экстрагируют органическую составляющую 3-х кратным объемом хлороформа. Хлороформный экстракт отделяют от водной фазы. Полноту выделения органической фазы проверяют методом тонкослойной хроматографии (ТСХ) в системе гексан:диэтиловый эфир (1:1 по объему) с проявлением парами иода. После высушивания экстракта в токе инертного газа гравиметрически определяют количество общих липидов. К сухому остатку добавляют 1 мл ледяной уксусной кислоты для свертывания белка и 1 мл реакционной смеси (1 г KJ на 15 мл уксусной кислоты). Затем образцы помещают в темноту на 1,5-2 часа для прохождения окислительно-восстановительной реакции (1) По окончании реакции выделившийся йод оттитровывают 0,01 н раствором тиосульфата натрия (Na2S2O3) Содержание пероксидных группировок рассчитывается по формуле где А и В – количество 0,01 н раствора Na2S2О3, пошедших на титрование анализируемой и холостой проб соответственно, мл; 0,00008 – количество кислорода, соответствующее 1 мл 0,01 н раствора Na2S2О3, г; С – навеска липидов, г. Возможность промышленного осуществления предлагаемого способа подтверждается следующими примерами конкретного выполнения. Пример 1. Предлагаемым способом обследовано 8 здоровых подростков в возрасте от 8 до 15 лет. Забор урины в количестве 15 мл осуществлялся после ночного сна. 6 мл отобранной урины экстрагировали в делительной воронке 3-кратным объемом хлороформа. Хлороформный экстракт отделяли от водной фазы и высушивали в токе инертного газа (аргон). Количество общих липидов определяли гравиметрически. К высушенному экстракту добавляли 1 мл ледяной уксусной кислоты и 1 мл реакционной смеси (1 г KJ на 15 мл СН2ОН). Образцы помещали в темноту на 1,5-2 часа для прохождения реакции (1), а затем раствор оттитровывали 0,01 н. раствором Na2S2О3. Количество пероксидных группировок рассчитывали по формуле (1). Среднестатистическое содержание пероксидных группировок составляло 0,462±0,002 мас.%. Общее количество липидов в группе составляло 10÷15 мг. Методом ТСХ определяли наличие перекиси водорода. Для проверки правильности полученных результатов использовали метод добавок. В качестве добавки применяют пероксид бензоила с содержанием пероксидной группировки 6,72 мас.%. Результаты сравнительных определений приведены в таблице 1. Сравнительные результаты определения суммарного количества пероксидных группировок приведены в таблице 2. Пример 2. Предложенным способом обследовано 16 практически здоровых человек в возрасте от 20 до 30 лет. Пробоподготовка и проведение анализа аналогично примеру 1. Среднестатистическое содержание пероксидных группировок составляло 0,654±0,002 мас.%. Общее количество липидов в урине составляло 12÷30 мг. Методом ТСХ определено наличие пероксидов и гидропероксида линолевой кислоты. Пример 3. Предложенным способом обследовано 10 практически здоровых человек в возрасте от 30 до 40 лет. Пробоподготовка и проведение анализа аналогично примеру 1. Среднестатистическое содержание пероксидных группировок составляло 0,397±0,005 мас.%. Общее количество липидов в урине составляло 14,5÷35,0 мг. Методом ТСХ определено наличие пероксида водорода и гидропероксида линолевой кислоты. Пример 4. Предложенным способом обследовано 20 практически здоровых человек в возрасте от 40 до 50 лет. Пробоподготовка и проведение анализа аналогично примеру 1. Для определенной группы людей среднестатистическое содержание пероксидных группировок составляло 0,414±0,003 мас.%. Общее количество липидов в урине составляло 15÷40 мг. Методом ТСХ установлено наличие пероксида водорода и гидропероксида линолевой кислоты. Пример 5. Предложенным способом обследована женщина в возрасте 37 лет, онкологическая больная. Пробоподготовка и проведение анализа аналогично примеру 1. Содержание пероксидных группировок составляло от 0,068 до 0,811 мас.%. Анализы на содержание пероксидных группировок в урине проводили ежедневно в течение 1,5 мес. Общее количество липидов в урине составляло 45,0÷64,5 мг. Методом ТСХ определено наличие гидропероксидов (расшифровка не проводилась). При сопоставлении результатов содержания пероксидных группировок в урине группы практически здоровых людей от 30 до 40 лет и онкологической больной, 37 лет, видно, что заболевание приводит к разбалансировке системы перекисного окисления липидов и антиоксидатной защиты, что свидетельствует о нарушении гомеостаза организма. Кроме того, это может служить критерием оценки состояния здоровья. Пример 6. Предложенным способом обследована женщина в возрасте 39 лет, онкологическая больная. Пробоподготовка и проведение анализа аналогично примеру 1. Содержание пероксидных группировок составляло от 0,052 до 0,31 мас.%. Общее количество липидов в урине составляло 23,5÷33,4 мг. Выводы по содержанию пероксидных группировок аналогичны примеру 5. Сравнительные результаты определения суммарного содержания пероксидных группировок приведены в таблице 2. Пример 7. Предложенным способом определялось содержание пероксидных группировок в сыворотке крови белых крыс линии “Вистар” массой 160-180 г. К 0,5 мл сыворотки крови белых крыс в количестве 9 особей трижды добавляли по 1 мл хлороформа. Полученную смесь в течение 5 минут тщательно встряхивали в делительной воронке и отделяли хлороформный экстракт. Далее все операции и расчеты проводились аналогично примеру 1. Содержание пероксидных группировок в сыворотке крови крыс составляло 0,04±0,0009 мас.%. Общее содержание липидов составляло 20,0÷40,0 мг. Пример 8. Предложенным способом определялось содержание пероксидных группировок в сыворотке крови белых крыс линии “Вистар” в количестве 9 особей массой 160-180 г, подвергнутых воздействию генератора низкочастотного импульсного магнитного поля типа “Колибри” с диапазоном модуля магнитной индукции в центре установки от 1,0 до 5,2 мТл. Забор крови и приготовление сыворотки проводились через 1 час после воздействия. Далее все операции и расчеты проводились аналогично примерам 1 и 7. Среднестатистическое содержание пероксидных группировок в сыворотке крови составляло 0,05±0,008 мас.%. Общее количество липидов составило 16,3÷44,0 мг для каждой особи. Пример 9. Все операции и расчеты проводились аналогично примерам 1, 7 и 8. Забор крови и приготовление сыворотки проводились через сутки после воздействия генератора низкочастотного импульсного магнитного поля. Среднестатистическое содержание пероксидных группировок составляло 0,03±0,007 мас.%. Общее количество липидов составляло от 18,5 до 36,7 мг. Сравнительные результаты определения суммарного содержания пероксидов в сыворотке крови крыс приведены в таблице 3. Таким образом, в результате проведения экспериментальных исследований предлагаемого способа определения пероксидных группировок было установлено, что для всех возрастных групп практически здоровых людей количество пероксидных группировок в урине остается на одинаковом уровне, в то время как для больных людей он резко отличается. Для лабораторных животных (белых крыс линии «Вистар»), подвергнутых воздействию НИМП, по сравнению с интактными животными, содержание пероксидных группировок изменяется незначительно. В целом при использовании предлагаемого способа обеспечивается упрощение способа, возможность определения пероксидных группировок в биологических жидкостях за счет сокращения числа трудоемких операций пробоподготовки, материальных затрат и использования неядовитых химических веществ.
Формула изобретения
Способ определения содержания пероксидных группировок в липидах, содержащихся в биологических жидкостях, характеризующийся тем, что производят забор пробы анализируемой жидкости, экстрагирование органических составляющих биологических жидкостей ведут путем обработки их 3-кратным количеством хлороформа в качестве растворителя, после экстрагирования осуществляют испарение растворителя в токе инертного газа, затем гравиметрически определяют общее количество липидов, после чего проводят обработку ледяной уксусной кислотой до полного осаждения белка в виде хлопьев, затем в анализируемую смесь вводят смесь реагентов, состоящую из KJ+СН3СООН, реагенты которой берут из расчета на каждые 100 г KJ – 1,0-1,5 л СН3СООН для проведения окислительно-восстановительного взаимодействия с молекулами глобулированного белка до полного восстановления йода, пробу помещают на 1,5-2 ч в темноту, затем титрометрическим методом определяют количество выделившегося йода, по которому определяют содержание пероксидных группировок в липидах.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

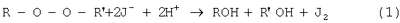
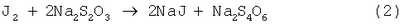
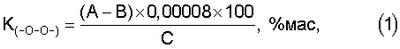
 навеска
навеска