Патент на изобретение №2293081
|
||||||||||||||||||||||||||
(54) СПОСОБЫ ПОЛУЧЕНИЯ (8
(57) Реферат:
Изобретение относится к новым способам получения (8
Область изобретения Данное изобретение относится к синтетическим димерам катехина и эпикатехина, их производным и способам их получения и применения. Предшествующий уровень техники Полифенолы представляют собой чрезвычайно разнообразную группу соединений (Ferreira, D., Steynberg, J.P., Roux, D.G. and Brandt, E.V., Tetrahedron, 48, (10), 1743-1803 (1992)), которые широко распространены среди растений, некоторые из которых являются звеньями пищевой цепи. Во многих случаях они представляют собой важный класс соединений, входящих в рацион человека. Хотя считается, что некоторые полифенолы не имеют питательной ценности, к данным соединениям возник интерес в силу их возможных положительных эффектов на здоровье. Например, в экспериментах на животных было показано, что кверцитин (флавоноид) обладает антиканцерогенной активностью (Deschner, E.E., Ruperto, J., Wong, G. and Newmark, H.L., Carcinogenesis, 7, 1193-1196 (1991) and Kato, R., Nakadate, Т., Yamamoto, S. and Sugimura, Т., Carcinogenesis, 4, 1301-1305 (1983)). Было показано, что (+)-катехин и (-)-эпикатехин (флаван-3-олы) ингибируют обратно-транскриптазную активность вируса лейкоза (Chu S.C., Hsieh, Y.S. and Lim, J.Y, J. Nat. Prod., 55, (2), 179-183 (1992)). Также было продемонстрировано, что ноботанин (олигомерный гидролизуемый таннин) обладает противоопухолевой активностью (Okuda Т., Yoshida, Т., and Hatano, Т., Molecular Structures and Pharmacological Activities of Polyphenols – Oligomeric Hydrolyzable Tannins and Others – Presented at the XVIth International Conference of Groupe Polyphenols, Lisbon, Portugal, July 13-16, 1992). Статистические исследования также показали, что смертность от злокачественных опухолей значительно ниже в районах Японии с развитым производством чая. Об эпигаллокатехингаллате сообщалось как о фармакологически активном веществе зеленого чая, которое ингибирует опухоли кожи у мышей (Okuda et al., ibid.). Также было продемонстрировано, что эллаговая кислота обладает антиканцерогенной активностью в различных животных моделях опухолей (Boukharta M., Jalbert, G. and Castonguay, A., Efficacy of Ellagitannins and Ellagic Acid as Cancer Chemopreventive Agents – Presented at the XVIth International Conference of the Groupe Polyphenols, Lisbon, Portugal, July 13-16, 1992). Kikkoman Corporation были описаны олигомеры проантоцианидина (JP 4-190774), используемые в качестве антимутагенов. Употребление фенольных соединений в пищу и модуляция ими развития опухолей в экспериментальных животных моделях недавно обсуждались в ходе 202nd National Meeting of The American Chemical Society (Phenolic Compounds in Foods and Their Effects on Health I, Analysis, Occurrence 5c Chemistry, Ho, C.T., Lee, C.Y., and Huang, M.T. editors, ACS Symposium Series 506, American Chemical Society, Washington D.C. (1992); Phenolic Compounds in Foods and Their Effects on Health П. Antioxidants & Cancer Prevention, Huang, M.T., Ho, C.T., and Lee, C.Y. editors, ACS Symposium Series 507, American Chemical Society, Washington, D.C. (1992)). Недавно было обнаружено, что процианидины и особенно олигомеры высших процианидинов обладают широким спектром биологической активности. Были разработаны методики синтеза для определения взаимосвязей структура-активность среди множества возможных регио- и стереоизомеров, содержащих данный олигомер. Данные методики фокусируются на типичных (4 Например, когда (+)-катехин, обозначенный здесь как С, связан с другим С или с (-)-эпикатехином, обозначаемым здесь как ЕС, связи преимущественно представляют собой (4 Однако среди мономеров, составляющих олигомер, возможны и другие положения связывания. Они представляют собой (8 Следовательно, существует интерес к синтезу данных олигомеров, содержащих данные связи. Сущность изобретения Данное изобретение относится к новым 8 8 8 (8 Альтернативный способ предусматривает выполнение описанных выше стадий (а)-(с) включительно с последующим проведением восстановительного связывания галогенированных соединений, например, путем использования реактива на основе никеля с нулевой валентностью в сочетании с порошкообразным соответствующим металлом с последующим снятием защиты. Если для защиты фенольных гидроксигрупп или 3-гидроксигрупп используют бензильные группы, снятие защиты осуществляют гидрогенолизом. Если для защиты 3-гидроксигрупп используют тетрагидропиранил, то сначала удаляют тетрагидропиранильные защитные группы, а затем бензильные защитные группы. Способ получения (6 (а) защита фенольных гидроксильных групп эпикатехиновых или катехиновых мономеров первой защитной группой; (b) галогенирование положений С-6 и С-8; (с) защита 3-гидроксильных групп второй защитной группой, например трет-бутилдиметилсилилом; (d) селективное удаление 8-галогеновых групп, например брома; (е) проведение окислительного или восстановительного связывания 6-галогенпроизводных; (f) снятие защиты с 3-гидроксильных групп; (д) этерификация 3-положений три-o-бензилгаллоилхлоридом; и (h) в положении С-3; и (i) снятие защиты с фенольных гидроксильных групп с получением свободного дигаллата (6 (6 Подробное описание изобретения Подходящие защитные группы для фенольных гидроксильных групп мономеров, применимые здесь, включают такие защитные группы, которые могут быть введены в мономеры и удалены без рацемизации или разрушения мономеров и которые стабильны в условиях, применяемых для проведения реакции окислительного или восстановительного связывания. Способы защиты и снятия защиты с гидроксильных групп хорошо известны специалистам в данной области и описаны в “Protective Groups in Organic Synthesis,” T.W.Greene, John Wiley & Sons. Предпочтительно защитные группы представляют собой бензильные группы, каждая из которых легко удаляется в одну стадию. Подходящие защитные группы для 3-гидроксильных групп включают бензил, тетрагидропиранил и тому подобное. Ссылки, в которых описано применение хлорида железа (FeCl3) в окислительном связывании 2 арила с арилом 2: С.A.Broka, Tetrahedron Lett. 32, 859 (1991). Ссылки, в которых описано восстановительное связывание 2 арила с арилом 2 с помощью реактивов на основе никеля с нулевой валентностью (в большинстве случаев никель с нулевой валентностью получают in situ из солей/комплексов Ni(II) и восстановителя), включают следующие: R.H.Mitchell et al., J. Am. Chem. Soc. 106, 7776 (1984); H.Matsumoto et al., J. Org. Chem. 48, 840 (1983); S. Inaba et al. Tetrahedron Lett. 23, 4215 (1982); S.Knapp et al., J. Org. Chem. 58, 997 (1993); К.Takagi et al., Bull. Chem. Soc. Jpn. 57, 1887 (1984); M.Iyoda et al., Bull. Chem. Soc. Jpn. 63, 80 (1990) (наиболее важная ссылка) К. Takagi et al., Chem. Lett., 917 (1979); M.A.Fox et al., J. Org. Chem. 56, 3246 (1991); Y.Rollin et al., J.Organomet. Chem. 303, 131 (1986); R.Vanderesse et al., J.Organomet. Chem. 264, 263 (1984); В.Loubinoux et al., Tetrahedron Lett., 3951 (1977). Ссылки, в которых описано связывание Suzuki для синтеза несимметричных биарилов (арил Br + арил’ В(ОН)2 с ArAr’ в присутствии соединения палладия (Pd) в качестве катализатора), включают следующие: R.В.Miller and S.Dugar, Organometallics 3, 1261 (1984); M.A.F.Brandao et al., Tetrahedron Lett. 34, 2437 (1993); M. Sato et al., Chem. Lett., 1405 (1989); S.P.Maddaford and В.А.Кеау, J. Org. Chem. 59, 6501-3 (1994) (ключевая ссылка); M.J.Burk et al., J. Am. Chem. Soc. 116, 10847-8 (1994); S.W.Wright et al., J. Org. Chem. 59, 6095-7 (1994) (ключевая ссылка); G.В.Smith et al., J. Org. Chem. 59, 8151-6 (1994); Т.I.Wallow and B.M.Novak, J. Org. Chem. 59, 5034-7 (1994) (ключевая ссылка); X.Yue et al., Tetrahedron Lett. 37, 8213-6 (1996); J.W.Benbow and B.L.Martinez, Tetrahedron Lett. 37, 8829-32 (1996); M.Beller et al., Angew. Chem. 107, 1992-3 (1995), (иногда свободным бороновым кислотам предпочитают сложные эфиры боронатов). Стереоизомеры димеров подпадают под объем настоящего изобретения. Стереохимия заместителей полифенольного мономерного звена димера может быть охарактеризована с учетом их взаимной стереохимии, “альфа/бета” или “цис/транс”, или абсолютной стереохимии, “R/S”. Термин “альфа” ( Пример 1 Получение (2R,3S,транс)-5,7,3 Раствор (+)-катехина (65,8 г, 226,7 ммоль, безводный), растворенный в безводном диметилформамиде (ДМФ, 720 мл), добавляли капельно при комнатной температуре в течение 80 мин к перемешиваемой суспензии гидрида натрия, 60% в масле, (39 г, 975 ммоль, 4,3 экв.) в ДМФ (180 мл) (S. Miura et al., Radioisotopes, 32, 225-230 1993). После перемешивания в течение 50 мин колбу помещали на NaCl/ледяную баню с температурой -10°С. Бензилбромид (121 мл, 1,02 моль, 4,5 экв.) добавляли капельно в течение 80 мин и коричневую реакционную смесь нагревали до комнатной температуры при перемешивании в течение ночи. Полученную реакционную смесь выпаривали и полученное леденцеобразное твердое вещество растворяли с нагреванием и перемешиванием в двух порциях растворителя, каждая из которых состояла из 200 мл хлороформа (CHCl3) и 100 мл воды. Фазы разделяли и водную фазу экстрагировали добавлением хлороформа (20 мл) и объединенные органические фазы промывали водой (100 мл), сушили над сульфатом магния (MgSO4) и выпаривали. Остаток очищали с помощью хроматографии на силикагеле (42×10 см; этилацетат/хлороформ/гексан 1:12:7) с получением после выпаривания и вакуумной сушки 85 г сырого продукта, который перекристаллизовывают из трихлорэтилена (1/3 л) с получением 35,1 г (24%) не совсем белого порошка. 1Н ЯМР (CDCl3) Альтернативно тетра-О-бензил-(+)-катехин может быть получен в соответствии с методикой, описанной в Н.Kawamoto et al., Mokazai Gakkaishi, 37, (5) 488-493 (1991), с использованием карбоната калия и бензилбромида в ДМФ. О частичной рацемизации катехина и в положении 2, и в положении 3 сообщалось в М.-С.Pierre et al., Tetrahedron Letters, 38, (32) 5639-5642 (1997). Пример 2 Получение (2R)-5,7,3 Свежеприготовленный перйодинан Dess-Martin (39,0 г, 92 ммоль, полученный методом D.B.Dess and J.C.Martin, J. Am. Chem. Soc. 113, 7277-7287 (1991) и R.E.Ireland and L. Liu, J. Org. Chem. 58, 2899 (1993)) добавляли при комнатной температуре весь сразу к перемешиваемому раствору тетра-O-бензилкатехина, полученному, как описано в предыдущем примере, (54,4 г, 83,8 ммоль) в метиленхлориде (420 мл). В течение 1,5 часов в реакционную смесь по каплям добавляли приблизительно 30 мл насыщенного водой метиленхлорида с образованием мутного раствора янтарного цвета. (S.D.Meyer and S.L.Schreiber, J. Org. Chem., 59, 7549-7552 (1994)). Двадцать минут спустя реакционную смесь разбавляли насыщенным раствором карбоната натрия (NaHCO3, 500 мл) и 10% водным раствором Na2S2O3·5Н2О (200 мл). Фазы разделяли и водную фазу экстрагировали добавлением 50 мл метиленхлорида. Объединенные органические фазы фильтровали через силикагель (24×9 см, хлороформ/этилацетат/9:1). Элюат упаривали и сушили в вакууме с получением 50,1 г (92%) кетона, который очищали путем перекристаллизации из хлороформа/эфира: т.пл. 144-144,5°С; [ Пример 3 Получение 8-бром-5,7,3 Способ А: К раствору 116 мг (178 мкмоль) тетра-O-бензилэпикатехина в 4 мл безводного CH2Cl2 добавляли при охлаждении на льду и перемешивании 32 мг (180 мкмоль) N-бромсукцинимида (NBS). Перемешивание при 0°С продолжали в течение 100 мин, раствор концентрировали и остаток очищали путем хроматографии на силикагеле (15×1,8 см) хлороформом/этилацетатом (CHC3/EtOAc) (25:1). Кристаллизация из CHCl3/этанола позволяла получить 110 мг (85%) бесцветного хлопкоподобного твердого вещества. Т.пл. 137,5°С; Способ В: К 563 мг (771 мкмоль) 5,7,3 К 598 мг (822 мкмоль) указанного выше неочищенного кетона в 8,2 мл безводного ТГФ по каплям в течение 10 минут добавляли 1,23 мл 1 М раствора три-втор-бутилборгидрида лития (L-Selectride®). После перемешивания при -78°С в течение 3 часов исходное вещество еще определялось в реакционной смеси путем тонкослойной хроматографии (ТСХ), (SiO2, EtOAc/гексан 1:3), и добавляли еще 1,23 мл восстановителя. Перемешивание продолжали еще в течение 4 часов, в то время как температура постепенно поднялась до -4°С. Водный гидроксид натрия (NaOH) (2,5 М, 6 мл) и 4 мл 35% водного пероксида водорода (Н2O2) добавляли с охлаждением; протекающая экзотермическая реакция поднимала температуру бани до +12°С. Перемешивание на водяной бане продолжали в течение ночи, затем смесь частично упаривали и добавляли 20 мл эфира и 10 мл этилацетата (EtOAc). Фазы разделяли и водную фазу экстрагировали добавлением 50 мл EtOAc. Объединенные органические фазы упаривали и остаток очищали путем хроматографии на силикагеле (23×2,5 см) EtOAc/гексаном 1:3 с получением 327 мг (55%) продукта в виде светло-желтой пены. Пример 4 5,7,3 К раствору 297 мг (407 мкмоль) 5,7,3 Пример 5 5,7,3 К раствору 527 мг (648 мкмоль) тетрагидропиранилового эфира из примера 4 в 6,5 мл безводного ТГФ при -78°С в течение 5 мин по каплям добавляли 0,91 мл (1,55 ммоль) трет-бутиллития (1,7 М в пентане). Полученный раствор перемешивали при -78°С в течение 5 минут, в то время как к 147 мг (0,91 ммоль) безводного хлорида железа (FeCl3) добавляли 1,5 мл безводного тетрагидрофурана (ТГФ) (бурная экзотермическая реакция). Полученный раствор/суспензию добавляли в течение 2 минут к органолитиевому реагенту с получением черно-коричневого раствора. Реакционную смесь выдерживали в течение 5 минут при -78°С, затем оттаивали до 0°С в течение 1 часа. После добавления 1 мл 5% HCl и частичного упаривания продукт экстрагировали добавлением 15 мл хлороформа (CHCl3) и органическую фазу промывали 2×5 мл 5% соляной кислоты (HCl) и сушили над сульфатом магния (MgSO4). Растворитель выпаривали и заменяли 4 мл ТТФ, к которому было добавлено 0,4 мл 5% HCl. Через 65 минут при комнатной температуре реакционную смесь упаривали и остаток хроматографировали на силикагеле (SiO2) смесями этилацетата/гексана. Элюирование головной фракции с отношением 2:5 позволяло получать 64 мг (15%) 5,7,3 Пример 6 5,7,3 К раствору 63,5 мг (144 мкмоль, 5 экв.) три-O-бензилгалловой кислоты и 1,5 мкл диметилформамида (ДМФ) в 1 мл метиленхлорида (СН2Cl2) добавляли 25 мкл (0,29 мкмоль, 10 экв.) оксалилхлорида. После перемешивания при комнатной температуре в посуде, снабженной хлоркальциевой трубкой (CaCl2), в течение 35 мин смесь упаривали и сушили в вакууме. К неочищенному хлорангидриду добавляли раствор 37,5 мг (28,9 мкмоль) 8,8 Пример 7 3,3″-Ди-O-галлоил-8,8″-бикатехин Раствор 29,2 мг (13,6 мкмоль) описанного выше соединения в 2 мл ТГФ и 2 мл МеОН гидрировали при атмосферном давлении (баллон) над 34,5 мг коммерческого (влажного) 20% Pd(OH)2,/C в течение 105 мин. Катализатор отфильтровывали через вату и промывали 2 мл МеОН. После упаривания неочищенный продукт очищали путем препаративной ВЭЖХ (Waters Bondapak С18, 300×19 мм, скорость элюции 9 мл/мин, УФ определение при 280 нм), используя следующий градиент растворителя В (0,5% АсОН в денатурированном EtOH) в растворителе А (0,5% АсОН в Н2O): 0-1 мин, 15% В; 1-15 мин, 15-26% В; 15-16 мин, 26-80% В; 16-20 мин, 80% В. Объединенные элюаты, содержащие главный компонент, упаривали и сушили в вакууме с получением 6,7 мг (56%) продукта в виде багрянистой пленки: 1H ЯМР (ацетон – d6/D2O 3: lv/v) 7,06 (с, 4Н), 7,03 (д, 2Н, J=2 Гц), 6,86, 6,76 (АВкв, 4Н, J=8 Гц, часть А д c J=1,5 Гц), 6,19 (с, 2Н), 5,23 (м, 2Н), 4,99 (д, 2Н, J=8 Гц), 3,05, 2,64 (АВкв, 4Н, J=16 Гц, обе части д с J=5,5 и 8 Гц соотв.); 13С ЯМР (ацетон-d6/D2O 3: lv/v) 166,59, 155,92, 155,59, 154,26, 145,81, 145,27, 145,19, 139,00, 131,30, 121,08, 119,58, 115,74, 114,76, 109,95, 100,89, 99,41, 96,08, 78,89, 71,36, 25,97; МС (Электровпрыск, МсОН/СН3CN) m/z 906,4/905,4 (М+Na+рассч. для 13С12С43Н34О20Na/12С44Н34O20Na: 906, 2/905,2), 735,6 (М+Na+-галловая кислота; рассч. для 12С37Н28О15Na: 735,1) 601,7 (М+Na+ – затем ретро-реакция Дильса-Альдера; рассч. для 12С29Н22O13Na: 601,1). Пример 8 Получение 5,7,3 Раствор (+)-катехина (65,8 г, 226,7 ммоль, безводный) растворяли в безводном диметилформамиде (ДМФ, 720 мл), добавляли по каплям при комнатной температуре в течение 80 минут к перемешиваемой суспензии гидрида натрия (60% в масле, 39 г, 975 ммоль, 4,3 экв.) в диметилформамиде (ДМФ) (180 мл). (S.Miura, et al., Radioisotopes, 32, 225-230 (1983)). После перемешивания в течение 50 минут колбу помещали в NaCl/ледяную баню с температурой -10°С. Бензилбромид (121 мл, 1,02 моль, 4,5 экв.) добавляли по каплям в течение 80 мин и коричневую реакционную смесь нагревали до комнатной температуры при перемешивании в течение ночи. Полученную реакционную смесь упаривали и полученное леденцеобразное твердое вещество растворяли с нагреванием и перемешиванием в двух порциях растворителя, каждая из которых состояла из 200 мл хлороформа (CHCl3) и 100 мл воды. Фазы разделяли, водную фазу экстрагировали добавлением CHCl3 (20 мл) и объединенные органические фазы промывали водой (100 мл), сушили над сульфатом магния (MgSO4) и упаривали. Остаток очищали путем хроматографии на силикагеле (42×10 см; этилацетат/хлороформ/гексан 1:12:7) с получением после упаривания и сушки в вакууме 85 г неочищенного продукта, который перекристаллизовывали из трихлорэтилена (1,3 л) с получением 35,1 г (24%) не совсем белого порошка. 1Н ЯМР (CDCl3) 7,47-7,25 (м, 20 Н), 7,03 (с, 1Н), 6,95 (с, 2Н), 6,27, 6,21 (АВкв, 2Н, J=2 Гц), 5,18 (с, 2Н), 5,17 (узкий АВкв, 2Н), 5,03 (s 2Н), 4,99 (s 2Н), 4,63 (д, 1Н, J=8,5 Гц), 4,00 (м, 1Н), 3,11, 2,65 (АВкв, 2Н, J=16,5 Гц, обе части д с J=5,5 и 9 Гц соотв.), 1,59 (д, 1Н, J=3,5 Гц); ИК (пленка) 3440 (ушир.), 1618, 1593, 1513, 1499, 1144, 1116, 733, 696 см1; МС m/z 650 (M+, 0,5%), 319, 181, 91. Альтернативно тетра-O-бензил-(+)-катехин может быть получен в соответствии с методикой, описанной в Н. Kawamoto et al, Mokazai Gakkaishi, 37, (5) 488-493 (1991), с использованием карбоната калия и бензилбромида в диметилформамиде (ДМФ). О частичной рацемизации катехина и в положении 2, и в положении 3 сообщалось в М.-С.Pierre et al., Tetrahedron Letters, 38, (32) 5639-5642 (1997). Пример 9 Получение 5,7,3 1 М раствор три-втор-бутилборгидрида лития в тетрагидрофуране (ТГФ) (100 мл, L-Selectride®, продается Aldrich Chemical Co, Inc., Milwaukee, WI) добавляли в атмосфере аргона к перемешиваемому раствору безводного бромида лития (LiBr) с температурой 0°С (34,9 г, 402 ммоль) в 100 мл безводного ТГФ. Полученную смесь охлаждали до -78°С, применяя ацетоновую/СО2 баню с последующим капельным добавлением раствора защищенного эпикатехина (50,1 г, 77,2 ммоль) в 400 мл безводного ТГФ в течение 50 мин. Перемешивание продолжали при -78°С в течение 135 минут. Охлаждающую баню удаляли и 360 мл 2,5 М водного гидроксида натрия (NaOH) добавляли в реакционную смесь. Реакционную колбу помещали в водяную баню комнатной температуры и смесь 35% водного пероксида водорода H2O2 (90 мл) и этанола (270 мл) добавляли в течение 130 мин. Перемешивание продолжали в течение ночи. Для растворения выкристаллизованного продукта добавляли хлороформ (700 мл), фазы разделяли, водную фазу экстрагировали добавлением хлороформа (CHCl3) (50 мл), объединенные органические фазы сушили над сульфатом магния (MgSO4, упаривали и сушили в вакууме с получением 56,6 г неочищенного продукта. Данный продукт растворяли в 600 мл кипящей смеси этилацетата (EtOAc) и этанола (EtOH) (2:3) и выкристаллизовывали при комнатной температуре, а затем в холодильнике. Продукт выделяли путем вакуумного фильтрования, промывали 2×50 мл холодного (-20°С) EtOAc/EtOH (1:3) и сушили в вакууме сначала при комнатной температуре, а затем при 80°С с получением 35,4 г (70%) светло-желтого твердого вещества. Упаренный маточный раствор фильтровали через силикагель (SiO2), (14×6,5 см, хлороформ (CHCl3), а затем CHCl3/EtOAc 12:1), элюат концентрировали до 40 мл и остаток разбавляли 60 мл этанола с получением дополнительных 5,5 г (11%) O-бензилэпикатехина в виде желтого твердого вещества: т.пл. 129,5-130°С (из EtOAc/EtOH); Пример 10 5,7,3 К раствору 334 мг (914 мкмоль) 5,7,3 Пример 11 5,7,3 К раствору 297 мг (407 мкмоль) 5, 7,3 Пример 12 5,7,3 К раствору 527 мг (648 мкмоль) соединения тетрагидропиранилового эфира из примера 9 в 6,5 мл безводного ТГФ при -78°С в течение 5 мин по каплям добавляли 0,91 мл (1,55 ммоль) трет-бутиллития (1,7 М в пентане). Полученный раствор перемешивали при -78°С в течение 5 минут, в то время как к 147 мг (0,91 ммоль) безводного хлорида железа (FeCl3) добавляли 1,5 мл безводного тетрагидрофурана (ТГФ) (бурная экзотермическая реакция). Полученный раствор/суспензию добавляли в течение 2 минут к органолитиевому реагенту. Реакционную смесь выдерживали в течение 5 минут при -78°С, затем оттаивали до 0°С в течение 1 часа. После добавления 1 мл 5% HCl и частичного упаривания продукт экстрагировали добавлением 15 мл CHCl3 и органическую фазу промывали 2×5 мл 5% HCl и сушили над MgSO4. Растворитель выпаривали и заменяли 4 мл ТГФ, к которому было добавлено 0,4 мл 5% HCl, и остаток очищали. Пример 13 5,7,3 К раствору 63,5 мг (144 мкмоль, 5 экв.) три-O-бензилгалловой кислоты и 1,5 мкл ДМФ в 1 мл СН2Cl2 добавляли 25 мкл (0,29 ммоль, 10 экв.) оксалилхлорида. После перемешивания при комнатной температуре в посуде, снабженной хлоркальциевой трубкой (CaCl2), в течение 35 мин смесь упаривали и сушили в вакууме. К неочищенному хлорангидриду добавляли раствор 37,5 мг (28,9 мкмоль) 6,6 Пример 14 3.3 Раствор 29,2 мг (13,6 мкмоль) соединения из примера 8 в 2 мл ТГФ и 2 мл МеОН гидрировали при атмосферном давлении (баллон) над 34,5 мг коммерческого (влажного) 20% Pd(OH)2/C в течение 105 мин. Катализатор отфильтровывали через вату и промывали 2 мл МеОН. После упаривания неочищенный продукт очищали путем препаративной ВЭЖХ.
Формула изобретения
1. Способ получения (8 (a) защиту фенольных гидроксильных групп эпикатехинового и/или катехинового мономера первой защитной группой; (b) защиту С-3 гидроксильных групп соединений со стадии (а) второй защитной группой; (c) галогенирование соединений со стадии (b) по положению С-8; (d) взаимодействие соединений со стадии (с) с алкиллитиевым соединением для введения лития в С-8 положение; (e) проведение окислительного или восстановительного связывания ариллитиевых соединений со стадии (d) с получением защищенного димера и (f) удаление защитных групп у соединения со стадии (е) с получением (8 2. Способ по п.1, где первая и вторая защитные группы представляют собой бензил, или бензил и тетрагидропиранил, или трет-бутилдиметилсилил. 3. Способ по п.1, где галогенирующий агент представляет собой N-бромсукцинимид, где алкиллитий представляет собой трет-бутиллитий или М-бутиллитий и где стадию удаления защитных групп проводят путем каталитического гидрогенолиза. 4. Способ по п.1, где окислительное связывание осуществляют с помощью хлорида железа (III). 5. Способ получения (8 (a) защиту С-3 гидроксильных групп первого и второго катехинового и/или эпикатехинового мономера первой защитной группой; (b) защиту фенольных гидроксильных групп соединений со стадии (а) второй защитной группой; (c) галогенирование соединений со стадии (b) для введения галогеновой группы в положение С-8; (d) взаимодействие соединений со стадии (с) с ариллитиевым соединением для введения лития в С-8 положение; (e) проведение окислительного или восстановительного связывания соединений со стадии (d); (f) удаление защитных групп у 3-гидроксильных положений соединений со стадии (е); (g) этерификацию соединений со стадии (f) три-О-бензилгаллоилгалогенидом с получением защищенного дигаллата димера и (h) удаление защитных групп у соединений со стадии (g) с получением дигаллата (8 6. Способ по п.5, где первая и вторая защитные группы представляют собой бензил, или бензил и тетрагидропиранил, или трет-бутилдиметилсилил. 7. Способ по п.5, где галогенирующий агент представляет собой N-бромсукцинимид, где алкиллитий представляет собой трет-бутиллитий или N-бутиллитий и где стадию удаления защитных групп проводят путем каталитического гидрирования. 8. Способ по п.5, где окислительное связывание осуществляют с помощью хлорида железа (III). 9. Способ по п.5, где три-О-бензилгаллоилгалогенид представляет собой три-О-бензилгаллоилхлорид.
|
||||||||||||||||||||||||||

 8) ДИМЕРА КАТЕХИНА, И/ИЛИ ЭПИКАТЕХИНА, И/ИЛИ ЭПИКАТЕХИНГАЛЛАТА
8) ДИМЕРА КАТЕХИНА, И/ИЛИ ЭПИКАТЕХИНА, И/ИЛИ ЭПИКАТЕХИНГАЛЛАТА
 ), (6
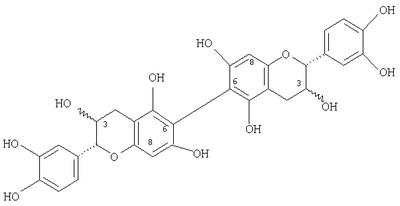
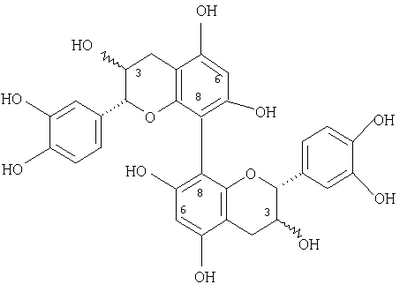
), (6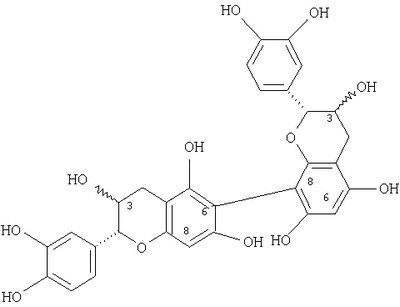
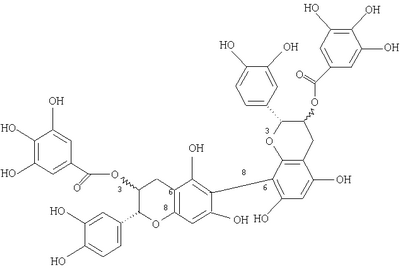
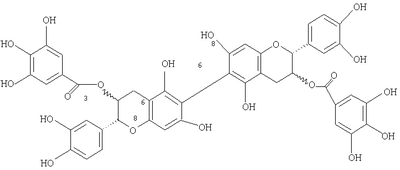
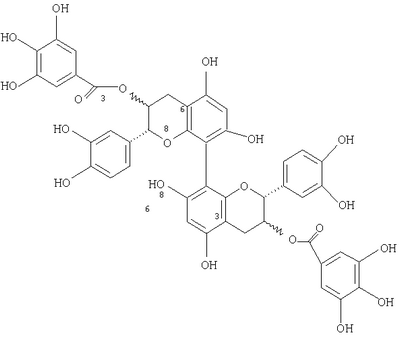
 ,4
,4 7,47-7,25 (м, 20Н), 7,03 (с, 1Н), 6,95 (с, 2Н), 6,27, 6,21 (АВкв, 2Н, J=2 Гц), 5,18 (с, 2Н), 5,17 (узкий АВкв, 2Н), 5,03 (с, 2Н), 4,99 (с, 2Н), 4,63 (д, 1Н, J=8,5 Гц), 4,00 (м, 1Н), 3,11, 2,65 (АВкв, 2Н, J=16,5 Гц, обе части д с J=5,5 и 9 Гц соотв.), 1,59 (д, 1Н, J=3,5 Гц); ИК (пленка) 3440 (ушир.), 1618, 1593, 1513, 1499, 1144, 1116, 733, 696 см-1; МС m/z 650 (М+, 0,5%), 319, 181, 91.
7,47-7,25 (м, 20Н), 7,03 (с, 1Н), 6,95 (с, 2Н), 6,27, 6,21 (АВкв, 2Н, J=2 Гц), 5,18 (с, 2Н), 5,17 (узкий АВкв, 2Н), 5,03 (с, 2Н), 4,99 (с, 2Н), 4,63 (д, 1Н, J=8,5 Гц), 4,00 (м, 1Н), 3,11, 2,65 (АВкв, 2Н, J=16,5 Гц, обе части д с J=5,5 и 9 Гц соотв.), 1,59 (д, 1Н, J=3,5 Гц); ИК (пленка) 3440 (ушир.), 1618, 1593, 1513, 1499, 1144, 1116, 733, 696 см-1; МС m/z 650 (М+, 0,5%), 319, 181, 91. Porasil 125 Å, размер частиц 10 мкм, 30×5 см, EtOAc/гексан 2:3, 80 мл/мин, УФ определение при 280 нм) с получением 65 мг (16%) чистого продукта в виде бесцветной пленки:
Porasil 125 Å, размер частиц 10 мкм, 30×5 см, EtOAc/гексан 2:3, 80 мл/мин, УФ определение при 280 нм) с получением 65 мг (16%) чистого продукта в виде бесцветной пленки: