|
|
(21), (22) Заявка: 2003126911/15, 05.02.2002
(24) Дата начала отсчета срока действия патента:
05.02.2002
(30) Конвенционный приоритет:
05.02.2001 DK PA 2001 00186
(43) Дата публикации заявки: 27.02.2005
(46) Опубликовано: 10.02.2007
(56) Список документов, цитированных в отчете о
поиске:
US 5891843, 6.04.1999. US 5866122, 16.04.1996.
(85) Дата перевода заявки PCT на национальную фазу:
05.09.2003
(86) Заявка PCT:
DK 02/00080 (05.02.2002)
(87) Публикация PCT:
WO 02/062376 (15.08.2002)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
КНУДСЕН Енс Бьерре (DK),
ХЕДНЕР Улла (SE),
РЕЙКЬЕР Расмус (DK)
(73) Патентообладатель(и):
НОВО НОРДИСК ХЕЛТ КЭР АГ (CH)
|
(54) КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ ПОЛИПЕПТИДОВ ФАКТОРА VII И ПОЛИПЕПТИДОВ ФАКТОРА IX
(57) Реферат:
Изобретение относится к области биохимии. Сущность его заключается к разработке комбинированного применения полипептидов фактора VII и полипептидов фактора IX. Данные фармацевтические препараты содержат фактор VII и полипептиды фактора IX или их родственные полипептиды. Кроме того, изобретение содержит описание полипептидов для производства фармацевтического лекарственного средства, а также способы профилактики или лечения эпизодического кровотечения у субъекта. Технический результат – повышение эффективности лечения эпизодического кровотечения у субъекта. 16 н. и 27 з.п. ф-лы, 1 табл., 1 ил.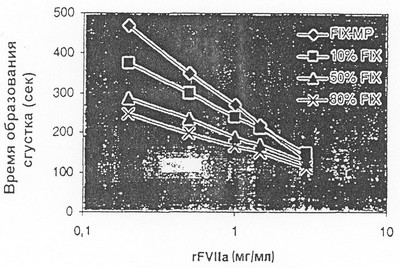
ОБЛАСТЬ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение связано с фармацевтической композицией, содержащей препарат фактора VII или препарат полипептида, родственного фактору VII, и препарат фактора IX или препарат полипептида, родственного фактору IX. Изобретение связано также с набором компонентов для лечения эпизодов кровотечения, включающим в себя препарат фактора VII или препарат полипептида, родственного фактору VII, и препарат фактора IX или препарат полипептида, родственного фактору IX. Изобретение связано также с применением препарата фактора VII или препарата полипептида, родственного фактору VII, и препарата фактора IX или препарата полипептида, родственного фактору IX, для получения лекарственного средства. Кроме того, изобретение связано со способами лечения кровотечений, сокращения времени свертывания, усиления гемостаза, сокращения количества введений белка-фактора свертывания, необходимого для достижения остановки кровотечения (гемостаза), снижения количества вводимого белка-фактора свертывания, необходимого для достижения гемостаза, пролонгирования времени растворения тромба (фибринолиза), увеличения прочности кровяного сгустка и усиления образования фибринового сгустка.
ОСНОВА СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Фактор VII свертывания крови представляет собой плазменный фактор свертывания (FVII). Активированный фактор VII (FVIIa) инициирует нормальный процесс гемостаза путем образования комплекса с тканевым фактором (TF), экспонированным в результате повреждения сосудистой стенки, которая вслед за этим активирует факторы IX и X (FIX и FX), переводя их в их активированную форму, факторы IXa и Xa (FIXa и FXa). Фактор Xa конвертирует ограниченное количество протромбина в тромбин на поверхности клеток, несущих тканевый фактор. Тромбин активирует тромбоциты и факторы V и VIII в факторы Va и VIIIa (FVa и FVIIIa), оба из которых служат кофакторами в дальнейшем процессе, ведущем к полному выбросу тромбина (full thrombin burst). Этот процесс включает в себя выработку фактора Xa под действием фактора IXa (в комплексе с фактором VIIIa) и происходит на поверхности активированных тромбоцитов. Наконец, тромбин превращает фибриноген в фибрин, что приводит к образованию фибринового сгустка.
Фактор VII существует в плазме главным образом в виде одноцепочечного зимогена, который расщепляется под действием фактора Xa, превращаясь в свою двухцепочечную активированную форму, FVIIa. Рекомбинантный активированный фактор (rFVIIa) развивается в прогемостатический агент. Введение rFVIIa приводит к быстрому и высокоэффективному прогемостатическому ответу у больных гемофилией с кровотечениями, которых нельзя лечить продуктами факторов свертывания крови из-за процесса антителообразования. Также и больные с кровотечением, имеющие дефицит фактора VII, или больные, имеющие нормальную систему свертывания, но с повышенной кровоточивостью, могут эффективно подвергаться лечению под действием фактора FVIIa. В этих исследованиях не было обнаружено никаких нежелательных побочных эффектов rFVIIa (в частности, возникновения тромбоэмболии).
Фактор IX свертывания крови (фактор IX) представляет собой плазменный фактор свертывания, участвующий в активации фактора X (FX). Снижение количества или активности фактора IX в кровяном русле приводит к развитию гемофилии B. Уровень снижения активности фактора IX прямо пропорционален тяжести заболевания. Традиционное лечение гемофилии B состоит в замещении недостающего белка полученным из плазмы или рекомбинантным фактором IX (так называемое FIX-замещение, или заместительное лечение или терапия).
Дефицит фактора свертывания (например, дефицит FIX) отражает генные дефекты различных типов. В тех случаях, когда имеются тяжелые генетические повреждения, такие как делеции или сдвиг рамки считывания, мРНК не продуцируется, и в результате возникает (тяжелый) дефицит. Менее тяжелые формы генетических повреждений, например, некритичным образом локализованные точковые мутации, приводят к секреции белка с пониженной биологической активностью. Ненаследуемый вариант носит рецессивный и X-сцепленный характер, означающий то, что он поражает только мужчин, у которых имеется только одна X-хромосома. Степень тяжести дефекта свертывания может носить слабый или выраженный характер. Степень тяжести зависит от концентрации нормально функционирующего фактора IX в плазме. Целью заместительной терапии является повышение уровня активности фактора свертывания у больного (здесь и далее называемого “уровень фактора”) до тех пор, пока не будет приблизительно восстановлен гемостаз, и затем поддержание этого уровня до окончания лечения, когда настанет выздоровление. Если начало эффективного лечения задерживается, заживление раны может оказаться замедленным, и тогда потребуется лечение, более интенсивное, чем обычно. Длительность и интенсивность лечения зависит от концентрации фактора свертывания в плазме, необходимой для гемостаза, для его восстановления в крови и времени полужизни материала трансфузии.
Уровень фактора IX также может быть более или менее сниженным у некоторых индивидуумов (например, у женщин-носителей заболевания), которые являются гетерозиготными в отношении этого генного дефекта. Такие субъекты могут иметь повышенную тенденцию к кровотечениям по сравнению с таковой у больных, в умеренной степени пораженных гемофилией, и могут быть подвергнуты соответствующему лечению.
У некоторых больных, получающих заместительную терапию в отношении фактора IX (пораженных гемофилией B), наблюдается образование антител против вводимого фактора IX. Однако у больных, родившихся с нормальным уровнем фактора IX (которые не имеют врожденного дефицита фактора IX), может по неизвестным причинам в более позднем возрасте развиться процесс образования аутоантител против фактора IX (приобретенная гемофилия B). В обоих случаях антитела могут быть представлены в малом, умеренном или большом количестве. В случае, когда у больных имеется низкий или средний титр ингибиторов (т.е. антител), их иногда можно лечить фактором IX.
Проявляемая гемофилия может иметь самую разную степень тяжести. Больной, у которого фактор IX не определяется или его уровень составляет менее 1%, обычно считается тяжелым больным с выраженными поражениями, у которого при малейшей травме, а иногда и случайно могут возникать кровотечения в ткани мышц и суставов. Небольшое количество фактора IX дает значительную защиту, так что больные, имеющие уровень фактора IX, составляющий 1-5% от нормального, обычно страдают только посттравматическим кровотечением и менее тяжелым кровотечением в ткани мышц и суставов и т.д., и зачастую считаются больными, пораженными заболеванием в слабой степени. Больные, у которых уровень фактора IX составляет более 5%, обычно подвержены кровотечениям в случаях значительной травмы или хирургических вмешательств, и такие больные обычно считаются больными, пораженными в умеренной степени. Следует отметить, что эта классификация применима не во всех случаях. Некоторые больные с очень низкими показателями уровня фактора IX в редких случаях подвержены кровотечениям, тогда как другие, у которых уровень фактора IX составляет даже выше 5%, могут повторно подвергаться кровотечению в «ткани-мишени», исходно поврежденные в результате травматического гемартроза, и у таких больных заболевание считается “тяжело” выраженным. Однако обычно симптомы кровотечения менее выражены при более высоких уровнях этого фактора в крови, так что аномальные кровотечения обычно не происходят, когда уровень фактора IX составляет порядка 35-40% нормальных уровней и выше. Обычная корреляция между содержанием этого фактора и симптомами гемофилии B показана ниже.
| Степень тяжести гемофилии в зависимости от фактора IX: |
| Степень тяжести |
Уровень фактора
(% от нормального уровня) |
Проявления |
| Тяжелая |
0-1 |
Кажущиеся спонтанными кровотечения. Тяжелое кровотечение |
| Средняя |
1-5 |
Несколько кровоподтеков. Гемартроз, в основном травматического характера. |
| Слабая |
5-30 |
Кровотечение посттравматического, постхирургического, постдентального происхождения. Несколько эпизодов. |
Обычно проводимое лечение гемофилии B состоит в заместительном восстановлении недостающего белка полученным из плазмы или рекомбинантным фактором IX. Продукты фактора IX используются, в случае необходимости, для внутривенной инфузии (или инъекции) при лечении острых кровотечений. Разные типы кровотечений делятся на следующие категории:
1. Гемартроз (кровотечение в суставах.
2. Кровотечения, представляющие угрозу жизни и конечности (кровотечения в забрюшинном пространстве, кровотечения в ЦНС, кровотечения в заглоточном пространстве, мышечные кровотечения с компартментным синдромом и массивные кровотечения желудочно-кишечного тракта).
3. Предупреждение кровотечения в связи с оперативным вмешательством (ортопедия, отдельные процедуры, хирургия в связи с несчастным случаем).
Опыт показывает, что если до завершения процесса заживления содержание фактора IX устанавливается на уровне 30-40% от его нормального уровня, обычно поддерживается нормальный гемостаз. Однако большое значение имеют также и другие факторы. Перемещение поврежденных частей, как при гемартрозе, кашель или вставание с постели и передвижения больного после абдоминальной хирургии могут вызвать кровотечения. Физиотерапия или иное воздействие могут потребовать более высоких уровней, тогда как иммобилизация слабых повреждений может контролироваться относительно низкими уровнями этого фактора. Приблизительные уровни этого фактора в случае конкретных органов-мишеней в той или иной ситуации показаны ниже.
Лечение стандартного гемартроза (категория 1).
Обычно целью является достижение исходной концентрации фактора IX в плазме крови на уровне по меньшей мере 20-30% от нормального уровня, а затем, в течение последующих 2-3 дней, поддержание на уровне по меньшей мере 10-20% от нормального уровня.
Лечение кровотечений, представляющих опасность для жизни и для конечности (категория 2).
Обычно целью является достижение исходной концентрации фактора IX в плазме крови на уровне по меньшей мере 40%, а затем, в течение последующей недели, на уровне по меньшей мере 10-20%.
Предупреждение кровотечения в связи с оперативным вмешательством (категория 3).
Обычно целью является достижение концентрации фактора IX в плазме крови на день оперативного вмешательства на уровне по меньшей мере 55-80%, затем, в течение последующих 2-7 дней, на уровне по меньшей мере 20-30%, а потом, в течение одной-двух недель, на уровне по меньшей мере 10-20%.
Если при лечении следовать приведенным выше указаниям, по поводу количества инъекций фактора IX в связи с указанными типами кровотечений можно сказать следующее.
С учетом того, что средний период полужизни фактора IX в плазме составляет от 18 до 24 часов, обычно в клинической практике используют следующее количество инъекций фактора IX, сопровождающих каждый эпизод кровотечения:
Гемартроз (кровотечение в суставах). Домашнее лечение, незначительный гемартроз: 1-3 инъекции. Лечение в стационаре, более обширный гемартроз: 6-14 инъекций.
Кровотечения, представляющие собой угрозу для жизни и конечности: 10-20 инъекций.
Предупреждение кровотечения в связи с оперативным вмешательством: 30-40 инъекций.
В настоящее время при лечении гемофилии в клинических условиях используют фактор VIIa для остановки кровотечений у больных, у которых присутствуют ингибиторы факторов VIII или IX (которые препятствуют заместительной терапии). Однако обычно клиницисты не склонны использовать фактор VIIa в качестве основного лечения в случае больных гемофилией без ингибиторов (где могут быть использованы, соответственно, факторы VIII или IX), поскольку предполагается, что короткое время полужизни фактора VIIa по сравнению с таковым фактора IX (2,5 часа по сравнению с 18-24 часами) потребует более частых инъекций фактора VIIa для поддержания определенного уровня гемостаза.
Европейский Патент №225160 (Novo Nordisk) относится к композициям фактора VIIa и способам лечения связанных с кровотечениями заболеваний, причиной которых не являются дефекты факторов свертывания или ингибиторы факторов свертывания крови.
Европейский Патент №82182 (Baxter Travenol Lab.) относится к композиции фактора VIIa, применяющейся для того, чтобы вызвать у больного противодействие дефицитам или эффектам ингибиторов факторов свертывания крови.
Публикация Lusher et al., Haemophilia, 1998, 4, pp.790-798 связана с введением рекомбинантного фактора VIIa при лечении суставной, мышечной геморрагии и геморрагии слизистой у больных с гемофилией A и B, у которых имеются или не имеются ингибиторы.
Публикация Kjalke et al, Thrombosis and Haemostasis, 1999 (Suppl), 095 1 связана с введением экстра-экзогенного фактора VIIa и эффектом образования тромбина на поверхности активированных тромбоцитов на модельной системе, имитирующей условия гемофилий A или B.
Патент США №5891843 (Immuno) относится к композиции фактора VIIa в комбинации со вторым ингредиентом, имеющим FEIB-активность, например, активированным протромбиновым комплексом или препаратом FEIBA.
На сегодняшний день многие продукты фактора IX, используемые при лечении гемофилии, содержат полученный рекомбинантным путем фактор IX. Однако эти продукты могут быть также выделены из плазмы крови свиньи или человека. Эти очищенные продукты зачастую содержат меньшие количества других факторов свертывания или других компонентов из плазмы крови. Обычно такие добавочные компоненты плазмы нежелательны (потому что возникает риск внесения вирусной инфекции или других загрязнений), и замещение части таких продуктов рекомбинантным белком (например, фактором VIIa) расценивается как улучшение свойств композиции и лечения и как преимущество для больного.
На сегодняшний день у субъектов, имеющих пониженный уровень фактора IX (например, у больных гемофилией B) и переживших эпизодические кровотечения, остановить кровотечение удается обычно только после лечения в виде нескольких инъекций или инфузий фактора IX. Более того, необходимо определенное количество инъекций для поддержания гемостаза до тех пор, пока повреждение, вызвавшее кровотечение, полностью заживет.
Жертвы травм, которые страдают от избыточных кровотечений, обычно лечат большими объемами инфузируемых жидкостей, таких как жидкости для внутривенного введения, инфузируемые путем инъекции коллоидные продукты, альбумин, концентраты красных кровяных клеток и т.д. Обширные кровотечения, требующие массивных трансфузий крови, могут приводить к развитию недостаточности многих органов, включая ослабление функций легких и почек.
Более быстрая остановка кровотечения у таких субъектов могла бы создать очень большое преимущество. Таким образом, следовало бы сократить количество инъекций, необходимых для остановки кровотечения и поддержания гемостаза, и/или сократить количество свертывающего белка, используемого для остановки кровотечения и поддержания гемостаза.
По-прежнему существует необходимость в улучшенной терапии субъектов, переживших эпизодические кровотечения, включая субъектов, у которых случаи кровотечения связаны с пониженным уровнем фактора IX свертывания крови. Существует также необходимость в улучшенных, надежных и широко применимых способах повышения свертывания, усиления или обеспечения формирования стабильных гемостатических сгустков, в повышении удобства применяемого способа лечения для пациентов, или достижения полного или удовлетворительного гемостаза у больных, в частности, у субъектов, у которых ослаблена выработка тромбина. Существует потребность в способах, позволяющих уменьшить количество фактора VIIa или количество фактора IX, необходимое для достижения полного или удовлетворительного гемостаза. Существует также потребность в способах, позволяющих снизить общее количество белка-фактора свертывания, необходимого для достижения полного или удовлетворительного гемостаза, и в способах, дающих возможность укоротить период, необходимый для остановки кровотечения.
КРАТКОЕ СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
Одним объектом согласно изобретению является обеспечение композиций, которые могут эффективно быть использованы в лечении или профилактике случаев кровотечения или болезней свертывания.
Вторым объектом согласно изобретению является обеспечение композиций единичной дозированной формы, которые могут эффективно быть использованы в лечении или профилактике случаев кровотечения или в качестве прокоагулянта. Другим объектом согласно изобретению является обеспечение композиций, способов лечения или наборов, оказывающих синергическое действие.
Другим объектом согласно изобретению является обеспечение композиций, способов лечения или наборов, не вызывающих существенных побочных эффектов, таких как высокий уровень системной активации системы свертывания крови.
Другие объекты согласно изобретению станут очевидны в процессе ознакомления с настоящим описанием.
В первом аспекте данное изобретение связано с фармацевтической композицией, содержащей препарат фактора VII или родственного фактору VII полипептида, и с получением фактора IX или родственного фактору IX полипептида.
Во втором аспекте данное изобретение относится к набору компонентов для лечения случаев кровотечения, включающему в себя a) эффективное количество препарата фактора VII или родственного фактору VII полипептида и фармацевтически приемлемый носитель в первой единичной дозированной форме; b) эффективное количество препарата фактора IX или родственного фактору IX полипептида и фармацевтически приемлемый носитель во второй единичной дозированной форме; и c) контейнер для содержания указанных первой и второй лекарственных форм.
В другом аспекте данное изобретение относится к применению препарата фактора VII или родственного фактору VII полипептида в комбинации с препаратом фактора IX или родственного фактору IX полипептида для производства лекарственного средства для лечения у больного случаев кровотечения.
В другом аспекте данное изобретение относится к применению препарата фактора VII или родственного фактору VII полипептида в комбинации с препаратом фактора IX или родственного фактору IX полипептида для производства лекарственного средства для уменьшения времени образования сгустка.
В другом аспекте данное изобретение относится к применению препарата фактора VII или родственного фактору VII полипептида в комбинации с препаратом фактора IX или родственного фактору IX полипептида для производства лекарственного средства для увеличения времени фибринолиза (времени растворения тромба).
В другом аспекте данное изобретение относится к применению препарата фактора VII или родственного фактору VII полипептида в комбинации с препаратом фактора IX или родственного фактору IX полипептида для производства лекарственного средства для увеличения прочности сгустка.
В другом аспекте данное изобретение относится к способу лечения эпизодического кровотечения у субъекта, включающему в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количество вместе являются эффективными для лечения кровотечений.
В другом аспекте данное изобретение относится к способу снижения времени образования сгустка у субъекта, включающему в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количество вместе являются эффективными для уменьшения времени образования сгустка.
В другом аспекте данное изобретение относится к способу усиления гемостаза у субъекта, включающему в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количество вместе являются эффективными для усиления гемостаза.
В другом аспекте данное изобретение относится к способу уменьшения числа введений белка-фактора свертывания крови, необходимого для остановки кровотечения и установления гемостаза у субъекта, включающему в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количество вместе являются эффективными для остановки кровотечения и установления гемостаза.
В другом аспекте данное изобретение относится к способу снижения количества вводимого белка-фактора свертывания крови, необходимого для остановки кровотечения и установления гемостаза у субъекта, включающему в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количество вместе являются эффективными для остановки кровотечения и установления гемостаза.
В другом аспекте данное изобретение относится к способу увеличения времени фибринолиза (времени растворения сгустка) у субъекта, включающему в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количество вместе являются эффективными для увеличения времени фибринолиза.
В другом аспекте данное изобретение относится к способу увеличения прочности сгустка у субъекта, включающему в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количество вместе являются эффективными для увеличения прочности сгустка.
В другом аспекте данное изобретение относится к способу усиления формирования фибринового сгустка у субъекта, включающему в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количество вместе являются эффективными для усиления формирования фибринового сгустка.
В другом аспекте данное изобретение относится к набору компонентов для лечения случаев кровотечения, включающему в себя a) эффективное количество препарата фактора VII или родственного фактору VII полипептида и эффективное количество препарата фактора IX или родственного фактору IX полипептида и фармацевтически приемлемый носитель в единичной дозированной форме; и b) контейнер для содержания единичной дозированной формы.
В одной серии аспектов согласно изобретению фактор VII или родственный фактору VII полипептид представляет собой родственный фактору VII полипептид. В другом аспекте фактор VII или родственный фактору VII полипептид представляет собой полипептид фактора VII. В одной серии аспектов согласно изобретению указанный родственный фактору VII полипептид представляет собой вариант аминокислотной последовательности фактора VII. В одном аспекте отношение между активностью родственного фактору VII полипептида и активностью нативного человеческого фактора VIIa (фактор VIIa дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании методом “гидролиза In Vitro”, как описано в материалах настоящей заявки.
В одной серии аспектов согласно изобретению фактор VII или родственный фактору VII полипептид представляет собой полипептид фактора VII. В одном из аспектов фактор VII представляет собой человеческий фактор VII. В одном из аспектов фактор VII представляет собой фактор VII быка, свиньи, собаки, лошади, мыши или лосося. В другом аспекте полипептид фактора VII представляет собой рекомбинантный фактор VII. В другом аспекте полипептид фактора VII представляет собой полученный из плазмы фактор VII. В другом аспекте полипептид фактора VII представляет собой полученный из плазмы фактор VII человека. В другом аспекте полипептид фактора VII представляет собой рекомбинантный фактор VII человека. В одной серии аспектов согласно изобретению фактор VII или родственный фактору VII полипептид представлен в своей активированной форме. В другом аспекте согласно изобретению полипептид фактора VII представляет собой рекомбинантный фактор VIIa человека.
В одной серии аспектов согласно изобретению фактор IX или родственный фактору IX полипептид представляет собой родственный фактору IX полипептид. В одном из аспектов родственный фактору IX полипептид представляет собой вариант аминокислотной последовательности фактора IX. В одном аспекте соотношение между активностью родственного фактору IX полипептида и активностью нативного человеческого фактора IX (фактор IX дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании методом “хромоникелевого анализа”, как описано в материалах настоящей заявки. В одном аспекте фактор IX или родственный фактору IX полипептид представляет собой полипептид фактора IX. В одном из аспектов фактор IX представляет собой фактор IX человека. В одном из аспектов фактор IX представляет собой фактор IX быка, свиньи, собаки, лошади, мыши или лосося. В другом аспекте полипептид фактора IX представляет собой рекомбинантный фактор IX. В другом аспекте полипептид фактора IX представляет собой полученный из плазмы полипептид фактора IX. В другом аспекте полипептид фактора IX представляет собой полученный из плазмы полипептид человеческого фактора IX. В другом аспекте полипептид фактора IX представляет собой рекомбинантный человеческий фактор IX. В одной серии аспектов согласно изобретению фактор IX или родственный фактору IX полипептид представлен в своей активированной форме.
В другом аспекте фактор VII и родственный фактору VII полипептид и фактор IX и родственный фактору IX полипептид представлены в массовом отношении приблизительно между 100:1 и приблизительно 1:100 фактора VII: к фактору IX.
В одном из аспектов родственные фактору VII полипептиды представляют собой варианты аминокислотной последовательности, содержащей не более 20 аминокислотных замен, делеций или инсерций по сравнению с фактором VII дикого типа (т.е. полипептида, описанного в патенте США №4784950). В другом аспекте, варианты фактора VIIa содержат не более чем 15 аминокислотных замен, делеций или инсерций; в другом аспекте, варианты фактора VII содержат не более чем 10 аминокислотных замен, делеций или инсерций; в другом аспекте, варианты фактора VII содержат не более чем 8 аминокислотных замен, делеций или инсерций; в другом аспекте, варианты фактора VII содержат не более чем 6 аминокислотных замен, делеций или инсерций; в другом аспекте, варианты фактора VII содержат не более чем 5 аминокислотных замен, делеций или инсерций; в другом аспекте, варианты фактора VII содержат не более чем 3 аминокислотные замены, делеции или инсерции по сравнению с фактором VII дикого типа. В одном из аспектов, варианты фактора VII выбраны из списка L305V-FVIIa, L305V/M306D/D309S-FVIIa, L305I-FVIIa, L305T-FVIIa, F374P-FVIIa, V158T/M298Q-FVIIa, V158D/E296V/M298Q-FVIIa, K337A-FVIIa, M298Q-FVIIa, V158D/M298Q-FVIIa, L305V/K337A-FVIIa, V158D/E296V/M298Q/L305V-FVIIa, V158D/E296V/M298Q/K337A-FVIIa, V158D/E296V/M298Q/L305V/K337A-FVIIa, K157A-FVII, E296V-FVII, E296V/M298Q-FVII, V158D/E296V-FVII, V158D/M298K-FVII и S336G-FVII.
В следующем аспекте полипептиды фактора VII или родственные фактору VII полипептиды имеют повышенную независимую от тканевого фактора активность по сравнению с нативным человеческим фактором VIIa свертывания крови. В следующем аспекте, повышенная активность не сопровождалась изменениями в субстратной специфичности. В другом аспекте согласно изобретению, связывание фактора VII или родственных фактору VII полипептидов с тканевым фактором не должно быть ослабленным, и фактор VII или родственные фактору VII полипептиды должны иметь по меньшей мере активность фактора VIIa дикого типа при связывании с тканевым фактором.
В одном предпочтительном воплощении фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид представляет собой рекомбинантный человеческий фактор VIIa и рекомбинантный человеческий фактор IX.
В одном воплощении сокращается время образования сгустка в крови млекопитающего. В другом воплощении, в крови млекопитающего усиливается гемостаз. В другом воплощении, в крови млекопитающего увеличивается время фибринолиза. В другом воплощении, увеличивается прочность сгустка в крови млекопитающего. В другом воплощении, усиливается образование фибринового сгустка в крови млекопитающего. В одном воплощении, кровь млекопитающего является кровью человека. В другом воплощении, кровь млекопитающего является нормальной кровью; в другом воплощении, кровь млекопитающего является кровью, имеющей нормальный уровень белков-факторов свертывания; в другом воплощении, кровь млекопитающего является кровью, имеющей нормальный уровень фактора IX; в другом воплощении, кровь является нормальной кровью человека; в одном воплощении, кровью является кровь, полученная у субъекта, имеющего нарушенную выработку тромбина. В одном воплощении, кровью является кровь, полученная у субъекта, имеющего дефицит одного или более факторов свертывания; в другом воплощении, кровь является кровью, полученной у субъекта, у которого имеются ингибиторы против одного или более факторов свертывания. В одном воплощении, кровь является кровью, полученной у субъекта, у которого понижена концентрация фибриногена. В одном воплощении, кровь является кровью человека с дефицитом фактора IX.
В одном из воплощений настоящего изобретения фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид являются единственно используемыми гемостатическими агентами. В другом воплощении, фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид являются единственно используемыми активными гемостатическими агентами. В другом воплощении, фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид являются единственно используемыми факторами свертывания. В одном воплощении данного изобретения, фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид являются единственно используемыми активными агентами. Здесь употребление “единственно используемые” агенты или факторы относится к ситуациям, при которых фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид, взятые вместе, являются единственными гемостатическими агентами, активными гемостатическими агентами или факторами свертывания, содержащимися в фармацевтической композиции или наборе, или являются единственными гемостатическими агентами, активными гемостатическими агентами или факторами свертывания, вводимыми пациенту в процессе особого курса лечения, такого, например, как в процессе лечения эпизодического кровотечения. Само собой разумеется, что такие ситуации входят в число случаев, при которых другие применимые гемостатические агенты или факторы свертывания не представлены либо в достаточном количестве, либо с достаточной активностью, так, чтобы значительно повлиять на один или более параметров свертывания.
В другом воплощении фармацевтическая композиция составлена для внутривенного введения. В одном воплощении данного изобретения, композиция дополнительно содержит фармацевтически приемлемый эксципиент.
В одном воплощении данного изобретения композиция представлена в виде единой лекарственной дозы, где единая лекарственная доза содержит оба фактора свертывания. В одном воплощении данного изобретения, композиция представлена в виде набора частей (компонентов), содержащего препарат фактора VII или родственного фактору VII полипептида в качестве первой единичной дозированной лекарственной формы и препарат фактора IX или родственного фактору IX полипептида в качестве второй единичной дозированной лекарственной формы, и содержащего контейнер, в который помещены указанные первая и вторая единичные дозированные лекарственные формы. В одном воплощении, применимые композиция или набор дополнительно содержат инструкции по применению композиции или, соответственно, отдельных компонентов.
В одном воплощении данного изобретения фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид вводятся в виде единой дозированной лекарственной формы. В одном воплощении данного изобретения, фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид вводятся в виде первой единой дозированной лекарственной формы, содержащей препарат фактора VII или родственного фактору VII полипептида, и второй единой дозированной лекарственной формы, содержащей препарат фактора IX или родственного фактору IX полипептида.
В одном воплощении данного изобретения фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид вводятся одновременно. В другом воплощении, фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид вводятся последовательно. В одном воплощении, фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид вводятся друг за другом с интервалом не более чем в 15 минут, предпочтительно – 10, более предпочтительно – 5, более предпочтительно – 2 минуты. В одном воплощении данного изобретения, фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид вводятся один за другим с интервалом вплоть до 2 часов, предпочтительно – от 1 до 2 часов, более предпочтительно – вплоть до 1 часа, более предпочтительно – от 30 минут до 1 часа, более предпочтительно – вплоть до 30 минут, более предпочтительно – от 15 до 30 минут.
В одном воплощении эффективное количество фактора VII или родственного фактору VII полипептида составляет количество приблизительно от 0,05 мг/день приблизительно до 500 мг/день (для субъекта весом 70 кг). В одном воплощении, эффективное количество препарата фактора IX или родственного фактору IX полипептида составляет приблизительно от 0,01 мг/день приблизительно до 500 мг/день (для субъекта весом 70 кг).
В одном воплощении фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид представлены в массовом соотношении приблизительно между 100:1 и приблизительно 1:100 фактора VII: к фактору IX.
В одном воплощении настоящего изобретения фармацевтическая композиция представлена в единой дозированной лекарственной форме и состоит в основном из препарата фактора VII или родственного фактору VII полипептида и препарата фактора IX или родственного фактору IX полипептида и одного или более компонентов, выбранных из списка фармацевтически приемлемых эксципиентов или носителей, стабилизаторов, детергентов, нейтральных солей, антиоксидантов, консервантов и протеиназных ингибиторов.
Еще в одном воплощении субъектом является человек; в другом воплощении, у субъекта имеется нарушение выработки тромбина; в одном воплощении, у субъекта понижена концентрация фибриногена в плазме (например, субъект, многократно подвергавшийся трансфузии); в одном воплощении у субъекта понижена концентрация фактора IX в плазме крови.
В одном воплощении фармацевтическая композиция представлена в виде препарата для лечения человека.
В другом аспекте изобретение связано с применением препарата фактора VII или родственного фактору VII полипептида и препарата фактора IX или родственного фактору IX полипептида для получения лекарственного средства для лечения кровотечений у субъекта, страдающего от синдрома чувствительности к фактору IX.
В другом аспекте изобретение связано с применением препарата фактора VII или родственного фактору VII полипептида и препарата фактора IX или родственного фактору IX полипептида для получения лекарственного средства для лечения кровотечений у субъекта, у которого снижен уровень фактора IX.
В другом аспекте изобретение связано со способом усиления гемостаза у субъекта, страдающего от синдрома чувствительности к фактору IX, по сравнению с тем, когда субъекта лечат фактором IX в качестве единственного белка-фактора свертывания, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными в усилении гемостаза.
В другом аспекте изобретение связано со способом усиления гемостаза у субъекта, у которого снижен уровень фактора IX по сравнению с тем, когда субъекта лечат фактором IX в качестве единственного белка-фактора свертывания, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными в усилении гемостаза.
В другом аспекте изобретение связано со способом усиления образования тромбина у субъекта, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными в усилении образования тромбина.
В другом аспекте изобретение связано со способом усиления образования тромбина у субъекта, страдающего от синдрома чувствительности к фактору IX, по сравнению с тем, когда субъекта лечат фактором IX в качестве единственного белка-фактора свертывания, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества, вместе взятые, являются эффективными в усилении образования тромбина.
В другом аспекте изобретение связано со способом усиления образования тромбина у субъекта, у которого снижен уровень фактора IX по сравнению с тем, когда субъекта лечат фактором IX в качестве единственного белка-фактора свертывания, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными в усилении образования тромбина.
В другом аспекте изобретение связано со способом уменьшения количества введений белка-фактора свертывания, необходимых для достижения гемостаза у субъекта, страдающего от синдрома чувствительности к фактору IX, по сравнению с количеством введений, необходимых, когда фактор IX вводят субъекту в качестве единственного белка-фактора свертывания, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными в снижении количества введений белка-фактора свертывания.
В другом аспекте изобретение связано со способом уменьшения количества введений белка-фактора свертывания, необходимых для достижения гемостаза у субъекта, у которого снижен уровень фактора IX, по сравнению с количеством введений, необходимых, когда фактор IX вводят субъекту в качестве единственного белка-фактора свертывания, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными в снижении количества введений белка-фактора свертывания.
В другом аспекте изобретение связано со способом уменьшения количества вводимого белка-фактора свертывания, необходимого для достижения гемостаза у субъекта, страдающего от синдрома чувствительности к фактору IX, по сравнению с количеством вводимого белка-фактора свертывания, необходимого, когда фактор IX вводят субъекту в качестве единственного белка-фактора свертывания, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными в снижении количества вводимого белка-фактора свертывания крови.
В другом аспекте изобретение связано со способом уменьшения количества вводимого белка-фактора свертывания, необходимого для достижения гемостаза у субъекта, у которого снижен уровень фактора IX, по сравнению с количеством вводимого белка-фактора свертывания, необходимого, когда фактор IX вводят субъекту в качестве единственного белка-фактора свертывания, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными в снижении количества вводимого белка-фактора свертывания крови.
В другом аспекте изобретение связано со способом лечения кровотечений у субъекта, страдающего от синдрома чувствительности к фактору IX, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными при лечении кровотечений.
В другом аспекте изобретение связано со способом лечения кровотечений у субъекта, у которого снижен уровень фактора IX, причем этот способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными при лечении кровотечений.
В одном воплощении у субъекта снижен уровень фактора IX. В другом воплощении, субъект страдает синдромом чувствительности к фактору IX. В одном воплощении, синдромом чувствительности к фактору IX является гемофилия B.
В одном воплощении сниженный уровень фактора IX составляет 90% или ниже по сравнению с нормальным уровнем, в другом воплощении, уровень фактора IX составляет 80% или ниже, в другом воплощении – 50% или ниже, в другом воплощении – 40% или ниже, в другом воплощении – 30% или ниже, в другом воплощении – 20% или ниже, в другом воплощении – 10% или ниже, в другом воплощении – 5% или ниже, в другом воплощении – 2% или ниже. Эти термины могут, соответственно, быть использованы попеременно. В предпочтительном воплощении, уровень фактора IX составляет ниже 30% от нормального уровня.
В другом аспекте изобретение связано со способом лечения кровотечений у субъекта, страдающего синдрома чувствительности к фактору IX, причем способ включает в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида и второго количества препарата фактора IX или родственного фактору IX полипептида, где первое и второе количества вместе взятые являются эффективными при лечении кровотечений.
В одном воплощении фактор VII представляет собой рекомбинантный человеческий фактор VIIa (rFVIIa). В другом воплощении, фактор VIIa представляет собой продукт производства NovoSeven® (Novo Nordisk A/S, Bagsvaerd, Denmark).
В одном воплощении фактор IX представляет собой рекомбинантный человеческий фактор IX (rFIX). В другом воплощении, фактор IX представляет собой продукт BeneFix (AHP/Genetics Institute), Mononine (Aventis), Proplex (Baxter), Bebulin VH (Baxter), FACTEUR IX-LFB (Laboratoire Francais du Fractionnement et des Biotechnologies (LFB)), Immunine (Baxter/Immuno), Octanyne (Octapharma), Octanine F (Octapharma), Mono FIX-VF (CSL), Novact M (Kaketsuken).
В одном воплощении, фармацевтическая композиция составлена для внутривенного введения. В одном воплощении, композиция дополнительно включает в себя фибринолитическую систему, включая, но не ограничиваясь этим, апротинин,  -аминокапроновую кислоту или транексамовую кислоту. -аминокапроновую кислоту или транексамовую кислоту.
СПИСОК ЧЕРТЕЖЕЙ
На чертеже показан эффект ускорения свертывания под действием rFVIIa, в отсутствие и в присутствии FIX.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
У субъектов, которые теряют много крови в связи с операцией или серьезной травмой и которые, таким образом, нуждаются в переливании крови, развиваются более серьезные осложнения, чем у тех, у которых обычно кровотечений не возникает. Однако умеренные кровотечения также могут приводить к осложнениям, если при этом требуется введение человеческой крови или компонентов крови (тромбоцитов, лейкоцитов, полученных из плазмы концентратов для лечения дефектов свертывания, и т.д.), потому что это связано с риском переноса человеческих вирусов (например, вируса гепатита, ВИЧ, парвовирусов или же других, не известных на сегодняшний день, вирусов), а также патогенов невирусной природы. Обширные кровотечения, требующие массивных переливаний крови, могут приводить к развитию недостаточности многих органов, включая недостаточность функции легких и почек. Как только у субъекта начинают развиваться такие серьезные осложнения, запускается каскад явлений с вовлечением целого ряда цитокинов и воспалительных реакций, что исключительно затрудняет любое лечение, зачастую, к сожалению, неэффективное. Следовательно, основная задача в хирургии, а также при лечении серьезных тканевых повреждений связана с тем, чтобы избежать или минимизировать кровотечение. Чтобы избежать или минимизировать столь нежелательные кровотечения, важно обеспечить образование стабильных и твердых гемостатических пробок, которые не очень легко поддаются растворению под действием фибринолитических ферментов. Более того, очень важно обеспечить быстрое и эффективное образование таких пробок или сгустков.
У субъектов с тромбоцитопенией (когда снижается количество или активность тромбоцитов) также ослаблена выработка тромбина, а кроме того, у них имеется дефект стабилизации фибриновых пробок, в результате которого гемостатическая пробка подвергается преждевременной деградации. Кроме того, у субъектов, которые подверглись обширной травме или повреждению органа и которые в результате этого подвергались частым переливаниям крови, зачастую снижено количество тромбоцитов, а также снижены уровни фибриногена, фактора VIII и других белков свертывания крови. У таких субъектов обычно ослаблена (или понижена) выработка тромбина. У таких субъектов, следовательно, имеет место дефективный или менее эффективный гемостаз, что приводит к образованию фибриновых пробок, которые легко, еще до их созревания, растворяются под действием протеолитических ферментов, вдобавок такие ферменты в ситуациях, связанных с обширной травмой или поражением органа, высвобождаются в больших количествах.
Пациент, перенесший обширную потерю крови, становится клинически нестабильным. У таких пациентов существует риск возникновения фибрилляции предсердий, которая может привести к фатальной остановке сердечной активности; ослаблению почечной функции или транссудации жидкости из сосудов в ткань легких (так называемые “влажные легкие”, или респираторный дистресс-синдром у взрослых (ARDS)).
Кровотечения в тканях могут приводить также к гематомам. Размеры гематом (в частности, интеркраниальной и спинальной) тесно связаны со степенью утраты нейрологической функции, трудностями реабилитации и/или тяжестью и степенью постоянного ухудшения неврологической функции после реабилитации. Наиболее тяжелые последствия гематом прослеживаются в тех случаях, когда они локализованы в мозге, и в этом случае они могут даже привести к гибели пациента. Так называемый компартментный синдром представляет собой клиническое состояние, вызванное тяжелым внутренним кровотечением в конечность. В руках и ногах мышцы и кости внешне окружены почти неэластичным коллагеновым слоем, называемым фасцией. Кровотечение в пространство, окруженное фасцией, приводит к повышению давления в этом компартменте, а следовательно, увеличивается давление на нервные, сосудистые и мышечные ткани, что вызывает в результате, если не приняты срочные меры, обширный некроз ткани. При образовании некроза некротическая ткань в значительной степени, благодаря процессам заживления, будет перенесена в соединительную ткань, которая укорочена (сокращена) по сравнению с исходной мышечной тканью. Такие контрактуры приводят к тому, что субъект вынужденно ограничивает подвижность поврежденных суставов, что, в свою очередь, вновь приводит к необходимости хирургической коррекции. Тяжелые гематомы могут привести затем к образованию псевдо-цист, которые могут уподобляться доброкачественным опухолям, в которых такие цисты, наподобие опухолей, эродируют поврежденную мышечную или костную ткани. И вновь возникает необходимость операции по удалению таких псевдоцист.
Кроме того, образование гематом повышает частоту возникновения инфекций у субъекта. К этому же результату может привести и инфузия компонентов крови, таких как эритроциты. Инфузии эритроцитов приводят к риску образования антител у субъекта. Когда у субъекта возникают антитела против компонентов крови, очень осложняется задача трансфузии у этого пациента, поскольку становится все труднее подобрать соответствующие типы крови.
Таким образом, главные задачи при лечении кровотечений сводятся к достижению гемостаза в течение минимально возможного промежутка времени, таким образом сводя к минимуму кровопотери.
Таким образом, настоящее изобретение обеспечивает благотворные композиции, применения и способы лечения для устранения эпизодов кровотечения у субъектов, в случае необходимости такого лечения. Такие композиции, применения и способы могут быть ассоциированы с благотворными эффектами, такими как уменьшение кровопотерь перед достижением гемостаза, уменьшение кровопотерь во время операций, поддержание кровяного давления на приемлемом уровне, пока не будет достигнуто состояние гемостаза, более быстрая стабилизация кровяного давления, укорочение времени восстановления больного, подвергаемого лечению, укорочение времени реабилитации больного, подвергаемого лечению, сокращение образования гематом или образование гематом меньшего размера, включая гематомы в мозге, снижение образования псевдоцист, снижение образования мышечных контрактур, более быстрая остановка кровотечений, снижение количества инъекций, необходимых для остановки кровотечения и достижения гемостаза, снижение количества свертывающего белка, используемого для остановки кровотечения и достижения гемостаза.
Введение препарата фактора VII или родственного фактору VII полипептида, например, фактора VIIa, в комбинации с препаратом фактора IX или родственного фактору IX полипептида, обеспечивает уменьшение времени свертывания крови по сравнению со временем свертывания, когда либо фактор VIIa, либо фактор IX назначаются отдельно.
Введение препарата фактора VII или родственного фактору VII полипептида, например, фактора VIIa, в комбинации с препаратом фактора IX или родственного фактору IX полипептида, обеспечивает также снижение общего количества фактора свертывания крови, применяемого для остановки кровотечения и достижения гемостаза у субъекта, в случае необходимости такого лечения, по сравнению с количеством белка, применяемого когда либо фактор VIIa, либо фактор IX назначаются отдельно.
Введение препарата фактора VII или родственного фактору VII полипептида, например, фактора VIIa, в комбинации с препаратом фактора IX или родственного фактору IX полипептида, обеспечивает также сокращение времени достижения остановки кровотечения и сокращение количества инъекций для достижения гемостаза по сравнению с ситуацией, когда либо фактор VIIa, либо фактор IX назначаются отдельно. Введение препарата фактора VII или родственного фактору VII полипептида, например, фактора VIIa, в комбинации с препаратом фактора IX или родственного фактору IX полипептида, обеспечивает также сокращение числа инъекций для обеспечения полного гемостаза по сравнению с ситуацией, когда либо фактор IX, либо фактор VIIa вводятся отдельно.
Пациентам, страдающим гемофилией B, настоящее изобретение обеспечивает благоприятный эффект при одновременном или последовательном введении доз препарата фактора IX или родственного фактору IX полипептида и препарата фактора VII или родственного фактору VII полипептида. Как замещение фактора свертывания IX, так и препарат фактора VII или родственного фактору VII полипептида индуцируют остановку кровотечения у этих групп пациентов, но имеют различные биохимические механизмы действия. Одновременное введение повышает гемостатический эффект.
Настоящее изобретение обеспечивает фармацевтическую композицию, включающую в себя комбинацию препарата фактора VII или родственного фактору VII полипептида и препарата фактора IX или родственного фактору IX полипептида. Композиция может быть составлена в виде одноразовой композиции или в виде многокомпонентного набора (набора из частей). Композиция согласно изобретению применима в качестве терапевтического и профилактического прокоагулянта у млекопитающих, включая приматов и человека. Кроме того, настоящее изобретение обеспечивает способ лечения (включая профилактическое лечение или предотвращение) эпизодов кровотечения у субъекта, включая человека.
Где бы в настоящем описании ни указывалось первое или второе, или третье и т.д. введение лекарственной дозы, имеется в виду не предпочтительный порядок введения, а скорее упомянуто из соображений удобства изложения.
Комбинация препарата фактора VII или родственного фактору VII полипептида и препарата фактора IX или родственного фактору IX полипептида представляет собой благоприятный продукт, обеспечивающий уменьшение времени свертывания и быстрое образование гемостатических пробок. Авторами данного изобретения будет показано, что комбинация фактора VII и фактора IX может более эффективно сократить время свертывания крови нормальной плазмы человека, чем фактор VIIa или фактор IX отдельно. Таким образом, укорачивая время свертывания, можно добиться более эффективного лечения кровотечений у субъектов. Более того, пациентов можно лечить более низкими суммарными количествами фактора VII и фактора IX или родственных фактору IX полипептидов.
Полипептиды фактора VII.
При практическом использовании настоящего изобретения можно использовать любой полипептид фактора VII, который эффективен в предотвращении или лечении кровотечения. Это включает в себя полипептиды фактора VII, полученные из крови или плазмы или полученные рекомбинантным способом.
Настоящее изобретение охватывает полипептиды фактора VII, такие, например, как те, которые имеют аминокислотную последовательность, описанную в патенте США №4784950 (человеческий фактор VII дикого типа). В некоторых воплощениях, полипептид фактора VII представляет собой человеческий фактор VIIa, как описано, например, в патенте США №4784950 (фактор VII дикого типа). В одной серии воплощений, полипептиды фактора VII включают в себя полипептиды, которые проявляют по меньшей мере приблизительно 10%, предпочтительно по меньшей мере приблизительно 30%, более предпочтительно по меньшей мере приблизительно 50%, и наиболее предпочтительно по меньшей мере приблизительно 70% специфической биологической активности человеческого фактора VIIa. В одной серии воплощений, полипептиды фактора VII включают в себя полипептиды, которые проявляют по меньшей мере приблизительно 90%, предпочтительно по меньшей мере приблизительно 100%, предпочтительно по меньшей мере приблизительно 120%, более предпочтительно по меньшей мере приблизительно 140%, и наиболее предпочтительно по меньшей мере приблизительно 160% специфической биологической активности человеческого фактора VIIa. В одной серии воплощений, полипептиды фактора VII включают в себя полипептиды, которые проявляют по меньшей мере приблизительно 70%, предпочтительно по меньшей мере приблизительно 80%, более предпочтительно по меньшей мере приблизительно 90%, и наиболее предпочтительно по меньшей мере приблизительно 95% идентичности с последовательностью фактора VII дикого типа, как описано в патенте США №4784950.
В настоящем описании термин “полипептид фактора VII” охватывает, не ограничиваясь этим, полипептиды фактора VII, а также родственные фактору VII полипептиды. Термин “фактор VII” подразумевает, не ограничиваясь этим, полипептиды, имеющие аминокислотную последовательность 1-406 человеческого фактора VII дикого типа (как описано в патенте США №4784950), а также фактора VII дикого типа, полученного у других видов, такого, например, как фактор VII быка, свиньи, собаки, мыши и лосося, причем указанный фактор VII получен из крови или плазмы, или же получен рекомбинантным путем. Он дополнительно охватывает природные аллельные варианты фактора VII, которые могут существовать и появляться у того или иного индивидуума. Также степень и локализация гликозилирования или других посттрансляционных модификаций может варьировать, в зависимости от выбора клеток хозяина и природы окружения хозяйских клеток. Под термином “Фактор VII” также подразумевается охват полипептидов фактора VII в их нерасщепленной форме (форме зимогена), а также тех полипептидов, которые подверглись протеолитическому процессингу, чтобы в результате образовались их соответствующие биологически активные формы, которые могут быть охарактеризованы как фактор VIIa. Обычно фактор VII расщепляется между остатками 152 и 153, образуя в результате фактор VIIa.
“Родственные фактору VII полипептиды” включают в себя, не ограничиваясь этим, полипептиды фактора VII, которые либо химически модифицированы по сравнению с человеческим фактором VII и/или содержат одно или более изменений в аминокислотной последовательности по сравнению с человеческим фактором VII (т.е. варианты фактора VII), и/или содержат усеченные аминокислотные последовательности по сравнению с человеческим фактором VII (т.е. фрагменты фактора VII). Такие родственные фактору VII полипептиды могут проявлять свойства, сходные со свойствами человеческого фактора VII, включая стабильность, фосфолипидное связывание, измененную специфическую активность и тому подобное. Термин “родственные фактору VII полипептиды” предназначен для обозначения таких полипептидов в их нерасщепленной форме (форме зимогена), а также тех полипептидов, которые подверглись протеолитическому процессингу, и в результате получены их соответствующие биологически активные формы, которые могут быть обозначены как “родственные фактору VIIa полипептиды” или “активированные родственные фактору VII полипептиды”.
Здесь термин “родственные фактору VII полипептиды” охватывает, не ограничиваясь этим, полипептиды, проявляющие по существу такую же или улучшенную биологическую активность по сравнению с человеческим фактором VII дикого типа, а также полипептиды, в которых биологическая активность фактора VIIa существенно модифицирована или снижена по сравнению с активностью человеческого фактора VIIa дикого типа. Эти полипептиды включают в себя, не ограничиваясь этим, фактор VII или фактор VIIa, который был химически модифицирован, и варианты фактора VII, в аминокислотные последовательности которого были внесены специфические изменения, которые модифицируют или нарушают биологическую активность полипептида.
Кроме того, он охватывает полипептиды со слегка модифицированной аминокислотной последовательностью, например, полипептиды, имеющие модифицированный N-конец, включая N-концевые аминокислотные делеции или добавки, и/или полипептиды, которые были химически модифицированы по сравнению с человеческим фактором VIIa.
Родственные фактору VII полипептиды, включая варианты фактора VII, независимо от того, проявляет ли он по существу такую же или улучшенную биологическую активность, чем фактор VII дикого типа, или, альтернативно, проявляет существенно модифицированную или сниженную биологическую активность по сравнению с фактором VII, включают в себя, не ограничиваясь этим, полипептиды, имеющие аминокислотную последовательность, которая отличается от последовательности фактора VII дикого типа вставкой, делецией или заменой одной или более аминокислот.
Родственные фактору VII полипептиды, включая варианты, охватывают такие полипептиды, которые проявляют по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 100%, по меньшей мере приблизительно 110%, по меньшей мере приблизительно 120% или по меньшей мере приблизительно 130% специфической активности фактора VIIa дикого типа, которая была продуцирована тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, как описано выше.
Родственные фактору VII полипептиды, включая варианты, имеющие по существу такую же или улучшенную биологическую активность по сравнению с фактором VIIa дикого типа, охватывают такие полипептиды, которые проявляют по меньшей мере приблизительно 25%, предпочтительно по меньшей мере приблизительно 50%, более предпочтительно по меньшей мере приблизительно 75%, более предпочтительно по меньшей мере приблизительно 100%, более предпочтительно по меньшей мере приблизительно 110%, более предпочтительно по меньшей мере приблизительно 120%, и наиболее предпочтительно по меньшей мере приблизительно 130% специфической активности фактора VIIa дикого типа, которая была продуцирована тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, как описано выше.
Родственные фактору VII полипептиды, включая варианты, имеющие существенно редуцированную биологическую активность по сравнению с фактором VIIa дикого типа, являются такими полипептидами, которые проявляют менее чем приблизительно 25%, предпочтительно менее чем приблизительно 10%, более предпочтительно менее чем приблизительно 5% и наиболее предпочтительно менее чем приблизительно 1% специфической активности фактора VIIa дикого типа, которая была продуцирована тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, как описано выше. Варианты фактора VII, имеющие существенно модифицированную биологическую активность по сравнению с фактором VII дикого типа, включают в себя, не ограничиваясь этим, варианты фактора VII, которые проявляют TF-независимую протеолитическую активность фактора X, а также такие варианты, которые связывают TF, но не расщепляют фактор X.
В некоторых воплощениях, полипептиды фактора VII представляют собой родственные фактору VII полипептиды, в частности, варианты, где соотношение между активностью полипептида указанного фактора VII и активностью нативного человеческого фактора VIIa (FVIIa дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании методом “гидролиза In Vitro” (см. “Анализы”, ниже); в других воплощениях, это соотношение составляет по меньшей мере приблизительно 2,0; в иных дополнительных воплощениях, это соотношение составляет по меньшей мере приблизительно 4,0. В некоторых воплощениях согласно изобретению, полипептиды фактора VII представляют собой родственные фактору VII полипептиды, в частности, варианты, где соотношение между активностью полипептида указанного фактора VII и активностью нативного человеческого фактора VIIa (FVIIa дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании методом “протеолиза in Vitro” (см. “Анализы”, ниже); в других воплощениях, соотношение составляет по меньшей мере приблизительно 2,0; в дальнейших воплощениях, соотношение составляет по меньшей мере приблизительно 4,0; в дальнейших воплощениях, соотношение составляет по меньшей мере приблизительно 8,0.
В некоторых воплощениях, полипептид фактора VII представляет собой человеческий фактор VII, как описано, например, в патенте США №4784950 (фактор VII дикого типа). В некоторых воплощениях, полипептид фактора VII представляет собой человеческий фактор VIIa. В одной серии воплощений, полипептиды фактора VII представляют собой родственные фактору VII полипептиды, которые проявляют по меньшей мере приблизительно 10%, предпочтительно по меньшей мере приблизительно 30%, более предпочтительно по меньшей мере приблизительно 50%, и наиболее предпочтительно по меньшей мере приблизительно 70% специфической биологической активности человеческого фактора VIIa. В некоторых воплощениях, полипептиды фактора VII имеют аминокислотную последовательность, которая отличается от последовательности фактора VII дикого типа включением, делецией или заменой одной или более аминокислот.
Неограничивающие примеры вариантов фактора VII, имеющих по существу такую же самую или улучшенную биологическую активность, что и фактор VII дикого типа, включают в себя S52A-FVII, S60A-FVII (lino et al., Arch. Biochem. Biophys. 352: 182-192, 1998); L305V-FVII, L305V/M306D/D309S-FVII, L305I-FVII, L305T-FVII, F374P-FVII, V158T/M298Q-FVII, V158D/E296V/M298Q-FVII, K337A-FVII, M298Q-FVII, V158D/M298Q-FVII, L305V/K337A-FVII, V158D/E296V/M298Q/L305V-FVII, V158D/E296V/M298Q/K337A-FVII, V158D/E296V/M298Q/L305V/K337A-FVII, K157A-FVII, E296V-FVII, E296V/M298Q-FVII, V158D/E296V-FVII, V158D/M298K-FVII и S336G-FVII; варианты FVIIa, проявляющие повышенную протеолитическую стабильность, как описано в патенте США №5580560; фактор VIIa, который протеолитически расщеплен между остатками 290 и 291 или между остатками 315 и 316 (Mollerup et al., Biotechnol. Bioeng. 48:501-505, 1995); и окисленные формы фактора VIIa (Kornfelt et al., Arch. Biochem. Biophys. 363:43-54, 1999). Неограничивающие примеры вариантов фактора VII, имеющих существенно редуцированную или модифицированную биологическую активность по сравнению с фактором VII дикого типа, включают в себя R152E-FVIIa (Wildgoose et al., Biochem 29:3413-3420, 1990), S344A-FVlla (Kazama et al., J. Biol. Chem. 270:66-72, 1995), FFR-FVlla (Holst et al., Eur. J. Vasc. Endovasc. Surg. 15:515-520, 1998) и фактор VIIa, лишенный домена Gla (Nicolaisen et al., FEBS Letts. 317:245-249, 1993). Неограничивающие примеры химически модифицированных полипептидов фактора VII и варианты последовательностей описаны, например, в патенте США №5997864.
Биологическая активность фактора VIIa в свертывании крови связана с его способностью (i) связываться с тканевым фактором (TF) и (ii) катализировать протеолитическое расщепление фактора IX или фактора X с получением активированного фактора IX или X (фактор IXa или Xa, соответственно).
Для целей настоящего изобретения, биологическая активность полипептидов фактора VII (“биологическая активность фактора VII”) может быть количественно оценена путем измерения способности препарата запускать процесс свертывания крови с использованием плазмы, дефицитной по фактору VII, и тромбопластина, как описано, например, в патенте США №5997864. В этом анализе биологическую активность выражают как уменьшение времени свертывания по сравнению с контрольным образцом и преобразуют в “единицы фактора VII” путем сравнения с объединенным стандартом сыворотки человека, содержащим 1 ед./мл активности фактора VII. Альтернативно, биологическая активность фактора VIIa может быть количественно оценена путем
(i) измерения способности фактора VIIa или родственного фактору VIIa полипептида продуцировать активированный фактор X (фактор Xa) в системе, содержащей тканевый фактор (TF), встроенный в липидную мембрану, и фактор X. (Persson et al., J. Biol. Chem. 272:19919-19924, 1997);
(ii) измерения гидролиза фактора X в водной системе (“анализ протеолиза in Vitro”, см. ниже);
(iii) измерения физического связывания фактора VIIa или родственного фактору VIIa полипептида с тканевым фактором с использованием аппарата, работающего на основе поверхностного плазмонного резонанса (Persson, FEBS Letts. 413:359-363, 1997); и
(iv) измерение гидролиза искусственного субстрата под действием фактора VIIa и/или родственного фактору VIIa полипептида (“анализ гидролиза in Vitro”, см. ниже); и
(v) измерение выработки тромбина в TF-независимой системе in vitro.
Под термином “биологическая активность фактора VII”, или “активность фактора VII” подразумевается способность вырабатывать тромбин; этот термин также подразумевает выработку тромбина на поверхности активированных тромбоцитов в отсутствие тканевого фактора.
Препаратом фактора VIIa, который может быть использован согласно изобретению, не ограничиваясь этим, является препарат, продуцируемый фирмой NovoSeven® (Novo Nordisk A/S, Bagsvaerd, Denmark).
Полипептиды фактора IX.
Настоящее изобретение включает в себя полипептиды фактора IX, такие, например, как полипептиды, имеющие аминокислотную последовательность, описанную, например, в публикации Jaye et al., Nucleic Acids Res. 11:2325-2335, 1983 (человеческий фактор IX дикого типа).
Фактически в связи с настоящим изобретением может быть использован любой полипептид фактора IX, который является эффективным в предотвращении или лечении кровотечения. Сюда входят полипептиды фактора IX, полученные из крови или плазмы или же полученные рекомбинантным путем.
Здесь под “полипептидом фактора IX” подразумевается, не ограничиваясь этим, фактор IX, а также родственные фактору IX полипептиды. Термин “фактор IX” включает в себя, не ограничиваясь этим, полипептиды, имеющие аминокислотную последовательность, описанную в публикации Jaye et al., Nucleic Acids Res. 1983 (см. выше) (человеческий фактор IX дикого типа), а также фактор IX дикого типа, полученный у других видов, такой, например, как фактор IX быка, свиньи, собаки, мыши и лосося. Кроме того, он включает в себя природные аллельные варианты фактора IX, которые могут существовать и возникать у того или иного индивидуума. Также степень и локализация гликозилирования или другие посттрансляционные модификации могут варьировать в зависимости от выбора клеток хозяина и природы окружения хозяйских клеток. Под термином “Фактор IX” также подразумевается охват полипептидов фактора IX в их нерасщепленной форме (форме зимогена), а также тех полипептидов, которые подверглись протеолитическому процессингу, с образованием в результате их соответствующих биологически активных форм, которые могут быть охарактеризованы как фактор IXa.
“Родственные фактору IX полипептиды” включают в себя, не ограничиваясь этим, полипептиды фактора IX, которые либо химически модифицированы по сравнению с человеческим фактором IX и/или содержат одно или более изменений в аминокислотной последовательности по сравнению с человеческим фактором IX (т.е. варианты фактора IX), и/или содержат усеченные аминокислотные последовательности по сравнению с человеческим фактором IX (т.е. фрагменты фактора IX). Такие родственные фактору IX полипептиды могут проявлять свойства, сходные со свойствами человеческого фактора IX, включая стабильность, фосфолипидное связывание, измененную специфическую активность и тому подобное. Термин “родственные фактору IX полипептиды” предназначен для обозначения таких полипептидов в их нерасщепленной форме (форме зимогена), а также тех полипептидов, которые подверглись протеолитическому процессингу, и в результате получены их соответствующие биологически активные формы, которые могут быть обозначены как “родственные фактору IXa полипептиды” или “активированные родственные фактору IX полипептиды”.
Здесь термин “родственные фактору IX полипептиды” охватывает, не ограничиваясь этим, полипептиды, проявляющие по существу такую же или улучшенную биологическую активность по сравнению с человеческим фактором IX дикого типа, а также полипептиды, в которых биологическая активность фактора IX существенно модифицирована или снижена по сравнению с активностью человеческого фактора IX дикого типа. Эти полипептиды включают в себя, не ограничиваясь этим, фактор IX или фактор IXa, который был химически модифицирован, и варианты фактора IX, в аминокислотные последовательности которого были внесены специфические изменения, которые модифицируют или нарушают биологическую активность полипептида.
Кроме того, он охватывает полипептиды со слегка модифицированной аминокислотной последовательностью, например, полипептиды, имеющие модифицированный N-конец, включая N-концевые аминокислотные делеции или добавки, и/или полипептиды, которые были химически модифицированы по сравнению с человеческим фактором IX.
Родственные фактору IX полипептиды, включая варианты фактора IX, независимо от того, проявляет ли он по существу такую же или улучшенную биологическую активность, чем фактор IX дикого типа, или, альтернативно, проявляет существенно модифицированную или сниженную биологическую активность по сравнению с фактором IX, включают в себя, не ограничиваясь этим, полипептиды, имеющие аминокислотную последовательность, которая отличается от последовательности фактора IX дикого типа вставкой, делецией или заменой одной или более аминокислот.
Родственные фактору IX полипептиды, включая варианты, охватывают такие полипептиды, которые проявляют по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 100%, по меньшей мере приблизительно 110%, по меньшей мере приблизительно 120% и по меньшей мере приблизительно 130% специфической активности фактора IX дикого типа, которая была продуцирована тем же самым типом клеток при тестировании в анализе активности фактора IX, как описано в настоящей заявке.
Родственные фактору IX полипептиды, включая варианты, имеющие по существу такую же или улучшенную биологическую активность по сравнению с фактором IX дикого типа, охватывают такие полипептиды, которые проявляют по меньшей мере приблизительно 25%, предпочтительно по меньшей мере приблизительно 50%, более предпочтительно по меньшей мере приблизительно 75%, более предпочтительно по меньшей мере приблизительно 100%, более предпочтительно по меньшей мере приблизительно 110%, более предпочтительно по меньшей мере приблизительно 120%, и наиболее предпочтительно по меньшей мере приблизительно 130% специфической активности человеческого фактора IX дикого типа, которая была продуцирована в том же самом типе клеток при тестировании в одном или более анализах специфической активности фактора IX, как описано выше. В целях, связанных с настоящим изобретением, биологическая активность фактора IX может быть количественно определена, как описано ниже в настоящем описании (в разделе «анализы»).
Родственные фактору IX полипептиды, включая варианты, имеющие существенно редуцированную биологическую активность по сравнению с фактором IX дикого типа, являются такими полипептидами, которые проявляют менее чем приблизительно 25%, предпочтительно менее чем приблизительно 10%, более предпочтительно менее чем приблизительно 5% и наиболее предпочтительно менее чем приблизительно 1% специфической активности фактора IX дикого типа, которая была продуцирована в клетках того же типа при тестировании в одном или более анализах специфической активности фактора IX, как описано выше.
Неограничивающие примеры полипептидов фактора IX включают в себя полученный из плазмы человеческий фактор IX, как описано, например, у Chandra et al., Biochem. Biophys. Acta 1973, 328:456; Andersson et al., Thromb. Res. 1975, 7:451; Suomela et al., Eur. J. Biochem. 1976, 71:145.
В некоторых воплощениях полипептиды фактора IX представляют собой родственные фактору IX полипептиды, причем соотношение между активностью полипептида указанного фактора IX и активностью нативного человеческого фактора IX (фактор IX дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании методом “хромогенного анализа” (см. ниже); в других воплощениях, это соотношение составляет по меньшей мере приблизительно 2,0; в иных дополнительных воплощениях, это соотношение составляет по меньшей мере приблизительно 4,0.
Коммерчески доступные продукты фактора IX (так называемые заместительные продукты) получены из объединенной нормальной плазмы или полученных с помощью методов генной инженерии линий клеток млекопитающих. Заместительные продукты часто классифицируют в соответствии с их конечной чистотой, определяемой как специфическая активность (международные единицы активности фактора свертывания на мг белка, МЕ/мг). Промежуточные продукты имеют относительно низкую специфическую активность(<50 МЕ/мг), потому что они содержат также и посторонние белки плазмы, такие как фибриноген, фибронектин и другие некоагулянтные белки. Высокая степень чистоты (>50 МЕ/мг) и сверхвысокая степень чистоты (>160 МЕ/мг) соответствуют очень низкому содержанию примесей других белков плазмы или их отсутствию, кроме альбумина, который добавляют в качестве стабилизатора.
Неограничивающими примерами коммерчески доступных продуктов фактора IX (концентратов и препаратов), которые могут быть использованы согласно изобретению, являются, например, не ограничиваясь перечисленным, BeneFix (rFIX) из AHP/Института Генетики, Mononine (FIX) фирмы Aventis, Proplex (FIX complex) фирмы Baxter, Bebulin VH (FIX complex) фирмы Baxter, FACTEUR IX-LFB (FIX на основе плазмы человека), оба из которых можно получить из Французской Лаборатории по фракционированию и биотехнологиям (LFB), Immunine (Baxter/Immuno), Octanyne (Octapharma), Octanine F (Octapharma), Mono FIX-VF (CSL), Novact M (Kaketsuken).
Неограничивающими примерами продуктов с высокой активностью и сверхвысокой активностью являются иммунин (Immunine) (Baxter/Immuno), Октанин (Octanyne) (Octapharma), Октанин F (Octapharma), Mono FIX-VF (CSL) (все с высокой активностью); BeneFix (AHP/Genetics Institute), Мононин (Mononine)(Aventis), Novact M (Kaketsuken) (все со сверхвысокой активностью).
Определения.
В тексте настоящего описания трехбуквенные или однобуквенные обозначения аминокислот используются в их обычном значении, как указано в таблице 1. Если особо не оговорено, под указанными здесь аминокислотами подразумеваются L-аминокислоты. Следует понимать, что первая буква, например, в K337 означает аминокислоту, природно находящуюся в указанном положении фактора VII дикого типа, и что, например, K337A-FVIIa означает вариант FVII, где аминокислота, представленная в однобуквенном коде как K и природно находящаяся в указанном положении, заменена аминокислотой, представленной в однобуквенном коде как A.
Таблица 1
Краткие обозначения аминокислот: |
| Аминокислота |
Трехбуквенный код |
Однобуквенный код |
| Глицин |
Gly |
G |
| Пролин |
Pro |
P |
| Аланин |
Ala |
A |
| Валин |
Val |
V |
| Лейцин |
Leu |
L |
| Изолейцин |
Ile |
I |
| Метионин |
Met |
M |
| Цистеин |
Cys |
C |
| Фенилаланин |
Phe |
F |
| Тирозин |
Tyr |
Y |
| Триптофан |
Trp |
W |
| Гистидин |
His |
H |
| Лизин |
Lys |
K |
| Аргинин |
Arg |
R |
| Глутамин |
Gln |
Q |
| Аспарагин |
Asn |
N |
| Глутаминовая кислота |
Glu |
E |
| Аспарагиновая кислота |
Asp |
D |
Термины “фактор VII”, “Фактор VII” или “FVII” могут быть использованы взаимозаменяемым образом. Термины “фактор VIIa”, “Фактор VIIa” или “FVIIa” могут быть использованы взаимозаменяемым образом. Термины “фактор IX”, “Фактор IX ” или “FIX ” могут быть использованы взаимозаменяемым образом.
В данном контексте под термином “субъекты с ослабленной выработкой тромбина” подразумеваются субъекты, у которых не генерируется полный выброс тромбина (full thrombin burst) на поверхности активированных тромбоцитов; он включает в себя субъектов, у которых выработка тромбина ниже уровня, который достигается у индивидуумов с полноценно функционирующей нормальной системой гемостаза, включая нормальное количество и нормальную функцию факторов свертывания крови, тромбоцитов и фибриногена, а также включает в себя, не ограничиваясь ими, субъектов, у которых отсутствует фактор IX свертывания крови; субъекты с пониженным числом тромбоцитов или имеющие тромбоциты с функциональным дефектом (например, тромбоцитопению или тромбоастению Гланцманна, или субъекты с избыточной кровоточивостью); субъектов, у которых снижены уровни протромбина, FX или FVII; субъектов, у которых снижен уровень содержания нескольких факторов свертывания (например, по причине избыточной кровоточивости в результате травмы или обширной операции); и субъектов, у которых снижены концентрации фибриногена в плазме крови (например, субъекты, перенесшие многократную трансфузию).
Термин “усиление системы гемостаза” означает повышение способности к выработке тромбина. Под термином “усиление гемостаза” подразумеваются ситуации, когда количественно определяемая выработка тромбина в пробе, содержащей препарат фактора VII или родственного фактору VII полипептида и препарат фактора IX или родственного фактору IX полипептида пролонгирована по сравнению с индивидуальной выработкой тромбина в контрольной пробе, содержащей, соответственно, только фактор VII или родственный фактору VII полипептид или фактор IX или родственный фактору IX полипептид, при тестировании одним и тем же способом оценки выработки тромбина. Выработку тромбина можно оценить, как описано в методе анализа выработки тромбина в настоящем описании (см. раздел «анализы»).
Параметры времени растворения тромба (время фибринолиза), прочности сгустка, образования фибринового сгустка и времени свертывания являются клиническими параметрами, используемыми для исследования статуса системы гемостаза пациентов. Образцы крови с соответствующими интервалами отбирают у пациентов, и изучают один или более параметров с помощью, например, тромбоэластографии, как описано, например, в публикациях Meh et al., Blood Coagulation & Fibrinolysis 2001; 12:627-637; Vig et al., Hematology, Vol.6 (3) pp.205-213 (2001); Vig et al., Blood coagulation & fibrinolysis, Vol.12 (7) pp.555-561 (2001) Oct; Glidden et al., Clinical and applied thrombosis/hemostasis, Vol.6 (4) pp.226-233 (2000) Oct; McKenzie et al., Cardiology, Vol.92 (4) pp.240-247 (1999) Apr; or Davis et al., Journal of the American Society of Nephrology, Vol.6 (4) pp.1250-1255 (1995).
Термин “пролонгирование времени растворения сгустка” охватывает ситуации, когда определяемое время растворения сгустка в пробе, содержащей препарат фактора VII или родственного фактору VII полипептида и препарат фактора IX или родственного фактору IX полипептида, пролонгировано по сравнению с индивидуальным временем растворения сгустка в контрольной пробе, содержащей, соответственно, только фактор VII или родственный фактору VII полипептид или фактор IX или родственный фактору IX полипептид, при тестировании одним и тем же методом анализа растворения сгустка. Время растворения сгустка можно оценить, как описано выше.
Под термином “повышение прочности сгустка” подразумеваются ситуации, когда определяемая прочность сгустка, например, механическая прочность, в пробах, содержащих препарат фактора VII или родственного фактору VII полипептида и препарат фактора IX или родственного фактору IX полипептида, повышена по сравнению с индивидуальным временем растворения сгустка в контрольной пробе, содержащей, соответственно, только фактор VII или родственный фактору VII полипептид или фактор IX или родственный фактору IX полипептид, при тестировании одним и тем же методом оценки прочности сгустка. Прочность сгустка можно оценить, как описано, например, у Carr et al, 1991. (Carr ME, Zekert SL. Measurement of platelet-mediated force development during plasma clot formation. AM J MED SCI 1991; 302:13-8), или, как описано выше, с помощью тромбоэластографии.
Под термином “усиление образования фибринового сгустка” подразумеваются ситуации, когда измеряемая скорость или степень формирования фибринового сгустка в тест-пробе, содержащей препарат фактора VII или родственного фактору VII полипептида и препарат фактора IX или родственного фактору IX полипептида, повышена по сравнению с индивидуальной скоростью или степенью формирования фибринового сгустка в контрольной пробе, содержащей, соответственно, только фактор VII или родственный фактору VII полипептид или фактор IX или родственный фактору IX полипептид, при тестировании одним и тем же методом оценки свертывания. Образование фибринового сгустка можно оценить, как описано выше.
Под термином “уменьшение времени свертывания” подразумеваются ситуации, когда измеряемое время образования сгустка (время свертывания) в тест-пробе, содержащей препарат фактора VII или родственного фактору VII полипептида и препарат фактора IX или родственного фактору IX полипептида, повышено по сравнению с индивидуальным временем в контрольной пробе, содержащей, соответственно, только фактор VII или родственный фактору VII полипептид или фактор IX или родственный фактору IX полипептид, при тестировании одним и тем же методом оценки свертывания. Время свертывания может быть оценено с помощью стандартных анализов PT og aPTT, которые известны специалистам в данной области.
Используемый здесь термин “расстройство, связанное с кровотечением” отражает любой врожденный, приобретенный или индуцированный дефект клеточной или молекулярной природы, который проявляется в виде эпизодических кровотечений. Примеры расстройств, связанных с кровотечением, включают в себя, не ограничиваясь этим, дефициты факторов свертывания (например, дефицит факторов VIII, IX, XI или VII), ингибиторы факторов свертывания, дефективную функцию тромбоцитов (например, тромбастения Гланцманна и синдром Бернарда-Сулье), тромбоцитопению, болезнь фон Виллебранда и коагулопатию, такую как коагулопатия, вызванная разбавлением белков свертывания, повышенный фибринолиз и сниженное количество тромбоцитов в результате кровотечений и/или трансфузий (например, у оперированных больных или больных с травмой, подвергавшихся многократным трансфузиям).
Кровотечением является транссудация крови за пределы любого компонента системы циркуляции. Под термином “эпизоды кровотечения” подразумевается нежелательное, неконтролируемое и часто избыточное кровотечение в связи с операцией, травмой или другими формами повреждения тканей, а также нежелательные кровотечения у субъектов с нарушениями, связанными с кровотечениями. Эпизодические кровотечения могут возникать у субъектов, у которых исходно нормальная система свертывания крови, но которые перенесли (временную) коагулопатию, а также у субъектов, у которых имеются наследственные или приобретенные нарушения свертывания или расстройства, связанные с кровотечением. У субъектов, имеющих нарушения функции тромбоцитов, кровотечения могут напоминать кровотечения, вызванные гемофилией, потому что в этих случаях, как и при гемофилии, в системе гемостаза отсутствуют главные «соединения» свертывания, или же они имеют аномальную природу (например, тромбоциты или белок-фактор фон Виллебранда). У субъектов, перенесших обширное повреждение ткани, например, в связи с операцией или обширной травмой, нормальный механизм гемостаза может быть подавлен в результате постоянной востребованности немедленного гемостаза, и у них, несмотря на исходно нормальный механизм гемостаза (предшествующий травме или предшествующий хирургическому воздействию), может развиться избыточная кровоточивость. У таких субъектов, которые затем часто подвергаются многократным трансфузиям, развивается (временно) коагулопатия как результат кровотечения и/или трансфузий (т.e. разбавление коагулирующих белков, повышенный фибринолиз и пониженное количество тромбоцитов в результате кровотечения и/или трансфузий). Кровотечения могут возникать также в органах, таких как мозг, область внутреннего уха, а также в глазу; это – области, в которых возможности хирургического гемостаза ограничены, и, следовательно, достижение удовлетворительного гемостаза в этих случаях является проблематичным. Подобные проблемы могут возникать в процессе отбора проб на биопсию из различных органов (печень, легкое, опухолевая ткань, желудочно-кишечный тракт), а также при лапароскопической хирургии и радикальной заднелобковой простатэктомии. Общим во всех этих ситуациях является проблематичность обеспечения гемостаза с помощью хирургических приемов (наложение швов, зажимов и пр.), в частности, когда кровотечение является диффузным (например, при геморрагическом гастрите и профузном маточном кровотечении). Кровотечения могут также возникать под действием антикоагуляционной терапии у субъектов, у которых дефективный гемостаз индуцирован проводимой терапией; такие кровотечения часто бывают острыми и обширными. Антикоагулянтная терапия часто назначается для предотвращения тромбоэмболического заболевания. Такая терапия может включать в себя гепарин, другие формы протеогликанов, варфарин или другие формы антагонистов витамина K, а также аспирин и другие ингибиторы агрегации тромбоцитов, такие, например, как антитела или другие ингибиторы активности GP ||b/|||a. Под эпизодами кровотечений также подразумеваются, не ограничиваясь ими, неконтролируемое и избыточное кровотечение в связи с операцией или травмой у субъектов, имеющих острый гемартроз (кровотечения в суставы), хроническую гемофилическую артропатию, гематомы (например, мышечную, ретроперитонеальную, подъязычную и ретрофарингеальную), кровотечения в других тканях, гематурию (кровотечение из почечного тракта), церебральную геморрагию, у субъектов при оперативном вмешательстве(например, гепатэктомии), удалении зуба и желудочно-кишечных кровотечениях (например, кровотечениях верхнего отдела желудочно-кишечного тракта). Эпизодические кровотечения могут быть ассоциированы с ингибиторами фактора VIII; гемофилией A; гемофилией A с ингибиторами; гемофилией B; дефицитом фактора VII; дефицитом фактора XI; тромбоцитопенией; дефицитом фактора фон Виллебранда (болезнь фон Виллебранда); тяжелым повреждением ткани; тяжелой травмой; операцией; лапароскопической хирургией; геморрагическим гастритом; отбором биопсийного материала; антикоагулянтной терапией; кровотечениями верхнего отдела желудочно-кишечного тракта (UGI) или трансплантацией стволовых клеток. Эпизодические кровотечения могут быть обширными маточными кровотечениями; кровотечениями, возникающими в органах, в отношении которых ограничены возможности механического гемостаза; кровотечениями, возникающими в мозге; возникающими в области внутреннего уха; или возникающими в глазах. Термины “эпизоды кровотечения” и “кровотечения” могут, соответственно, использоваться как взаимозаменяемые.
В этом контексте термин “лечение” включает в себя как предотвращение возможного кровотечения, такого, например, как кровотечение при хирургическом вмешательстве, так и регуляцию уже возникшего кровотечения, такого, например, как при травме, с целью ингибирования или минимизирования кровотечения. Вышеуказанным “возможным кровотечением” может быть кровотечение, возникновение которого можно ожидать в конкретной ткани или конкретном органе, или это может быть непредусмотренным кровотечением. Профилактическое назначение препарата фактора VII или родственного фактору VII полипептида и препарата фактора IX или родственного фактору IX полипептида является, таким образом, включенным в понятие “лечение”.
Здесь под термином “субъект” подразумевается любое животное, в частности, млекопитающие, такое как человек, и этот термин может, при необходимости, использоваться, наряду с термином “пациент”, взаимозаменяемым образом.
Фактор VII или родственные фактору VII полипептиды и фактор IX или родственные фактору IX полипептиды, как определено в настоящем описании, могут вводиться одновременно или последовательно. Эти факторы могут быть представлены в виде единой лекарственной формы, где единая лекарственная форма содержит оба фактора свертывания, или в виде набора из частей, содержащего препарат фактора VII или родственного фактору VII полипептида в качестве первой лекарственной дозированной формы и препарат фактора IX или родственного фактору IX полипептида в качестве второй дозированной лекарственной формы. Вторая дозированная лекарственная форма может быть представлена в виде продукта с высокой, средней или низкой активностью фактора IX. Предпочтительными являются высокоактивные продукты. Наиболее предпочтительными являются рекомбинантные высокоактивные продукты. В настоящем описании упоминание первой, второй или третьей и т.д. дозированной лекарственной формы относится не к предпочтительной очередности их введения, а скорее сделано из соображений удобства.
Под “одновременной” дозировкой препарата фактора VII или родственного фактору VII полипептида и препарата фактора IX или родственного фактору IX полипептида подразумевается введение белков-факторов свертывания в единой дозированной лекарственной форме или введение первого белка-фактора свертывания, а затем второго белка-фактора свертывания с интервалом между введениями не более чем 15 минут, предпочтительно – 10, более предпочтительно – 5, еще более предпочтительно – 2 минуты. Любой из факторов может быть введен в первую очередь.
Под “последовательной” дозировкой подразумевается введение первого белка-фактора свертывания, а затем второго белка-фактора свертывания с интервалом между введениями вплоть до 2 часов, предпочтительно – от 1 до 2 часов, более предпочтительно – вплоть до 1 часа, еще более предпочтительно – от 30 минут до 1 часа, еще более предпочтительно – вплоть до 30 минут, более предпочтительно – от 15 до 30 минут. Любая из этих двух единичных дозированных лекарственных форм, или белков-факторов свертывания, может быть введена в первую очередь. Предпочтительно, чтобы оба продукта были инъецированы с использованием одного и того же приспособления для внутривенного введения.
Под “уровнем фактора IX” подразумевается уровень активности фактора свертывания IX у больного по сравнению с его уровнем у здоровых субъектов. Этот уровень обозначается как процент от нормального уровня. Эти термины могут быть взаимозаменяемыми при необходимости.
Под “сниженным уровнем фактора IX” подразумевается снижение присутствующего количества или активности фактора IX в кровяном русле по сравнению со средним уровнем фактора IX в популяции субъектов, не имеющих дефицита фактора IX свертывания крови или ингибиторов фактора IX свертывания крови. На основании данных, полученных при очистке этого фактора, выделенного из плазмы крови человека, концентрация фактора IX у нормального взрослого человека составляет приблизительно от 300 до 400 мкг/мл плазмы.
У нормальных здоровых индивидуумов активность фактора IX и уровни антигена варьируют между 50 и 160% от таковой в нормальной объединенной плазме. Клинически уровень циркулирующего фактора IX может быть измерен либо путем оценки коагуляции, либо путем иммунологического анализа. Прокоагулянтная активность фактора IX определяется на основании способности плазмы пациента корректировать время свертывания плазмы, дефицитной по фактору IX (например, в анализе APTT (частичное активированное тромбопластиновое время), см. ниже; см. также раздел «анализы» настоящего описания).
Единица фактора IX определяется как количество фактора IX, находящееся в одном миллилитре нормальной (объединенной) плазмы (соответствующее 100%-му уровню фактора IX).
Единица фактора VII определяется как количество фактора VII, находящееся в одном мл нормальной (объединенной) плазмы, соответствующее приблизительно 0,5 мкг белка. После активации 50 единиц соответствуют приблизительно 1 мкг белка.
Под “дефицитом” подразумевается снижение количества или активности, например, фактора IX в плазме по сравнению с таковыми у нормальных здоровых индивидуумов. Этот термин может, при необходимости, использоваться, наряду с термином “сниженный уровень фактора IX”, как взаимозаменяемые.
Под термином “APTT” или “aPTT” подразумевается частичное активированное тромбопластиновое время (описанное, например, в публикации Proctor RR, Rapaport SI: The partial thromboplastin time with kaolin; a simple screening test for first-stage plasma clotting factor deficiencies. Am J Clin Pathol 36:212, 1961).
Под термином “синдром чувствительности к фактору IX” подразумевается синдром, при котором введение субъекту, в случае необходимости, экзогенного фактора IX может предотвратить, вылечить или улучшить состояние при любых симптомах, состояниях или заболеваниях, предполагаемых или присутствующих, вызванных этим синдромом. В их число входят, не ограничиваясь перечисленными, синдромы, вызванные сниженным уровнем фактора IX, например, нарушения, связанные с кровотечением, такие как перечисленные далее, не ограничиваясь ими, гемофилия B, или синдромы, вызванные ингибиторами фактора IX.
Под термином “синдром чувствительности к фактору VII” подразумевается синдром, при котором введение субъекту, в случае необходимости, экзогенного фактора VII может предотвратить, вылечить или улучшить состояние при любых симптомах, состояниях или заболеваниях, предполагаемых или присутствующих, вызванных этим синдромом. В их число входят, не ограничиваясь перечисленными, синдромы, вызванные сниженным уровнем факторов свертывания VIII, IX, XI или VII, ингибиторами факторов свертывания, дефективной функцией тромбоцитов (например, при тромбастении Гланцманна и синдроме Бернарда-Сулье), тромбоцитопения, болезнь фон Виллебранда и коагулопатия, такая как вызванная разбавлением коагулирующих белков, повышенным фибринолизом и сниженным количеством тромбоцитов в связи с кровотечениями и/или трансфузиями (например, у субъектов, подвергавшихся многократной трансфузии в связи с операцией или травмой).
“Время полужизни” означает время, необходимое для того, чтобы концентрация в плазме фактора VII или родственного фактору VII полипептида или фактора IX или родственного фактору IX полипептида снизилась вдвое по сравнению с конкретным (первоначальным) значением.
Под “первичным гемостазом” подразумевается исходная выработка тромбина под действием FXa и TF:фактор VIIa, последующая активация тромбоцитов и образование рыхлой пробки из активированных, прикрепленных тромбоцитов, которые еще не стабилизированы фибрином, и, наконец, (стабилизированы) поперечно связанным фибрином. Если образовавшаяся пробка не стабилизирована фибрином на втором этапе гемостатического процесса (поддерживаемый гемостаз), она легко подвергается растворению под действием фибринолитической системы.
Под “вторичным гемостазом”, или “поддерживаемым гемостазом” подразумевается вторичный, полный, и главный выброс, или выработка, тромбина, имеющая место на поверхности активированных тромбоцитов и катализируемая фактором IXa и фактором IXa, последующее образование фибрина и стабилизация исходной тромбоцитарной пробки. Стабилизация пробки под действием фибрина приводит к полному гемостазу.
Под “полным гемостазом” подразумевается образование стабильного и твердого фибринового сгустка, или пробки, в сайте повреждения, которая эффективно останавливает кровотечение и которая не подвержена быстрому растворению под действием фибринолитической системы. В данном контексте термин гемостаз будет использован для обозначения полного гемостаза, как описано выше.
В данном описании термин “препарат” фактора свертывания, например фактора IX, означает такой препарат, в котором фактор IX является превалирующим фактором. В одном из аспектов фактор свертывания представлен в препарате в количестве более 20% (в/в) от общего количества белка, более предпочтительно – 30%, более предпочтительно – 40%, более предпочтительно – 50%, более предпочтительно – 60%, более предпочтительно – 70%, более предпочтительно – 80%, более предпочтительно – 90%, более предпочтительно – 95%, более предпочтительно – 98%, более предпочтительно – 99%.
В предпочтительном воплощении, фактор свертывания представлен в количестве более 50% (в/в) от общего количества белка-фактора коагуляции, более предпочтительно – 80%, более предпочтительно – 90%, более предпочтительно – 95%, более предпочтительно – 98%, более предпочтительно – 99%.
Общее количество белка в таком препарате может быть измерено с помощью основных известных способов, например путем измерения оптической плотности. Количество белка-фактора IX свертывания крови может быть измерено общеизвестными методами, такими как стандартный иммуноферментный метод Elisa. В общих словах, такой анализ проводится посредством контактирования раствора препарата, содержащего белок фактора IX с анти-FIX-антителом, иммобилизованным на пластинке elisa, последующего контактирования иммобилизованного комплекса антитело-фактор IX со вторичным анти-FIX-антителом, несущим маркер, количество которого определяется на третьей стадии. Количества каждого из факторов могут быть оценены сходным образом с помощью соответствующих антител. Общее количество белка-фактора свертывания в препарате определяется путем добавления количеств индивидуальных белков-факторов свертывания. В одном из воплощений, препарат содержит выделенный фактор свертывания. В другом воплощении, препарат свободен от фактора свертывания || и фактора свертывания ||a.
В данном контексте термин “выделенный” относится к факторам свертывания, например, фактору IX или родственным фактору IX полипептидам, которые выделены из клеток, в которых они были синтезированы, или из среды, в которой они существуют в природе (например, в плазме или крови). Выделение полипептидов из клеток, из которых они произошли, может быть достигнуто с помощью методов, известных в данной области, включая, но не ограничиваясь ими, метод удаления культуральной среды, содержащей требуемый продукт, из культуры прикрепленных клеток; метод центрифугирования или фильтрации для удаления неприкрепленных клеток; и им подобные. Выделение полипептидов из среды, в которой они образуются в природе, может быть достигнуто рядом методов, известных в данной области, включая, без ограничения ими, аффинную хроматографию, такую, например, как на колонке с антителом против фактора VII или с антителом против фактора IX, соответственно; хроматографию с использованием гидрофобных взаимодействий; ионообменную хроматографию; хроматографию исключенного размера; электрофоретические процедуры (например, препаративное изоэлектрическое фокусирование (IEF)), дифференциальную растворимость (например, осаждение сульфатом аммония) или экстрагирование и т.п.
Обозначения:
| TF |
тканевый фактор |
| FVII |
фактор VII в его одноцепочечной, неактивированной форме |
| FVIIa |
фактор VII в его активированной форме |
| rFVIIa |
рекомбинантный фактор VII в его активированной форме |
| фактор IX |
фактор IX в его зимогенной, неактивированной форме |
| фактор IXa |
фактор IX в его активированной форме |
| rфактор IX |
рекомбинантный фактор IX |
| rфактор IXa |
рекомбинантный фактор Ixa |
Получение соединений.
Человеческий очищенный фактор VIIa, подходящий для использования в настоящем изобретении, предпочтительно получен с помощью технологий рекомбинантной ДНК, например, как описано Hagen et al., Proc. Natl. Acad. Sci. USA 83:2412-2416, 1986, или как описано в Европейском патенте No. 200421 (ZymoGenetics, Inc.).
Фактор VII может быть продуцирован методами, описанными Broze and Majerus, J. Biol. Chem. 255 (4):1242-1247, 1980 and Hedner and Kisiel, J. Clin. lnvest. 71:1836-1841, 1983. Эти методы дают возможность получить фактор VII без заметных количеств других факторов свертывания крови. Еще более очищенный препарат фактора VII можно получить, если дополнительно провести гель-фильтрацию в качестве конечной стадии очистки. Затем фактор VII конвертируют в активированный фактор VIIa с помощью известных приемов, например, с использованием нескольких различных белков плазмы, таких как фактор XIIa, IXa или Xa. Альтернативно, как описано Bjoern et al. (Research Disclosure, 269 September 1986, pp.564-565), фактор VII может быть активирован путем пропускания его через ионообменную хроматографическую колонку, такую как Mono Q® (Pharmacia fine Chemicals) или ей подобные.
Родственные фактору VII полипептиды можно продуцировать путем модификации фактора VII дикого типа или с помощью рекомбинантной технологии. Родственные фактору VII полипептиды с измененной аминокислотной последовательностью, при сравнении с фактором VII дикого типа, могут быть получены путем модификации последовательности нуклеиновой кислоты, кодирующей фактор VII дикого типа, либо путем изменения кодонов, соответствующих аминокислотам, либо путем удаления некоторых из кодонов, соответствующих аминокислотам, в нуклеиновой кислоте, кодирующей фактор VII, известными способами, например, путем сайт-специфического мутагенеза.
Для специалистов будет очевидно, что замены могут быть произведены вне областей, критических для фактора VIIa или молекулы фактора IX, с тем, чтобы активность полипептида сохранилась. Аминокислотные остатки, существенные для активности фактора VII или родственного фактору VII полипептида или фактора IX или родственного фактору IX полипептида, и следовательно, предпочтительно не подлежащие замене, могут быть идентифицированы согласно процедурам, известным в данной области, таким как сайт-направленный мутагенез или аланин-сканирующий мутагенез (см., например, Cunningham and Wells, 1989, Science 244: 1081-1085). В последнем методе мутации вводятся на уровне каждого положительно заряженного остатка в молекуле, и полученные в результате мутантные молекулы тестируются на коагулянтную, в соответствии с перекрестным связыванием, активность для идентификации аминокислотных остатков, которые являются критическими для активности молекулы. Сайты фермент-субстратного взаимодействия могут также быть определены путем анализа трехмерной структуры, определяемой такими методами как ядерный магнитный резонанс, кристаллография или фотоаффинное мечение (см., например, de Vos et al., 1992, Science 255:306-312; Smith et al., 1992, Journal of Molecular Biology 224:899-904; Wlodaver et al., 1992, FEBS Letters 309:59-64).
Введение мутации в последовательность нуклеиновой кислоты с целью замены одного нуклеотида другим нуклеотидом может быть достигнуто путем сайт-направленного мутагенеза при использовании любого из известных в этой связи способов. В частности, применима технология, в которой используется вектор суперскрученной, двухцепочечной ДНК с требуемой вставкой и два синтетических праймера, содержащих требуемую мутацию. Олигонуклеотидные праймеры, каждый из которых комплементарен противоположным цепям вектора, удлиняется (наращивается) в процессе циклизации температуры с помощью ДНК-полимеразы Pfu. При встраивании праймеров вырабатывается мутированная плазмида, содержащая зигзагообразно расположенные однонитевые разрывы. При последующем цикле температуры продукт обрабатывают Dpnl, который специфичен в отношении метилированной и полуметилированной ДНК, для расщепления родительской ДНК-матрицы и селекции синтезированной ДНК, содержащей мутацию. Можно использовать также и другие процедуры, известные в данной области техники, для создания, идентификации и выделения вариантов, такие, например, как перетасовка генов или технология фагового дисплея.
Отделение полипептидов от клеток, из которых они произошли, может быть достигнуто с помощью одного из методов, известных в данной области, включая, без ограничения перечисленным, отделение культуральной среды, содержащей требуемый продукт, от культуры прикрепленных клеток; центрифугирование или фильтрование с целью удаления неприкрепленных клеток; и т.п.
Фактор VII или родственный фактору VII полипептид может быть – необязательно – дополнительно очищен. Очистка может быть достигнута с помощью любого известного в данной области метода, включая, без ограничения перечисленными, аффинную хроматографию, такую, например, как аффинная хроматография на колонке с антителом против фактора VII (см., например, Wakabayashi et al., J. Biol. Chem. 261:11097, 1986; and Thim et al., Biochem. 27:7785, 1988); гидрофобная хроматография; ионообменная хроматография; хроматография исключенного размера; электрофоретические подходы (например, препаративное изоэлектрическое фокусирование (IEF), дифференциальная растворимость (например, осаждение сульфатом аммония) или экстракция и т.п. В общем плане см. Scopes, Protein Purification, Springer-Verlag, New York, 1982; и Protein Purification, J.C.Janson and Lars Ryden, editors, VCH Publishers, New York, 1989. После очистки препарат предпочтительно содержит менее чем приблизительно 10% (по весу), более предпочтительно – менее чем приблизительно 5%, и наиболее предпочтительно – менее чем приблизительно 1% полипептидов, не являющихся фактором VII или не являющихся родственными фактору VII полипептидами из клеток-хозяев.
Фактор VII или родственные фактору VII полипептиды могут быть активированы путем протеолитического расщепления с помощью фактора XIIa или других протеиназ, имеющих трипсиноподобную специфичность, таких, например, как фактор IXa, калликреин, фактор Xa и тромбин. См., например, Osterud et al., Biochem. 11:2853 (1972); Thomas, патент США №4456591; и Hedner et al., J. Clin. Invest. 71:1836 (1983). Альтернативно, фактор VII или родственные фактору VII полипептиды могут быть активированы в результате их пропускания через колонку ионообменной хроматографии, такую как Mono Q® (Pharmacia) или ей подобные. Полученный в результате активированный фактор VII или родственный фактору VII полипептид может быть затем составлен (в композицию) и может быть введен (больному), как описано ниже.
Для применения в рамках настоящего изобретения фактор IX может быть выделен из плазмы в соответствии с известными методиками, такими как методики, описанные, например, в публикациях Chandra et al., Biochem. Biophys. Acta 1973, 328:456; Andersson et al., Thromb. Res. 1975, 7:451; Suomela et al., Eur. J. Biochem. 1976, 71:145. Однако предпочтительно использование рекомбинантного фактора IX, с тем, чтобы избежать применения продуктов, полученных из крови или других тканей, поскольку это связано с риском переноса заболеваний. Очищенный человеческий фактор IX, подходящий для применения в настоящем изобретении, предпочтительно получают с использованием технологий рекомбинантной ДНК, например, как описано в EP 107278 (British Technology Group), US 5171569 (Nat. res. Dev. Corp.), EP 430930 (British Technology Group).
Родственные фактору IX полипептиды могут быть получены путем модификации фактора IX дикого типа или с использованием рекомбинантной технологии. Родственные фактору IX полипептиды с измененной аминокислотной последовательностью по сравнению с фактором IX дикого типа могут быть получены путем модификации последовательности нуклеиновой кислоты, кодирующей фактор IX дикого типа, либо путем изменения аминокислотных кодонов, либо путем удаления некоторых из аминокислотных кодонов в нуклеиновой кислоте, кодирующей природный фактор IX, с помощью известных методов, например, сайт-направленного мутагенеза, как более подробно описано выше. Отделение полипептидов от клеток, из которых они произошли, может быть достигнуто с помощью любого из методов, известных в данной области, включая, без ограничения перечисленным, отделение культуральной среды, содержащей требуемый продукт, от культуры прикрепленных клеток; центрифугирование или фильтрование с целью удаления неприкрепленных клеток; и т.п. Фактор IX или родственный фактору IX полипептид может быть – необязательно – дополнительно очищен. Очистка может быть достигнута с помощью любого известного в данной области метода, включая, без ограничения перечисленными, аффинную хроматографию, такую, например, как аффинная хроматография на колонке с антителом против фактора IX; гидрофобная хроматография; ионообменная хроматография (например, как описано в патенте США 6034222); хроматография исключенного размера; электрофоретические методы (например, препаративное изоэлектрическое фокусирование (IEF), дифференциальная растворимость (например, осаждение сульфатом аммония) или экстракция и т.п., как более подробно описано выше. После очистки препарат предпочтительно содержит менее чем приблизительно 10% (по весу), более предпочтительно – менее чем приблизительно 5%, и наиболее предпочтительно – менее чем приблизительно 1% полипептидов, не являющихся фактором IX или не являющихся родственными фактору IX полипептидами из клеток-хозяев. Полученный в результате активированный фактор IX или родственный фактору IX полипептид может быть затем составлен (в композицию) и может быть введен (больному), как описано ниже.
Специалистам в данной области должно быть очевидно, что предпочтительным является применение полипептидов фактора IX и родственных фактору IX полипептидов, сингенных субъекту, с тем, чтобы уменьшить риск индуцирования иммунного ответа. Способ получения и свойства фактора IX нечеловеческой природы описан, например, Fujikawa et al., Biochemistry 1973, 12:4938 (бычий FIX). Настоящее изобретение также связано с применением таких полипептидов фактора IX и полипептидов фактора VII в ветеринарной практике.
Фармацевтические композиции и способы применения
Препараты согласно изобретению могут быть использованы для лечения любого синдрома чувствительности к фактору IX, такого, например, как нарушения, связанные с кровотечениями, включая, но не ограничиваясь перечисленным, нарушения, вызванные дефицитами факторов свертывания (например, гемофилия B), или вызванные ингибиторами (низким или средним титром) фактора IX.
Препараты согласно изобретению могут быть использованы для лечения любого синдрома чувствительности к фактору VII, такого, например, как нарушения, связанные с кровотечениями, включая, но не ограничиваясь перечисленным, синдромы, вызванные сниженным уровнем факторов свертывания VIII, IX, XI или VII, наличием ингибиторов факторов свертывания, дефективной функцией тромбоцитов (например, при тромбастении Гланцманна и синдроме Бернарда-Сулье), тромбоцитопенией, болезнью фон Виллебранда и коагулопатией, такой как коагулопатия, вызванная разбавлением коагулирующих белков, повышением фибринолиза и снижением количества тромбоцитов в результате кровотечений и/или трансфузий (например, у многократно трансфузируемых субъектов, подвергшихся оперативному вмешательству или травме).
Фармацевтические композиции, содержащие препарат фактора VII или родственного фактору VII полипептида и препарат фактора IX или родственного фактору IX полипептида согласно изобретению, в первую очередь предназначены для парентерального введения для профилактики и/или терапевтического применения. Предпочтительно фармацевтические композиции вводятся парентерально, например, внутривенно, подкожно или внутримышечно; при этом внутривенное введение является наиболее предпочтительным. Они могут быть введены также путем непрерывной или пульсирующей инфузии.
Фармацевтические композиции или составы согласно изобретению содержат препарат препарата фактора VII или родственного фактору VII полипептида или препарат препарата фактора IX или родственного фактору IX полипептида, или препарат препарата фактора VII или родственного фактору VII полипептида в комбинации с препаратом препарата фактора IX или родственного фактору IX полипептида, в комбинации с (предпочтительно при разведении в нем) фармацевтически приемлемым носителем, предпочтительно водным носителем или разбавителем. Могут быть использованы разнообразные водные носители, такие как вода, забуференная вода, 0,4% солевой раствор, 0,3% глицин и т.п. Препараты согласно изобретению могут быть составлены также с использованием неводных носителей, такие, например, как препараты в виде геля или липосомные препараты для доставки или нацеливания на конкретные сайты повреждения. Липосомные препараты в общем описаны, например, в патентах США №4837028, 4501728 и 4975282. Композиции могут стерилизоваться путем обычно применяемых, хорошо известных технологий стерилизации. Полученные в результате водные растворы могут быть упакованы для применения или же отфильтрованы в асептических условиях и лиофилизированы, а лиофилизированный препарат может быть объединен со стерильным водным раствором перед введением.
Композиции могут содержать фармацевтически приемлемые вспомогательные вещества или адъюванты, включая, без ограничения перечисленным, стабилизаторы pH и забуферивающие агенты и/или агенты, регулирующие тоничность раствора, такие, например, как ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция и т.д.
Кроме того, композиции могут включать в себя один или более разбавителей, эмульгаторов, консервантов, буферов, эксципиентов и т.д. и могут быть получены в таких формах как жидкая форма, порошки, эмульсии, форма контролируемого высвобождения и т.д. Специалисту в данной области можно будет составить композиции согласно изобретению соответствующим образом и в соответствии с приемлемой практикой, такие как описано в Remington’s Pharmaceutical Sciences, Gennaro, ed., Mack Publishing Co., Easton, PA, 1990. Таким образом, типичная фармацевтическая композиция для внутривенной инфузии может быть составлена вплоть до содержания в ней 250 мл стерильного раствора Рингера и 10 мг препарата.
Композиции, содержащие препараты согласно изобретению, могут быть введены в профилактических и/или лечебных целях. При терапевтическом применении композиции вводятся субъекту, уже страдающему от заболевания, как описано выше, в количестве, достаточном для излечения, облегчения или для того, чтобы частично остановить клинические проявления заболевания и его осложнения. Адекватное для достижения этой цели количество определяется как “терапевтически эффективное количество”. Эффективные для каждой цели количества будут зависеть от тяжести заболевания или повреждения, а также от веса и общего состояния субъекта. Разумеется, определение подходящей дозировки может быть достигнуто с помощью обычного экспериментирования, путем создания матрицы значений (показателей) и тестирования различных точек (показателей) в этой матрице.
Локальная доставка препаратов согласно изобретению, такая, например, как местная аппликация, может быть реализована, например, посредством спрея, перфузии, двойных баллонных катетеров, стента, встроенного в сосудистый имплантат или стенты, гидрогелей, используемых для покрытия баллонных катетеров, или других хорошо известных способов. В любом случае фармацевтические композиции должны обеспечить количество препарата, достаточное для эффективного лечения (патологического) состояния.
Концентрация фактора VII или родственного фактору VII полипептида, фактора IX или родственного фактору IX полипептида, или фактора VII или родственного фактору VII полипептида в комбинации с фактором IX или родственным фактору IX полипептидом в таких композициях может широко варьировать, т.e. от менее чем приблизительно 0,5% по весу, обычно при 1% или по меньшей мере приблизительно 1% по весу, до 15 или 20% по весу и в первую очередь они будут отбираться по объемам жидкости, вязкости и т.д., в соответствии с конкретно выбранным способом введения. Введение путем инъекции или инфузии, в частности инъекции, является предпочтительным. Таким образом, фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид получены в виде, подходящем для внутривенного введения, таком как препарат, который либо является растворенным лиофилизированным порошком, либо жидкой композицией, содержащей как фактор VII или родственный фактору VII полипептид, так и фактор IX или родственный фактору IX полипептид в единой дозированной форме, или же содержащей растворенный лиофилизированный порошок или жидкую композицию, содержащую фактор VII или родственный фактору VII полипептид, в одной дозированной форме, и растворенный лиофилизированный порошок или жидкую композицию, содержащую фактор IX или родственный фактору IX полипептид, в другой дозированной форме.
Должно быть очевидно, что количество фактора VII или родственного фактору VII полипептида и количество фактора IX или родственного фактору IX полипептида вместе составляют суммарное эффективное количество для лечения эпизодов кровотечения.
Следует иметь в виду, что материалы согласно изобретению могут обычно быть использованы при серьезных заболеваниях или состояниях повреждения, таких как ситуации, представляющие угрозу жизни, или потенциально угрожающие жизни ситуации. В таких случаях, из соображений минимизации посторонних веществ и обычно отсутствия иммуногенности фактора VIIa или фактора IX у человека, представляется возможным, а может оказаться и необходимым, назначение лечащим врачом существенно избыточных количеств указанных композиций.
Для профилактического применения композиции, содержащие препарат фактора VII или родственного фактору VII полипептида и препарат фактора IX или родственного фактору IX полипептида, вводят субъекту, чувствительному к – или, иначе – имеющему риск развития заболевания или повреждения, с целью повышения собственной коагулирующей способности у субъекта. Такое количество определяется как “профилактически эффективная доза”. Следует понимать, что количество фактора VII или родственного фактору VII полипептида и количество фактора IX или родственного фактору IX полипептида вместе составляют суммарно эффективное количество для предотвращения эпизодического кровотечения.
Однократное или многократные введения композиций могут быть осуществлены уровнями и характером дозировки, выбранными лечащим врачом. Такие композиции могут вводиться один или несколько раз в день или в неделю. Эффективным количеством таких фармацевтических композиций является количество, которое обеспечивает клинически значительный эффект против эпизодических кровотечений. Такие количества отчасти будут зависеть от конкретного состояния, которое подлежит лечению, от возраста, веса и общего состояния здоровья субъекта, а также и от других факторов, очевидных для специалистов в данной области.
Композиция согласно изобретению обычно вводится в однократной дозе до ожидаемого кровотечения или в самом начале кровотечения. Однако она может вводиться также и повторно (в многократных дозах), предпочтительно с интервалами в 2-4-6-12 часов, в зависимости от вводимой дозы и состояния субъекта.
Для лечения в связи с преднамеренным вмешательством фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид обычно назначается в интервале приблизительно 24 часов перед реализацией вмешательства, и в течение 7 дней или более после него. Введение в качестве коагулянта может быть произведено различными путями, как описано в настоящей заявке.
Композиция может быть представлена в виде единого препарата (единичная дозированная форма), содержащего как препарат препарата фактора VII или родственного фактору VII полипептида, так и препарат препарата фактора IX или родственного фактору IX полипептида, в соответствующих концентрациях. Композиция может быть представлена также в виде набора из частей, состоящего из первой дозированной формы, содержащей препарат препарата фактора VII или родственного фактору VII полипептида, и второй дозированной формы, содержащей препарат препарата фактора IX или родственного фактору IX полипептида. В этом случае фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид должны вводиться последовательно, предпочтительно в течение 15 минут один за другим, например, в течение 10 минут один за другим, или, предпочтительно, в течение 5 минут, или, более предпочтительно, в течение 2 минут один за другом. При этом любая из двух дозированных форм может быть введена в первую очередь.
Этот набор включает в себя по меньшей мере две раздельные фармацевтические композиции. Набор включает в себя устройство-контейнер для содержания в нем раздельных композиций, таких как распределенные по флаконам или распределенные по пакетикам из фольги. Обычно набор также содержит инструкции по применению отдельных компонентов набора. Композиция в виде набора является особенно предпочтительной тогда, когда отдельные компоненты предпочтительно вводятся в различных дозированных лекарственных формах, вводятся с разными интервалами дозировок или когда делающий назначение лечащий врач считает необходимым оттитровать индивидуальные компоненты этой комбинации.
Количество вводимого согласно данному изобретению фактора VII или родственного фактору VII полипептида и количество фактора IX или родственного фактору IX полипептида может варьировать, начиная от соотношения одного к другому приблизительно между 1:100 и приблизительно до 100:1 (в/в). Отношение фактора VII к фактору IX может, таким образом, составлять приблизительно 1:100, или 1:90, или 1:80, или 1:70 или 1:60, или 1:50, или 1:40, или 1:30, или 1:20, или 1:10, или 1:5, или 1:2, или 1:1, или 2:1, или 5:1, или 10:1, или 20:1, или 30:1, или 40:1, или 50:1, или 60:1, или 70:1, или 80:1, или 90:1, или 100:1; или приблизительно между 1:90 и 1:1, или приблизительно между 1:80 и 1:2, или приблизительно между 1:70 и 1:5, или приблизительно между 1:60 и 1:10, или приблизительно между 1:50 и 1:25, или приблизительно между 1:40 и 1:30, или приблизительно между 90:1 и 1:1, или приблизительно между 80:1 и 2:1, или приблизительно между 70:1 и 5:1, или приблизительно между 60:1 и 10:1, или приблизительно между 50:1 и 25:1, или приблизительно между 40:1 и 30:1.
Доза фактора VII или родственного фактору VII полипептида варьирует, начиная от дозы, соответствующей приблизительно от 0,05 мг до 500 мг/день фактора VII дикого типа, например, приблизительно от 1 мг до 200 мг/день, или, например, приблизительно от 5 мг до 175 мг/день для субъекта весом 70 кг в качестве нагрузочной и поддерживающей дозы, в зависимости от веса субъекта, его состояния и степени тяжести состояния.
Доза фактора IX или родственного фактору IX полипептида варьирует, начиная от дозы, соответствующей приблизительно от 0,01 мг до 500 мг/день фактора IX дикого типа, например, приблизительно от 1 мг до 200 мг/день, или, например, приблизительно от 5 мг до 175 мг/день для субъекта весом 70 кг в качестве нагрузочной и поддерживающей дозы, в зависимости от веса субъекта, его состояния и степени тяжести состояния.
При лечении субъектов с пониженным уровнем фактора IX предпочтительны дозы, представленные ниже.
При таком дозировании фактора IX или родственного фактору IX полипептида, чтобы уровень его активности в плазме достигал вплоть до 10% уровня нормальной активности в плазме фактора IX,
предпочтительные уровни фактора VII или родственного фактору VII полипептида составляют 15-300 микрограммов/кг веса тела.
Более предпочтительные уровни фактора VII или родственного фактору VII полипептида: 30-250 микрограммов/кг веса тела.
Наиболее предпочтительные уровни фактора VII или родственного фактору VII полипептида: 60-180 микрограммов/кг веса тела.
При таком дозировании фактора IX или родственного фактору IX полипептида, чтобы уровень его активности в плазме достигал вплоть до 30% уровня нормальной активности в плазме фактора IX,
предпочтительные уровни фактора VII или родственного фактору VII полипептида составляют 15-300 микрограммов/кг веса тела.
Более предпочтительные уровни фактора VII или родственного фактору VII полипептида: 30-250 микрограммов/кг веса тела.
Наиболее предпочтительные уровни фактора VII или родственного фактору VII полипептида: 60-180 микрограммов/кг веса тела.
При таком дозировании фактора IX или родственного фактору IX полипептида, чтобы уровень его активности в плазме достигал вплоть до 50% уровня нормальной активности в плазме фактора IX,
предпочтительные уровни фактора VII или родственного фактору VII полипептида составляют 10-300 микрограммов/кг веса тела.
Более предпочтительные уровни фактора VII или родственного фактору VII полипептида: 20-200 микрограммов/кг веса тела.
Наиболее предпочтительные уровни фактора VII или родственного фактору VII полипептида: 40-140 микрограммов/кг веса тела.
При таком дозировании фактора IX или родственного фактору IX полипептида, чтобы уровень его активности в плазме достигал вплоть до 80% уровня нормальной активности в плазме фактора IX.
предпочтительные уровни фактора VII или родственного фактору VII полипептида составляют 5-300 микрограммов/кг веса тела.
Более предпочтительные уровни фактора VII или родственного фактору VII полипептида: 10-180 микрограммов/кг веса тела.
Наиболее предпочтительные уровни фактора VII или родственного фактору VII полипептида: 60-120 микрограммов/кг веса тела.
При таком дозировании фактора IX или родственного фактору IX полипептида, чтобы уровень его активности в плазме достигал вплоть до 100% уровня нормальной активности в плазме фактора IX.
Предпочтительные уровни фактора VII или родственного фактору VII полипептида составляют 5-300 микрограммов/кг веса тела.
Более предпочтительные уровни фактора VII или родственного фактору VII полипептида: 10-180 микрограммов/кг веса тела.
Еще более предпочтительные уровни фактора VII или родственного фактору VII полипептида: 30-120 микрограммов/кг веса тела.
Наиболее предпочтительные уровни фактора VII или родственного фактору VII полипептида: 60-120 микрограммов/кг веса тела.
Однако редко приходится превышать максимальную дозу фактора IX или родственного фактору IX полипептида, соответствующую 80% уровню нормальной активности фактора IX, поскольку более высокие уровни замещения ассоциированы с повышением количества случаев тромботических осложнений.
Дозировку можно оценить, исходя из посылки, что 1 единица заместительного FIX на кг веса тела повышает активность в плазме приблизительно на 0,01 Ед. на мл (1%). Мониторинг уровня фактора IX в крови пациента осуществляют, производя через соответствующие временные интервалы тестирование проб крови пациента в отношении активности фактора IX (см. описание выше).
Анализы.
Тестирование активности фактора VIIa.
Для осуществления соответствующего анализа на тестирование активности фактора VIIa и, таким образом, осуществления отбора подходящих вариантов фактора VIIa может быть предпринято простое предварительное тестирование in vitro:
Анализ гидролиза In Vitro
Нативный фактор VIIa (дикого типа) и вариант фактора VIIa (здесь далее одинаково обозначаемые как “фактор VIIa”) могут быть протестированы в отношении их специфических активностей. Их можно также тестировать параллельно для того, чтобы напрямую сравнить их специфические активности. Анализ проводят в микротитрационном планшете (MaxiSorp, Nunc, Denmark). Хромогенный субстрат D-Ile-Pro-Arg-пара-нитроанилид (S-2288, Chromogenix, Sweden), в конечной концентрации 1 мМ, добавляют к фактору VIIa (конечная концентрация 100 нМ) в 50 мМ буфере Hepes, pH 7,4, содержащем 0.1 M NaCl, 5 mM CaCl2 и 1 мг/мл бычьего сывороточного альбумина. Поглощение при 405 нм непрерывно измеряют в планшете SpectraMaxТМ 340, снабженном считывающим устройством (Molecular Devices, USA). Поглощение, развивающееся в течение 20-минутной инкубации, после вычитания из него показателя поглощения в контрольной лунке, не содержащей фермента, используется для расчета соотношения между активностями варианта и фактора VIIa дикого типа.
Отношение = (A405 нм варианта фактора VIIa)/(A405 нм фактора VIIa дикого типа).
Исходя из этого, можно идентифицировать варианты фактора VIIa с активностью, сравнимой с активностью нативного фактора VIIa или выше нее, такие, например, как варианты, в которых соотношение между активностью варианта и активностью нативного фактора VII (FVII дикого типа) приблизительно составляет выше 1,0.
Активность фактора VIIa или вариантов фактора VIIa может быть измерена также с помощью физиологического субстрата, такого как фактор X, в соответствующей концентрации 100-1000 нМ, где вырабатываемый фактор Xa измеряют после добавления соответствующего хромогенного субстрата (например, S-2765). Кроме того, тестирование активности может проводиться при физиологической температуре.
Анализ протеолиза In Vitro
Нативный фактор VIIa (дикого типа) и вариант фактора VIIa (здесь далее одинаково обозначаемые как “фактор VIIa”) тестируются параллельно, для того, чтобы можно было напрямую сравнить их специфические активности. Анализ проводят в микротитрационном планшете (MaxiSorp, Nunc, Denmark). Фактор VIIa (10 нМ) и фактор X (0.8 мкМ) в 100 мкл 50 мМ буфера Hepes, pH 7,4, содержащего 0,1 M NaCl, 5 мМ CaCl2 и 1 мг/мл бычьего сывороточного альбумина, инкубируют в течение 15 мин. Затем расщепление фактора X останавливают путем добавления 50 мкл 50 мМ буфера Hepes, pH 7,4, содержащего 0.1 M NaCl, 20 мМ ЭДТА и 1 мг/мл бычьего сывороточного альбумина. Количество вырабатываемого фактора Xa измеряют путем добавления хромогенного субстрата Z-D-Arg-Gly-Arg-пара-нитроанилида (S-2765, Chromogenix, Sweden), конечная концентрация 0,5 мМ. Поглощение при 405 нм непрерывно измеряют в планшете SpectraMaxТМ 340, снабженном считывающим устройством (Molecular Devices, USA). Поглощение, развивающееся в течение 10-минутной инкубации, после вычитания из него показателя поглощения в контрольной лунке, не содержащей FVIIa, используется для расчета соотношения между протеолитическими активностями варианта и фактора VIIa дикого типа:
Отношение=(A405 нм варианта фактора VIIa)/(A405 нм фактора VIIa дикого типа).
Исходя из этого, можно идентифицировать варианты фактора VIIa с активностью, сравнимой с активностью нативного фактора VIIa или выше нее, такие, например, как варианты, в которых соотношение между активностью варианта и активностью нативного фактора VII (FVII дикого типа) приблизительно составляет выше 1,0.
Анализ выработки тромбина:
Способность фактора VII или родственных фактору VII полипептидов (например, вариантов) или фактора IX или родственных фактору IX полипептидов (например, вариантов) вырабатывать тромбин может быть измерена путем анализа, включающего в себя все родственные факторы свертывания и ингибиторы в физиологических концентрациях и активированные тромбоциты (как описано на странице 543 в публикации Monroe et al. (1997) Brit. J. Haematol. 99, 542-547, которая включена в настоящее описание в виде ссылки).
Тестирование активности фактора IX:
Для осуществления подходящего анализа на тестирование активности фактора IX и, таким образом, обеспечивая возможность для отбора подходящих вариантов фактора IX, могут быть предприняты простые тесты in vitro, такие, например, как описано у Wagenvoord et al., Haemostasis 1990; 20 (5):276-88 (“хромогенный анализ”).
Биологическую активность фактора IX можно оценить также путем измерения способности препарата корректировать время свертывания в плазме, дефицитной по содержанию фактора IX, например, как это описано у Nilsson et al., 1959. (Nilsson IM, Blombaeck M, Thilen A, von Francken I., Carriers of haemophilia A – A laboratory study, Acta Med Scan 1959; 165:357). В этом анализе биологическую активность выражают в единицах/мл плазмы (1 единица соответствует количеству FIX, присутствующего в нормальной объединенной плазме).
Аспекты данного изобретения.
В одном из аспектов, настоящее изобретение связано с фармацевтической композицией, содержащей полипептид FVII и полипептид FIX в качестве единственных активных факторов свертывания. В одном из аспектов, полипептид FVII представляет собой рекомбинантный человеческий FVIIa. В одном из аспектов, полипептид FIX представляет собой рекомбинантный человеческий FIX. В одном из аспектов, полипептид FVII и полипептид FIX смешаны (объединены). В одном из аспектов, полипептид FVII и полипептид FIX представлены в различных упаковках. В одном из аспектов, композиция предназначена для лечения человека.
В другом аспекте, настоящее изобретение связано с набором для лечения эпизодических кровотечений, содержащим
a) эффективное количество полипептида FVII и, необязательно, фармацевтически приемлемый носитель в составе первой единичной дозированной лекарственной формы;
b) эффективное количество полипептида FIX и, необязательно, фармацевтически приемлемый носитель в составе второй единичной дозированной лекарственной формы; и
c) устройство-контейнер для содержания указанных первой и второй дозированных лекарственных форм.
В одном из воплощений, полипептид FVII представляет собой рекомбинантный человеческий FVIIa. В одном из воплощений, полипептид FIX представляет собой рекомбинантный человеческий FIX. В одном из воплощений, набор предназначен для лечения человека. В другом аспекте, изобретение связано с применением полипептида FVII и полипептида FIX для получения лекарственного средства для лечения кровотечений у субъекта, страдающего синдромом чувствительности к фактору FIX. В другом аспекте, изобретение связано с применением полипептида FVII и полипептида FIX для получения лекарственного средства для лечения кровотечений у субъекта, имеющего сниженный уровень FIX. В одном аспекте, лекарственное средство предназначено для лечения эпизодов кровотечения у пациентов с гемофилией A. В одном аспекте, лекарственное средство включает в себя смесь полипептида фактора FVII и полипептида фактора FIX. В одном аспекте, лекарственное средство получено в виде первой дозированной лекарственной формы, содержащей полипептид FVII, и второй дозированной лекарственной формы, содержащей полипептид FIX. В одном аспекте, полипептид FVII представляет собой рекомбинантный человеческий FVIIa. В одном аспекте, полипептид FIX представляет собой рекомбинантный человеческий FIX.
В другом аспекте, настоящее изобретение связано со способом повышения гемостаза у субъекта, страдающего синдромом чувствительности к фактору FIX, по сравнению с ситуацией, когда субъекту вводят FIX в качестве единственного коагулирующего белка, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом аспекте, настоящее изобретение связано со способом повышения гемостаза у субъекта, имеющего сниженный уровень FIX, по сравнению с ситуацией, когда субъекту вводят FIX в качестве единственного коагулирующего белка, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом аспекте, настоящее изобретение связано со способом повышения выработки тромбина у субъекта, страдающего синдромом чувствительности к фактору FIX, по сравнению с ситуацией, когда субъекту вводят FIX в качестве единственного коагулирующего белка, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом аспекте, настоящее изобретение связано со способом повышения выработки тромбина у субъекта, имеющего сниженный уровень фактора FIX, по сравнению с ситуацией, когда субъекту вводят FIX в качестве единственного коагулирующего белка, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом аспекте, настоящее изобретение связано со способом снижения количества введений белка-фактора свертывания, необходимого для достижения гемостаза у субъекта, страдающего синдромом чувствительности к фактору FIX, по сравнению с количеством введений, необходимых, если бы субъекту вводили FIX в качестве единственного белка-фактора коагуляции, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом аспекте, настоящее изобретение связано со способом снижения количества введений белка-фактора свертывания, необходимого для достижения гемостаза у субъекта, имеющего сниженный уровень фактора FIX, по сравнению с количеством введений, необходимых, если бы субъекту вводили FIX в качестве единственного белка-фактора коагуляции, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом аспекте, настоящее изобретение связано со способом снижения количества вводимого белка-фактора свертывания, необходимого для достижения гемостаза у субъекта, страдающего синдромом чувствительности к фактору FIX, по сравнению с количеством вводимого белка-фактора свертывания, необходимого, если бы субъекту вводили FIX в качестве единственного белка-фактора коагуляции, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом аспекте, настоящее изобретение связано со способом снижения количества вводимого белка-фактора свертывания, необходимого для достижения гемостаза у субъекта, имеющего сниженный уровень фактора FIX, по сравнению с количеством вводимого белка-фактора свертывания, необходимого, если бы субъекту вводили FIX в качестве единственного белка-фактора коагуляции, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом аспекте, настоящее изобретение связано со способом лечения кровотечений у субъекта, страдающего синдромом чувствительности к фактору FIX, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом аспекте, настоящее изобретение связано со способом лечения кровотечений у субъекта, имеющего сниженный уровень фактора FIX, где указанный способ включает в себя введение субъекту, в случае необходимости, эффективного количества полипептида FVII и эффективного количества полипептида FIX.
В другом воплощении указанных способов, полипептид FVII представляет собой рекомбинантный человеческий фактор FVIIa.
В одном воплощении, полипептид FIX представляет собой рекомбинантный человеческий фактор FIX. В одном воплощении, указанный субъект страдает гемофилией B.
Настоящее изобретение дополнительно проиллюстрировано следующими далее примерами, которые, однако, не следует рассматривать как ограничивающие объем охраны данного изобретения. Признаки, описанные в предшествующем описании и в последующих примерах, могут, как по отдельности, так и в комбинации друг с другом, служить материалом для реализации настоящего изобретения в различных его вариантах.
ПРИМЕРЫ
Пример 1. In vivo лечение внутричерепного кровотечения у пациента с гемофилией
При лечении не имеющего ингибитора пациента с гемофилией B, страдающего от внутричерепного кровотечения, коммерчески доступным продуктом FIX, для достижения гемостаза приходилось, как правило, делать от 8 до 16 инъекций или инфузий фактора FIX. Инфузия FIX предназначена для достижения концентрации FIX в плазме, составляющей первоначально по меньшей мере 80%, а затем, через одну неделю, составляющей 50% от нормального уровня концентрации в плазме.
Такому больному вводили одну дозу 90-180 мкг/кг веса тела препарата NovoSeven® (Novo Nordisk A/S, Bagsvaerd, Denmark) и одновременно вводили продукт FIX, или же вводили одну дозу 90-180 мкг/кг веса тела препарата NovoSeven® (Novo Nordisk A/S, Bagsvaerd, Denmark), а продукт FIX вводили через некоторое время, например, через 5 минут. Оба продукта инъецировали через одно и то же устройство для внутривенного введения. У больного сократилось время, необходимое для остановки кровотечения, и уменьшилось количество инъекций, необходимых для поддержания гемостаза. Такая схема лечения приводит к снижению общего количества белка-фактора коагуляции, применяемого для остановки кровотечения и гемостазирования.
Пример 2. In vivo лечение кровотечений верхнего отдела желудочно-кишечного тракта у пациента с хроническим заболеванием печени
Пациент страдает от кровотечений верхнего отдела желудочно-кишечного тракта из-за геморрагического гастрита неизвестной этиологии. У пациента снижены уровни витамин K-зависимых факторов свертывания, в частности факторов VII и IX, из-за функции печени, ослабленной вторично в результате хронического гепатита C. Пациент был подвергнут трансфузии эритроцитов крови, жидкостей для внутривенного введения и свежей замороженной плазмы, которая содержала фактор свертывания IX.
Такому больному вводили одну дозу 90-120 мкг/кг веса тела FVIIa и одновременно вводили продукт FFP, или вводили одну дозу 90-120 мкг/кг веса тела FVIIa, а продукт FFP вводили через некоторое время, например, через 5 минут. Оба продукта инъецировали через одно и то же устройство для внутривенного введения. У больного сократилось время, необходимое для остановки кровотечения, и уменьшилось количество инъекций, необходимых для поддержания гемостаза. Такая схема лечения приводит к снижению общего количества белка-фактора коагуляции, применяемого для остановки кровотечения и гемостазирования, а также к улучшению выживаемости.
Пример 3. Не имеющий ингибитора пациент с гемофилией B, страдающий от мышечного кровотечения в руке, с компартментным синдромом
Пациент является не имеющим ингибитора пациентом с гемофилией В, страдающим обширным травматическим мышечным кровотечением в правой руке, с симптомами компартментного синдрома.
При лечении такого пациента коммерчески доступным продуктом FIX для достижения гемостаза приходилось, как правило, делать от 8 до 16 инъекций или инфузий фактора FIX. Инфузия FIX предназначена для достижения концентрации FIX в плазме, составляющей первоначально по меньшей мере 80%, а затем, через одну неделю, составляющей 50% от нормального уровня концентрации в плазме.
Такому больному вводили одну дозу 90-180 мкг/кг веса тела препарата NovoSeven® (Novo Nordisk A/S, Bagsvaerd, Denmark) и одновременно вводили продукт FIX, или же вводили одну дозу 90-180 мкг/кг веса тела препарата NovoSeven® (Novo Nordisk A/S, Bagsvaerd, Denmark), а продукт FIX вводили через некоторое время, например, через 5 минут. Оба продукта инъецировали через одно и то же устройство для внутривенного введения.
Указанные комбинации препарата NovoSeven и продукта FIX обеспечивают улучшение временных показателей остановки кровотечения, степени повреждения периферических нервов и сосудов, а также объема и сложности хирургического вмешательства по сравнению с эффектом, вызываемым при отдельном применении препарата NovoSeven либо продукта FIX.
Пример 4. Исследование статуса свертывания крови у не имеющего ингибитора пациента с гемофилией B
Пациентом является не имеющий ингибитора пациент с гемофилией B, страдающий от кровотечений, например, внутричерепных кровотечений.
При лечении такого пациента коммерчески доступным продуктом FIX приходилось, как правило, делать от 8 до 16 инъекций или инфузий фактора FIX для достижения гемостаза. Инфузия FIX предназначена для достижения концентрации FIX в плазме, составляющей первоначально по меньшей мере 80%, а затем, через одну неделю, составляющей 50% от нормального уровня концентрации в плазме.
Такому больному вводили одну дозу 90-180 мкг/кг веса тела препарата NovoSeven® (Novo Nordisk A/S, Bagsvaerd, Denmark) и одновременно вводили продукт FIX, или же вводили одну дозу 90-180 мкг/кг веса тела препарата NovoSeven® (Novo Nordisk A/S, Bagsvaerd, Denmark), а продукт FIX вводили через некоторое время, например, через 5 минут. Оба продукта инъецировали через одно и то же устройство для внутривенного введения. Через десять минут после введения последнего из двух коагулирующих белков больному делали полный анализ свертывания крови с использованием тромбоэластографического метода, являющегося стандартизированным методом анализа, клинически соответствующим статусу свертывания (см., например, Meh et al., BLOOD COAGULATION & FIBRINOLYSIS 2001; 12:627-637). На основании данных, полученных с помощью стандартных считывающих устройств, в результате такого анализа было обнаружено усиление образования фибринового сгустка; повышение прочности сгустка и удлинение времени растворения тромба. Такие измерения, проводимые в последующих пробах крови, показали наличие вариабельности у этих параметров, в зависимости от времени после инъекции продуктов фактора VII и фактора IX.
Пример 5. Уменьшение времени свертывания под действием комбинаций факторов VIIa и фактора IX
МЕТОДЫ.
Анализ сгустка. Специфическая свертывающая активность рекомбинантного человеческого фактора свертывания VIIa (rVIIa), в присутствии или в отсутствие различных концентраций очищенного из плазмы человеческого фактора IX (FIX), определялась с помощью одностадийного анализа, как было описано выше (Persson et al., J Biol Chem 276:29195-9, 2001). Вкратце, аликвоты (55 мкл) rFVIIa (0,2-3 мкг/мл, Novo Nordisk stock) в 50 мМ трубочках, 100 мМ NaCl, 2 мМ ЭДТА, 1% BSA, pH 7,2, смешивали с равным объемом буфера, содержащего 50 мМ CaCl2 и фосфатидилхолиновые/фосфатидилсериновые везикулы (общая концентрация фосфолипидов 100 мкМ; 80% фосфатидилхолин/20% фосфатидилсерин), и процесс свертывания инициировали путем добавления 55 мкл FIX-дефицитной плазмы (Helena Labs Helena Labs #5793), к которой добавлены различные концентрации FIX (10, 50 и 80% от концентрации в плазме, Haematologic Technologies). Реакцию свертывания проводили в течение 500 секунд в коагулометре для исследований ACL 300 (Instrumentation Laboratory, Milan, Italy), с использованием стандартной программы APTT.
РЕЗУЛЬТАТЫ.
Анализ сгустка: rFVIIa и FIX, отдельно и в сочетании друг с другом, добавляли к FIX-дефицитной плазме, и определяли времена свертывания. До добавления rFVIIa/FIX время свертывания обеих плазм составляло более 500 секунд. Эффект уменьшения времени свертывания под действием rFVIIa, в присутствии и в отсутствие FIX, показан на чертеже.
ЗАКЛЮЧЕНИЕ.
Полученные результаты показывают, что комбинация rFVIIa и FIX способна вызвать эффект уменьшения времени свертывания FIX-дефицитной плазмы в большей степени, чем когда белки добавляли по отдельности.
Формула изобретения
1. Фармацевтическая композиция, содержащая препарат фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и препарат фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX.
2. Композиция по п.1, где указанный фактор VII или родственный фактору VII полипептид представляет собой родственный фактору VII полипептид, такой как вариант аминокислотной последовательности фактора VII, содержащей не более 20 аминокислотных замен, делеций или инсерций по сравнению с фактором VII дикого типа.
3. Композиция по п.1 или 2, где соотношение между активностью указанного родственного фактору VII полипептида и активностью нативного человеческого фактора VIIa (FVIIa дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании с помощью анализа “гидролиза in vitro”, как описано в настоящем описании.
4. Композиция по п.1, где указанный фактор VII или родственный фактору VII полипептид представляет собой полипептид фактора VII, такого как рекомбинантный человеческий фактор VII.
5. Композиция по любому из пп.1-4, где указанный фактор VII или родственный фактору VII полипептид представлен в своей активированной форме.
6. Композиция по п.5, где указанный полипептид фактора VII представляет собой рекомбинантный человеческий фактор VIIa.
7. Композиция по любому из пп.1-6, где указанный фактор IX или родственный фактору IX полипептид представляет собой родственный фактору IX полипептид, такой как вариант аминокислотной последовательности фактора IX, который отличается от последовательности фактора IX дикого типа заменой, делецией или инсерцией одной или более аминокислот.
8. Композиция по п.7, где соотношение между активностью указанного родственного фактору IX полипептида и активностью нативного человеческого фактора IX (FIX дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании с помощью “хромогенного анализа”, как описано в настоящем описании.
9. Композиция по любому из пп.1-6, где указанный фактор IX или родственный фактору IX полипептид представляет собой полипептид фактора IX, такой как человеческий фактор IX или рекомбинантный человеческий фактор IX.
10. Композиция по любому из пп.1-9, где указанный фактор VII или родственный фактору VII полипептид и указанный фактор IX или родственный фактору IX полипептид присутствуют в массовом отношении приблизительно между 100:1 и 1:100 фактора VII к фактору IX.
11. Набор для лечения эпизодов кровотечения, включающий в себя а) эффективное количество препарата фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и фармацевтически приемлемый носитель в первой дозированной лекарственной форме; b) эффективнее количество препарата фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, и фармацевтически приемлемый носитель во второй дозированной лекарственной форме; и с) контейнер для содержания указанных первой и второй дозированных лекарственных форм.
12. Набор по п.11, где указанный фактор VII или родственный фактору VII полипептид представляет собой родственный фактору VII полипептид, такой как вариант аминокислотной последовательности фактора VII, содержащей не более 20 аминокислотных замен, делеций или инсерций по сравнению с фактором VII дикого типа.
13. Набор по п.11 или 12, где соотношение между активностью указанного родственного фактору VII полипептида и активностью нативного человеческого фактора VIIa (FVIIa дикого типа) составляет по меньшей мере приблизительно 1,25 при тестировании с помощью анализа “гидролиза In Vitro”, как описано в настоящем описании.
14. Набор по п.11, где указанный фактор VII или родственный фактору VII полипептид представляет собой полипептид фактора VII, такой как человеческий фактор VII или рекомбинантный человеческий фактор VII.
15. Набор по любому из пп.11-14, где указанный фактор VII или родственный фактору VII полипептид представлен в своей активированной форме.
16. Набор по п.15, где указанный полипептид фактора VII представляет собой рекомбинантный человеческий фактор VIIa.
17. Набор по любому из пп.11-16, где указанный фактор IX или родственный фактору IX полипептид представляет собой родственный фактору IX полипептид, такой как вариант аминокислотной последовательности фактора IX, который отличается от последовательности фактора IX дикого типа заменой, делецией или инсерцией одной или более аминокислот.
18. Набор по п.17, где соотношение между активностью указанного родственного фактору IX полипептида и активностью нативного человеческого фактора IX (FIX дикого типа) составляет по меньшей мере приблизительно 1,25, при тестировании с помощью “хромогенного анализа”, как описано в настоящем описании.
19. Набор по любому из пп.11-16, где указанный фактор IX или родственный фактору IX полипептид представляет собой полипептид фактора IX, такой как человеческий фактор IX или рекомбинантный человеческий фактор IX.
20. Набор по любому из пп.11-19, где указанный фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид представлены в массовом отношении приблизительно между 100:1 и 1:100 фактора VII к фактору IX.
21. Применение композиции по любому из пп.1-10 для производства лекарственного средства для лечения у субъекта эпизодов кровотечения.
22. Применение композиции по любому из пп.1-10 для производства лекарственного средства для уменьшения времени свертывания.
23. Применение композиции по любому из пп.1-10 для производства лекарственного средства для увеличения времени растворения сгустка.
24. Применение композиции по любому из пп.1-10 для производства лекарственного средства для повышения прочности сгустка.
25. Применение композиции по любому из пп.1-10 для производства лекарственного средства для усиления образования фибринового сгустка.
26. Применение по любому из пп.21-25, где субъект страдает синдромом чувствительности к фактору IX и/или имеет сниженный уровень фактора IX.
27. Применение по п.26, где субъект страдает гемофилией А.
28. Применение по любому из пп.21-27, где лекарственное средство представлено в единой дозированной форме.
29. Применение по любому из пп.21-27, где лекарственное средство получено в виде первой дозированной формы, содержащей препарат фактора VII или родственного фактору VII полипептида, и второй дозированной формы, содержащей препарат фактора IX или родственного фактору IX полипептида.
30. Способ лечения эпизодов кровотечения у субъекта, включающий в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и второго количества препарата фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, где первое и второе количество вместе являются эффективными для лечения кровотечений.
31. Способ уменьшения времени свертывания у субъекта, включающий в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и второго количества препарата фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, где первое и второе количество вместе являются эффективными для уменьшения времени свертывания.
32. Способ усиления гемостаза у субъекта, включающий в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и второго количества препарата фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, где первое и второе количество вместе являются эффективными для усиления гемостаза.
33. Способ снижения количества введений белка-фактора свертывания, необходимых для остановки кровотечения и установления гемостаза у субъекта, включающий в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и второго количества препарата фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, где первое и второе количество вместе являются эффективными для остановка кровотечения и установления гемостаза.
34. Способ снижения количества вводимого белка-факторе свертывания, необходимого для остановки кровотечения и установления гемостаза у субъекта, включающий в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и второго количества препарата фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, где первое и второе количество вместе являются эффективными для остановки кровотечения и установления гемостаза.
35. Способ увеличения времени растворения сгустка у субъекта, включающий в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и второго количества препарата фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, где первое и второе количество вместе являются эффективными для увеличения времени растворения сгустка.
36. Способ увеличения прочности сгустка у субъекта, включающий в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и второго количества препарата фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, где первое и второе количество вместе являются эффективными для увеличения прочности сгустка.
37. Способ усиления образования фибринового сгустка у субъекта, включающий в себя введение субъекту, в случае необходимости, первого количества препарата фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-связывания, и второго количестве препарата фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, где первое и второе количество вместе являются эффективными для усиления образования фибринового сгустка.
38. Способ по любому из пп.30-37, где субъект страдает синдромом чувствительности к фактору IX и/или имеет сниженный уровень фактора IX.
39. Способ по п.38, где субъект страдает гемофилией А.
40. Способ по любому из пп.30-39, где фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид вводят в составе единой дозированной формы.
41. Способ по любому из пп.30-39, где фактор VII или родственный фактору VII полипептид и фактор IX или родственный фактору IX полипептид вводят в виде первой дозированной формы, содержащей препарат фактора VII или родственного фактору VII полипептида, и второй дозированной формы, содержащей препарат фактора IX или родственного фактору IX полипептида.
42. Способ по п.41, где первая дозированная форма и вторая дозированная форма вводятся с интервалом во времени не более чем 15 мин.
43. Набор для лечения эпизодов кровотечения, включающий в себя а) эффективное количество фактора VII или родственного фактору VII полипептида, который проявляет по меньшей мере 50% специфической активности фактора VIIa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в одном или более анализах на свертывание, анализе на протеолиз или анализе TF-сзязынания, и эффективное количество фактора IX или родственного фактору IX полипептида, который проявляет по меньшей мере 50% специфической активности фактора IXa дикого типа, которая продуцируется тем же самым типом клеток при тестировании в анализе специфической активности фактора IX, и фармацевтически приемлемый носитель в единой дозированной лекарственной форме; и е) контейнер для содержания указанной единой дозированной лекарственной формы.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 06.02.2008
Извещение опубликовано: 27.07.2010 БИ: 21/2010
|
|