Патент на изобретение №2292890
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
(57) Реферат:
Изобретение относится к медицине. Описано лекарственное средство, содержащее по отдельности или в виде единой композиции (А) соединение формулы (I) в свободной форме или в форме фармацевтически приемлемой соли или сольвата и (Б) кортикостероид, предназначенное для одновременного, последовательного или раздельного введения при лечении воспалительных или обструктивных заболеваний дыхательных путей, причем молярное соотношение компонентов (А) и (Б) составляет от 100:1 до 1:300. Лекарственные средства обладают высокими бронхолитическими и противовоспалительным свойствами и применяются при лечении воспалительных или обструктивных заболеваний дыхательных путей. 2 н. и 15 з.п. ф-лы.
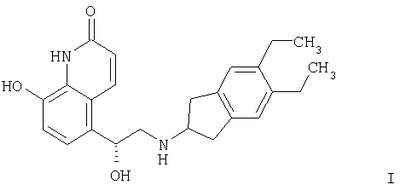
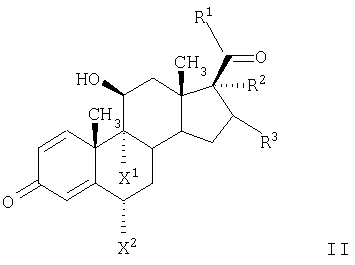
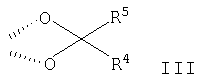
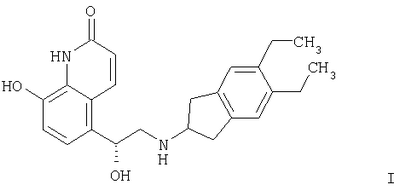
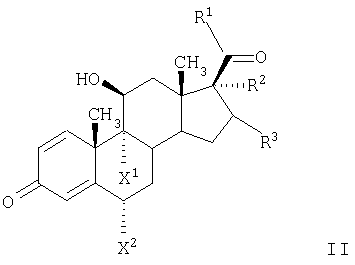
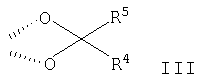
Изобретение относится к органическим соединениям и их применению в качестве фармацевтических средств для лечения воспалительных или обструктивных заболеваний дыхательных путей. Одним из объектов настоящего изобретения является лекарственное средство, содержащее по отдельности или в сочетании друг с другом композиции (А) – соединение формулы в свободной форме или в форме фармацевтически приемлемой соли или сольвата и (Б) кортикостероид, предназначенное для одновременного, последовательного или раздельного введения при лечении воспалительного или обструктивного заболевания дыхательных путей. Следующим объектом настоящего изобретения является способ лечения воспалительного или обструктивного заболевания дыхательных путей, заключающийся в том, что пациенту, нуждающемуся в таком лечении, вводят терапевтически эффективные количества указанного выше компонента (А) и указанного выше компонента (Б). Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая смесь эффективных количеств указанного выше компонента (А) и указанного выше компонента (Б) необязательно в сочетании по меньшей мере с одним фармацевтически приемлемым носителем. Кроме того, объектом изобретения является применение указанного выше компонента (А) и/или указанного выше компонента (Б) для приготовления лекарственного средства, предназначенного для совместной терапии, заключающейся в одновременном, последовательном или раздельном введении компонентов (А) и (Б) при лечении воспалительного или обструктивного заболевания дыхательных путей. Соединение формулы I можно получать в свободной форме или в форме соли или сольвата путем взаимодействия (R)-8-бензилокси-5-оксиранилкарбостирила с 5,6-диэтилиндан-2-иламином с получением 8-бензилокси-5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-IH-хинолин-2-она, удаления из полученного продукта защитных групп для замещения бензильной группы водородом и выделения образовавшегося соединения формулы I в свободной форме или в форме соли или сольвата. Реакции можно осуществлять с помощью описанных в примерах или аналогичных им методов. (R)-8-бензилокси-5-оксиранилкарбостирил можно получать методом, описанным в WO 95/25104. 5,6-Диэтилиндан-2-иламин можно получать с помощью известных или аналогичных им методов, например согласно методам, описанным в примерах. Фармацевтически приемлемые соли соединения формулы I могут представлять собой кислотно-аддитивные соли, в частности соли, образованные с неорганическими кислотами, такими как галогенводородные кислоты, например фтористоводородная кислота, соляная кислота, бромистоводородная кислота или йодистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота; и органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, бензойная кислота, орто-гидроксибензойная кислота, пара-гидроксибензойная кислота, пара-хлорбензойная кислота, дифенилуксусная кислота, трифенилуксусная кислота, 1-гидроксинафталин-2-карбоновая кислота, 3-гидроксинафталин-2-карбоновая кислота; алифатическими оксикислотами такими как молочная кислота, лимонная кислота, винная кислота или яблочная кислота; дикарбоновыми кислотами, такими как фумаровая кислота, малеиновая кислота или янтарная кислота; и сульфоновыми кислотами, такими как метансульфоновая кислота или бензолсульфоновая кислота. Эти соли можно получать из соединений формулы I с помощью известных методов получения солей. Фармацевтически приемлемые сольваты, как правило, представляют собой гидраты. Наиболее предпочтительной формой соединения формулы I является малеат. Кортикостероид (Б) может представлять собой, например, соединение формулы или его 1,2-дигидро-производное, где R1 обозначает С1-С4алкил, необязательно замещенный галогеном (предпочтительно хлором или фтором), гидрокси-, C1-С4алкокси-, ацилокси- или ацилтиогруппу, или R1 обозначает С1-С4алкокси или С1-С4алкилтиогруппу, необязательно замещенную галогеном, или R1 обозначает 5- или 6-членную гетероциклилтиогруппу, причем либо R2 обозначает ацилоксигруппу и R3 обозначает водород или С1-С4алкил, либо R2 и R3 вместе обозначают группу формулы где R4 обозначает С1-С4алкил или С3-С6циклоалкил и R5 обозначает водород или С1-С4алкил, и X1 и X2 каждый независимо друг от друга обозначает водород, хлор или фтор. В контексте настоящего описания С1-С4алкил может представлять собой метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил или трет-бутил. В контексте настоящего описания С1-С4алкокси может представлять собой метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси или трет-бутокси. В контексте настоящего описания С1-С4алкилтио может представлять собой метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, втор-бутилтио или трет-бутилтио. Если R1 обозначает С1-С4алкил, замещенный ацилоксигруппой, то ацилоксигруппа может представлять собой, например, C1-С2алкилкарбонилоксигруппу, например ацетилокси-, н-пропионилокси-, изопропионилокси- или гексадеканоилокси- или С3-С6циклоалкилкарбонилокси-, например циклогексилкарбонилоксигруппу. Если R1 обозначает С1-С4алкил, замещенный ацилтиогруппой, то ацилтиогруппа может представлять собой, например, С1-С4алкилкарбонилтиогруппу, например ацетилтио- или н-пропионилтиогруппу. Если R обозначает 5- или 6-членную гетероциклилтиогруппу, то гетероциклильная группа может представлять собой O-гетероциклильную группу, например фуранонильную группу. Если R2 обозначает ацилоксигруппу, то она может представлять собой, например, С1-С4алкилкарбонилоксигруппу, например ацетилокси-, н-пропионилокси- или н-бутироилокси-, С3-С6циклоалкилкарбонилокси-, например циклопропилкарбонилоксигруппу, или 5- или 6-членную гетероциклилкарбонилоксигруппу, например фуроилоксигруппу. Если R3 обозначает С1-С4алкил, то он может находиться в альфа- или бета-конфигурации, как правило, в альфа-конфигурации. Если R2 и R3 вместе обозначают группу формулы III, то R4, обозначающий С3-С6циклоалкил, может представлять собой, например, циклогексил. Кортикостероиды формулы I и их 1,2-дигидропроизводные включают дипропионат бекламетасона, будесонид, пропионат флутикасона, фуроат мометасона, циклесонид, ацетонид триамцинолона, флунисолид, пальмитат рофлепонида, пропионат бутиксокорта и энбутат мометазона. В наиболее предпочтительном варианте осуществления изобретения кортикостероид (Б) представляет собой бутесонид, пропионат флутикасона или фуроат мометасона. Введение описанных выше лекарственного средства или фармацевтической композиции, т.е. содержащих компоненты (А) и (Б) в смеси или по отдельности, предпочтительно осуществляют путем ингаляции, т.е. компоненты (А) и (Б) или их смесь находятся в форме, пригодной для ингаляции. Пригодная для ингаляции форма лекарственного средства, т.е. компонентов (А) и/или (Б) может представлять собой, например, распыляемую композицию, такую как аэрозоль, содержащий действующее вещество, т.е. компоненты (А) и (Б) по отдельности или в смеси в виде раствора или дисперсии в пропелленте, или распыляемую композицию, содержащую раствор или дисперсию действующего вещества в водной, органической или водно/органической среде. Например, форма, пригодная для ингаляции, может представлять собой аэрозоль, содержащий смесь компонентов (А) и (Б) в виде раствора или дисперсии в пропелленте или комбинацию аэрозоля, содержащего компонент (А) в виде раствора или дисперсии в пропелленте, и аэрозоля, содержащего компонент (Б) в виде раствора или дисперсии в пропелленте. В другом примере пригодная для ингаляции форма представляет собой распыляемую композицию, содержащую дисперсию компонентов (А) и (Б) в водной, органической или водно/органической среде или комбинацию дисперсии компонента (А) в такой среде и дисперсии компонента (Б) в такой среде. Аэрозольная композиция, пригодная в качестве формы для ингаляции лекарственного средства, может содержать действующее вещество в виде раствора или дисперсии в пропелленте, который может представлять собой любой пропеллент, известный в данной области. Пригодными для этой цели пропеллентами являются углеводороды, такие как н-пропан, н-бутан или изобутан или смеси двух или нескольких таких углеводородов, и замещенные галогеном углеводороды, например замещенные хлором и/или фтором метаны, этаны, пропаны, бутаны, циклопропаны или циклобутаны, такие как дихлордифторметан (CFC12), трихлорфторметан (CFC11), 1,2-дихлор-1,1,2,2-тетрафторэтан (CFC114) или, прежде всего, 1,1,1,2-тетрафторэтан (HFA134a) и 1,1,1,2,3,3,3-гептафторпропан (HFA227), или смеси двух или нескольких таких галогензамещенных углеводородов. Если действующее вещество присутствует в виде суспензии в пропелленте, т.е. если она присутствует в форме отдельных частиц, диспергированных в пропелленте, то аэрозольная композиция может содержать также замасливатель и поверхностно-активное вещество, которые можно выбирать из числа замасливателей и поверхностно-активных веществ, известных в данной области. Другими аэрозольными композициями являются не содержащие поверхностно-активное вещество или практически не содержащие поверхностно-активное вещество аэрозольные композиции. Аэрозольная композиция может содержать приблизительно до 5 мас.%, например от 0,0001 до 5%, от 0,001 до 5%, от 0,001 до 3%, от 0,001 до 2%, от 0,001 до 1%, от 0,001 до 0,1% или от 0,001 до 0,01% действующего вещества в пересчете на массу пропеллента. В том случае если они присутствуют, замасливатель и поверхностно-активное вещество могут составлять до 5% и 0,5% в пересчете на массу аэрозольной композиции соответственно. Аэрозольная композиция может содержать также сорастворитель, такой как этанол, в количестве до 30% в пересчете на массу композиции, прежде всего композиции, предназначенной для введения с помощью находящегося под давлением устройства для ингаляции, снабженного дозируемым клапаном. Аэрозольная композиция может содержать дополнительно наполнитель, например сахар, такой как лактоза, сахароза, декстроза, маннит или сорбит, в количестве, например, до 20%, как правило, от 0,001 до 1% в пересчете на массу композиции. Согласно другому варианту осуществления изобретения предназначенная для ингаляции форма представляет собой сухой порошок, т.е. компонент (А) и/или компонент (Б) находятся в форме сухого порошка, содержащего тонко измельченные компоненты (А) и/или (Б) необязательно в сочетании по меньшей мере с одним состоящим из отдельных частиц фармацевтически приемлемым носителем, который может представлять собой одно или несколько веществ, применяемых в качестве фармацевтически приемлемых носителей, предпочтительно выбранных из веществ, применяемых в качестве носителей в композициях сухих порошков для ингаляции, например сахаридов, включая моносахариды, дисахариды, полисахариды и сахарные спирты, такие как арабиноза, глюкоза, фруктоза, рибоза, манноза, сахароза, трегалоза, лактоза, мальтоза, крахмалы, декстран, маннит или сорбит. Наиболее предпочтительным носителем является лактоза. Сухой порошок может находиться в виде стандартных доз в капсулах, например, из желатина или пластика, или в блистерной упаковке (например, из алюминия или пластика), предназначенных для введения с помощью ингалятора для сухого порошка, который может представлять собой ингалятор для введения однократной дозы или нескольких доз, причем предпочтительно в стандартных дозах компоненты (А) и/или (Б) содержатся вместе с носителем в таких количествах, чтобы общая масса порошка в капсуле составляла от 5 до 50 мг. В альтернативном варианте сухой порошок может находиться в резервуаре ингалятора, предназначенного для введения нескольких доз, который приспособлен для введения, например, 3-25 мг сухого порошка при одном нажатии. В лекарственном средстве, находящемся в форме тонко измельченных частиц и в аэрозольной композиции, в которой действующее вещество присутствует в форме отдельных частиц, частицы действующего вещества могут иметь средний диаметр до 10 мкм, например от 0,1 до 5 мкм, предпочтительно от 1 до 5 мкм. Если присутствует состоящий из отдельных частиц носитель, то, как правило, максимальный диаметр его частиц не превышает 300 мкм, предпочтительно не превышает 212 мкм, и предпочтительно средний диаметр частиц составляет от 40 до 100 мкм, например от 50 до 75 мкм. Размер частиц действующего вещества и частиц состоящего из отдельных частиц носителя, присутствующего в композициях в виде сухого порошка, может быть уменьшен до необходимого уровня с помощью общепринятых методов, например путем измельчения в воздухоструйной мельнице, шаровой мельнице или вибромельнице, путем просеивания, микроосаждения, сушки распылением, лиофилизации или контролируемой кристаллизации из обычных растворителей или из суперкритических сред. Предназначенное для ингаляции лекарственное средство можно вводить с помощью ингалятора, пригодного для конкретной формы, предназначенной для ингаляции, такие устройства хорошо известны в данной области. В соответствии с этим объектом изобретения является также фармацевтический продукт, представляющий собой описанные выше лекарственное средство или фармацевтическую композицию, в форме, пригодной для ингаляции, как она описана выше, в сочетании с одним или несколькими ингаляторами. Еще одним объектом изобретения является ингалятор или набор из двух или большего количества ингаляторов, которые включают лекарственное средство или фармацевтическую композицию, как они описаны выше, в форме, пригодной для ингаляции, как она описана выше. Если предназначенная для ингаляции форма действующего вещества представляет собой аэрозольную композицию, то ингалятор может представлять собой аэрозольный баллон, снабженный клапаном, приспособленным для выпуска определенной дозы, например от 10 до 100 мкл, например от 25 до 50 мкл, т.е. устройство, известное как ингалятор с дозирующим устройством. Такие пригодные аэрозольные баллоны и методы заполнения их аэрозольными композициями под давлением хорошо известны специалистам в области ингаляционной терапии. Например, аэрозольную композицию можно вводить с помощью баллона с покрытием, например, согласно методу, описанному в ЕР-А 0642992. Если предназначенная для ингаляции форма действующего вещества представляет собой распыляемую водную, органическую или водную/органическую дисперсию, то ингалятор может представлять собой известный распылитель, например обычный пневматический распылитель, такой как воздухоструйный распылитель или ультразвуковой распылитель, который может содержать, например, от 1 до 50 мл, обычно от 1 до 10 мл дисперсии; или ручной распылитель, иногда называемый ингалятором, создающим увлажняющий туман или увлажняющий спрей, например электронно управляемое устройство, такое как AERx (фирма Aradigm, США) или механическое устройство, такое как распылитель типа RESPIMAT (фирма Boehringer Ingelheim), который позволяет распылять намного меньшие объемы, чем обычные распылители, например от 10 до 100 мкл. Если предназначенная для ингаляции форма действующего вещества представляет собой форму, состоящую из тонкоизмельченных отдельных частиц, то ингалятор может представлять собой, например, ингалятор для сухого порошка, приспособленный для введения сухого порошка из капсулы или блистерной упаковки, содержащей сухой порошок, включающий стандартную дозу компонента (А) и/или (Б), или ингалятор для сухого порошка, содержащий несколько доз (МДПИ), приспособленный для введения при однократном нажатии, например, 3-25 мг сухого порошка, включающего стандартную дозу компонента (А) и/или (Б). Такие ингаляторы, пригодные для ингаляции сухого порошка, хорошо известны. Например, пригодным устройством для введения сухого порошка в капсулированной форме является устройство, описанное в патенте US 3991761, а пригодным МДПИ-устройством является устройство, описанное в WO 97/20589. Лекарственное средство по изобретению предпочтительно представляет собой фармацевтическую композицию, содержащую смесь указанного выше компонента (А) и указанного выше компонента (Б), предпочтительно в сочетании по меньшей мере с одним из описанных выше фармацевтически приемлемых носителей. Молярное соотношение соединения (А) и стероида (Б) в целом может составлять от 100:1 до 1:300, например от 50:1 до 1:100 или от 20:1 до 1:50, предпочтительно от 10:1 до 1:20, более предпочтительно от 5:1 до 1:10, от 3:1 до 1:7 или от 2:1 до 1:2. Соединение (А) и стероид (Б) можно вводить раздельно в указанных соотношениях. Пригодная для ингаляции суточная доза соединения (А), прежде всего в виде малеата, может составлять от 20 до 2000 мкг, например от 20 до 1500 мкг, от 20 до 1000 мкг, предпочтительно от 50 до 800 мкг, например от 100 до 600 мкг или от 100 до 500 мкг. Пригодная суточная доза стероида (Б) для ингаляции может составлять от 20 мкг до 5000 мкг, например от 20 до 4000 мкг, от 50 до 3000 мкг, от 50 до 2000 мкг, от 50 до 1000 мкг, от 50 до 500 мкг, от 50 до 400 мкг, от 50 до 300 мкг, от 50 до 200 мкг или от 50 до 100 мкг. Если компонент (Б) представляет собой будесонид, то пригодная суточная доза может составлять от 25 до 4800 мкг, например от 25 до 4000 мкг, от 25 до 3200 мкг, от 25 до 2400 мкг, от 25 до 1600 мкг, от 50 до 4800 мкг, от 50 до 4000 мкг, от 50 до 3200 мкг, от 50 до 2400 мкг, от 50 до 1600 мкг, от 100 до 4000 мкг, от 100 до 3200 мкг, от 100 до 2400 мкг, от 100 до 1600 мкг, от 100 до 800 мкг, от 100 до 400 мкг, от 200 до 4000 мкг, от 200 до 1600 мкг, от 200 до 800 мкг или от 200 до 400 мкг, предпочтительно от 100 до 1600 мкг. Если компонент (Б) представляет собой фуроат мометасона, пригодная суточная доза может составлять от 50 до 2000 мкг, например от 100 до 200 мкг, от 100 до 1600 мкг, от 100 до 1000 мкг или от 100 до 800 мкг, предпочтительно от 200 до 500 мкг, например от 200 до 400 мкг. Если (Б) представляет собой пропионат флутикасона, то пригодная суточная доза для ингаляции может составлять от 25 до 2000 мкг, например от 25 до 1500 мкг, от 25 до 1000 мкг, от 25 до 500 мкг, от 25 до 250 мкг, от 50 до 1500 мкг, от 50 до 1000 мкг, от 50 до 500 мкг, от 50 до 250 мкг, от 100 до 1500 мкг, от 100 до 1000 мкг, от 100 до 500 мкг, от 100 до 250 мкг, от 200 до 1500 мкг, от 200 до 1000 мкг или от 200 до 500 мкг, предпочтительно от 100 до 1000 мкг. Пригодная стандартная доза соединения (А), прежде всего в виде малеата, может составлять от 20 до 2000 мкг, например от 20 до 1500 мкг, от 20 до 1000 мкг, предпочтительно от 50 до 800 мкг, от 50 до 600 мкг или от 50 до 500 мкг. Пригодная стандартная доза будесонида может составлять от 25 до 2400 мкг, например от 50 до 2400 мкг, от 50 до 2000 мкг, от 50 до 1600 мкг, от 50 до 800 мкг, от 50 до 400 мкг, от 50 до 200 мкг, от 100 до 1600 мкг, от 100 до 800 мкг, от 100 до 400 мкг, от 100 до 200 мкг, от 200 до 1600 мкг, от 200 до 800 мкг или от 200 до 400 мкг, предпочтительно от 100 до 400 мкг. Пригодная стандартная доза фуроата мометасона может составлять от 25 до 2000 мкг, например от 50 до 1500 мкг, от 50 до 1000 мкг, от 50 до 800 мкг, от 50 до 400 мкг, от 50 до 200 мкг, от 50 до 100 мкг, от 100 до 800 мкг, от 100 до 400 мкг или от 100 до 200 мкг, предпочтительно от 100 до 400 мкг. Пригодная стандартная доза пропионата флутикасона может составлять от 25 до 1000 мкг, например от 25 до 500 мкг, от 25 до 250 мкг, от 25 до 200 мкг, от 50 до 1000 мкг, от 50 до 500 мкг, от 50 до 250 мкг, от 50 до 200 мкг, от 100 до 1000 мкг, от 100 до 500 мкг, от 100 до 250 мкг, от 100 до 200мкг, от 150 до 500 мкг или от 150 до 250 мкг, предпочтительно от 100 до 500 мкг. Эти стандартные дозы можно вводить один или два раза в день в соответствии с указанной выше предпочтительной суточной дозой. Точная применяемая доза должна, конечно, зависеть от подлежащего лечению состояния, пациента и эффективности ингалятора. В одном из предпочтительных вариантов осуществления изобретения, где фармацевтическая композиция по изобретению представляет собой сухой порошок в капсуле, содержащий стандартную дозу компонентов (А) и (Б), например, предназначенную для ингаляции с помощью ингалятора, вмещающего одну капсулу, причем капсула предпочтительно содержит стандартную дозу компонента (А), например, описанную выше, и стандартную дозу компонента (Б), например, описанную выше, наряду с описанным выше фармацевтически приемлемым носителем, взятом в количестве, необходимом для того, чтобы общая масса сухого порошка в капсуле составляла от 5 до 50 мг, например 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 мг. В другом предпочтительном варианте осуществления изобретения фармацевтическая композиция по изобретению представляет собой сухой порошок, предназначенный для введения из резервуара ингалятора для сухого порошка, вмещающего несколько доз, приспособленного для введения при одном нажатии от 3 до 25 мг порошка, содержащего стандартную дозу компонентов (А) и (Б), например, если компонент (А) находится в форме малеата, то порошок содержит от 20 до 2000 мас.ч., например от 60 до 1000 мас.ч., от 100 до 500 мас.ч., или от 100 до 300 мас.ч. компонента (А); от 25 до 800 мас.ч., например от 25 до 500 мас.ч., от 50 до 400 мас.ч., или от 100 до 400 мас.ч. компонента (Б); и от 2000 до 25000 мас.ч., например от 4000 до 15000 мас.ч. или от 4000 до 10000 мас.ч. описанного выше фармацевтически приемлемого носителя. В еще одном предпочтительном варианте осуществления изобретения лекарственное средство по изобретению представляет собой фармацевтическую композицию в виде аэрозоля, содержащего компоненты (А) и (Б), например, в указанном выше соотношении, в пропелленте, указанном выше, необязательно в сочетании с поверхностно-активным веществом и/или наполнителем и/или сорастворителем, таким как этанол, как описано выше, предназначенную для введения при однократном нажатии с помощью ингалятора с дозируемым клапаном, приспособленным для введения количества аэрозоля, содержащего стандартную дозу компонента (А) и стандартную дозу компонента (Б), или определенную часть стандартной дозы компонента (А) и определенную часть стандартной дозы компонента (Б). Так, если, например, ингалятор при однократном нажатии выпускает половину стандартных доз компонентов (А) и (Б), то стандартные дозы можно вводить путем двукратного нажатия. В соответствии с вышеизложенным в изобретении также предложен фармацевтический набор, включающий описанные выше компоненты (А) и (Б) в виде отдельных стандартных дозируемых форм, причем указанные формы пригодны для введения эффективных количеств компонентов (А) и (Б). Кроме того, такой набор дополнительно включает один или несколько ингаляторов, предназначенных для введения компонентов (А) и (Б). Например, набор может включать один или несколько ингаляторов для сухого порошка, приспособленных для введения сухого порошка из капсулы, вместе с капсулами, содержащими сухой порошок, включающий стандартную дозу компонента (А), и капсулами, содержащими сухой порошок, включающий стандартную дозу компонента (Б). В другом варианте набор может включать вмещающий несколько доз ингалятор для сухого порошка, имеющий в своем резервуаре сухой порошок, содержащий компонент (А), и вмещающий несколько доз ингалятор для сухого порошка, имеющий в своем резервуаре сухой порошок, содержащий компонент (Б). Еще в одном варианте набор может включать ингалятор с дозирующим клапаном, содержащий аэрозоль, который представляет собой компонент (А) в пропелленте, и ингалятор с дозирующим клапаном, содержащий аэрозоль, который представляет собой компонент (Б) в пропелленте. Лекарственные средства по изобретению, обладающие высокими бронхолитическими и противовоспалительными свойствами, предпочтительно применяют при лечении воспалительных или обструктивных заболеваний дыхательных путей. Например, можно применять совместную терапию по изобретению с целью уменьшения доз кортикостероида, необходимого для достижения требуемого терапевтического действия, по сравнению с дозами, необходимыми при лечении только одним кортикостероидом, тем самым минимизируя возможные побочные действия. Такие композиции, прежде всего в том случае, когда компоненты (А) и (Б) находятся в составе одной композиции, позволяют достигать высокого противовоспалительного действия, вследствие чего количество кортикостероида, необходимого для достижения требуемого противовоспалительного действия, можно уменьшать при его применении в смеси с соединением формулы I, уменьшая тем самым риск возникновения побочных действий в результате многократного применения стероида, используемого для лечения воспалительных или обструктивных заболеваний дыхательных путей. Кроме того, с использованием композиций по изобретению, прежде всего композиций, содержащих компоненты (А) и (Б), можно приготавливать лекарственные средства, обладающие быстрым началом действия и большой продолжительностью действия. Кроме того, для осуществления такой совместной терапии можно приготавливать лекарственные средства, которые существенно улучшают функцию легких. Согласно другому варианту осуществления изобретения для осуществления совместной терапии по изобретению можно приготавливать лекарственные средства, обеспечивающие эффективный контроль обструктивных или воспалительных заболеваний дыхательных путей или снижение обострения таких заболеваний. Согласно еще одному варианту осуществления изобретения на основе композиций, содержащих компоненты (А) и (Б), можно приготавливать лекарственные средства, которые уменьшают или исключают необходимость лечения с использованием обладающих кратковременным действием лекарственных средств, применяемых для экстренного лечения, таких как салбутамол или тербуталин; таким образом, композиции по изобретению, содержащие компоненты (А) и (Б), позволяют облегчать лечение обструктивного или воспалительного заболевания дыхательных путей с помощью одного лекарственного средства. Лечение воспалительных или обструктивных заболеваний дыхательных путей согласно изобретению может представлять собой симптоматическое или профилактическое лечение. Воспалительные или обструктивные болезни дыхательных путей, для которых применимо настоящее изобретение, включают астму любого типа и происхождения, в том числе наследственную (неаллергическую) бронхиальную астму и приобретенную (аллергическую) бронхиальную астму, слабую астму, астму средней тяжести, тяжелую астму, бронхиальную астму, астму, вызываемую физической нагрузкой, астму, вызываемую закупоркой, и инфекционно-аллергическую бронхиальную астму. Следует понимать, что лечение астмы также охватывает лечение пациентов, например, возрастом менее 4 или 5 лет, у которых имеются симптомы стридора и которые диагностированы или могут быть диагностированы как “стридорные дети”, представляющие собой определенную категорию пациентов, имеющую важное медицинское значение, и которых в настоящее время часто относят к ранним астматикам или астматикам первой фазы. (Для удобства это конкретное астматическое состояние называют “синдромом стридорного ребенка”.) Эффективность профилактического лечения астмы может быть оценена по уменьшению частоты или серьезности симптоматических приступов, например острого приступа астмы или бронхостеноза, по улучшению функции легких или улучшению гиперреактивности дыхательных путей. Кроме того, она может быть оценена по уменьшению потребности в другой симптоматической терапии, т.е. терапии, предназначенной или предлагаемой для ограничения или прекращения симптоматических приступов, когда они начинаются, например, терапии с применением противовоспалительных (например, кортикостероидов) или бронхолитических средств. Профилактическое действие в отношении астмы может быть особенно наглядно продемонстрировано на пациентах, подверженных “утреннему погружению”. “Утреннее погружение” представляет собой известный астматический синдром, характерный для значительного процента астматиков и характеризующийся приступом астмы, например между 4 и 6 часами утра, т.е. в период времени, обычно существенно отдаленный от времени осуществления какой-либо ранее проводимой симптоматической терапии. Другие воспалительные или обструктивные заболеванмя и состояния дыхательных путей, для которых применимо настоящее изобретение, включают острую травму легкого (ОТЛ), острый респираторный дистресс-синдром (ОРДС), хроническую обструктивную легочную болезнь, болезнь дыхательных путей или легких (ХОЗЛ (хроническое обструктивное заболевание легких), ХОБ (хроническая обструкция бронхов) или ХОП (хроническая обструктивная пневмония)), включая хронический бронхит и эмфизему, бронхоэктаз и обострение реактивности дыхательных путей вследствие другой лекарственной терапии, в частности терапии с применением ингаляции другого лекарственного средства. Другие воспалительные или обструктивные заболевания дыхательных путей, для которых применимо настоящее изобретение, включают пневмокониоз (воспалительное часто встречающееся заболевание легких, которое часто сопровождается хронической или острой обструкцией дыхательных путей, возникающей вследствие многократного вдыхания пыли) любого типа или происхождения, включая, например, алюминоз, антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз и биссиноз. Изобретение проиллюстрировано с помощью приведенных ниже примеров, в которых части представляют собой мас.ч., если не указано иное. В примерах соединение А обозначает соединение формулы I в форме малеата, Буд обозначает будесонид, ПФ обозначает пропионат флутикасона, ФМ фуроат мометасона и ОК обозначает олеиновую кислоту (поверхностно-активное вещество). Примеры получения Пример получения 1. 3-Хлор-1-(3,4-диэтилфенил)-1-пропанон 1,2-Диэтилбензол (10,9 г, 74,6 ммоль) и пропионилхлорид (9,7 г, 74,6 ммоль) добавляют по каплям в течение 30 мин к AlCl3 (22,3 г, 167,8 ммоль) в нитрометане (75 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, после чего добавляют 70 г льда и 14 мл концентрированной серной кислоты. Водную фазу экстрагируют простым эфиром и объединенные органические фазы экстрагируют 2н. HCl и насыщенным водным раствором NaCl. Затем органическую фазу обрабатывают активированным углем, сульфатом магния и фильтруют и растворитель удаляют в вакууме. 1Н-ЯМР (CDCl3) част./млн: 7,8 (1Н, s, Ar); 7,7 (1Н, d, Ar); 7,2 (1Н, d, Ar); 3,9 (2Н, t, СН2); 3,4 (2Н, t, CH2); 2,8 (4Н, q, СН2СН3); 1,2 (6Н, m, СН3). Пример получения 2. 5,6-Диэтилиндан-1-он 3-Хлор-1-(3,4-диэтилфенил)-1-пропанон (15,5 г) растворяют в 66 мл концентрированной серной кислоты и нагревают до 90°С в течение 4 ч. Реакционную смесь охлаждают, добавляют лед (70 г) и водный раствор дважды экстрагируют толуолом. Органический слой промывают бикарбонатом натрия, насыщенным водным раствором NaCl и обрабатывают активированным углем и сульфатом магния. После фильтрации растворитель удаляют в вакууме. Продукт очищают с помощью экспресс-хроматографии на колонке (диоксид кремния, гексан/этилацетат 10:1) и затем кристаллизуют в гексане. 1Н-ЯМР (CDCl3) част./млн: 7.6 (1Н, s, Ar); 7.3 (1Н, d, Ar); 3.1 (2Н, m, CH2); 2.7 (6Н, m, СН2+СН2СН3); 1.2 (6Н, т, СН3). Пример получения 3. 5,6-Диэталиндан-1,2-дион-2-оксим 5,6-Диэтилиндан-1-он (5 г, 26 ммоль) в метаноле (75 мл) нагревают до 40°С, добавляют по каплям н-бутилнитрит (3,0 г, 28,6 ммоля), а затем добавляют концентрированную HCl (1,25 мл). Через 1 ч реакционную смесь охлаждают до комнатной температуры и отфильтровывают осадившийся продукт, промывают охлажденным на льду метанолом и сушат. 1Н-ЯМР (d6-ДМСО) част./млн: 12,6 (1Н, s, ОН); 7,4 (1Н, s, Ar); 7,3 (1Н, d, Ar); 3,6 (2Н, s, СН2); 2,6 (4Н, m, CH2CH3); 1,1 (6Н, m, СН3). Пример получения 4. Гидрохлорид 5,6-диэтилиндан-2-иламина 5,6-Диэтилиндан-1,2-дион-2-оксим (4,5 г) добавляют к смеси уксусной кислоты (150 мл) и концентрированной серной кислоты (4,5 мл). Добавляют 5%-ный Pd/C (1,5 г), реакционную смесь дегазируют азотом и гидрируют в течение 5 ч. Затем катализатор удаляют фильтрацией, значение рН доводят до 10 с помощью 4М NaOH и раствор экстрагируют хлороформом. Органическую фазу сушат над сульфатом магния и растворитель удаляют в вакууме. Остаток повторно растворяют в минимальном количестве простого эфира и добавляют простой эфир, насыщенный HCl. Осадок белого цвета фильтруют и сушат, получая гидрохлорид 5,6-диэтилиндан-2-иламина. 1Н-ЯМР (d6-ДМСО) част./млн: 8,7 (3Н, bd s, NH3); 7,3 (2Н, s, Ar); 4,2 (1H, bd s, CH); 3,5 (2H, dd, CH2); 3,3 (2H, dd, CH2); 2,8 (4Н, q, CH2СН3); 1,4 (6Н, t, СН3). Пример получения 5. 8-Бензилокси-5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-1Н-хинолин-2-он Раствор (R)-8-бензилокси-5-оксиранилкарбостирила (5,00 г) и 5,6-диэтилиндан-2-иламина (3,87 г) в н-бутаноле выдерживают в течение 4 ч при 110°С. После охлаждения до комнатной температуры добавляют толуол (100 мл) и органическую фазу промывают водой (3×25 мл), загружают в хроматографическую колонку с силикагелем и элюируют толуолом, а затем смесью толуол : этанол : этилацетат : концентрированный аммиак (45:10:45:2), получая указанное в заголовке соединение. Пример получения 6. Соединение А: малеат 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1Н-хинолин-2-она 8-Бензилокси-5-[(R)2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-1Н-хинолин-2-он (360 мг) растворяют в метаноле (10 мл) и у образовавшегося соединения удаляют защитные группы путем добавления каталитического количества 10%-ного палладия на угле и помещая раствор в атмосферу водорода. По данным анализа с помощью тонкослойной хроматографии (ТСХ) реакция завершается через 4 ч. Катализатор отфильтровывают и растворитель удаляют в вакууме. Продукт растворяют в изопропаноле и добавляют раствор малеиновой кислоты в изопропаноле. После перекристаллизации из этанола получают указанное в заголовке соединение. ТСХ (диоксид кремния, дихлорметан/метанол 10:1 Rf=0,05). ES+MC m/e 393 (МН+). Примеры 1-60 Приготавливают желатиновые капсулы, пригодные для использования в капсульном ингаляторе, таком как ингалятор, описанный в патенте US 3991761, причем каждая капсула содержит сухой порошок, который получают путем смешения соединения А и будесонида, предварительно размолотого в воздухоструйной мельнице до получения частиц, имеющих средний диаметр 1-5 мкм, и моногидрата лактозы, имеющего диаметр частиц менее 212 мкм, при этом используют количества компонентов, указанные в приведенной ниже таблице:
Примеры 61-90 Применяют метод, описанный для примеров 1-60, но заменяют будесонид фуроатом мометасона (ФМ) и используют количества компонентов, указанные в приведенной ниже таблице:
Примеры 91-135 Сухой порошок, пригодный для введения из резервуара ингалятора, вмещающего несколько доз, описанного в WO 97/20589, получают путем смешения соединения А и пропионата флутикасона (ПФ), который предварительно размалывают до получения частиц со средним диаметром 1-5 мкм, моногидрата лактозы, имеющего диаметр частиц менее 212 мкм, при этом используют количества компонентов, указанные в приведенной ниже таблице:
Примеры 136-163 Аэрозольные композиции получают следующим образом: вносят тонко измельченные действующие вещества и при необходимости лактозу, используемую в качестве наполнителя, в баллон, герметически закрывают баллон дозирующим клапаном, вводят путем инъекции через клапан предварительно подготовленную смесь этанола/пропеллента и необязательно поверхностно-активного вещества и подвергают баллон облучению ультразвуком для диспергирования твердых частиц. Компоненты и используемые количества представлены в приведенных ниже таблицах:
Примеры 164-199 Повторяют процедуру, которую применяют для примеров 91-135, но заменяют пропионат флутикасона на фуроат мометасона и используют количества, указанные в приведенной ниже таблице.
Примеры 200-236 Повторяют процедуру, которую применяют для примеров 136-163, но используют количества, указанные в приведенной ниже таблице, причем в некоторых из примеров не применяют этанол:
Пример 237-245 Повторяют процедуру, которую применяют для примеров 136-163, но используют в качестве поверхностно-активного вещества триолеат сорбитана (ТС) вместо олеиновой кислоты, количества ингредиентов указаны в приведенной ниже таблице:
Формула изобретения
1. Лекарственное средство, содержащее соединение (А) формулы I в свободной форме или в форме фармацевтически приемлемой соли или сольвата и (Б) кортикостероид, как комбинированный препарат для одновременного, последовательного или раздельного введения для лечения воспалительного или обструктивного заболевания дыхательных путей, где молярное соотношение компонентов (А) и (Б) составляет от 100:1 до 1:300. 2. Лекарственное средство по п.1, представляющее собой фармацевтическую композицию, содержащую смесь эффективных количеств компонентов (А) и (Б) необязательно в сочетании по меньшей мере с одним фармацевтически приемлемым носителем. 3. Лекарственное средство по п.1 или 2, где компонент (А) представляет собой соединение формулы I в форме малеата. 4. Лекарственное средство по п.1, 2 или 3, где кортикостероид (Б) представляет собой соединение формулы или его 1,2-дигидропроизводное, где R1 обозначает С1-С4алкил, необязательно замещенный галогеном, гидрокси-, С1-С4алкокси-, ацилокси- или ацилтиогруппу, или R1 обозначает С1-С4алкокси или С1-С4алкилтиогруппу, необязательно замещенную галогеном, или R1 обозначает 5- или 6-членную гетероциклилтиогруппу, причем либо R2 обозначает ацилоксигруппу и R3 обозначает водород или С1-С4алкил, либо R2 и R3 вместе обозначают группу формулы где R4 обозначает С1-С4алкил или С3-Сбциклоалкил и R5 обозначает водород или С1-С4алкил, и X1 и X2 каждый независимо друг от друга обозначает водород, хлор или фтор. 5. Лекарственное средство по любому из пп.1-4, где кортикостероид (Б) представляет собой дипропионат бекламетасона, будесонид, пропионат флутикасона, фуроат мометасона, циклесонид, ацетонид триамцинолона, флунисолид, пальмитат рофлепонида, пропионат бутиксокорта или энбутат икометазона. 6. Лекарственное средство по п.5, где кортикостероид (Б) представляет собой будесонид, пропионат флутикасона или фуроат мометасона. 7. Лекарственное средство по любому из пп.1-6 в форме, пригодной для ингаляции, такой как аэрозоль, содержащее смесь компонентов (А) и (Б) в виде раствора или дисперсии в пропелленте или комбинацию аэрозоля, содержащего компонент (А) в виде раствора или дисперсии в пропелленте, и аэрозоля, содержащего компонент (Б) в виде раствора или дисперсии в пропелленте. 8. Лекарственное средство по любому из пп.1-6 в форме, пригодной для ингаляции, такой как распыляемая композиция, содержащая дисперсию компонентов (А) и (Б) в водной, органической или водно/органической среде или комбинацию дисперсии компонента (А) в указанной среде и дисперсии компонента (Б) в указанной среде. 9. Лекарственное средство по любому из пп.1-6, где компонент (А) и/или компонент (Б) находятся в форме, пригодной для ингаляции, такой как сухой порошок, содержащий тонко измельченные компоненты (А) и/или (Б) необязательно вместе по меньшей мере с одним состоящим из отдельных частиц фармацевтически приемлемым носителем. 10. Лекарственное средство по п.7 или 9, где компоненты (А) и/или (Б) имеют средний диаметр частиц до 10 мкм. 11. Лекарственное средство по любому из предыдущих пунктов, где молярное соотношение компонентов (А) и (Б) составляет от 5:1 до 1:10. 12. Лекарственное средство по любому из предыдущих пунктов, где молярное соотношение компонентов (А) и (Б) составляет от 3:1 до 1:7. 13. Лекарственное средство по любому из предыдущих пунктов, где молярное соотношение компонентов (А) и (Б) составляет от 2:1 до 1:2. 14. Лекарственное средство по п.2, которое представляет собой сухой порошок в капсуле, где капсула содержит стандартную дозу компонента (А), стандартную дозу компонента (Б) и фармацевтически приемлемый носитель, в количестве, необходимом для того, чтобы общая масса сухого порошка в капсуле составляла от 5 до 50 мг. 15. Лекарственное средство по п.2, которое представляет собой сухой порошок, содержащий от 20 до 2000 частей компонента (А) в форме малеата, от 25 до 800 частей компонента (Б) и от 2000 до 25000 частей фармацевтически приемлемого носителя. 16. Лекарственное средство по п.2, которое представляет собой аэрозоль, содержащий компоненты (А) и (Б), в соотношении, указанном в п.12 или 13, в пропелленте, необязательно в сочетании с поверхностно-активным веществом и/или наполнителем и/или сорастворителем, предназначенное для введения при однократном нажатии с помощью ингалятора с дозируемым клапаном, приспособленного для введения количества аэрозоля, содержащего стандартную дозу компонента (А) и стандартную дозу компонента (Б), или определенную часть стандартной дозы компонента (А) и определенную часть стандартной дозы компонента (Б). 17. Фармацевтический набор, содержащий компонент (А), как он определен в п.1 или 3, и компонент (Б), как он определен в любом из пп.1 и 4-6, как комбинированный препарат в виде раздельных стандартных дозируемых форм, причем указанные формы пригодны для введения эффективных количеств компонентов (А) и (Б), а также один или несколько ингаляторов для введения компонентов (А) и (Б).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||