|
(21), (22) Заявка: 2003130376/15, 26.04.2002
(24) Дата начала отсчета срока действия патента:
26.04.2002
(30) Конвенционный приоритет:
27.04.2001 FR 01/05,843
(43) Дата публикации заявки: 10.04.2005
(46) Опубликовано: 10.02.2007
(15) Информация о коррекции:
Версия коррекции № 1 (
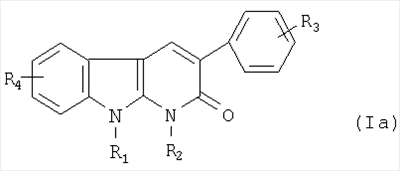
где:
– R1 представляет собой атом водорода или метильную либо этильную группу;
– R2 представляет собой метильную или этильную группу; или
– R1 и R2 вместе образуют группу (СН2)3;
– r3 представляет собой либо фенильную группу, возможно, замещенную атомом галогена или метильной либо метоксигруппой или тиенильную группу;
– R4 представляет собой водород, или атом хлора, или метильную или метоксигруппу.
В описании указанного документа упоминается, что соединения формулы (I), которые обладают сродством к омега-модуляторным сайтам, ассоциированным с GABAA (гамма-аминоуксусной кислоты, тип А) рецепторами, можно применять при лечении заболеваний, связанных с нарушениями GABAергической трансмиссии, относящимися к GABAA подтипам рецепторов, таких как тревога, нарушения сна, эпилепсия и так далее.
Теперь обнаружено, что соединения формулы (I) являются противораковыми агентами, которые ингибируют пролиферацию опухолевых клеток и которые обладают антимитотическими свойствами.
Данное изобретение относится к применению соединений формулы (I), как она описана выше, и их фармацевтически приемлемых солей, гидратов или сольватов для приготовления лекарственных продуктов, которые полезны в качестве противораковых агентов.
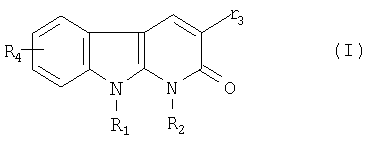
Предпочтительные соединения по изобретению представляет собой соединения формулы
где:
– R1 представляет собой атом водорода или метильную либо этильную группу;
– R2 представляет собой метильную или этильную группу; или
– R1 и R2 вместе образуют группу (СН2)3;
– R3 представляет собой атом водорода или галогена или метильную или метоксигруппу;
– R4 представляет собой атом водорода или хлора или метильную или метоксигруппу.
Особенно предпочтительные соединения по изобретению представляют собой соединения формулы

где:
– R1 представляет собой атом водорода или метильную либо этильную группу;
– R2 представляет собой метильную или этильную группу;
– R3 представляет собой атом водорода или галогена или метильную или метоксигруппу;
– R4 представляет собой атом водорода или хлора или метильную или метоксигруппу.
Более конкретно предпочтительные соединения по изобретению представляют собой соединения формулы

где:
– R1 представляет собой метильную или этильную группу;
– R2 представляет собой метильную или этильную группу;
– R3 представляет собой атом водорода или галогена или метильную или метоксигруппу;
– R4 представляет собой атом водорода или хлора или метильную или метоксигруппу.
В качестве примера соединениями по изобретению являются следующие:
– 6-хлор-1,9-диметил-3-фенил-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он; температура плавления 178,5-179,5°С;
– 3-(4-метоксифенил)-1,9-диметил-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он; температура плавления 166-167°С;
– 1,6,9-триметил-3-(3-тиенил)-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он;
ЯМР (ядерный магнитный резонанс) (200 МГц): 2.6 м.д. (миллионных долей): s: 3H; 4.1 м.д.: s: 3H; 4.2 м.д.: s: 3H; 7.1 м.д.: d: 1H; 7.4-7.9 м.д.: m: 4H; 8.3 м.д.: d: 1Н; 8.7 м.д.: s: 1H;
– 1,6,9-триметил-3-фенил-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он; температура плавления 198-199°С;
– 1,6-диметил-3-фенил-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он;
ЯМР (200 МГц): 2.5 м.д.: s: 3H; 3.8 м.д.: s: 3H; 7.1 м.д.: d: 1H; 7.3-7.5 м.д.: m: 4H; 7.75 м.д.: d: 2Н; 7.8 м.д.: s: 1 Н; 8.4 м.д.: s: 1Н; 11.8 м.д.: s: 1 Н.
Соединения формулы (I) получают способом, описанным в документе FR 9708409.
Соединения формулы (I) по настоящему изобретению испытывали in vitro на линии клеток рака молочной железы человека – линии MDA-MB-231, имеющейся в американской коллекции типовых культур (см. НТВ26).
Оценку антипролиферативного действия осуществляли согласно J. М. Derocq et al., FEBS Letters, 1998, 425, 419-425: степень включения [3Н]тимидина в ДНК (дезоксирибонуклеиновая кислота) обработанных клеток измеряют через 96 часов инкубации соединения формулы (I). 50% ингибирующую концентрацию (IC50) определяют как концентрацию, которая ингибирует пролиферацию клеток на 50%.
Соединения по изобретению имеют значение IC50 обычно менее 10 мкМ для линии MDA-MB-231.
Соединения формулы (I) также испытывали на линии клеток рака молочной железы человека, упоминаемой как линия MDR с множественной устойчивостью к лекарствам и известной как MDA-A1. Эта линия описана Е.Collomb, С.Dussertand Р.М.Martin в Cytometry, 1991, 12(1), 15-25.
Термин “множественная устойчивость к лекарствам”, который характеризует эту линию, означает, что указанная линия является в основном относительно нечувствительной к обычно применяемым химиотерапевтическим лекарствам и, в частности, к антимитотическим агентам природного происхождения, таким как паклитаксел, винкристин и винбластин.
Соединения по изобретению имеют значение IC50 обычно ниже 10 мкМ для линии MDA-A1 с множественной устойчивостью к лекарствам.
Соединение формулы (I) по настоящему изобретению, 1,6,9-триметил-3-фенил-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он (именуемое далее как «соединение») тестировали на противоопухолевую активность против следующих клеточных линий, полученных из Американской коллекции типовых культур (12301 Parklawn drive, Rockville, Maryland 20852, USA): MDA-MB-231 (аденокарцинома молочной железы); MCF7 (аденокарцинома молочной железы); РС3 (аденокарцинома предстательной железы); LnCap (метастатическая аденокарцинома предстательной железы); DU145 (карцинома предстательной железы); НТ29 (аденокарцинома толстой кишки, степень II); НСТ15 (аденокарцинома толстой кишки); А431 (сквамозноклеточная карцинома); NCI-H209 (мелкоклеточный рак легкого) и U87 (глиобластома, степень III).
Тестирование соединения включало оценку антипролиферативного действия согласно процедуре, описанной J.M.Derocq et al., FEBS Letters, 1998, 425, 419-425. Степень включения [3Н]тимидина в ДНК обработанных клеток измеряли через 96 часов инкубации с соединением.
Результаты описанного выше тестирования представлены в следующей таблице:
| Опухоль |
Гистопатологическое происхождение |
IC50(мкМ) |
| MDA-MB-231 |
аденокарцинома молочной железы |
менее 10 |
| MCF7 |
аденокарцинома молочной железы |
менее 10 |
| РС3 |
аденокарцинома предстательной железы |
менее 10 |
| LnCap |
метастатическая аденокарцинома предстательной железы |
менее 10 |
| DU145 |
карцинома предстательной железы |
менее 10 |
| НТ29 |
аденокарцинома толстой кишки, степень II |
менее 10 |
| НСТ15 |
аденокарцинома толстой кишки |
менее 10 |
| А431 |
сквамозноклеточная карцинома |
менее 10 |
| NCI-H209 |
мелкоклеточный рак легкого |
менее 10 |
| U87 |
глиобластома, степень III |
менее 10 |
Как видно из представленных результатов, соединение высокоактивно против многочисленных клеточных линий различного гистопатологического происхождения.
Таким образом, согласно настоящему изобретению, соединения формулы (I) ингибируют пролиферацию опухолевых клеток, включая пролиферацию клеток, проявляющих множественную устойчивость к лекарствам.
Некоторые соединения по изобретению оценивали in vivo на модели ксенотрансплантата человеческих опухолей, имплантированных подкожно SCID (Severe Combined Immuno Deficiency, с тяжелым комбинированным иммунодефицитом) иммунодефицитным мышам.
Лечение животных соединением по изобретению начинали через 6-7 суток после имплантации, когда опухоль достигала массы приблизительно 60 мг. Соединение в виде раствора в растворителе вводили перорально.
Противоопухолевую активность оценивали, когда средняя масса опухоли достигала приблизительно 1000 мг у контрольных животных, которых обрабатывали одним растворителем: измеряли отношение Т/С, где Т представляет собой среднюю массу опухолей у животных, которых лечили, и С представляет собой среднюю массу опухолей у контрольных животных. Соотношение Т/С, меньшее или равное 42% расценивают как указывающее на значительное противоопухолевое действие согласно Stuart et al., J. Med. Chem., 2001, 44 (11), 1758-1776. При введенной суммарной суточной дозе между 50 и 300 мг/кг определенные соединения по изобретению показывали соотношение Т/С менее 20%.
Соединения формулы (I) и их фармацевтически приемлемые соли, гидраты или сольваты полезны для предупреждения или лечения заболеваний, вызванных или осложненных пролиферацией опухолевых клеток, таких как первичные или метастатические опухоли, карциномы и разные виды рака, в частности: рак молочной железы; рак легких; рак тонкой кишки; рак толстой кишки и прямой кишки; рак дыхательных путей, ротоглотки и гортаноглотки; рак пищевода; рак печени, рак желудка, рак желчных протоков; рак желчного пузыря, рак поджелудочной железы; разные виды рака мочевых путей, включая почки, уротелий и мочевой пузырь; виды рака женских половых органов, включая рак матки, шейки матки и яичников; хлориокарциному и трофобластому; виды рака мужских половых органов, включая рак простаты, семенных пузырьков и яичек, и опухоли эмбриональных клеток; виды рака эндокринных желез, включая рак щитовидной железы, гипофиза и надпочечников; виды рака кожи, включая гемангиомы, меланомы и саркомы, включая саркому Калоши; опухоли головного мозга, нервов, глаз, оболочек мозга, включая астроцитомы, глиомы, глиобластомы, ретинобластомы, нейриномы, нейробластомы, шванномы и менингиомы; опухоли, возникающие из злокачественных опухолей гемопоэтической системы, включая лейкемии, хлоромы, плазмацитомы, грибовидный микоз, лимфому или Т-клеточную лейкемию, неходжкинскую лимфому, злокачественные болезни крови и миеломы.
Соединения указанной выше формулы (I) можно применять в суточных дозах от 0,002 до 2000 мг на килограмм массы тела млекопитающего, которого нужно лечить, предпочтительно в суточных дозах от 0,1 до 300 мг/кг. Для человека эта доза может предпочтительно находиться в интервале от 0,02 до 10000 мг в сутки и более предпочтительно от 1 до 3000 мг в зависимости от возраста субъекта, которого лечат, или типа лечения (профилактическое или лечебное).
В соответствии с другими аспектами настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного начала эффективную дозу по меньшей мере одного соединения по изобретению или фармацевтически приемлемой соли, гидрата или сольвата указанного соединения а также один или более чем один фармацевтически приемлемый эксципиент.
Указанные эксципиенты выбирают в соответствии с фармацевтической формой и желательным способом введения, из обычных эксципиентов, которые известны из уровня техники.
Фармацевтические композиции по настоящему изобретению можно приготовить для перорального, сублингвального, подкожного, внутримышечного, внутривенного, местного, локального, интратрахеального, интраназального, чрескожного или ректального введения человеку и животным для предупреждения или лечения указанных выше заболеваний.
Подходящие формы введения включают пероральные формы, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы для сублингвального, защечного, интратрахеального, внутриглазного и интраназального введения, для введения путем ингаляции, формы для местного, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для местного нанесения соединения по изобретению можно применять в кремах, гелях, мазях или лосьонах.
В соответствии с традиционной практикой дозировку, которая подходит для каждого пациента, определяет врач в соответствии со способом введения, возрастом, массой и реакцией указанного пациента.
Соединения по изобретению могут быть приготовлены в виде, например, следующих лекарственных продуктов.
1. Раствор для инъекций
| Соединение по изобретению |
5,0 г |
| Хлорид натрия для инъекций |
6,0 г |
| Гидроксид натрия для доведения рН до значения |
5-7 |
| Вода для инъекций |
до 1000 мл |
Соединение и хлорид натрия растворяют в 500 мл воды. pH раствора доводят до требуемого значения с помощью раствора гидроксида натрия, а затем добавляют воду до конечного объема 1000 мл. Полученный раствор фильтруют через фильтр 22 мкм и немедленно разливают в стерильные ампулы на 10 мл. Ампулы запаивают.
2. Таблетки
| Соединение по изобретению |
100,0 г |
| Лактоза |
200,0 г |
| Поливинилпирролидон |
30,0 г |
| Микрокристаллическая целлюлоза |
30,0 г |
| Стеарат магния |
6,0 г |
Соединение и лактозу смешивают с водным раствором поливинилпирролидона. Смесь высушивают и размалывают с образованием гранул, с которыми затем смешивают микрокристаллическую целлюлозу, а затем стеарат магния. Затем полученную смесь прессуют в таблетки в таблеточной машине, получая 1000 таблеток, каждая из которых содержит 100 мг соединения.
Формула изобретения
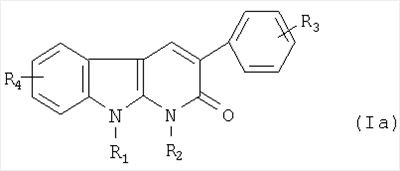
1. Применение соединения формулы
где R1 представляет собой атом водорода или метильную или этильную группу;
R2 представляет собой метильную или этильную группу; или
R1 и R2 вместе образуют группу (СН2)3;
r3 представляет собой либо фенильную группу, возможно замещенную атомом галогена или метильной или метоксигруппой, или тиенильную группу;
R4 представляет собой атом водорода или хлора или метильную или метоксигруппу;
для приготовления лекарственных продуктов, которые полезны в качестве противораковых агентов.
2. Применение по п.1 соединения формулы
где R1 представляет собой атом водорода или метильную или этильную группу;
R2 представляет собой метильную или этильную группу; или
R1 и R2 вместе образуют группу (СН2)3;
R3 представляет собой атом водорода или галогена или метильную или метоксигруппу;
R4 представляет собой атом водорода или хлора или метильную или метоксигруппу.
3. Применение по п.1 или 2 соединения формулы

где R1 представляет собой атом водорода или метильную или этильную группу;
R2 представляет собой метильную или этильную группу;
R3 представляет собой атом водорода или галогена или метильную или метоксигруппу;
R4 представляет собой атом водорода или хлора или метильную или метоксигруппу.
4. Применение одного из соединений, указанных ниже:
6-хлор-1,9-диметил-3-фенил-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он;
3-(4-метоксифенил)-1,9-диметил-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он;
1,6,9-триметил-3-(3-тиенил)-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он;
1,6,9-триметил-3-фенил-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он;
1,6-диметил-3-фенил-1,9-дигидро-2Н-пиридо[2,3-b]индол-2-он;
для приготовления лекарственных продуктов, которые полезны в качестве противораковых агентов.
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция в тексте формулы изобретения
Извещение опубликовано: 20.06.2007 БИ: 17/2007
|