|
|
(21), (22) Заявка: 2005101639/15, 25.07.2003
(24) Дата начала отсчета срока действия патента:
25.07.2003
(30) Конвенционный приоритет:
25.07.2002 (пп.1-21) US 60/398,427
25.07.2002 (пп.1-21) US 60/398,447
(43) Дата публикации заявки: 10.08.2005
(46) Опубликовано: 10.02.2007
(56) Список документов, цитированных в отчете о
поиске:
RU 2205007 С2, 10.05.2002. WO 97/04752 A1, 13.02.1997. US 2002049230 A, 25.04.2002. RU 2023712 C1, 06.12.1991.
(85) Дата перевода заявки PCT на национальную фазу:
24.01.2005
(86) Заявка PCT:
US 03/23418 (25.07.2003)
(87) Публикация PCT:
WO 2004/010998 (05.02.2004)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
ЭМИДОН Грегори Э. (US),
ГАНОРКАР Локсидх Д. (US),
ХАЙМЛИХ Джон М. (US),
ЛИ Эрнест Дж. (US),
МАРТИНО Элис К. (US),
НОАК Роберт М. (US),
РЕО Джозеф П. (US),
СКОУГ Конни Дж. (US)
(73) Патентообладатель(и):
ФАРМАЦИЯ КОРПОРЕЙШН (US)
|
(54) ТАБЛЕТКА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩАЯ РЕБОКСЕТИН
(57) Реферат:
Настоящее изобретение относится к медицине и описывает фармацевтическую композицию с замедленным высвобождением в форме таблетки, доставляемой перорально, содержащую активный фармацевтический агент, выбранный из (S,S)-ребоксетина или его соли и прамипексола или его соли, активный фармацевтический агент составляет приблизительно от 0,01 мас.% приблизительно до 25 мас.% композиции и диспергирован в матриксе, содержащем гидрофильный полимер и крахмал, имеющий прочность на разрыв по меньшей мере приблизительно 0,15 кН·см-2, по меньшей мере приблизительно 0,175 кН·см-2 или по меньшей мере приблизительно 0,2 кН·см-2, при доле твердого вещества, характерной для таблетки, где гидрофильный полимер составляет приблизительно от 20 мас.% приблизительно до 70 мас.% композиции, и крахмал составляет приблизительно от 25 мас.% приблизительно до 75 мас.% композиции. Также описан способ определения пригодности крахмала и применение композиции для лечения нарушения или состояния, выбранного из депрессивного психоза, невропатической боли и болезни Паркинсона. Крахмал с указанной прочностью на разрыв позволяет таблетке выдерживать высокоскоростную операцию таблетирования, в то же время обеспечивая терапевтический эффект пролонгированного высвобождения лекарственного средства, что позволяет принимать таблетку один раз в день. 4 н. и 17 з.п. ф-лы, 9 табл., 5 ил.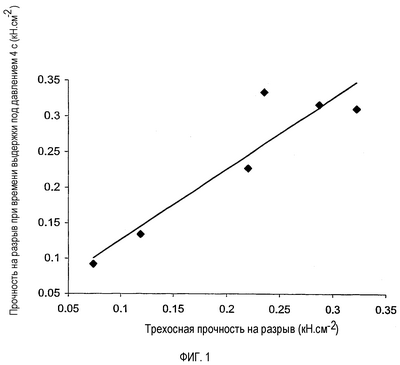
Область техники, к которой относится изобретение
Настоящее изобретение относится к композициям для таблеток и конкретнее к композиции таблетки с замедленным высвобождением для пероральной доставки водорастворимого лекарственного средства или пролекарства.
Предпосылки создания изобретения
Многие активные фармацевтические агенты, в том числе лекарственные средства и пролекарства, составляют как доставляемые перорально лекарственные формы, обеспечивающие отсроченное высвобождение (иначе называемое медленным высвобождением или продолжительным высвобождением) таких средств на протяжении периода времени, позволяющего вводить средство один раз в сутки. Хорошо известная система для приготовления таких лекарственных форм включает матрикс, содержащий гидрофильный полимер, в котором диспергировано средство; средство высвобождается в течение некоторого периода времени в желудочно-кишечном тракте после растворения или разрушения матрикса. Лекарственные формы с замедленным высвобождением, содержащие такую матриксную систему, обычно получают в виде прессованных таблеток, называемых в данном случае “матриксными таблетками”.
Лекарственные средства и пролекарства, имеющие относительно высокую растворимость в воде, например растворимость примерно 10 мг/мл или большую, определяют необходимость создания лекарственной формы с замедленным высвобождением, и чем выше растворимость, тем насущнее такая необходимость. В качестве примера такой необходимости можно привести дигидрохлорид прамипексола, имеющего растворимость в воде примерно 200 мг/мл, и мезилат ребоксетина, имеющего растворимость в воде примерно 250 мг/мл.
Прамипексол (I) является агонистом допаминового рецептора D2, применимым при лечении болезни Паркинсона. Прамипексол, как и его соль дигидрохлорид, в Соединенных Штатах является доступным коммерчески в виде таблеток Mirapex® от Pharmacia & Upjohn. Указанные таблетки являются таблетками с немедленным высвобождением, содержащими 0,125 мг, 0,25 мг, 0,5 мг, 1,0 мг и 1,5 мг активного средства, созданными для перорального введения по одной таблетке три раза в сутки с обеспечением суточной дозы в 0,375-4,5 мг. См. Physicians’ Desk Reference, 57th edition (2003), 2768-2772. В данном случае дозы выражены в количествах моногидрата дигидрохлорида прамипексола, если не указано иное; 1,0 мг моногидрата дигидрохлорида прамипексола эквивалентен примерно 0,7 мг прамипексола основания
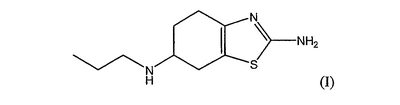
Схема приема лекарственного средства три раза в сутки для таблеток с немедленным высвобождением дигидрохлорида прамипексола хорошо переносится, но соблюдение пациентами схемы приема можно значительно улучшить, если бы была возможна схема с однократным приемом. В этом отношении следует отметить, что основное показание для этого лекарственного средства, болезнь Паркинсона, является недугом, который становится распространенным с возрастом и часто сопровождается ухудшением памяти. Режим приема один раз в сутки будет особенно пригодным для усиления соблюдения режима приема лекарственного средства среди пациентов преклонного возраста.
Авторы настоящего изобретения обнаружили, что композиция с моногидратом дигидрохлорида прамипексола в таблетке с гидрофильным матриксом, как правило, не отвечает требованиям для обеспечения свойств замедленного высвобождения, согласующихся с введением дозы один раз в сутки. Характеристики также можно изменить, нанося на таблетку покрытие для замедленного высвобождения. Такое покрытие, как правило, содержит гидрофобный полимер и гидрофильный порообразователь.
Необходимость наносить покрытие на матриксную таблетку вызывает другие проблемы. Дополнительные рабочие операции, включаемые на стадии нанесения покрытия, требуют, чтобы таблетка была достаточно твердой для того, чтобы избежать разрушения и/или истирания во время таких операций, в частности, в условиях высокоскоростной обработки.
Ребоксетин (II) является селективным ингибитором обратного захвата норадреналина (SNRI), пригодным при лечении депрессивного расстройства. Ребоксетин, как и его соль метансульфонат (мезилат), коммерчески доступен в Великобритании и других странах в виде таблеток Edronax® от Pharmacia & Upjohn. Такие таблетки представляют собой таблетки с немедленным высвобождением с насечкой для разламывания, облегчающей деление. Каждая таблетка эдронакса® содержит 4 мг ребоксетина и создана для перорального приема дважды в сутки для обеспечения суточной дозы в 4-12 мг, с делением таблетки при необходимости. См. British National Formulary, 41st edition (2001), 196. В данном случае дозы выражают в количествах ребоксетина основания, если не оговорено иное
Схема приема лекарственного средства два раза в сутки для таблеток с немедленным высвобождением ребоксетина хорошо переносится, но соблюдение пациентами схемы приема можно значительно улучшить, если бы была возможна схема с однократным приемом без существенного повышения возможности побочного действия. В этом отношении следует отметить, что основное показание для этого лекарственного средства, депрессивное расстройство, является недугом, который часто сопровождается нарушением режима приема.
Авторы настоящего изобретения обнаружили, что композиция с солями ребоксетина в таблетке с гидрофильным матриксом может обеспечить свойства замедленного высвобождения, согласующиеся с приемом дозы один раз в сутки. Однако полученные таблетки чувствительны к разрушению и/или истиранию во время обработки, в особенности на высокоскоростной операции таблетирования.
Доказано, что трудно получить таблетку с подходящим сочетанием свойств замедленного высвобождения и обрабатываемости, где лекарственное средство является средством с относительно высокой растворимостью, как в случае солей прамипексола и ребоксетина.
В патенте США № 6197339 раскрывается таблетка с замедленным высвобождением, содержащая Z-2-бутендиоат (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4.5-ij]хинолин-2(1Н)-она (1:1) (малеат суманирола) в матриксе, содержащем гидроксипропилметилцеллюлозу (НРМС) и крахмал. Сообщается, что таблетка пригодна при лечении болезни Паркинсона. Сообщается, что подходящие в данном случае крахмалы включают предварительно желатинизированный крахмал.
В патенте США № 5458887 раскрывается таблетка с регулируемым высвобождением, содержащая осмотическую сердцевину, состоящую из лекарственного средства в смеси с набухающим в воде компонентом, таким как НРМС или полиэтиленоксид, и покрытие, содержащее водостойкий полимер и небольшое количество водорастворимого соединения, действующего как порообразователь. Сообщается, что после образования пор в покрытии за счет растворения водорастворимого соединения вещество, набухающее в воде, увеличивает сердцевину и обеспечивает контакт поверхности, обогащенной лекарственным средством, со средой в желудочно-кишечном тракте.
В патенте США № 5656296 раскрывается двойная таблетка с регулируемым и замедленным высвобождением, содержащая сердцевину, содержащую лекарственное средство и низкоплавкий наполнитель, и слой покрытия на сердцевине, содержащий рН-независимый нерастворимый в воде полимер и водорастворимый пленкообразующий полимер.
В заявке на Европейский патент № ЕР 0933079 раскрывается крахмал, о котором сообщается, что он пригоден для получения таблеток с высокой твердостью, но еще способных быстро рассыпаться в водной среде. Прочность на разрыв конечных таблеток вычисляют по твердости.
Патенты и публикации, цитированные выше, включены в настоящее описание в качестве ссылок.
Объектом настоящего изобретения является композиция для таблетки с замедленным высвобождением водорастворимого лекарственного средства или пролекарства, подходящая для перорального введения один раз в сутки. Другой целью является такая композиция, имеющая достаточную твердость для того, чтобы выдерживать высокоскоростную операцию таблетирования, в частности сопротивляться эрозии во время нанесения покрытия. Еще одной целью является фармацевтическая таблетка, обеспечивающая длительное лечебное действие на центральную нервную систему (ЦНС) субъекта при введении один раз в сутки. Особой целью является такая таблетка, которая обеспечивает длительное лечебное действие как агонист допамина при введении один раз в сутки, в особенности, где водорастворимое лекарственное средство представляет собой соль прамипексола, без существенного возрастания числа случаев побочного действия. Еще одной особой целью является такая таблетка, которая обеспечивает лечебное действие как SNRI при введении один раз в сутки, в особенности, где водорастворимое лекарственное средство представляет собой соль ребоксетина или его энантиомера, например (S,S)-ребоксетина, без существенного возрастания числа случаев побочного действия. Еще одной целью является способ испытания крахмала для оценки его пригодности для включения в матриксную таблетку для замедленного высвобождения водорастворимого лекарственного средства или пролекарства.
Краткое изложение сущности изобретения
Настоящее изобретение относится к фармацевтической композиции в форме таблетки, доставляемой перорально, содержащей активное фармацевтическое средство с растворимостью не менее примерно 10 мг/мл, диспергированное в матриксе, содержащем гидрофильный полимер и крахмал, имеющий прочность на разрыв при доле твердого вещества, характерной для таблетки, по меньшей мере 0,15 кН·см-2. Композиция, предпочтительно, обнаруживает свойства замедленного высвобождения, соответствующие терапевтической эффективности при пероральном введении не более одного раза в сутки субъекту, нуждающемуся в этом.
Изобретение также относится к способу получения фармацевтической композиции с замедленным высвобождением в форме таблетки, доставляемой перорально, включающему выбор путем подходящего испытания крахмала, имеющего прочность на разрыв при доле твердого вещества, характерной для таблетки, по меньшей мере 0,15 кН·см-2; смешивание с выбранным крахмалом гидрофильного полимера и активного фармацевтического агента с растворимостью не менее примерно 10 мг/мл для получения смеси, где средство диспергировано в матриксе, содержащем полимер и крахмал; и прессование смеси для образования таблетки.
Особенно удобный метод испытания, который сам является другим воплощением изобретения, включает получение брикетов образца крахмала на таблеточном пресс-автомате в интервале сжимающих усилий, измерение твердости брикетов, определение доли твердого вещества в брикетах, вычисление прочности на разрыв брикетов из твердости и размеров брикетов, определение отношения прочности на разрыв к доле твердого вещества в брикетах и оценка из полученного отношения прочности на разрыв при доле твердого вещества, характерной для нужной таблетки.
Изобретение также относится к способу лечения субъекта, имеющего состояние или нарушение, в случае которого показан активный фармацевтический агент с растворимостью не менее примерно 10 мг/мл, включающему пероральное введение субъекту композиции с замедленным высвобождением лекарственного средства в форме таблетки, содержащей агент, диспергированный в матриксе, содержащем гидрофильный полимер и крахмал, имеющий прочность на разрыв при доле твердого вещества, характерной для таблетки, по меньшей мере 0,15 кН·см-2.
В данном случае “активное фармацевтическое средство” может представлять собой лекарственное средство, или пролекарство, или его соль, в том числе диагностические средства. Если не указано иное, в данном описании “растворимость” означает растворимость в воде при 20-25°С при любом физиологически приемлемом рН, например при любом рН в интервале от примерно 4 до примерно 8. В случае средства, представляющего собой соль, ссылка на растворимость в воде относится к соли, но не к средству в форме свободной кислоты или свободного основания.
В данном описании термин “доставляемое перорально” означает подходящее для перорального, в том числе перорального и интраорального (например, подъязычного или буккального), приема, но таблетки настоящего изобретения приспособлены главным образом, для перорального приема, т.е., для проглатывания, типично, целиком или в разломанном виде, с помощью воды или другой питьевой жидкости.
В данном описании “брикет” представляет собой прессованную таблетку, полученную, например, на таблеточном прессе, состоящую только из образца крахмала, для которого нужно измерить прочность на разрыв. “Доля твердого вещества” представляет собой отношение абсолютной плотности брикета к кажущейся плотности. “Доля твердого вещества”, характерная для таблетки, представляет собой долю твердого вещества, выбранную как подобную доле твердого вещества таблеток, полученных по изобретению. Типично будет выбираться доля твердого вещества таблеток от примерно 0,75 до примерно 0,85, например 0,8.
В данном описании “субъект” представляет собой животное любого вида, предпочтительно млекопитающее, наиболее предпочтительно человека. Состояния и расстройства у субъекта, для которых в данном случае “показано” определенное средство, не ограничиваются состояниями и расстройствами, для которых указанное средство одобрено контролирующим органом, но также включают состояния и расстройства, о которых врачам известно, или предполагается, что они поддаются лечению указанным средством. “Лечение” в данном случае охватывает профилактическое лечение, если из контекста не следует иное.
Краткое описание чертежей
Фиг. 1 является графиком, показывающим соотношение прочности на разрыв партий предварительно желатинизированного крахмала при определении методом испытания по изобретению с использованием времени выдержки в пресс-форме под давлением 4 секунды (пример 1 данного описания) и трехосной прочности на разрыв.
Фиг. 2 является графиком, показывающим соотношение прочности на разрыв партий предварительно желатинизированного крахмала при определении методом испытания по изобретению с использованием времени выдержки в пресс-форме под давлением 90 секунд (пример 1 данного описания) и трехосной прочности на разрыв.
Фиг. 3 является графиком, показывающим корреляцию прочности на разрыв партий предварительно желатинизированного крахмала с максимальной твердостью таблеток, содержащих указанные партии.
Фиг. 4 представляет собой график, показывающий профили растворения in vitro трех разных композиций таблеток с замедленным высвобождением с 0,375 мг моногидрата дигидрохлорида прамипексола, что подробнее описано в примере 10.
Фиг. 5 представляет собой график, показывающий профили растворения in vitro трех разных композиций таблеток с замедленным высвобождением с 4 мг (S,S)-ребоксетина в форме его соли сукцината, что подробнее описано в примере 12.
Подробное описание изобретения
Изобретение относится к фармацевтической композиции в форме доставляемой перорально таблетки, содержащей водорастворимое фармацевтическое средство. Композиция, предпочтительно, проявляет свойства замедленного высвобождения лекарственного средства, адекватные обеспечению терапевтической эффективности при пероральном введении не более одного раза в сутки.
Как правило, средства, для которых изобретение особенно пригодно, не подходят для однократного введения в сутки, когда входят в состав композиции с немедленным высвобождением лекарственного средства. Такая непригодность может возникнуть из-за одного или нескольких свойств таких средств, в том числе, без ограничений, из-за
(а) короткого полупериода существования (Т1/2) средства или его активного метаболита в кровотоке, требующего, чтобы для поддержания терапевтически эффективной концентрации в плазме ее “подпитывали” через периоды более короткие, чем одни сутки;
(b) возможного нежелательного побочного действия, возникающего из-за высокой концентрации в плазме (Сmax) средства или его терапевтически активного метаболита.
Сравнительно немногие средства, имеющие растворимость не менее примерно 10 мг/мл, являются недиссоциируемыми соединениями. Большинство представляет собой соединения, существующие в форме свободной кислоты или свободного основания и присутствующие в композиции по изобретению в такой форме или, чаще, в форме фармацевтически приемлемой соли. Растворимость предпочтительных средств составляет не менее примерно 50 мг/мл, предпочтительнее не менее примерно 100 мг/мл. Для целей настоящего изобретения средства, классифицируемые в United States Pharmacopeia, 14th edition (2000) (USP 24) как “полностью растворимые” или “неограниченно растворимые”, рассматриваются как имеющие растворимость не менее примерно 100 мг/мл, и вместе с тем средства, классифицируемые в USP 24 как “растворимые” или “умеренно растворимые”, рассматриваются как имеющие растворимость не менее примерно 10 мг/мл.
Активные фармацевтические средства, пригодные в данном случае, могут относиться к любой терапевтической категории, например к любой из терапевтических категорий, перечисленных в The Merk Index, 13th edition (2001). Неполный список средств, пригодных в данном случае, приводится ниже для иллюстрации с замечанием, что, когда перечисляются одна или несколько солей средства, другие фармацевтически приемлемые соли с растворимостью не менее примерно 10 мг/мл (“аналогичные соли”) могут быть заменены.
Сульфат абакавира
Акарбоз
Гидрохлорид ацебутолола
Кальциевая соль ацетилсалициловой кислоты
Ацикловир натрия
Сульфат альбутерола
Алендронат натрия
Гидрохлорид алфентанила
Малеат алмотриптана
Гидрохлорид алосетрона
Гидрохлорид амантадина
Амдиноциллин
Гидрохлорид аминолевулиновой кислоты
Аминофиллин
Соли п-аминосалицилаты кальция, натрия и калия
Гидрохлорид амитриптилина
Соли ацетат, гидрохлорид и мезилат амлодипина
Соли фосфат и сульфат амфетамина
Арбутамин
Атенолол
Сульфат атропина
Азлоциллин натрия
Бальсалазид динатрия
Гидрохлорид беназиприла
Мезилат бензтропина
Хлорид бетанехола
Фумарат бисопролола
Малеат бромфенирамина
Гидрохлорид бупропиона
Кофеин и цитрат кофеина
Капецитабин
Каптоприл
Карбенициллин динатрия
Цитрат карбетапентана
Малеат карбионксамина
Цефаклор
Цефметазол натрия
Цефодизим динатрия
Цефтезол натрия
Цефтиофур натрия
Цефтриаксон динатрия
Цефуроксим натрия
Цефузонам натрия
Гидрохлорид цетризина
Гидрохлорид цевимелина
Гидрохлорид хлордиазэпоксида
Фосфат хлорохина
Малеат хлорфенирамина
Гидрохлорид хлорпромазина
Циластатин натрия
Гидрохлорид циметидина
Гидрохлорид клиндамицина
Фосфат клиндамицина
Гидрохлорид кломипрамина
Гидрохлорид клонидина
Клоразепат дикалия
Соли гидрохлорид и сульфат кодеина
Фосфат кодеина
Гидрохлорид циклобензаприна
Гидрохлорид ципрогептадина
Гидрохлорид цистеамина
Гидрохлорид даунорубицина
Гидрохлорид дезипрамина
Дексаметазон-21-фосфат динатрия
Гидробромид декстрометорфана
Дибекацин
Диклофенак калия
Диклоксациллин натрия
Гидрохлорид дицикломина
Диданозин
Дигидрокодеин
Гидрохлорид дилтиазема
Гидрохлорид дифенидрамина
Дисульфирам
Мезилат доластерона
Гидрохлорид донепезила
Гидрохлорид допамина
Гидрохлорид дорзоламида
Гидрохлорид доксепина
Гиклат (hyclate) доксициклина
Гемисульфат элетриптана
Малеат эналаприла
Гидрохлорид эпинастина
Соли глюкогептаноат и лактобионат эритромицина
Этозуксимид
Этидроновая кислота и натриевая соль
Гидрохлорид этоперидона
Гидрохлорид фадрозола
Фамцикловир
Фентанил цитрат
Флуктозин
Фосфат флударабина
Гидрохлорид флуоксетина
Флувастатин натрия
Фосфомицин и фосфомицинтрометамин
Фосфозал
Фозиноприл натрия
Фосфенитоин динатрия
Сукцинат фловатриптана
Габапентин
Гатифлоксацин
Гликопирролат
Гидрохлорид гранисетрона
Гуаифенезин
Гидрохлорид галоперидола
Гоматропинметилбромид
Гидрохлорид гидралазина
Соли битартрат и гидрохлорид гидрокодона
Гидрохлорид гидроморфона
Сульфат гидроксихлорохина
Дигидрохлорид гидроксизина
Гидробромид гиосциамина
Мезилат иматиниба
Гидрохлорид имипрамина
Инкадронат динатрия
Сульфат индинавира
Изониазид
Гидрохлорид изоксуприна
Кеторолактрометамин
Гидрохлорид лабеталола
Ламивудин
Гидрохлорид левамизола
Левитрацетам
Гидрохлорид лидокаина
Лизиноприл
Лозартан калия
Ацетат мафенида
Гидрохлорид мекамиламина
Гидрохлорид медетомидина
Меглутол
Гидрохлорид меперидина
Битартрат метараминола
Гидрохлорид метформина
Гидрохлорид метадона
Гидрохлорид метамфетамина
Метенамин
Метимазол
Бромид метскополамина
Метилдопа
Гидрохлорид метилфенидата
Метилпреднизолон-21-сукцинат натрия
Метоклопрамид
Сукцинат метопролола
Гидрохлорид метралиндола
Гидрохлорид мексилетина
Мезлоциллин натрия
Гидрохлорид мидазолама
Гидрохлорид мидодрина
Миглитол
Мизорибин
Гидрохлорид моэксиприла
Гидрохлорид молиндона
Монтелукаст натрия
Гидрохлорид морфина
Сульфат морфина
Салицилат морфолина
Гидрохлорид налмефена
Гидрохлорид налоксона
Напроксен натрия
Гидрохлорид наратриптана
Недокромил динатрия
Соли бромид и метилсульфат неостигмина
Соли битартрат, салицилат и сульфат никотина
Нитрофурантоин
Низатидин
Гидрохлорид нортриптилина
Офлоксацин
Олсалазин натрия
Гидрохлорид ондансетрона
Гидрохлорид орфенадрина
Гидрохлорид оксибутинина
Гидрохлорид оксикодона
Пантопразол натрия
Парэкоксиб натрия
Пемироласт калия
Пеницилламин
Натриевая и калиевая соли пенициллина G
Пенициллин V калия
Изэтионат пентамидина
Пентобарбитал натрия
Пентозанполисульфат натрия
Пентоксифиллин
Периндоприлэрбумин
Тартрат фендиметразина
Сульфат фенелзина
Гидрохлорид феноксибензамина
Гидрохлорид фентермина
Гидрохлорид фенилэфрина
Гидрохлорид фенилпропаноламина
Фенитоин натрия
Цитрат фенилтолоксамина
Пидотимод
Гидрохлорид пилокарпина
Пиперациллин натрия
Дигидрохлорид пирензепина
Дигидрохлорид прамипексола
Правастатин натрия
Фосфат преднизолона натрия
Гидрохлорид прокаинамида
Гидрохлорид прокарбазина
Прокодазол
Гидрохлорид прометазина
Гидрохлорид пропацетамола
Гидрохлорид пропоксифена
Гидрохлорид пропанолола
Гидрохлорид протриптилина
Гидрохлорид псевдоэфедрина
Бромид пиридостигмина
Гемифумарат кветиапина
Гидрохлорид хинаприла
Глюконат хинидина
Бисульфат хинина
Рабепразол натрия
Ралтитрексед
Гидрохлорид рамосетрона
Гидрохлорид ранитидина
Соли мезилат и сукцинат ребоксетина
Рибавирин
Гидрохлорид римантадина
Ризедронат натрия
Тартрат ривастигмина
Бензоат ризатриптана
Гидрохлорид ропинирола
Гидробромид скополамина
Гидрохлорид селегилина
Гидрохлорид соталола
Ставудин
Сульбенциллин динатрия
Сульфацетамид натрия
Малеат суманирола
Сукцинат суматриптана
Гидрохлорид такрина
Тауролидин
Гидрохлорид теразозина
Гидрохлорид тетрациклина
Ацетат теобромина натрия и салицилат теобромина натрия
Теофиллинэтаноламин и теофиллинизопропаноламин
Ацетат теофиллина натрия и глицинат теофиллина натрия
Гидрохлорид тиоридазина
Тироксин натрия
Гидрохлорид тиклопидина
Малеат тимолола
Тартрат толтеродина
Гидрохлорид трамадола
Гидрохлорид триэнтина
Дигидрохлорид трифлуоперазина
Гидрохлорид валацикловира
Гидрохлорид валганцикловира
Валпроат натрия
Гидрохлорид венлафаксина
Гидрохлорид верапамила
Варфарин натрия
Золмитриптан
Гемитартрат золпидема
К другим средствам, пригодным в данном случае, относятся N-[5-(1,4-диазепан-1-ил)-2-[(3-фторфенил)сульфонил]фенил]ацетамид, N-[(3R)-1-азабицикло[2.2.2]окт-3-ил]фуро[2,3-с]пиридин-5-карбоксамид и их соли.
Следует иметь в виду, что указание активного фармацевтического агента в данном случае охватывает его рацематы, энантиомеры, полиморфы, гидраты и сольваты.
Настоящее изобретение особенно подходит для сильных лекарственных средств и пролекарств, например, таких, которые являются терапевтически эффективными при малых суточных дозах, например, не превышающих примерно 100 мг/сутки, в особенности не превышающих примерно 50 мг/сутки, предпочтительнее не превышающих примерно 25 мг/сутки, даже предпочтительнее не превышающих примерно 10 мг/сутки и наиболее предпочтительно не превышающих примерно 5 мг/сутки.
В одном воплощении активное фармацевтическое средство обладает лечебным действием на центральную нервную систему (ЦНС). Такие средства, называемые в данном описании “ЦНС-средства”, пригодны при лечении или предупреждении расстройств ЦНС и включают, без ограничения, противосудорожные средства, антидепрессанты, средства против дискинезии, противоэпилептические средства, средства против мании, средства против мигрени, блокаторы мускариновых рецепторов, антиобсессивные средства, средства против паркинсонизма, антипсихотические средства, спазмолитические средства, анксиолитики, холинергические средства, стимуляторы ЦНС, агонисты допаминовых рецепторов, антагонисты допаминовых рецепторов, снотворные, ингибиторы моноаминоксидазы, нейролептические средства, нейропротекторы, антагонисты рецепторов NMDA, ноотропные средства, ингибиторы пролактина, седативные средства, селективные ингибиторы обратного захвата серотонина, селективные ингибиторы обратного захвата норадреналина, снижающие агрессивность средства, агонисты серотониновых рецепторов, антагонисты серотониновых рецепторов и транквилизаторы.
Для пояснения, ЦНС-средства, пригодные в данном случае, включают соли суманирола, ребоксетина и прамипексола.
Суманирол, предпочтительно, используют в форме R-энантиомера (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4.5-ij]хинолин-2(1Н)-она (III), который может быть заменен его тионовым аналогом (R)-5,6-дигидро-5-(метиламино)-4Н-имидазо[4.5-ij]хинолин-2(1Н)-тионом (IV)
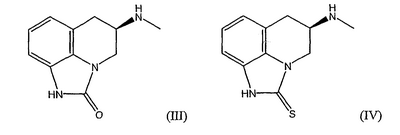
В случае соединения (III) или (IV) подходящими солями являются соли гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, ацетат, пропионат, лактат, малеат, малат, сукцинат, тартрат, циклогексансульфамат, мезилат (метансульфонат), эзилат (этансульфонат), безилат (бензолсульфонат) и тозилат (п-толуолсульфонат). Предпочтительной солью является малеат.
Композиции с суманиролом по изобретению подходят для введения не более двух раз в сутки, предпочтительно не более одного раза в сутки. Такие композиции пригодны при лечении любого состояния или расстройства ЦНС, в случае которого суманирол имеет лечебную пригодность, но в особенности в случае болезни Паркинсона и связанных с ней осложнений.
Ребоксетин (II) можно использовать в форме рацемической смеси, содержащей два или большее число энантиомеров из числа (R,R)-ребоксетина, (S,S)-ребоксетина, (R,S)-ребоксетина и (S,R)-ребоксетина, или в форме любого одного из указанных энантиомеров. Предпочтительно используют (S,S)-ребоксетин.
Подходящими солями ребоксетина являются соли гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, ацетат, пропионат, лактат, малеат, малат, сукцинат, фумарат, тартрат, циклогексансульфамат, мезилат, эзилат, безилат и тозилат. В случае рацемата ребоксетина предпочтительной солью является малеат. В случае (S,S)-ребоксетина предпочтительными солями являются соли сукцинат и фумарат, в особенности сукцинат.
Композиции с ребоксетином и (S,S)-ребоксетином по изобретению, предпочтительно, подходят для введения не более одного раза в сутки. Такие композиции пригодны при лечении состояния или расстройства ЦНС, в случае которого ребоксетин и его энантиомеры имеют терапевтическую пригодность, но в особенности в случае депрессивной болезни и невропатической боли, включая постгерпетическую невралгию и диабетическую невропатию.
Прамипексол (I) используют, предпочтительно, в форме его S-энантиомера (S)-2-амино-4,5,6,7-тетрагидро-6-(пропиламино)-бензотиазола. Предпочтительной солью прамипексола является дигидрохлорид, наиболее предпочтительно, в форме моногидрата.
Композиции с прамипексолом по изобретению, предпочтительно, подходят для введения не более одного раза в сутки. Такие композиции пригодны при лечении состояния или расстройства ЦНС, в случае которого прамипексол имеет терапевтическую пригодность, но в особенности в случае болезни Паркинсона и связанных с ней осложнений.
Все активные фармацевтические агенты, пригодные в данном случае, можно получить способами, известными сами по себе, раскрытыми в патентах и другой литературе, имеющей отношение в конкретным агентам, представляющим интерес.
Количество активного фармацевтического агента, присутствующего в композиции по изобретению, зависит от силы агента, но является достаточным для обеспечения суточной дозы при одновременном введении от одной до небольшого числа, например от одной до примерно 4 таблеток. Предпочтительно, полная суточная доза доставляется в единственной таблетке. В большинстве случаев количество агента на таблетку составляет от примерно 0,1 до примерно 200 мг, предпочтительно от примерно 0,2 до примерно 100 мг. Выраженное в процентах от массы композиции количество агента типично составляет от примерно 0,01% до примерно 25%, предпочтительно от примерно 0,05% до примерно 20%. В случае агента, представляющего собой соль, количество агента в данном описании выражают как эквивалентное количество свободной кислоты или свободного основания, если не указано иное.
Для пояснения, в случае суманирола подходящим, как правило, будет количество от примерно 0,5 до примерно 25 мг на таблетку или от примерно 0,1 мас.% до примерно 15 мас.% от композиции. Конкретные дозировки на таблетку, предполагаемые в данном описании, включают 0,5, 1, 2, 4, 8, 12 и 24 мг суманирола в форме малеата суманирола.
В случае прамипексола подходящим, как правило, будет количество от примерно 0,1 до примерно 10 мг на таблетку или от примерно 0,05 мас.% до примерно 5 мас.% от композиции. Предпочтительно, присутствует количество от примерно 0,2 до примерно 6 мг, предпочтительнее количество от примерно 0,3 до примерно 5 мг, прамипексола на таблетку. Конкретные дозировки на таблетку, предполагаемые в данном описании, включают 0,375, 0,5, 0,75, 1,0, 1,5, 3,0 и 4,5 мг моногидрата дигидрохлорида прамипексола.
В случае ребоксетина или (S,S)-ребоксетина подходящим, как правило, будет количество от примерно 0,2 до примерно 15 мг на таблетку или от примерно 0,1 мас.% до примерно 10 мас.% от композиции. Предпочтительно, присутствует количество от примерно 1 до примерно 12 мг ребоксетина или (S,S)-ребоксетина на таблетку. Конкретные дозировки на таблетку, предполагаемые в данном описании, включают 1, 2, 4, 6, 8 и 12 мг ребоксетина в форме его соли мезилата или (S,S)-ребоксетина в форме его соли сукцината.
Композиция настоящего изобретения включает активный фармацевтический агент, указанный выше, диспергированный в матриксе, содержащем гидрофильный полимер и крахмал, имеющий прочность на разрыв по меньшей мере примерно 0,15 кН·см-2 при доле твердого вещества, характерной для таблетки, например, от примерно 0,75 до примерно 0,85, например 0,8.
Гидрофильные полимеры, пригодные в данном случае, являются фармацевтически приемлемыми полимерными материалами, имеющими достаточное число и распределение гидрофильных заместителей, таких как гидрокси- и карбоксигруппы, придающих гидрофильные свойства полимеру в целом. Подходящими гидрофильными полимерами, без ограничений, являются метилцеллюлоза, НРМС (гипромеллоза), кармелозанатрий (карбоксиметилцеллюлоза) и карбомер (полиакриловая кислота). Можно использовать, необязательно, несколько таких полимеров.
НРМС является предпочтительным гидрофильным полимером. Доступны различные НРМС и с разной степенью замещения. В одном воплощении используют тип 2208 НРМС, предпочтительно, удовлетворяющий требованиям спецификаций, указанных в стандартных фармакопеях, таких как USP 24. Тип 2208 НРМС содержит 19-24 мас.% метокси и 4-12 мас.% гидропропоксизаместителей. Особенно подходящие НРМС имеют условную вязкость, колеблющуюся от примерно 100 до примерно 10000 мПа·с; например, подходящей НРМС типа 2208 является НРМС с условной вязкостью примерно 4000, с измеренной вязкостью от примерно 3000 до примерно 56000 мПа·с. Такая НРМС доступна, например, как метоцел® К4МР от Dow Chemical Co., и по существу эквивалентные продукты доступны от других изотовителей.
Количество гидрофильного полимера в композиции зависит от конкретного выбранного полимера, от активного фармацевтического агента и от нужного профиля замедленного высвобождения. Однако, типично, гидрофильный полимер включают в количестве от примерно 20% до примерно 70%, предпочтительно от примерно 30% до примерно 60% и предпочтительнее от примерно 35% до примерно 50%, от массы композиции. В случае приведенной в качестве примера НРМС типа 2208 подходящее количество будет, как правило, находиться в интервале от примерно 30% до примерно 60%, предпочтительно от примерно 35% до примерно 50%, например в количестве примерно 40%, от массы композиции.
Предполагается, не вдаваясь в теорию, что функции гидрофильного полимера обеспечивают протяженное или отсроченное высвобождение активного фармацевтического агента, например, за счет постепенного растворения или эрозии полимера в желудочно-кишечном тракте.
Крахмалы, пригодные в данном случае, включают крахмалы из любого растительного источника, например кукурузы, пшеницы, риса, тапиоки, картофеля и т.д. Предпочтительные крахмалы имеют относительно высокое отношение амилозы к амилопектину и содержат, например, по меньшей мере примерно 20%, предпочтительнее по меньшей мере примерно 25%, амилозы. Особенно предпочтительным является предварительно желатинизированный крахмал, представляющий собой тип модифицированного крахмала, обработанного с целью придания крахмалу большей текучести и прямой сжимаемости. Можно использовать частично или полностью предварительно желатинизированные крахмалы.
Предполагается, не вдаваясь в теорию, что основной функцией крахмала в композиции по изобретению является его функция как связующего вещества. Крахмал, удовлетворяющий критерию по прочности на разрыв, указанному в данном описании, можно назвать “суперсвязующим”.
Количество крахмала в композиции типично превышает обычное его количество как связующего в составах таблеток. Подходящие количества будут, как правило, находиться в интервале от примерно 25 мас.% до примерно 75 мас.%. Предпочтительно, количество крахмала составляет от примерно 40% до примерно 70%, предпочтительнее от примерно 45% до примерно 65%, например 50%, от массы композиции.
Прочность на разрыв образца крахмала можно измерить в любом подходящем испытании. Примеры процедур испытаний описываются в Hiestand & Smith (1984), Powder Technology, 38, 145-159, и в Hiestand & Smith (1991), International Journal of Pharmaceutics, 67, 231-246, причем указанные статьи включены в данное описание в качестве ссылок.
Для испытания на прочность на разрыв, которое можно использовать (далее в данном описании называется “испытание на трехосную прочность на разрыв”), требуется получить ряд брикетов образца крахмала с последующим определением прочности на разрыв брикетов с использованием автоматизированного многофункционального тестера для таблеток (МТТ). Брикеты готовят со сжимающими усилиями разной степени для получения брикетов с интервалом доли твердого вещества. Так как композиции таблеток с замедленным высвобождением типично имеют долю твердого вещества примерно 0,8, полезно получать брикеты, приближающиеся к такой доле твердого вещества.
Абсолютную плотность образца крахмала можно измерить с использованием гелийвоздушного пикнометра.
Для получения брикетов используют трехосевой таблеточный пресс с программным управлением. Выход напряжения с пуансона и динамометрических датчиков матрикса таблеточного пресса сначала устанавливают на нуль. Пуансон и матрикс смазывают порошком стеарата магния и матрикс помещают в пресс. Выбирают на компьютере параметры сжатия и декомпрессии. Взвешивают нужное для брикетирования количество крахмала и загружают в полость матрикса. Полученный слой порошка выравнивают шпателем. Вставляют пуансон в матрикс и начинают управляемый компьютером цикл сжатие/декомпрессия.
Непосредственно перед окончанием фазы сжатия регистрируют толщину брикета, измеряемую LVDT. По окончании фазы сжатия регистрируют конечное сжимающее усилие, измеряемое по напряжению на динамометрическом датчике пуансона.
По окончании фазы декомпрессии отводят плунжеры пуансона и матрикса. Брикет извлекают из матрикса и проверяют на дефекты, такие как растрескивание и прилипание. Растрескивание можно уменьшить, повышая время декомпрессии. Если брикет не имеет дефектов, измеряют его длину, ширину, толщину и массу, чтобы можно было вычислить кажущуюся плотность. Долю твердого вещества вычисляют путем деления абсолютной плотности на кажущуюся плотность.
При получении МТТ для определения прочности на разрыв прогоняют подходящую программу. К динамометрическому датчику МТТ привинчивают пластину и устройство для определения прочности на разрыв вдвигают в МТТ напротив пластины. Сигнал с динамометрического датчика контролируют через компьютер и регулируют смещение нуля на формирователе сигнала для обеспечения положительного опорного напряжения, максимально близкого к нулю. Выбирают скорость, которая будет давать постоянную времени приблизительно 15 секунд (как правило, выбранная скорость будет равна от примерно 0,8 до примерно 1,2 мм·с-1.
Испытываемый брикет помещают в держатель устройства для определения прочности на разрыв. Включают мотор через компьютер, продвигая пластину к брикету до тех пор, пока не обнаружится поверхность брикета, и останавливают пластину в нескольких миллиметрах от брикета. Включают осциллограф для регистрации усилия, прилагаемого к брикету, и вновь запускают мотор. Пластину вдвигают в брикет до обнаружения растрескивания или по виду, или по звуку и мотор сразу же переключают на обратный ход.
Регистрируют пиковое усилие по осцилограмме. Прочность на разрыв вычисляют из пикового усилия с использованием соответствующей компьютерной программы.
Строят график по данным нескольких опытов с использованием брикетов в интервале долей твердого вещества вблизи 0,8 и оценивают прочность на разрыв при доле твердого вещества 0,8. Если прочность на разрыв при доле твердого вещества 0,8 равна примерно 0,15 кН·см-2 или большей величине, образец крахмала считают подходящим для применения при получении композиции по изобретению.
Теперь неожиданно обнаружилось, что значительно более простое испытание, которое можно осуществлять в производственной обстановке, можно использовать для оценки прочности на разрыв образца крахмала, в частности для определения того, имеет ли образец крахмала прочность на разрыв по меньшей мере 0,15 кН·см-2 при доле твердого вещества, характерной для нужной таблетки с замедленным высвобождением.
Согласно такому испытанию брикеты крахмала получают на стандартном таблеточном прессе-автомате в интервале сжимающих усилий. Например, найдено, что удовлетворительные результаты дает пресс Carver (например, модель 3888.1DT0000), снабженный оснасткой с плоской поверхностью подходящего диаметра (например, 10/32 дюйма или примерно 0,7 см для брикета в 300 мг), работающий при сжимающих усилиях от примерно 4 до примерно 16 кН (от примерно 900 до примерно 3600 ф/д2) для времени выдержки в пресс-форме под давлением по меньшей мере примерно 4 секунды. Для примера, такие брикеты можно получать при 1000, 1500, 2000 и 3000 ф/д2 (4,45, 6,67, 8,90 и 13,34 кН). Предпочтительно, используют время выдержки в пресс-форме под давлением по меньшей мере примерно 10 секунд, предпочтительнее по меньшей мере примерно 30 секунд, еще предпочтительнее по меньшей мере примерно 60 секунд. Для пояснения, найдено, что удовлетворительные результаты получают при времени выдержки в пресс-форме 90 секунд. Массу, диаметр и толщину каждого брикета измеряют точно (с другой стороны, диаметр можно оценить как равный диаметру оснастки), чтобы иметь возможность вычислить кажущуюся плотность и, следовательно, долю твердого вещества, причем абсолютную плотность измеряют так, как описано выше, например, с помощью гелийвоздушного пикнометра.
Затем определяют твердость каждого брикета, полученного таким образом, в любом подходящем испытании на твердость таблетки, например, с использованием твердомера Key НТ 500. Твердость является мерой усилия, требуемого для того, чтобы вызвать раздавливание брикета, и типично выражается в единицах, таких как килопонды (кп) (kiloponds, kp) или единицы Стронга-Кобба (Strong-Cobb) (SCU). Твердость примерно 10,2 кп или примерно 14,4 SCU соответствует усилию 0,1 кН.
Для целей настоящего изобретения считается, что прочность на раздавливание брикета эквивалентна прочности на разрыв. Таким образом, прочность на разрыв (sT, в кН) можно вычислить из уравнения
sT = 2F/pDH,
где F представляет собой усилие, требуемое для того, чтобы вызвать раздавливание (в кН), D представляет собой диаметр брикета (в см), и Н представляет собой толщину брикета (в см). Например, брикет диаметром 0,7 см и толщиной 0,4 см, имеющий твердость 20 SCU (эквивалентную усилию 0,139 кН), имеет вычисленную прочность на разрыв 0,316 кН·см-2.
Затем для образца крахмала оценивают соотношение прочности на разрыв и доли твердого вещества. Это можно осуществить, откладывая данные для прочности на разрыв и доли твердого вещества на графике (доля твердого вещества имеет тенденцию к повышению с повышением сжимающего усилия во время получения брикета) или осуществляя регрессионный анализ. Из такого соотношения можно оценить прочность на разрыв при стандартизированной величине доли твердого вещества. Выбранная стандартизированная величина является величиной, которая представляет долю твердого вещества нужной таблетки с замедленным высвобождением, например, 0,8.
Обнаружено, что, когда вещество брикета представляет собой предварительно желатинизированный крахмал, прочность на разрыв, определенная в простом испытании, только что описанном выше, неожиданно приближается к измерению “истинной” прочности на разрыв, осуществленному трехосным методом испытания на прочность на разрыв, описанным ранее, который в свою очередь по существу подобен методам, известным в технике, таким как метод, описанный Hiestand & Smith (1984), цит. выше.
Также обнаружено, что более длительное время выдержки под давлением в пресс-форме (например, 90 секунд) в способе испытания настоящего изобретения дает лучшую корреляцию с трехосным прочностью на разрыв, чем очень короткое время выдержки (например, 4 секунды). Смотри ниже пример 1 и фиг. 1 и 2.
Таким образом, согласно одному воплощению изобретения оно относится к способу определения пригодности крахмала для применения в доставляемой перорально таблетке с замедленным высвобождением, содержащей активный фармацевтический агент с растворимостью не менее примерно 10 мг/мл, диспергированный в матриксе, содержащем гидрофильный полимер и крахмал. Способ включает стадии
(а) получения брикетов образца крахмала на таблеточном прессе-автомате в интервале сжимающих усилий, применяемых в течение времени выдержки под давлением в пресс-форме по меньшей мере примерно 4 секунды;
(b) измерения твердости каждого брикета, выражаемой как усилие, требуемое для того, чтобы вызвать раздавливание брикета;
(с) определения доли твердого вещества каждого брикета;
(d) вычисления прочности на разрыв sT каждого брикета из уравнения
sT = 2F/pDH,
где F представляет собой усилие, требуемое для того, чтобы вызвать раздавливание, D представляет собой диаметр брикета, и Н представляет собой толщину брикета;
(е) установления соотношения прочности на разрыв и доли твердого вещества брикета, например, путем построения графика по этим параметрам и/или путем осуществления регрессионного анализа; и
(f) оценки с использованием соотношения, установленного на стадии (е), прочности на разрыв при доле твердого вещества, характерной для нужной таблетки с замедленным высвобождением; например, при доле твердого вещества 0,8.
Если прочность на разрыв крахмала такова, что при указанной оценке составляет по меньшей мере примерно 0,15 кН·см-2, крахмал считают подходящим для применения.
Особенно предпочтительный крахмал имеет прочность на разрыв по меньшей мере примерно 0,175 кН·см-2, даже предпочтительнее по меньшей мере примерно 0,2 кН·см-2, при доле твердого вещества, характерной для нужной таблетки с замедленным высвобождением.
Даже среди коммерчески доступных предварительно желатинизированных крахмалов – предпочтительного типа крахмала для применения в композиции изобретения, существуют существенные колебания прочности на разрыв. Предварительно желатинизированные крахмалы, не отвечающие критерию, установленному в данном описании, трудно идентифицировать без испытания, например, способом, описанным выше. Такие предварительно желатинизированные крахмалы, как правило, не подходят для коммерческого производства композиции матричных таблеток с замедленным высвобождением водорастворимого лекарственного средства или пролекарства из-за проблемы, указанной непосредственно ниже.
Таблетка без покрытия, или сердцевина таблетки до нанесения покрытия, содержащая крахмал и гидрофильный полимер, действующие как матрикс для водорастворимого лекарственного средства или пролекарства, должна иметь некоторую минимальную твердость для того, чтобы иметь возможность сопротивляться разрушению и/или истиранию из-за механических напряжений, возникающих во время высокоскоростной операции таблетирования (включая все стадии и включая помещение таблеток в емкости). Минимальная приемлемая твердость будет зависеть от ряда факторов, в том числе величины механических напряжений, но составляет, типично, по меньшей мере примерно 20 SCU, предпочтительно по меньшей мере примерно 22 SCU, предпочтительнее по меньшей мере примерно 24 SCU (примерно 17 кп).
Твердость можно повысить, повышая сжимающее усилие, прилагаемое таблеточным прессом, но только до определенного уровня. По меньшей мере, в случае таблеток, описанных в данном описании, выше определенного сжимающего усилия дальнейшее повышение сжимающего усилия дает небольшое повышение твердости таблетки или не дает его совсем. Иными словами, существует максимальная твердость, достигаемая сжатием определенной композиции крахмал/гидрофильный полимер/активное вещество. Крахмал, обеспечивающий максимальную твердость, неадекватную для выдерживания механических напряжений высокоскоростной операции таблетирования, не подходят для целей настоящего изобретения. Как видно на фиг. 3, обнаружено, что некоторые предварительно желатинизированные крахмалы обеспечивают максимальную твердость 20 SCU или меньше; теперь они идентифицированы как крахмалы с низкой прочностью на разрыв (0,1 кН·см-2 или меньше согласно способу испытания по изобретению с использованием времени выдержки под давлением 90 секунд).
Даже если достигают максимальной твердости по меньшей мере примерно 20 SCU, с крахмалом с низкой прочностью на разрыв ее можно достичь только с применением исключительно высоких сжимающих усилий. Потребность в таких усилиях снижает скорость и эффективность и повышает стоимость операции таблетирования и по этим причинам является нежелательной.
Когда таблетки должны подвергаться по способу дополнительной стадии после сжатия, в частности стадии нанесения покрытия, воздействие механических сил существенно возрастает. Согласно предпочтительному воплощению таблетка с замедленным высвобождением по изобретению также содержит покрытие.
В случае лекарственных средств и пролекарств с высокой растворимостью в воде, о которых идет речь в данном описании, гидрофильный полимерный матрикс часто неадекватен для обеспечения замедленного высвобождения в течение достаточно длительного периода, чтобы была возможность однократного введения в сутки. Предполагается, что такие лекарственные средства легко выщелачиваются из гидрофильного матрикса при контакте с водной средой, такой как гастроинтестинальная жидкость. Поэтому желательно замедлить процесс высвобождения лекарственного средства путем создания на всей таблетке покрытия, регулирующего высвобождение. Такое покрытие типично содержит гидрофобный или водонерастворимый полимерный компонент, такой как этилцеллюлоза, вместе с гидрофильным или водорастворимым порообразующим компонентом, таким как НРМС.
Обнаружено, что, когда используют крахмал с прочностью на разрыв по меньшей мере примерно 0,15 кН·см-2, предпочтительно по меньшей мере примерно 0,175 кН·см-2, предпочтительнее по меньшей мере примерно 0,2 кН·см-2, при доле твердого вещества, характерной для таблетки (например, от примерно 0,75 до примерно 0,85), композиция особенно подходит для высокоскоростной операции таблетирования, которая включает стадию нанесения на таблетку слоя, регулирующего высвобождение.
Альтернативы этилцеллюлозе и НРМС как компонентам покрытия, регулирующего высвобождение, включают другие целлюлозы (например, метилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, натрийкарбоксиметилцеллюлозу, сложные эфиры целлюлозы, такие как ацетат целлюлозы, и т.д.), поливинилацетат, поливинилпирролидон, полимеры и сополимеры акриловой кислоты и метакриловой кислоты и их эфиров, полиэтиленгликоль, карраген и другие камеди и подобные вещества.
Слой, регулирующий высвобождение, если он присутствует, типично составляет от примерно 1% до примерно 15%, предпочтительно от примерно 2,5% до примерно 10%, от массы всей таблетки в целом. Гидрофобный или водонерастворимый компонент, предпочтительно, включающий этилцеллюлозу, типично составляет от примерно 1% до примерно 10%, предпочтительно от примерно 2% до примерно 7%, от массы всей таблетки в целом. Порообразующий компонент, предпочтительно, включающий НРМС, типично присутствует в количестве от примерно 5% до примерно 50%, предпочтительно от примерно 10% до примерно 40%, от массы водонерастворимого или гидрофобного компонента.
Покрытие, если оно присутствует, может содержать, необязательно, другие фармацевтически приемлемые эксципиенты, такие как пластификаторы, красители и т.д.
Для пояснения, слой, регулирующий высвобождение, в количестве от примерно 2,5% до примерно 5% от массы сердцевины таблетки (т.е. массы таблетки за исключением покрытия) содержит материал на основе этилцеллюлозы (например, Surelease®, Colorcon) и порообразующий материал на основе НРМС (например, Opadry®, Colorcon) в массовом соотношении от примерно 3:1 до примерно 4:1.
Слой или покрытие, регулирующие высвобождение, необходимо наносить равномерным по толщине, насколько возможно, для обеспечения оптимального регулирования скорости высвобождения активного фармацевтического агента.
С другой стороны, или кроме того, таблетка с замедленным высвобождением по изобретению содержит нефункциональное покрытие. Нефункциональное покрытие может содержать полимерный компонент, например НРМС, необязательно, с другими ингредиентами, например одним или несколькими пластификаторами, красителями и т.д. Термин “нефункциональное” в данном контексте обозначает отсутствие существенного влияния на свойства таблетки высвобождать лекарственное средство и не предполагает, что покрытие не служит цели полезности. Например, такое покрытие может придавать характерный вид таблетке, обеспечивать защиту против истирания во время упаковки и транспортировки, облегчать проглатывание и/или иметь другие благоприятные свойства. Нефункциональное покрытие следует наносить в количестве, достаточном для обеспечения полного покрытия таблетки. Типично, подходящим будет количество от примерно 1% до примерно 10%, типичнее количество от примерно 2,5% до примерно 5%, от массы всей таблетки в целом.
Таблетки без покрытия или сердцевины таблеток с покрытием по изобретению, кроме компонентов крахмала и гидрофильного полимера, описанных выше, необязательно, содержат один или несколько фармацевтически приемлемых эксципиентов. Такие эксципиенты включают, без ограничения, глиданты и смазывающие вещества. Также могут быть включены другие обычные эксципиенты, известные в технике.
Глидант можно использовать для улучшения свойств текучести порошка перед и во время таблетирования и для уменьшения слеживания. Подходящими глидантами являются коллоидный диоксид кремния, трисиликат магния, порошкообразная целлюлоза, крахмал, тальк, трехосновный фосфат кальция и подобные вещества. В одном воплощении в качестве глиданта включают коллоидный диоксид кремния в количестве до примерно 2%, предпочтительно от примерно 0,2% до примерно 0,6%, от массы таблетки.
Смазывающее вещество можно использовать для облегчения высвобождения таблетки из устройства, в котором ее получают, например, путем предотвращения прилипания к поверхности верхнего пуансона (“отщипывания”) или нижнего пуансона (“приклеивания”). Подходящие смазывающие вещества включают стеарат магния, стеарат кальция, масло канола, глицерилпальмитостеарат, гидрированное растительное масло, оксид магния, минеральное масло, проксамер, полиэтиленгликоль, поливиниловый спирт, бензоат натрия, лаурилсульфат натрия, стеарилфумарат натрия, стеариновую кислоту, тальк, стеарат цинка и подобные вещества. В одном воплощении в качестве смазывающего вещества включают стеарат магния в количестве от примерно 0,1% до примерно 1,5%, предпочтительно от примерно 0,3% до примерно 1%, от массы таблетки.
Таблетки могут иметь любые подходящие размер и форму, например круглую, овальную, многогранника или подушечки, и, необязательно, нанесенные на поверхности нефункциональные метки. Особенно в случае таблеток с покрытием их, предпочтительно, создают для проглатывания целиком и поэтому типично не снабжают насечкой для разламывания. Таблетки по изобретению можно упаковывать в емкости в сопровождении вкладыша, предоставляющего подходящую информацию для пациента, такую как, например, информацию о дозировке и введении, противопоказаниях, мерах предосторожности, взаимодействиях с лекарственными препаратами и вредных реакциях.
Изобретение также относится к способу лечения субъекта, имеющего состояние или нарушение, в случае которого показан активный фармацевтический агент с растворимостью не менее примерно 10 мг/мл, включающему пероральное введение субъекту фармацевтической композиции с замедленным высвобождением в форме таблетки, содержащей агент, диспергированный в матриксе, содержащем гидрофильный полимер и крахмал, имеющий прочность на разрыв по меньшей мере примерно 0,15 кН·см-2 при доле твердого вещества, характерной для таблетки. Предпочтительно, композицию вводят не более одного раза в сутки.
В одном воплощении состояние или нарушение представляет собой состояние или нарушение ЦНС, и средство является ЦНС-средством, определение которого дается в данном описании. Состояния и расстройства ЦНС включают состояния и расстройства, имеющие неврологический и/или психиатрический компонент.
Для пояснения, к состояниям и расстройствам ЦНС, которые можно лечить способом изобретения, относятся, например, личностные расстройства, в том числе параноидные, шизоидные, типа шизоидных, биполярные, наигранные, бредовые, нарциссистические, эмоциональной неустойчивости, психопатические и социопатические личностные расстройства; расстройства в связи с привычками и импульсивные расстройства, в том числе патологическая склонность к азартным играм, воровству, трихотиломания и т.д.; обсессивно-компульсивное расстройство; пассивно-агрессивное расстройство; острые и транзиторные психотические расстройства; психотическая депрессия; шизоаффективное расстройство; ипохондрия; циклотимия; дистимия; маниакально-депрессивный психоз; большое депрессивное расстройство; депрессия устойчивости к лечению; начальная шизофрения у взрослых и детей; лекарственная зависимость, в том числе вредоносное применение и злоупотребление, пристрастие и зависимость от опиоидов, наркотиков, барбитуратов, алкоголя, бензодиазепинов, амфетаминов, кокаина, каннабиноидов, галлюциногенов, стимуляторов, никотина (табака) и растворителей; состояния отмены и расстройства настроения и психотические расстройства, связанные с такой зависимостью; половая дисфункция, в том числе гипофункциональное расстройство полового влечения, половое отвращение и избегание и эректильная дисфункция; расстройства половой идентичности; расстройства полового предпочтения; генерализованное тревожное расстройство; социальное тревожное расстройство; смешанное тревожное и депрессивное расстройство; синдром дефицита внимания – гиперактивности (ADHD) и депрессия и тревога, связанные с этим; депрессия, тревога, эмоциональное разрегулирование и нарушения поведения, связанные с задержкой умственного развития; нарушения развития, в том числе аутизм, синдром Аспергена и синдром Ретта; кондуктивные расстройства и расстройства привязанности у детей; предменструальное дисфорическое расстройство; послеродовая депрессия; фобии, в том числе социальные фобии, агрофобия и специфические фобии, связанные, например, с больницами, инъекциями, венесекцией и т.д.; посттравматическое стрессовое расстройство; диссоциативные расстройства; синдром Брике; аффективные расстройства, в том числе депрессия, биполярное аффективное расстройство и рецидивирующее депрессивное расстройство; органические расстройства настроения, тревога и эмоциональная неустойчивость, в результате, например, повреждения головного мозга или дисфункции, возникшей из-за травмы головы, внутричерепных масс, удара и т.д.; хроническая усталость; вызванные стрессом психотические приступы; деменция, в том числе пресенильная деменция, болезнь Пика, сосудистая деменция, деменция множественного инфаркта, болезнь Альцгеймера, деменция, ассоциированная с болезнью Крейтцфельда-Якоба, и деменция, ассоциированная с ВИЧ; другие нейродегенеративные расстройства, в том числе болезнь Паркинсона и болезнь Гентингтона; суицидальное поведение; расстройства аппетита, в том числе анорексия, булимия и расстройство аппетита вследствие выпивки; регулируемые расстройства; соматизированное расстройство; соматоформная автономная дисфункция; соматоформное болевое расстройство; панические атаки; паническое расстройство; амнезия; невропатическая боль; фибромиалгия; мигрень; эпилепсия; шум в ушах; энурез; расстройства сна, в том числе бессонница, гиперсомния, нарколепсия, кошмарные сновидения и ночные страхи; делирий; совокупность симптомов после сотрясения; рассеянный склероз; треморы; мышечные спазмы; синдром усталых ног; синдром Леннокса; двигательный и голосовой тик; болезнь Туретта; надъядерный паралич; синдром Шая-Дрейджера; тригеминальная невралгия; паралич Белла; болезни двигательных нейронов, такие как боковой амиотрофный склероз; и психосоматические и психологические состояния, связанные с болезнями не ЦНС, такие как диабет, воспалительное заболевание, бесплодие, аллергии, псориаз, астма, гипертензия, гиперфункция мочевого пузыря, расстройства щитовидной железы, ожирение, иммунные расстройства и злокачественные опухоли.
В определенном воплощении, состояние или нарушение является состоянием или нарушением, которое реагирует на терапию агонистами допаминового рецептора D2 или на терапию SNRI, и активный фармацевтический агент представляет собой агонист допаминового рецептора D2 или SNRI или их пролекарства.
В настоящее время предпочтительными агонистами допаминового рецептора D2 для применения по способу изобретения являются соли прамипексола или суманирола. Такие агонисты допаминового рецептора D2 особенно пригодны при лечении болезни Паркинсона. В настоящее время предпочтительными SNRI для применения по способу изобретения являются соли ребоксетина и (S,S)-ребоксетина. Такие SNRI особенно пригодны при лечении депрессивной болезни и невропатической боли, в том числе постгерпетической невралгии и диабетической невропатии.
Для пояснения, в случае суманирола подходящие суточные дозировки включают 0,5, 1, 2, 4, 8, 12 и 24 мг суманирола в форме малеата суманирола. В случае прамипексола подходящие суточные дозировки включают 0,375, 0,5, 0,75, 1,0, 1,5, 3,0 и 4,5 мг моногидрата дигидрохлорида прамипексола. В случае ребоксетина или (S,S)-ребоксетина подходящие суточные дозировки включают 1, 2, 4, 6, 8 и 12 мг ребоксетина в форме его соли мезилата или (S,S)-ребоксетина в форме его соли сукцината.
В другом воплощении композицию по изобретению вводят при комбинированной терапии с одним или несколькими другими лекарственными средствами или пролекарствами. Термин “комбинированная терапия” в данном случае обозначает схему лечения, где средство, обеспечиваемое композицией по изобретению, и другое средство вводят по отдельности или вместе, последовательно или одновременно, таким способом, который дает благоприятный эффект от совместного введения указанных лечебных средств. Такой благоприятный эффект может относиться к фармакокинетике или фармакодинамике совместного введения лечебных средств и к другим параметрам. Комбинированная терапия может, например, позволить вводить меньшую дозу одного или обоих средств, чем дозы, которые нужно было бы обычно вводить при монотерапии, причем за счет этого снижается опасность вредного действия, связанного с более высокими дозами. С другой стороны, комбинированная терапия может привести к повышенному лечебному эффекту при обычной дозе каждого средства при монотерапии. В данном случае не подразумевается, что “комбинированная терапия” охватывает введение двух или большего числа лечебных средств как частей схем отдельной монотерапии, которые случайно и произвольно проявляются в последовательном или одновременном лечении.
Композиции по изобретению могут быть особенно подходящими для комбинированной терапии, в частности, когда второе средство представляет собой средство, которое вводят или которое можно вводить один раз в сутки. Имеются существенные преимущества в удобстве для пациента и его согласии, когда оба компонента комбинированной терапии можно вводить одновременно и с одной и той же частотой. Это особенно справедливо, когда пациентами являются пожилые люди или люди, страдающие ухудшением памяти.
При одновременном введении оба компонента комбинированной терапии можно вводить в отдельных лекарственных формах или в общей композиции, т.е. в единой лекарственной форме. При последовательном введении или в отдельных лекарственных формах второе средство можно вводить любым подходящим способом и в любой фармацевтически приемлемой лекарственной форме, например, способом и/или в лекарственной форме, иных, чем для композиции по изобретению. В предпочтительном воплощении оба компонента комбинированной терапии включают в состав единой лекарственной формы.
Пример комбинированной терапии включает введение один раз в сутки композиции по изобретению, содержащей SNRI, например соль ребоксетина или (S,S)-ребоксетина, и введение один раз в сутки SSRI, например, флуоксетина, флувоксамина, пароксетина или сертралина или их солей. Комбинированная терапия с SNRI/SSRI предлагается, например, для лечения депрессии устойчивости к лечению, что раскрывается в Forbes & Rogers (2003), Progress in Neurology and Psychiatry, 7(2), 10-14; согласно настоящему изобретению оба компонента такой комбинированной терапии можно вводить один раз в сутки, на что пациенты соглашаются охотнее.
ПРИМЕРЫ
Пример 1
Определяют прочность на разрыв шести полученных коммерчески партий предварительно желатинизированного крахмала с использованием трехосной процедуры испытания на прочность на разрыв, описанной в данном описании выше. Результаты для прочности на разрыв при доле твердого вещества 0,8 приводятся в табл. 1.
Таблица 1
Прочность на разрыв партий предварительно желатинизированного крахмала при доле твердого вещества 0,8 (трехосная процедура испытания) |
| Партия |
Прочность на разрыв (кН·см-2) |
| 1 |
0,323 |
| 2 |
0,220 |
| 3 |
0,074 |
| 4 |
0,119 |
| 5 |
0,287 |
| 6 |
0,236 |
Наблюдается большой перепад в прочности на разрыв предварительно желатинизированных крахмалов, колеблющейся от 0,074 до 0,323 кН·см-2. Партии 3 и 4, показывающие самые низкие значения прочности на разрыв, были от одного изготовителя. Партии 1, 5 и 6, показывающие самые высокие значения прочности на разрыв, были от другого изготовителя. Партия 2, показывающая промежуточное значение прочности на разрыв, была от третьего изготовителя.
Пример 2
Определяют прочность на разрыв шести партий предварительно желатинизированного крахмала с использованием описанной далее упрощенной процедуры испытания.
Брикеты крахмала каждой партии получают на прессе Caver, модель 3888.1DT0000, снабженной оснасткой с плоской поверхностью 10/32 дюйма (0,7 см), при сжимающих усилиях 1000, 1500, 2000 и 3000 ф/д2 (4,45, 6,67, 8,90 и 13,34 кН) для выдержки под давлеием 4 секунды и 90 секунд. Получают брикеты из еще трех партий предварительно желатинизированного крахмала (партии 7, 8 и 9) от того же изготовителя, что и партий 3 и 4, с использованием времени выдержки под давлением только 90 секунд. Измеряют массу и толщину каждого брикета (причем диаметр равен диаметру оснастки), чтобы иметь возможность вычислить кажущуюся плотность. Абсолютную плотность каждой партии крахмала измеряют с использованием гелийвоздушного пикнометра. Долю твердого вещества вычисляют как отношение кажущейся плотности к абсолютной плотности.
Твердость (усилие, требуемое для раздавливания образца) каждого брикета определяют с использованием твердомера Key НТ 500. Прочность на разрыв вычисляют из полученного усилия и размеров брикета с использованием уравнения
sT = 2F/pDH,
описанного выше.
Выполняют регрессионный анализ для определения соотношения прочности на разрыв и доли твердого вещества для каждой партии крахмала и вычисляют прочность на разрыв при стандартизированной доле твердого вещества 0,8. Данные приводятся в табл. 2.
Таблица 2
Прочность на разрыв партий предварительно желатинизированного крахмала при доле твердого вещества 0,8 (упрощенная процедура испытаний по изобретению) |
| Партия |
Прочность на разрыв (кН·см-2) |
| |
Время выдержки 4 с |
Время выдержки 90 с |
| 1 |
0,310 |
0,306 |
| 2 |
0,227 |
0,191 |
| 3 |
0,092 |
0,085 |
| 4 |
0,134 |
0,096 |
| 5 |
0,316 |
0,277 |
| 6 |
0,333 |
0,242 |
| 7 |
не опр. |
0,087 |
| 8 |
не опр. |
0,088 |
| 9 |
не опр. |
0,172 |
Корреляция прочности на разрыв, измеренной в упрощенном испытании с использованием времени выдержки под давлением 4 секунды (данный пример) с прочностью на разрыв, измеренной в трехосной процедуре испытаний примера 1, показана графически на фиг. 1.
Корреляция прочности на разрыв, измеренной в упрощенном испытании с использованием времени выдержки под давлением 90 секунд (данный пример) с прочностью на разрыв, измеренной в трехосной процедуре испытаний примера 1, показана графически на фиг. 2.
Хорошая корреляция обнаруживается при обоих временах выдержки под давлением, но корреляция особенно тесная, когда в упрощенном испытании используют время выдержки под давлением 90 секунд. Из этого следует, что упрощенное испытание, описанное в данном описании, можно использовать для оценки прочности на разрыв партии крахмала для цели предсказания, подойдет ли данная партия крахмала для получения композиции для таблетки с замедленным высвобождением по настоящему изобретению.
Пример 3
Получают таблетки с замедленным высвобождением малеата суманирола, имеющие составы, указанные в табл. 3. Содержание активного вещества в мг выражают как содержание суманирола основания.
Таблица 3
Композиция для таблеток с малеатом суманирола примера 3 |
| |
Содержание активного вещества (мг) |
| Ингредиент |
0,5 |
1 |
2 |
4 |
8 |
8 |
12 |
24 |
| |
Количество (мас.%) |
| Малеат суманирола |
0,23 |
0,45 |
0,9 |
1,8 |
3,6 |
3,6 |
5,4 |
10,9 |
НРМС, тип 2208,
4000 мПа.с |
35,00 |
35,00 |
35,0 |
35,0 |
35,0 |
35,0 |
35,0 |
35,0 |
| Предварительно желатинизированный крахмал |
63,87 |
63,65 |
63,2 |
62,3 |
60,5 |
60,0 |
58,2 |
52,5 |
| Коллоидный диоксид кремния |
0,40 |
0,40 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
| Стеарат магния |
0,50 |
0,50 |
0,5 |
0,5 |
0,5 |
1,0 |
1,0 |
1,0 |
Все ингредиенты, за исключением смазывающего вещества (стеарат магния), просеивают для удаления комков и смешивают мешалкой с малыми сдвиговыми усилиями при 24 об/мин в течение 10-30 минут. Затем в мешалку просеивают смазывающее вещество и материалы перемешивают еще в течение 2-5 минут. Полученную смесь со смазывающим веществом прессуют в таблетки в форме подушечек с использованием таблетирующей машины Kilian S100.
Пример 4
Получают таблетки, подобные таблеткам примера 3, с использованием предварительно желатинизированного крахмала партий 1-6, испытанных в примерах 1 и 2. Определяют максимальную твердость таблеток, которую можно получить с каждой партией предварительно желатинизированного крахмала.
Осуществляют корреляцию максимальной твердости с прочностью на разрыв используемой партии крахмала, измеренной в упрощенном испытании примера 2 с использованием времени выдержки под давлением 90 секунд. Результаты показаны на фиг. 3. Корреляция, по существу, линейная.
В последующих испытаниях таблетки с разной твердостью используют в качестве сердцевин для нанесения покрытия и испытывают на сопротивление эрозии во время высокоскоростной операции нанесения покрытия. Обнаруживают, что сердцевины таблеток с твердостью по меньшей мере примерно 24 SCU (примерно 17 кп) имеют приемлемое сопротивление эрозии. Как видно на фиг. 3, такую степень твердости можно достичь с использованием предварительно желатинизированного крахмала, имеющего прочность на разрыв по меньшей мере примерно 0,175 кН·см-2. Предварительно желатинизированный крахмал партий 3 и 4 является непригодным, имея прочность на разрыв менее примерно 0,15 кН·см-2, причем таблетки с таким крахмалом имеют максимальную твердость не более примерно 20 SCU (примерно 14 кп).
Пример 5
Получают таблетки с замедленным высвобождением моногидрата дигидрохлорида прамипексола, имеющие составы, указанные в табл. 4.
Таблица 4
Композиции таблеток с дигидрохлоридом прамипексола примера 5 |
| Ингредиент |
Количество (мг) |
| Моногидрат дигидрохлорида прамипексола |
0,375 |
0,75 |
1,5 |
3,0 |
4,5 |
0,375 |
0,375 |
4,5 |
НРМС, тип 2208,
4000 мПа·с |
140,0 |
140,0 |
140,0 |
140,0 |
140,0 |
70,0 |
157,5 |
157,5 |
| Предварительно желатинизированный крахмал |
206,5 |
206,1 |
205,4 |
203,9 |
202,4 |
101,5 |
189,0 |
184,9 |
Коллоидный диоксид
Кремния |
1,4 |
1,4 |
1,4 |
1,4 |
1,4 |
1,4 |
1,4 |
1,4 |
| Стеарат магния |
1,75 |
1,75 |
1,75 |
1,75 |
1,75 |
1,75 |
1,75 |
1,75 |
| Всего |
350 |
350 |
350 |
350 |
350 |
175 |
350 |
350 |
Таблетки получают процедурой, описанной в примере 3, с использованием предварительно желатинизированного крахмала, имеющего прочность на разрыв по меньшей мере примерно 0,175 кН·см-2.
Пример 6
Получают таблетки с покрытием с замедленным высвобождением дигидрохлорида прамипексола, имеющие состав, указанный в табл. 5.
Таблица 5
Композиция таблеток с покрытием примера 6 |
| Ингредиент |
Количество (мг) |
| Моногидрат дигидрохлорида прамипексола |
0,375 |
| НРМС, тип 2208, 4000 мПа·с |
140,0 |
| Предварительно желатинизированный крахмал |
206,5 |
| Коллоидный диоксид кремния |
1,4 |
| Стеарат магния |
1,75 |
| Сердцевина, всего |
350 |
Материал покрытия на основе
этилцеллюлозы (Surelease®) |
7,88 |
Материал покрытия на основе
НРМС (Opadry®) |
2,63 |
| Покрытие, всего |
10,5 |
Получают сердцевины таблеток так же, как в примере 5, с применением предварительно желатинизированного крахмала, имеющего прочность на разрыв по меньшей мере примерно 0,175 кН·см-2. Раствор для нанесения покрытия получают следующим образом. Материал на основе НРМС Opadry® в количестве 6,004 г добавляют к 106,682 г воды и перемешивают в течение 45 минут для получения смеси НРМС. Затем к смеси НРМС добавляют 72,045 г материала на основе этилцеллюлозы Surelease® и перемешивают еще в течение 30 минут для получения раствора для покрытия.
Раствор для покрытия наносят на сердцевины таблеток с использованием ванны для нанесения покрытия 12-дюймовой (примерно 30 см) Vector LCDS или 24-дюймовой (примерно 60 см) Thomas Accla-Coata в течение примерно 15 минут при температуре слоя по меньшей мере примерно 70°С. После отверждения температуру снижают в течение примерно 8 минут до температуры выпуска примерно 45оС.
Пример 7
Получают таблетки с покрытием с замедленным высвобождением дигидрохлорида прамипексола, имеющие состав, указанный в табл. 6.
Таблица 6
Композиция таблеток с покрытием примера 7 |
| Ингредиент |
Количество (мг) |
| Моногидрат дигидрохлорида прамипексола |
0,375 |
| НРМС, тип 2208, 4000 мПа.с |
140,0 |
| Предварительно желатинизированный крахмал |
206,5 |
| Коллоидный диоксид кремния |
1,4 |
| Стеарат магния |
1,75 |
| Сердцевина, всего |
350 |
Материал покрытия на основе
этилцеллюлозы (Surelease®) |
8,4 |
Материал покрытия на основе
НРМС (Opadry®) |
2,1 |
| Покрытие, всего |
10,5 |
Получают сердцевины таблеток точно так же, как в примере 5, с использованием предварительно желатинизированного крахмала, имеющего прочность на разрыв по меньшей мере примерно 0,175 кН·см-2. Раствор для нанесения покрытия получают следующим образом. Материал на основе НРМС Opadry® в количестве 4,801 г добавляют к 103,041 г воды и перемешивают в течение 45 минут для получения смеси НРМС. Затем к смеси НРМС добавляют 76,819 г материала на основе этилцеллюлозы Surelease® и перемешивают еще в течение 30 минут для получения раствора для покрытия.
Нанесение покрытия до увеличения массы на 3 мас.% и отверждение таблеток с покрытием осуществляют точно так же, как в примере 6.
Пример 8
Получают таблетки с покрытием с замедленным высвобождением дигидрохлорида прамипексола, имеющие состав, указанный в табл. 7.
Таблица 7
Композиция таблеток с покрытием примера 8 |
| Ингредиент |
Количество (мг) |
| Моногидрат дигидрохлорида прамипексола |
0,375 |
| НРМС, тип 2208, 4000 мПа·с |
140,0 |
| Предварительно желатинизированный крахмал |
206,5 |
| Коллоидный диоксид кремния |
1,4 |
| Стеарат магния |
1,75 |
| Сердцевина, всего |
350 |
Материал покрытия на основе
этилцеллюлозы (Surelease®) |
13,13 |
Материал покрытия на основе
НРМС (Opadry®) |
4,38 |
| Покрытие, всего |
17,5 |
Получают сердцевины таблеток точно так же, как в примере 5, с использованием предварительно желатинизированного крахмала, имеющего прочность на разрыв по меньшей мере примерно 0,175 кН·см-2. Раствор для нанесения покрытия получают следующим образом. Материал на основе НРМС Opadry® в количестве 10,003 г добавляют к 177,737 г воды и перемешивают в течение 45 минут для получения смеси НРМС. Затем к смеси НРМС добавляют 120,03 г материала на основе этилцеллюлозы Surelease® и перемешивают еще в течение 30 минут для получения раствора для покрытия.
Нанесение покрытие до увеличения общей массы на 3 мас.% и отверждение таблеток с покрытием осуществляют точно так же, как в примере 6. После этой стадии первого отверждения покрытие наносят повторно и получают в итоге таблетку с увеличением массы на примерно 5%, после чего проводят отверждение в течение примерно 15 минут при температуре слоя по меньшей мере примерно 70оС. После отверждения температуру снижают в течение примерно 8 минут до температуры выпуска примерно 45°С.
Пример 9
Получают таблетки с покрытием с замедленным высвобождением дигидрохлорида прамипексола, имеющие состав, указанный в табл. 8.
Таблица 8
Композиция таблеток с покрытием примера 9 |
| Ингредиент |
Количество (мг) |
| Моногидрат дигидрохлорида прамипексола |
0,375 |
| НРМС, тип 2208, 4000 мПа·с |
140,0 |
| Предварительно желатинизированный крахмал |
206,5 |
| Коллоидный диоксид кремния |
1,4 |
| Стеарат магния |
1,75 |
| Сердцевина, всего |
350 |
Материал покрытия на основе
этилцеллюлозы (Surelease®) |
14,0 |
Материал покрытия на основе
НРМС (Opadry®) |
3,5 |
| Покрытие, всего |
17,5 |
Получают сердцевины таблеток точно так же, как в примере 5, с использованием предварительно желатинизированного крахмала, имеющего прочность на разрыв по меньшей мере примерно 0,175 кН·см-2. Раствор для нанесения покрытия получают следующим образом. Материал на основе НРМС Opadry® в количестве 8,002 г добавляют к 171,735 г воды и перемешивают в течение 45 минут для получения смеси НРМС. Затем к смеси НРМС добавляют 128,032 г материала на основе этилцеллюлозы Surelease® и перемешивают еще в течение 30 минут для получения раствора для покрытия.
Нанесение покрытия до увеличения общей массы на 5 мас.% и отверждение таблеток с покрытием осуществляют точно так же, как в примере 8.
Пример 10
Профили растворения таблеток с 0,375 мг дигидрохлорида прамипексола каждого из примеров 5, 6 и 9 оценивают в стандартном анализе на растворение in vitro, USP, в следующих условиях. Используют прибор 1 USP для перемешивания растворяющей среды (900 мл 0,05 М фосфатного буфера при рН 6,8) при скорости вращения шпинделя 100 об/мин и температуре 37°С.
Данные приводятся на фиг. 4. Таблетка без покрытия примера 5 и таблетка примера 6 с 3% покрытием, содержащим 25% порообразователя, показывают весьма схожие общие профили растворения. Однако при более тщательной проверке будет заметно, что таблетка без покрытия примера 5 показывает более быстрое начальное растворение, так что через 1 час и 2 часа обработки образцов процент растворенного вещества выше, чем в случае таблетки с покрытием примера 6. Например, за 1 час таблетка с покрытием примера 6 показывает растворение только на 11%, в то время как таблетка без покрытия примера 5 показывает растворение на 15%. Подобным образом, за 2 часа таблетка с покрытием примера 6 показывает растворение не более чем на 20%, в то время как таблетка без покрытия примера 5 показывает растворение на 24%.
Растворение таблетки примера 9, имеющее 5% покрытие, содержащее 20% порообразователя, показывает профиль растворения более медленного, чем таблетка примера 5 или таблетка примера 6.
Пример 11
Получают таблетки с замедленным высвобождение сукцината (S,S)-ребоксетина, имеющие составы, указанные в табл.9. Следует отметить, что каждая таблетка содержит 5,5 мг сукцината (S,S)-ребоксетина, эквивалентные 4 мг (S,S)-ребоксетина основания.
Таблица 9
Композиции таблеток с сукцинатом (S,S)-ребоксетина примера 11 |
| Ингредиент |
Количество (мг) |
| Сукцинат (S,S)-ребоксетина |
5,5 |
5,5 |
5,5 |
| НРМС, тип 2208, 4000 мПа·с |
40,0 |
80,0 |
160,0 |
| Предварительно желатинизированный крахмал |
53,5 |
112,5 |
230,5 |
| Коллоидный диоксид кремния |
0,5 |
1,0 |
2,0 |
| Стеарат магния |
0,5 |
1,0 |
2,0 |
| Всего |
100,0 |
200,0 |
400,0 |
Таблетки получают процедурой, описанной в примере 3, с использованием предварительно желатинизированного крахмала, имеющего прочность на разрыв по меньшей мере примерно 0,175 кН·см-2.
Пример 12
Оценивают профили растворения таблеток примера 11 с 4 мг сукцината (S,S)-ребоксетина примера 11 в стандартном анализе на растворение in vitro, USP, в следующих условиях. Используют прибор 2 USP для перемешивания растворяющей среды (1 л 0,05 М фосфатного буфера при рН 6,8) при скорости вращения лопасти 50 об/мин и температуре 37°С. Затем среду фильтруют и образцы анализируют методом УФ-детекции.
Данные приводятся на фиг. 5. Таблетка, имеющая общую массу 100 мг, растворяется быстрее других, а таблетка массой 400 мг растворяется медленнее всего. Таблетка общей массой 200 мг имеет среднюю скорость растворения.
Формула изобретения
1. Фармацевтическая композиция с замедленным высвобождением в форме таблетки, доставляемой перорально, содержащая активный фармацевтический агент, выбранный из (S,S)-ребоксетина или его соли и прамипексола или его соли, активный фармацевтический агент составляет приблизительно от 0,01 мас.% приблизительно до 25 мас.% композиции и диспергирован в матриксе, содержащем гидрофильный полимер и крахмал, имеющий прочность на разрыв по меньшей мере приблизительно 0,15 кН·см-2, по меньшей мере приблизительно 0,175 кН·см-2 или по меньшей мере приблизительно 0,2 кН·см-2, при доле твердого вещества, характерной для таблетки, где гидрофильный полимер составляет приблизительно от 20 мас.% приблизительно до 70 мас.% композиции, и крахмал составляет приблизительно от 25 мас.% приблизительно до 75 мас.% композиции.
2. Композиция по п.1, где крахмал представляет собой предварительно желатинизированный крахмал.
3. Композиция по п.1, где крахмал присутствует в количестве приблизительно от 40 мас.% приблизительно до 70 мас.% или приблизительно от 45 мас.% приблизительно до 65 мас.%.
4. Композиция по п.1, где гидрофильный полимер выбирают из группы, состоящей из метилцеллюлозы, гидроксипропилметилцеллюлозы, натрийкармеллозы и карбомера.
5. Композиция по п.1, где гидрофильный полимер представляет собой гидроксипропилметилцеллюлозу.
6. Композиция по п.1, где гидрофильный полимер присутствует в количестве приблизительно от 30 мас.% приблизительно до 60 мас.% или приблизительно от 35 мас.% приблизительно до 50 мас.%.
7. Композиция по п.1, где активный фармацевтический агент представляет собой сукцинат (S,S)-ребоксетина.
8. Композиция по п.7, содержащая приблизительно от 0,2 приблизительно до 15 мг ребоксетина на таблетку, или приблизительно от 1 приблизительно до 12 мг ребоксетина на таблетку.
9. Композиция по п.1, дополнительно содержащая покрытие на таблетке.
10. Композиция по п.9, где указанное покрытие представляет собой слой, регулирующий высвобождение.
11. Композиция по п.10, где указанный слой, регулирующий высвобождение, составляет приблизительно от 1% приблизительно до 15% от массы таблетки.
12. Композиция по п.9, где указанное покрытие является нефункциональным покрытием.
13. Фармацевтическая композиция в форме таблетки, доставляемой перорально, содержащая сукцинат (S,S)-ребоксетина в количестве приблизительно от 0,2 мг приблизительно до 15 мг на таблетку или приблизительно от 0,1 до 10 мас.% композиции, диспергированный в матриксе, содержащем (а) НРМС в количестве приблизительно от 35% приблизительно до 50% от массы таблетки и (b) предварительно желатинизированный крахмал, имеющий прочность на разрыв по меньшей мере приблизительно 0,15 кН·см-2 при доле твердого вещества 0,8, в количестве приблизительно от 45% приблизительно до 65% от массы таблетки.
14. Способ определения пригодности крахмала для применения в таблетке с замедленным высвобождением, доставляемой перорально, содержащей активный фармацевтический агент с растворимостью не менее приблизительно 10 мг/мл, предусматривающий стадии
(a) получения брикетов образца крахмала на таблеточном прессе-автомате в интервале сжимающих усилий, применяемых в течение времени выдержки под давлением в пресс-форме по меньшей мере приблизительно 4 с;
(b) измерения твердости каждого брикета, выражаемой как усилие, требуемое для того, чтобы вызвать раздавливание брикета;
(c) определения доли твердого вещества каждого брикета;
(d) вычисления прочности на разрыв 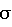 Т каждого брикета из уравнения Т каждого брикета из уравнения
 T=2F/ T=2F/ DH, DH,
где F представляет собой усилие, требуемое для того, чтобы вызвать раздавливание, D представляет собой диаметр брикета, и Н представляет собой толщину брикета;
(e) установления соотношения прочности на разрыв и доли твердого вещества брикетов; и
(f) использования указанного соотношения для оценки прочности на разрыв при доле твердого вещества, характерной для нужной таблетки с замедленным высвобождением;
причем крахмал считают подходящим для указанного применения, если его прочность на разрыв, оцененная таким образом, равна по меньшей мере примерно 0,15 кН·см-2.
15. Композиция по п.1, где активный фармацевтический агент представляет собой прамипексол или его соль.
16. Композиция по п.1, где активный фармацевтический агент представляет собой S-энантиомер прамипексола или его соль.
17. Композиция по п.1, где активный фармацевтический агент представляет собой моногидрат дигидрохлорида прамипексола.
18. Композиция по любому из пп.15-17, где активный фармацевтический агент составляет приблизительно от 0,05 мас.% приблизительно до 5 мас.% композиции.
19. Композиция по любому из пп.15-17, где композиция содержит приблизительно от 0,1 приблизительно до 10 мг активного фармацевтического ингредиента на таблетку, приблизительно от 0,2 приблизительно до 6 мг активного фармацевтического ингредиента на таблетку или приблизительно от 0,3 мг приблизительно до 5 мг активного фармацевтического ингредиента на таблетку.
20. Применение фармацевтической композиции по любому из пп.1-13 и 15-19 для лечения нарушения или состояния, выбранного из депрессивного психоза, невропатической боли и болезни Паркинсона.
21. Применение по п.20, где фармацевтическая композиция применяется не более одного раза в день.
РИСУНКИ
|
|