Патент на изобретение №2292390
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ШТАММ Aerococcus viridans N167K, КОТОРЫЙ ПРОЯВЛЯЕТ ПРОТИВОМИКРОБНУЮ АКТИВНОСТЬ, И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ЕГО ОСНОВЕ
(57) Реферат:
Изобретение относится к биотехнологии и медицине, и может быть использовано в бактериотерапии и бактериопрофилактике инфекций разнообразной этиологии и локализаций. Штамм Aerococcus viridans B-7069 ИМВ HAH Украины проявляет противомикробную активность и является пригодным для получения лечебных средств, предназначенных для лечения инфекционных заболеваний разной этиологии и локализации. Лекарственное средство содержит терапевтически эффективное количество лиофилизированных вегетативных клеток штамма Aerococcus viridans B-7069 ИМВ НАН Украины и фармацевтически приемлемый носитель. Изобретение обеспечивает проявление у штамма высокой антимикробной активности и является эффективным средством в лечении инфекционных поражений разной локализации. 2 н.п. ф-лы, 4 табл.
Изобретение относится к медицине и биотехнологии, в частности к новым штаммам микроорганизмов-пробиотиков и медицинских препаратов на их основе. Бактериотерапия и бактериопрофилактика инфекций разнообразной этиологии и локализации, а также патологические процессы неинфекционного происхождения приобретают все большую актуальность в связи с возрастанием понимания роли. нормальной микрофлоры для организма человека в процессах неспецифичной резистентности к инфекциям, в формировании иммунных ответов, антагонистической роли микрофлоры, участия в регуляции метаболических процессов, а также в связи с выявлением их антидотии, антиоксидантной, антиканцерогенной роли в макроорганизме. На сегодня существует большое количество биопрепаратов для внутреннего применения, которые как активный агент содержат известные штаммы микроорганизмов, например такие как бифидум-, лакто- и колибактерин. Основным фактором эффективности бифидумбактерина является антагонистическая активность, обусловленная сильным кислотообразованием, продуцированием лизоцима. Механизм действия лактобактерина близкий к бифидумбактерину и также предопределяется сильным кислотообразованием. Этот препарат наиболее действенный при лечении острых и хронических кишечных инфекций, коррекции дисбактериозов. Поскольку названные препараты содержат штаммы-представители исключительно индигенной микрофлоры кишечника, которые осуществляют свое антагонистическое действие и антагонистическую способность колонизации только для слизистых оболочек кишечника, область их применения узкая и ограничивается лечением и профилактическим влиянием при инфекциях кишечника. В основу группы изобретений, которая заявляется, поставлена задача расширить ассортимент биологических препаратов, которые содержат лиофилизированные жизнеспособные клетки бактерий и носитель и отличаются более широким спектром действия. Указанную задачу решает штамм Aerococcus viridans №167К [Депозитарий Института микробиологии и вирусологи НАН Украины, ул. Заболотного, 154, Киев-143, 03143; 20 июня 2002 г.; регистрационный номер-Aerococcus viridans IMB В-7069, сокращенно – р.н. ИМВ В-7069] для изготовления врачебных препаратов, косметических средств и биоактивных добавок. Наиболее близким штаммом к предложенному является штамм Aerococcus viridans №167 (рег. номер ИМВ В-7041), выделенный из грудного молока. Однако использование этого штамма не всегда эффективно из-за недостаточной технологичности и умеренной биологической активности. В основу изобретения поставлена задача получить более продуктивный штамм Aerococcus viridans (путем использования методов аналитической селекции) с высокими адгезивными свойствами и широким спектром антагонистического действия. Поставленная задача решена путем получения нового штамма Aerococcus viridans №167К, выделенного методами аналитической селекции из штамма Aerococcus viridans №167 (р.н. ИМВ В-7041) и депонированного в коллекции Института микробиологии и вирусологи (ИМВ) HAH Украины под номером ИМВ В-7069. Штамм идентифицирован по “Краткому определителю бактерий” Берги. В результате селекционной работы вышеупомянутый штамм приобретает такие культурально-морфологические и физиолого-биохимические свойства, которые и обеспечивают его высокую производительность при лечении и профилактике заболеваний слизистых оболочек и кожных покровов. Культурально-морфологические свойства штамма. Грамположительные кокки, недвижимые, 1-2 мкм в диаметре, которые располагаются парами или нерегулярными сосредоточениями. Клеточная стенка состоит из двух электронно-плотных и одного менее плотного промежуточного пласта. Толщина цитоплазматической мембраны 200-400А. Цитоплазма клеток имеет гетерогенный характер. Она заполнена мелкими гранулами, полирибосомами, сконцентрированными вокруг мезосом или ядерных образований. Колонии аэрококков на плотном питательном агаре круглые, 0,5-1,0 мм в диаметре, полупрозрачные, белые или серые, иногда бусинкоподобные. На кровяном агаре колонии аэрококков имеют большие размеры, окруженные зоной позеленения, возможно, в результате действия лактат-оксидазы. Рост в питательном бульоне сопровождается гомогенным помутнением, которое имеет тенденцию превращаться в зернистый осадок. Рост аэрококков зависит от наличия в среде биотина, пантотеновой и никотиновой кислот. Штамм не требует для своего роста витаминов группы “В”: тиамина, рибофлавина, пиридоксина, фолиевой и флавоновой кислот. Tween-80 заменяет потребность в биотине. Для роста аэрококков необходимы экзогенные пурины. Гуанин и ксантин взаимозаменяемые с аденином. Штамм не имеет потребности в экзогенных пиримидинах. Потребность в аминокислотах вариабельна. Потребность для роста в биотине, никотиновой, пантотеновой кислотах, пуринах и независимость от наличия в среде витаминов группы “В”, отличает аэрококки от других грамположительных кокков, например педиококков, которые требуют фолиевую кислоту, или стрептококков – потребность в тиамине. Биохимическая активность. При культивировании на молоке с 1,0% метиленовым синим не восстанавливают последний, подкисляют молоко при отсутствии свертывания, желатин не разрежают, аргинин, крахмал, эскулин не гидролизуют. Аэрококки продуцируют кислоту, но не газ, при культивировании на средах с глюкозой, мальтозой, лактозой, манитолом, сахарозой. Ацетоин не образовывают, рафинозу не сбраживают, каталазу не продуцируют, коагулазу не образовывают. При культивировании в глюкозном (1%) бульоне – конечное рН 5,1-5,8 и рост микроаэрофильный. При аэробном росте продуцируют пероксид водорода. Каталазная активность аэрококков может иметь негеминовый характер. Аэрококки содержат фермент, который защищает их от супероксидных радикалов – супероксидную дисмутазу, кофактором которой является марганец. По кислородостойкости аэрококки занимают второе место после S.faecalis и находятся перед Е.coli. Максимальная продукция перекиси водорода культурами аэрококков отмечается в ранний период логарифмической фазы культуры. У аэрококков – сильных продуцентов пероксида водорода стационарная фаза развития культуры непродолжительная. Отмечается их высокая чувствительность к антибиотикам. Химический состав. Клеточная стенка аэрококков содержит глюкозу, галактозу, галактозамин и не содержит рамнозу, глицерол или рибитол. Определено одинаковое содержание Г+Ц пар в ДНК аэрококков и педиококков, равный 41-43%. Содержание Г+Ц пар в ДНК аэрококков колебалось в границах 39,5-42,0%. У аэрококков, выделенных из грудного молока, содержимое Г+Ц пар – 39,9-42,0%, из коровьего – 39,5-41,6%. Биологические свойства Антагонистическую активность штамма Aerococcus viridans 167K (р.н. ИМВ В-7069) проверяют по отношению 9 тест-штаммов -Staphylococcus aureus 209p, Proteus vulgaris 401, Proteus mirabilis H 2091, Klebsiella pneumoniae 320, Pseudomonas aeruginosa 1312, Shigella sonnei, Shigella flexneri 1046, Salmonella typhimurium 5710, Vibrio Nag p 6078 – методом штриха на плотной питательной среде в чашках Петри. Ампулу с культурой разводят 0,9% раствором натрия хлорида, из расчета содержимого 2·108 аэрококков в 1 мл и засевают штрихом по диаметру чашки с МПА, который содержит 1% глюкозы и 0,4 мг/мл калия йодида. После инкубации посевов в термостате при температуре (36±1)°С на протяжении 48 часов перпендикулярно выросшей культуре аэрококков подсевают петлей Генле культуру тест-штаммов. После 24-х часов инкубации при температуре (36±1)°С зоны задержки роста тест-культуры измеряют от края штриха к началу роста тест-культуры. Зоны угнетения роста тест-штаммов должны быть не меньше чем 7 мм для Pseudomonas aeruginosa 1312 и не меньше чем 15 мм для всех других культур, в сравнении с 5 мм и 10 мм прототипа. Оксидазная активность. С антагонистической активностью штама коррелирует показатель оксидазной активности, который определяют по способности аэрококков изменять окраску крахмала в составе питательной среды с йодидом калия. Диаметр посинения крахмала вокруг штриха Aerococcus viridans 167K (р.н. ИМВ В-7069) составляет не меньше 30 мм. Способность к адгезии in vitro изучали на переживающей культуре эпителиоцитов кишечника кроликов и белых беспородных мышей по общепринятой методике. После часовой инкубации при 37°С культуры эпителиоцитов вместе с аэрококками штаммов Aerococcus viridans 167K (р.н. ИМВ В-7069) и Aerococcus viridans 167 (р.н. ИМВ В-7041) готовили препараты для электронной микроскопии. Степень адгезии оценивали по мазкам, окрашенным 1% раствором тулоидинового синего. При этом определяли количество клеток, которые находятся в состоянии контакта с аэрококками, и интактных. Результаты приведены в таблице 1.
В соответствии с приведенными данными оба штамма аэрококков одинаково активно адсорбировались на энтероцитах как кролика, так и мыши, но заявленный штамм демонстрировал более высокую эффективность в сравнении с прототипом. Влияние на фагоцитарную активность полиморфно-ядерных нейтрофилов периферической крови. Продуктами метаболизма A.viridans 167К (р.н. ИМВ В-7069) являются вещества, необходимые в процессе осуществления фагоцитарной функции – перекись водорода, супероксиддисмутаза, лизоцимоподобные вещества, токсичные формы кислорода, а также гидроксильные радикалы. Активность нейтрофильных гранулоцитов оценивали по фагоцитарной активности и индексом завершения фагоцитоза – килингом, что наиболее полно характеризует функциональную способность нейтрофильных фагоцитов за счет образования гранулоцитами токсичных форм кислорода, а также гидроксильного радикала. Супероксиддисмутаза связывает этот кислород с водородом, образовывая перекись водорода. Процессы перекисного окисления ведут к повреждению мембран микроорганизмов, предопределяя их гибель. Проведены две серии опытов in vitro с целью выяснения влияния ферментного комплекса A.viridans 167K (р.н. ИМВ В-7069) на фагоцитарную функцию полиморфно-ядерных нейтрофилов. Результаты представлены в таблицах 2 и 3.
Как свидетельствуют приведенные данные, в 4 из 5-ти проведенных опытов отмеченное статистически достоверное повышение индекса завершения фагоцитоза при добавлении 0,01 мл ферментного комплекса A.viridans ИМВ В-7069.
Сравнивая данные, приведенные в таблицах 2 и 3, можно сделать вывод о дозозависимом стимулирующем влиянии ферментного комплекса A. viridans 167K (р.н. ИМВ В-7069) на важнейшую, конечную стадию фагоцитоза – килинг. Доза 0,01 мл стимулирует килинг, не угнетая функции адгезии и поглощения. Еще одним объектом данного изобретения является лечебное средство Виабак (Viabac), содержащее терапевтически эффективное количество лиофилизованных вегетативных клеток штамма A.viridans 167K (р.н. ИМВ В-7069) в составе биоконцентрата. Согласно с обычной фармацевтической практикой биоконцентрат преимущественно вводят в состав композиции совместно с одним или несколькими носителями (разнообразные лечебные, вкусовые, пищевые добавки и наполнители). Перечни пригодных для этой цели компонентов хорошо известны осведомленным специалистам, как и способы их смешивания. В частности, ими могут быть молочный сахар, фруктовый пектин, поливинилпирролидон, производные целлюлозы, стеарат магния, витамины, фруктовые порошки и т.п. Для перорального употребления биоконцентрат в соответствии с этим изобретением может быть введен в состав капсул, таблеток или других пероральных врачебных форм. Для внешнего применения он может использоваться в виде мазей, лечебно-профилактических зубных паст и т.п. Приведенные дальше примеры иллюстрируют изобретение, но никаким образом не ограничивают его. Пример 1. Получение лиофилизированного биоконцентрата А.viridans 167K (р.н. ИМВ В-7069) (в дальнейшем биоконцентрат). Оптимальный рост аэрококков наблюдается через 24 часа при (36±1)°С на мясопептонном агаре. Состав среды для культивирования штамма следующий, г:
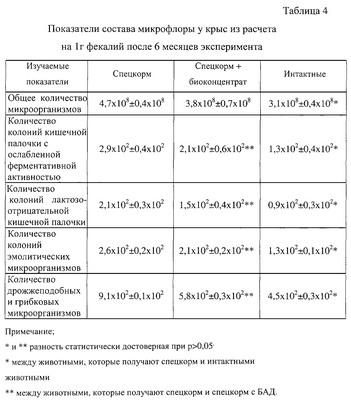
Для приготавливания среды дистиллированную воду смешивают с пептоном и агаром. Смесь выдерживают 20-30 минут при комнатной температуре для набухания агара и кипятят 15-20 минут до его полного расплавления. Далее 30%-ным раствором уксусной кислоты устанавливают рН 3,8. После часового отстаивания среду декантируют через ватно-марлевый фильтр и добавляют глюкозу, после чего стерилизуют при температуре (110±1)°С на протяжении 30 минут. На питательной среде вырастают колонии диаметром 0,5-2,0 мм в виде плоских бесцветных дисков. После инкубации микробную массу смывают в асептических условиях путем добавления водного раствора стабилизатора. Проводят бактериоскопический и бактериологический контроль собранной микробной суспензии и лиофилизируют ее. Высушенную суспензию измельчают и расфасовывают в стерильную тару и герметизируют. В 1 г биоконцентрата помещается до 5×1010 жизнеспособных клеток. Полученный биоконцентрат представляет собой смесь лиофильно высушенных живых вегетативных клеток бактерии; стабилизатора, например желатины и сахарозы; сухих компонентов питательной среды и биологически активных веществ, которые продуцируются штаммом. В дальнейшем полученный биоконцентрат может использоваться сам по себе или в составе лечебного средства для профилактики и лечения разнообразных болезненных состояний. Для культивирования A.viridans 167K (р.н. ИМВ В-7069) также можно использовать жидкую питательную среду, в частности МПБ с азотно-амиачной добавкой (не менее чем 12 мас.%). Хороший урожай культуры получают, если эта среда дополнительно содержит Tween-80 и никотиновую кислоту. Коррекцию рН раствора осуществляют с помощью 10%-ного аммиака и доводят до значения 6,2-6,4. Для промышленного производства наиболее привлекательным для выращивания A.viridans 167K (р.н. ИМВ В-7069) является использование грибного отвара, что объясняется его умеренной ценой и промышленно значащим выходом готового продукта. Это в конечном счете отразится на удешевлении лечебного средства на основе A.viridans 167K (р.н. ИМВ В-7069). Пример 2. Использование биоконцентрата A.viridans 167K (р.н. ИМВ В-7069) для получения лечебного средства в форме таблетки. Смешивают 20,0 г глюкозы, 20,0 г яблочного пектина и 32,0 г лактозы. Полученную смесь увлажняют раствором ячменно-солодового экстракта (4,5 г экстракта и 1,2 г воды), гранулируют, подсушивают, снова гранулируют, прибавляют 1 г биоконцентрата, полученного в Примере 1, 1,3 г аскорбиновой кислоты и 0,9 г стеарата кальция. Смесь тщательно перемешивают и таблетируют, получая приятные на вкус таблетки, которые содержат 4,2×108 клеток A.viridans 167K (р.н. ИМВ В-7069). В дальнейшем полученные таблетки можно покрыть фармацевтично пригодным пленочным покрытием или использовать для получения порошка или микрогранул, которыми можно заполнить желатиновые капсулы. Пример 3. Клиническое применение A.viridans 167K (р.н. ИМВ В-7069). 3.1. Для оценки лечебных свойств А.viridans 167K (р.н. ИМВ В-7069) проведен эксперимент с моделированием дисбактериоза у крыс. Исследование количественного и качественного состава микрофлоры желудка, тонкого и толстого кишечника крыс проводили общепризнанными методами. В результате применения биоконцентрата A.viridans 167К (р.н. ИМВ В-7069) в составе корма отмечены восстановление нормального ценоза кишечника подопытных крыс, уменьшение количества условно-патогенных бактерий в толстой кишке, кишечная палочка с неизменными ферментативными свойствами высеивалась в 105-106, энтерококки в 106, практически отсутствовали гемолитические формы бактерий, спорообразующие формы бактерий высеивались как у контрольных животных, так и у тех, которые получали обычный корм (таблица 4). Таким образом, биоконцентрат A.viridans 167K (р.н. ИМВ В-7069) положительно влиял на показатели микрофлоры желудка, тонкого и толстого кишечника подопытных животных. Показатели микрофлоры у животных, которые получали исследуемый биоконцентрат как биологически активную добавку к корму, существенным образом отличались от таких же в контроле, что позволяет сделать вывод о его благоприятном действии на количественный и качественный состав микрофлоры желудочно-кишечного тракта. 3.2. Применение биоконцентрата A.viridans 167K (р.н. ИМВ В-7069) для лечения стоматологических инфекций. При лечении зубов с хроническим периодонтитом в стадии ремиссии после медикаментозной и механической обработки корневых каналов и раскрытия верхушечных отверстий в корневых каналах оставляли турунды с раствором биоконцентрата [2 дозы биоконцентрата (4,2×108 клеток), 2 мл дистиллированной воды, 0,5 мл димексида] под герметичной повязкой. Через двое суток при отсутствии клинических симптомов корневые каналы пломбировали пастоподобными материалами. Лечение острых и хронических периодонтитов в стадии обострения проходило следующим образом. В первую посещаемость раскрывались кариозные пустоты, проводилась механическая и медикаментозная обработка корневых каналов. На последнем этапе корневые каналы промывались раствором биоконцентрата. Зуб оставляли открытым с целью оттока эксудата. Через трое суток при отсутствии симптомов воспаления в каналах оставляли турунды с раствором биоконцентрата под герметичной повязкой. Через 2-3 суток при отсутствии воспаления проводили пломбирование. Проведенные исследования показали высокую эффективность биоконцентрата при лечении периодонтитов зубов: 138 зубов с хроническим периодонтитом в стадии ремиссии были вылечены за две посещаемости, 150 зубов с острым и хроническим периодонтитом в стадии обострения были вылечены за три посещения и лишь 12 зубов, рентгенограмма которых показала наличие гранулемы величиной с 0,5 на 0,5 см, были вылечены после четырех посещений. 3.3. Применение биоконцентрата A.viridans 167(р.н. ИМВ В-7069) для лечения инфекций кожных покровов. Биоконцентрат A.viridans 167K (р.н. ИМВ В-7069) использовался в отделении патологии новорожденных при лечении грудных детей с опрелостями третьей степени с некротическими изменениями. После орошения пораженных участков раствором биоконцентрата отмечалось быстрое заживление с дальнейшей эпителизацией без применения стереотипных методов лечения. Продолжительность лечения составила семь суток, то есть в два раза быстрее, чем при использовании традиционных методов. 3.4. Лечение дисбактериозов. Больным на дисбактериоз, вызванный такими возбудителями, как Staph. aureus, Citrobacter, Klebsiella+Proteys vulgaris, Eterobacter назначались препараты A.viridans 167K (р.н. ИМВ В-7069) для внутреннего применения в количествах, которые зависели от тяжести состояния больного. Во всех случаях положительный эффект от такого лечения наступал уже на вторые сутки. 3.5. Лечение острой дизентерии, эшерихиоза и сальмонеллеза. Больным на фоне традиционной терапии с целью купирования повреждений слизистой толстой кишки и дисбиоза кишечника назначались препараты A.viridans 167K (р.н. ИМВ В-7069). Препараты вводили внутренне и ректально в дозах, которые зависели от тяжести течения болезни. Результаты положительные. 3.6. Использование A.viridans 167K (р.н. ИМВ В-7069) в гинекологии также дало хорошие результаты. Больным в возрасте от 4 до 17 лет с внутривагинальными дрожжевыми, хламидиозными и трихомонадными инфекциями назначали спринцевание раствором биоконцентрата дважды в день. После курса лечения в подавляющем большинстве результаты были удовлетворительными – мазки второй и третьей степени чистоты. Штамм A.viridans 167K (р.н. ИМВ В-7069), как и лечебное средство Виабак (Viabac) на основе лиофилизированных вегетативных клеток штамма A.viridans 167K (р.н. ИМВ В-7069), проявляет антимикробную активность и является эффективным для лечения инфекционных поражений разной локализации.
Формула изобретения
1. Штамм Aerococcus viridans B-7069 ИМВ HAH Украины, проявляющий антимикробную активность. 2. Лекарственное средство, проявляющее антимикробную активность, характеризующееся тем, что оно содержит терапевтически эффективное количество лиофилизированных вегетативных клеток штамма Aerococcus viridans B-7069 ИМВ HAH Украины и фармацевтически приемлемый носитель.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||