|
(21), (22) Заявка: 98119712/04, 03.04.1997
(24) Дата начала отсчета срока действия патента:
03.04.1997
(30) Конвенционный приоритет:
03.04.1996 US 08/627,173
(43) Дата публикации заявки: 10.09.2000
(46) Опубликовано: 27.01.2007
(15) Информация о коррекции:
Версия коррекции № 1 (). Рецепторы для MIP-1 клонировались; как и другие хемокинные рецепторы эти рецепторы MIP-1 клонировались; как и другие хемокинные рецепторы эти рецепторы MIP-1 представляют собой семь рецепторов трансмембранной области (или рецепторами, “имеющими связь по гуанину”), которые соединены с белками, связывающими нуклеотид гуанина (GTP) подкласса Gингнбиторный (Gi) (рассмотренных в Murphy, Cytokine & Growth Factor Rev. 7:47-64, 1996). Для подкласса Gi “ингибирующее” предназначение определяется его ингибирующей активностью на аденилат циклазе. представляют собой семь рецепторов трансмембранной области (или рецепторами, “имеющими связь по гуанину”), которые соединены с белками, связывающими нуклеотид гуанина (GTP) подкласса Gингнбиторный (Gi) (рассмотренных в Murphy, Cytokine & Growth Factor Rev. 7:47-64, 1996). Для подкласса Gi “ингибирующее” предназначение определяется его ингибирующей активностью на аденилат циклазе.
MIP- был выделен из клеточной линии, а не из первичного материала. В то время как Грехэм и др. наблюдали, что антитело к MIP-1 был выделен из клеточной линии, а не из первичного материала. В то время как Грехэм и др. наблюдали, что антитело к MIP-1 аннулировало деятельность сырой вытяжки костного мозга, другие авторы продемонстрировали, что важной является другая ингибирующая активность. Например, Грехэм и др. (Журнал экспериментальной медицины. 178:925-32, 1993) предположили, что трансформирующий фактор роста бета- (TGF аннулировало деятельность сырой вытяжки костного мозга, другие авторы продемонстрировали, что важной является другая ингибирующая активность. Например, Грехэм и др. (Журнал экспериментальной медицины. 178:925-32, 1993) предположили, что трансформирующий фактор роста бета- (TGF ), а не MIP-1 ), а не MIP-1 , является основным ингибитором для кроветворных стволовых клеток. Далее, Ивз и др. (PNAS 90:12015-19, 1993) предположили, что как MIP-1 , является основным ингибитором для кроветворных стволовых клеток. Далее, Ивз и др. (PNAS 90:12015-19, 1993) предположили, что как MIP-1 , так и TGF , так и TGF присутствуют на субоптимальных уровнях в здоровом костном мозге и что ингибирование требует синергии между двумя факторами. присутствуют на субоптимальных уровнях в здоровом костном мозге и что ингибирование требует синергии между двумя факторами.
Недавно были получены мыши, у которых ген MIP-1 был удален путем гомологической рекомбинации (Cook et al., Science 269:1583-5, 1995). У подобных мышей не наблюдалось явного нарушения кроветворной системы, ставя под сомнение роль MIP-1 был удален путем гомологической рекомбинации (Cook et al., Science 269:1583-5, 1995). У подобных мышей не наблюдалось явного нарушения кроветворной системы, ставя под сомнение роль MIP-1 в качестве физиологического регулятора цикла развития стволовой клетки при нормальных гомеостатических условиях. Подобным же образом, хотя трансформирующий фактор роста бета – (TGF в качестве физиологического регулятора цикла развития стволовой клетки при нормальных гомеостатических условиях. Подобным же образом, хотя трансформирующий фактор роста бета – (TGF ) также обладает ингибирующей стволовую клетку активностью, продолжительность периода времени, который занимает реакция стволовой клетки на данный цитокин, дает основания полагать, что он не является эндогенным фактором, присутствующим в вытяжках костного мозга; далее, нейтрализующие антитела к TGF ) также обладает ингибирующей стволовую клетку активностью, продолжительность периода времени, который занимает реакция стволовой клетки на данный цитокин, дает основания полагать, что он не является эндогенным фактором, присутствующим в вытяжках костного мозга; далее, нейтрализующие антитела к TGF не устраняют деятельности ингибитора стволовой клетки в супернатантах костного мозга (Hampson et al., Exp. Hemat. 19:245-249, 1991). не устраняют деятельности ингибитора стволовой клетки в супернатантах костного мозга (Hampson et al., Exp. Hemat. 19:245-249, 1991).
Другие авторы описывали дополнительные, ингибирующие стволовые клетки факторы. Фриндел и соавторы выделили из мозгового вещества зародыша теленка и из печеночных вытяжек тетрапептид, который обладает ингибирующей стволовую клетку активностью (Lenfant et al., PNAS 86:779-782,1989). Пауковитц и др. (Cancer Res. 50:328-332,1990) охарактеризовали пентапептид, который в своей мономерной форме является ингибитором, а в своей димерной форме является стимулятором прохождения цикла стволовой клеткой. Другие факторы также были заявлены как ингибирующие в различных системах in vitro (см. Wright and Pragnell in Bailliere’s Clinical Haematologv, том 5, стр.723-39, 1992 (Bailliere Tinadall, Paris); Marshall and Lord, Int Rev. Cyt. 167:185-261, 1996).
Цирлова и др., SU 1561261 A1, раскрыла процесс очистки для ингибитора пролиферации стволовой клетки.
Заявки, находящиеся в совместной собственности, WO 94/22915 и WO 96/10634 раскрывают ингибитор пролиферации стволовой клетки, и они полностью включены здесь в виде ссылки.
К настоящему времени ни один из этих факторов не был одобрен для клинического использования. Однако существует потребность в эффективных ингибиторах стволовой клетки. Основная токсичность, связанная с химиотерапией или лечением облучением, связана с разрушением аномально пролиферирующих клеток, что может привести к подавлению костного мозга или желудочно-кишечной токсичности. Эффективный ингибитор стволовой клетки защитит эти клетки и позволит оптимизировать эти терапевтические режимы. Подобно тому, как существует доказанная необходимость в различных стимулирующих цитокинах (т.е. таких цитокинах, как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-13, IL-14, IL-15, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофакгальный колониестимулирующий фактор (G-M-CSF), эритропоэтин, тромбопоэтин, фактор стволовой клетки, лиганд flk/flt3 и т.д., которые стимулируют прохождение цикла кроветворными клетками), в зависимости от клинической ситуации, также вероятна необходимость различных ингибирующих факторов для удовлетворения разнообразных клинических потребностей.
Далее, существует необходимость быстрого реверсирования деятельности подобного ингибитора. Первоначальные исследования Лорда и др. (ссылка на работы которых делается выше) продемонстрировали, что ингибирующая активность могла бы быть реверсирована путем добавления стимулирующей активности. В то время как были идентифицированы различные стимулирующие цитокины (см. выше), ни один из них не продемонстрировал присутствия в вытяжках костного мозга активности, описанной Лордом и соавторами, и способность реверсировать деятельность ингибитора.
У здоровых взрослых кроветворные клетки предшественники и стволовые клетки, в основном, находятся в костном мозге. При определенных условиях, например химиотерапии или лечении такими цитокинами, как гранулоцитарный колониестимулирующий фактор, большие количества клеток предшественников и стволовых клеток выходят в периферийную кровь, процесс называемый “мобилизацией” (рассмотренный в Simmons et al., Stem Cells 12 (suppl 1): 187-202, 1994; Scheding et al. Stem Cells 12 (suppl 1): 203-11, 1994; Mangan, Sem. Oncology 22:202-9,1995; Moolten, Sem. Oncology 22:271-90, 1995). Недавно опубликованные данные дают основания полагать, что преобладающее большинство мобилизованных клеток предшественников не принимает активного участия в цикле развития клетки (Roberts and Metcalf, Blood 86:1600, 1995; Donahue et al., Blood 87:1644, 1996; Siegert and Serke, Bone Marrow Trans. 17:467, 1996; Uchida et al., Blood 89:465-72, 1997).
Гемоглобин является хорошо сохраняющимся тетрамерным белком с молекулярным весом приблизительно 64000 Дальтон. Он состоит из двух цепочек альфа- и двух цепочек бета-. Каждая цепочка связывает отдельную молекулу гемма (ферропротопорфирин IX), железосодержащую протетическую группу. Цепочки альфа- и бета-позвоночных, вероятно, выводились из отдельного предкового гена, который удвоился и затем разветвился; две цепочки сохраняют большую степень идентичности как между собой, так и между различными позвоночными (см. фиг.16А). У человека кластер альфа-цепочки на хромосоме 16 содержит два альфа-гена (альфа-1 и альфа-2), которые кодируют идентичные полипептиды, а также гены, кодирующие другие альфа-подобные цепочки: зета-, тета- и ряд нетранскрибируемых псевдогенов (см. фиг.16 В по поводу кДНК и последовательностей аминокислот альфа-цепочки человека). Кластер бета-цепочки на хромосоме 11 состоит из одного гена бета-цепочки и нескольких бета-подобных генов: дельта-, эпсилон-, G-гамма- и А-гамма-, а также по крайней мере двух невыраженных псевдогенов (см. фиг.16С по поводу кДНК и последовательностей аминокислот бета-цепочки человека).
Выражение этих генов меняется во время развития. В кроветворении человека, которое было широко охарактеризовано, эмбрионные эритробласты последовательно синтезируют тетрамеры двух зета-цепочек и двух цепочек эпсилон- (Gower I), две альфа-цепочки и две цепочки эпсилон- (Gower II) или две зета-цепочки и две гамма-цепочки (Hb Portland). По мере прохождения эмбриогенезиса преобладающая форма состоит из фетального гемоглобина (Hb F), который состоит из двух альфа- цепочек и двух гамма-цепочек. Гемоглобин взрослого (две альфа- и две бета-цепочки) начинает синтезироваться во время фетального периода; при рождении приблизительно 50% гемоглобина имеет взрослую форму и переход завершается к приблизительно шести месяцам. Преобладающее большинство гемоглобина (приблизительно 97%) у взрослых состоит из вида, имеющего две альфа- и две бета- цепочки (Hb А) с обнаружением небольших количеств Hb F или дельта-цепочки (Hb A2).
Использовалось несколько методов для выражения рекомбинантных цепочек гемоглобина в Е-coli и в дрожжах (например, Jessen et al., Methods Enz. 231:347-364, 1994; Looker et al., Methods Enz. 231: 364-374, 1994; Ogden et al., Methods Enz. 231:374-390, 1994; Martin de Llano et al., Methods Enz. 231:364-374, 1994). Таким образом, до сих пор не предоставлялось возможным выразить изолированную альфа-цепочку человека в больших количествах с помощью рекомбинантных методов (например, Hoffman et al., PNAS 87:8521-25, 1990; Hernan et al., Biochem. 31:8619-28, 1992). Очевидно, что изолированная альфа-цепочка не принимает стабильную форму и быстро деградирует в Е.coli. Совместное выражение бета-цепочки с альфа-цепочкой приводит к увеличенной выраженности того и другого (Hoffman et al. and Hernen et al., цитируемая работа). В то время как альфа-цепочка выражалась как слитый белок с частью бета-цепочки и местом распознания фактора Ха (Nagai and Thorgersen, Methods Enz. 231:347-364, 1994), при этих условиях она выражается как нерастворимое включение.
Как бета-цепочка, так и альфа-цепочка содержат места присоединения для гаптоглобина. Гаптоглобин представляет собой сывороточный белок с чрезвычайно высоким аффинитетом к гемоглобину (например, Putnam в The Plasma Proteins-Structure, Function and Genetic Control (F.W.Putnam, Ed.), том 2, стр.1-49 (Академик Пресс, Нью Йорк); Hwang and Greer, JBC 255:3038-3041, 1980). Перенос гаптоглобина в печень является основным катаболическим путем для циркулирующего гемоглобина. На альфа-цепочке имеется единственное место присоединения для гаптоглобина (аминокислоты 121-127) и два – на бета-цепочке (участки аминокислот 11-25 и 131-146) (Kazim and Atassi, Biochem J. 197:507-510, 1981; McCormick and Atassi, J. Prot. Chem. 9:735-742, 1990).
Биологически активные пептиды с опиатной активностью были получены протеолитической деградацией гемоглобина (рассмотрено в Karelin et al., Peptides 16:693-697, 1995). Альфа-цепочка гемоглобина имеет кислотно-лабильный участок дробления клетки между аминокислотами 94-95 (Shaeffer, J. Biol. Chem. 269:29530-29536, 1994).
Креглер и др. (Экспериментальная гематология 9:11-21, 1981) описали, что гемоглобин имеет усиливающее воздействие на колонии клеток предшественников колониеобразующих единиц КОЕ-С костного мозга мыши. Подобные анализы демонстрируют воздействие на популяции клеток предшественников КОЕ-ГМ и КОЕ-М, в отличие от таких стволовых клеток как колониеобразующие единицы смешанного типа (КОЕмикст). Авторы наблюдали активность в обеих изолированных цепочках альфа- и бета-гемоглобина. Данная активность устранялась путем обработки N-этилимидмалеиновой кислоты, что навело Креглера и др. на мысль о необходимости сульфидрильной группы. Это наблюдение, наряду с тем фактом, что стимулирующая деятельность оказывала сопротивление усвоению трипсина, навели Креглера и др. на мысль о том, что за эту активность отвечала С-терминальная гидрофобная область или “сердечник”. Могатташ и др. (Acta. Haematol. 92:182-186, 1994) раскрыли, что рекомбинантный гемоглобин имеет стимулирующее воздействие на число клеток предшественников КОЕ-Е, БОЕэ и КОЕ-ГМ, что подобно воздействию, наблюдаемому у гемина. Мюллер и др. (Кровь 86: 19746 1995) раскрыли, что очищенный взрослый гемоглобин стимулирует эритроидные клетки-предшественники подобно гемину.
Петров и др. (Bioscience Reports 15:1-14, 1995) раскрыли использование “неидентифицированной миелопептидной смеси” при лечении врожденной анемии у мыши Wv/Wv. Смесь увеличивала число колоний селезенки, особенно имеющих эритроидный тип.
Гем и гемин широко исследовались в отношении их влияния на кроветворение (см. Sassa, Seminars Hemat. 25:312-20, 1988, и N. Abraham et al., Int. J. Cell Cloning 9:185-210, 1991, где рассматриваются эти вопросы). Гем необходим для созревания эритробластов; in vitro гемин (хлороферропротопорфирин IX, т.е. гем с дополнительным ионом хлорида) увеличивает пролиферацию колониеобразующей единицы гранулоцитов-эритроцитов-макрофагов-мегакариоцитов (КОЕ-ГЭММ), эритроидной бурстобразующей единицы (БОЕэ) и КОЕ-Е. Подобным же образом гемин увеличивает насыщенность клетками в долгоживущих культурах костного мозга.
“Опиаты” являются веществами с анальгетическими свойствами, подобными морфину, основному активному веществу в опиуме. Опиаты могут быть небольшими органическими молекулами, такими как морфин и другие алкалоиды или синтетические соединения, или эндогенными пептидами, такими как энкефалины, эндорфины, динорфины и их синтетические производные. Эндогенные опиатные пептиды производятся in vivo из более крупных предшественников – пред-проэнкефалина А для Met и Leu энкефалинов, пред-проопиомеланокортина для  , ,  и и 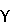 эндорфинов и пред-продинорпина для динорпинов А и В, эндорфинов и пред-продинорпина для динорпинов А и В,  -неоэндорпина и -неоэндорпина и  -неоэрдорпина. В дополнение, пептиды с опиатной активностью могут быть получены из неклассических источников, таких как протеолиз или гидролиз таких белков, как -неоэрдорпина. В дополнение, пептиды с опиатной активностью могут быть получены из неклассических источников, таких как протеолиз или гидролиз таких белков, как  – или – или  -казеин, клейковина пшеницы, лактальбумин, цитохромы или гемоглобин или из других источников, таких как кожа лягушки (дерморфины) или коровье адренальное мозговое вещество. Подобные пептиды назывались термином “экзорфины” в противоположность классическим эндорфинам; их также называют атипичными опиатными пептидами (Zioudrou et al.; JBC 254:2446-9, 1979; Quirion and Weiss, Peptides 4:445, 1983; Loukas et at., Biochem. 22:4567, 1983; Brantl, Eur. J. Pharm. 106:213-14, 1984; Brantl et al., Eur. J. Pharm. 111:293-4, 1985; Branti et al., Eur Pharm. 125:309-10, 1986; Brantl and Neubert, TIPS 7:6, 1986; Glamsta et al., BBRC 184:1060-6, 1992; Teschemacher, Handbook Exp.Pharm. 104:499-28, 1993; Petrov et al., Bioscience Reports 15:1-14, 1995; Karelin et al., Peptides 16:693-7, 1995). Было показано, что другие эндогенные пептиды, такие как семейство Tyr-MIF-1, также имеют опиатную активность (Reed et al., Neurosci. and Biobehav. Rev. 18:519-25, 1994). -казеин, клейковина пшеницы, лактальбумин, цитохромы или гемоглобин или из других источников, таких как кожа лягушки (дерморфины) или коровье адренальное мозговое вещество. Подобные пептиды назывались термином “экзорфины” в противоположность классическим эндорфинам; их также называют атипичными опиатными пептидами (Zioudrou et al.; JBC 254:2446-9, 1979; Quirion and Weiss, Peptides 4:445, 1983; Loukas et at., Biochem. 22:4567, 1983; Brantl, Eur. J. Pharm. 106:213-14, 1984; Brantl et al., Eur. J. Pharm. 111:293-4, 1985; Branti et al., Eur Pharm. 125:309-10, 1986; Brantl and Neubert, TIPS 7:6, 1986; Glamsta et al., BBRC 184:1060-6, 1992; Teschemacher, Handbook Exp.Pharm. 104:499-28, 1993; Petrov et al., Bioscience Reports 15:1-14, 1995; Karelin et al., Peptides 16:693-7, 1995). Было показано, что другие эндогенные пептиды, такие как семейство Tyr-MIF-1, также имеют опиатную активность (Reed et al., Neurosci. and Biobehav. Rev. 18:519-25, 1994).
Опиаты выполняют свои действия путем связывания трех основных фармакологических классов эндогенных опиатных рецепторов: мю-, дельта- и каппа-. Рецепторы, представляющие каждый фармакологический класс, клонировались и были показаны как связанные гуанином (G) рецепторы, соединенные с Gi (описано в Reisine and Bell, TINS 16: 506-510, 1993; Uhl et al., TINS 17:89-93, 1994; Knall et al., FASEB J. 9:516-525, 1995; Satoh and Minami, Pharm. Ther. 68:343-64, 1995; Kieffer, Cell. Mol. Neurobiol. 15:615-635, 1995; Reisine, Neuropharm. 34:463-472, 1995; Zaki et al., Ann. Rev. Pharm. Toxicol., 36:379-401, 1996).
Для каждого рецептора имеются специфические агонисты и антагонисты, например, для мю-рецепторов (которые селективно активируются DAMGO и DALDA и селективно подавляются СТОР и налоксоназином), для каппа-рецепторов (которые селективно активируются GR 89696 фурмаратом или U-69593 и селективно подавляются нор-биналтофимин гидрохлоридом) и для дельта-рецепторов (которые селективно активируются DADLE и DPDPE и селективно подавляются натриндолом). В дополнение, существуют антагонисты (такие как налоксон) и агонисты (такие как эторпин) широкого спектра, которые действуют на все три подтипа рецепторов.
Как классические, так и атипичные опиатные пептиды могут быть химически видоизменены или дериватизированы для того, чтобы изменить их специфические свойства связывания опиатных рецепторов (рассмотрено в Hruby and Gehrig, Med. Res. Rev. 9:343-401, 1989; Schiller, Prog. Med. Chem. 28:301-40, 1991; Teschemacher, Handbook Exp.Pharm. 104:499-28, 1993; Handbook of Experimental Pharmacology, A. Hertz (Ed), тома 104/1 и 104/11, 1993, Springer Verlag, Berlin; Karelin et al., Peptides 16:693-7, 1995). Примеры включают производные дерморфина (например, DALDA) и энкефалинов (например, DADLE, DAMGO или DAMME). Могут также быть получены пептиды, которые обычно не связываются с опиатными рецепторами, такие как соматостатин, со специфическим свойством связывания опиатных рецепторов (например, СТОР (Hawkins et al., J. Pharm. Exp. Ther. 248:73, 1989)). Аналоги могут также быть выведены из алкалоидов, таких как морфин с измененными свойствами связывания рецепторов (например, героин, кодеин, гидроморфон, оксиморфон, леворфанол, леваллорфан, кодеин, гидрокодон, оксикодон, налорфин, налоксон, налтрексон, бупренорфин, бутанорфанол и налбуфин); в дополнение к этому, небольшие молекулы, структурально не связанные с морфином, могут также действовать на опиатные рецепторы (например, меперидин и представители его же рода – альфа-продин, дипеноксилат и фентанил) (см. Руководство по экспериментальной фармакологии, цитируемая работа; Goodman and Oilman The Pharmacological Basis of Therapeutics, 7th Ed., A.G. Gilman, T.W. Rail and F. Murad (Eds), 1985 Macmillan Publishing Co. Нью Йорк).
Эндогенные опиатные пептиды (энкефалины, эндорфины и динорфины) имеют сохраненный N-терминальный тетрапептид Tyr-Gly-Gly-Phe, за которым следует Leu или Met и любая оставшаяся С-терминальная последовательность. Удаление гидроксильной группы на N-терминальном Tyr (что дает N-терминальное Phe) приводит к сильной потере активности для Met-энкефалина. Эти структурные данные привели к гипотезе “сообщение-адрес”, по которой N-терминальное “сообщение” вызывает биологическую активность, в то время как С-терминальный “адрес” придает специфичность и усиливает активность (Chavkin and Goildstein, PNAS 78:6543-7, 1981). Экзорфины обычно имеют Tyr-Pro, заменяющий N-терминальный Tyr-Gly классических опиатных пептидов; считается, что остаток пролина придает большую стабильность против деградации аминопептидазы (Shipp et al., PNAS 86:287, 1989; Glasma et al., BBRC 184:1060-6, 1992).
Недавно был клонирован рецептор орфан (“ORL1”) в связи со связью последовательности с опиатными рецепторами мю-, дельта- и каппа- (Mollereau et al., FEBS 341:33-38, 1994, Fukuda et al., FEBS 343:42-46, 1994; Bunzow et al., FEBS 347:284-8, 1994; Chen et al., FEBS 347:279-83, 1994; Wang et al., FEBS 348:75-79; Keith et al., Reg. Peptides 54 143-4, 1994; Wick et al., Mol. Brain Res. 27:37-44, 1994; Halford et al., J. Neuroimmun. 59:91-101, 1995). Лиганд для данного рецептора, называемый по-разному, ноцисептин или орфанин FQ (далее называемый ноцисептин), был клонирован и оказался гептадекапептидом, который выводится из более крупного предшественника (Meunier et al., Nature, 377:532-535, 1995; Reinscheid et al., Science 270:792-794, 1995). Было продемонстрировано, что он обладает проноцисептическими, гиперанальгезирующими функциями in vivo, в противоположность классическим опиатам, имеющим анальгезирующие свойства. Ноцисептин имеет в основе N-терминальный Phe-Gly-Gly-Phe… в отличие от N-терминальной основы Tyr-Gly-Gly-Phe… классических опиатных пептидов, рассмотренных выше. Соблюдая требование о наличие N-терминального Tyr для деятельности опиатов в классических опиатных пептидах, ноцисептин проявляет низкую аффинность или отсутствие аффинности к опиатным рецепторам мю-, каппа- или дельта-. Подобным же образом нолаксон, антагонист опиата широкого спектра, не имеет заметной аффинности к ORL1.
Наблюдалось, что энкефалины не влияют на мышиную кроветворную деятельность in vivo при условиях иммобилизационной нагрузки (Goldberg et al., Folia Biol. (Praha) 36:319-331, 1990). Лей-энкефалин ингибировал, а мет-энкефалин стимулировал кроветворную деятельность костного мозга. Эти воздействия были косвенными, и, как полгал Голдберг и др., вызывались воздействиям на глюкокортикоидных уровнях и миграцией Т-лимфоцита. Кризанаг-Бенгез и др. (Biomed. & Pharmacother, 46:367-43, 1992; Biomed. & Pharmacother. 49:27-31, 1995; Biomed. & Pharmacother, 50:85-91, 1996) рассмотрели воздействия этих соединений in vitro. Предварительная обработка костного мозга мышей мет- или лей-энкефалином или нолаксоном влияла на количество гранулоцитарно-макрофагальных предшественников, наблюдаемых при анализе колонии. Этот эффект был чрезвычайно переменным и приводил к подавлению, стимулированию или отсутствию влияния; далее, не было четкой реакции на дозу. Эта переменчивость относилась Кризанак-Бенгез и др. на счет циркадных ритмов и А-клеток.
Недавно было продемонстрировано, что у мышей, у которых опиатный рецептор мю был делецирован гомологической рекомбинацией, увеличивалось число КОЕ-ГМ, БОЕэ и КОЕ-ГЭММ на бедренной кости. У этих мышей с делецированным мю рецептором клетки-предшественники костного мозга и селезенки более быстро проходили цикл по сравнению с обычными мышами. Не было определено, было ли это воздействие вызвано прямым или косвенным влиянием на стволовые клетки костного мозга, возникающим вследствие отсутствия мю рецептора у этих животных (Broxmeyer et al., Blood 88:338a, 1997).
I. Химиотерапия и лучевая терапия рака.
Продуктивное исследование стимулирующих факторов роста привело к клиническому использованию ряда из этих факторов (эритропоэтина, гранулоцитарного колониестимулирующего фактора (G-CSF), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) и т.д.)). Эти факторы снизили смертность и заболеваемость, связанные с лечением химиотерапией и облучением. Дальнейшие клинические преимущества для пациентов, проходящих химиотерапию или облучение, могут быть обеспечены альтернативной стратегией блокировки поступления стволовых клеток в клеточный цикл, тем самым защищая их от токсических побочных эффектов. Реверсирование данной защиты позволит быстро восстановить функцию костного мозга после химиотерапии или лучевой терапии.
II. Трансплантация костного мозга и стволовой клетки, размножение стволовой клетки ex vivo и очистка опухоли.
Трансплантация костного мозга (ВМТ) является полезным лечением для разнообразных гематологических, аутоиммунных и злокачественных заболеваний. Используемая в настоящее время терапия включает кроветворные клетки, полученные из крови пуповины, эмбриональной печени или из периферийной крови (немобилизованные, либо мобилизованные такими средствами, как гранулоцитарный колониестимулирующий фактор или циклофосфоамид), а также из костного мозга; стволовые клетки могут быть неочищенными, частично очищенными (например, аффинитетная очистка популяции CD34+) или интенсивно очищенными (например, путем флуоресцентного активированного сортирования клеток с использованием таких маркеров, как CD34, CD38 или родамин). Манипулирование кроветворными клетками ex vivo в настоящее время используется для расширения примитивных стволовых клеток в популяцию, пригодную для трансплантации. Оптимизация этой процедуры требует: (1) достаточного числа стволовых клеток, способных поддерживать долгосрочное восстановление кроветворения; (2) истощения трансплантанта по отношению к исходным индуцирующим Т-лимфоцитам и (3) отсутствия остаточных злокачественных клеток. Эта процедура может быть оптимизована путем включения ингибитора(ов) стволовой клетки и/или стимулятора(ов) стволовой клетки.
Эффективность очистки кроветворных клеток цитотоксическими лекарственными средствами для удаления остаточных злокачественных клеток ограничена из-за токсичности этих соединений для здоровых кроветворных клеток и в особенности стволовых клеток. Существует необходимость эффективной защиты здоровых клеток во время очистки; защита может быть выполнена путем выведения стволовых клеток из цикла с помощью эффективного ингибитора.
III. Сбор периферийных стволовых клеток.
По сравнению с костным мозгом стволовые клетки периферийной крови (PBSC) предоставляют ряд потенциальных преимуществ для аутотрансплантации. У пациентов, не имеющих приемлемых участков для сбора мозгового вещества в связи с опухолью или предшествовавшей лучевой терапией, все равно можно производить сборы PBSC. Использование стволовых клеток крови устраняет необходимость общей анестезии и хирургической процедуры для пациентов, которые не хорошо переносят это. Технология аферезиса, необходимая для сбора стволовых клеток, является эффективной и широко распространена в большинстве крупных медицинских центров. Главными ограничениями метода являются низкая повторяемость нормального стационарного состояния стволовых клеток в периферийной крови и интенсификация прохождения цикла после процедур мобилизации лекарствами или факторами роста (например, циклофосфамидом, гранулоцитарным колониестимулирующим фактором, фактором стволовой клетки). Эффективный ингибитор стволовой клетки будет необходим для возвращения подобных клеток в спокойное состояние, тем самым предотвращая их потерю путем дифференциации.
IV. Лечение гиперпролиферативных нарушений.
Ряд заболеваний характеризуются гиперпролиферативным состоянием, при котором разрегулированные стволовые клетки приводят к перепроизводству клеток на терминальной стадии дифференцировки. Подобные болезненные состояния включают псориаз, но не ограничиваются им, при котором существует перепроизводство клеток эпидермы, предзлокачественные состояния желудочно-кишечного тракта, характеризующиеся появлением кишечных полипов, и приобретенный синдром иммунодефицита (СПИД), при котором ранние стволовые клетки не инфиируются ВИЧ инфекцией, а осуществляют быстрое прохождение цикла, что приводит к истощению стволовой клетки. Ингибитор стволовой клетки был бы полезен при лечении подобных состояний.
V. Лечение гипопролиферативных нарушений.
Ряд заболеваний характеризуется гипопролиферативным состоянием, при котором разрегулированные стволовые клетки вызывают недопроизводство клеток на терминальной стадии дифференцировки. Подобные болезни включают миелодиспластический синдром или апластическую анемию, при которой существует недопроизводство клеток крови, а также состояния, связанные со старением, при которых существует дефицит регенерации клеток и их замены. Стимулятор стволовой клетки будет полезен при лечении подобных состояний.
VI. Пересадка генов.
Способность переносить генетическую информацию в кроветворные клетки используется в настоящее время в клинических условиях. Кроветворные клетки являются полезной мишенью для генной терапии из-за легкости доступа, обширного опыта манипулирования и лечения этой ткани ex vivo и из-за способности кровяных клеток проходить сквозь ткани. Более того, корректировка некоторых генетических дефектов человека может быть возможна путем введения функционального гена в примитивные стволовые клетки кроветворной системы человека.
Существует несколько ограничений введения генов в кроветворные клетки человека при использовании либо ретровирусных векторов, либо физических приемов пересадки гена: (1) низкая частота стволовых клеток в кроветворных тканях приводит к необходимости разработки высокоэффективных приемов пересадки генов и (2) более быстро циклирующие стволовые клетки оказались более подверженными векторной инфекции, но увеличение частоты встречаемости инфекции путем стимуляции пролиферации стволовой клетки факторами роста оказывает отрицательное воздействие на долгосрочную экспрессию гена, потому что клетки, содержащие данные трансгены, вынуждаются к необратимой дифференциации и теряют свое самовозобновление. Эти проблемы могут быть смягчены путем использования ингибитора стволовой клетки для предотвращения дифференциации и потери самовозобновления и стимулятора стволовой клетки для регулирования вхождения стволовых клеток в цикл, тем самым облегчая пересадку гена с ретровирусным посредником.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям, включающим пептиды и полипептиды, которые являются ингибиторами и/или стимуляторами пролиферации стволовой клетки (соединения INPROL и опиатные соединения) и их использованию.
Настоящее изобретение включает ингибитор пролиферации стволовой клетки, характеризующийся следующими свойствами:
a) удельной активностью (IC50), меньшей или равной 20 нг/мл при анализе колониеобразующей единицы селезенки мыши (КОЕ-С) (см. Пример 4),
b) молекулярным весом, большим 10000 Дальтон и меньшим чем 100000 Дальтон (по ультрафильтрации),
c) активностью, чувствительной к деградации трипзином,
d) большей гидрофобностью, чем MIP-1 или TGF или TGF и отделимостью от того и другого путем обращенно-фазовой хроматографии (см. Пример 12), и отделимостью от того и другого путем обращенно-фазовой хроматографии (см. Пример 12),
е) биологической активностью, сохраняющейся после нагревания в течение одного часа при 37°С, 55°С или 75°С в водном растворе, и
f) биологической активностью, сохраняющейся после осаждения 1% хлористоводородной кислотой в ацетоне.
Настоящее изобретение далее характеризуется и отличается от других кандидатов в ингибиторы стволовой клетки (например, MIP-1 , TGF , TGF и различных олигопептидов) своей способностью достигать ингибирования в анализе in vitro после короткого прединкубационного периода (см. Пример 5). и различных олигопептидов) своей способностью достигать ингибирования в анализе in vitro после короткого прединкубационного периода (см. Пример 5).
Настоящее изобретение также включает фармацевтические средства, содержащие INPROL для лечения различных нарушений.
Настоящее изобретение обеспечивает метод лечения субъекта, ожидающего воздействия агентом, способным убивать или повреждать стволовые клетки, путем введения данному субъекту количества состава, эффективного для ингибирования стволовой клетки. Стволовая клетка, защищенная данным методом, может быть обычной кроветворной стволовой клеткой, присутствующей и делящейся в костном мозге, пуповинной клетке, фетальной печени или мобилизованной в циркуляцию периферийной крови. В то время как большинство мобилизованных стволовых клеток находится в состоянии покоя при анализе активированным флуоресцентным классификатором (FACS), мультипотентные стволовые клетки демонстрируют прохождение цикла развития и могут быть ингибированы INPROL в количествах, необходимых для ингибирования стволовой клетки. Альтернативно, стволовые клетки могут быть эпителиальными, расположенными, например, в кишечнике или в волосистой части кожи головы или в других областях тела, или зародышевыми клетками, расположенными в репродуктивных органах. Метод данного изобретения может подходить для использования на людях, хотя в данный метод также включено лечение животных. При использовании в данном документе термины “субъект” или “пациент” относятся к животному, подобному млекопитающим, включая человека.
Настоящее изобретение также обеспечивает метод лечения субъекта с гипопролиферирующими стволовыми клетками путем введения данному субъекту количества состава, эффективного для стимуляции стволовой клетки. Стволовые клетки, стимулируемые данным методом, могут быть кроветворными стволовыми клетками, обычно присутствующими в костном мозге, пуповинной крови, фетальной печени или мобилизованными в циркуляцию периферийной крови; подобные стволовые клетки могли быть ранее переведены в состояние покоя путем использования INPROL в количествах, необходимых для ингибирования стволовой клетки. INPROL в количествах, вызывающих стимулирующее действие на стволовые клетки, позволит при желании стимулировать циклирование стволовой клетки, например, после сбора стволовых клеток для использования во время размножения ех vivo или in vivo после трансплантации стволовой клетки и приживления. Альтернативно, стволовые клетки могут быть эпителиальными, расположенными, например, в кишечнике или в волосистой части кожи головы или в других областях тела, или зародышевыми клетками, расположенными в репродуктивных органах.
В другом аспекте изобретение предоставляет метод защиты и восстановления кроветворной, иммунной или других систем стволовых клеток у пациентов, проходящих химиотерапию, что включает прием пациентом количества INPROL, эффективного для ингибирования стволовой клетки, и/или для стимулирования восстановления после химиотерапии или облучения путем введения INPROL в количествах, эффективных для стимулирования стволовой клетки.
В еще одном дальнейшем аспекте настоящее изобретение включает метод вспомогательного лечения любого вида рака, включая вид, характеризующийся твердыми опухолями (например, опухолями груди, толстой кишки, легких, тестикулярными, овариальными, печени, почек, поджелудочной железы, мозга, саркомы), путем приема пациентом, имеющим рак, количества INPROL, эффективного для ингибирования стволовых клеток, для защиты стволовых клеток костного мозга, желудочно-кишечного тракта или других органов от токсического воздействия химиотерапии или лучевой терапии и/или для стимулирования восстановления после химиотерапии или лучевой терапии путем приема INPROL в количествах, стимулирующих стволовую клетку.
Еще один аспект настоящего изобретения относится к лечению лейкоза (например, хронического миелопоэзного лейкоза, острого миелогенного лейкоза, хронического лимфоцитного лейкоза, острого лимфоцитного лейкоза, миеломной болезни, болезни Ходжкинса) и включает лечение кроветворных клеток с пролиферирующими клетками лейкоза количествами INPROL, эффективными для ингибирования пролиферации здоровых стволовых клеток, и лечение костного мозга цитотоксическим средством для разрушения клеток лейкоза. Этот метод может быть усилен последующим лечением костного мозга другими средствами, которые стимулируют его развитие, например факторами, стимулирующими колонии, и/или INPROL в количествах, стимулирующих стволовые клетки. В одном примере осуществления изобретения этот метод выполняется in vivo. Альтернативно, данный метод может также использоваться для чистки ex vitro и размножения кроветворных клеток для трансплантации.
В еще одном дальнейшем аспекте метод включает лечение субъекта, имеющего нарушения, вызванные пролиферацией стволовых клеток. Подобные нарушения, такие как псориаз, миелодисплазия, некоторые аутоиммунные болезни, подавление иммунитета при старении, миелодиспластический синдром, апластическая анемия или истощение стволовых клеток при СПИД, лечатся приемом субъектом количества INPROL, эффективного для ингибирования или для стимулирования пролиферации имеющейся в виду стволовой клетки.
Настоящее изобретение обеспечивает метод реверсивной защиты стволовых клеток от повреждения цитотоксическим агентом, способным убивать или повреждать стволовые клетки. Метод включает прием субъектом, ожидающим воздействия подобного агента, количества INPROL, эффективного для ингибирования стволовых клеток.
Настоящее изобретение также обеспечивает метод реверсивного стимулирования пролиферации стволовых клеток во время фазы восстановления после химиотерапии или облучения. Метод включает прием субъектом, ожидающим воздействия подобным агентом, количества INPROL, эффективного для стимуляции стволовых клеток.
Настоящее изобретение также обеспечивает:
Ингибитор пролиферации стволовой клетки, выделенный из свиного или другого костного мозга следующей процедурой (см. Пример 12):
a) экстрагирование спинного мозга и удаление корпускулярного вещества путем фильтрации,
b) тепловая обработка при 56°С в течение 40 минут с последующим охлаждением в ледяной ванне,
c) удаление преципитата путем центрифугирования при 10000 g в течение 30 минут при 4°С,
d) кислотное осаждение путем добавления супернатанта к 10 объемам перемешиваемого охлажденного ацетона, содержащего 1% по объему концентрированной гидрохлорной кислоты, и инкубация при 4°С в течение 16 часов,
е) изоляция преципитата путем центрифугирования при 20000 g в течение 30 минут при 4°С и промывка холодным ацетоном с последующей сушкой,
f) изолирование с помощью обращенно-фазовой хроматографии и контролирование активности путем ингибирования формирования колонии клетками костного мозга, предварительно обработанными 5-фторурацилом и инкубированными в присутствии мышиного IL-3, а также путем абсорбции при 280 нм и с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE).
Данное изобретение также обеспечивает:
Метод для практически полной очистки ингибитора пролиферации стволовой клетки от других белковых веществ, входящих в предшествующие этапы, как это более детально описано ниже.
Настоящее изобретение также обеспечивает:
Метод лечения для людей или животных, отличающийся тем, что ингибитор пролиферации стволовой клетки функционирует для уменьшения иммунного подавления, вызванного гиперпролиферацией стволовой клетки.
Настоящее изобретение также обеспечивает:
Метод лечения для людей или животных, отличающийся тем, что INPROL в количествах, стимулирующих стволовую клетку, ослабляет подавление стволовой клетки, вызванное гипопролиферацей стволовой клетки.
Настоящее изобретение также обеспечивает:
Метод лечения для людей или животных, отличающийся тем, что ингибитор пролиферации стволовой клетки вводится после того, как вызывается пролиферация стволовой клетки путем воздействия цитотоксических лекарств или процедуры облучения. Стволовые клетки обычно находятся в состоянии покоя, но стимулируются на вхождение в клеточный цикл после химиотерапии. Это делает их более чувствительными при втором приеме химиотерапии; настоящий метод предохраняет их от данного лечения.
Настоящее изобретение также обеспечивает:
Метод лечения для людей или животных, отличающийся тем, что стимулятор пролиферации стволовой клетки (например, INPROL, в количествах, стимулирующих стволовую клетку) вводится до или после приема INPROL в количествах, ингибирующих стволовую клетку, чтобы способствовать регенерации костного мозга.
Количества INPROL, оказывающие ингибирующее воздействие, замедляют скорость, при которой стволовые клетки проходят клеточный цикл и защищают от химиотерапии или облучения; стимулирующие количества INPROL для стволовых клеток реверсируют данное ингибирование и способствуют восстановлению костного мозга. И наоборот, количества INPROL, стимулирующие стволовую клетку, могут способствовать восстановлению костного мозга, в то время как ингибирующие количества для стволовой клетки используются впоследствии для возвращения стволовых клеток в состояние покоя после достижения восстановления костного мозга.
Настоящее изобретение также обеспечивает:
Метод лечения для людей или животных, отличающийся тем, что вышеупомянутый ингибитор пролиферации стволовой клетки принимается в качестве адъюванта до или вместе с вакцинацией с целью увеличения иммунной реакции.
Настоящее изобретение также обеспечивает:
Метод лечения иммунодефицита у млекопитающих, включающий прием вышеупомянутыми млекопитающими иммуностимулирующего количества INPROL.
Настоящее изобретение также обеспечивает:
Метод лечения боли у млекопитающих, включающий прием вышеупомянутыми млекопитающими количества INPROL, оказывающего анальгезирующее действие.
Настоящее изобретение также обеспечивает:
Метод лечения для людей или животных, принимающих цитотоксические лекарства или проходящих лечение облучением, который включает прием количества ингибитора пролиферации стволовой клетки, эффективного для защиты стволовых клеток от повреждения.
Настоящее изобретение также обеспечивает:
Метод лечения для людей или животных, принимающих цитотоксические лекарства или проходящих лечение облучением, который включает прием эффективного для стимуляции стволовой клетки количества INPROL для усиления восстановления после лечения.
Изобретение также включает фармацевтический состав, включающий гемоглобин и фармацевтически приемлемый носитель.
Изобретение также включает фармацевтический состав, включающий (а) полипептид, выбранный из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, цепочки эпсилон- гемоглобина и зета-цепочки гемоглобина, полипептид, включающий аминокислоты 1-97 альфа-цепочки гемоглобина человека (“пептид 1-97”) и полипептид, включающий аминокислоты 1-94 альфа-цепочки гемоглобина человека (“пептид 1-94”), и (б) фармацевтически приемлемый носитель. Подобные фармацевтические составы могут состоять из отдельного полипептида, выбранного из вышеупомянутой группы, смеси полипептидов, выбранных из вышеупомянутой группы, или полипептидов из вышеупомянутой группы в форме димеров или мультимеров, с или без гема.
Изобретение также включает пептиды, имеющие последовательности:
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val (“Пептид 43-55”),
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys,
где два остатка Cys формируют дисульфидную связь (“Циклический пептид 43-55”),
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys,
где два остатка Cys соединены углеродным мостиком,
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala
(“Пептид 64-82”) и
пептид, включающий первые 97 N-терминальных аминокислот альфа-гемоглобина человека, как на фиг.16А.
Также включены в изобретение последовательности белков и пептидов, состоящие из модифицированных версий альфа-цепочки человека, которые сохраняют ингибирующие и/или стимулирующие свойства. Подобные модификации включают удаление или модификацию С-терминального гидрофобного участка (приводящего к улучшению характеристик растворимости) и/или удаление или модификацию области связывания гаптоглобина (приводящему к улучшению фармокинетических свойств), но не ограничиваются ими. С-терминальный гидрофобный участок в альфа-гемоглобине человека включает область от аминокислот 98 (фенилаланил) до 141 (аргинин) и содержит 23 гидрофобные аминокислоты из общего количества в 44. Весь участок или одна или более из данных гидрофобных аминокислот (6 аланинов, 4 валина, 8 лейцинов, 2 пролина и 3 фенилаланина) могут быть удалены делецией (“делецированная” С-терминальная гидрофобная область). Альтернативно, одна или более из этих аминокислот может быть замещена неполярной аминокислотой (например, глицин, серин, треонин, цистин, тирозин, аспарагин или глютамин) (“замещенная” С-терминальная гидрофобная область).
В другом примере осуществления изобретения используются химические модификации, такие как карбоксиметилация, которые уменьшают гидрофобный характер этого участка и увеличивают растворимость.
В другом примере осуществления изобретения гидрофобные осадки замещаются соответствующими гидрофильными участками в последовательности бета-гемоглобина человека. Например, в последовательности бета-гемоглобина человека участок между аминокислотами 107 (глицин) по 117 (гистидин) или участок между аминокислотами 130 (тирозин) по 139 (аспарагин) являются относительно гидрофильными и каждый или оба могут быть замещены эквивалентными гидрофобными участками в альфа-гемоглобине человека.
Область связи гаптоглобина содержится в С-терминальном гидрофобном участке и состоит из аминокислот 121-127. Этот участок может быть удален весь полностью или может быть удалена делецией одна или более аминокислот в данном участке (“делецированная” С-терминальная область связи гаптоглобина). Этот участок или одна или более аминокислот в данном участке могут быть замещены на другие аминокислоты, такие как, например, полиаланин или полиглицин или другие аминокислоты, которые влияют на устранение связи пептида и гаптоглобина, но сохраняют ингибиторующую стволовую клетку активность (“замещенная” С-терминальная область связи гаптоглобина).
Другие примеры осуществления данного изобретения включают соответствующие модификации цепочки бета-гемоглобина (либо в С-терминальном гидрофобном участке и/или в одной или более областей связи гаптоглобина (аминокислоты 11-25 и 136-146)) и соответствующие модификации цепочек гемоглобина дельта-, гамма-, эпсилон- и/или зета-.
Также включены в изобретение последовательности ДНК, кодирующие идентифицированные выше пептиды, векторы, содержащие вышеуказанные ДНК, и клетки-хозяева, содержащие эти векторы. Эти пептиды могут быть синтезированы использованием стандартных химических методов (например, синтез твердой фазы) или путем использования методов рекомбинации (включая системы слияния, такие как использующие глютотианин-S-трансферазу (D.B. Smith and K.S. Johnson, Gene 67:31-40, 1988), тиредоксин (La Vallie et al., Biotechnology 11: 187-193, 1993) или убихитин (Butt et al., PNAS 86:2540-4, 1989; Cherney et al., Biochem. 30: 10420-7, 1991; Baker et al., JBC 269:25381-6, 1994; патенты США 5132213; 5196321 и 5391490 и PCT WO 91/17245). Каждая из этих статей, заявок или патентов включена здесь в виде ссылки.
Дополнительно изобретение включает метод ингибирования или стимулирования пролиферации стволовой клетки, включающий вхождение в контакт с кроветворными клетками с помощью соединения, способного связывать опиатные рецепторы, преимущественно опиатные рецепторы подкласса мю. Дополнительно изобретение включает метод ингибирования или стимулирования пролиферации стволовой клетки, включающий вхождение в контакт с кроветворными клетками с помощью соединения, способного связывать рецепторы ноцисептина (например, ORL1). Далее изобретение включает метод ингибирования или стимулирования пролиферации стволовой клетки, включающий вхождение в контакт с кроветворными клетками с помощью соединения, способного связывать опиатоподобные рецепторы.
Пептиды (называемые “геморфины”) были выделены из гемоглобина, который проявляет опиатную активность (например, Brantl et al., Eur. J. Pharm, 125:309-10, 1986; Davis et al., Peptides 10:747-51, 1989; Hoffman et al., PNAS 87:8521-25, 1990; Hernan et al., Biochem. 31: 8619-28, 1992; Karelin et al., Bioch. Biophys. Res. Comm, 202:410-5, 1994; Zhao et al., Ann. N.Y. Acad. Science 750:452-8. 1995; Petrov et al., Bioscience Reports, 15; 1-14, 1995; Karelin et al., Peptides 16:693-697, 1995). Каждая из этих статей включена здесь в виде ссылок. Также существуют другие атипичные опиатные пептиды и небольшие молекулы (Zioudrou et al., JBC 254:2446-9, 1979; Quirion and Weiss, Peptides 4: 445, 1983; Loukas et al., Biochem. 22:45-67, 1983; Brantl, Eur. J. Pharm. 106:213-14, 1984; Brantl et al., Eur. J. Pharm 111:293-4, 1985; Brantl and Neubert, TIPS 7:6-7, 1986; Hruby and Gehrig, Med. Res. Rev. 9:343-401, 1989; Schiller, Prog. Med. Chem. 28:301-40, 1991; Glamsta et al., BBRC 184:1060-6, 1992; Teschemacher, Handbook Exp. Pharm. 104:499-28, 1993; Handbook of Experimental Pharmacology, A. Hertz (Ed.), тома 104/1 и 104/11, 1993, Springer Verlag, Berlin; Reed et al., Neurosci. and Biobehav. Rev. 18: 519-25. 1994; Karelin et al., Peptides 16:693-7, 1995). Каждая из данных статей включена здесь в виде ссылок. При использовании в данном документе “опиатоподобные рецепторы” определены по их способности связывать опиаты, INPROL, геморфины, экзорфины, ноцисептин, члены семейства Tyr-MIF-1, алколоиды и/или другие соединения, которые либо ингибируют, либо стимулируют пролиферацию стволовой клетки способом, антагонизированным включением соответствующего количества налоксона (см. Примеры 29 и 38).
В дополнение изобретение включает метод идентификации рецептора(ов) и лигандов, включающий использование INPROL (преимущественных пептидных форм, таких как Пептид 1-94, 1-97, 43-55 или 64-82) при анализе связывающей способности рецептора. Далее изобретение включает метод идентификации рецептора(ов) и лигандов, включающих использование INPROL при анализе аденилат циклазы.
Дополнительно метод включает ингибирование или стимулирование пролиферации стволовой клетки, включающее вступление в контакт с кроветворными клетками с помощью соединения (например, мастопарана), способного активировать белки, связывающие GTP, преимущественно G ингибиторного подтипа.
Изобретение также включает метод ингибирования или стимулирования пролиферации стволовой клетки, включающий вступление в контакт с кроветворными клетками с помощью пептида, выбранного из группы геморфинных пептидов, имеющих следующую последовательность:
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-GIn,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-GIn,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-GIn и
Tyr-Pro-Trp-Thr.
Вышеупомянутые пептиды имеют сходную последовательность и/или биологическую активность, подобную другим атипичным опиатным пептидам, таким как пептиды семейства Tyr-MIF-1 (их рассмотрение см. в Reed et al., Neurosci. Biobehav. Rev. 18:519-25, 1994), производные от казеина казоморфины (Brant et al., Hoppe-Seyler’s Z. Physiol. Chem. 360:1211-16, 1979; Loukas et al., Biochem. 22:4567-4573, 1983; Fiat and Jolles, Mol. Cell. Biochim. 87:5-30, 1989), пептиды, производные от цитохрома, условные цитохрофины (BrantI et al., Eur. J. Pharm. 111: 293-4, 1985), различные экзорфины и опиатные пептиды от человеческих и не человеческих видов (Zioudrou et al., JBC 254:2446-9, 1979; BrantI, Eur. J. Pharm. 106:213-14, 1984; Brantle et al., Eur. J. Pharm 125:309-10, 1986; Brantl and Neubert, TIPS 7:6-7, 1986; Glamsta et al., BBRC 184:1060-6, 1992; Teschemacher, Handbook Exp.Pharm. 104:499-28, 1993; Karelin et al., Peptides 16:693-7, 1995), а также пептиды, полученные из комбинаторных библиотек, выделенных для связи опиатных рецепторов (см. обзор в Dooley et al., Peptide Research 8:124-137, 1995). Каждая из данных статей включена здесь в виде ссылки.
Изобретение также включает метод ингибирования или стимулирования пролиферации стволовой клетки, включающий вхождение в контакт с кроветворными клетками пептида, выбранного из группы, состоящей из относящихся к Tyr-MIF-1 пептидам, казоморфинам, цитохрофинам и экорфинам. Конкретно включаются пептиды Tyr-MIF-1, имеющие следующие последовательности:
Tyr-Pro-Try-Gly-NH2,
Tyr-Pro-Lys-Gly-NH2,
Tyr-Pro-Leu-Gly-NH2 и
Pro-Leu-Gly-NH2.
Изобретение также включает метод ингибирования или стимулирования пролиферации стволовой клетки, включающий вхождение в контакт с кроветворными клетками с помощью опиатного пептида, выбранного из группы, состоящей из
(D-Ala2, N-Me-Phe4, Gly-ol5)-Enkephalin (DAMGO),
(D-Arg2, Lys4)-Dermorhine-(1-4)amide (DALDA),
(Phe4)-Dermorphine(1-4)amide,
Ac-Arg-Phe-Met-Trp-Met-Arg-NH2,
Ac-Arg-Phe-Met-Trp-Met-Lys-NH2 и
H-Tyr-Gly-Gly-Phe-Met-Arg-Arg-Val-NH2.
Изобретение также включает метод ингибирования или стимулирования пролиферации стволовой клетки, включающий вхождение в контакт с кроветворными с помощью соединения-агониста к опиатам, выбранного из группы, состоящей из морфина, кодеина, метадона, героина, меперидина, альфапродина, дифеноксилата, фентанила, суфентанила, альфентанила, леворфанола, гидрокодона, дигидрокодеина, оксикодона, гидроморфона, пропоксифена, бупренорфина, эторфина, оксиморфона, декстопропоксифена и мептазинола. Особенно включается морфин в ингибирующих количествах, меньших чем 10-7 молярных.
Изобретение также включает метод ингибирования или стимулирования пролиферации стволовой клетки, включающий вхождение в контакт с кроветворными клетками с помощью соединения-агониста к опиатам или смешанного агониста/антагониста, выбранного из группы, состоящей из налоксона, налтрексона, налорфина, пентазоцина, налбуфина и буторфанола. Специально включается налоксон в ингибирующих количествах, меньших чем 10-8 молярных.
Изобретение также включает метод стимулирования пролиферации стволовой клетки, включающий вхождение в контакт с кроветворными клетками с помощью стимулирующего для стволовой клетки количества белка или пептида, выбранного из группы, включающей INPROL, миоглобин, DAMGO и DALDA.
Изобретение также включает метод проведения генной терапии у млекопитающего, включающий:
a) удаление кроветворных клеток у вышеуказанного млекопитающего,
b) обработку вышеуказанных кроветворных клеток ex vivo количеством IMPROL, оказывающим стимулирующее действие на стволовую клетку, и/или соединением опиатов,
c) трансфектирование или инфицирование вышеупомянутых кроветворных клеток заранее выбранным геном,
d) введение вышеуказанных кроветворных клеток в контакт ех vivo с ингибирующим количеством INPROL и/или соединения опиатов,
e) трансплантацию вышеуказанному млекопитающему кроветворных клеток по пункту d,
f) дополнительную обработку вышеуказанного млекопитающего in vivo ингибирующим или стимулирующим количеством INPROL и/или опиатным соединением.
Изобретение также включает метод проведения размножения стволовой клетки ех vivo, включающий обработку вышеупомянутых кроветворных клеток ингибирующим количеством INPROL и по крайней мере одним стимулирующим цитокином. INPROL контактирует с кроветворными клетками до, во время и/или после контакта со стимулирующим цитокином. Размножение стволовой клетки ех vivo позволяет производить достаточное количество стволовых клеток из ограниченных источников, таких как кровь пуповины, фетальная печень, аутологовый костный мозг после химиотерапии и т.д., или после очистки (например, путем флуоресцентной активированной сортировки с использованием таких маркеров как CD34, CD38 или родамин). Способность к селективному выращиванию определенных кроветворных последовательностей клеточных поколений также позволяет клиницисту конкретно проектировать трансплантанты стволовой клетки в соответствии с потребностями индивидуального пациента.
Изобретение также включает метод проведения размножения стволовой клетки ex vivo, включающий обработку вышеупомянутых кроветворных клеток стимулирующим количеством INPROL с или без добавления по крайней мере одного стимулирующего цитокина. INPROL вступает в контакт с кроветворными клетками до, во время и после контакта со стимулирующим цитокином(ами). Ех vivo стимулятор стволовой клетки обеспечит экспансию стволовых клеток и/или клеток-предшественников, в то время как ингибитор стволовой клетки будет поддерживать стволовые клетки в их недифференцированном состоянии. Процедура может быть также оптимизована путем использования INPROL в количествах, ингибирующих стволовую клетку in vivo для поддержания стволовых клеток в состоянии покоя до тех пор, пока они не привьются, после чего может использоваться INPROL в количествах, стимулирующих стволовую клетку для стимуляции регенерации костного мозга. Дополнительно кроветворные клетки могут быть разбиты на два препарата и один из них обрабатывается стимулирующими количествами INPROL, чтобы способствовать экспансии стволовых клеток и/или родоначальных клеток, в том время как другой препарат обрабатывается ингибиторными количествами INPROL для удержания стволовых клеток в их недифференцированном состоянии. Два препарата могут быть затем объединены и ведены пациенту.
Данное изобретение также включает фармацевтический состав, включающий (a) INPROL и (б) и по крайней мере одно ингибирующее соединение, выбранное из группы, состоящей из MIP-1 , TGF , TGF , TNF , TNF , INF , INF , INF , INF , INF , INF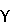 , пентапептид pyroGlu-Glu-Asp-Cys-Lys, тетрапептид N-acetil-Ser-Asp-Lys-Pro и трипептид глютатион (Gly-Cys- , пентапептид pyroGlu-Glu-Asp-Cys-Lys, тетрапептид N-acetil-Ser-Asp-Lys-Pro и трипептид глютатион (Gly-Cys-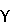 Glu). Glu).
Изобретение также включает фармацевтический состав, включающий (а) INPROL и (б) по крайней мере один стимулирующий цитокин, выбранный из группы, состоящей из IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-13, IL-14, IL-15, гранулоцитарного колониестимулирующего фактора (G-CSF), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), макрофагального колониестимулирующего фактора (M-CSF), эритропоэтина, тромбопоэтина, фактора стволовой клетки, дельта-подобного белка и лиганда flk2/flt3.
Настоящее изобретение описывает ингибитор стволовых клеток (INPROL), который отличается от ингибиторов, известных в данной области, таких как MIP-1 , TGF , TGF , тетрапептид Фринделя и коллег или пентапептид Пауковица и соавторов (сравни, Wright & Pragnell, 1992 (цитируемое произведение)). Естественно встречающийся природный INPROL имеет молекулярный вес, превышающий 10000 Дальтон при ультрафильтрации, что отличает его от тетрапептида, а также пентапептида. Он более гидрофобный, чем MIP-1 , тетрапептид Фринделя и коллег или пентапептид Пауковица и соавторов (сравни, Wright & Pragnell, 1992 (цитируемое произведение)). Естественно встречающийся природный INPROL имеет молекулярный вес, превышающий 10000 Дальтон при ультрафильтрации, что отличает его от тетрапептида, а также пентапептида. Он более гидрофобный, чем MIP-1 или TGF или TGF в обращенно-фазовых хроматографических системах, что отличает его от этих цитокинов. Далее, его способ действия отличается от действия любого из ранее описанных ингибиторов тем, что он активен в образце in vivo при использовании только во время прединкубационного периода. Например, MIP в обращенно-фазовых хроматографических системах, что отличает его от этих цитокинов. Далее, его способ действия отличается от действия любого из ранее описанных ингибиторов тем, что он активен в образце in vivo при использовании только во время прединкубационного периода. Например, MIP не эффективен при использовании только во время прединкубационного периода (Пример 5). Далее, естественно встречающийся INPROL активен в анализе, измеряющем “колониеобразующие клетки с высоким пролиферативным потенциалом”, в то время как MIP-1 не эффективен при использовании только во время прединкубационного периода (Пример 5). Далее, естественно встречающийся INPROL активен в анализе, измеряющем “колониеобразующие клетки с высоким пролиферативным потенциалом”, в то время как MIP-1 не активен (Пример 6). INPROL отличается от таких известных в данной области стимуляторов, как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), макрофагальный колониестимулирующий фактор (M-CSF), эритропоэтин, тромбопоэтин, фактор стволовой клетки и лиганд flk2/flt3. Естественно встречающийся INPROL имеет незначительное сходство или совсем не имеет сходства с последовательностью данных цитокинов. не активен (Пример 6). INPROL отличается от таких известных в данной области стимуляторов, как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), макрофагальный колониестимулирующий фактор (M-CSF), эритропоэтин, тромбопоэтин, фактор стволовой клетки и лиганд flk2/flt3. Естественно встречающийся INPROL имеет незначительное сходство или совсем не имеет сходства с последовательностью данных цитокинов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1-4 показан полиакриламидный гель додецилсульфата натрия, выходящий из продукта после каждой стадии очистки.
Фиг.1 – ряд 1 является химотрипсиногеном, ряд 2 является овальбумином, ряд 3 является BSA, ряд 4 является фракциями <30 kD, ряд 5 является фракциями 30-50 kD и ряд 6 является фракциями 50-100 kD.
Фиг.2 – ряд 1 представлен после осаждения сульфатом аммония (40-80%) и ряды 2-5 являются фракциями DEAE (ряд №2 представляет собой активную фракцию).
Фиг.3 – ряд 1 представляет собой супернатант после осаждения сульфатом аммония, ряд 2 является активной фракцией DEAE, ряды 3-5 представляют фракции фильтрации геля (ряд №5 представляет активную фракцию).
Фиг.4 – ряд 2 представляет конечный продукт.
На фиг.5 показана хроматограмма конечной очистки обращенно-фазовой жидкостной хроматографией высокого разрешения (ЖХВР).
На фиг.6 показано включение меченного тритием тимидина (cpm-клеток на миллион) в клетки линии FDCP-mix без (контроль = 0% ингибирования) и с различными количествами INPROLa, очищенного из свиного костного мозга (pINPROL). Данные нормализуются относительно контрольного значения.
На фиг.7 показан процент клеток в фазе S цикла клетки после лечения мыши тестостероном пропионатом (TSP), TSP плюс pINPROL или носителем (контроль). Каждая группа содержала 25 животных (3-4 на временную точку).
На фиг.8 показано выживание мышей после обработки двумя дозами 5-фторурацила, с или без лечения pINPROL. Каждая группа содержала 30 животных.
На фиг.9 показано выживание облученных мышей с и без лечения pINPROL. Каждая группа содержала 50 животных.
На фиг.10А и 10В показана регенерация клеток долгоживущей культуры костного мозга: 1 неделя (10А) и 3 недели (10В) после лечения Ara-С или Ara-С плюс pINPROL.
На фиг.11 показано выживание мышей (75 на группу) после летального облучения и трансплантации 3×104 клеток костного мозга после предварительной инкубации со средой (контрольной) или с pINPROL (25 нг/мл) в течение 4 часов. Выживание контролировалось в течение 30 дней.
На фиг.12 показано число гранулоцитарно-макрофагальных колониеобразующих единиц (КОЕ-ГМ) после 14 дней в культуре из клеток костного мозга мыши после летального облучения и восстановления донорскими клетками костного мозга, предварительно инкубированными с pINPROL или со средой в течение 4 часов.
На фиг.13 показаны клетки взвеси из лимфоидной долгоживущей культуры, которые забирались каждую неделю, вымывались и высеивались с IL-7 (10 нг/мл) после предварительной инкубации со средой или с pINPROL в течение 4 часов.
На фиг.14 показано улучшение способности к репопуляции лейкозных клеток периферийной крови, обработанных pINPROL. Клетки, инициирующие долгоживущую культуру (LTC-IC) измерялись посевом адгезивных или неадгезивных клеток LTC с или без pINPROL и подсчетом КОЕ-ГМ на седьмой день. Данные нормализуются по контрольным значениям.
На фиг.15А показана обращенно-фазовая хроматограмма С4 очищенного pINPROL, элюированного при 53% ацетонитрила. Ряд 1 является сырьевым материалом, Ряд 2 представляет собой маркеры молекулярного веса и Ряд 3 представляет собой очищенный материал. На фиг.15В показана обращенно-фазовая хроматограмма С4 для MIP-1 , элюированного при 49,9% ацетонитрила. На фиг.15С показана хроматограмма после электрофореза в полиакиламидном геле с додецилсульфатом натрия (SDS-PAGE) для сырого препарата pINPROL и чистого препарата после обратной фазы. , элюированного при 49,9% ацетонитрила. На фиг.15С показана хроматограмма после электрофореза в полиакиламидном геле с додецилсульфатом натрия (SDS-PAGE) для сырого препарата pINPROL и чистого препарата после обратной фазы.
На фиг.16 показаны последовательности гемоглобина: на фиг.16А показана кДНК и последовательности альфа-гемоглобина человека, а на фиг.16В показана кДНК и последовательность бета-гемоглобина человека. Нумерация производится в соответствии с аминокислотой. На фиг.16С показано сравнение последовательности аминокислоты цепочек альфа- и бета- для гемоглобина человека, мышиного и свиного гемоглобина.
На фиг.17 показаны следы pINPROL (фиг.17А) и кристаллизованного свиного гемоглобина (фиг.17В) в обращенно-фазовой жидкостной хроматографии (ЖХВР) С4.
На фиг.18 показаны фракции геля, полученные при электрофорезе в полиакриламидном геле додецилсульфата натрия, после сепарации кристаллизованного гемоглобина свиньи обращенно-фазовой жидкостной хроматографией высокого разрешения (ЖХВР) С4. Ряд 1 показывает маркеры молекулярного веса, Ряд 2 показывает фракции 48-49, полученные от первого пика (при 47, 11 мин). Ряд 3 показывает фракции 50-51, выведенные из второго пика (при 49, 153 мин). Ряд 4 показывает фракции 54-55, выведенные из третьего пика (при 52, 25 мин) и Ряд 5 показывает фракции 56-57, выведенные из четвертого пика (при 53, 613 мин).
На фиг.19 показано сравнение 2-мерного электрофореза геля pINPROL (фиг.19А) и очищенного бета-гемоглобина свиньи (фиг.19В).
На фиг.20 показано сравнение влияния очищенного альфа-гемоглобина свиньи, бета-гемоглобина или pINPROL при анализе FDCP-MIX.
На фиг.21 показана обращенно-фазовая сепарация свиного гемоглобина с использованием пологого градиента эллюции.
На фиг.22А показана плазмида по Хочули и др. (1988); на фиг.22В показана плазмида по Лоэтшер и др. (1991); на фиг.22С показана плазмида pDSUb.
На фиг.23 показаны результаты обработки INPROL при анализе образования групп клеток.
Для того чтобы более полно понять описанное здесь изобретение, приводится последующее детальное описание. Данное описание, хотя и иллюстрирующее настоящее изобретение, не должно толковаться как конкретно ограничивающее изобретение, и те варианты, которые станут понятны имеющему опыт в данной области, должны рассматриваться как относящиеся к объему данного изобретения.
ДЕТАЛЬНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
INPROL обратимо ингибирует или стимулирует деление стволовых клеток. Не стремясь ограничиваться конкретной теорией, мы полагаем, что ингибиторы и стимуляторы стволовой клетки оказывают свое воздействие путем влияния на скорость, с которой стволовые клетки проходят через цикл клетки. INPROL особенно эффективен при временном ингибировании или стимулировании деления клеток кроветворных стволовых клеток, которые зависят от использованного количества. Способность клинически использовать соединение, которое может ингибировать или стимулировать пролиферацию стволовой клетки, позволяет точно контролировать циклирование кроветворных стволовых клеток, например, во время химиотерапии, трансплантации стволовой клетки или протокола генной терапии. Таким образом, метод данного изобретения может быть использован для ослабления нежелательных побочных эффектов химиотерапии на кроветворные, миелоидные и иммунные системы пациента путем защиты стволовых клеток от поражения, вызванного химиотерапевтическими средствами или облучением, используемыми для разрушения клеток, инфицированных раком или вирусом, или для стимуляции восстановления после подобного поражения. В одном примере осуществления изобретения INPROL вводится пациенту в дозе, достаточной для ингибирования деления стволовой клетки, во время действия на заболевшие клетки химиотерапевтического средства. После того как химиотерапевтическое средство выполнит свою функцию, ингибированные INPROL стволовые клетки без дальнейшего лечения возобновят деление клеток. Если желательно усилить восстановление кроветворной деятельности, могут дополнительно использоваться стимулирующие факторы роста, цитокины или такие количества INPROL, которые оказывают стимулирующее действие на стволовую клетку.
При использовании в данной работе термин INPROL включает белки млекопитающих и немлекопитающих, очищенные так, как в примерах, гемоглобин, альфа-цепочку гемоглобина (с или без группы гем), бета-цепочку гемоглобина (с или без группы гем), смеси альфа- и бета-цепочек (с или без группы гем) и фрагменты или аналоги этих белков, включая эмбрионные, фетальные или взрослые формы (например, альфа-, бета-, гамма-, дельта-, эпсилон- или зета-цепочки, либо отдельно, либо в виде смесей, димеры или мультимеры, с или без группы гем), имеющие способность ингибировать и/или стимулировать пролиферацию стволовой клетки. Термин “INPROL” включает как естественно встречающиеся, так и не встречающиеся в естественном виде (полученные рекомбинацией и/или синтезированием) формы этих белков. Термин “INPROL полипептид” относится к INPROL, состоящему из 40 или более аминокислот.
При использовании в данной работе термин “опиатные соединения” означает соединения, включающие опиаты, а не INPROL, которые связывают опиатные рецепторы (или рецепторы, последовательность которых имеет отношение к опиатным рецепторам, например, ORL1) и которые проявляют агонистическую, антагонистическую или агонистическо/антагонистическую активность. Например, существуют специфические агонисты и антагонисты для рецепторов мю- (которые селективно активируются DAMGO и DALDA и селективно противодействуются СТОР и налоксоназином), для рецепторов каппа- (которые селективно активируются GR 89696 фурмаратом или U-69593 и селективно противодействуются норбиналторфимин гидрохлоридом) и для дельта-рецепторов (которые селективно активируются DADLE и DPDPE и селективно противодействуются натриндолом). В дополнение к этому существуют антагонисты (такие как налоксон) и агонисты (такие как эторфин) широкого спектра, которые действуют на все три подтипа рецепторов. Ноцисептин конкретно подавляет рецептор ORL1. Опиатные соединения, стимулирующие и/или ингибирующие активность стволовых клеток, могут использоваться для каждого из описанных здесь применений для INPROL.
При использовании в данной работе “количество, необходимое для стимуляции стволовой клетки” является количеством, которое вызывает пролиферацию стволовых клеток. При использовании в данной работе “количество, необходимое для ингибирования стволовой клетки” является количеством, которое ингибирует пролиферацию стволовой клетки. Во всех случаях, как in vivo, так и ex vivo, выбранное количество будет зависеть от конкретно выбранного INPROL или опиатного соединения и конкретного условия или применения; в частности, равномолярные дозы полипептидов или фрагменты INPROL так же активны, как и равномолярные опиатные пептиды или небольшие молекулы.
В типичной клинической ситуации, когда желательно ингибирование стволовой клетки, INPROL ежедневно вводится пациенту путем внутривенной инъекции или инфузии в форме единицы дозы, используя, например, от 0,01 до 100 мг/кг; когда желательно ингибировать прохождение цикла развития стволовой клетки, вводится преимущественно от 0,1 до 1,0 мг/кг INPROL, например, за от 4 до 60 часов до стандартной химиотерапии или облучения.
В ситуациях, когда желательна стимуляция циклирования стволовой клетки, таких как для ускорения восстановления после химиотерапии или облучения, INPROL используется в количествах, вызывающих стимуляцию стволовой клетки. Подобные дозы обычно составляют 1-500 мг/кг, преимущественно 10 – 100 мг/кг.
В случаях, когда желательно использовать опиатное соединение(я) для ингибирования или стимулирования циклирования стволовой клетки, опиатное соединение(я) используются в концентрациях, равномолярных описанным для INPROL.
В другом примере осуществления изобретения предварительное лечение INPROL в количествах, ингибирующих стволовую клетку, позволяет увеличить дозы химиотерапевтических средств или дозы облучения по сравнению с дозами, обычно переносимыми пациентами. Подобным же образом, лечение INPROL после химиотерапии или после облучения в количествах, стимулирующих стволовую клетку, также позволяет увеличить обычно переносимые дозы химиотерапии или облучения.
Большая доля кроветворных стволовых клеток обычно находится в состоянии покоя (медленно циклирующие или нециклирующие). Однако в качестве компенсаторной реакции на вызванное химиотерапией поражение кроветворения большая часть стволовых клеток вступает в циклирование после химиотерапии, что делает их особенно подверженными влиянию последующих доз цитотоксической химиотерапии или лучевой терапии. Путем ингибирования подобных стволовых клеток лечение INPROL позволяет более раннее или более частое введение последующих доз цитотоксической химиотерапии либо в обычных, либо в повышенных дозах.
Некоторые здоровые индивидуумы имеют стволовые клетки, которые спонтанно переходят к быстрому прохождению кроветворного цикла; INPROL в количествах, ингибирующих стволовую клетку, полезен для подобных индивидуумов, даже если его дают до первой дозы облучения или химиотерапии.
В одном примере осуществления изобретения INPROL (от 0,1 до 6 гм/кг веса тела, преимущественно от 1,0 до 60 мг/кг) вводится от около 24 часов до 10 дней после первоначальной дозы химиотерапии. После еще от 4 до 60 часов, преимущественно от 24 до 48 часов, вводится другая доза химиотерапии. Этот цикл чередования химиотерапии и INPROL продолжается в зависимости от терапевтического результата. Химиотерапевтические средства и протоколы приема выбираются в стандартной клинической практике в зависимости от их приемлемости для определенных типов опухолей. Дополнительно для дальнейшего улучшения восстановления кроветворения после химиотерапии или лечения облучением используются такие стимулирующие факторы роста, как гранулоцитарный колониестимулирующий фактор, фактор стволовой клетки или INPROL в количествах, стимулирующих стволовую клетку.
При применении ex vivo в случаях, в которых желательно ингибировать пролиферацию стволовой клетки, используется от 0,1 до 10 нг/106 клеток/мл, преимущественно 2-50 нг/106 клеток/мл, INPROL. Для случаев, в которых желательна стимуляция стволовой клетки, используется 10-100  /106 клеток/мл, преимущественно 1-100 /106 клеток/мл, преимущественно 1-100  /106 клеток/мл INPROL. /106 клеток/мл INPROL.
В случаях, когда желательно использовать опиатное соединение(я) для ингибирования или стимуляции кроветворного цикла стволовой клетки, опиатное соединение(я) используются в концентрациях, равномолярных описанным для INPROL.
В другом примере осуществления изобретения INPROL используется в методе для подготовки аутологичных кроветворных клеток для трансплантации. Кроветворные клетки обрабатываются ех vivo количеством INPROL, эффективным для ингибирования деления стволовой клетки, и затем очищаются от раковых клеток введением в мозговые культуры эффективного количества химиотерапевтического средства или облучения. Предпочтительны химиотерапевтические средства, обладающие специфичностью к циклирующим клеткам. Обработанное таким образом мозговое вещество повторно вводится в аутологичного донора. Дополнительно пациента лечат количеством INPROL, стимулирующим стволовую клетку, и/или другим средством, известным своей стимуляцией кроветворения, для улучшения восстановления кроветворной деятельности у пациента.
Подобная методика позволяет эффективно очищать опухолевые клетки во время аутотрансплантаций костного мозга, в то же время защищая кроветворные стволовые клетки. Подобная защита может быть обеспечена во время протоколов очистки ex vivo или in vivo. После успешной трансплантации существует необходимость быстрой пролиферации стволовых клеток для восстановления нормального функционирования костного мозга. Это может быть обеспечено путем использования INPROL в количествах, стимулирующих стволовую клетку, что стимулирует кроветворный цикл стволовых клеток и усиливает восстановление функции костного мозга.
В другом примере осуществления изобретения INPROL используется в методе для подготовки кроветворных клеток для генной терапии. Кроветворные клетки обрабатываются INPROL ex vivo в количествах, стимулирующих кроветворную клетку, и/или другим стимулирующим цитокином(ами), чтобы стимулировать деление стволовых клеток, и затем трансфицируются (преимущественно инфицированные, например, при использовании ретровирусного вектора) представляющим интерес геном(ами). После проведения трансфекции клетки промываются и затем обрабатываются INPROL в количествах, ингибирующих стволовые клетки, чтобы вернуть стволовые клетки в состояние покоя. Обработанное таким образом мозговое вещество повторно вводится в донора. Дополнительно пациента обрабатывают in vivo INPROL в количествах, ингибирующих стволовую клетку, для поддержания стволовых клеток в состоянии покоя и для увеличения их способности к репопуляции мозгового вещества.
В другом примере осуществления изобретения INPROL используется в качестве дополнительных лечебных мероприятий при лечении лейкоза. Например, при состоянии заболевания, когда лейкемические клетки не реагируют на INPROL, кроветворные клетки обрабатываются ех vivo количеством INPROL, ингибирующим стволовую клетку. Введением INPROL предотвращается пролиферация здоровых стволовых клеток. Таким образом, в то время, когда размножающиеся лейкемические клетки обрабатываются специфическим для цикла клетки цитотоксическим средством, популяция здоровых стволовых клеток защищена от поражения. Дополнительно по выбору вводится стимулирующий цитокин, подобный IL-3, гранулоцитарно-макрофагальному колониестимулирующему фактору (GM-CSF) для того, чтобы способствовать прохождению цикла лейкемическими клетками во время лекарственного или лучевого лечения, в то время как здоровые стволовые клетки защищены INPROL. Пациента лечат химиотерапевтическими средствами или облучением для разрушения лейкемических клеток, а очищенное мозговое вещество затем трансплантируется пациенту для восстановления кроветворной деятельности.
Подобным же образом, в другом примере осуществления изобретения при лечении пациентов с серьезными вирусными инфекциями, охватывающими кровяные клетки или лимфоциты, такими как ВИЧ инфекция, кроветворные клетки обрабатываются ex vivo или in vivo с помощью INPROL, за которым следуют антивирусные средства, лекарства, разрушающие инфицированные клетки, или основанные на антителах системы для удаления инфицированных клеток. После миелоаблатиной антивирусной обработки или миелоаблативной химиотерапии для уничтожения вирусных клеток-хозяин у пациента обработанные INPROL костномозговые клетки возвращаются пациенту.
В другом примере осуществления изобретения INPROL используется для лечения нарушений, связанных с гиперпролиферирующими стволовыми клетками. Например, псориаз, вызванный гиперпролиферирующими эпителиальными клетками кожи, иногда лечится цитотоксическими лекарствами. Другие преднеопластические поражения, которые затрагивают пролиферацию стволовой клетки, также могут быть исправлены эффективными количествами INPROL, ингибирующими пролиферацию стволовых клеток. Пациенты с приобретенным синдромом иммунодефицита имеют ненормально высокие скорости прохождения цикла клетки, что приводит к истощению стволовой клетки; этим пациентам также помогает лечение количеством INPROL, эффективным для ингибирования цикла стволовой клетки. В случае необходимости для подобных применений в качестве альтернативы парентеральному приему используются локальные или трансдермальные составы (например, мази, лосьоны, гели или повязки), содержащие INPROL.
В большинстве случаев лейкоза, клетки-предшественники лейкоза являются дифференцированными популяциями клеток, которым INPROL не наносит ущерба и которые поэтому лечатся методами с использованием INPROL, подобными описанным выше. В случаях, когда клетки-предшественники лейкоза являются очень примитивными и напрямую чувствительны к ингибированию INPROL, пролиферация клеток лейкоза ослабляется путем приема эффективных количеств INPROL.
В другом примере осуществления изобретения INPROL используется для лечения нарушений, связанных с гипопролиферирующими стволовыми клетками. Например, миелодиспластические синдромы и апластическая анемия являются нарушениями, вызванными гипопролиферирующими стволовыми клетками костного мозга. Другие синдромы, при которых проявляется гипопролиферация стволовой клетки, лечатся количеством INPROL, стимулирующим стволовую клетку.
Антитела, моноклональные или поликлональные, к пептидам или полипептидам INPROL разрабатываются стандартными методами. Эти антитела или пептиды или полипептиды INPROL метятся детектируемыми метками, много типов которых известно в данной области. Меченые антитела INPROL или анти-INPROL затем используются в качестве маркеров стволовой клетки для того, чтобы идентифицировать и отделить стволовые клетки при прямом введении их пациенту для диагностических целей. Альтернативно, данные меченые пептиды, полипептиды или антитела используются ex vivo для идентификации стволовых клеток в препарате кроветворных клеток, чтобы позволить удалить их во время чистки неопластических клеток в мозговом веществе. Подобным же образом, такие меченые пептиды, полипептиды или антитела используются для выделения и идентификации эпителиальных или других стволовых клеток. В дополнении к этому, подобные антитела, меченые или немеченные, используются терапевтически, путем нейтрализации активности INPROL, или диагностически, путем детектирования уровней циркулирования INPROL.
INPROL может клонироваться из гена человека или библиотек кДНК (комплементарной ДНК) для выражения рекомбинантного INPROL человека с использованием стандартных методов. Например, используя информацию о последовательности, полученную из очищенного белка, конструируются олигонуклеотидные пробы, которые могут маркироваться, например, фосфором-32 и использоваться для выделения соответствующей библиотеки кДНК (например, из костного мозга). Альтернативно, выраженная библиотека из соответствующего источника (например, костного мозга) проверяется на кодирование кДНК на INPROL путем использования антител или путем использования соответствующего функционального анализа (например, описанного в Примере 2). Сам гемоглобин, также как и отдельные альфа- и бета-цепочки, клонировались и выражались с помощью известных в данной области методов (см. Pagnier et al., Rev. Fr. Trabsfus. Hemobiol. 35:407-15, 1992; Looker et al., Nature 356:258-60, 1992; Methods in Enzymology, том 2316, 1994).
Настоящее изобретение включает последовательности ДНК, которые включают включение кодонов, “предпочтительных” для выражения с помощью выбранных клеток-хозяев немлекопитающих; обеспечение мест для расщепления клетки путем ограничения ферментов эндонуклеазы; обеспечение дополнительных исходных, конечных или промежуточных последовательностей ДНК, что облегчает конструирование свободно выраженных векторов или производство или очистку цепочки альфа-, бета-, гамма-, дельта-, эпсилон- и/или зета-гемоглобина.
Настоящее изобретение также обеспечивает кодирование последовательностей ДНК для аналогов полипептидов или производных цепочек альфа-, бета-, гамма-, дельта-, эпсилон- и/или зета-гемоглобина, отличающихся от естественно встречающихся форм с точки зрения идентичности или местоположения одного или более остатка аминокислот (например, делеционные аналоги, содержащие меньше всех указанных остатков; замещающие аналоги, отличающиеся тем, что один или более из указанные остатков замещаются другими остатками, и дополняющие аналоги, в которых один или более остатоков аминокислот добавляется к терминалу или средней части полипептида) и которые включают некоторые или все свойства естественно встречающихся форм.
В преимущественном примере осуществления изобретения INPROL является продуктом прокариотического или эвкаритического выражения клетки-хозяина (например, бактериальные, дрожжевые клетки, клетки высших растений, клетки насекомых или млекопитающих в культуре) экзогенных последовательностей ДНК, полученных геномным клонированием или клонированием кДНК или генным синтезом. Таким образом, в преимущественном примере осуществления изобретения INPROL является “рекомбинантным INPROL”. Являющиеся продуктом выражения в типичных дрожжах (например, Saccharomyces cerevisiae) или прокариоте (например, Е.coli), клетки-хозяин свободны от ассоциации с любыми белками млекопитающих. Продукты выражения в клетках позвоночных (например, млекопитающих, отличных от человека (например, COS или СНО) и птиц) свободны от ассоциаций с любыми белками человека. В зависимости от использованной клетки-хозяин, полипептиды по данному изобретению могут быть гликолизированы или негликолизированы. Пептиды по данному изобретению могут также дополнительно включать первоначальный остаток метионин аминокислоты (в позиции 1).
Настоящее изобретение также охватывает другие продукты, такие как аналоги полипептидов альфа-, бета-, гамма-, дельта-, эпсилон- и/или зета-цепочки гемоглобина. Подобные аналоги включают фрагменты альфа-, бета-, гамма-, дельта-, эпсилон- и/или зета-цепочки гемоглобина. В соответствии с известными процедурами можно легко спроектировать и изготовить гены, кодирующие микробное выражение полипептидов, имеющих первичные последовательности, отличающиеся от указанных в данном материале, с точки зрения их идентичности или местоположения одного или более остатков (например, замены, терминальные и промежуточные добавления и делеции). Альтернативно, модификации кДНК и геномных генов могут быть легко выполнены хорошо известными методами ориентированного на участок мутагенеза и они используются для генерации аналогов и дериватов альфа-, бета-, гамма-, дельта-, эпсилон- и зета-цепочек гемоглобина. Подобные продукты имеют по крайней мере одно из общих с INPROL биологических свойств, но могут отличаться другими. В качестве примеров продукты изобретения включают альфа-, бета-, гамма-, дельта-, эпсилон- или зета-цепочки, которые укорочены, например, делециями; или такие, которые более стабильны к гидролизу (и, следовательно, могут иметь более заметные или более длительные воздействия, чем естественно встречающиеся); или такие, которые были изменены для удаления или добавления одного или более потенциальных участков для O-гликолизации и/или N-гликолизации или у которых один или более остатков цистина удален или замещен, например, остатками аланина или серина и которые более легко изолируются в активной форме от микробных систем; или у которых один или более остатков тирозина замещен фениланалином и которые более или менее легко связываются с белками мишени или рецепторами на клетках мишенях. Также включены фрагменты пептидов или полипептидов, дублирующие только часть непрерывной последовательности аминокислот или вторичные конформации в рамках альфа-, бета-, гамма-, дельта-, эпсилон- или зета-цепочек, и эти фрагменты могут обладать одним свойством INPROL (например, связывание рецепторов), а не другими (например, ингибирующая стволовую клетку активность). Примечательно, что для того, чтобы один или более продуктов по изобретению имел терапевтическую полезность, или полезность в других контекстах, таких как в анализе подавления ингибирующего фактора, активность не обязательна (см. Wieland et al., Blut 44: 173-5, 1982). Конкурирующие антагонисты полезны в случаях перепроизводства ингибиторов стволовой клетки или ее рецептора.
В дополнение при использовании стандартных методов могут быть химически синтезированы пептиды, выведенные из последовательности белка, который сохраняет биологическую активность. Также настоящее изобретение предусматривает кодирование последовательностей для аналогов пептидов или производных альфа-, бета-, гамма-, дельта-, эпсилон- или зета-цепочки гемоглобина, которые отличаются от естественно встречающихся форм по своей идентичности или местоположению одного или более остатков аминокислот (например, делеционные аналоги, содержащие менее чем все указанные остатки; заменяющие аналоги, в которых один или более обозначенных остатков замещаются другими остатками; естественно встречающиеся или другие известные в данной области аналоги, такие как D-аминокислоты; и дополнительные аналоги, в которых один или более остатков аминокислоты химически модифицируется для увеличения стабильности, растворимости и/или сопротивляемости протеолизу) и которые имеют некоторые или все свойства естественно встречающихся форм.
Последовательности пептидов, подобные вышеописанным, могут идентифицироваться разнообразными средствами. Сравнение трехмерных структур природных цепочек гемоглобина, активных в анализе (например, альфа-цепочка), со структурально связанными белками, которые являются неактивными (например, миоглобин), могут идентифицировать участки, имеющие различные конформации в трехмерном пространстве, и которые поэтому являются участками-кандитатами для активных пептидов. В другом подходе используется селективный протеолиз, в котором протеолитические ферменты используются в ограниченных гидролизатах цепочек гемоглобина, что дает пептиды, которые могут быть выделены, например, обращенно-фазовой жидкостной хроматографией высокого разрешения (ЖХВР) и затем проверены на ингибирование стволовой клетки. Пептиды могут также генерироваться химическим синтезом (например, синтезом твердой фазы); ряд перекрывающихся пептидов (например, 15-меры), которые включают последовательность представляющей интерес цепочки гемоглобина (например, альфа-цепочки) могут легко генерироваться и испытываться в образцах стволовых клеток. Могут генерироваться комбинаторные библиотеки, в которых проводится множественный химический синтез и в которых выбранные позиции аминокислот делаются переменными, что приводит к большим количествам аналогов пептидов для отбора (например, Dooley et al., Peptide Research 8:124-137, 1995). Альтернативно могут использоваться рекомбинантные методы. Направленный по месту мутагенез может использоваться для идентификации критических остатков, необходимых для активности определенной цепочки гемоглобина. Участки цепочки, которые известны как активные в качестве ингибитора стволовых клеток (например, альфа-цепочка), могут быть заменены участками родственного, но неактивного белка (например, миоглобин) и испытаны в анализах стволовой клетки, что позволяет идентифицировать участки, необходимые для активности. Подобные идентифицированные участки могут быть выражены как пептиды и испытаны на активность в анализе циклирующей стволовой клеткой.
Гомологичные или аналогичные версии INPROL от других видов используются для различного использования в ветеринарии, подобно терапевтическим примерам осуществления изобретения, описанным выше.
INPROL в количествах, ингибирующих стволовую клетку, действует на прохождение кроветворного цикла стволовыми клетками путем помещения их в состояние “покоя” без деления или с медленным делением. Когда желательно стимулировать находящиеся в состоянии покоя стволовые клетки к делению, например, после лечения ракового пациента химиотерапией или облучением, может использоваться INPROL в количествах, стимулирующих стволовые клетки. Альтернативно или дополнительно, субъекту вводятся стимулирующие колонии факторы и другие стимуляторы кроветворной деятельности. Примеры подобных факторов включают, но не ограничиваются: макрофагальный колониестимулирующий фактор (M-CSF (CSF-1)), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), мегакриеоцитарный колониестимулирующий фактор (Megakaryocyte-CSF), тромбопоэтин, фактор стволовой клетки или другие цитокины, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-12, IL-13, IL-14 или эритропоэтин.
Полипептиды INPROL или активные фрагменты, обладающие ингибирующей стволовые клетки активностью, очищаются или синтезируются обычными химическими процессами, объединенными с соответствующими биопробами для ингибирующей стволовые клетки активности, как приведено в описанных ниже протоколах.
В одном примере осуществления изобретения терапевтически эффективное количество белка INPROL или терапевтически эффективный его фрагмент используются в смеси с фармацевтически приемлемым носителем. Этот состав INPROL обычно вводится путем парентеральной инъекции или инфузии. В соответствии с достигаемым терапевтическим эффектом выбираются подкожные, внутривенные или внутримышечные пути введения.
Для систематического введения терапевтический состав для использования в данном изобретении представляет собой форму непирогенного, парентерально приемлемого водного раствора. Фармацевтически приемлемый стерильный белковый раствор, должным образом учитывающий рН, изотонность, стабильность, носитель белков и тому подобное, входит в известный для данной области уровень знаний.
Также включены в изобретение фармацевтические составы, включающие терапевтически эффективные количества пептидов или полипептидных продуктов по изобретению, вместе с приемлемыми разбавителями, консервантами, солюбилизаторами, эмульгаторами, адъювантами и/или носителями, полезными при терапии INPROL. При использовании здесь термин “терапевтически эффективное количество” обозначает такое количество, которое обеспечивает терапевтический эффект для данного состояния и режима приема. Подобные составы представляют собой жидкости, гели, мази или лиофилизованные, или по-иному высушенные лекарственные средства и включают разбавители с различным содержанием буфера (например, Tris-HCl, ацетат, фосфат), с различными рН и ионной силой, такие добавки, как альбумин или желатин, для предотвращения адсорбции к поверхностям, детергенты (например, Tween 20, Tween 80, Pluronic F68, соли желчной кислоты), солюбилизирующие средства (например, глицерин, полиэтиленгликоль), антиоксиданты (например, аскорбиновая кислота, метабисульфит натрия), консерванты (например, Тимерозол, бензиловый спирт, парабены), вещества, увеличивающие объем растворителя при растворении или модификаторы концентрации (например, лактоза, маннитол), ковалентное присоединение полимеров, подобное присоединению полиэтиленгликоля к белку, усложнение с помощью ионов металла или включение материала в или на определенные препараты из полимерных соединений, таких как полиакриловая кислота, полигликолевая кислота, гидрогели, и т.д., или в липосомы, ниосомы, микроэмульсии, мицеллу, однослойные или многослойные пузырьки, биодеградируемые инжектируемые микрокапсулы или микросферы, или белковые матрицы, тени эритроцитов, сферопласты, кожные “заплаты”, или другие известные методы выделения или упаковки фармацевтических средств. Подобные средства будут влиять на физическое состояние, растворимость, стабильность, норму выхода in vivo и скорость очищения крови in vivo INPROL. Соединения с контролируемым или сдерживаемым выходом включают соединения, образованные в жировых депо (например, жирные кислоты, парафины, масла). Также охватываются изобретением корпускулярные композиции, покрытые полимерами (например, полоксамеры или полаксамины) и INPROL в соединении с антителами, направленными против специфических рецепторов тканей, лигандов или антигенов или в соединении с лигандами против специфических рецепторов ткани. Другие примеры осуществления лекарственных средств по изобретению включают определенные формы защитных покрытий, ингибиторные факторы протеаза или усилители проникновения для различных путей приема, включая парентеральный, пульмонарный, назальный, местный (кожный или слизистый) и оральный. В другом примере осуществления изобретения, средства, содержащие INPROL, применяются местно или через трансдермальные “заплаты”.
В одном примере осуществления изобретения средства по предмету изобретения упакованы в стерильные пробирки или ампулы в форме единиц дозы.
Изобретение также включает средства, включающие один или более дополнительных факторов, таких как химиотерапевтические средства (например, 5-фторурацил (5-FU), цитозин арабинозид, циклофосфамид, цисплатин, карбоплатин, диоксирубицин, этопозид, таксол, алкилирующие средства), антивирусные средства (например, AZT, ацикловир), TNF, цитокины (например, интерлейкины), антипролиферационные лекарственные средства, антиметаболиты и лекарства, которые вмешиваются в метаболизм ДНК.
Дозовый режим, применяющийся в методе для лечения субъекта, ожидающего воздействия подобных цитотоксических средств, или для лечения гиперпролиферирующих стволовых клеток, определяется ведущим его лечение врачом, учитывающим различные факторы, которые модифицируют действие лекарств, например, состояние, вес тела, пол и диета пациента, серьезность любой инфекции, время приема и другие клинические факторы.
После воздействия на субъект цитотоксических средств или облучения терапевтический метод по данному изобретению дополнительно включает введение субъекту INPROL в количествах, стимулирующих стволовые клетки, дополнительно включая один или более лимфокинов, колониестимулирующие факторы или другие цитокины, гематопоэтины, интерлейкины или факторы роста, чтобы в общем стимулировать рост и деление стволовых клеток (и их потомков), ингибированных предшествующим лечением INPROL. Подобные терапевтические средства, которые способствуют кроветворной деятельности, включают IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, мегранулоцитарный колониестимулирующий фактор (Meg-CSF), макрофагальный колониестимулирующий фактор (M-CSF (CSF-1)), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF) или эритропоэтин. Дозы этих средств выбираются в соответствии со знаниями, полученными при их использовании в клинических испытаниях в отношении эффективности способствования восстановлению кроветворной деятельности после химиотерапии или трансплантации кроветворной стволовой клетки. Эти дозы должны были бы корректироваться для компенсации отклонений в физическом состоянии пациента и в зависимости от количества и типа химиотерапевтического средства или облучения, которым был подвергнут пациент. Прохождение реверсирования ингибирования стволовых клеток, вызванного приемом INPROL, у проходящего лечение пациента контролируется обычными методами.
При лечении лейкоза полезно принимать как INPROL для ингибирования нормального прохождения цикла стволовой клеткой, так и такой стимулятор роста лейкемических клеток, как IL-3 или гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), одновременно с лечением цитотоксическими лекарствами или во время облучения. По этому протоколу можно достигнуть наибольшей разницы между состоянием прохождения цикла и чувствительностью к лекарствам здоровых и лейкемических клеток.
Пример 1. Анализ ингибирования пролиферации стволовой клетки in vivo.
Для детектирования пролиферации стволовой клетки измерялось число колониеобразующих единиц селезенки (КОЕ-С) в фазе S цикла клетки с помощью “суицидного” метода (метода “самоубийства”) с использованием 3H-Тимидина (Becker et al., Blood 26:296-308, 1965).
Незрелые кроветворные клетки-предшественники – колониеобразующие единицы селезенки (КОЕ-С) – могут быть детектированы in vivo путем формирования макроскопических колоний в селезенках летально облученных мышей через 8-12 дней после внутривенной инъекции кроветворных клеток (Till & McCulloch, 1961).
Для стандартного анализа пролиферации КОЕ-С обычно используется “суицидный” метод с использованием 3Н-Тимидина (Becker et al., 1965). Метод основан на включении меченного радиоактивностью Тимидина (3H-Тимидин), предшественника ДНК, в клетки во время синтеза ДНК. КОЕ-С, которые находятся в фазе S цикла во время тестирования, убиваются высокой радиоактивностью и поэтому не могут образовывать колонии в селезенке. Таким образом, разница между численностью КОЕ-С, образованных путем инъекции образца клетки, инкубированного без 3H-Тимидина, и теми же клетками, инкубированными с 3H-Тимидином, показывает процент пролиферирующих КОЕ-С в первоначальном образце.
Тестирование ингибитора не может быть выполнено с популяцией стволовой клетки костного мозга, взятого у животных без проведения стимуляции, так как ингибитор влияет только на циклирующие КОЕ-С, которые составляют 7-10% от всей популяции КОЕ-С в костном мозге нормальной мыши.
Для стимуляции пролиферации КОЕ-С использовались фенилшидразин (PHZ) или сублетальное облучение (Lord, 1976).
Мы разработали метод использования тестостерон-пропионата (TSP), основываясь на его стимулирующем воздействии на циклирование КОЕ-С (Byron et al., Nature 228:1204, 1970), что облегчало тестирование и не вызывало никаких побочных эффектов. TSP вызывал стимуляцию пролиферации КОЕ-С в течение 20-24 часов после введения и эффект мог быть заметен по крайней мере в течение 7 дней.
Процедура, используемая для скрининга фракций во время очистки ингибитора, была следующей.
Мыши: во время всего тестирования использовались штаммы мышей BDF1 или СВF1.
Донорские мыши обрабатывались дозой TSP, составляющей 10 мг/100 г, путем внутрибрюшинной инъекции 0,2 мл/мышь для того, чтобы вывести 30-35% КОЕ-С в фазу S.
Через двадцать четыре часа костный мозг забирается из бедренных костей для подготовки клеточной суспензии. Пять к десяти миллионам клеток на 1 мл затем инкубируются с различными контрольными образцами и тестовыми фракциями в течение 3,5 часов при 37°С в водяной ванной, с использованием двух пробирок для каждой группы (одна для горячей (радиоактивной) и одна для холодной (нерадиоактивной)).
После 3,5 часов 3Н-Тимидин (мКи/мл, удельная активность 18-25 Ки/ммоль) добавляется к каждой горячей пробирке в объеме 200  л на 1 мл клеточной суспензии; ничто не добавляется в холодные пробирки. Инкубация продолжается в течение более 30 минут при 37°С. л на 1 мл клеточной суспензии; ничто не добавляется в холодные пробирки. Инкубация продолжается в течение более 30 минут при 37°С.
После 30 минут инкубации реакция нейтрализации прекращается добавлением 10 мл холодной (4°С) среды, содержащей 400  г/мл нерадиоактивного тимидина. Клетки обильно промываются (3 раза). г/мл нерадиоактивного тимидина. Клетки обильно промываются (3 раза).
Клетки повторно переводятся во взвешенное состояние и разводятся до концетрации, необходимой для инъекций, обычно 2-4×104 клеток на мышь в 0,3-0,5 мл.
Мыши реципиенты, 8-10 на группу, облучаются не более 6 часов до инъекций.
В день 9-12 производится сбор на селезенках реципиентов и фиксируется в растворе Теллеснитского; колонии обсчитываются визуальным подсчетом. Процент клеток в фазе S вычисляется с использованием формулы
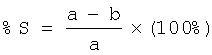 , ,
где а – число КОЕ-С без 3H-Тимидина;
b – число КОЕ-С с 3H-Тимидином.
Данные испытаний INPROL, представленные в Таблице 1, демонстрируют, что циклирующие стволовые клетки после обработки INPROL приобретают сопротивляемость к воздействию 3H-Тимидина. Для данного и всех последующих примеров термин “pINPROL” относится к белку, очищенному из костного мозга свиньи. Наблюдается такая же защита для специфических для фазы S цитотоксических лекарств – цитозина арабинозина и гидроксимочевины (данные не показаны). Если обработанные стволовые клетки затем промываются холодной средой, содержащей нерадиоактивный тимидин, выжившие стволовые клетки пролиферируют в селезенке мыши и нормально образуют колонии.
Таблица 1
Ингибиторное действие pINPROL на пролиферацию КОЕ-С во время четырехчасовой инкубации с клетками костного мозга |
| Группа |
-3H-Tdr |
+3H-Tdr |
Процент КОЕ-С, убитых SH-Tdr |
| Инкубация отсутствует |
22,2±2,0* |
13,7±+2,4* |
38,3±1,7 |
| 4 часа со средой |
18,7±3,0* |
11,4±1,3* |
43,1±1,4 |
| 4 часа с pINPROL |
21,2±2,3* |
20,7±2,6* |
2,1±0,08 |
| * КОЕ-С на 2×104 клеток |
Пример 2. Анализ ингибирования пролиферации стволовой клетки in vitro.
Прямое влияние INPROL было показано с использованием следующей системы тестирования (Лорд и др. в работе “Ингибиторы кроветворной деятельности”, стр.227-239, 1987). Линия клетки, зависящая от фактора мультилинейной дифференцировки (IL-3), смесь А4 FDCP (A4), содержались в среде Дульбекко, модифицированной по способу Исков (IMDM), дополненной 20% сыворотки лошади и 10% кондиционированной WEHI-3 среды в качестве источника колониестимулирующего IL-3.
Для измерения пролиферации использовался анализ с включением насыщенного тритием Тимидина: клетки A4 (5×104) в 10  л среды с 20% сыворотки лошади и 50% WEHI-3CM) инкубировались при 37°С в 5% СО2 в течение 16 часов. л среды с 20% сыворотки лошади и 50% WEHI-3CM) инкубировались при 37°С в 5% СО2 в течение 16 часов.
В начале добавлялся pINPROL или сырая вытяжка костного мозга (фракция IV). Насыщенный тритием тимидин ((3H-Tdr) 3,7 КБеккерель в 10  л при 740 ГБеккерель/м моль) затем добавлялся к каждой группе для дальнейшей инкубации в течение 3 часов. Уровень пролиферации измерялся сбором клеток и % ингибирования рассчитывался с использованием формулы. л при 740 ГБеккерель/м моль) затем добавлялся к каждой группе для дальнейшей инкубации в течение 3 часов. Уровень пролиферации измерялся сбором клеток и % ингибирования рассчитывался с использованием формулы.

cpm – клеток на миллион.
Включение насыщенного тритием тимидина (3H-Tdr) в смесь FDCP клеток A4 в присутствии градуированных доз экстракта костного мозга или pINPROL показано на фиг.6. Можно увидеть, что очищенный состав pINPROL по крайней мере в 1000 раз активнее, чем исходный материал. Время выдержки (16 часов) является важным фактором для эффективного ингибирования и дает свидетельство прямого влияния pINPROL на стволовые клетки клеточной линии A4.
Пример 3. Ингибирование пролиферации КОЕ-С с помощью доз INPROL, вводимого in vivo, и продолжительность эффекта.
Исследования действия INPROL, вводимого in vivo, показали, что INPROL может эффективно блокировать вовлечение КОЕ-С в цикл, тем самым защищая эти клетки от цитотоксического воздействия дальнейшего лечения, демонстрируя его потенциал для клинического использования.
Протокол эксперимента имел две цели: проверить влияние INPROL на КОЕ-С при введении in vivo и определить эффективную длительность активности INPROL по отношению к циклирующим стволовым клеткам.
Чтобы стимулировать пролиферацию КОЕ-С использовалась инъекция тестостерона пропионата, основываясь на эффекте, упомянутом выше в примере 1.
Мышам BDF1 вводили тестостерон пропианат (TSP) (10 мг/100 г) в день 0; через 24 часа мыши каждой экспериментальной группы (4 мыши на группу) получали одну инъекцию pINPROL в дозах 0  г, 5 г, 5  г и 15 г и 15  г/мышь внутрибрюшинно. г/мышь внутрибрюшинно.
Через 24 часа после инъекции pINPROL мыши умерщвлялись и измерялся процент циклирующих КОЕ-С с помощью анализа, описанного в примере 1. Введение TSP побуждало к вступлению в цикл около 50% КОЕ-С по сравнению с 7% у необработанных мышей. pINPROL в таких небольших дозах, как 2  г/мышь, мог ингибировать вызванную TSP пролиферацию и довести ее до нормального уровня. г/мышь, мог ингибировать вызванную TSP пролиферацию и довести ее до нормального уровня.
Для оценки продолжительности эффекта одной группе мышей (21 мышь на группу) вводился только TSP, а другой группе вводился как TSP, так и pINPROL (через 24 часа после TSP). Циклирование КОЕ-С измерялось каждые 24 часа в течение недели путем отбора 3 доноров от каждой группы и измерения состояния цикла КОЕ-С в их костном мозге описанным выше методом (см. Пример 1). Представленные на фиг.7 данные показывают, что в то время как длительность действия TSP составляет по крайней мере 7 дней, отдельная инъекция INPROL может перевести КОЕ-С в состояние покоя и сохранять их вне цикла в течение более 48-72 часов. Так как большинство химиотерапевтических средств, используемых для химиотерапии рака и лейкоза, имеют относительно короткий полупериод in vivo, обычно менее 24 часов, в соответствии с полученными данными действие INPROL сохраняется в течение более длительного периода времени, чем эффективное время, в течение которого химиотерапевтические средства, подобные цитозин арабинозиду или гидроксимочевине, активны in vivo. Что более важно, для химиотерапевтического лечения и лечения облучением, имеющего более длительные интервалы (более 24 часов и менее 96 часов) между первым (неразрушающим для стволовых клеток) и вторым (разрушительным для КОЕ-С) лечениями, будет достаточно одной инъекции INPROL во время интервалов между двумя применениями химиотерапевтического средства или лучевой терапии. Для нескольких повторяющихся циклов цитотоксической терапии или облучения могла бы использоваться такая же стратегия, основываясь на длительности воздействия INPROL.
Пример 4. Большинство примитивных кроветворных стволовых клеток, простимулированных к более быстрому прохождению цикла после лечения 5-фторурацилом (5-FU), защищаются INPROL от повторного воздействия 5-FU.
Лекарство 5-фторурацил (5-FU) значительно снижает число клеток в миелоидном и лимфоидном отделах. Обычно считается, что оно конкретно направлено на цикл, нацеливаясь на быстро пролиферирующие клетки, так как включение нуклеотидного аналога в ДНК во время фазы S цикла клетки или до него приводит к умиранию клетки. Отдельная доза 5-FU не влияет на долгосрочное выживание и на реконструкцию иммунной и кроветворной функции костного мозга мыши; однако было продемонстрировано (Harrison et al., Blood 78:1237-1240, 1991), что плюрипотентные кроветворные стволовые клетки (ПКСК) подвержены влиянию второй дозы 5-FU в течение короткого периода, составляющего около 3-5 дней, после первоначальной дозы. Это можно объяснить тем, что обычно ПКСК слишком медленно проходят цикл, чтобы была бы эффективной отдельная доза 5-FU, и они стимулируются к быстрому прохождению цикла стимулами, происходящими от первоначального лечения 5-FU. Мы предположили, что ПКСК можно вернуть к состоянию медленного цикла с помощью INPROL и тем самым защитить от второго лечения 5-FU.
Используемые в данных опытах мыши были мышами мужского пола BDF1. Основной раствор 5-FU (Сигма) был подготовлен в физиологическом растворе при концентрации 10  г/мл. Каждая обрабатываемая мышь получала 2 мг 5-FU на 10 г веса тела в хвостовую вену в день 0 эксперимента; через 24 часа мышам вводился pINPROL (10 г/мл. Каждая обрабатываемая мышь получала 2 мг 5-FU на 10 г веса тела в хвостовую вену в день 0 эксперимента; через 24 часа мышам вводился pINPROL (10  г/100 г веса тела) внутрибрюшинно и в день 3 им вводилась вторая доза 5-FU. Проводилось исследование выживания путем контролирования смертности мышей в экспериментальной (обработанной pINPROL) и контрольной группе по 30 мышей каждая. Кривые выживания показаны на фиг.8. г/100 г веса тела) внутрибрюшинно и в день 3 им вводилась вторая доза 5-FU. Проводилось исследование выживания путем контролирования смертности мышей в экспериментальной (обработанной pINPROL) и контрольной группе по 30 мышей каждая. Кривые выживания показаны на фиг.8.
Пример 5. Воздействие предварительной инкубации с INPROL в сравнении с MIP-1 на клетки костного мозга. на клетки костного мозга.
Целью данного эксперимента было сравнение ингибирующего действия предварительной инкубации с pINPROL и MIP-1 на клетки костного мозга мыши in vitro. на клетки костного мозга мыши in vitro.
Использовалась следующая процедура.
In vivo. Мышам BDF1 возрастом 6-15 недель вводилось 200 мг/кг 5-фторурацила внутрибрюшинно за 48 часов до сбора мозгового вещества с бедренных костей.
In vitro. Производится отсчет отдельных клеток из группы клеток в суспензии и 5×106 клеток инкубируются в общем объеме 2 мл с или без pINPROL или MIP-1 , с 5% лошадиной сыворотки в среде Дульбекко, модифицированной по способу Искова (IMDM) с добавлением L-глютамина, при 37°С и 5% CO2 в течение 4 часов. Клетки затем дважды промывались и пересчитывались. Они высеиваются в метилцеллюлозу при следующих конечных условиях: , с 5% лошадиной сыворотки в среде Дульбекко, модифицированной по способу Искова (IMDM) с добавлением L-глютамина, при 37°С и 5% CO2 в течение 4 часов. Клетки затем дважды промывались и пересчитывались. Они высеиваются в метилцеллюлозу при следующих конечных условиях:
0,8% метилцелюлозы
25% лошадиной сыворотки
20 нг/мл рекомбинантного мышиного IL3
добавление L-глютамина
5×105 клеток на 1 мл
Среда IMDM (среда Дульбекко, модифицированная по способу Искова)
Посевы инкубировались в течение 11 дней при 37°С и 5% CO2 при 100% влажности. Колонии из более 50 клеток обсчитывались.
| Таблица 2 |
| Группы |
Количество колоний |
Процент контроля |
| Контрольная |
31,0 |
100% |
| pINPROL |
21,25 |
68,5% |
MIP-1 |
35,25 |
114% |
Пример 6. INPROL ингибирует пролиферацию колониеобразующих клеток с высоким пролиферативным потенциалом (HPP-CFC).
Анализ in vitro для оценки мышиных восстанавляющихся стволовых клеток и ранних клеток предшественников является анализом колонии (HPP-PFC) с высоким пролиферативным потенциалом; другие связанные анализы, например, анализ КОЕ-А, КОЕ-ГМ, КОЕ-Е и КОЕ-ГЭМММ, детектируют прогрессивно ограничивающиеся популяции клеток-предшественников (М.Moore, Blood 177:2122-2128, 1991). Данный пример показывает, что предварительная обработка клеток pINPROL ингибирует их пролиферацию, в то время как MIP-1 не может выполнить этого при данных условиях эксперимента. не может выполнить этого при данных условиях эксперимента.
Мыши BDF1 обрабатывались 5-фторурацилом (200 мг/кг внутрибрюшинно) перед тем, как их костный мозг был проанализирован на количество колониеобразующих клеток с высоким пролиферативным потенциалом (HPP-CFC). Клетки промывались центрифугированием и инкубировались при плотностях от 106 до 5×106/мл в среде либо без добавления средства (контрольная группа), либо с добавлением pINPROL (25 нг/мл) или MIP-1 (200 нг/мл) в течение 4 часов. После инкубации клетки промывались и высеивались в агар (0,3%) с 30% фетальной телячьей сыворотки (FCS) и комбинированной кондиционированной средой из линий клеток 5637 и WEHI-3B (7,5% каждой кондиционированной среды, как рекомендовано Шарп и др., 1991). Концентрация посева составляла 5×104 клеток/мл в 60 мм чашках. Колонии были обсчитаны на 14 день и результаты показаны ниже. (200 нг/мл) в течение 4 часов. После инкубации клетки промывались и высеивались в агар (0,3%) с 30% фетальной телячьей сыворотки (FCS) и комбинированной кондиционированной средой из линий клеток 5637 и WEHI-3B (7,5% каждой кондиционированной среды, как рекомендовано Шарп и др., 1991). Концентрация посева составляла 5×104 клеток/мл в 60 мм чашках. Колонии были обсчитаны на 14 день и результаты показаны ниже.
| Таблица 3 |
| Группа |
HPP-CFU |
% контроля |
| Контрольная |
15,5±1,2 |
100% |
| pINPROL |
8,3±0,7 |
53,5% |
MIP-1 |
15,8+0,9 |
101% |
В соответствии с данными результатами MIP-1 не ингибирует пролиферацию большинства незрелых клеток-предшественников, когда он присутствует только во время прединкубационного периода. pINPROL действительно эффективно ингибировал пролиферацию при этих условиях, указывая на фундаментальные различия между pINPROL и MIP-1 не ингибирует пролиферацию большинства незрелых клеток-предшественников, когда он присутствует только во время прединкубационного периода. pINPROL действительно эффективно ингибировал пролиферацию при этих условиях, указывая на фундаментальные различия между pINPROL и MIP-1 с точки зрения биологической активности. с точки зрения биологической активности.
Пример 7. Воздействие терапии INPROL на восстановление от вызванной облучением аплазии костного мозга.
Аплазия костного мозга является основной ограничивающей токсичностью лучевой терапии рака. Было продемонстрировано, что некоторые факторы роста (например, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин) могут ускорить восстановление от вызванной облучением аплазии костного мозга. Концепция защиты путем использования ингибитора пролиферации стволовой клетки является отличным и дополнительным подходом к тому, чтобы справится с гематологическим ущербом. Для того чтобы проследить разработанную ранее процедуру лечения (Примеры 3, 4) была установлена модель летального облучения мыши. В данной области известно, что мыши, получающие 9 Грей кобальта 60 начинают умирать после 10-14 дней; к 30 дню смертность достигает 50%. Данная летальная доза использовалась в нашей модели путем разбивки на два последовательных приема по 4,5 Грей каждый с интервалом 3 дня между дозами. Предварительные данные показали, что кривая выживания в той модели очень близка к известной кривой для отдельного облучения в 9 Грей; более того, проверка на пролиферацию КОЕ-С показала, что через 24 часа после первого облучения 35-50% КОЕ-С вынуждаются к пролиферации. Подобные клетки могут быть защищены ингибитором стволовой клетки, отпущенным до второй дозы.
Для изучения данной возможности мыши (50 мышей /группа) получали 4,5 Грей в день 0. Через двадцать четыре часа одна группа получала pINPROL (2  г/мышь внутрибрюшинно), а другой, контрольной группе, вводился физиологический раствор. Вторая доза облучения (4,5 Грей) давалась в день 3. г/мышь внутрибрюшинно), а другой, контрольной группе, вводился физиологический раствор. Вторая доза облучения (4,5 Грей) давалась в день 3.
На фиг.9 показано увеличение выживаемости после единственной дозы pINPROL. Условия модели клинически приемлемы для лечения любого рака, включая рак, характеризующийся твердыми опухолями; подобное лечение вводится онкологическому пациенту путем отпуска эффективной дозы INPROL между двумя последовательными дозами облучения, тем самым позволяя использовать большие дозы облучения для лечения рака. Предоставляется возможным распространить этот способ воздействия на химиотерапевтические средства.
Пример 8. Использование INPROL для аутотрансплантации костного мозга.
Трансплантация костного мозга является единственным видом лечебной терапии для ряда видов лейкоза (CML, AML и других). Кондиционирование ex vivo аутологовых трансплантантов костного мозга для инфузии должно обеспечить потенциальные аутологовые источники нормальных стволовых клеток, свободных от заражения лейкозом и способных возродить кроветворную систему пациента, что обеспечивает агрессивную и эффективную терапию.
1. Долгоживущая культура клеток костного мозга при лейкозе модели L1210 для изучения воздействия INPROL на сохранение кроветворной деятельности во время чистки с помощью AraC.
Долгоживущие культуры костного мозга (LTBMC) были стабилизированы в соответствии с работой Токсоз и др. (Кровь, 55:931-936, 1980) и лейкемическая клеточная линия L1210 была придана долгоживущей культуре клеток костного мозга (LTBMC) путем совместной культивации в течении 2 недель. Одновременный рост здоровых и лейкемических клеток-предшественников происходил в данных комбинированных культурах LTBMC/L1210, подобно ситуации, возникающей в костном мозге пациента, страдающего лейкозом. Распознавание между здоровыми колониеобразующими единицами (КОЕ) и лейкемическими КОЕ было возможно путем выращивания их в качестве агарных колоний в присутствии или в отсутствие кондиционированной среды из WEHI-3 (мышиная линия клеток, продуцирующая IL-3). Здоровые клетки проходят апоптоз при отсутствии IL-3, в то время как лейкемические клетки могут образовывать колонии при его отсутствии. Суспензионные клетки из соединения LTBMC-L1210 дают приблизительно 150 колоний в присутствии IL-3 (нормальные кроветворные клоны) и 170 колоний при выращивании без IL-3 (лейкемические клоны) на 50000 высеянных клеток.
Процедура очистки была следующей: в день 0 все суспензионные клетки и среда (10 мл/колба) вынимались из колб с LTBMC-L1210 и заменялись 2 мл среды, содержащей 200  г цитозин арабинозида (AraC) (Tsyrlova et al., in Leukemia: Advances in Biology and Therapy, том 35, 1988); после 20 часов инкубации колбы вымывались и замещались 2 мл только свежей среды (контрольная группа) или свежей средой, содержащей 25 нг/мл pINPROL, на 4 часа. После данной предварительной инкубации клетки вновь выращивались с помощью 100 г цитозин арабинозида (AraC) (Tsyrlova et al., in Leukemia: Advances in Biology and Therapy, том 35, 1988); после 20 часов инкубации колбы вымывались и замещались 2 мл только свежей среды (контрольная группа) или свежей средой, содержащей 25 нг/мл pINPROL, на 4 часа. После данной предварительной инкубации клетки вновь выращивались с помощью 100  г/колбу AraC в течение 3 часов при 37°С. Каждая группа содержала 4 колбы. Культуры LTBMC-L1210 промывались 3 раза и замещались свежей средой LTBMC-L1210; они как и раньше сохранялись для исследования регенерации в течение 3-4 недель. г/колбу AraC в течение 3 часов при 37°С. Каждая группа содержала 4 колбы. Культуры LTBMC-L1210 промывались 3 раза и замещались свежей средой LTBMC-L1210; они как и раньше сохранялись для исследования регенерации в течение 3-4 недель.
Данные представлены на фиг.10. В контрольных культурах, обработанных только AraC, не было заметно роста клеток, в то время как в защищенных INPROL колбах регенерация кроветворения происходила значительно более быстро благодаря пролиферации клеток-предшественников из адгезивного слоя. Более того, клетки из экспериментальной группы при высеивании в агар росли только в присутствии IL-3, давая около 100 КОЕ на 50000 клеток; по крайней мере в течение 4 недель рост лейкемических клеток не наблюдался. Таким образом, мозговое вещество, обработанное ex vivo эффективной дозой АгаС в комбинации с INPROL может быть очищено от раковых клеток, при этом стволовые клетки будут защищены. Представляется возможным распространить этот способ на другие формы химиотерапии или лечения облучением.
2. Способность мозгового вещества к репопуляции (MRA) и тридцатидневная защита от облучения увеличиваются путем обработки INPROL in vitro.
MRA, способность клеток к репопуляции костного мозга, летально облученных мышей вместе со способностью обеспечить защиту от облучения в течение 30 дней, является прямым измерением in vivo потенциала к спасению животных с миелоторможением (Visser et al., Blood Cells 14:369-1988).
Для изучения защиты от облучения мыши BDF1 получали облучение 9,5 Грей и восстанавливались трансплантацией костного мозга от доноров, простимулированных тестостероном. Одна группа реципиентов восстанавливалась клетками костного мозга, предварительно инкубированными в течение 4 часов со средой (контрольная группа – группа А), а другая (группа В) – с 25 нг/мл pINPROL. Клетки в обеих группах промывались и 30000 клеток на мышь трансплантировались облученным животным. Данные выживания приводятся (фиг.11). Отражена сумма 3 экспериментов при контроле, нормализованном до 100%. Инкубация с INPROL увеличивала выживание мышей с 36,5% в контрольной группе до 61,8% к 30 дню.
Увеличение способности костного мозга к репопуляции (MRA) путем предварительной инкубации с INPROL может быть одним из механизмов улучшения защиты от облучения. Для изучения данной гипотезы MRA измерялась в соответствии с Виссер и др. (цитируемая работа). В нескольких словах, донорские мыши BDF1 предварительно обрабатывались тестостероном, их костный мозг предварительно инкубировался со средой или с pINPROL в течение 4 часов и вводился облученным животным. На 13 день клетки костного мозга из бедренных костей реципиентов высеивались в агар с 3 различными концентрациями (0,01, 0,05, 0,1 – эквивалент бедренной кости) в присутствии 20% лошадиной сыворотки и 10% WEHI-CM. Количество колоний 7 дня представляло способность костного мозга к репопуляции (MRA), так как колониеобразующие клетки в костном мозге реципиентов в то время являлись предшественниками незрелых стволовых клеток донора.
Как видно из фиг.12, способность к репопуляции костного мозга (MRA) популяции клеток, предварительно инкубированных с INPROL, больше, чем в контрольной группе(В).
Пример 9. Антигиперпролиферативное воздействие INPROL на стволовые клетки может изменить нарушения их дифференциации.
Гиперпролиферация КОЕ-С наблюдается не только во время восстановления от цитотоксических лекарств или облучения, но также как следствие естественного старения, и считается главным признаком при миелодиспластическом синдроме (MDS). Она сопровождается нарушениями дифференциации, такими как преобладание эритроидной дифференциации при снижении дифференциации по гранулоцитному пути.
Клетки костного мозга инкубировались в течение 4 часов при 37°С с 25 нг/мл pINPROL или со средой (контрольная группа), промывались и затем высеивались в агар с 20% лошадиной сыворотки, 2 единицами/мл эритропоэтина и 10% WEHI-CM. Количество колоний эритроидных бурстобразующих единиц (БОЕэ) и ГМ-КОЕ просчитывалось на 7 день. Данные, представленные в Таблице 4, суммированы из 3 экспериментов – для каждой группы бралось 4 животных на точку; высевание производилось на 4 чашки.
Как очевидно из Таблицы 4, инкубация нормального костного мозга (NBM) от здоровых молодых животных (BDF1, возраст 8-12 недель) с INPROL не меняла число или пропорцию колоний различных типов. Доноры BDF1, предварительно обработанные тестостерон пропианатом (TSP), демонстрировали такое же увеличение пролиферации КОЕ-С, как и наблюдавшееся ранее (Пример 1, 3, 4), незначительное увеличение в числе эритроидальных родоначальных клеток (колонии БОЕэ) и уменьшение КОЕ-ГМ, которые полностью аннулировались инкубацией с INPROL. В дополнение к этому, аномально высокий уровень пролиферации КОЕ-С был возвращен к 10% КОЕ-С в фазе S клеточного цикла. Гиперпролиферация КОЕ-С известна как признак некоторых штаммов мыши, подверженных вирусному возбуждению лейкоза, например мыши Balb/c (Таблица 4), а также может наблюдаться у более старых животных (Таблица 4). Подобное же перераспределение коммитированных клеток-предшественников, как и у обработанных TSP мышей BDF1, наблюдается у Blb/с и у более старых (23-25 месячных) BDF1, общим для которых является аномально высокий уровень пролиферации КОЕ-С. Коррекция как пролиферации КОЕ-С, так и дифференциации, вызывалась инкубацией с INPROL. Исследование показало, что введение in vivo INPROL (2  г/мышь) влияло как на пролиферацию КОЕ-С, так и на соотношение эритроидных (БОЕэ) колоний и гранулоцитарно-макрофагальных колоний (GM) (Таблица 4), что имеет еще большее отношение к клинической практике. г/мышь) влияло как на пролиферацию КОЕ-С, так и на соотношение эритроидных (БОЕэ) колоний и гранулоцитарно-макрофагальных колоний (GM) (Таблица 4), что имеет еще большее отношение к клинической практике.
Таблица 4
Воздействие INPROL на дифференциацию КОЕ-С на комментированные клетки-предшественники БОЕэ и КОЕ-ГМ |
| Доноры костного мозга |
pINPROL |
Процент КОЕ-С, убитых 3HTdR |
БОЕэ |
КОЕ-ГМ |
| Молодые BDF1 |
–
+ |
12,0±0,3
15,0±1,3 |
28,33±1,91
22,00±3,74 |
46,22±3,44
47,70±3,72 |
| Старые BDF1 |
–
+ |
47,1±1,9
11,4±0,7 |
43,75±1,54
15,25+1,45 |
24,0±1,33
44,0±7,63 |
| BDF1, стимулированные TSP |
–
+ |
53,2±1,6
7,2±0,4 |
32,67±2,44
12,00±1,83 |
15,71+2,28
35,50±1,4 |
| Balb/С |
–
+ |
57,0±1,9
23,0±2,4 |
47,60±2,96
24,86±2,53 |
33,57±3,45
70,60±4,96 |
Пример 10. Иммуностимулирующая активность INPROL.
Было замечено, что инкубация клеток костного мозга, содержащих большую пропорцию пролиферирующих КОЕ-С, с INPROL не только меняет циклирование КОЕ-С, но также их дифференциацию, переключая пробладающе эритроидную дифференциацию в пользу гранулоцитарных и лимфоидных клеток-предшественников. Это свойство INPROL является важным из-за иммуноподавляющих побочных эффектов цитотоксической химиотерапии и лучевой терапии, а также подавления иммунитета, сопровождающего нарушения гиперпролиферирующих стволовых клеток и старение.
Пример показывает прямое воздействие INPROL на дифференциацию незрелых клеток предшественников из лимфоидной долгоживущей культуры (LLTC), подготовленной в соответствии с работой Виттлок и Витте (Годовой иммунологический обзор 3:213-35, 1985) в клетки предшественники рге-В, измеряемые формированием колоний в метилцеллюлозе, содержащей IL-7.
Лимфоидная долгоживущая культура (LLTC) была стабилизирована в соответствии с описанием и в нее дважды в неделю подавалась свежая среда LLTC (Terry Fox Labs., Vancouver, Canada). Неприлипающие клетки собирались один раз в неделю, промывались от факторов и инкубировались в течение 4 часов с 25 нг/мл pINPROL или только со средой для контроля. После инкубации клетки промывались и высеивались при концентрации 105 клеток/мл в метилцеллюлозу, содержащую 30% свободных секреторных компонентов (FSC), и 10 нг/мл IL-7. Данные 3 недель показаны на фиг.13. Количество крупных колоний pre-В колебалось в контрольном образце, увеличиваясь со временем, но предварительная инкубация с INPROL всегда стимулировала рост колоний в с 4 по 8 раз выше контрольного уровня. Это демонстрирует иммуностимулируещее свойство INPROL, которое полезно при коррекции иммунодефицитных состояний и при увеличении желаемой иммунной реакции, например, на вакцинацию.
Пример 11. INPROL улучшает способность стволовых клеток к репопуляции. Клетки, инициирующие долгоживущую культуру, от пациента с CML (хроническим миелоидным лейкозом).
Хронический миелоидный лейкоз (CML) является злокачественным расстройством кроветворной стволовой клетки. Лечение CML в хронической фазе с помощью химиотерапии одним средством, комбинационной химиотерапии, спленектомии или облучения селезенки, может контролировать клинические признаки и симптомы, но не продлевает значительно выживание. По мере прогрессирования CML от хронической к ускоренной стадии, стандартная терапия не является эффективной. В настоящее время трансплантация костного мозга (ВМТ) является единственной известной лечебной терапией для CML. Терапия с помощью трансплантации костного мозга от донора не родственника затруднена из-за проблем гистологической совместимости. Менее 40% пациентов с хроническим миелоидным лейкозом, которые могли бы пройти трансплантацию, будут иметь приемлемо совместимого донора родственника; следовательно, предпочтительна аутотрансплантация. Кондиционирование ex vivo аутологового трансплантанта костного мозга для инфузии, вместе со способностью выбрать нелейкозные (Ph-отрицательные) миелоидные клетки-предшественники у Ph-положительных пациентов, выращиваемые в долгоживущей культуре (LTC), дает основание полагать, что у аутологовых источников здоровых стволовых клеток есть потенциал для агрессивной и эффективной терапии хронического миелоидного лейкоза (CML).
В контексте трансплантации костного мозга (ВМТ) кроветворная стволовая клетка может быть определена как клетка, имеющая способность генерировать зрелые кровяные клетки в течение продолжительных периодов. Мы использовали систему долгоживущей культуры (LTC) человека, разработанную К.Ивз и А.Ивз как для определения количества численности стволовых клеток, так и как средство для манипулирования ими при терапевтическом использовании. Это включает посев клеток на предварительно стабилизированный, облученный адгезивный слой костного мозга человека; эти культуры затем выдерживаются в течение 5 недель. Конечной точкой является общее клоногенное содержание (адгезивных + неадгезивных) клеток культур, собираемых в конце этого времени. Выход клоногенных клеток при этом условии линейно связан с числом первоначально добавленных клеток-предшественников (клетки, инициирующие долгоживущую культуру (LTC-IC)); средний выход от отдельного LTC-IC человека составляет 4 клоногенных клеток-предшественников на LTC-IC. Ранее было показано, что когда костный мозг от пациентов с CML помещается в подобные условия, лейкемические (Ph-положительные) клоногенные клетки быстро убывают. Путем использования количественной оценки остаточных здоровых LTC-IC у пациентов с CML можно выбрать тех пациентов, которые получат пользу от интенсивной терапии, поддерживаемой трансплантацией культивированных аутотрансплантатов (Phillips et al., Bone Marrow Transplantation 8:477-487, 1991).
Следующая процедура использовалась для изучения воздействия INPROL на число клоногенных клеток (LTC-IC) среди клеток трансплантанта костного мозга, полученного из периферийной крови пациента с CML.
Культуры инициировались в качестве долгоживущих культур на предварительно облученной строме. Периферийная кровь здорового донора использовалась в качестве контрольной. Клетки периферийной крови от пациента с CML были предварительно инкубированы с или без pINPROL (25 нг/мл) в течение 4 часов, промывались и помещались в систему LTC-IC на 5 недель для определения контрольного числа LTC-IC. Для экспериментов в течение 10 дней образовывались другие, параллельные структуры. Смесь прилипающих (адгезивных) и неприлипающих (неадгезивных) клеток из культур, выращиваемых в течение 10 дней, была предварительно инкубирована с или без pINPROL и помещалась на заранее стабилизированные питающие организмы на 8 недель дополнительно. Количество LTC-IC из каждой экспериментальной культуры оценивалось высеиванием как прилипающих, так и неприлипающих клеток в метилцеллюлозу с соответствующими факторами роста (Terry Fox Laboratories, Vancouver, Canada) и просчетом получаемого общего числа колониеобразующих клеток. Значения LTC-IC, полученные с использованием данной процедуры, выводились из оценки общего содержания клоногенных клеток (CFC) с использованием формулы
#LTC-IC=#CFC/4.
Данные, представленные на фиг.14, показывают, что не было потери в LTC-IC в течение первых 10 дней культуры, инициированной из костного мозга здорового донора и приблизительно 30% из числа введенных клеток LTC-IC все еще присутствовали в культуре после 5 недель. Число LTC-IC у пациента с хроническим миелоидным лейкозом (CML) значительно снижалось до приблизительно 8% в течение 10-дневного периода и не восстанавливалось после дальнейшей инкубации, в то время как предварительная инкубация клеток с INPROL увеличивала уровень LTC-IC до 30% от первоначального числа и сохраняло его в течение 8 недель.
Клинически приемлемые применения INPROL, которые были предсказаны этими предварительными данными, включают их использование в стратегиях для селективного улучшения содержания здоровой стволовой клетки свежих или культивированных трансплантантов костного мозга, в стратегиях для усиления восстановления остаточных здоровых стволовых клеток in vivo, а также в протоколах для пересадки нового генетического материала в стволовые клетки мозгового вещества человека для дальнейшей трансплантации пациентам.
Пример 12А. Метод выделения иммуноактивного ингибитора пролиферации стволовых клеток из препаратов костного мозга.
Костный мозг выделялся из ребер свиней. Ребра из скелетов свиней отделялись и очищались от мышечных волокон и жира, разрезались на части и костный мозг извлекался гидропрессом, изготовленным Биофизприбор. Клетки костного мозга отделяются центрифугированием в центрифуге К-70 со скоростью 2000 оборотов в минуту в течение 20 минут. Экстракт супернатант затем последовательно подвергается ультрафильтрации через мембраны ХМ-100, РМ-30, РМ-50 фирмы Амикон, США. В соответствии с анализом электрофорезом основным компонентом продукта является альбумин (см. фиг.1).
Биохимическая очистка
Экстракт костного мозга и белковые компоненты фракций анализировались на каждой стадии очистки с помощью электрофореза геля в 10% полиакриламида, содержащего 0,1% додецилсульфата натрия. До 7% додецилсульфата натрия и до 0,5-1% меркаптоэтанола добавлялось к образцам, которые инкубировались в течение 5 минут при 70°С до загрузки в гель.
Электрофорез проводился при выходе 20 см геля в течение пяти часов. Затем гель окрашивался в 0,25% Coomassie CBBC250 в смеси этанол : вода : уксусная кислота 5:5:1 в течение одного часа при 20°С и промывался в нескольких сменах 7% уксусной кислоты. Активность продукта оценивалась методом ингибирования пролиферации кроветворных стволовых клеток (КОЕ-С). Метод детально описан далее.
Стадия 1. Очистка преципитацией с сульфатом аммония.
Активность определялась с помощью преципитации с сульфатом аммония при 25% с насыщением от 40 до 80%, что выбиралось на основании результатов Таблицы 5.
| Таблица 5 |
| Насыщение (%) |
0-40 |
40-60 |
60-80 |
80-100 |
| Активность (%) |
37,2-35,4 |
37,2-1,8 |
37,2-12,8 |
37,2-26,1 |
| |
=1,8% |
=35,4% |
=24,4% |
=11,1% |
Количество препарата, использованного для тестирования, после каждой стадии очистки определялось в соответствии с уровнем очистки и было эквивалентно 2×10-2 мг первоначального продукта. Активность определялась по формуле
% изменения = % Sa-% Sb,
где % Sa является % S в контрольном,
% Sb является % S после инкубации тестовой фракцией.
Фракция обессоливалась для того, чтобы понизить концентрацию сульфата аммония в 20 раз перед каждой проверкой активности и до каждой последующей стадии очистки.
Стадия 2. Неочищенный ингибитор из стадии 1 вводится после обессоливания и фракционируется с использованием ионообменной хроматографии, здесь целлюлоза DEAE 23, и затем элюируется с градиентом буфера ацетата натрия (рН 6,0).
Активные фракции ингибитора элюируют между 3-5 мМ.
Объем колонки составлял 1 мл и скорость элюирования была 4 мл/час. Детектирование производилось хроматографом Милликром при 230 и 280 нм. Фракция 1 (см. фиг.1), которая проявляла наивысшую активность, была изолирована и элюировалась в буфере ацетата натрия (см. Таблицу 6).
| Таблица 6 |
| Фракции |
1 |
2 |
3 |
4 |
5 |
| Активность |
46,3-0 |
46,3-14,1 |
46,3-42,1 |
46,3-19,6 |
46,3-45,1 |
| |
=46,3% |
=32,2% |
=4,2% |
=26,7% |
=1,2% |
Данные электрофореза указывают, что основной загрязнитель белка – альбумин (см. фиг.3) удаляется из данной фракции, что приводит к дополнительной четырехкратной очистке.
Стадия 3. Частично очищенный ингибитор из стадии 2 затем напрямую подается в колонку G-75 Sephadex.
Объем колонки составляет 20 мл (2Х1), скорость элюирования составляет 2 мл/час. Буфер для элюирования представляет собой 50 mM NaCl, 10 mM Tris-HCl, pH 7,5. Детектирование производилось на хроматографе Миллихром при 230 и 280 нм. Фракция 5, которая имела наивысшую активность, выделялась.
| Таблица 7 |
| Фракции |
1 |
2 |
3 |
4 |
5 |
| Активность |
42,1-19,1 |
42,2-35,2 |
42,2-21,5 |
42,2-38,8 |
42,2-0 |
| |
=23,1% |
=7,0% |
=20,7% |
=3,4% |
=42,2% |
Стадия 4. Обращенно-фазовая хроматография (система Pharmacia FPLC) с использованием колонок Pro-REC выполняется на матрице Ультрасфера. Белок элюируется с использованием 0,1% трифторуксусной кислоты в ацетонитрильном градиенте.
Гомогенность продукта с MW16-17kD равна 90%, как показано при анализе гели акриламида/додецилсульфата натрия (см. фиг.6). Результат представлен на фиг.4. Активность определялась по фракции 5. Конечный выход продукта составил 5%. В результате общее количество белка с MW 16kD после очистки составляет 650 нг/мл исходного продукта. Во время процесса очистки продукт подвергался горячей инкубации при 70°С, но не была обнаружена потеря биологической активности.
Пример 12В. Альтернативный метод выделения больших количеств INPROL.
Первоначальная изоляция
Ребра из свежих скелетов свиней очищаются от мышечных волокон и жира, затем разрезаются на части и погружаются в фосфатный буферный физиологический раствор в соотношении 1:1 (вес/объем). Полученная смесь измельчается гидравлическим прессом для отделения костного мозга от твердого материала кости.
Суспензия клеток костного мозга собирается и фильтруется от твердых частиц через четыре слоя ситовой ткани. Фильтрат инкубируется при 56°С в течение 56 минут, затем охлаждается в ледяной ванне до 4°С. Получаемый преципитат удаляется центрифугированием при ускорении 10000 g в течение 30 минут при 4°С и выбрасывается.
Очищенный супернатант добавляется по каплям в течение 40 минут к 10 объемам перемешиваемого холодного ацетона, содержащего 1% по объему концентрированной соляной кислоты. Получающаяся смесь хранится при 4°С в течение 16 часов для полного образования преципитата. Затем преципитат гранулизируется центрифугированием при ускорении 20000 g в течения 30 минут при 4°С. Эта гранула промывается ацетоном холодным ацетоном и сушится.
Очистка жидкостной хроматографией высокого разрешения (ЖХВР)
Гранула растворяется в элюирующем буфере А, предназначенном для жидкостной хроматографии высокого разрешения (ЖХВР), содержащем 5% ацетонитрила (MeCN) и 0,1% трифторуксусной кислоты (TFA) до конечной концентрации белка, составляющей 8-10 мг/мл. Этот раствор (0,5-0,6 мл) загружается в колонку жидкостной хроматографии высокого разрешения (ЖХВР), размером 250×4,6 мм, уплотняется Полизил ODS-300 (10 мсм) и уравновешивается тем же буфером А.
Элюирование осуществляется градиентом буфера В (90% MeCN, 0,1% TFA) в буфере А со скоростью потока 1 мл/мин в соответствии со следующей программой:
| Время, мин |
% В |
| 0 |
0 |
| 4 |
0 |
| 5 |
25 |
| 25 |
90 |
Используется дополнительная стадия из 100% буфера В в течение 5 минут для промывки колонки до повторного уравновешивания. Затем колонка вновь уравновешивается для того, чтобы вернуть ее в первоначальное состояние, и может быть загружена следующая порция белкового раствора. Типичная хроматограмма показана на фиг.5.
Во время сепарации поток из колонки контролируется при 280 нм для детектирования белковых пиков. Фракции, содержащие белковый материал, собираются, отделенные пики группируются и ротационно выпариваются при 30°С до сухости. Полученные осадки растворяются в дистиллированной воде и анализируются с помощью проверки биологической активности и с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) (14% гель, редуцирующие условия). Пик, содержащий активный материал, элюируется между 70 и 80% буфера В и содержит основную белковую зону 16 kD и следы более быстро перемещающихся белков, проанализированных с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE).
Анализ материала, полученного сбором только второго крупного пика жидкостной хроматографии, показан на фиг.15 (А и С). Материал, содержащий оба пика (например, фиг.5) будет называться здесь Препарат IpINPROL, а содержащий только второй пик, будет называться Препарат 2 pINPROL. 500  г данного активного очищенного препарата 2pINPROL загружалось в обращеннофазовую колонку С4 и элюировалось с использованием градиента 59,5% ацетонитрила в 0,1% трехфтороуксусной кислоты. Материал элюировался в виде отдельного пика при 53% ацетонитрила (фиг.15А). Однако, когда 250 г данного активного очищенного препарата 2pINPROL загружалось в обращеннофазовую колонку С4 и элюировалось с использованием градиента 59,5% ацетонитрила в 0,1% трехфтороуксусной кислоты. Материал элюировался в виде отдельного пика при 53% ацетонитрила (фиг.15А). Однако, когда 250  г MIP-1 г MIP-1 (Системы исследований и разработок) перегонялось при идентичных условиях, он элюировал при 43,9% ацетонитрила (фиг.15В, обратите внимание на то, что более ранние пики до 14% ацетонитрила являются артефактными и вызываются пузырьками воздуха в детекторе). Таким образом, естественно встречающийся INPROL значительно более гидрофобный, чем MIP-1 (Системы исследований и разработок) перегонялось при идентичных условиях, он элюировал при 43,9% ацетонитрила (фиг.15В, обратите внимание на то, что более ранние пики до 14% ацетонитрила являются артефактными и вызываются пузырьками воздуха в детекторе). Таким образом, естественно встречающийся INPROL значительно более гидрофобный, чем MIP-1 при данных условиях. Известно, что TGF при данных условиях. Известно, что TGF элюирует при более низких концентрациях, чем наблюдаемые для pINPROL при этих условиях (Miyazono et al., J. Biol. Chem. 263:6407-15, 1988). элюирует при более низких концентрациях, чем наблюдаемые для pINPROL при этих условиях (Miyazono et al., J. Biol. Chem. 263:6407-15, 1988).
Гель элюированного материала pINPROL показан на фиг.15С. Ряд 1 представляет собой исходный материал, ряд 2 представляет собой маркеры молекулярного веса и ряд 3 представляет собой очищенный материал. Имеются две крупные зоны, одна у приблизительно 14kD и одна – у приблизительно 35 kD. Считается, что зона 35 kD является мультимерной формой зоны 14 kD.
Пример 13А. Активные препараты INPROL содержат бета-цепочку гемоглобина.
pINPROL был подготовлен, как показано на фиг.5 (т.е. Препарат 1 pINPROL (см. Пример 12В)). Материал подвергался электрофорезу в полиакриламидном геле с додецилсульфатом натрия и переносился в нитроцеллюлозу с использованием стандартных методов. Материал подвергался анализу N-терминальной последовательности с использованием секвенсера белков АВ 477А с неавтономным анализатором РТН-АА на 120А при использовании стандартных методов. Была получена следующая N-терминальная последовательность:
VHLSAEEKEAVLGLWGKVNVDEV…
Компьютерный поиск баз данных для белков обнаружил, что данная последовательность имеет идентичность с N- терминальной последовательностью бета-цепочки гемоглобина свиней (сравни фиг.16С).
Пример 13В. Активные препараты INPROL содержат альфа-цепочку гемоглобина.
Как показано на фиг.15С, белок, очищенный сбором второго крупного пика, показанного на фиг.15 (т.е. Препарат 2pINPROL), приводил к возникновению двух крупных полос, соответствующих молекулярным весам приблизительно 15 К и 30 К, а также нескольких более мелких полос. Гели SDS-PAGE переносились в нитроцеллюлозу путем использования стандартных методов, а отдельные полосы возбуждались и подвергались анализу N-терминальной последовательности, как показано в Примере 13А. Для зоны 15 kD была получена следующая N-терминальная последовательность:
VLSAADKANVKAAWGKVGGQ…
Зона 30 kD затем подвергалась ограниченной протеолитической переработке и получалась следующая внутренняя цепочка: ** FPHFNLSHGSDQVK…
Первая последовательность демонстрирует идентичность с N-терминальной последовательностью альфа-гемоглобина свиней, в то время как вторая последовательность демонстрирует идентичность с остатками 43-56 альфа-цепочки гемоглобина свиней (см. фиг.16С для сравнения последовательности альфа- и бета-цепочки человека, мыши и свиньи). Повторное определение последовательности этих полос, а также некоторых из более мелких полос, постоянно давало части последовательности альфа-глобина. Таким образом, различные полосы, наблюдаемые на фиг.15С, представляют собой либо фрагменты, либо совокупности альфа-гемоглобина свиньи.
Пример 13С. Дальнейшая характеристика INPROLa свиньи.
Для того чтобы произвести дальнейшее сравнение pINPROL с гемоглобином свиньи, дважды кристаллизованный гемоглобин свиньи был получен от химической компании Сигма Кемикал Компани и был подвергнут обращенно-фазовой жидкостной хроматографии, описанной в Примере 12В для фиг.15. Как видно на фигуре 17, хроматограмма неповрежденного гемоглобина подобна хроматограмме для Препарата 1pINPROL. Далее, при прямом сравнении оказывается, что Препарат 2pINPROL, показанный на фиг.17А (т.е. полученный из второго пика фиг.5), перекрывается с препаратом, показанным для вторых двух пиков гемоглобина свиньи (фиг.17В), при этом время удержания для крупных пиков составляло соответственно 52,51 и 52,25 минут. Следует отметить, что гем ко-мигрирует с первым крупным пиком в гемоглобине, в данном случае при 49,153 минут; гем поэтому является компонентом Препарата 1pINPROL, но не Препарата 2. Это подтверждается отсутствием абсорбции данного препарата pINPROL при 575 нм, длине волны, диагностирующей присутствие гема.
Прогнозируемые молекулярные веса альфа- и бета-цепочек гемоглобина свиньи составляют соответственно 15038 и 16034 Дальтон. Как видно из хроматограммы SDS-PAGE на фиг.18, первые два пика состоят из цепочки с более высоким молекулярным весом, а вторые два состоят из цепочки с более низким молекулярным весом. Таким образом, первые два пика, очевидно, представляют бета-цепочку гемоглобина и вторые два пика представляют альфа-цепочку гемоглобина.
Дополнительные сепарации гемоглобина свиньи выполнялись с использованием пологого градиента элюирования (фиг.21). N-Терминальные анализы этих пиков продемонстрировали, что первый пик является альфа-цепочкой свиньи, а второй пик представляет собой бета-цепочку свиньи. Результаты биопробы подтверждают, что обе выделенные цепочки гемоглобина являются биологически активными (например, примеры 14 и 15).
Для того чтобы далее сравнить препарат 2pINPROL и бета-цепочку гемоглобина, проводился 2-мерный электрофорез. В качестве первого измерения проводилось изоэлектрическое фокусирование в стеклянных пробирках с использованием 2% амфолинов с рН 4-8 в течение 9600 вольт часов. Тропомиозин (MW 33 kD, pI 5,2) использовался в качестве внутреннего стандарта; его положение отмечается на конечном геле 2D стрелкой. Гель пробирки уравновешивалась в буфере и прилеплялась к верхней части концентрирующего геля поверх 12,5% акриламидного вязкого геля. Электрофорез вязкого геля додецилсульфата натрия проводился в течение 4 часов при 12,5 мА/гель. Гели были окрашены серебром и высушены.
Сравнение картин двухмерного электрофореза выявило только одно или два небольших пятна, которые имеют отличия между очищенной жидкостной хроматографией бета-цепочкой гемоглобина и препаратом 2pINPROL. Западные анализы с использованием антител антисвиного гемоглобина и одномерного или двухмерного электрофореза подтверждают присутствие бета-гемоглобина в препарате. Таким образом, активный препарат 2 pINPROL, приготовленный в соответствии с Примером 12В, по сути является бета-цепочкой свиного гемоглобина.
Пример 14. Альфа-цепочка гемоглобина, бета-цепочка гемоглобина или неповрежденный гемоглобин проявляют ингибирующую стволовую клетку активность.
Чтобы подтвердить, что бета-цепочка гемоглобина обладает активностью INPROL, проводился суицидный анализ с использованием костного мозга обработанных тестостероном мышей при использовании методологии, описанной в Примере 1, с использованием материала, очищенного, как в примере 12 В. Как показано в Таблице 8, 15% клеток костного мозга нормальных мышей были убиты по сравнению с 36% у животных, обработанных тестостероном. Как и ожидалось, это указывало, что лечение тестостероном увеличивает процент клеток в цикле (тем самым делая их более подверженными умерщвлению, например, Пример 1). По резкому контрасту клетки от обработанных тестостероном животных, инкубированные с pINPROL или с бета-цепочкой очищенного гемоглобина при 40 нг/мл демонстрировали значительное снижение процента клеток в цикле, соответственно с 36% до 0% и 7%. Более высокая доза, составляющая 200 нг, была менее эффективна для обоих белков. Использовавшийся для контроля положительного влияния ранее охарактеризованный ингибитор стволовой клетки MIP-1 снижал циклирование до 13%. снижал циклирование до 13%.
Подобный же анализ может быть выполнен in vitro, используя циклирующее состояние колониеобразующих единиц смешанного типа (КОЕмикст) вместо КОЕ-С. Анализ выполняется так же, как описывалось выше для анализа КОЕ-С, за исключением того, что цитозин арабинозид (AraC, 30 микрограмм/мл) используется в качестве специфического для цикла токсического средства вместо насыщенного интенсивной дозой трития тимидина (см. B.I.Lord in Haemopoiesis – A Practical Approach. N.G. Testa and G Molineux (Eds.), IRL Press 1993; Pragnell et al., in Culture of Hematopoietic Cells. R.I. Pragnell and M.G. Freshey (Eds), Wiley Liss, 1994) и штамм мыши с высокими нормами эндогенного циклирования (Balb/c) используется вместо обработанных тестостероном мышей BDF1. Как показано в Таблице 9, сильно очищенная свиная бета-цепочка или сильно очищенная свиная альфа-цепочка обе активны в данном анализе. Обратите внимание, что в данном анализе уровни циклирования клеток, обработанных pINPROL, иногда имеют отрицательные числа, что указывает на наличие большего количества колоний в обработанном Ara С пуле клеток, чем в необработанном пуле.
Как описано в примере 2, pINPROL ингибирует пролиферацию линии мышиных стволовых клеток FDCP-MIX в анализе поглощения с обработанным тритием тимидином. Фиг.20 демонстрирует, что очищенные альфа- или бета-цепочки гемоглобина обе активны в данном анализе, с ингибированием, заметным при <2 нг/мл.
Предшествующее описание предоставляет свидетельство того, что бета-цепочка свиного гемоглобина проявляет активность INPROLa. Другие данные (например, Таблица 9, фиг.20) демонстрируют, что изолированная альфа-цепочка также, как и неповрежденный гемоглобин, активны в качестве ингибиторов стволовой клетки. Активные препараты также включают смеси альфа- и бета-цепочек (например, фиг.5).
Наблюдения, что изолированная цепочка альфа-глобина и/или изолированная цепочка бета-глобина являются активными, указывают на то, что описанные здесь активности не требуют трехмерной структуры неповрежденного гемоглобина. Фрагменты альфа- и бета-цепочки также активны в качестве ингибиторов и стимуляторов стволовой клетки.
| Таблица 8 |
| Обработка |
% умерщвления |
| NBM1 |
15 |
| ТРВМ2 |
36 |
| pINPROL 200 нг/мл |
23 |
| 40 нг/мл |
0 |
| Hbg3 200 нг/мл |
25 |
| 40 нг/мл |
7 |
MIP-1 200 нг/мл 200 нг/мл |
13 |
1 NBM = нормальный костный мозг,
2 ТРВМ = костный мозг от обработанных тестостероном мышей,
3 Hgb = очищенная обращенно-фазовой хроматографией С4 бета-цепочка гемоглобина свиньи (полученная из 2Х кристаллизованного гемоглобина свиньи) |
| Таблица 9 |
| Обработка |
% умерщвления |
| Контроль1 |
43 |
| Свиная альфа-цепочка2 |
-4 |
| Свиная бета-цепочка2 |
-14 |
1 Контроль – костный мозг от мышей Balb/с.
2 100 нг/мл (очищено, как на фиг.12). |
Пример 15. Очищенный INPROL, очищенный свиной альфа-гемоглобин или очищенный свиной бета-гемоглобин активны in vivo.
Для того чтобы проверить способность очищенных цепочек свиного гемоглобина проявлять активность in vivo, мышам BDF1 был введен тестостерон пропиоат, как описано в Примере 1. Через двадцать четыре часа мыши получали внутривенно 500 нг либо pINPROL, альфа-цепочки свиного гемоглобина (очищенной от периферийных красных кровяных клеток, как на фиг.12), бета-цепочки свиньи (очищенной от периферийных красных кровяных клеток, как на фиг.12), либо эквивалентный объем носителя. Через сорок восемь часов собирался костный мозг от каждой мыши и проводился анализ колониеобразующих единиц смешанного типа (КОЕмикст), как описано в примере 14. Как показано в таблице 10, pINPROL, альфа-цепочка свиньи и бета-цепочка свиньи были все активны in vivo, снижая процент КОЕмикст в цикле до базовых уровней.
| Таблица 10 |
| Обработка |
% умерщвления |
| Контроль1 |
45 |
| pINPROL2 |
5 |
| Свиная альфа-цепочка2 |
5 |
| Свиная бета-цепочка2 |
-5 |
| Базовый3 |
4 |
1 Контроль – костный мозг от мышей BDF1, обработанных тестостероном.
2 100 нг/мл (очищено, как на фиг.12).
3 Базовый – костный мозг от необработанных мышей BDF1. |
Пример 16. Очищенная альфа-цепочка гемоглобина человека, альфа-цепочка биотинилированного гемоглобина человека, бета-цепочка биотинилированного гемоглобина человека, гамма-цепочка гемоглобина человека – все они проявляют ингибирующую активность по отношению к стволовой клетке in vitro.
Гемоглобин человека получали либо от корпорации Сигма Кемикал Корпорейшен, либо он выделялся стандартными средствами из периферийной крови взрослого человека или крови пуповины. Индивидуальные цепочки изолировались обращенно-фазовой жидкостной хроматографией образом, подобным описанному выше для альфа- и бета-цепочки свиньи (см. В.Masala and L.Methods in Enzymology, том 231, стр.21-44, 1994). Были получены очищенные альфа-, бета-, гамма- и дельта-цепочки. Для биотинилированных альфа- и бета-цепочек 1 мг гемоглобина взрослого человека обрабатывался 37  г Биотина NHS LC (Пирс), и цепочки разделялись обращенно-фазовой хроматографией, как описано выше. г Биотина NHS LC (Пирс), и цепочки разделялись обращенно-фазовой хроматографией, как описано выше.
Как показано в Таблицах 11, 12 и 13, очищенная альфа-цепочка человека, биотинилированная альфа-цепочка человека, гамма- и дельта-цепочки человека – все активны в анализе циклирования КОЕмикст.
| Таблица 11 |
| Обработка |
% умерщвления |
| Контроль1 |
49 |
| Альфа-цепочка человека2 |
-1 |
| Бета-цепочка человека2 |
41 |
| Гамма-цепочка человека2 |
-63 |
1 Контроль – костный мозг от мышей Balb/c.
2 100 нг/мл (очищено, как на фиг.12). |
| Таблица 12 |
| Обработка |
% умерщвления |
| Контроль1 |
47 |
| Гамма-цепочка человека2 |
12 |
| Дельта-цепочка человека2 |
-4 |
| 1 Контроль – костный мозг от мышей Balb/c. |
| 2 100 нг/мл (очищено, как на фиг.12). |
| Таблица 13 |
| Обработка |
% умерщвления |
| Контроль1 |
68 |
| Альфа-цепочка человека2 |
19 |
| Биотинилированная альфа-цепочка2 |
7 |
| Бета-цепочка человека2 |
55 |
| Биотинилированная бета-цепочка 2 |
25 |
1 Контроль – костный мозг от мышей Balb/c.
2 100 нг/мл (очищено, как на фиг.12). |
Пример 17. Очищенная альфа-цепочка человека, димер альфа-бета- или гемоглобин активны in vivo.
Очищенная альфа-цепочка, димер альфа-, бета- или гемоглобин испытывались в анализе in vivo, как описано в Примере 15. Как показано в Таблице 14, каждый из них был активен при концентрации 500 нг/мышь.
| Таблица 14 |
| Обработка |
% умерщвления |
| Контроль1 |
49 |
| Альфа-цепочка человека |
-22 |
| Димер альфа-бета-цепочка человека |
14 |
| Гемоглобин человека |
-31 |
| 1 Контроль – костный мозг от мышей BDF1, обработанных тестостероном. |
Пример 18. Свиной INPROL действует на мононуклеарные клетки человека или клетки пуповины CD34+in vitro.
Для того чтобы исследовать способность очищенного INPROL из свиного костного мозга влиять на прохождение цикла клетками- предшественниками человека, были получены кровяные клетки пуповины. Использовались либо общая мононуклеарная клеточная фракция, полученная после сепарации на Ficoll, либо фракция CD34+, полученная после фракционализации на анти CD34 аффинитетных колонках (CelloProInc.). Клетки инкубировались в течение 48 часов in vitro в присутствии интерлейкина 3 (IL-3) и фактора стволовых клеток (SCF) (100 нг/мл каждый) для того, чтобы обеспечить, чтобы недифференцированные стволовые клетки находились в цикле. После их предварительной инкубации были проведены анализы цикличности, как описано в Примере 14 для мыши, за исключением того, что просчитывались КОЕ-ГЭММ (вместо КОЕмикст) в день 18 после высевания. Как показано в Таблице 15, свиной INPROL ингибировал циклирование КОЕ-ГЭММ либо в основных мононуклеарных клетках, либо в фракции CD34+.
| Таблица 15 |
| |
Обработка |
% умерщвления |
| Мононуклеарные клетки |
|
|
| |
Контроль |
93 |
| |
pINPROL1 |
16 |
| Клетки CD34+ |
Контроль |
41 |
| |
pINPROL1 |
21 |
| 1 100 нг/мл. |
Пример 19. Очищенный альфа-гемоглобин человека воздействует на колониеобразующую единицу гранулоцитов-эритроцитов-макрофагов-мегакариоцитов (КОЕ-ГЭММ) человека.
Мононуклеарные клетки пуповины человека были получены и инкубировались в IL-3 и факторе стволовых клеток (SCF) и использовались в анализе циклирования, как описано в примере 18. Как показано в таблице 16, как свиной INPROL, очищенный от костного мозга, так и альфа-гемоглобин человека, очищенный от периферийной крови, были активны в данном анализе.
| Таблица 16 |
| Обработка |
% умерщвления |
| Контроль |
100 |
| pINPROL1 |
-6 |
| Альфа-цепочка человека1 |
-23 |
| 1 100 нг/мл. |
Пример 20. Пептиды, полученные из последовательностей альфа-гемоглобина человека и из бета-гемоглобина человека являются активными.
Для идентификации активных последовательностей пептидов трехмерная структура миоглобина (который не активен в данном анализе) накладывалась на природную трехмерную структуру альфа-цепочки, присутствующей в гемоглобине взрослого человека, путем использования программы компьютерного моделирования. Было идентифицировано два пептида (представляющих аминокислоты 43-55 и 64-82, которые являются участками, которые структурально отличаются от миоглобулина в трехмерном пространстве) как имеющие активность при анализе циклирования КОЕмикст. Для того чтобы более близко аппроксимировать петлю, обнаруживаемую в природной альфа-цепочке, была также синтезирована циклическая производная пептида 43-55 (с43-55) (используя дисульфидную связь), и она оказалась активной.
Последовательность этих пептидов следующая:

Испытывались две последовательности геморфина, геморфин 10 (аминокислоты 32-41 последовательности бета-цепочки) и геморфин 7 (аминокислоты 33-40) и они были найдены активными.
Последовательности следующие:
| Геморфин 10 |
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe |
| Геморфин 7 |
Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg |
Для проверки активности этих последовательностей был проведен анализ циклирования, описанный в Примере 14. Как показано в Таблицах 17-19, все эти пептиды активны в данном анализе.
| Таблица 17 |
| Обработка |
% умерщвления |
| Контроль |
47 |
| pINPROL1 |
0 |
| Пептид (43-55) |
|
| |
100 нг/мл |
2 |
| |
10 нг/мл |
18 |
| |
1 нг/мл |
11 |
| 1 100 нг/мл |
| Таблица 18 |
| Обработка |
% умерщвления |
| Контроль |
43 |
| Пептид (43-55)1 |
5 |
| Пептид (64-82)1 |
9 |
| Геморфин 101 |
1 |
| Геморфин 71 |
0 |
| 1 Все пептиды тестировались при 100 нг/мл |
| Таблица 19 |
| Обработка |
% умерщвления |
| Контроль |
47 |
| Циклический пептид (43-55)1 |
0 |
| 1 Тестировались при 100 нг/мл. |
Пример 21. Пептид, полученный из альфа-гемоглобина человека путем расщепления муравьиной кислоты, является активным.
Альфа-гемоглобин человека имеет место расщепления муравьиной кислоты между позициями аминокислоты 94 и 95 (Asp-Pro). Расщепление достигалось путем инкубирования очищенной альфа-цепочки человека (как в Примере 16) при концентрации 1 мг/мл в 70% муравьиной кислоты в течение 72 часов при 37°С. Фрагмент 1-94 очищался от нерасщепившейся альфа-цепочки и фрагмент 95-141 проходил обращенно-фазовую жидкостную хроматографию, как в Примере 16; фракции получали электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) (как в Примере 22). Идентичность очищенного фрагмента белка 1-94 была подтверждена электрораспылительной ионизационной масс-спектрометрией.
Для оценки ингибирующей стволовую клетку активности данного фрагмента используется анализ циклирования КОЕмикст, как показано в Примере 14.
| Таблица 20 |
| |
Обработка |
% умерщвления |
| |
Контроль1 |
50 |
| |
Альфа- человека2 |
12 |
| |
Фрагмент 1-943 |
0 |
1 Костный мозг Balb/c.
2 Очищенный, нерекомбинантный альфа-гемоглобин человека, как в Примере 16 (100 нг/мл).
3 Очищенный расщепленный муравьиной кислотой белок, как в настоящем Примере (100 нг/мл). |
Пример 22. Выражение альфа-цепочки гемоглобина, полипептида 1-141, полипептида 1-97, пептида 43-55 и пептида с(43-55) в Е.coli в качестве слитых белков убихитина.
Гены для пептидов 43-55 (“р13”) и с43-55 (“р15”) (как в примере 20) синтезировались отжигом соответствующих олигонуклеотидов в соответствии с оптимальным использованием кодона Е.coli (Anderssen and Kurland, Micro. Revies 54:198-210, 1990). Ген неповрежденной цепочки альфа-гемоглобина человека (“р141”) был получен путем конструирования группы олигомерных комплексов для амплификации полимеразной реакции синтеза цепи из пула кДНК костного мозга человека (Clontech, Palo Alto, СА). Ген для фрагмента 1-97 (“1-97”) был получен путем амплификации полимеразной реакции синтеза цепи плазмида, содержащего ген р141, после соответствующего клонирования.
Вышеупомянутые гены были выражены в качестве слитого белка убихитина (см. Патенты США 5132213; 5196321 и 5391490 и РСТ WO 91/17245). Штамм-хозяин (акцептор), E-coli DH5 FIQ (Life Technologies, Inc., Gaithersburg, MD) трансформировался с помощью вектора экспрессии убихитина, pDSUb, содержащего соответственно синтезированный ген (вышеупомянутый). pDSUb является производным pDS78/RBSII, который выражает убихитин человека (фиг.22А) (Hochuli et al., Biotechnology 6:1321-5, 1988). Лоэтшер и др. (JBC 266:11213-11220, 1991) модифицировали pDS78/RBSII путем эксцизионирования последовательностей хлорамфеникол ацетил трансферазы (CAT) из плазмиды Хочули и изгнания плазмиды (фиг.22В). Синтетический ген убихитина был сконструирован путем парного отжига полученных киназой синтетических олигонуклеотидов, кодирующих убихитин человека, с использованием кодона, оптимизованного для бактериальной экспрессии. pDSUb был затем сконструирован путем инсерции синтезированного гена убихитина, состоящего из собранных олигонуклеотидов, в дефосфолированный гидролизат Кленоу Bam Hl-Bgl II дериватизированного pDS7/RBSII. Было показано, что получаемая в результате плазмида, pDSUb, (фиг.22С) выражает убихитин на высоком уровне в Е.coli. FIQ (Life Technologies, Inc., Gaithersburg, MD) трансформировался с помощью вектора экспрессии убихитина, pDSUb, содержащего соответственно синтезированный ген (вышеупомянутый). pDSUb является производным pDS78/RBSII, который выражает убихитин человека (фиг.22А) (Hochuli et al., Biotechnology 6:1321-5, 1988). Лоэтшер и др. (JBC 266:11213-11220, 1991) модифицировали pDS78/RBSII путем эксцизионирования последовательностей хлорамфеникол ацетил трансферазы (CAT) из плазмиды Хочули и изгнания плазмиды (фиг.22В). Синтетический ген убихитина был сконструирован путем парного отжига полученных киназой синтетических олигонуклеотидов, кодирующих убихитин человека, с использованием кодона, оптимизованного для бактериальной экспрессии. pDSUb был затем сконструирован путем инсерции синтезированного гена убихитина, состоящего из собранных олигонуклеотидов, в дефосфолированный гидролизат Кленоу Bam Hl-Bgl II дериватизированного pDS7/RBSII. Было показано, что получаемая в результате плазмида, pDSUb, (фиг.22С) выражает убихитин на высоком уровне в Е.coli.
Плазмида, содержащая р97, и плазмида, содержащая р141, были сконструированы путем инсерции Afl II-Pst I, расщепленных продуктов полимеразной реакции синтеза цепи, кодирующих белок р97 и р141, и соединения слиянием, при прямом клонировании, в pDSU, который расщеплялся с Afl II и Pst I. Подобным же образом плазмида, содержащая р13, и плазмида, содержащая р15, была сконструирована путем инсерции киназеированных и отожженных олигонуклеотидов, имеющих соответствующие липкие концы и кодирующих стык пептида и соединение слиянием, в pDSUb, расщепленном Afl II-Pst I.
Селекция трансформантов производилась с помощью 100  г/мл ампицилина, 5 г/мл ампицилина, 5  г/мл неомицина, при этом колонии появлялись после двух дней при 30°. Трансформанты сортировались полимеразно-цепьевой реакцией вдоль места инсерции. Колонии, содержащие инсерционные сегменты правильного размера, затем сортировались по экспрессии слитого белка соответствующего размера с помощью электрофореза SDS-PAGE (см. ниже). Слияние убихитина было сверхпродуцировано путем добавления IPTG, который осуществляет титрование белка репрессора lac, удаляя его из промотера pDSUb (DH5 г/мл неомицина, при этом колонии появлялись после двух дней при 30°. Трансформанты сортировались полимеразно-цепьевой реакцией вдоль места инсерции. Колонии, содержащие инсерционные сегменты правильного размера, затем сортировались по экспрессии слитого белка соответствующего размера с помощью электрофореза SDS-PAGE (см. ниже). Слияние убихитина было сверхпродуцировано путем добавления IPTG, который осуществляет титрование белка репрессора lac, удаляя его из промотера pDSUb (DH5 F’IQ содержит позитивно регулированный ген lacIq на факторе F1, который отбирается с помощью 10 F’IQ содержит позитивно регулированный ген lacIq на факторе F1, который отбирается с помощью 10  г/мл неомицина). г/мл неомицина).
Была приготовлена плазмида ДНК из клонов, которые отличались сверхпродуцированным индуцированным слитым белком убихитина, и она была секвенирована методом дидеоксии с использованием комплекта секвенатора версии 2.0 (Юнайтед Стейтс Биокемикал). Положительные клоны затем замораживались и хранились в глицерине при -80°С. Положительные клоны сохранялись на лабораторных планшетах, содержащих ампицилин (100  г/мл), неомицин (10 г/мл), неомицин (10  г/мл) и 1% глюкозы при 30°С. Они еженедельно подвергались штриховой разводке с до 10 переносами, после чего свежий штрих отбирался из замороженной пробирки с посевом для последовательного культивирования, чтобы обеспечить аутентичность штамма. г/мл) и 1% глюкозы при 30°С. Они еженедельно подвергались штриховой разводке с до 10 переносами, после чего свежий штрих отбирался из замороженной пробирки с посевом для последовательного культивирования, чтобы обеспечить аутентичность штамма.
Для получения белка для анализа 100 мл начальных культур в 250 мл встряхиваемых колбах выращивались из моноколоний с помощью круглосуточной инкубации (16-20 часов) в среде 2×YT с ампицилином (100  г/мл), неомицином (10 г/мл), неомицином (10  г/мл) и 1% глюкозы. Культуры в встряхиваемых колбах сохранялись при 30°С и при 250 оборотах в минуту в встряхиваемом инкубаторе с искусственным климатом Нью Брунсвик. На следующее утро культура разбавлялась до 1 литра средой. Клетки индуцировались добавлением IPTG до 1 мМ (окончательное разведение) при OD600=0,5 и собирались при OD600=0,8 центрифугированием. Собранные клетки ресуспендировались в гипотонном лизисном буфере (100 г/мл) и 1% глюкозы. Культуры в встряхиваемых колбах сохранялись при 30°С и при 250 оборотах в минуту в встряхиваемом инкубаторе с искусственным климатом Нью Брунсвик. На следующее утро культура разбавлялась до 1 литра средой. Клетки индуцировались добавлением IPTG до 1 мМ (окончательное разведение) при OD600=0,5 и собирались при OD600=0,8 центрифугированием. Собранные клетки ресуспендировались в гипотонном лизисном буфере (100  л от 50 мМ Tris, pH 10,0). Бактериальные клетки лизировались путем подвергания суспензии трем циклам замораживания – оттаивания (сухая ледяная этаноловая ванна для замораживания и 60°С для оттаивания). Суспензия затем разрушалась ультразвуком в течение 10 мин и центрифугировалась при 12000 g в течение 10 минут. Получаемый в результате супернатант обозначался как “S1”. Дебфиг.затем ресуспендировался в буфере с загрузкой трицина 50 мМ Tris и 2×SDS (Novex, San Diego, CA) (1:1). Смесь затем нагревалась при 95°С в течение 15 минут и центрифугировалась при 12000 g в течение 10 минут. Порция преципитата, способная ресолюбилизироваться таким образом, была названа “Р1”. Порция преципитата, дериватизированная из оставшегося дебфиг.ам была названа “Р2”. Р2 ресуспендировался в загрузочном буфере, как и Р1. Образцы из S1, Р1 и Р2 анализировались с помощью электрофореза SDS-PAGE. л от 50 мМ Tris, pH 10,0). Бактериальные клетки лизировались путем подвергания суспензии трем циклам замораживания – оттаивания (сухая ледяная этаноловая ванна для замораживания и 60°С для оттаивания). Суспензия затем разрушалась ультразвуком в течение 10 мин и центрифугировалась при 12000 g в течение 10 минут. Получаемый в результате супернатант обозначался как “S1”. Дебфиг.затем ресуспендировался в буфере с загрузкой трицина 50 мМ Tris и 2×SDS (Novex, San Diego, CA) (1:1). Смесь затем нагревалась при 95°С в течение 15 минут и центрифугировалась при 12000 g в течение 10 минут. Порция преципитата, способная ресолюбилизироваться таким образом, была названа “Р1”. Порция преципитата, дериватизированная из оставшегося дебфиг.ам была названа “Р2”. Р2 ресуспендировался в загрузочном буфере, как и Р1. Образцы из S1, Р1 и Р2 анализировались с помощью электрофореза SDS-PAGE.
Гели SDS-PAGE прогонялись с использованием трицинной системы с двумя буферами в устройстве для мини гелей с 10-20% гелей трицина (Novex). Анодный (нижний) буфер представлял собой 0,2 М Tris, pH 9,0. Катодный (верхний) буфер представлял собой 0,1 М Tris, о,1 Трицин, 0,1% SDS, pH 8,25. Использовался имеющийся в продаже маркер молекулярного веса “Мульти-Марк” (Новекс). Свиной убихитин, используемый в качестве стандарта, покупался у компании Сигма. Гели прогонялись при постоянном токе 4 мА до тех пор, пока цветной маркер не достигал низа гели. Гели окрашивались с помощью 0,25% красителя Coomassie Blue R 250 (фирма Сигма) в растворе уксусной кислоты : метанола (10% : 40%) и обесцвечивались в том же растворе без красителя.
Большая часть (>70%) неповрежденного слитого белка р141-убихитин обнаруживалась в преципитате (Р1 и Р2) после центрифугирования бактериального лизата. Значительно отличаясь от этого, большая часть (>70%) слитого белка р97-убихитин обнаруживалась в растворимой фракции (S1). Это подтверждало, что удаление С-терминального гидрофобного участка приводило к появлению продукта с улучшенными характеристиками растворимости. Подобным же образом пептиды р13 и р15 также сохранялись в растворимой фракции.
Фермент убихиназы UCH-L3 (Recksteiner, M. (Ed) Ubiquitin, Plenum Press (NY) 1988; Wilkinson et al., Science 246:670-73, 1989) был выражен в pRSET (Invitrogen, San Diego, CA) и он использовался для трансформации штамма-хозяина (акцептора) BL12/DE3. UCH-L3 является специфической для убихитина протеазой, которая расщепляется на С-терминальном удлинняющем сегменте убихитина. Он был частично очищен из бактериальных лизатов с помощью преципитации 35% (вес/объем) сульфата аммония. Точный процент используемого сульфата аммония контролировался SDS-PAGE на присутствие полосы 25,5 kD. Супернатант диализировался относительно 50 мМ Tris, pH 7,4, и анализировался относительно субстрата слияния пептида убихитина. Была взята аликвотная проба активного супернатанта и она замораживалась при -20°С. Типичная для прохождения реакции смесь содержит 3  л лизата, 1 л лизата, 1  л 1М DTT, 1 л 1М DTT, 1  л UCH-L3 (как вышеупомянуто) и 5 л UCH-L3 (как вышеупомянуто) и 5  л буфера реакции (50 мМ Tris, pH 7,4). Реакция проводилась при комнатной температуре в течение 20 минут. Для крупного ферментативного расщепления 300 л буфера реакции (50 мМ Tris, pH 7,4). Реакция проводилась при комнатной температуре в течение 20 минут. Для крупного ферментативного расщепления 300  л лизата смешивалось с 100 л лизата смешивалось с 100  л 1b DTT, 20 л 1b DTT, 20  л UCH-L3 и 580 л UCH-L3 и 580  л буфера реакции. л буфера реакции.
Пептиды или белки, содержащиеся в растворимой (S1) фракции далее очищались обращенно-фазовой жидкостной хроматографией высокого разрешения (ЖХВР), как в примере 16; фракции контролировались электрофорезом SDS-PAGE и их идентичность подтверждалась электрораспылительной ионизационной масс-спектрометрией (см. ниже). Как и выше, очищенные пептиды или протеины ферментативно расщеплялись с помощью UCH-L3, что давало неубихинированный конечный продукт. Этот расщепленный материал затем повторно очищался обращенно-фазовой жидкостной хроматографией высокого разрешения (ЖХВР). За очисткой следовал электрофорез SDS-PAGE и идентичность конечного продукта подтверждалась электрораспылительной ионизационной масс-спектрометрией.
Альтернативой для описанного выше расщепления in vitro с помощью UCH-L3 является совместное выражение фермента, расщепляющего убихитин, в тех же бактериях, как и желаемое слияние убихитина. Для этой цели использовался вектор (pJT184), выражающий убихиназу UBP1 (Tobias and Varshavsky, JBC 266:12021-12028, 1991). Бактерии, совместно выражающие слияние убихитина р97 и UBP1, демонстрировали полное расщепление слитого белка in vivo; бактерии, совместно выражающие слияние убихитина р141 и UBP1 демонстрировали частичное (приблизительно 70%) расщепление слитого белка. Расщепленный in vivo белок р97 очищался преципитацией сульфата аммония, за которой следовала, как и выше, обращенно-фазовая жидкостная хроматография высокого разрешения (ЖХВР).
Для подтверждения идентичности выраженных и очищенных полипептидов выполнялась электрораспылительная ионизационная масс-спектрометрия с использованием прибора VG Biotech BIO-Q с квадрупольным анализатором. Для калибровки прибора использовался миоглобин. Основным компонентом, полученным с очищенным р97, был отдельный пик с молекулярным весом 10339 Дальтон; это благоприятно сопоставимо с рассчитанным молекулярным весом в 10347, подтверждая идентичность рекомбинантного фрагмента р97.
Пример 23. Рекомбинантный р1-97 сохраняет ингибирующую стволовые клетки активность.
Для оценки биоактивности рекомбинантного р1-97 использовался анализ циклирования КОЕ-ГЭММ, как и в Примере 18.
| Таблица 21 |
| Обработка |
% умерщвления |
| Контроль1 |
62 |
| Альфа-человека2 |
11 |
| р973 |
0 |
1 Мононуклеарные клетки костного мозга человека.
2 Очищенный, нерекомбинантный альфа-гемоглобин человека, как в Примере 16 (100 нг/мл).
3 Очищенный нерекомбинантный р97, как в Примере 22 (100 нг/мл). |
Пример 24. Альфа-гемоглобин человека и пептид 43-55 ингибируют циклирование КОЕмикст in vivo у мышей, обработанных тестостероном или 5-фторурацилом (5-FU).
Для оценки ингибиторной активности пептида 43-55 in vivo мыши B6D2F1 были предварительно обработаны тестостероном пропионатом, как описано в Примере 1, или 5-фторурацилом. А именно, тестостерон пропианат (100 мг/кг веса тела) вводился мышам внутрибрюшинно в день 0. Альтернативно мышам в день 0 вводился 5-фторурацил (200  г/кг веса тела). г/кг веса тела).
Через 24 часа (день 1) различные дозы пептида 43-55 или наполнителя водились внутрибрюшинно. Костный мозг собирался в день 2, и проводился анализ циклирования КОЕмикст, как в примере 14. А именно, мыши умерщвлялись, и из бедренных костей готовились уникальные взвеси клеток костного мозга. Клетки один раз промывались и концентрация корректировалась до 5×106 клеток/мл в среде Фишера. Для каждого условия испытания один миллилитр клеток добавлялся к каждой из двух полипропиленовых пробирок. Пробирки инкубировались при 37°С в течение 3 часов без (контрольные) или с (экспериментальные) добавлением соответствующей концентрации испытываемой субстанции. В конце инкубации 30  г/мл цитозин арабинозида (“Ara С” (фирма Сигма)) добавлялось в половину пробирок и тот же объем среды Фишера добавлялся в другие. Пробирки инкубировались еще в течение 1 часа при 37°С, после чего они помещались на лед и дважды промывались холодной средой Фишера. г/мл цитозин арабинозида (“Ara С” (фирма Сигма)) добавлялось в половину пробирок и тот же объем среды Фишера добавлялся в другие. Пробирки инкубировались еще в течение 1 часа при 37°С, после чего они помещались на лед и дважды промывались холодной средой Фишера.
Клетки повторно корректировались до 5×104-106 мл в среде Фишера и 0,5 мл взвеси клеток добавлялись к 5 мл среды метокультуры Methocult 3430 (Stem Sell Technologies, Vancouver, British Columbia). Смесь интенсивно перемешивалась прибором для встряхивания и перемешивания и 1 мл переносился пипеткой-дозатором в каждую из пяти 35 мм чашек. 35 мм чашки были в свою очередь были помещены в закрытую 150 мм чашку с одной открытой 35 мм чашкой, содержащей стерильную воду. После семи дней инкубации при 37°С колонии КОЕмикст просчитывались с использованием инверсионного микроскопа.
Различия между численностью колонии в пробирках, обработанных средой, в сравнении с пробирками, обработанными Ага С, представляют собой процент клеток в цикле при данном условии в соответствии с формулой
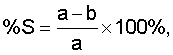
где а = число КОЕмикст из пробирки, инкубированной только со средой,
b = число КОЕмикст из пробирки, инкубированной с Ara С.
| Таблица 221 |
| Обработка |
% умерщвления |
| Контроль |
35 |
| Альфа-цепочка человека (500 нг)2 |
13 |
| Пептид 43-55 (0,5 нг)2 |
0 |
1 Предварительно обработанные тестостероном животные.
2 Количество, вводимое внутрибрюшинно на 20-граммовую мышь. |
| Таблица 231 |
| Обработка |
% умерщвления |
| Контроль |
62 |
| Альфа-цепочка человека (500 нг)2 |
0 |
| Пептид 43-55 (0,5 нг)2 |
3 |
| Циклический пептид 43-55 (0,5 нг)2 |
14 |
1 Животные, предварительно обработанные 5-фторурацилом.
2 Количество, вводимое внутрибрюшинно на 20-граммовую мышь. |
Пример 25. Пептид 43-55 активен в качестве ингибитора стволовой клетки при биотинилировании у N-терминального Phe (Phe43) или иодизированнии у Phe43 или Phe46.
Пептид 43-55 синтезировался с помощью твердофазовых методов синтезирования пептидов (American Peptide Co., Sunnyvale, CA). Аналоги пептидов синтезировались иодом в para позиции Phe43 или Phe46. Биотинилированный пептид 43-55 синтезировался путем присоединения СООН биотина со связывающим агентом С4 к N-терминальному NH2 от Phe43.
| Таблица 24 |
| Обработка |
% умерщвления |
| Контроль |
31 |
| Пептид 43-55 (1 нг/мл) |
8 |
| Биотинилированный пептид 43-55 (1 нг/мл) |
15 |
Пример 26. Морфин ингибирует циклирование мышиных КОЕмикст in vitro.
Морфин проверялся в анализе циклирования колониеобразующих единиц смешанного типа (КОЕмикст) с использованием костного мозга от мышей Balb/c, как и в примере 24.
| Таблица 25 |
| Обработка |
% умерщвления |
| Контроль |
44 |
| Альфа-цепочка человека (100 нг/мл) |
0 |
| Морфин |
(10-7 М) |
10 |
| |
(10–9 М) |
15 |
| |
(10-11 М) |
32 |
Пример 27. Опиатные пептиды DAMGO и DALDA ингибируют циклирование мышиных КОЕмикст in vitro.
DAMGO и DALDA испытывались в анализе циклирования колониеобразующих единиц смешанного типа (КОЕмикст) с использованием костного мозга от мышей Bala/с, как и в примере 24.
| Таблица 26 |
| Обработка |
% умерщвления |
| Контроль |
33 |
| DAMGO (10-5 M) |
15 |
| |
(10-7 М) |
0 |
| |
(10-9 М) |
38 |
| DALDA (10-5 M) |
47 |
| |
(10-7 М) |
0 |
| |
(10-9 М) |
34 |
Пример 28. Ноцисептин ингибирует циклирование мышиных КОЕмикст in vitro.
Ноцисептин проверялся в анализе циклирования колониеобразующих единиц смешанного типа (КОЕмикст) с использованием костного мозга от мышей Balb/c, как в Примере 24.
| Таблица 27 |
| Обработка |
% умерщвления |
| Контроль |
31 |
| Пептид 43-55 (1 нг/мл) |
8 |
| Ноцисептин |
(10-7 М) |
6 |
| |
(10-9 М) |
0 |
Пример 29. Налоксон антагонизирует ингибиторную активность цепочек альфа- и дельта-гемоглобина человека, геморфина 10 и пептида 43-55.
Анализ циклирования колониеобразующих единиц смешанного типа (КОЕмикст) проводился, как в Примере 24. Тестовые субстанции анализировались сами по себе или в присутствии налоксона (10-5 М или 10-7 М). Сам налоксон не имел влияния на анализ при данных концентрациях.
| Таблица 28 |
| Обработка |
|
% умерщвления |
| Контроль |
|
38 |
| Налоксон1 |
|
36 |
| Альфа-гемоглобин человека (100 нг/мл) |
0 |
| “ |
+ Налоксон1 |
52 |
| Пептид 43-55 (10 нг/мл) |
6 |
| “ |
+ Налоксон1 |
50 |
| Геморфин 10 (10 нг/мл) |
0 |
| “ |
+ Налоксон1 |
36 |
| 1 Используется при окончательной концентрации 10-5 М. |
| Таблица 29 |
| Обработка |
|
% умерщвления |
| Контроль |
|
32 |
| Дельта-гемоглобин человека (100 нг/мл) |
10 |
| “ |
+ Налоксон1 |
31 |
| 1 Используется при окончательной концентрации 10-7 М. |
Пример 30. Низкие концентрации налоксона ингибируют циклирование мышиных КОЕмикст.
Анализ циклирования колониеобразующих единиц смешанного типа (КОЕмикст) проводился, как в Примере 24.
| Таблица 30 |
| Обработка |
% умерщвления |
| Контроль |
38 |
| Альфа-гемоглобин человека (100 нг/мл) |
0 |
| Налоксон (10-10 М) |
0 |
Пример 31. Антагонист опиатного рецептора мю СТОР подавляет ингибиторную активность альфа-цепочки гемоглобина человека, пептида 43-55 и пептида 64-82.
СТОР (H-D-Phe-Cys-Tyr-Orn-Thr-Pen-Thr-NH2 с дисульфидом между Cys2 и Pen7) является аналогом соматостатина, являющегося специфическим антагонистом опиатного рецептора мю. Тестовые субстанции оценивались сами по себе или в присутствии СТОР (10-7 М). СТОР сам по себе не воздействовал на анализ при данной концентрации, но подавлял ингибирование цикла клетки, вызванное альфа-гемоглобином или пептидом 43-55.
| Таблица 31 |
| Обработка |
|
% умерщвления |
| Контроль |
|
42 |
| СТОР1 |
|
35 |
| Альфа-гемоглобин человека (100 нг/мл) |
0 |
| “ |
+ СТОР1 |
20 |
| Пептид 43-55 (10 нг/мл) |
8 |
| “ |
+ СТОР1 |
21 |
| 1 Использовался при окончательной концентрации 10-7 М. |
Пример 32. Предварительная обработка альфа-цепочкой гемоглобина увеличивает число поздно формирующихся группообразующих клеток.
Анализ групп клеток проводился, как описывалось Плоэмахером и его коллегами (Ploemacher et al., Blood 74: 2755-63, 1989; van der Sluijs et al., Exp.Hematol. 18:893-6, 13:63, 1990; Ploemacher et al., Blood 78:2527-33, 1991; Ploemacher et al., J. Tiss. Cult. Meth. 13:63-68, 1991; Down and Ploemacher, Exp.Hematol. 21:213-21, 1993). Анализ групп измеряет появление групп клеток (или “булыжников”) внутри монослоя стромальных клеток. Очень примитивные стволовые клетки не будут образовывать колонии в мягком агаре, но они действительно образуют группы в присутствии стромального монослоя. Клетки, которые образуют группы клеток, называются “группообразующими клетками” (CAFC). Более дифференцированные клетки-предшественники (например, гранулоцитарно-макрофагальные колониеобразующие клетки GM-CFC) образуют переходные группы, которые появляются и затем исчезают в течение первых нескольких недель культуры, в то время как более примитивные стволовые клетки (например, долгоживущие репопулирующие клетки) образуют группы, которые появляются только после 4-5 недель культуры. Таким образом группообразующие клетки (CAFC), образующиеся в дни 7-14 культуры обогащаются в КОЕ-ГМ, а CAFC, образующиеся в дни 28-35, обогащаются в КОЕмикст, и CAFC, образующиеся в дни 28-35, обогащаются в долгоживущих репопулирующих клетках.
Мыши B6D2F1 обрабатывались тестостероном пропианатом, как в примере 24. На следующий день удалялся костный мозг и инкубировался в течение 4 часов с или без альфа-цепочки гемоглобина человека (100 нг/106 клеток), после чего клетки высеивались в образец для анализа групп клеток. Использованный образец состоит из ограничивающих растворение долгоживущих культур костного мозга (LTBM) в планшетах с 96 лунками. Культуры готовились путем выращивания мышиной стромальной линии клеток FBMD-1 (Breems et al., Leukemia 11:142-50, 1997) до слияния; планшеты с 96 лунками с сливающимися слоями хранились при 33°С до анализа. Клетки мышиного костного мозга готовились в виде взвеси клеток и клетки высеивались на каждую лунку в 0,2 мл среды LTBM (Stem Cell Technologies, Vancouver) со следующим разведением: 27000; 9000; 3000; 1000; 333. Двадцать лунок засеивалось для каждого разведения и условия, и они распределялись по двум планшетам.
Частота клеток, образующих группы клеток (CAFC), просчитывалась так, как описывалось ранее (Ploemacher et al., Blood 78:2527-33, 1991; Ploemacher et al., J. Tiss. Cult. Meth. 13:63-68, 1991; Breems et al., Leukemia 8:1095-104). Результаты показаны на фиг.23. Предварительная инкубация циклирующих стволовых клеток альфа-цепочки гемоглобина человека увеличивала пропорцию позднообразующихся CAFC приблизительно в пять раз. Обработка нециклирующей клетки альфа-цепочкой не имела действия.
Пример 33. Альфа-гемоглобин человека и пептиды 43-55. циклические 43-55 и 64-82 ингибируют циклирование КОЕ-ГЭМММ пуповинной крови человека.
Анализ циклирования КОЕ-ГЭМММ пуповинной крови человека проводился, как в Примере 19. Конкретно, мононуклеарные клетки были выделены из клеток пуповинной крови человека и откорректировались до 2-4×104 клеток/мл в тканевой культуре среды Дульбекко, модифицированной по способу Исков (IMDM), дополненной 10% FBS, 100 нг/мл лиганда котенка и 100 нг/мл IL-3 человека. Клетки инкубировались в течение 48 часов при 37°С.
После инкубации клетки промывались и повторно суспендировались в свободной от сыворотки IMDM при концентрации 106 клеток/мл. 1 мл клеток был добавлен к каждой из двух полипропиленовых пробирок и анализ циклирования проводился, как в примере 14 для мышиного костного мозга. После инкубации с Ara С клетки промывались холодной средой IMDM, корректировались до от 10000 до 20000 клеток на 0,5 мл среды IMDM и смешивались с 5 мл метокультуры Н4433 (Стем Сел Текнолоджиз). Альтернативно использовалась метилцеллюлозная среда метокультуры Н4435 (Стем Сел Текнолоджиз) и в этом случае концентрация клеток корректировалась до 2500-5000 клеток на 0,5 мл IMDM (среды Дульбекко, модифицированной по способу Исков). Клетки высеивались, как в примере 24, и колонии КОЕ-ГЭМММ обсчитывались в дни 14-18.
| Таблица 32 |
| Обработка |
|
|
% умерщвления |
| Контроль |
|
|
52 |
| Альфа-цепочка человека (100 нг/мл) |
0 |
| Пептид 43-55 (1 нг/мл) |
20 |
| |
(10 нг) |
|
12 |
| |
(100 нг) |
|
5 |
| Циклический пептид 43-55 (1 нг/мл) |
32 |
| |
|
(10 нг) |
0 |
| |
|
(100 нг) |
11 |
| Пептид 64-82 (1 нг/мл) |
21 |
| |
(10 нг) |
|
20 |
| |
(100 нг) |
|
39 |
Пример 34. Альфа-гемоглобин человека и пептид 43-55 ингибируют циклирование КОЕ-ГЭМММ костного мозга взрослого человека.
Стволовые клетки CD34+ были получены по технологии фирмы Поитик Текнолоджиз (Гейтерсбург, Мериленд) после очистки из костного мозга человека при помощи колонки CellPro. Клетки инкубировались в течение 48 часов с лигандом котенка и IL-3 и использовались в анализе циклирования КОЕ-ГЭМММ (колониеобразующей единицы гранулоцитов-эритроцитов-макрофагов-мегакариоцитов), как в примере 26.
| Таблица 33 |
| Обработка |
% умерщвления |
| Контроль |
47 |
| Альфа-цепочка человека (нг/мл) |
0 |
| Пептид 43-55 (нг/мл) |
0 |
Пример 35. КОЕ-ГЭМММ активно циклируют в мобилизованной периферийной крови человека и могут быть ингибированы альфа-гемоглобином человека, пептидом 43-55, DAMGO или морфином.
Периферийная кровь была получена от пациентов с раком груди, проходящих мобилизацию периферийных стволовых клеток циклофосфамидом и гранулоцитарным колониестимулирующим фактором (G-CSF) в соответствии со стандартными протоколами. Красные кровяные клетки были удалены с помощью Ficoll Hypaque (клетки растворялись 1:1 средой IMDM и 20 мл помещались слоями поверх 16 мл Ficoll и центрифугировались при 800 g в течение 30 минут; мононуклеарные клетки были удалены из промежуточной фазы и дважды промывались в среде IMDM). В одном случае мононуклеарные клетки хранились замороженными в жидком азоте до анализа. Мононуклеарные клетки высевались для анализа циклирования КОЕ-ГЭМММ, как в примере 26, за исключением того, что 2,5-5×105 клеток высеивалось на чашку.
| Таблица 34 |
| Обработка |
% умерщвления |
| Контроль (пациент №1) |
48 |
| Альфа- цепочка человека (100 нг/мл) |
0 |
| Таблица 35 |
| Обработка |
|
% умерщвления |
| Контроль (пациент №2)1 |
67 |
| Альфа-цепочка человека (нг/мл) |
2 |
| Пептид 43-55 (10 нг/мл) |
0 |
| Морфин |
(10-7 М) |
24 |
| “ |
(10-9 М) |
0 |
| DAMGO |
(10-7 М) |
15 |
| “ |
(10-9 М) |
0 |
| Таблица 36 |
| Обработка |
% умерщвления |
| Контроль (пациент №3)1 |
29 |
| Пептид 43-55 (0,1 нг/мл) |
23 |
| |
(1,0 нг/мл) |
0 |
| |
(10 нг/мл) |
15 |
| 1 Из клеток, хранившихся замороженными до анализа |
Пример 36. Интенсивные дозы альфа- или бета-гемоглобина человека, миоглобина, пептида 1-97, пептида 43-55, пептида 64-82, ноцисептина или DALDA стимулируют циклирование находящихся в состоянии покоя мышиных стволовых клеток
Дозы микрограмм на миллилитр цепочек гемоглобина, миоглобина и пептидов были проанализированы на стимуляцию находящихся в состоянии покоя стволовых клеток. Костный мозг был получен от необработанных B6D2F1 и проверялся в анализе циклирования КОЕмикст (колониеобразующих единиц смешанного типа), как в примере 24. Стволовые клетки, выделенные из необработанных мышей B6D2F1 обычно медленно циклируют, если их не стимулировать (например, тестостероном пропианатом (сравни пример 1) или химиотерапией, подобной 5-фторурацилу (сравни пример 4)) к вхождению в цикл.
| Таблица 37 |
| Обработка |
|
% умерщвления |
| Контроль |
|
3 |
| Альфа-цепочка человека |
(1  г/мл) г/мл) |
0 |
| |
(10  г/мл) г/мл) |
24 |
| |
(100  г/мл) г/мл) |
40 |
| Таблица 38 |
| Обработка |
% умерщвления |
| Контроль |
9 |
Бета- цепочка человека ( г/мл) г/мл) |
55 |
Миоглобин человека ( г/мл) г/мл) |
30 |
| Таблица 39 |
| Обработка |
% умерщвления |
| Контроль |
3 |
Альфа-цепочка человека (100  г/мл) г/мл) |
41 |
| DALDA |
(10-5 М) |
24 |
| |
(10-3 м) |
41 |
| DADLE |
(10-5 М) |
0 |
| |
(10-3 М) |
0 |
| Таблица 40 |
| Обработка |
|
% умерщвления |
| Контроль |
|
0 |
Альфа-цепочка человека (100  г/мл) г/мл) |
30 |
Пептид 43-55 (10  г/мл) г/мл) |
26 |
| Таблица 41 |
| Обработка |
|
% умерщвления |
| Контроль |
|
16 |
| Пептид 1-97 |
(10  г/мл) г/мл) |
62 |
| |
(10  г/мл) г/мл) |
41 |
| Таблица 42 |
| Обработка |
% умерщвления |
| Контроль |
4 |
Пептид 64-82 (1  г/мл) г/мл) |
25 |
| Ноцисептин (10-5 М) |
36 |
Пример 37. Внутривенный прием большой дозы альфа-гемоглобина человека стимулирует циклирование находящихся в состоянии покоя мышиных стволовых клеток.
Альфа-гемоглобин человека вводился в необработанных мышей B6D2F1. Через 24 часа мышей умерщвляли, костный мозг собирался с бедренных костей и проводился анализ КОЕмикст, как описано в Примере 24.
| Таблица 43 |
| Обработка |
% умерщвления |
| Контроль |
0 |
| Среда (контроль инъецирования) |
0 |
Альфа-цепочка человека (150  г/мышь) г/мышь) |
48 |
Пример 38. Налоксон подавляет стимулирующую стволовую клетку активность большой дозы альфа-гемоглобина человека, пептида 43-55.
| Таблица 44 |
| Обработка |
% умерщвления |
| Контроль |
6 |
| Альфа-цепочка человека (100 нг/мл) |
48 |
| “ |
+ Налоксон1 |
0 |
| 1 Используется при окончательной концентрации 10-7 М |
Хотя настоящее изобретение было описано с точки зрения предпочтительных примеров его осуществления, имеющим опыт в данной области понятно, что могут возникнуть варианты и модификации.
Следовательно, предполагается, что прилагающиеся пункты патентной формулы включают все подобные эквивалентные варианты, которые входят в рамки изобретения в том виде, в котором оно заявлено.
Формула изобретения
1. Полипептид, включающий фрагменты альфа-цепочки гемоглобина, отличающийся тем, что в ней замещен или удален С-терминальный гидрофобный участок, содержащий гидрофобные аминокислоты, причем замещение включает замену одной или более из указанных гидрофобных аминокислот неполярной аминокислотой, выбранной из группы, включающей глицин, серии, треонин, цистеин, тирозин, аспарагин и глютамин, а удаление включает удаление одной или более из указанных гидрофобных аминокислот, выбранных из группы, включающей аланин, валин, лейцин, пролин и фенилаланин, при этом растворимость указанного полипептида больше, чем у полноразмерной альфа-цепи гемоглобина.
2. Полипептид, включающий фрагменты альфа-цепочки гемоглобина, отличающийся тем, что в ее С-терминальном гидрофобном участке замещена или удалена область связывания гаптоглобина, содержащая аминокислоты 121-127, причем замещение включает замену одной или более из указанных аминокислот на другие аминокислоты типа полиаланина или полиглицина, обеспечивающие устранение связи пептида и гаптоглобина, а удаление включает удаление одной или более из указанных аминокислот 121-127 для обеспечения устранения связи пептида и гаптоглобина.
3. Полипептид по п.1 или 2, содержащий аминокислоты 1-97 альфа-цепочки гемоглобина человека.
4. Фармацевтический состав, обладающий свойствами модулятора пролиферации стволовой клетки, включающий (а) полипептид по п.1 или 2, и (b) фармацевтически приемлемый носитель.
5. Фармацевтический состав, обладающий свойствами модулятора пролиферации стволовой клетки, включающий полипептид, состоящий из аминокислот 1-97 цепочки альфа-гемоглобина человека, и фармацевтически приемлемый носитель.
6. Фармацевтический состав, обладающий свойствами модулятора пролиферации стволовой клетки, включающий полипептид, состоящий из аминокислот 1-94 цепочки альфа-гемоглобина человека, и фармацевтически приемлемый носитель.
7. Фармацевтический состав по п.4, или 5, или 6 в виде единичной дозировки.
8. Фармацевтический состав по п.7, содержащий от 0,1 мг до 6 г одного или двух соединений, выбранных из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека.
9. Способ ингибирования пролиферации стволовой клетки, включающий вступление в контакт с кроветворными клетками с помощью полипептида, выбранного из группы, содержащей полипептиды по п.1 или 2, и пептида, имеющего последовательность Phe-Leu-Gly-Phe-Pro-Thr, в количестве, ингибирующем пролиферацию стволовой клетки.
10. Способ по п.9, отличающийся тем, что вышеупомянутый полипептид выбран из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и пептид, имеющий последовательность Phe-Leu-Gly-Phe-Pro-Thr.
11. Способ стимулирования роста кровяных клеток (В), который включает вступление в контакт с кроветворными клетками с помощью полипептида по п.1 или 2 или пептида, имеющего последовательность Phe-Leu-Gly-Phe-Pro-Thr, в количестве, стимулирующем рост кроветворных клеток.
12. Способ лечения рака у млекопитающих, включающий этапы: (a) прием лучевой терапии или химиотерапии, и (b) прием полипептида по п.1 или 2 в количестве, ингибирующем пролиферацию стволовых клеток.
13. Способ по п.12, отличающийся тем, что вышеупомянутый полипептид выбран из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека.
14. Способ по п.12, отличающийся тем, что этапы (а) и (b) повторяются один или более раз.
15. Способ по п.12, отличающийся тем, что этап (а) проводится после этапа (b).
16. Способ по п.12, отличающийся тем, что этап (b) проводится в течение 24 ч до или после этапа (а).
17. Способ лечения рака у млекопитающих, включающий этапы:
(a) взятие кроветворных клеток у вышеупомянутого млекопитающего,
(b) обработка указанных кроветворных клеток ex vivo полипептидом по п.1 или 2,
(c) лечение вышеупомянутых кроветворных клеток обработанных на этапе (b) химиотерапией или лучевой терапией,
(d) проведение миелоаблативного лечения вышеупомянутого млекопитающего, и
(e) трансплантация указанному млекопитающему кроветворных клеток обработанных на этапе (с).
18. Способ по п.17, отличающийся тем, что полипептид на этапе (b) выбирается из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека.
19. Способ ингибирования деления стволовых клеток у млекопитающего, подвергаемого влиянию средства, которое поражает или разрушает стволовые клетки, включающий прием полипептида, выбранного из группы, содержащей полипептиды по п.1 или 2, или пептид, имеющий последовательность Phe-Leu-Gly-Phe-Pro-Thr, в количестве, ингибирующем пролиферацию стволовых клеток.
20. Способ по п.19, отличающийся тем, что вышеупомянутый полипептид выбран из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и пептид, имеющий последовательность Phe-Leu-Gly-Phe-Pro-Thr.
21. Способ по п.19, отличающийся тем, что вышеупомянутое средство является антивирусным средством.
22. Способ поддержания кроветворных клеток млекопитающего ex vivo, включающий вступление в контакт с кроветворными клетками с помощью полипептида, выбранного из группы, содержащей полипептиды по п.1 или 2, и пептид, имеющий последовательность Phe-Leu-Gly-Phe-Pro-Thr, в количестве, ингибирующем пролиферацию стволовых клеток.
23. Способ по п.22, отличающийся тем, что указанный полипептид выбран из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и пептид, имеющий последовательность Phe-Leu-Gly-Phe-Pro-Thr.
24. Способ по п.22, отличающийся тем, что указанные кроветворные клетки выбраны из группы, включающей клетки костного мозга, клетки периферийной крови, мобилизованные клетки периферийной крови, клетки печени эмбриона и клетки крови пуповины.
25. Способ лечения миелопролиферативного или аутоиммунного заболевания или гиперпролиферации эпителиальных стволовых клеток, включающий прием полипептида по п.1 или 2 в количестве, снижающем гиперпролиферацию.
26. Способ по п.25, отличающийся тем, что миелопролиферативное заболевание является миелодиспластическим синдромом.
27. Способ дифференцированной защиты здоровых стволовых клеток и не раковых клеток млекопитающего от химиотерапии или лучевой терапии, включающий прием полипептида, выбранного из группы, содержащей полипептиды по п.1 или 2, и пептида, имеющего последовательность Phe-Leu-Gly-Phe-Pro-Thr, в количестве, защищающем стволовую клетку.
28. Способ по п.27, отличающийся тем, что указанный полипептид выбран из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, полипептид, имеющий последовательность аминокислот 1 -94 альфа-цепочки гемоглобина человека, и пептид, имеющий последовательность Phe-Leu-Gly-Phe-Pro-Thr.
29. Способ по п.27, отличающийся тем, что указанный полипептид вводится после того, как здоровые стволовые клетки побуждаются к пролиферации под действием цитотоксического лекарства или лучевой терапии.
30. Способ вакцинации млекопитающего, включающий введение полипептида по п.1 или 2 в качестве адъюванта до, во время или после введения вакцины.
31. Способ лечения млекопитающего, имеющего иммунодепрессию, вызванную гиперпролиферацией стволовых клеток, включающий введение вышеупомянутому млекопитающему полипептида по п.1 или 2 в количестве, реверсирующем гиперпролиферацию.
32. Способ проведения генной терапии у млекопитающего, включающий этапы:
(a) взятие кроветворных клеток у вышеупомянутого млекопитающего,
(b) трансфецирование указанных кроветворных клеток заранее установленным геном,
(c) вступление в контакт с трансфецированными кроветворными клетками ех vivo полипептидом по п.1 или 2, и
(d) трансплантация кроветворных клеток обработанных на этапе (с) указанному млекопитающему.
33. Способ по п.32, отличающийся тем, что указанный полипептид в этапе (с) выбран из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека.
34. Способ по п.32 далее включающий после этапа (а) обработку указанных кроветворных клеток по крайней мере одним стимулирующим цитокином, чтобы вызвать пролиферацию стволовой клетки.
35. Способ по п.32 далее включающий после этапа (d) обработку млекопитающего in vivo вышеупомянутым полипептидом.
36. Способ проведения ех vivo экспансии стволовой клетки, включающий вступление в контакт с кроветворными клетками полипептида по п.1 или 2 и по крайней мере одного стимулирующего цитокина.
37. Способ по п.36, отличающийся тем, что указанный полипептид выбран из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека.
38. Способ по п.36, отличающийся тем, что указанные кроветворные клетки выбраны из группы, включающей клетки костного мозга, клетки периферийной крови, мобилизованные клетки периферийной крови, клетки печени эмбриона и клетки крови пуповины.
39. Фармацевтический состав, модулирующий пролиферацию стволовой клетки, включающий (а) полипептид по п.1 или 2 и (b) по крайней мере одно ингибирующее соединение, выбранное из группы, включающей MIP-1 , TGF , TGF , TNF , TNF , INF , INF , INF , INF , INF , INF , пентапептид pyroGlu-Glu-Asp-Cys-Lys, тетрапептид N-Acetil-Ser-Asp-Lys-Pro и трипептид глютатион (Gly-Cys- , пентапептид pyroGlu-Glu-Asp-Cys-Lys, тетрапептид N-Acetil-Ser-Asp-Lys-Pro и трипептид глютатион (Gly-Cys- Glu). Glu).
40. Фармацевтический состав по п.39, отличающийся тем, что вышеупомянутый полипептид выбирается из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека.
41. Фармацевтический состав, модулирующий пролиферацию стволовой клетки, включающий (а) полипептид по п.1 или 2 и (b) по крайней мере одно стимулирующее соединение, выбранное из группы, состоящей из IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-13, IL-14, IL-15, гранулоцитарного колониестимулирующего фактора (G-CSF), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), макрофагального колониестимулирующего фактора (M-CSF), эритропоэтина, тромбопоэтина, фактора стволовой клетки и лиганда flk2/flt3.
42. Фармацевтический состав по п.41, отличающийся тем, что указанный полипептид выбран из группы, включающей полипептид, имеющий последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и полипептид, имеющий последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека.
43. Способ экспрессии альфа-гемоглобина или его аналогов с их замещением или удалением, включающий экспрессию вышеупомянутого гемоглобина или аналогов с замещением или удалением как слияние убихитина, причем вышеупомянутый этап экспрессии производится в Е.coli.
44. Способ по п.43, отличающийся тем, что указанный этап экспрессии включает экспрессию фермента, расщепляющего убихитин.
45. Пептид, имеющий последовательность, выбранную из группы, состоящей из biotin-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val, (iodo)Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val, Phe-Pro-His-(iodo)Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val и (iodo)Phe-Pro-His-(iodo)Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val.
46. Способ стимулирования пролиферации стволовых клеток, который включает вступление в контакт с кроветворными клетками с помощью количества INPROL, стимулирующего пролиферацию стволовых клеток, выбранного из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина,
полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека,
полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь),
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala,
Phe-Leu-Gly-Phe-Pro-Thr,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-Gln,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-Gln и
Tyr-Pro-Trp-Thr.
47. Способ стимулирования пролиферации стволовых клеток, который включает вступление в контакт с кроветворными клетками с помощью количества опиатного соединения, стимулирующего пролиферацию стволовых клеток.
48. Способ по п.47, отличающийся тем, что вышеупомянутое соединение имеет селективность к подклассу мю-опиатного рецептора.
49. Способ по п.47, который включает вступление в контакт с кроветворными клетками с помощью соединения, способного связывать рецепторы ноцисептина.
50. Способ стимулирования пролиферации стволовых клеток, который включает вступление в контакт с кроветворными клетками с помощью количества INPROL, выбранного из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина,
полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека,
полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь),
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala,
Phe-Leu-Gly-Phe-Pro-Thr,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-Gln,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-Gln и
Tyr-Pro-Trp-Thr,
и опиатного соединения, стимулирующего пролиферацию стволовых клеток.
51. Способ по п.47 или 50, отличающийся тем, что вышеупомянутое опиатное соединение выбрано из группы, состоящей из морфина, эторфина, кодеина, героина, гидроморфона, оксиморфона, леворфанола, леваллорфана, кодеина, гидрокодона, оксикодона, налорфина, налоксона, налтрексона, бупренорфина, бутанорфанола, налбуфина, мередина, альфапродина, дифеноксилата, фентанила, DAMGO, DALDA и ноцисептина.
52. Способ стимулирования пролиферации стволовых клеток, который включает вступление в контакт с кроветворными клетками с помощью соединения, способного активировать Gингибиторный подкласс белков, связывающих GTP, и применяемого в количестве, обеспечивающем стимулирование пролиферации стволовых клеток.
53. Способ ингибирования пролиферации стволовых клеток, который включает вступление в контакт с кроветворными клетками с помощью соединения, способного связывать рецепторы ноцисептина, и применяемого в количестве, ингибирующем пролиферацию стволовых клеток.
54. Способ ингибирования пролиферации стволовых клеток, который включает вступление в контакт с кроветворными клетками с помощью соединения, способного активировать Gингибиторный подкласс белков, связывающих GTP, и применяемого в количестве, ингибирующем пролиферацию стволовых клеток.
55. Способ стимулирования или ингибирования пролиферации стволовых клеток, который включает вступление в контакт с кроветворными клетками с помощью соединения, способного связывать опиатоподобный рецептор, не включая классические опиатные рецепторы мю-, каппа- и дельта- или ORL1, отличающийся тем, что вышеупомянутый рецептор (а) обладает способностью стимулировать и/или ингибировать стволовую клетку и (b) что вышеупомянутая способность стимулировать и/или ингибировать стволовую клетку может быть подавлена налоксоном.
56. Способ по п.55, отличающийся тем, что вышеупомянутый опиатоподобный рецептор имеет способность связывать пептид Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val, при этом константа диссоциации (Kd) меньше или равна 1 микромоль.
57. Способ по п.56, отличающийся тем, что вышеупомянутая константа диссоциации меньше или равна 10 микромоль.
58. Способ идентификации рецептора для INPROL, включающий вступление в контакт с материалом, который содержит вышеупомянутый рецептор, с помощью INPROL для анализа связывания рецептора, где INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина, полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека,
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
biotin-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
(iodo)Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Phe-Pro-His-(iodo)Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
(iodo)Phe-Pro-His-(iodo)Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys и
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala.
59. Способ идентификации рецептора для INPROL, включающий вступление в контакт с материалом, содержащим вышеупомянутый рецептор, с помощью INPROL в анализе аденилат циклазы, где INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина, полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека,
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
biotin-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
(iodo)Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Phe-Pro-His-(iodo)Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
(iodo)Phe-Pro-His-(iodo)Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys и
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala.
60. Способ лечения рака у больных млекопитающих, включающий этапы:
(a) прием лучевой терапии и/или химиотерапии, и
(b) прием количества INPROL, стимулирующего пролиферацию стволовой клетки, где INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина, полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь),
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala,
Phe-Leu-Gly-Phe-Pro-Thr,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-Gln,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-Gln и
Tyr-Pro-Trp-Thr.
61. Способ по п.60, в котором этапы (а) и (b) повторяются один или более раз.
62. Способ по п.60, в котором этап (а) проводится до этапа (b).
63. Способ дифференцированной защиты здоровых стволовых клеток млекопитающего от химиотерапии или лучевой терапии, включающий прием опиатного соединения в количестве, защищающем стволовую клетку.
64. Способ по п.63, отличающийся тем, что вышеупомянутое опиатное соединение выбрано из группы, состоящей из морфина, эторфина, кодеина, героина, гидроморфона, оксиморфона, леворфанола, леваллорфана, кодеина, гидрокодона, оксикодона, налорфина, налоксона, налтрексона, бупренорфина, бутанорфанола, налбуфина, мередина, альфапродина, дифеноксилата, фентанила, DAMGO, DALDA и ноцисептина.
65. Способ стимулирования деления стволовой клетки у млекопитающего, подвергаемого действию средства, которое повреждает или разрушает стволовые клетки, включающий прием количества INPROL, стимулирующего пролиферацию стволовой клетки, отличающийся тем, что указанный INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина, полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и пептидов, имеющих последовательность:
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь),
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala,
Phe-Leu-Gly-Phe-Pro-Thr,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-Gln,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-Gln и
Tyr-Pro-Trp-Thr.
66. Способ по п.65, отличающийся тем, что вышеупомянутое средство является антивирусным или антинеопластическим средством.
67. Способ поддержания кроветворных стволовых клеток млекопитающего ex vivo, включающий вступление в контакт с кроветворными клетками с помощью количества INPROL, стимулирующего пролиферацию стволовой клетки, отличающийся тем, что указанный INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина, полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека,
полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и пептидов, имеющих последовательность:
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь),
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala,
Phe-Leu-Gly-Phe-Pro-Thr,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-Gln,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-Gln и
Tyr-Pro-Trp-Thr.
68. Способ по п.67, отличающийся тем, что указанные кроветворные клетки выбираются из группы, включающей клетки костного мозга, клетки периферийной крови, мобилизованные клетки периферийной крови, клетки печени эмбриона и клетки крови пуповины.
69. Способ лечения миелопролиферативного заболевания, гипопролиферациии кроветворных или эпителиальных исходных клеток у млекопитающих, страдающих этими заболеваниями, включающий прием INPROL в количестве, обеспечивающем стимулирование пролиферации стволовых клеток, отличающийся тем, что указанный INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина, полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и пептидов, имеющих последовательность:
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь),
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala,
Phe-Leu-Gly-Phe-Pro-Thr,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-Gln,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-Gln и
Tyr-Pro-Trp-Thr.
70. Способ по п.69, отличающийся тем, что указанное миелодиспластическое заболевание является миелодиспластическим синдромом или апластической анемией.
71. Способ лечения или предотвращения истощения стволовой клетки, включающий прием ингибирующего пролиферацию стволовой клетки количества INPROL, отличающийся тем, что указанный INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина, полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и пептидов, имеющих последовательность:
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь),
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala,
Phe-Leu-Gly-Phe-Pro-Thr,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-Gln,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-Gln и
Tyr-Pro-Trp-Thr.
72. Способ по п.71, отличающийся тем, что указанное истощение стволовой клетки вызвано приобретенным синдромом иммунодефицита.
73. Способ проведения генной терапии у млекопитающего, включающий этапы:
(a) взятие кроветворных клеток у вышеупомянутого млекопитающего,
(b) обработка указанных кроветворных клеток ex vivo стимулирующим стволовую клетку количеством INPROL,
(c) трансфецирование или инфецирование указанных кроветворных клеток заранее определенным геном,
(d) вступление в контакт с трансфецированными кроветворными клетками ех vivo с помощью ингибирующего стволовую клетку количества INPROL,
(e) трансплантация кроветворных клеток обработанных на этапе (d) указанному млекопитающему, и
(f) дополнительное лечение вышеупомянутого млекопитающего in vivo ингибирующим или стимулирующим стволовую клетку количеством INPROL,
отличающийся тем, что указанный INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина,
полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека,
полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и пептидов, имеющих последовательность:
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь),
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala,
Phe-Leu-Gly-Phe-Pro-Thr,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-Gln,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-Gln и
Tyr-Pro-Trp-Thr.
74. Способ проведения ex vivo экспансии стволовой клетки, включающий вступление в контакт с кроветворными клетками стимулирующим стволовую клетку количеством INPROL, отличающийся тем, что указанный INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина,
полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека,
полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека, и
пептидов, имеющих последовательность:
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь),
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala,
Phe-Leu-Gly-Phe-Pro-Thr,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg,
Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln,
Leu-Val-Val-Tyr-Pro-Trp-Thr,
Leu-Val-Val-Tyr-Pro-Trp,
Leu-Val-Val-Tyr-Pro,
Val-Val-Tyr-Pro-Trp-Thr-Gln,
Tyr-Pro-Trp-Thr-Gln-Arg-Phe,
Tyr-Pro-Trp-Thr-Gln-Arg,
Tyr-Pro-Trp-Thr-Gln и
Tyr-Pro-Trp-Thr.
75. Способ по п.74, отличающийся тем, что указанные кроветворные клетки выбраны из группы, включающей клетки костного мозга, клетки периферийной крови, мобилизованные клетки периферийной крови, клетки печени эмбриона и клетки крови пуповины.
76. Фармацевтический состав, модулирующий пролиферацию стволовой клетки, включающий (а) опиатное соединение и (b) по крайней мере одно ингибирующее соединение, выбранное из группы, состоящей из MIP-1 , TGF , TGF , TNF , TNF , INF , INF , INF , INF , INF , INF , пентапептида pyroGlu-Glu-Asp-Cys-Lys, тетрапептида N-Acetil-Ser-Asp-Lys-Pro и трипептида глютатиона (Gly-Cys- , пентапептида pyroGlu-Glu-Asp-Cys-Lys, тетрапептида N-Acetil-Ser-Asp-Lys-Pro и трипептида глютатиона (Gly-Cys- Glu). Glu).
77. Фармацевтический состав, модулирующий пролиферацию стволовой клетки, включающий (а) опиатное соединение и (b) по крайней мере одно стимулирующее соединение, выбранное из группы, состоящей из IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-13, IL-14, IL-15, G-CSF, GM-CSF, M-CSF, эритропоэтина, тромбопоэтина, фактора стволовой клетки и лиганда flk2/flt3.
78. Способ лечения боли у млекопитающего, включающий введение вышеупомянутому млекопитающему INPROL в количестве, вызывающем аналгезирующее действие, причем указанный INPROL выбирается из группы, состоящей из гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина,
полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и
полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека,
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь) и
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala.
79. Способ лечения иммунодефицита у млекопитающих, включающий введение вышеупомянутому млекопитающему иммуностимулирующего количества INPROL, отличающийся тем, что указанный INPROL выбран из группы, состоящей из альфа-цепочки гемоглобина, бета-цепочки гемоглобина, гамма-цепочки гемоглобина, дельта-цепочки гемоглобина, эпсилон-цепочки гемоглобина, зета-цепочки гемоглобина,
полипептида, имеющего последовательность аминокислот 1-97 альфа-цепочки гемоглобина человека, и
полипептида, имеющего последовательность аминокислот 1-94 альфа-цепочки гемоглобина человека,
Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val,
Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val-Cys
(где два остатка Cys формируют дисульфидную связь) и
Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-Asp-Asp-Met-Pro-Asn-Ala-Leu-Ser-Ala.
РИСУНКИ
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция в тексте описания изобретения
Извещение опубликовано: 10.05.2007 БИ: 13/2007
|
|