Патент на изобретение №2292350
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 5
(57) Реферат:
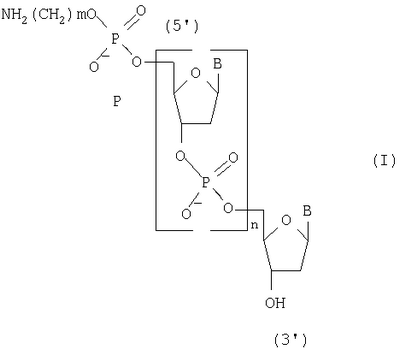
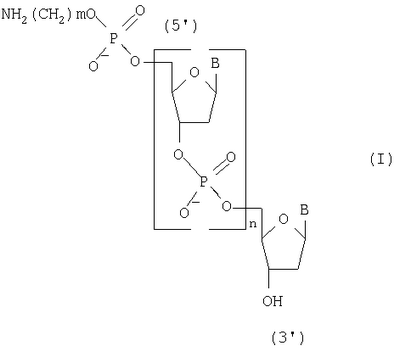
Изобретение относится к способу получения 5′-аминоакилофосфат олигодезоксирибонуклеотидов общей формулы (I), где В – остаток тимина, цитозина, аденина и гуанина, m=2-6 и n=1-20, на твердофазном носителе, которые могут быть использованы в молекулярной биологии и медицине в качестве исходных соединений для получения 5′-модифицированных олигодезоксирибонуклеотидных реагентов. Способ включает промывку растворителем носителя, с закрепленным на нем нуклеозидом, содержащим 5′-O-защитную группу, удаление 5′-O-защитной группы нуклекозида, связанного с носителем, повторную промывку растворителем твердофазного носителя с закрепленным на нем нуклеозидом, содержащим 5′-гидроксильную группу, смешивание N,5′-защищенных дезоксирибонуклеозид-3′-Н-фосфонатов с активирующим реагентом, подачу смеси в реактор, конденсацию с 5′-гидроксильной группой концевого нуклеозида, связанного с носителем, повторение этих операций до получения N-защищенного олигодезоксирибонуклеозид Н-фосфоната с необходимым числом мономерных звеньев, применяя на последней стадии N-защищенный аминоалкил H-фосфонат, обработку полученного соединения раствором йода с последующей промывкой реактора, отщепление носителя и удаление N-защитных групп водным аммиаком. При этом смешивание N,5′-защищенных дезоксирибонуклеозид-3′-Н-фосфонатов с активирующим реагентом и подачу смеси в реактор проводят за 0,4-0,5 секунды, а конденсацию с 5′-гидроксильной группой концевого нуклеозида за 2-3 секунды, причем эти операции повторяют 14-20 раз при температуре реагентов на всех стадиях синтеза, равной 30-35°С. Способ позволяет повысить производительность способа за счет сокращения времени получения N-защищенных 5′-аминоалкилфосфат олигодезоксирибонуклеотидов и экономии используемых реагентов.
(56) (продолжение): CLASS=”b560m”полимерном носителе. Введение спиновых, флуоресцентных и других меток. Биоорганическая химия. 1988, том 14, №5, стр.606-614. SU 1773916 A1, 07.11.1992. RU 2131881 C1, 02.06.1999. ЕР 0101985 А1, 05.08.1983.
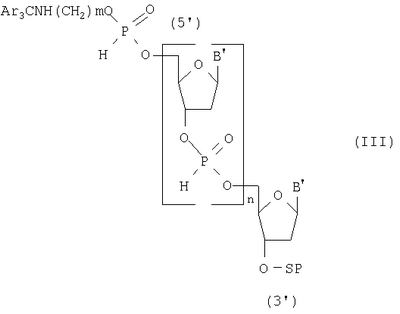
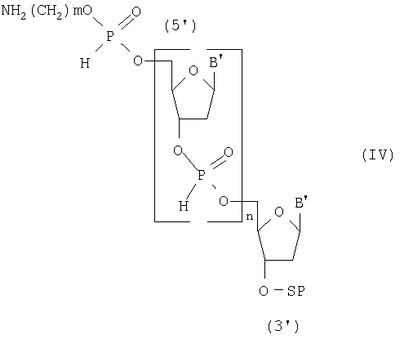
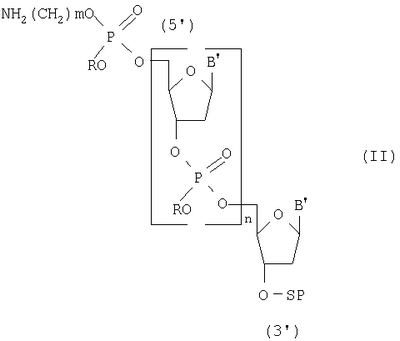
Изобретение относится к области биоорганической химии, а именно к способу получения 5′-аминоалкилфосфат олигодезоксирибонуклеотидов общей формулы I где В – остаток аденина, гуанина, тимина и цитозина, m=2-6 и n=1-20, которые могут быть использованы в молекулярной биологии и медицине в качестве исходных соединений для получения 5′-модифицированных олигодезоксирибонуклеотидных реагентов. Известен способ получения 5′-аминоалкилфосфат олигодезоксирибонуклеотидов общей формулы I путем получения N,Р-защищенных 5′-аминоалкилфосфат олигодезоксирибонуклеотидов общей формулы II где R – твердофазным фосфоамидитным методом и обработки полученных соединений водным аммиаком для удаления N,P-защитных групп и носителя [Kaiser R.J., MacKellar S.L., Vinayak R.S., 1989, Nucleic Acids Research, v.17, N15, pp.6087-6102]. Недостатками данного способа являются высокая концентрация мономеров (0,1-0,15 М) и активирующего реагента, необходимость проведения стадий копирования и окисления в каждом цикле и большое время одного цикла наращивания цепи (больше пяти минут). Наиболее ближайшим к заявляемому способу-прототипом является способ получения 5′-аминоалкилфосфат олигодезоксирибонуклеотидов общей формулы I путем получения 5′,N-защищенных 5′-аминоалкилфосфат олигодезоксирибонуклеозид Н-фосфонатов общей формулы III где Ar3С – защитная группа (пиксил, монометокситритил или диметокситритил), SP – твердофазный носитель, В’ – остаток N6-бензоиладенина, N2-изобутирилгуанина, N4-бензоилцитозина и тимина, m=2-6 и n=11-29, твердофазным H-фосфонатным методом и последовательной обработкой полученных соединений раствором йода, водным аммиаком и уксусной кислотой [Sinha N.D., Cook R.M., 1988, Nucleic Acid Research, v.16, N.6, pp.2659-2669]. Получение 5′-аминоалкилфосфат олигодезоксирибонуклеотидов на твердой фазе (0,1 микромолярный масштаб) при комнатной температуре в синтезаторе состоит из следующих стадий: 1) промывка реактора с твердофазным носителем безводным ацетонитрилом (45 секунд); 2) удаление 5′-защитной группы с нуклеозида (или олигодезоксирибонуклеозид Н-фосфоната), присоединенного к твердофазному носителю 2,5%-ным раствором дихлоруксусной кислоты в дихлорметане (60 секунд); 3) промывка реактора с носителем смесью безводных пиридина и ацетонитрила (45 секунд); 4) смешивание раствора мономера (0,01 М N,5′-защищенный дезоксирибонуклеозид 3′-Н-фосфонат) и раствора активирующего реагента (0,05 М пивалоил хлорид), подача смеси в реактор и конденсация с 5′-гидроксильной группой концевого нуклеозида, связанного с носителем (90 секунд), при этом расход мономера на присоединение одного звена составляет 2,5 мг; 5) повторение операций 1-4 до получения защищенного олигодезоксирибонуклеозид Н-фосфоната с необходимым числом мономерных звеньев (время цикла присоединения одного мономерного звена составляет 240 секунд); 6) проведение операций 1-3 для получения свободной 5′-гидроксильной группы; 7) смешивание чередованием доз раствора N-защищенного амино-алкил-Н-фосфоната (концентрация 25 мг/мл в смеси безводных пиридина и ацетонитрила) и раствора активирующего агента (200 мМ пивалоил хлорид в смеси безводных пиридина и ацетонитрила), подача смеси в реактор и конденсация с 5′-гидроксильной группой концевого нуклеозида, связанного с носителем (90 секунд); 8) превращение Н-фосфонатных групп в фосфатные группы обработкой раствором 0,16 М йода в смеси (18:7:1) тетрагидрофуран, вода, N-метилимидазол (40 минут). Полученные соединения обрабатывают водным аммиаком для удаления N-защитных групп и носителя, выделяют продукт методом обращеннофазовой высокоэффективной жидкостной хроматографии и обрабатывают 80%-ной уксусной кислотой для удаления 5′-защитных групп. Недостатками прототипа являются большое время одного цикла наращивания цепи (240 секунд) и повышенный расход исходных мономеров (2,5 мг на присоединение одного звена). Технической задачей настоящего изобретения является повышение производительности способа получения 5′-аминоалкилфосфат олигодезоксирибонуклеотидов общей формулы I за счет сокращения времени получения N-защищенных 5′-аминоалкилфосфат олигодезоксирибонуклеозид Н-фосфонатов общей формулы IV и экономии используемых реагентов. Поставленная техническая задача достигается предлагаемым способом, включающим промывку растворителем твердофазного носителя с закрепленным на нем нуклеозидом, содержащим 5′-O-защитную группу, удаление 5′-O-защитной группы нуклеозида, связанного с носителем, повторную промывку растворителем твердофазного носителя с закрепленным на нем нуклеозидом, содержащим 5′-гидроксильную группу, смешивание раствора N,5′-защищенного дезоксирибонуклеозид 3′-Н-фосфоната и раствора активирующего реагента и подачу смеси в реактор за время 0,4-0,5 секунды, конденсацию с 5′-гидроксильной группой концевого нуклеозида, связанного с носителем, за 2-3 секунды, причем операции смешивания, подачи и конденсации повторяют 14-20 раз, повторение всех вышеперечисленных операций до получения N-защищенного N-аминоалкилфосфат олигодезоксирибонуклеозид Н-фосфоната с необходимым числом мономерных звеньев, применяя на последней стадии N-защищенный аминоалкил H-фосфонат, обработку полученного соединения раствором йода с последующей промывкой реактора при температуре реагентов на всех стадиях синтеза, равной 30-35°С, отщепление носителя и удаление N-защитных групп водным аммиаком. Расход исходного мономера на присоединение одного звена составляет 0,4-0,6 мг. Определяющим отличием заявляемого способа от прототипа является экспериментально подобранный оптимальный режим проведения синтеза, а именно смешивание N,5′-защищенных дезоксирибонуклеозид 3′-Н-фосфонатов с активирующим реагентом и подача их в реактор с носителем за время 0,4-0,5 секунды, конденсация с 5′-гидроксильной группой концевого нуклеозида, связанного с носителем, за 2-3 секунды, причем эти операции повторяют 14-20 раз при температуре реагентов на всех стадиях синтеза, равной 30-35°С, что позволило повысить производительность способа, и это было не очевидно на основании известных закономерностей протекания химических реакций, однако стало возможным за счет предварительно установленной зависимости эффективности присоединения N,5′-защищенных дезоксирибонуклеозид 3′-Н-фосфонатов к наращиваемой цепи от времени, прошедшего после их смешивания с раствором активирующего реагента. Сокращение времени смешивания и подачи смеси мономеров и конденсирующего агента приводит к более эффективному образованию межнуклеотидной связи на твердофазном носителе, что позволяет сократить время одного цикла наращивания цепи в 6 раз (с 240 до 36 сек) и расход используемых дефицитных реактивов в 4-6 раз. Изобретение иллюстрируется следующими примерами конкретного выполнения. Пример 1. Получение 5′-(4-аминобутилфосфат) декадезоксирибонуклеотида NH2(CH2)4p-5′-d(ACGTCCTTAG). Синтез проводили по специальной программе на синтезаторе АСМ-10У фирмы «БИОССЕТ» (Россия), управляемом персональным компьютером. В качестве твердофазного носителя использовали CPG-500 (фирма «Serva», Германия) с емкостью по нуклеозиду – 23 мкмоль/г. Объем реактора – 0,012 мл (5 мг носителя), масштаб синтеза – 0,1 микромолярный, температура термостата синтезатора – 30°С. Осуществили: 1) промывку реактора с твердофазным носителем безводным ацетонитрилом (0,3 мл, 6 секунд); 2) удалили 5′-О-защитную группу (монометокситритил) обработкой 3%-ным раствором трифторуксусной кислоты в дихлорметане (0,2 мл, 8 секунд); 3) промыли реактор безводным ацетонитрилом (0,3 мл, 6 секунд); 4) провели смешивание 2 мкл раствора мономера (15 мг N,5′-защищенного дезоксирибонуклеозид 3′-Н-фосфоната в 1 миллилитре смеси (1:1) безводных пиридина и ацетонитрила) и 2 мкл раствора активирующего реагента (0,10 мл пивалоил хлорида в 9 мл смеси (1:1) безводных пиридина и ацетонитрила) и подачу смеси в реактор за время 0,4 секунды, конденсацию с 5′-гидроксильной группой концевого нуклеозида, связанного с носителем, за 3 секунды, причем операции смешивания, подачи и конденсации повторяли 20 раз в течение 16 секунд; 5) повторяли все вышеперечисленные операции 9 раз до получения N-защищенного олигодезоксирибонуклеозид Н-фосфоната длиной 10 звеньев (время цикла присоединения одного мономерного звена составляет 36 секунд); 6) повторили операции 1-3 для получения свободной 5′-гидроксильной группы; 7) провели смешивание 2 мкл раствора мономера (5 мг N-монометокситритил 4-аминобутил Н-фосфоната в 1 мл смеси (1:1) безводных пиридина и ацетонитрила) и 2 мкл раствора активирующего реагента (0,10 мл пивалоил хлорида в 9 мл смеси (1:1) безводных пиридина и ацетонитрила) и подачу смеси в реактор за время 0,4 секунды, конденсацию с 5′-гидроксильной группой концевого нуклеозида, связанного с носителем, за 3 секунды, причем операции смешивания, подачи и конденсации повторяли 20 раз в течение 16 секунд; 8) повторили операции 1-3; 9) обработали реактор с 5′-(4-аминобутилфосфат) декадезоксирибонуклеозид H-фосфонатом 0,1 М раствором йода в смеси (160:40:4) диоксана, пиридина и воды (0,3 мл, 5 минут); 10) промыли реактор безводным ацетонитрилом (0,3 мл, 6 секунд). По завершении синтеза носитель переносили из реактора в полиэтиленовую пробирку, обрабатывали 25%-ным водным аммиаком (0,5 мл) для отщепления носителя и удаления N-защитных групп при температуре 57°С в течение 18 часов и выделяли продукт методом электрофореза в полиакриламидном геле. Расход мономера в одном цикле – 0,6 мг. Время одного цикла наращивания цепи – 36 секунд. Выход продукта – 2,5 о.е. (при длине волны 260 нм). Пример 2. Получение 5′-(6-аминогексилфосфат) генэйкозадезоксирибонуклеотида NH2(CH2)6p-5′-d(CCAATTGTCACGTCCTTCAGA) Продукт получали, как в примере 1, но 1) температура термостата равнялась 35°С; 2) концентрация мономеров составляла 10 мг/мл смеси; 3) объем дозы реагентов – 0,003 мл раствора; 4) время смешивания растворов – 0,5 секунды; 5) время конденсации – 2 секунды; 6) операции смешивания, подачи и конденсации повторяли 14 раз; 7) повторяли все вышеперечисленные операции 20 раз до получения N-защищенного олигодезоксирибонуклеозид Н-фосфоната длиной в 21 звено; 8) использовали N-монометокситритил 6-аминогексил H-фосфонат. Расход мономера в одном цикле – 0,4 мг. Время одного цикла наращивания цепи – 36 секунд. Выход целевого продукта – 2,2 о.е. (при длине волны 260 нм). Способ позволяет с высокой производительностью получать целевой продукт, затрачивая при этом меньшее количество дефицитных реактивов.
Формула изобретения
Способ получения 5′-аминоакилофосфат олигодезоксирибонуклеотидов общей формулы I где В – остаток аденина, гуанина, тимина и цитозина, m=2-6 и n=1-20, на твердофазном носителе, включающий промывку растворителем носителя, с закрепленным на нем нуклеозидом, содержащим 5′-O-защитную группу, удаление 5′-O-защитной группы нуклекозида, связанного с носителем, повторную промывку растворителем твердофазного носителя, с закрепленным на нем нуклеозидом, содержащим 5′-гидроксильную группу, смешивание N,5′-защищенных дезоксирибонуклеозид-3′-Н-фосфонатов с активирующим реагентом, подачу смеси в реактор, конденсацию с 5′-гидроксильной группой концевого нуклеозида, связанного с носителем, повторение этих операций до получения N-защищенного олигодезоксирибонуклеозид Н-фосфоната с необходимым числом мономерных звеньев, применяя на последней стадии N-защищенный аминоалкил H-фосфонат, обработку полученного соединения раствором йода с последующей промывкой реактора, отщепление носителя и удаление N-защитных групп водным аммиаком, отличающийся тем, что смешивание N,5′-защищенных дезоксирибонуклеозид-3′-Н-фосфонатов с активирующим реагентом и подачу смеси в реактор проводят за 0,4-0,5 с, а конденсацию с 5′-гидроксильной группой концевого нуклеозида за 2-3 с, причем эти операции повторяют 14-20 раз при температуре реагентов на всех стадиях синтеза, равной 30-35°С.
|
||||||||||||||||||||||||||

 -АМИНОАЛКИЛФОСФАТ ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДОВ
-АМИНОАЛКИЛФОСФАТ ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДОВ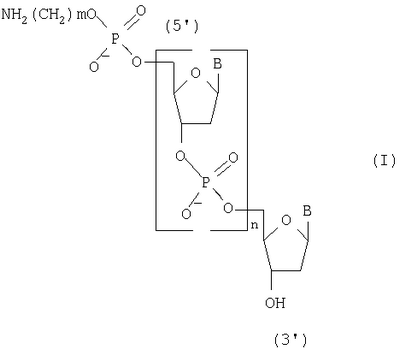
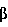 -цианоэтил, SP – твердофазный носитель, В’ – остаток N6-бензоиладенина, N2-изобутирилгуанина, N4-бензоилцитозина и тимина, m=2-6 и n=1-24,
-цианоэтил, SP – твердофазный носитель, В’ – остаток N6-бензоиладенина, N2-изобутирилгуанина, N4-бензоилцитозина и тимина, m=2-6 и n=1-24,