Патент на изобретение №2292336
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ 2-ОКСО-1-ПИРРОЛИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
(57) Реферат:
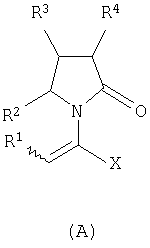
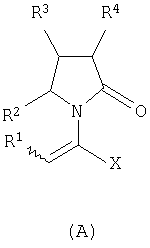
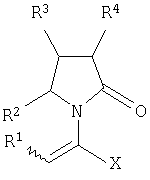
Изобретение относится к новым производным 2-оксо-1-пирролидина общей формулы (А) и их фармацевтически приемлемым солям
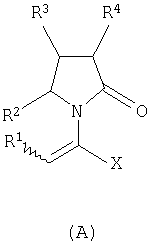
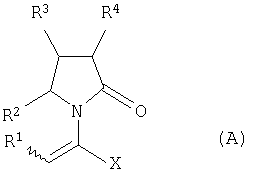
где Х означает -CONR5R6, -COOR7 или -COR8; R1 представляет собой Н, галоген, C1-С6алкил; R2 и R4 являются одинаковыми или различными и каждый независимо означает Н, галоген, C1-С6алкил; R3 означает Н, галоген, C1-С6 алкил, замещенный одним или более галогеном C2-C5 алкенил; R5, R6, R7 являются одинаковыми или различными и каждый независимо означает Н, C1-C6 алкил; R8 означает -ОН, С1-С6 алкил. Соединения (А) могут быть использованы для получения (S)-(-)-
Изобретение касается 2-оксо-1-пирролидиновых производных, способа их получения, а также применения. Изобретение также касается способа получения производных Особенно изобретение касается новых промежуточных продуктов и их применения для получения (S)-(-)-
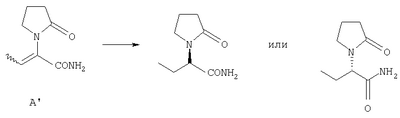
Леветирацетам, левовращающее соединение, описано в качестве защитного агента для лечения и профилактики гипоксийного и ишемического типа заболеваний центральной нервной системы в ЕР 162036. Указанное соединение также эффективно при лечении эпилепсии, но терапевтическое проявление его, как было продемонстрировано, полностью исчезает в случае правовращающего энантиомера (R)-(+)- Ассиметрический атом углерода несет атом водорода (не показано), находящийся выше листа бумаги. Получение Леветирацетама было описано в ЕР 0162036 и в патенте GB 2225322. Получение правовращающего энантиомера (R)-(+)- В одном аспекте изобретение представляет собой соединение, имеющее общую формулу (А) и его фармацевтически приемлемые соли,
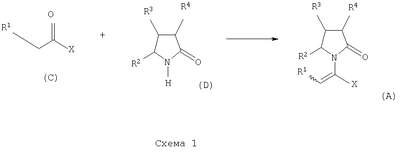
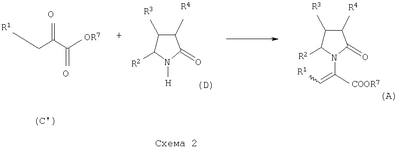
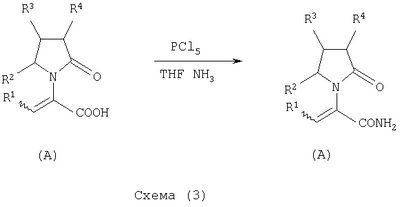
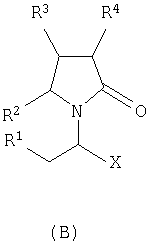
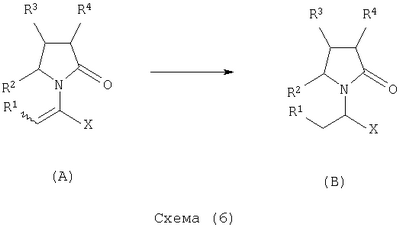
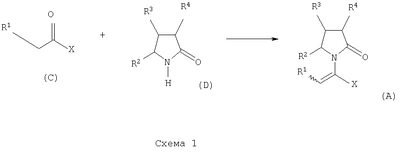
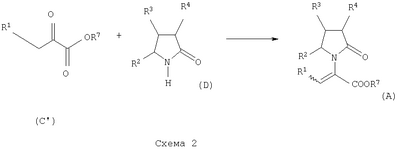
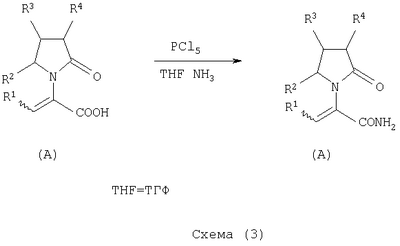
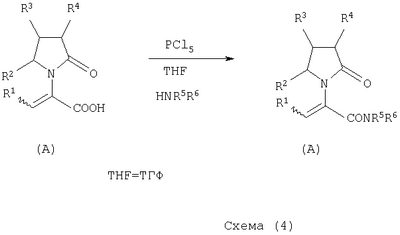
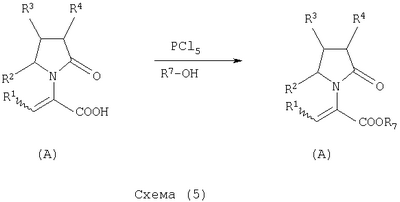
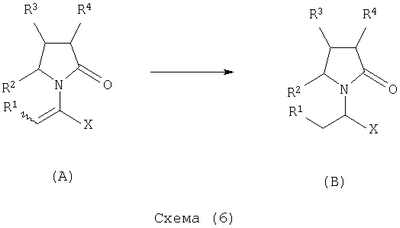
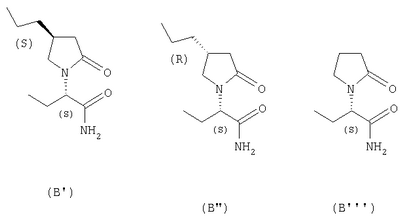
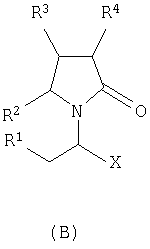
где Х представляет собой -CONR5R6 или -COOR7 или -CO-R8 или CN; R1 является водородом или алкилом, арилом, гетероциклоалкилом, гетероарилом, галогеном, гидрокси, амино, нитро, пиано; R2, R3, R4 являются одинаковыми или различными и каждый независимо представляет собой водород или галоген, гидрокси, амино, нитро, циано, ацил, ацилокси, сульфонил, сульфинил, алкиламино, карбокси, простой эфир, сложный эфир, амидо, сульфоновую кислоту, сульфонамид, алкилсульфонил, арилсульфонил, алкоксикарбонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, алкил, алкокси, оксисложный эфир, оксиамидо, арил, ариламино, арилокси, гетероциклоалкил, гетероарил, винил; R5, R6, R7 являются одинаковыми или различными и каждый независимо представляет собой водород, гидрокси, алкил, арил, гетероциклоалкил, гетероарил, алкокси, арилокси; и R8 представляет собой водород, гидрокси, тиол, галоген, алкил, арил, гетероциклоалкил, гетероарил, алкилтио, арилтио. Термин “алкил” включает насыщенные одновалентные углеводородные радикалы, имеющие линейные, разветвленные или циклические остатки или их комбинациии, содержащие 1-20 атомов углерода, предпочтительно 1-5 атомов углерода. Алкильная группа может быть необязательно замещенной от 1 до 5 заместителями, независимо выбранными из группы, включающей галоген, гидрокси, тиол, амино, нитро, циано, ацил, ацилокси, сульфонил, сульфинил, алкиламино, карбокси, простой эфир, сложный эфир, амидо, сульфоновую кислоту, сульфонамид, алкилсульфонил, арилсульфонил, алкоксикарбонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, оксисложный эфир, оксиамидо, гетероциклоалкил, гетероарил, винил, (С1-С5)алкокси, (С6-С10) арилокси, (С6-С10)арил. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере группой, выбранной из галогена, гидрокси, тиола, амино, нитро, циано, такие как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил. Термин “гетероциклоалкил” представляет собой “(С1-С6)циклоалкил”, как определено выше, имеющий по крайней мере один О, S и/или N атом, прерывающий карбоциклическую кольцевую структуру, такой как тетрагидрофуранил, тетрагидропиранил, пиперидинил, пиперазинил, морфолино и пирролидинильные группы или те же группы, замещенные по крайней мере группой, выбранной из галогена, гидрокси, тиола, амино, нитро, циано, Термин “алкокси” включает -О-алкильные группы, где “алкил” определен выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой, такие как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил. Термин “алкилтио” включает -S-алкильные группы, где “алкил” определен выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой, такой как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-диброметил, 1,1 -диметил-2,2,2-трихлорэтил. Термин “алкиламино” включает -NHалкил или -N(алкил)2 группы, где “алкил” имеет значение, как определено выше. Предпочтительными алкильными группами являются метил, этил, н-пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Термин “арил” включает органический радикал, полученный из ароматического углеводорода путем удаления одного водорода, такой как фенил, фенокси, нафтил, арилалкил, бензил, необязательно замещенный от 1 до 5 заместителями независимо выбранными из группы, такой как галоген, гидрокси, тиол, амино, нитро, циано, ацил, ацилокси, сульфонил, сульфинил, алкиламино, карбокси, простой эфир, сложный эфир, амидо, сульфоновая кислота, сульфонамид, алкилсульфонил, алкоксикарбонил, алкилсульфинил, алкилтио, оксисложный эфир, оксиамидо, арил, (С1-С6)алкокси, (С6-С10)арилокси и (С1-С6)алкил. Арильный радикал состоит из 1-3 колец, предпочтительно из одного кольца и содержит 2-30 атомов углерода, предпочтительно 6-10 атомов углерода. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, нафтил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “ариламино” включает -NHарил или -N(арил)2 группы, где “арил” определен выше. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “арилокси” включает -O-арильные группы, где “арил” определен выше. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “арилтио” включает -S-арильные группы, где “арил” определен выше. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “галоген” включает атом Cl, Br, F, I. Термин “гидрокси” представляет собой группу формулы -ОН. Термин “тиол” представляет собой группу формулы-SH. Термин “циано” представляет собой группу формулы -CN. Термин “нитро” представляет собой группу формулы -NO2 Термин “амино” представляет собой группу формулы -NH2 Термин “карбокси” представляет собой группу формулы -СООН. Термин “сульфоновая кислота” представляет собой группу формулы – SO3Н. Термин “сульфонамид” представляет собой группу формулы – SO3NH2. Термин “гетероарил” представляет собой “арил” как он определен выше, имеющий по крайней мере один О, S и/или N атом, прерывающий карбоциклическую кольцевую структуру, такой как пиридил, фурил, пирролил, тиенил, изотиазолил, имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, изобензофурил, бензотиенил, пиразолил, индолил, изоиндолил, пуринил, карбазолил, изоксазолил, тиазолил, оксазолил, бензтиазолил или бензоксазолил, необязательно замещенный от 1 до 5 заместителями, независимо выбранными из группы, включающей гидрокси, галоген, тиол, амино, нитро, пиано, ацил, ацилокси, сульфонил, сульфинил, алкиламино, карбокси, сложный эфир, простой эфир, амидо, сульфоновую кислоту, сульфонамид, алкилсульфонил, алкоксикарбонил, оксисложный эфир, оксиамидо, алкоксикарбонил, (С1-С5)алкокси и (С1-С5)алкил. Термин “арилалкил” представляет собой группу формулы арил-(С1-С4 алкил)-. Предпочтительными арилалкильными группами являются бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил, дифенилметил, (4-метоксифенил)дифенилметил. Термин “ацил” представляет собой радикал карбоновой кислоты и, таким образом, он включает группы формулы алкил-СО-, арил-СО-, гетероарил-СО-, арилалкил-СО-, где различные углеводородные радикалы определены в данной части описания. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “оксиацил” представляет собой радикал карбоновой кислоты и, таким образом, он включает группы формулы алкил-СО-O-, арил-СО-O-, гетероарил-СО-O-, арилалкил-СО-O-, где различные углеводородные радикалы определены в данной части описания. Предпочтительными алкильными и арильными группами являются те же, что определены для ацильной группы. Термин “сульфонил” представляет собой группу формулы -SO2-алкил или -SO2-арил, где “алкил” и “арил” определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “сульфинил” представляет собой группу формулы -SO-алкил или -SO-арил, где “алкил” и “арил” определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “сложный эфир” означает группу формулы -СОО-алкил, или -СОО-арил, где “алкил” и “арил” определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “оксисложный эфир” означает группу формулы -O-СОО-алкил или -O-СОО-арил где “алкил” и “арил” определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “простой эфир” означает группу формулы алкил-О-алкил или алкил-О-арил или арил-О-арил, где “алкил” и “арил” определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “амидо” означает группу формулы -CONH2 или -CONHалкил или -CON(алкил)2 или -CONHарил или -CON(арил)2, где “алкил” и “арил” определены выше. Предпочтительно алкил имеет 1-4 атомов углерода и арил имеет 6-10 атомов углерода. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Термин “оксиамидо” означает группу формулы -O-CONH2 или -О-CONHалкил или -O-CON(алкил)2 или -О-CONHарил или -O-CON(арил)2, где “алкил” и “арил” определены выше. Предпочтительно алкил имеет 1-5 атомов углерода и арил имеет 6-8 атомов углерода. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил. Предпочтительно R1 представляет собой метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой, такой как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил. Предпочтительно R2, R3 и R4 независимо представляют собой водород или галоген, или метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой, такую как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил. Предпочтительно R5 и R6 независимо представляют собой водород, метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил. Предпочтительно R7 представляет собой водород, метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил, метокси, этокси, фенил, бензил или те же группы, замещенные по крайней мере галогенной группой, такие как трифторметил, хлорфенил. Предпочтительно R8 представляет собой водород, метил, этил, пропил, изопропил, бутил, изо- или трет-бутил, 2,2,2-триметилэтил, фенил, бензил или те же группы, замещенные по крайней мере галогенной группой, такие как трифторметил, хлорбензил или те, в которых Х является -CN. Если другое не отмечено, в отношении соединений общей формулы (А) либо индивидуально, либо их смеси подразумевается, что они включают геометрические изомеры, т.е. оба Z и Е изомеры и их смеси (рацематы). Что касается способа ассиметрического гидрирования описанного ниже, лучшие результаты были получены для Z и Е изомеров соединений формулы (А), где R1 представляет собой метил, R2 и R4 представляет собой Н и Х является-CONH2, или -СООМе, или -COOEt, или -СООН. В указанной группе соединения 1, в которых R3 представляет собой водород, алкил (особенно пропил) или галогеналкенил (особенно дифторвинил) особенно хорошо пригодны. Аспект изобретения касается способа получения соединения, имеющего общую формулу (А). Указанный способ включает следующие реакции. Соединения, имеющие общую формулу (А), где Х является -CONR5R6 или -COOR7, или -CO-R8, или CN могут быть приемлемо получены путем взаимодействия производного Соединения, имеющие общую формулу (А), где Х представляет собой -COOR7 могут быть приемлемо получены путем взаимодействия производного Пригодные условия реакции включают применение толуола при кипении с обратным холодильником. В полученном соединении (А), R7 может легко быть превращенным из Н в алкил или из алкила в H. Производные общей формулы (С) или (С’) и пирролидоны общей формулы (D) хорошо известны специалисту в этой области и могут быть получены согласно синтезу, приведенному в литературе, такой как в “Handbook of Heterocyclic Chemistry” by A.Katrisky. Pergamon, 1985 (Chapter 4.) и в “Comprehensive Heterocyclic Chemistry” by A. Katrisky & C.W.Rees, Pergamon, 1984 (Volume 4, Chapters 3.03 & 3.06). Соединения общей формулы (А), где Х представляет собой-CONH2 или -CONR5R6 могут быть приемлемо получены путем превращения соответствующей кислоты (соединение формулы (А), где Х представляет собой СО2Н) в хлорангидрид кислоты с последующим аммонолизом или реакцией с первичным или вторичным амином общей формулы HNR5R6. Следующие две схемы (3 и 4) описывают такой способ: Указанные реакции предпочтительно осуществляют, используя PCl5, что дает хлорангидрид кислоты, а затем безводный аммиак или первичный или вторичный амин формулы HNR5R6, что дает желаемый енамид амида. Соединения общей формулы (А), где Х представляет собой-COOR7 могут быть приемлемо получены путем превращения соответствующей кислоты (соединение (А), где Х представляет собой СООН), полученной по схеме (2), в хлорангидрид кислоты с последующим алкоголизом с соединением формулы R7-OH (спирт), где R7 определен выше, (смотри схему 5). Указанные реакции предпочтительно осуществляют, используя PCl5, что дает хлорангидрид кислоты, с последующим алкоголизом с R7-OH, что дает желаемый сложный эфир. Условия вышеупомянутых реакций хорошо известны специалистам в этой области. В другом аспекте изобретение касается применения соединения формулы (А) для синтеза промежуточных продуктов. Соединение формулы (А), где Х представляет собой -CONH2 особенно интересно, поскольку каталитическое гидрирование указанного соединения приводит непосредственно к Леветирацетаму. Оба Z и Е изомера указанных соединений подвергаются быстрому и селективному ассиметричному гидрированию до любого энантиомера желаемого продукта. Положение связи, присоединяющей группу R1 к молекуле, определяет либо Z изомер, либо Е изомер. Как частный пример, применение соединений (А) для синтеза соединений (В) может быть проиллюстрировано согласно следующей схеме (6): где R1, R2, R3, R4 и Х определены выше. Предпочтительно, R1 представляет собой метил, этил, пропил, изопропил, бутил или изобутил; наиболее предпочтительно метил, этил или н-пропил. Предпочтительно, R2 и R4 независимо представляют собой водород или галоген или метил, этил, пропил, изопропил, бутил, изобутил; и, наиболее предпочтительно, каждый является водородом. Предпочтительно, R3 представляет собой С1-C5 алкил, С2-C5 алкенил, С2-С5 алкинил, циклопропил, азидо, каждый необязательно замещен одним или более галогеном, циано, тиоциано, азидо, алкилтио, циклопропилом, ацилом и/или фенилом; фенил; фенилсульфонил; фенилсульфонилокси, тетразол, тиазол, тиенил, фурил, пиррол, пиридин, где любая фенильная часть может быть замещена от одного или более галогеном, алкилом, галогеналкилом, алкокси, нитро, амино, и/или фенилом; наиболее предпочтительными являются метил, этил, пропил, изопропил, бутил или изобутил. Предпочтительно, Х представляет собой -СООН или -СООМе или -COOEt или -CONH2: наиболее предпочтительно -CONH2. Соединения формулы (В) могут быть выделены в свободной форме или преобразованы в их фармацевтически приемлемые соли, или наоборот, обычным путем. Предпочтительные индивидуальные соединения среди соединений, имеющих общую формулу (В), имеют формулы (В’), (В”) и (В'”). Соединения формулы (В) являются подходящими для применения при лечении эпилепсии и родственных заболеваний. Согласно другому воплощению изобретение соответственно касается способа получения соединения, имеющего формулу (В)
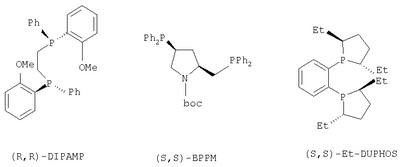
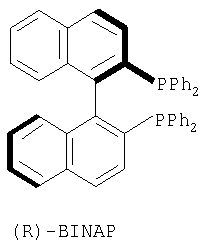
где R1, R2, R3, R4 и Х определены выше, через каталитическое ассиметрическое гидрирование соответствующего соединения, имеющего формулу (А), как проиллюстрированно и определено выше. Каталитическое гидрирование описано во многих публикациях или книгах, таких как “Synthese et catalyse asymetriques – auxiliaires et ligandas chiraux” Jacqueline Seyden-Penne (1994) – Savoirs actuel. interEdition/CNRS Edition – CH 7.1 “hydrogenation catalytique” page 287-300. Если другое не отмечено, в отношении соединений общей формулы (В) либо индивидуальных, либо их смесей, то предполагается, что они включают геометрические изомеры, т.е. оба Z и Е изомеры, также как энантиомеры, диастериоизомеры и их смеси (рацематы). Предпочтительно, способ по изобретению касается получения соединения формулы (В), в которой R2 и R4 представляет собой водород и Х представляет собой -СООН или -СООМе или -COOEt или -CONH2 и R1 представляет собой метил, особенно те, в которых R3 является водородом, алкилом (особенно пропилом) или галогеналкенилом (особенно дифторвинилом). Лучшие результаты были получены в способе получения леветирацетама, соединения формулы (В), в котором R1 представляет собой метил, R2 и R4 представляет собой водород, R3 представляет собой водород, пропил или дифторвинил и Х представляет собой -CONH2. Как правило, указанный способ содержит стадию каталитического гидрирования соединения формулы (А), как описано выше. Предпочтительно соединение формулы (А) подвергается ассиметричному гидрированию путем использования хирального катализатора, основанного на хелате родия (Rh) или рутения (Ru). Методики ассиметричного гидрирования описаны во многих публикациях или книгах, таких как “Asymmetric Synthesis” RA Aitken и S.N.Kilenyi (1992) – Blackie Academic & Professional или “Synthesis of Optically active – Amino Acids” Robert M. Willimas (1989) – Pergamon Press. Rh(I) – и Ru(II) – комплексы хиральных хелатирующих лигандов, как правило, представляют собой дифосфины, и они имеют большой успех в процессе ассиметричного гидрирования олефинов. Много хиральных бидентантных лигандов, таких как дифосфиниты, бис(аминофосфин) и аминофосфинфосфиниты или хиральные каталитические комплексы, описаны в литературе или являются коммерчески доступными. Хиральный катализатор может также быть ассоциатирован с противоионом и/или олефином. Хотя было накоплено много информации относительно каталитической активности и стереоселективности хиральных катализаторов, выбор лигандов, хиральных катализаторов и условий реакции все еще осуществляют опытным путем для каждого индивидуального соединения. Как правило, основанные на Rh(I) системы, в большинстве случаев используют для получения аминокислотных производных, в то время как Ru(II) катализаторы дают хорошие или отличные результаты с намного более широкой группой олефиновых субстратов. Хелаты хиральных катализаторов, которые могут быть использованы в настоящем изобретении, представляют собой DUPHOS, ВРРМ, BICP, BINAP, DIPAMP, SKEWPHOS, BPPFA, DIOP, NORPHOS, PROPHOS, PENNPHOS, QUPHOS, ВРРМС, BPPFA. В дополнение к сказанному могут быть получены из приведенных хелатов и использованы в соответствии с изобретением катализаторы на подложке или же иммобилизованные катализаторы, что дает либо улучшенные превращения, либо улучшенные селективность в дополнение к улучшенному восстановлению катализатора и рециклу. Предпочтительными хелатами хиральных катализаторов, пригодными для применения для методики указанного изобретения, являются из DUPHOS или Метил, Диэтил, Диизопропил-DUPHOS (1,2-бис-(2,5-диметилфосфолано)бензол – US 5171892), DIPAMP (Фосфин, 1,2-этандиилбис ((2-метоксифенил)фенил – патенты US 4008281 и 4142992), ВРРМ (1-пирролидинкарбоновая кислота, 4-(дифенилфосфино)-2-((дифенилфосфино)метил)-,1,1-диметилэтиловый сложный эфир – Японский патент 87045238) и BINAP (Фосфин, (1,1′-бинафтален)-2,2′-диилбис(дифенил) -ЕР 0366390). Структуры указанных хелатов приведены ниже.
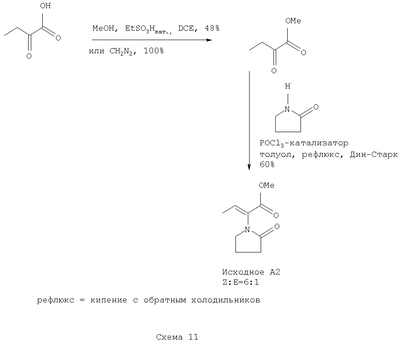
Предпочтительные растворители для применения в методике указанного изобретения выбраны из тетрагидрофурана (ТГФ=THF), диметилформамида (ДМФА), этанола, метанола, дихлорметана (ДХМ), изопропанола (IPA), толуола, этилацетата (AcOEt). Противоион выбирают из галоида (галоген(-)), BPh4(-), ClO4(-), BF4(-), PF6(-), PCl6(-), ОАс(-), трифлата (OTf(-)), мезилата или тозилата. Предпочтительные противоионы для применения с указанными хиральными катализаторами выбирают из OTf(-), BF4(-) или ОАс(-). Олефин выбирают из этилена, 1,3-бутадиена, бензола, циклогексадиена, норборнадиена или циклоокта-1,5-диена (COD). Используя указанные хиральные катализаторы в комбинации с набором противоионов и при соотношениях катализатор-субстрат, находящихся в интервале 1:20 до 1:20,000, в наборе с коммерчески доступными растворителями, возможно превратить соединения формулы (А) в левовращающие или правовращающие энантиомеры соединений формулы (В), имеющие высокий % энантиомерного избытка (е.е.) и отличный выход, а также высокую степень чистоты. Более того, указанный путь использует стандартные промышленные установки и оборудование, а также более дешев. Указанный ассиметричный синтетический способ также более дешев, благодаря возможности рецикла и возможности отделения ненужного энантиомера, полученного в соответствующем синтетическом процессе. Лучшие результаты были достигнуты в способе получения (S)- Следуя указанному, сделана отсылка, в особенности к четырем соединениям формулы (А), в которых R1 представляет собой метил, R2, R3 и R4 представляют собой водород и, для соединения, которое далее определяется как исходное А1, Х представляет собой -СООН; для соединения, которое далее определяется как исходное А2, Х представляет собой -СООМе; для соединения, которое далее определяется как исходное А2′, Х представляет собой -COOEt; и для соединения, которое далее определяется как исходное A3, Х представляет собой -CONH2. Как будет понятно специалисту в этой области, в зависимости от заместителя, не все соединения общей формулы (А) и (В) способны образовывать соли так, что ссылку к фармацевтически приемлемым солям применяют только к таким соединениям общей формулы (А) или (В), которые имеют указанную способность. Следующие примеры должны обеспечить иллюстрацию изобретения, и они не должны рассматриваться как его ограничение. Специалисту в данной области понятно, что различные варианты и модификации следующих примеров могут быть осуществлены без выхода за границы изобретения. Пример 1 Получение исходного А1 осуществляют с 70% выходом сырого продукта путем взаимодействия Сырой продукт перекристаллизовывают из ацетона с 70% выходом. Геометрия двойной связи является Z, как определяют на базе корреляции спектральных данных 1Н-ЯМР (Ядерный Магнитный Резонанс) для известных соединений с аналогичной структурой. Пример 2 Исходный продукт А2 получают из А1 с диазометаном в ТГФ. Наблюдали Z-E изменения соотношения с 80:1 до 29:1 во время перегонки (смотри схему 8). Е-изомер исходного А21 получают, как показано на схеме 9 из Z-изомера исходного А1 с этанолом, дициклогексилкарбодимидом (DCC) и диметиламинопиридином (DMAP). Этерификацию исходного A1 также выполняют в небольших масштабах с PCl5 в ТГФ, затем СН3ОН, в результате чего образуются желаемые метиловые сложные эфиры (E:Z=5:1), смотри схему 10. Пример 3 Исходное А2 также получают путем взаимодействия метилового эфира кетомасляной кислоты и пирролидинона при кипении с обратным холодильником в толуоле в присутствии каталитического количества POCl3, смотри схему 11. Этерификацию кетомасляной кислоты осуществляют либо с метанолом, следуя известной методике, либо с диазометаном. Последующие конденсирование дает исходное А2 с 60% выходом. Указанная методика приводит к более высокому содержанию Е-изомера по сравнению с использованием пути синтеза через исходное А1 (схема 8). Оба пути позволяют получить другие производные эфирного исходного А2. Пример 4 Синтез исходного A3 активируют путем взаимодействия енамида кислоты с PCl5, что дает хлорангидрид кислоты, и затем вводят газообразный аммиак, чтобы получить желаемый енамид амида A3. Продукт был определен как Z-изомер. Сырой енамид амида A3 выделяют из реакционной смеси растворением его в ТГФ-СН3ОН и фильтрованием для того, чтобы удалить неорганические остатки. После упаривания растворителя получают твердое вещество желтого цвета. Сырой продукт очищают с помощью сухой флэш хроматографии с последующей перекристаллизацией из изо-PrOH, что обеспечивает получение чистого продукта. Указанная процедура успешно применяется для практического производства одной порции А3 (118 г, 54%, >99% максимальный пик) и она отражена на схеме 12. В большинстве случаев ассиметричного гидрирования исходных катализатор получают in situ путем взаимодействия [Rh(COD)2]+OTf– и соответствующего хирального лиганда в растворителе по выбору с последующим добавлением субстрата. Некоторые катализаторы являются коммерчески доступными и их используют без дальнейшей очистки. Пример 5 Результаты ассиметричного гидрирования исходных А1 и А2 при использовании ряда основанных на родии каталитических систем суммированы в Таблице 1. Эти реакции осуществляют с количеством катализатора, находящимся между 0.005 моль % и 5 моль % катализатора и 100 мг или 200 мг субстрата при температуре окружающей среды (комнатная температура: rt) в течение 24 ч. Условия реакции, такие как давление Н2, разновидность растворителей, количество исходного, модифицируют надлежащим образом, чтобы получить оптимальные условия. Все продукты выделяют упариванием растворителя из реакционной смеси и анализируют без дальнейшей очистки с помощью 1Н-ЯМР спектроскопии. HPLC (Высокоэффективная жидкостная хроматография) метод определения энантиомерного избытка в % (е.е.), полученного в результате гидрирования исходного А1, вызывает обоснованные трудности. Таким образом, проводят превращение сырых продуктов в их сложные метиловые эфиры, используя диазометан в растворе ТГФ. Затем эфирные производные анализируют, используя хиральный метод HPLC для отслеживания гидрирования енамида эфира А2. Для HPLC метода используют Chiracel OD4.6×250 мм колонку и IPA/н-гексан (95:05) в качестве элюента. Для гидрированного продукта исходного А2 результаты были получены с помощью следующей хиральной HPLC методики: Chiralcel OD 4.6×250 мм, IPA-Гексан (5:95 об/об), 205 нм, 1 мл/мин, при температуре окружающей среды (rt), образец 1 мг/мл, 13 мин (S-энантиомер), 16 мин (R-энантиомер). Сначала скрининг осуществляют на 100 мг шкале с 5 моль % катализатора. Результаты в % энантиомерного избытка (е.е.) положительны при выражениях процентного содержания левовращающего S-энантиомера и отрицательны при выражениях процентного содержания правовращающего R-энантиомера.
Пример 5.1. Получение метил(2S)-2-[2-оксо-(4S)-4-пропил-1-пирролидинил]бутеоната В колбу помещают 2 г метил(Z)-2-[2-оксо-(4S)-4-пропил-1-пирролидинил]-2-бутеоната, 20 мл безводного и дегазированного метанола и 27 мг (S,S)-Me-DUPHOS/Rh(BF4). Колбу продувают водородом, и давление водорода доводят до желаемого уровня. Реакционную смесь перемешивают в течение 20 ч при комнатной температуре, а затем концентрируют. Получают 1,96 г метил(2S)-2-[2-оксо-(4S)-4-пропил-1-пирролидинил]бутеоната. Пример 6: Ассиметричное гидрирование исходного A3 Используя тот же подход, что и в примере 5; ряд родиевых и рутениевых катализаторов анализируют, смотри схему 13 и Таблицу 2, получая следующие результаты.
Как показано выше, родиевые катализаторы получают in situ или покупают и используют без дальнейшей очистки. Рутенивые катализаторы получают согласно известных в литературе процессов. Большинство экспериментов проводят на уровне от 100 мг до 15 г продукта и от 0.001 моль % до 5 моль % катализатора. Сырые продукты анализируют с помощью 1Н, 13С ЯМР спектроскопии и хирального HPLC анализа. Пример 7: Ассиметричное гидрирование исходного A3 с Rh-(Et,Et)-DUPHOS. Результаты гидрирования A3 с Rh-DUPHOS катализатором приведены в Таблице 3. Эти реакции осуществляют аналогично примерам 5 и 6, с давлением водорода в 4 атмосферы. Обычно на энантиселективность в процессах гидрирования на Rh-DUPHOS катализаторах производных Тем не менее, отличные результаты были получены в ДХМ (дихлорметане). Как можно увидеть, энантиселективности от 97 до 98% е.е. постоянно достигают на субстрате на шкале в количестве от 0.5 до 15 г в указанном растворителе. Другие многообещающие результаты достигнуты в EtOAc-ДХМ смеси растворителей и в толуоле.
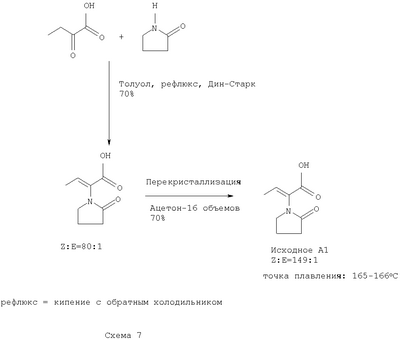
А. Получение исходного А1:(Z)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-бутеновой кислоты (Исходное А1) В колбу, объемом 1 л, оснащенную магнитной мешалкой и ловушкой Дина-Старка, загружают 2-оксобутановую кислоту (25 г, 245 ммоль), толуол (500 мл, 20 об.) и 2-пирролидинон (37.2 мл, 490 ммоль, 2 экв.). Реакционную смесь перемешивают при кипении с обратным холодильником с азотропной отгонкой воды через ловушку Дина-Старка в течение 5.5 ч. Раствор затем концентрируют примерно до 90 мл (3.6 об.) и дают остыть медленно до температуры окружающей среды. Грязно-белое твердое вещество высаживается из раствора примерно при 55°С. Твердое вещество фильтруют, пирог промывают толуолом (2×1 об.) затем дихлорметаном (3×1 об.) и сушат на фильтре под вакуумом в течение 5 мин, что дает сырой продукт (28 г, 70% выходом). Сырой продукт растворяют в ацетоне (450 мл, 16 об.) при кипении с обратным холодильником, охлаждают медленно до температуры окружающей среды и дают кристаллизоваться более 12 ч при температуре от -15 до -20°С. Чистый продукт получают в виде белого кристаллического твердого вещества (21 г, 51% общий выход). Точка плавления (т.пл.). 165.5-166°С. 1Н ЯМР (CDCl3): 13С ЯМР(СН3ОН-d4): Тонкослойная хроматография (ТСХ): SiO2. Толуол/АсОН/СН3ОН (4:1:0.5). УФ и анисальдегидное пятно. В. Получение исходного А2: Метил (Z)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-бутеноата (Исходное А2) Исходное А1 (12 г, 71 ммоль) растворяют в ТГФ (240 мл, 20 об.) при 0-5°С. Раствор диазометана в этиловом эфире (200 мл, 78 ммоль, 1,1 экв.) добавляют порциями к реакционной смеси, поддерживая температуру ниже 5°С. Реакционная смесь желтеет с последней порцией реагента. Указанную смесь перемешивают дополнительно 30 мин при низкой температуре и затем ей дают нагреться. Оставшиеся следы диазометана разрушают добавлением капли разбавленной уксусной кислоты в ТГФ, пока желтый раствор не станет бесцветным. Реакционную смесь концентрируют в вакууме и сырой продукт перегоняют (93-94°С, 0.01 мм Hg), что дает чистый продукт (9.44 г, 73%) в виде бесцветного масла, которое затвердевает при охлаждении ниже 10°С. 1Н ЯМР (CDCl3): 13С ЯМР(СН3ОН-d4): С. Получение метил 2-оксобутаноата. 2-Оксобутановую кислоту (15 г) перегоняют при пониженном давлении, используя аппарат Кюгельруха (Kugelruhr) (84°С, 20 мм Hg) с выходом 14 г чистого продукта. Перегнанную 2-оксобутановую кислоту (14 г) растворяют в метаноле (безводный, 20 мл, 1.4 об.) и дихлорэтане (безводный, 80 мл, 5.7 об.) в присутствии нескольких капель этансульфоновой кислоты. Реакционную смесь перемешивают при кипении с обратным холодильником в течение 18 ч в инертной атмосфере. Затем ей дают остыть, сушат над MgSO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают дистилляцией (т. кипения 76°С, 20 мм Hg), что дает чистый продукт в виде бесцветного масла (7.53 г, 48% выходом). 1Н ЯМР (CDCl3): D. Получение метил (Z)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-бутеноата (Исходное А2) В колбу объемом 100 мл, оснащенную магнитной мешалкой и ловушкой Дина-Старка загружают метил 2-оксобутаноат (7.5 г, 73 ммоль), толуол (50 мл, 7 об.) и 2-пирролидинон (8.4 мл, 111 ммоль, 1.5 экв.) с последующим добавлением по каплям POCl3 (1.6 мл, 20 ммоль, 0.27 экв.). Реакционную смесь перемешивают при кипении с обратным холодильником с азотропной отгонкой воды через ловушку Дина-Старка в течение 8 ч. После охлаждения раствор промывают 10% водный раствор KHSO4 (2×3 об.). Водную фазу насыщают NaCl и снова экстрагируют толуолом (1х6 об.). Объединенные органические фазы сушат над MgSO4, фильтруют и концентрируют в вакууме, что дает сырой продукт (7.5 г) в виде оранжевого подвижного масла. Сырое масло перегоняют (92-94°С, 0.1 мм Hg), что дает чистый продукт (4.7 г, 60%) в виде бесцветного масла. Z:E соотношение 6:1 при 1Н ЯМР. Е. Получение метил (Е)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-бутеноата (Исходное А2) В сухую колбу, объемом 100 мл, оснащенную магнитной мешалкой, загружают Z-A1 (2 г, 11.8 ммоль), этанол (2.2 мл, 37.3 ммоль), тетрагидрофуран (ТГФ. 40 мл, 20 об.) и диметиламинопиридин (DMAP, 150 мг, 1.23 ммоль) в атмосфере азота. Реакционную смесь охлаждают до 0°С перед добавлением дициклогексилкарбодимида (DCC, 2.46 г, 11.9 ммоль), затем нагревают до температуры окружающей среды. Реакционную смесь перемешивают энергично в течение 21 ч. После чего добавляют гексан (40 мл), чтобы высадить твердое вещество. Осадок отфильтровывают и фильтрат концентрируют в вакууме, что дает 3.03 г бесцветного жидкого масла. Масло в воде (40 мл) промывают дихлорметаном (ДХМ, 40 мл, затем 2×20 мл), растворитель сушат с помощью Na2SO4 и концентрируют в вакууме, что дает 2 г Е-А2 этиловый эфир (100% выходом). F. Получение исходного A3:(Z)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-бутенамида (Исходное A3). В 20-литровую фланцевую колбу, снабженную мешалкой в инертной атмосфере, загружают А1 (222 г, 1.313 моль, 1 вес) и безводный ТГФ (7.0 л, 30 об.). Реакционной смеси дают охладиться ниже 5°С и добавляют порциями PCl5 (300 г, 1.44 моль, 1,1 экв.), поддерживая температуру реакции ниже 10°С. Реакционную смесь перемешивают при температуре от -5 до 0°С в течение одного часа, дают нагреться до 15°С, чтобы растворить оставшийся PCl5, и затем охлаждают снова ниже 0°С. Конденсат заполняют сухим льдом/ацетоном и пробулькивают газообразный аммиак (200 г) медленно через раствор, поддерживая температуру ниже 15°С. Суспензию перемешивают в течение дополнительных 15 мин и избыток аммиака удаляют, пробулькивая газообразный азот в течение нескольких минут. Добавляют метанол (3.7 л, 17 об.), реакционную смесь нагревают при кипении с обратным холодильником в течение 1.5 ч, затем охлаждают – ниже 30°С, фильтруют и промывают с помощью ТГФ/СН3ОН (2:1, 600 мл, 3 об.). Фильтрат упаривают, что дает желтое твердое вещество. Указанное вещество растворяют в метаноле (640 мл, 3 об.) и этилацетате (440 мл, 2 об.) и очищают, используя сухую флэш хроматографию (SiO2, 11 вес, 3.4 кг) с EtOAc/ СН2ОН (6:1), что дает сырой продукт (288 г). Сырой продукт перекристаллизовывают из изопропанола (1.9 л, – 8.5 об.), что дает белые кристаллы (127 г). Твердое вещество сушат в вакууме в духовом шкафу при температуре окружающей среды в течение 2 дней с выходом A3 (118 г, 54%). 1Н ЯМР (CDCl3+несколько капель MeOD): Элементный анализ (% м/м): С 56.90 (57.13% теория); Н 7.19 (7.19% теория); N 16.32 (16.66% теория). A3 (108 г) перекристаллизовывают снова из IPA (1 л, 9.3 об.), что дает заключительную загрузку, которую используют на стадии гидрирования (100 г, 93%). Т.пл. 172.0°С- 174.2°С. Элементный анализ (% м/м): С 56.95 (57.13% теория); Н 7.10 (7.19% теория); N 16.38. (16.66% теория). TCX: SiO2, Толуол/ АсОН/ СН3ОН (4:1:0.5). УФ и пятно анисового альдегида. G. Получение хиральных родиевых и рутениевых катализаторов – Получение [Rh(I)L [Rh(I)COD2]+OTf– (35 мг, 0.075 ммоль) и хиральный лиганд (L Н. Получение Rh(I)(СН3ОН)2[(R)-Binap] В сухую трубку Шленка, объемом 200 мл, оснащенную магнитной мешалкой, загружают [Rh(I)(nbd)2]ClO4 (251 мг, 0.649 ммоль) и (R)-Binap (405 мг, 0.65 ммоль) в атмосфере аргона. Дихлорметан (безводный, дегазированный, 5 мл, 20 об.) добавляют с помощью шприца и реакционную смесь дегазируют (3 × вакуум/аргон). Медленно добавляют тетрагидрофуран (безводный, дегазированный, 10 мл, 40 об.), а затем гексан (безводный, дегазированный, 20 мл, 80 об.). Полученную суспензию выдерживают при 0-5°С в течение 16 ч. Растворители декандируют под аргоном и добавляют метанол (безводный, дегазированный, 5 мл, 20 об.). Шленковую трубку продувают водородом (5 × вакуум/водород) и перемешивают при температуре окружающей среды в течение 1.5 ч. Светло-красный оранжевый раствор переносят с помощью шприца в другую Шленковую трубку (продутую аргоном). Раствор катализатора сохраняют в аргоне при 0-5°С и используют непосредственно для гидрирования (Terpahedron, 1245,1984). I. Получение [RuCl(R)-Binap)(C6H6)l+Cl– В сухую трубку Шленка (Schlenk), объемом 200 мл, оснащенную магнитной мешалкой, загружают [RuCl2(C6Hg)]2 (0.33 г, 0.66 ммоль) и (R)-Binap (0.815 г, 1.3 ммоль) в атмосферу аргона. Добавляют дегазированный безводный бензол (20 мл, 60 об.) и этанол (130 мл, 330 об.) и раствор дегазируют (3 × вакуум/аргон). Красно-коричневую суспензию нагревают до 50-55°С в течение 45 мин, получая прозрачный коричневый раствор. Полученный раствор фильтруют через целитовую подушку и в атмосфере аргона в другую трубку Шленка. Растворители упаривают в вакууме, что дает катализатор в виде желто-оранжевого твердого вещества (1.08 г, 86%), которое сохраняют в атмосфере аргоне при 0-5°С (J.Org.Chem., 3064,1994). J. Получение [RuCl(R)-Binap)(С6Н6)]+BF4 – В сухую трубку Шленка, объемом 100 мл, оснащенную магнитной мешалкой, загружают [RuCl(R)-Binap)(C6H6)]+ Cl– (0.45 г, 0.52 ммоль) и дегазированный безводный дихлорметан (20 мл, 44 об.) в атмосфере аргона. Полученный раствор дегазируют (3 × вакуум/аргон) и переносят с помощью шприца в другую трубку Шленка, содержащую дегазированную суспензию AgBF4 (0.15 г, 0.77 ммоль, 1.5 экв.) в дихлорметане (10 мл, 22 об.). Смесь перемешивают энергично в течение 0.5 ч и затем фильтруют через целитовую подушку в атмосфере аргона. Фильтрат концентрируют в вакууме, что дает катализатор в виде зеленого твердого вещества (0.42 г, 88%), которое сохраняют в атмосфере аргоне при 0-5°С (J.Org.Chem., 3064, 1994). К. Получение Ru(ОСОСН3)2[(R)-Binap] В сухую трубку Шленка, объемом 200 мл, оснащенную магнитной мешалкой, загружают [RuCl2(C6H6)]2 (0.805 г, 1.60 ммоль) и (R)-Binap (1.89 г, 3.03 ммоль, 0.95 экв.) в атмосфере аргона. Добавляют сухой дегазированный диметилформамид (30 мл, 38 об.) и раствор дегазируют (3 × вакуум/аргон). Реакционную смесь нагревают до 100°С в течение 10 мин, что дает темно-красный раствор, который затем охлаждают до температуры окружающей среды. Дегазированный раствор ацетата натрия (5.2 г, 63.4 ммоль, 20 экв.) в метаноле (50 мл, 60 об.) загружают в реакционный сосуд и перемешивают в течение 5 мин. Добавляют дегазированную воду (50 мл, 60 об.) и толуол (25 мл, 30 об.) и реакционную смесь перемешивают энергично в течение 5 мин. Слой толуола переносят с помощью шприца в другую сухую трубку Шленка (продувают аргоном) и водную фазу экстрагируют толуолом (2×25 мл). Объединенные толуоловые растворы промывают водой (4×10 мл), растворитель концентрируют в вакууме при 45°С и сушат в течение 12 ч под вакуумом (0.1 мм Hg). Желто-коричневое твердое вещество растворяют в толуоле (25 мл) без перемешивания и добавляют медленно гексан (75 мл) для формирования сверху второго слоя. Двухфазную смесь оставляют стоять при температуре окружающей среды в течение 7 часов и затем при 0-5°С в течение 3 дней. Катализатор выкристаллизовывается. Растворители удаляют с помощью шприца в атмосфере аргона, твердое вещество промывают гексаном (20 мл) и сушат под вакуумом в течение 2 ч, что дает катализатор в виде желтого коричневого твердого вещества (1.76, 70%), которое сохраняют в аргоне при 0-5°С (J.Org. Chem., 4053, 1992). L. Ассиметричное гидрирование исходных A1, A2, A3. Ассиметричное гидрирование осуществляют по одной методике для каждого исходного. Таким образом, только ассиметричное гидрирование A3 описано ниже. Ассиметричное гидрирование исходных A3. Гидрирование при атмосферном давлении Н2. В сухую трубку Шленка, объемом 100 мл, оснащенную магнитной мешалкой, загружают субстрат (500 мг, 3 ммоль) и продувают газообразным аргоном. Дегазированный растворитель добавляют с помощью шприца с последующим добавлением раствора катализатора (от 0.5 до 2.5 моль%). Реакционную смесь дегазируют (3 × вакуум/аргон) и затем продувают водородом (5 × вакуум/водород), используя баллонный водород. Реакционную массу перемешивают в течение 16-65 ч при температуре окружающей среды. Атмосферу водорода заменяют на атмосферу азота и растворитель упаривают в вакууме, чтобы получить сырой продукт, который анализируют с помощью ЯМР спектроскопического анализа и хирального HPLC анализа. Гидрирование при давлении в 4 атм. Все манипуляции выполняют в AtmosBagTM (Aldrich Chemical CO) в атмосфере аргона. Субстрат (500-10000 мг) был помещен в реакционный сосуд из нержавеющей стали высокого давления (Vinci Technologies Ltd, France), оснащенный тефлоновой мензуркой (или стеклянной плошкой) и магнитной мешалкой, покрытой тефлоном. Добавляют дегазированный растворитель и катализатор или раствор катализатора (от 0.25 до 2.5 моль%). Реакционный сосуд герметизируют и продувают водородом под давлением в реакционном сосуде – 4.5-5.5 атм и затем снижают давление (в 5 раз). И наконец, давление регулируют до желаемого уровня и реакционную смесь перемешивают при температуре окружающей среды в течение 16-65 ч. По завершении атмосферу водорода заменяют на атмосферу азота и растворитель упаривают в вакууме, что дает сырой продукт, который анализируют с помощью ЯМР спектроскопического анализа и хирального HPLC анализа. Очистка конечного соединения: Очистка (S)- Леветирацетам, полученный ассиметричным гидрированием, описанным выше (5 г, 98% е.е.), растворяют в воде (20 мл, 4 об.) и экстрагируют этилацетатом (3×10 мл, 3×2 об.). Органическую фазу затем снова экстрагируют водой (10 мл, 2 об.) и водную фазу упаривают, что дает бледно-желтое твердое вещество (4.83 г, 80%). Полученное твердое вещество (4 г) растворяют в ацетоне (24 мл, 6 об.) и нагревают при кипении с обратным холодильником в течение одного часа. Раствору дают медленно остыть до 0°С со скоростью 5-10°С/ч. Кристаллы фильтруют, промывают ацетоном (1.6 мл, 0.4 об.) и сушат, что дает белое твердое вещество (3.23 г, 81%. >99.8% е.е., 54 частей на миллн. Rh). Очистка (S)- Леветирацетам, полученный ассиметричным гидрированием, описанным выше (5 г, 98% е.е.), перекристаллизовывают из ацетона (30 мл, 6 об.), как описано выше, с получением белого кристаллического твердого вещества (3.94 г, 81%, >99.8% е.е., 52 частей на миллн. Rh). Указанное вещество – (3 г) перекристаллизовывают снова, как описано выше, что дает белое кристаллическое твердое вещество (2.31 г, 77%, >99.8% е.е., 23 частей на миллн. Rh). Т.пл. – 118.4-119.9°С.
Формула изобретения
1. Производные 2-оксо-1-пирролидина общей формулы (А) и их фармацевтически приемлемые соли,
где Х представляет собой -CONR5R6, -COOR7 или -COR8; R1 представляет собой водород, галоген или C1-С6алкил; R2 и R4 являются одинаковыми или различными и каждый независимо представляет собой водород, галоген или C1-С6алкил; R3 представляет собой водород, галоген, C1-С6 алкил или замещенный одним или более галогеном С2-С5алкенил; R5, R6, R7 являются одинаковыми или различными и каждый независимо представляет собой водород или C1-С6 алкил; и R8 представляет собой гидрокси или C1-С6 алкил, при этом соединение не является метил 2-(4R,S-изопропил-2-оксопирролидин-1-ил)акрилатом, метил 2-(3R,S-хлор-4R,S-изопропил-2-оксопирролидин-1-ил)акрилатом или метил 2-(2-оксопирролидин-1-ил)акрилатом. 2. Производные 2-оксо-1-пирролидина по п.1, где R3 представляет собой водород, C1-С6 алкил или замещенный галогеном С2-С5алкенил. 3. Производные 2-оксо-1-пирролидина по п.1 или 2, где R1 представляет собой метил и R2 и R4 являются Н, R3 представляет собой водород, C1-С6 алкил или С2-С5 галогеналкенил и Х представляет собой -CONH2 или -СООМе, или -COOEt, или -СООН. 4. Производные 2-оксо-1-пирролидина по п.3, где R3 представляет собой водород, пропил или дифторвинил. 5. Производные 2-оксо-1-пирролидина по пп.1-4, которые представляют собой Z изомер или Е изомер. 6. Способ получения производного 2-оксо-1-пирролидина общей формулы (А),
где Х представляет собой -CONR5R6, -COOR7 или -COR8; R1 представляет собой водород, галоген или C1-С6 алкил; R2 и R4 являются одинаковыми или различными и каждый независимо представляет собой водород, галоген или C1-С6 алкил; R3 представляет собой водород, галоген или C1-С6алкил или замещенный одним или более галогеном С2-С5 алкенил; R5, R6, R7 являются одинаковыми или различными и каждый независимо представляет собой водород или C1-С6 алкил; R8 представляет собой гидрокси или C1-С6 алкил, включающий реакцию производного 7. Способ получения производного 2-оксо-1-пирролидина общей формулы (А),
где Х представляет собой -COOR7; R1 представляет собой водород, галоген или C1-С6 алкил; R2 и R4 являются одинаковыми или различными и каждый независимо представляет собой водород, галоген или C1-С6алкил; R3 представляет собой водород, галоген или C1-С6алкил или замещенный одним или более галогеном C2-C5 алкенил; R5, R6, R7 являются одинаковыми или различными и каждый независимо представляет собой водород или C1-С6 алкил; R8 представляет собой гидрокси или C1-С6 алкил, включающий взаимодействие производного 8. Способ получения производного 2-оксо-1-пирролидина общей формулы (А),
где Х представляет собой -CONH2, R1 представляет собой водород, галоген или C1-C6 алкил; R2 и R4 являются одинаковыми или различными и каждый независимо представляет собой водород, галоген или C1-С6 алкил; R3 представляет собой водород, галоген или C1-С6 алкил или замещенный одним или более галогеном С2-С5 алкенил; R5, R6, R7 являются одинаковыми или различными и каждый независимо представляет собой водород или C1-С6 алкил; R8 представляет собой гидрокси или C1-С6 алкил, включающий конверсию кислоты, при этом указанная кислота является соединением формулы (А), где Х представляет собой CO2H, в хлорангидрид кислоты с последующим аммонолизом согласно следующей схеме (3) 9. Способ получения соединения общей формулы (В),
где Х представляет собой -CONR5R6, -COOR7 или -COR8; R1 представляет собой водород, галоген или C1-С6 алкил; R2 и R4 являются одинаковыми или различными и каждый независимо представляет собой водород, галоген или C1-С6 алкил; R3 представляет собой водород, галоген или C1-С6 алкил или замещенный одним или более галогеном С2-С5 алкенил; R5, R6, R7 являются одинаковыми или различными и каждый независимо представляет собой водород или C1-С6 алкил; R8 представляет собой гидрокси или C1-С6 алкил, включающий каталитическое гидрирование соответствующего соединения общей формулы (А), где R1, R2, R3, R4 и Х имеют значения, как определено выше, согласно следующей схеме (6) 10. Способ по п.9, отличающийся тем, что соединение формулы (А) подвергается ассиметричному гидрированию при использовании хирального катализатора, основанного на хелате родия или рутения. 11. Способ получения (S)-
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -этил-2-оксо-1-пирролидинацетамида. Описаны способы получения соединения А. 6 н. и 5 з.п. ф-лы, 3 табл., 13 схем.
-этил-2-оксо-1-пирролидинацетамида. Описаны способы получения соединения А. 6 н. и 5 з.п. ф-лы, 3 табл., 13 схем.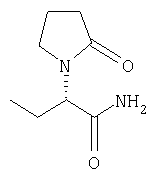





 (химический сдвиг) 2.13 (5Н, дублет (д) и мультиплет). 2.51(2Н, триплет (т)), 3.61(2Н, т), 6.27(1Н, квадроплет (кв)), 8 до 10(1Н, широкий); сигналы для Е-изомера,
(химический сдвиг) 2.13 (5Н, дублет (д) и мультиплет). 2.51(2Н, триплет (т)), 3.61(2Н, т), 6.27(1Н, квадроплет (кв)), 8 до 10(1Н, широкий); сигналы для Е-изомера,  COD]+OTf– (0.15 М растворы)
COD]+OTf– (0.15 М растворы)