|
|
(21), (22) Заявка: 2003102629/15, 29.06.2001
(24) Дата начала отсчета срока действия патента:
29.06.2001
(30) Конвенционный приоритет:
30.06.2000 JP 2000-237717
30.06.2000 JP 2000-237718
(43) Дата публикации заявки: 10.05.2004
(46) Опубликовано: 27.01.2007
(56) Список документов, цитированных в отчете о
поиске:
JP 63144704 А, 14.06.1988. JP 01016799 А2, 20.01.1989. ЕР 672682 A1, 20.09.1995.
(85) Дата перевода заявки PCT на национальную фазу:
30.01.2003
(86) Заявка PCT:
JP 01/05674 (29.06.2001)
(87) Публикация PCT:
WO 02/02136 (10.01.2002)
Адрес для переписки:
103735, Москва, ул. Ильинка, 5/2, ООО “Союзпатент”, пат.пов. А.П.Агурееву
|
(72) Автор(ы):
МИНАМИТАКЕ Есихару (JP),
ОНО Тетсу (JP),
КАВАНИСИ Коудзи (JP),
СУЗУКИ Юдзи (JP)
(73) Патентообладатель(и):
ДАЙИТИ АСУБИО ФАРМА КО., ЛТД. (JP)
|
(54) ФАРМАЦЕВТИЧЕСКИЙ КОМПОНЕНТ НА ОСНОВЕ ПАРАТИРЕОИДНОГО ГОРМОНА ЧЕЛОВЕКА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНТРАНАЗАЛЬНОГО ПРИМЕНЕНИЯ
(57) Реферат:
Изобретение относится к области медицины и касается высокостабильного фармацевтического компонента, включающего пептид паратиреоидного гормона человека или его производное и уксусную кислоту, содержащуюся в количестве, меньшем ее химического эквивалента по отношению к пептиду паратиреоидного гормона человека или его производному. В результате низкого содержания уксусной кислоты в продукте полученные фармацевтические композиции на его основе высокостабильны и обеспечивают приятные ощущения при применении. Преимущество изобретения заключается в повышении стабильности. 3 н. и 5 з.п. ф-лы, 7 ил., 9 табл.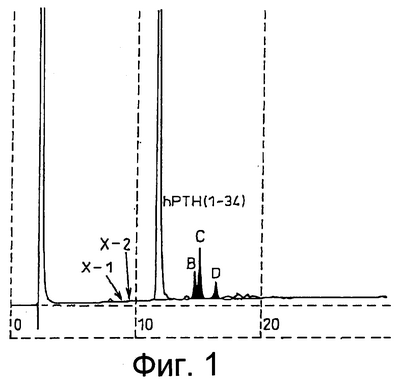
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение касается фармацевтического компонента на основе паратиреоидного гормона человека, который обладает отличной стабильностью и, будучи использованным в качестве компонента фармацевтической композиции, обеспечивает приятные ощущения при применении. Также настоящее изобретение касается фармацевтической композиции на основе паратиреоидного гормона человека, предназначенной для интраназального введения, которая пригодна для долговременного применения.
УРОВЕНЬ ТЕХНИКИ
Пептиды-производные паратиреоидного гормона человека (в дальнейшем обозначаемого как “hPTH”) – это биологически активные пептиды, которые отвечают за метаболизм костной ткани и обладают высокой активностью при ее формировании (Aurbach et al., Recent Progr. Horm. Res., 1972, vol.28, p.35). hPTH представляет собой пептид, который обычно состоит из 84 аминокислотных остатков (hPTH(1-84)). Происходящий из него пептид hPTH(1-34), состоящий из 34 аминокислотных остатков, соответствующих аминокислотам 1-34 hPTH(1-84), как известно, обладает такой же фармакологической активностью, как hPTH(1-84) (Tregear et al., Hoppe-Seyler’s Z. Physiol Chem., 1974, vol.355, p.415). Аминокислотные последовательности hPTH(1-84) и hPTH(1-34) приведены в SEQ ID No. 1 и 2 Перечня последовательностей соответственно.
Кальцитонин, бифосфонат и лекарственные средства, применяемые для лечения остеопороза, проявляют терапевтическое действие, ингибируя резорбцию кости, тогда как hPTH(1-84) и hPTH(1-34) стимулируют формирование кости или метаболический процесс, участвующий в ее формировании. Таким образом, ожидалось, что эти пептиды могут служить в качестве новых лекарственных средств при остеопорозе (Lane et al., J. Clin. Invest, 1998, vol.102, pp.1627-1633).
Сообщалось, что при подкожном введении человеку один раз в неделю определенной дозы hPTH(1-34) наблюдается увеличение содержания минеральных веществ в кости, а если подобным образом вводить то же самое лекарственное средство в дозе, составляющей одну пятую от предыдущей, но один раз в день в течение пяти дней, также наблюдается значительное увеличение минеральной плотности кости (МПК) (Sone et al. Miner. Electrolyte Metab, 1995, vol.21, pp.232-235). В экспериментах на животных было показано, что при подкожном введении определенных доз hPTH один раз в неделю происходит меньшее увеличение МПК по сравнению с тем, что наблюдается при разделении дозы на части (Tawaragi et al., Osteoporosis International, vol 6, suppl. 1, 1996, р.235). Из этого следует, что максимальный терапевтический эффект hPTH может быть достигнут при ежедневном введении малых доз на протяжении длительного времени, а не при кратковременном использовании больших доз с длительным промежутком между отдельными введениями. Если постоянное введение небольших доз hPTH на протяжении длительного времени обеспечит терапевтический эффект, равный или превышающий тот, что достигается кратковременным периодическим использованием больших доз, то такой режим будет желательным еще и с той точки зрения, что малые дозы hPTH, вероятно, не будут вызывать нежелательных побочных эффектов на пищеварительную и сердечно-сосудистую системы, как это наблюдается при использовании высоких доз hPTH.
Кроме того, инъекции не подходят для лечения больных остеопорозом, которым обычно требуется продолжительное лечение, так как в этом случае процедура должна проводиться под контролем врача, пациент при этом будет испытывать боль и должен регулярно посещать врача, что может быть обременительно для пациента.
Ввиду этого существует потребность в препарате для интраназального применения, который позволит пациенту принимать его на дому на протяжении длительного времени без излишней боли и не будет обременительным для него.
Однако для безопасного применения интраназального препарата на протяжении длительного времени абсолютно необходимо, чтобы он хорошо всасывался через слизистую оболочку носовой полости, не оказывал на нее раздражающего действия и вызывал приятные ощущения при применении, так как слизистая оболочка носовой полости очень чувствительна к раздражающему действию лекарств или их компонентов. В частности, для таких лекарственных средств, как те, что содержат hPTH, терапевтический эффект которого достигается при продолжительном применении, приятные ощущения особенно важны в том случае, когда средство предназначается для интраназального введения. Для получения интраназального лекарственного средства, пригодного и для продолжительного применения, необходимо выбрать активный компонент в виде лекарственного препарата или его соли, а также соответствующие добавки, установить их эффективные концентрации и найти оптимальную комбинацию. К факторам, определяющим ощущения при применении интраназального препарата, относятся его запах и наличие раздражающего действия. Таким образом, выбор лекарственных препаратов и добавок для приготовления интраназальных лекарственных средств и диапазон их концентраций очень ограничены.
Имеется коммерчески доступный препарат на основе hPTH, а именно препарат для инъекций, содержащий 5-ацетат hPTH(1-34), который применяется в диагностике для определения функциональной активности околощитовидной железы (его родовое название – teriparatide acetate, он выпускается фирмой Asahi Kasei Kogyo Corp.). Однако таких интраназальных лекарственных средств на основе hPTH, которые бы давали приятные ощущения при применении в смысле запаха и отсутствия раздражающего действия, нет.
В Japanese Patent Laid-Open No. 64-16799 описано, что при очистке hPTH(1-34) его смешивают с уксусной кислотой, используемой в процессе очистки, причем содержание уксусной кислоты в препаратах сильно варьируется от партии к партии, что затрудняет получение препаратов с одинаковым содержанием уксусной кислоты, а ее попадание в препарат ведет к снижению активности.
В том же документе далее описан способ, пригодный для повышения стабильности hPTH(1-34), в котором применяется лиофилизованная композиция hPTH(1-34) с применением винно-каменной кислоты. Однако винно-каменная кислота настолько кислая, что содержащее ее средство будет непригодным для интраназального введения.
В Japanese Patent Laid-Open No. 2-111 раскрыта порошкообразная композиция для интраназального введения на основе водорастворимой органической кислоты, которая была разработана для улучшения всасывания через нос такого биологически активного пептида, как hPTH(1-34). Однако эта композиция непригодна для долговременного применения, так как она будет прямо раздражать слизистую оболочку носовой полости в зависимости от вида и количества входящей в состав композиции органической кислоты.
Как изложено выше, пока еще не разработано средство на основе hPTH для интраназального применения, которое было бы пригодно и для продолжительного применения, обеспечивало приятные ощущения при применении и обладало хорошими стабильностью и всасываемостью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическому компоненту на основе hPTH, который при применении в качестве компонента фармацевтической композиции обладает высокой стабильностью и дает приятные ощущения при применении. Настоящее изобретение также относится к фармацевтической композиции для интраназального введения на основе hPTH, которая пригодна для продолжительного применения.
С целью получения фармацевтической композиции для интраназального введения, описанной выше, авторы настоящего изобретения провели обширные исследования и установили, что препараты hPTH, полученные общепринятым способом, неудовлетворительны, так как они издают запах кислоты и вызывают раздражение при попадании на слизистую оболочку носовой полости, и что этот недостаток объясняется присутствием уксусной кислотой, которая применяется в процессе очистки и в очень небольшом количестве находится в составе соли hPTH или в виде примеси. На основании этих данных авторы получили фармацевтический компонент, у которого содержание уксусной кислоты понижено по сравнению с предшествующим, исследовали его и неожиданно для себя обнаружили, что данный компонент обладает высокой стабильностью, в составе фармацевтической композиции дает приятные ощущения при применении и обладает способностью к безопасному сочетанию с соответствующими количествами функциональных компонентов, добавляемых для улучшения всасывания и стабильности, а также с носителями и наполнителями, обычно применяемыми при изготовлении лекарств. Таким образом авторы совершили настоящее изобретение.
Более точно, настоящее изобретение касается фармацевтического компонента, состоящего из hPTH и уксусной кислоты, которая содержится в количестве, меньшем определенного химического эквивалента относительно веса hPTH. Также настоящее изобретение относится к фармацевтической композиции для интраназального введения, которая содержит hPTH в качестве активного ингредиента, а также содержит уксусную кислоту, содержащуюся в количестве, меньшем определенного химического эквивалента относительно веса hPTH.
ПЕРЕЧЕНЬ ФИГУР
На фиг.1 приведена хроматограмма, полученная методом обращеннофазовой ВЭЖХ на препарате hPTH(1-34) с содержанием уксусной кислоты 9,5%, после хранения при 40°С в течение 6 месяцев.
На фиг.2 приведена хроматограмма, полученная методом обращеннофазовой ВЭЖХ на препарате hPTH(1-34) с содержанием уксусной кислоты 2,9%, после хранения при 40°С в течение 6 месяцев.
На фиг.3 показано количество продуктов разложения (побочных продуктов) В, С и D в препаратах hPTH(1-34), содержащих различные количества уксусной кислоты, после хранения при 80°С в течение 15 часов.
На фиг.4 показана степень чистоты препаратов hPTH(1-34), содержащих различные количества уксусной кислоты, после хранения при 80°С в течение 15 часов.
На фиг.5 приведена хроматограмма, полученная методом обращеннофазовой ВЭЖХ на препарате hPTH(1-84) с содержанием уксусной кислоты 12,3%, после хранения при 80°С в течение 15 часов.
На фиг.6 показано содержание продуктов разложения (побочных продуктов) в препаратах hPTH(1-84), содержащих различные количества уксусной кислоты, после хранения при 80°С в течение 15 часов.
На фиг.7 показана степень чистоты препаратов hPTH(1-84), содержащих различные количества уксусной кислоты, после хранения при 80°С в течение 15 часов.
ПОДРОБНОЕ РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением к группе веществ, объединяемых под общим названием hPTH, относятся пептиды, участвующие в метаболизме костной ткани, обладающие сильным стимулирующим действием на формирование костей и обладающие способностью к повышению концентрации кальция в сыворотке крови, то есть природные hPTH(1-84), состоящие из 84 аминокислотных остатков, и их производные.
Например, к hPTH относятся hPTH(1-84) (Biochemistry 17, 5723 (1978); Kimura et al., Biochem. Biophys. Res. Commun., vol.114, p.493, 1983), hPTH(1-38) (Japanese Patent Laid-Open No. 57-81448), hPTH(1-34) (Japanese Patent Laid-Open No. 9-29600; Takai et al., Peptide Chemistry, p.187, 1979), hPTH(1-34)NH2 (Japanese Patent Laid-Open No. 58-96052), [Nle8,18]hPTH(1-34) и [Nle8,18, Tyr34]hPTH(1-34) (Japanese Patent Laid-Open No. 55-113753), [Nle8,18, Tyr34]hPTH(1-34) (Japanese Patent Laid-Open No. 61-24598), [NIe8,18, Tyr34]hPTH(1-34)NH2 (Japanese Patent Laid-Open No. 60-34996), hPTH(1-37) (Japanese Patent Presentation [Kohyo] No. 5-505594), hPTH(2-84), hPTH(3-84), hPTH(4-84), hPTH(5-84), hPTH(6-84), hPTH(7-84), hPTH(8-84) (Japanese Patent Presentation [Kohyo] No. 4-505259) и др. Способы получения этих hPTH основываются на методах генетической инженерии или химического синтеза, как описано в вышеуказанных документах, либо эквивалентных им.
Вообще говоря, для очистки физиологически активных пептидов, полученных методами генетической инженерии или химического синтеза, применяется колоночная хроматография. Однако, поскольку hPTH является щелочным пептидом, он будет адсорбироваться на смоле в колонке, если он будет неправильно нанесен на колонку. Для предупреждения адсорбции hPTH и повышения его растворимости используют кислоту в качестве элюента. Чтобы пептид мог служить материалом для фармацевтической композиции, он должен быть заключен в лиофилизованную композицию, которая послужит исходным материалом для получения фармацевтической композиции. Для того, чтобы выполнялось это требование, кислота должна быть летучей, а это сужает спектр применяемых кислот.
Для иллюстрации предположим, к примеру, что для этой цели применяется соляная кислота. Она проявляет высокую кислотность даже при низких концентрациях, легко вызывает в побочные реакции типа гидролиза и обладает сильным коррозионным действием. Таким образом, соляная кислота не подходит для этой цели. Если для этого используют органическую кислоту, то ее выбирают из трифторуксусной, муравьиной и уксусной кислот, которые имеют низкие температуры кипения. Однако введение трифторуксусной кислоты в фармацевтическую композицию нежелательно с позиции безопасности. Применение муравьиной кислоты также ограничено вследствие ее восстановительных свойств, и она несовместима с таким пептидом, как hPTH.
Напротив, уксусная кислота является наиболее подходящим материалом для фармацевтической композиции вследствие ее безопасности и химических свойств, и эта кислота незаменима на последней стадии очистки основных пептидов. Например, успешно применяются способы очистки, основанные на обращеннофазовой высокоэффективной жидкостной хроматографии (обращеннофазовой ВЭЖХ) или эксклюзивной хроматографии с использованием элюента, содержащего уксусную кислоту. В этом способе уксусную кислоту добавляют в концентрации, достаточной для предупреждения адсорбции hPTH на колонке, поэтому элюированный водным раствором уксусной кислоты образец, фракция целевого пептида и полученная из нее лиофилизованная композиция содержат уксусную кислоту в концентрации, превышающей тот уровень, при котором она присутствует только в виде соли, образованной остатками основных аминокислот, то есть уксусная кислота присутствует не только как составная часть соли hPTH, но и как примесь.
Так, уксусная кислота в фармацевтическом компоненте на основе hPTH находится в двух формах: как составная часть соли hPTH и как примесь. Поскольку уксусная кислота является летучим веществом, то поддерживать ее содержание в лиофилизованной композиции на постоянном уровне трудно из-за того, что содержание уксусной кислоты в лиофилизованной композиции зависит от условий лиофилизации и от концентрации уксусной кислоты в исходном растворе до лиофилизации относительно концентрации hPTH в том же исходном растворе.
Фармацевтический компонент, описываемый в настоящем изобретении, включает hPTH и уксусную кислоту, и в нем уменьшено содержание уксусной кислоты в виде составной части соли hPTH и в виде примеси. Этот компонент, вследствие пониженного содержания уксусной кислоты, улучшает стабильность hPTH и обеспечивает приятные ощущения при введении его в состав фармацевтической композиции для интраназального введения и использовании в таковом качестве.
В фармацевтическом компоненте, описываемом настоящим изобретением, под пониженным содержанием уксусной кислоты понимается уменьшение содержания уксусной кислоты ниже определенного заданного химического эквивалента.
Поскольку hPTH(1-34) содержит 9 остатков основных аминокислот (включая остаток триптофана), одна молекула его может связывать максимум 9 молекул одновалентной кислоты (уксусной кислоты и других), образуя соль. Однако hPTH(1-34) также содержит 4 остатка кислых аминокислот, которые могут связываться с основными остатками с образованием внутримолекулярной соли. Таким образом, в отношении hPTH(1-34) по настоящему изобретению остаются 5 остатков основных аминокислот, которые можно считать доступными для связывания с уксусной кислотой, и отсюда можно вывести вес уксусной кислоты, связывающейся с одной молекулой hPTH(1-34), или количество химических эквивалентов уксусной кислоты по отношению к hPTH(1-34). Содержание уксусной кислоты можно получить с помощью уравнения I:
вес уксусной кислоты × 100%/вес пептида hPTH,
исходя из веса уксусной кислоты и пептида паратиреоидного гормона человека. Химический эквивалент уксусной кислоты по отношению к hPTH(1-34) равняется 7,3% (по весу, если не указано иначе) в пересчете на содержание уксусной кислоты.
Аналогичным образом, поскольку hPTH(1-84) содержит 19 остатков основных аминокислот (включая триптофан) и 12 остатков кислотных аминокислот, при получении препарата hPTH(1-84) по настоящему изобретению принимается, что для связывания с уксусной кислотой доступны только 7 основных аминокислотных остатков в одной молекуле hPTH(1-84), что позволяет рассчитать вес уксусной кислоты, связывающейся с одной молекулой hPTH(1-34), или количество химических эквивалентов уксусной кислоты по отношению к hPTH(1-34). Содержание уксусной кислоты можно рассчитать с помощью уравнения I, при этом химический эквивалент уксусной кислоты по отношению к hPTH(1-84) равняется 4,5% в пересчете на содержание уксусной кислоты.
Так, согласно настоящему изобретению, под содержанием уксусной кислоты в количестве, меньшем ее химического эквивалента, понимается, что уксусная кислота входит не в качестве примеси, а только как составная часть соли hPTH, причем весовое содержание ее меньше этого химического эквивалента.
Настоящее изобретение предусматривает стабильный фармацевтический компонент на основе hPTH за счет контролирования в нем содержания уксусной кислоты, а также фармацевтическую композицию для интраназального введения, содержащую этот фармацевтический компонент.
Далее, настоящее изобретение предусматривает фармацевтический компонент на основе hPTH, в котором содержание уксусной кислоты контролируется таким образом, чтобы оно находилось на заданном уровне, а также лекарственную композицию для интраназального введения, содержащую этот фармацевтический компонент.
Поскольку пептиды обычно нестабильны в растворе, в качестве материала для фармацевтического компонента используется лиофилизованный препарат. Если такой пептид, как hPTH, находящийся в виде соли, содержащей уксусную кислоту или летучее вещество в составе соли, растворить в воде или в разбавленной уксусной кислоте и использовать лиофилизованный препарат из него в качестве материала для получения фармацевтического компонента, то содержание уксусной кислоты в этом компоненте не будет оставаться на одном уровне, и это представляет проблему. Настоящее изобретение дает возможность получить водный раствор hPTH с пониженным содержанием уксусной кислоты, что позволяет вырабатывать основанный на hPTH фармацевтический компонент, устойчиво содержащий заданное количество уксусной кислоты. Таким образом, настоящее изобретение дает преимущества и с точки зрения стабильности при производстве.
В фармацевтическом компоненте по настоящему изобретению содержание уксусной кислоты по отношению к весу hPTH поддерживается ниже химического эквивалента. Например, для компонента на основе hPTH(1-34) содержание уксусной кислоты должно составлять менее 7,3% по отношению к весу hPTH(1-34), более предпочтительно 6,0% или меньше, особенно 4,0% или меньше с точки зрения стабильности и практичности, либо же более предпочтительно 4,0% или меньше, особенно 3,0% или меньше с точки зрения стабильности при производстве. С точки зрения стабильности при производстве не является предпочтительным поддерживать содержание уксусной кислоты на слишком низком уровне, так как компонент, хотя он и будет обладать отличной стабильностью и давать хорошие ощущения при применении, легко становится нерастворимым при высоких значениях рН: изоэлектрическая точка hPTH(1-34) равна 8,2 (pI=8,2). Содержание уксусной кислоты предпочтительно поддерживается на уровне 0,5% или более, особенно 1,0% или больше. С другой стороны, для компонента на основе hPTH(1-84) содержание уксусной кислоты должно составлять менее 4,5%, более предпочтительно 3,0% или меньше с точки зрения стабильности и практичности, более предпочтительно 0,1% или больше с точки зрения стабильности при производстве.
Фармацевтический компонент настоящего изобретения можно получить любым общеизвестным способом или любым эквивалентным способом. Так, снижение содержания уксусной кислоты, находящейся в виде составной части соли hPTH или в виде примеси, ниже некоторого заданного уровня осуществляется путем надлежащего использования таких известных методов, как диализ, электродиализ, ионообменная хроматография, эксклюзивная колоночная хроматография, обращеннофазовая ВЭЖХ и др. в процесс очистки hPTH, полученного методом генетической инженерии или методом химического синтеза.
Когда излишек уксусной кислоты удаляют таким методом, как диализ, электродиализ, ионообменная хроматография и др., содержание уксусной кислоты можно довести до требуемого уровня непосредственно путем измерения рН раствора hPTH или концентрации уксусной кислоты в растворе с тем, чтобы получить раствор hPTH, содержащий уксусную кислоту в требуемой концентрации.
Например, содержание уксусной кислоты в водном растворе hPTH можно довести до требуемого значения на основе существующей зависимости между содержанием уксусной кислоты в растворе и значением рН этого раствора.
Диализ может проводиться следующим образом: водный раствор hPTH, полученного методом генетической инженерии или химического синтеза, или тот же водный раствор, у которого значение рН было доведено до 5-9 с помощью раствора щелочи типа водного раствора гидроокиси натрия или аммония, помещают в диализную мембрану в форме цилиндра, через который проходят низкомолекулярные компоненты, а растворенные вещества подвергаются диализу по принципу простой диффузии, при этом удаляется уксусная кислота. Например, раствор hPTH(1-34) с содержанием уксусной кислоты в 2% получают, подвергая исходный раствор диализу до тех пор, пока рН раствора снаружи от диализной мембраны не достигнет значения рН около 6,5.
Электродиализ может проводиться следующим образом: водный раствор hPTH, полученного методом генетической инженерии или химического синтеза, или тот же водный раствор, значение рН которого было доведено до 5-9 с помощью раствора щелочи типа водного раствора гидроокиси натрия или аммония, циркулирует между двумя диализными мембранами, пропускающими компоненты с молекулярным весом 300 или меньше, и подвергается воздействию электрического поля, причем ионы уксусной кислоты мигрируют к катоду и скапливаются там, тогда как ионы свободного основания hPTH мигрируют к аноду и скапливаются там; ионы уксусной кислоты с небольшим молекулярным весом при этом свободно выходят наружу через мембраны, тогда как свободные основные ионы hPTH с большим молекулярным весом остаются циркулировать в системе диализа. Это дает возможность получить раствор hPTH, содержащий требуемое постоянное количество уксусной кислоты, путем измерения рН или ионной силы диализного раствора, тем самым проверяя снижение содержания уксусной кислоты. Например, раствор hPTH(1-34) с содержанием уксусной кислоты в 2% можно получить, подвергая исходный раствор электродиализу до тех пор, пока рН диализного раствора не достигнет значения около 6,5.
При ионообменной хроматографии уксусная кислота адсорбируется и удаляется, связываясь с ионообменной смолой, находящейся в щелочной форме. Например, водный раствор hPTH, полученного методом генетической инженерии или химического синтеза, наносят на колонку с анионообменной смолой на основе четвертичного или вторичного аммониевого основания; уксусная кислота связывается со смолой посредством ион-ионных взаимодействий, а несвязавшуюся фракцию, просто проскакивающую через колонку, собирают, получая раствор hPTH с пониженным содержанием уксусной кислоты. Это дает возможность получить раствор hPTH с заданным содержанием уксусной кислоты путем варьирования количества ионообменной смолы по отношению к весу hPTH в растворе. Например, для получения раствора hPTH(1-34) с содержанием уксусной кислоты в 2% можно использовать такую навеску смолы, чтобы рН элюата достигло значения около 6,5.
Эксклюзивная колоночная хроматография может проводиться следующим образом: водный раствор hPTH, полученного методом генетической инженерии или химического синтеза, или тот же водный раствор, значение рН которого было доведено до 5-9 с помощью раствора щелочи типа водного раствора гидроокиси натрия или аммония, наносят на колонку, а для элюирования используют водный раствор, содержащий органический растворитель типа ацетонитрила, при этом происходит удаление уксусной кислоты. Это дает возможность получить раствор hPTH с заданным содержанием уксусной кислоты путем изменения рН водного раствора hPTH, наносимого на колонку. Например, для получения раствора hPTH(1-34) с содержанием уксусной кислоты в 2% на колонку наносят раствор hPTH, значение рН которого было доведено до приблизительно 6,5, и собирают фракцию элюата, содержащую hPTH.
При обращеннофазовой ВЭЖХ используется водный раствор hPTH, полученного методом генетической инженерии или химического синтеза, или тот же водный раствор, у которого значение рН было доведено до 5-9 с помощью раствора щелочи типа водного раствора гидроокиси натрия или аммония. Раствор наносят на колонку С18 или С4, уравновешенную водой, и используют, к примеру, воду для элюирования неорганических солей. Затем пропускают водный раствор, содержащий органический растворитель типа ацетонитрила, чтобы элюировать hPTH, адсорбировавшийся на колонке, получая при этом раствор hPTH с пониженным содержанием уксусной кислоты.
Раствор hPTH с заданным содержанием уксусной кислоты можно получить путем доведения рН водного раствора hPTH, наносимого на колонку. Также раствор hPTH с заданным содержанием уксусной кислоты можно получить, делая раствор hPTH с очень малым содержанием уксусной кислоты, например, настолько малым, как это позволяет метод, а затем добавляя такое количество уксусной кислоты, которое необходимо для получения раствора hPTH с заданным содержанием уксусной кислоты. Например, раствор hPTH(1-34), из которого было удалено слишком много уксусной кислоты, разбавляют водой до концентрации 10 мг/мл и добавляют в него уксусную кислоту до тех пор, пока рН раствора не достигнет значения около 6,5, при этом образуется раствор hPTH(1-34) с содержанием уксусной кислоты в 2%.
Полученный вышеописанным способом раствор hPTH лиофилизируют общепринятым методом, получая фармацевтический компонент настоящего изобретения.
Лекарственный компонент настоящего изобретения может включать водорастворимые органические кислоты либо, предпочтительно, по меньшей мере одну кислоту из числа лимонной, адипиновой и гликолевой кислот с целью улучшения всасывания этого компонента слизистой оболочкой. Фармацевтический компонент, дополнительно включающий такую органическую кислоту, обеспечит высокую стабильность, а также хорошие ощущения при введении его не парентеральным путем, а другим способом, особенно при интраназальном введении.
Соответственно, фармацевтический компонент настоящего изобретения может применяться в качестве компонента фармацевтической композиции для интраназального введения, пригодной для долговременного применения.
Кроме того, фармацевтическая композиция настоящего изобретения для интраназального введения обладает совместимостью с целым рядом функциональных компонентов, а также с носителями, наполнителями, повышающими вязкость веществами, консервантами, стабилизаторами, антиоксидантами, связующими веществами, диспергирующими веществами, увлажнителями, смазывающими веществами, красителями, ароматизаторами, корригентами (corrigent), суспендирующими веществами, эмульгаторами, солюбилизаторами, буферными и поддерживающими изотоничность веществами, детергентами, смягчающими веществами, серосодержащими восстановителями и др. Таким образом, фармацевтическая композиция настоящего изобретения обладает совместимостью с различными функциональными компонентами, которые могут быть введены в ее состав для улучшения всасывания, стабильности в сухом виде и т.д. по мере необходимости.
В качестве носителей или наполнителей могут быть использованы вещества, хорошо или умеренно растворимые в воде: сахара, полисахариды, декстрины, целлюлозы, синтетические или полусинтетические полимеры, аминокислоты, полиаминокислоты, белки и фосфолипиды.
Сахара (моносахариды, олигосахариды) могут включать, к примеру, D-маннитол, глюкозу, лактозу, фруктозу, инозитол, сахарозу, мальтозу и др., а полисахариды могут включать декстран, пуллулан, альгиновую кислоту, гиалуроновую кислоту, пектиновую кислоту, фитиновую кислоту, фитин и др. К декстринам относятся  -циклодекстрин, -циклодекстрин, 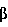 -циклодекстрин, -циклодекстрин, 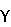 -циклодекстрин, декстрин, гидроксипропилкрахмал, гидроксиэтилкрахмал и др. -циклодекстрин, декстрин, гидроксипропилкрахмал, гидроксиэтилкрахмал и др.
К целлюлозам относятся метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и др.
Синтетические или полусинтетические полимеры могут включать поливиниловый спирт, карбоксивиниловые полимеры, полиэтиленгликоль, поливинилпирролидон (PVP), полиакрилат натрия, полиактовую кислоту (polyactic acid) и др.
Аминокислоты могут включать глицин, таурин, а полиаминокислоты – полиглутаминовую кислоту, полиаспарагиновую кислоту, полиглицин, полилейцин и др.
Белки могут включать желатин и другие; кроме того, хитин и хитозан.
Из числа этих носителей или наполнителей особенно предпочтительны сахароза, мальтоза,  -циклодекстрин, -циклодекстрин, 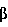 -циклодекстрин, декстрин, D-маннитол, инозитол, лактоза, декстран, метилцеллюлоза, гидроксипропилцеллюлоза, поливиниловый спирт, пуллулан и др. -циклодекстрин, декстрин, D-маннитол, инозитол, лактоза, декстран, метилцеллюлоза, гидроксипропилцеллюлоза, поливиниловый спирт, пуллулан и др.
Помимо них, также сорбиновая кислота, бензалконийхлорид, цетилпиридинийхлорид, бензэтонийхлорид, парабены: метил-параоксибензоат, этил-параоксибензоат, пропил-параоксибензоат, бутил-параоксибензоат и др., гуммиарабик, сорбитол, стеарат магния, тальк, диоксид кремния, микрокристаллическая целлюлоза, крахмал, фосфат кальция, растительное масло, карбоксиметилцеллюлоза, лаурилсульфат натрия, вода, этанол, глицерин и сироп.
Типичные примеры поверхностно-активных веществ приведены ниже. В составы по изобретению можно добавлять один из них или комбинации из более чем двух детергентов.
В качестве неионных детергентов могут использоваться такие сложные эфиры, как эфиры ангидросорбита и жирных кислот, например, сорбитанмонокаприлат, сорбитанмонолаурат, сорбитанмонопальмитат и др.; эфиры глицерина и жирных кислот, например, глицерилмонокаприлат, глицерилмономиристат, глицерилмоностеарат и др.; эфиры полиглицерина и жирных кислот, например, декаглицерилмоностеарат, декаглицерилдистеарат, декаглицерилмонолинолеат и др.; эфиры полиоксиэтилен-производных ангидросорбита и жирных кислот, как, например, сорбитанполиоксиэтиленмонолаурат, сорбитанполиоксиэтиленмоноолеат, сорбитанполиоксиэтиленмоностеарат, сорбитанполиоксиэтиленмонопальмитат, сорбитанполиоксиэтилентриолеат, сорбитанполиоксиэтилентристеарат и др.; эфиры полиоксиэтилен-производных сорбита и жирных кислот, как, например, сорбитполиоксиэтилентетрастеарат, сорбитполиоксиэтилентетралаурат и др.; эфиры полиоксиэтилен-производных глицерина и жирных кислот типа глицеринполиоксиэтиленмоностеарата; эфиры полиэтиленглицерина и жирных кислот типа полиэтиленглицерилдистеарата; а также простые эфиры, такие как полиоксиэтиленалкиловые эфиры типа полиоксиэтиленлаурилового эфира; полиоксиэтилен-полиоксипропиленалкиловые эфиры, например, полиоксиэтилен-полиоксипропиленгликолевый эфир, полиоксиэтилен-полиоксипропиленпропиловый эфир, полиоксиэтилен-полиоксипропиленцетиловый эфир и др.; полиоксиэтилен-алкилфениловые эфиры типа полиоксиэтилен-нонилфенилового эфира; полиоксиэтилен-производные касторового масла, например, полиоксиэтилен-производное касторового масла, полиоксиэтилен-производное гидрогенизированного касторового масла; полиоксиэтилен-производные желтого пчелиного воска типа сорбитполиоксиэтилен-производного пчелиного воска; полиоксиэтилен-производные ланолина типа полиоксиэтиленланолина; и полиоксиэтилен-производные амидов жирных кислот со значением гидрофильно-липофильного баланса от 6 до 18 типа полиоксиэтиленстеариламида.
Анионные детергенты выбирают из солей алкилсульфатов (от С10 до C18), например цетилсульфат натрия, лаурилсульфат натрия, олеилсульфат натрия и др.; соли сульфатов полиоксиэтиленалкиловых эфиров, у которых среднее число молей этиленоксида равно 2-4, а алкильная группа содержит 10-18 атомов углерода, например натриевая соль сульфата полиоксиэтиленлаурилового эфира; и соли алкиловых эфиров сульфоянтарной кислоты, у которых алкильная группа состоит из 8-18 атомов углерода, например натриевая соль лаурилового эфира сульфоянтарной кислоты.
Природные детергенты выбирают из лецитина, фосфоглицеролипидов, сфинголипидов типа сфингомиелина и эфиры сахарозы и жирных кислот (от С12 до С18).
Серосодержащие восстановители выбирают из N-ацетилцистеина, N-ацетилгомоцистеина, липоевой кислоты, тиоэтанола, тиоэтаноламина, тиоглицерина, тиосорбита, тиогликолевой кислоты и ее соли, тиосульфата натрия, глутатиона, тиоалкановых кислот (от C1 до С7), имеющих сульфгидрильную группу.
Антиоксиданты выбирают из изоаскорбиновой кислоты (erysorbic acid), дибутилгидрокситолуола, бутилгидроксианизола,  -токоферола, токоферола ацетата, L-аскорбиновой кислоты и ее соли, L-аскорбилпальмитата, L-аскорбилстеарата, бисульфита натрия, сульфита натрия, триамилгаллата, пропилгаллата, а также хелатообразующих веществ, например, кальций-динатриевой соли ЭДТА, пирофосфата натрия, метафосфата натрия и др. -токоферола, токоферола ацетата, L-аскорбиновой кислоты и ее соли, L-аскорбилпальмитата, L-аскорбилстеарата, бисульфита натрия, сульфита натрия, триамилгаллата, пропилгаллата, а также хелатообразующих веществ, например, кальций-динатриевой соли ЭДТА, пирофосфата натрия, метафосфата натрия и др.
В фармацевтической композиции настоящего изобретения hPTH может находиться в количестве 0,01-20%, предпочтительно 0,05-10%, а органическую кислоту можно добавлять по необходимости. Исходное содержание органической кислоты составляет 0,05-99,5%, предпочтительно 0,1-99,0%. Носитель или наполнитель, добавляемый обычно при приготовлении лекарственных препаратов, можно добавить по необходимости, или он может находиться исходно, например, в количестве 0,01-99,5%. Различные другие функциональные компоненты можно добавлять по необходимости, или они могут находиться исходно, например, в количестве 0,05-99,5%.
Приготовление фармацевтической композиции для интраназального введения по настоящему изобретению может осуществляться любым известным способом.
Например, в качестве фармацевтической композиции может служить фармацевтический компонент на основе hPTH, в котором уменьшено содержание уксусной кислоты. С другой стороны, в фармацевтический компонент на основе hPTH с пониженным содержанием уксусной кислоты можно по мере необходимости добавить носитель или наполнитель, добавляемый обычно при приготовлении фармацевтических препаратов, а также органическую кислоту и различные другие функциональные компоненты, и полученный состав использовать в качестве фармацевтического компонента. Органическая кислота может служить для замены уксусной кислоты или просто в качестве добавки. Например, в фармацевтический компонент на основе hPTH добавляют носитель или наполнитель, обычно добавляемый при приготовлении фармацевтических препаратов, органическую кислоту и различные функциональные компоненты, получая смесь, которую растворяют в дистиллированной воде, а раствор лиофилизируют, и при этом образуется однородная композиция.
В качестве альтернативы фармацевтический компонент на основе hPTH и носитель или наполнитель, обычно добавляемый при приготовлении фармацевтических препаратов, вместе растворяют в дистиллированной воде, затем в раствор добавляют органическую кислоту и различные функциональные компоненты и раствор лиофилизируют, при этом образуется однородная композиция. В другом варианте фармацевтический компонент на основе hPTH, органическую кислоту и различные функциональные компоненты вместе растворяют в дистиллированной воде и раствор лиофилизируют, по мере необходимости нужное количество лиофилизованного соединения растворяют вместе с носителем или наполнителем, обычно используемым при приготовлении фармацевтических препаратов, и при этом образуется однородная композиция.
Фармацевтический компонент настоящего изобретения может находиться в различных лекарственных формах в зависимости от предусмотренного способа введения: он может находиться в форме, предназначенной для нанесения на слизистые оболочки прямой кишки, носовой полости, ротовой полости и т.д. Фармацевтическая композиция для интраназального введения по настоящему изобретению предпочтительно применяется в форме, соответствующей интраназальному применению.
Предпочтительным примером фармацевтической композиции для интраназального введения по настоящему изобретению может служить растворимая по требованию форма, состоящая из лиофилизованной части, содержащей фармацевтическую композицию по настоящему изобретению в лиофилизованном виде, и прилагаемой к ней растворяющей части (растворителя).
Органическая кислота, такая как лимонная, адипиновая или гликолевая кислоты, добавляемая для улучшения всасывания, может находиться в виде составной части соли hPTH, примеси или добавки. С другой стороны, органическая кислота может быть растворена в растворяющей части (растворителе).
Введение фармацевтической композиции для интраназального применения по настоящему изобретению осуществляется любым известным способом. Например, может применяться распыление фармацевтической композиции для интраназального введения по настоящему изобретению: композиция находится в контейнере, к которому прикреплен распылитель, наконечник распылителя вводится в носовую полость, и осуществляется распыление фармацевтической композиции.
Дозировка фармацевтической композиции по настоящему изобретению может варьироваться в зависимости от вида заболевания, возраста и веса пациента, тяжести заболевания и способа введения композиции. Например, если композиция на основе hPTH вводится интраназально, ее можно вводить один раз в день или несколько раз в день, при этом пропорционально снижая дозу, в течение определенного времени. Разовая доза композиции на основе hPTH(1-34) предпочтительно составляет от 10 до 5000 мкг. Во время лечения можно сделать перерыв на так называемую отмывку, а затем возобновить лечение.
ПРИМЕРЫ
Далее настоящее изобретение раскрывается на Примерах, однако оно не должно быть ограничено этими примерами.
Методы тестирования и приборы, используемые в Примерах, основаны на том, что описано ниже, если не указано иначе.
1. Определение hPTH методом ВЭЖХ
Определение содержания данного пептида в композиции и проверку на присутствие в ней продуктов разложения (побочных продуктов) проводили методом обращеннофазовой ВЭЖХ на приборах и в условиях, указанных ниже.
| Прибор: |
система LC-9A фирмы Shimadzu Ltd. |
| Колонка: |
YMC Protein-RP(4,6 мм × 150 мм) |
| Темп. колонки: |
40°С |
| Элюент: |
концентрацию ацетонитрила в 0,1% |
| |
трифторуксусной кислоте измеряли линейно |
| |
от 25% до 40% за 30 минут |
| Скорость протока: |
1 мл/мин |
| Детекция: |
УФ (210 нм) |
| Вводимое кол-во: |
50 мкл |
2. Определение уксусной кислоты
Содержание уксусной кислоты в диализных растворах и в лиофилизованных композициях определяли методом ионообменной хроматографии в условиях, указанных ниже.
| Прибор: |
система LC-91 фирмы Shimadzu Ltd. |
| Колонка: |
IC-A1 фирмы Shimadzu (4,6 мм × 100 мм) |
| Темп. колонки: |
40°С |
| Элюент: |
смесь (1:1) из 0,84% водного |
| |
раствора фталевой кислоты и 0,58% |
| |
водного раствора |
| |
трис(гидроксиметил)аминометана |
| Скорость протока: |
1,5 мл/мин |
| Детекция: |
детектор электропроводности |
| Вводимое кол-во: |
10 мкл |
3. Определение масс
Определение масс hPTH, продуктов разложения (побочных продуктов) hPTH и продуктов их энзиматического расщепления осуществляли на приборах и в условиях, указанных ниже.
| Прибор: |
MAT TSQMS фирмы Finnigan |
| Ионизация: |
ESI |
| Режим детекции: |
положительный |
| Напряжение в распылителе: |
4,5 кВ |
| Темп. капилляра: |
250°С |
| Подвижная фаза: |
смесь (1:1) из 0,2% уксусной кислоты |
| |
и метанола |
| Скорость протока: |
0,2 мл/мин |
| Интервал сканирования: |
m/z 550-850 |
4. Определение аминокислотных последовательностей
Определение аминокислотных последовательностей продуктов разложения (побочных продуктов) hPTH и продуктов их энзиматического расщепления осуществляли на следующем приборе.
| Прибор: |
секвенатор типа 477А фирмы Perkin-Elmer |
5. Определение аминокислотного состава
Определение аминокислотного состава hPTH, продуктов разложения (побочных продуктов) hPTH и продуктов их энзиматического расщепления осуществляли на следующем приборе.
| Прибор: |
аминокислотный анализатор типа L-8500 фирмы Hitachi |
6. Хранение образцов (тест на стабильность)
Исследуемые образцы находились в хранилище в условиях, указанных ниже.
| Прибор: |
LH-30-14 фирмы Nagano Science Co. Ltd. |
| Температуры: |
1) 40±1°C, 2) 60±1°С, 3) 80±2°С |
7. Лиофилизация
| Прибор: |
RL-903BS фирмы Kyowa Vacuum Engineering, Ltd. |
| Флакон: |
стеклянный флакон на 15 мл |
Ссылочный пример 1. Получение hPTH(1-34) (1)
Экспрессионную плазмиду pG117S4HPPH34 (Japanese Patent Laid-Open No. 9-29660), содержащую ген, кодирующий химерный белок hPTH(1-34), полученный присоединением фрагмента ДНК, кодирующего производное  -галактозидазы Е. coli, к фрагменту ДНК, кодирующему hPTH(1-34), через промежуточный фрагмент ДНК, кодирующий линкер, содержащий мотив (Lys-Arg) для расщепления протеазой Кех2 или ферментом процессинга, вводили в клетки Е. coli штамма М25 (W3110/ompT: Sugimura et al., Biochem. Biophys. Res. Commun., vol.153, 1988, p.753-759). Трансформированные клетки Е.coli штамма М25 культивировали в среде, содержащей 2% дрожжевого экстракта, в сосуде объемом 20 л. -галактозидазы Е. coli, к фрагменту ДНК, кодирующему hPTH(1-34), через промежуточный фрагмент ДНК, кодирующий линкер, содержащий мотив (Lys-Arg) для расщепления протеазой Кех2 или ферментом процессинга, вводили в клетки Е. coli штамма М25 (W3110/ompT: Sugimura et al., Biochem. Biophys. Res. Commun., vol.153, 1988, p.753-759). Трансформированные клетки Е.coli штамма М25 культивировали в среде, содержащей 2% дрожжевого экстракта, в сосуде объемом 20 л.
Культивирование продолжали до достижения оптической плотности OD660=12. Клетки отделяли и разрушали при помощи гомогенизатора высокого давления (Manton-Gaullin) в 10 мМ трис-HCl буфере (рН 8,2), содержащем 1 мМ ЭДТА, центрифугировали, промывали и получали около 625 мл суспензии, содержащей примерно 100 г телец включения химерного белка. К 250 мл суспензии, содержащей 40 г телец включения, добавляли 100 мл 1 М трис-HCl буфера (рН 8,2), 50 мл 5 М NaCl, 500 мл деионизированной воды и 900 г мочевины и эту смесь перемешивали при 30°С для растворения телец включения.
Раствор разбавляли деионизированной водой до 5 л и добавляли 50 мл 250 мМ CaCl2. Затем в раствор добавляли Кех2-660 – производное протеазы Кех2, содержащее аминокислотные остатки №1-660 (Japanese Patent Laid-Open No. 10-229884), до концентрации 20 000 Ед/мл или выше. Смесь осторожно перемешивали 2 часа, при этом от химерного белка отщеплялся hPTH(1-34). После обработки раствор доводили до рН 6,4 с помощью уксусной кислоты и разбавляли в 2 раза деионизированной водой, что вызывало выпадение в осадок непрореагировавшего химерного белка и производного  -галактозидазы, после чего смесь центрифугировали и получали супернатант, содержащий 6,7 г hPTH(1-34). Супернатант доводили до рН 5,0 с помощью уксусной кислоты и раствор наносили на катионообменную смолу (SP Toyopearl фирмы Tosoh Corporation), предварительно уравновешенную 10 мМ ацетатом натрия, чтобы на смоле адсорбировался hPTH(1-34), затем смолу промывали 10 мМ натрийацетатным буфером; элюцию проводили 0,4 М NaCl, получая фракцию, содержащую 6,0 г ПРТН(1-34). -галактозидазы, после чего смесь центрифугировали и получали супернатант, содержащий 6,7 г hPTH(1-34). Супернатант доводили до рН 5,0 с помощью уксусной кислоты и раствор наносили на катионообменную смолу (SP Toyopearl фирмы Tosoh Corporation), предварительно уравновешенную 10 мМ ацетатом натрия, чтобы на смоле адсорбировался hPTH(1-34), затем смолу промывали 10 мМ натрийацетатным буфером; элюцию проводили 0,4 М NaCl, получая фракцию, содержащую 6,0 г ПРТН(1-34).
В эту фракцию добавляли уксусную кислоту до 3% (об/об) и раствор наносили на колонку для обращеннофазовой хроматографии ODS низкого давления (Soken ODS-W фирмы Soken Chemicals Co.), предварительно уравновешенную 3% уксусной кислотой, и элюировали hPTH(1-34) с помощью 30% (об/об) ацетонитрила, содержащего 3% уксусной кислоты. Содержащий hPTH(1-34) элюат концентрировали при пониженном давлении и наносили на колонку для обращеннофазовой ВЭЖХ (TSK gel ODS 120T размером 55 мм × 600 мм фирмы Tosoh Corp.), а затем пропускали раствор ацетонитрила в 5% (об/об) уксусной кислоте со скоростью 40 мл/мин в течение 60 минут, используя при этом линейный градиент концентрации ацетонитрила от 16% до 32% для элюирования hPTH(1-34). Таким образом получали очищенную фракцию, содержащую 4 г hPTH(1-34).
Остальные 60 г телец включения обрабатывали таким же образом и полученную при этом очищенную фракцию, содержащую 5 г hPTH(1-34), объединяли с предыдущей. Из этой смеси удаляли ацетонитрил при пониженном давлении и разбавляли 5% уксусной кислотой так, чтобы концентрация hPTH(1-34) составила 10 мг/мл. В стеклянные флаконы вносили по 15 мл раствора и все флаконы лиофилизировали, получая в общем 9 г hPTH(1-34) (150 мг × 60 флаконов).
Результаты масс-спектрометрического анализа ESI: 4117,7 (теоретическое значение 4117,8).
Аминокислотный состав после гидролиза в 6 N HCl: Asx-4,0(4); Ser-2,6(3); Glx-4,9(5); Gly-1,0(1); Val-3,0(3): Met-2,0(2); Ile-1,0(1); Leu-5; Phe-1,1(1); Lys-3,0(3); His-3,0(3); Arg-2,0(2); Trp не обнаруживается (1).
Ссылочный пример 2. Получение hPTH(1-34) (2)
Такие же микроорганизмы, как в ссылочном примере 1, выращивали в ферментере объемом 200 л. Культивирование продолжали до достижения плотности клеток OD660=160. Клетки отделяли и разрушали при помощи гомогенизатора высокого давления в 10 мМ трис-HCl буфере (рН 8,2), содержащем 1 мМ ЭДТА, центрифугировали, промывали и получали около 10 л суспензии, содержащей примерно 5 кг телец включения химерного белка.
К 4,0 л суспензии, содержащей 2 кг телец включения, добавляли 1,6 л 1 М трис-HCl буфера (рН 8,2), 0,8 л 5 М NaCl, 15 л деионизированной воды и 13 кг мочевины и эту смесь перемешивали при 30°С для растворения телец включения.
Раствор разбавляли деионизированной водой до 80 л и добавляли 0,8 л 250 мМ CaCl2. Затем в раствор добавляли Кех2-660 (Japanese Patent Laid-Open No. 10-229884) до концентрации 10 000 Ед/мл или выше. Смесь осторожно перемешивали 1 час, при этом hPTH(1-34) отщеплялся от химерного белка. После обработки раствор доводили до рН 6,3 с помощью уксусной кислоты и разбавляли в 2 раза деионизированной водой, что вызывало выпадение в осадок непрореагировавшего химерного белка и производного  -галактозидазы, после чего смесь подвергали фильтрованию под давлением и получали супернатант, содержащий hPTH(1-34). -галактозидазы, после чего смесь подвергали фильтрованию под давлением и получали супернатант, содержащий hPTH(1-34).
Супернатант доводили до рН 5,0 с помощью уксусной кислоты и раствор наносили на колонку (5 л) с катионообменной смолой (Poros 50HS фирмы PerSeptive Biosystems, USA), предварительно уравновешенную 10 мМ натрийацетатным буфером, чтобы на колонке адсорбировался hPTH(1-34), затем колонку промывали 10 мМ натрийацетатным буфером и использовали градиент концентрации до 0,4 М NaCl для элюирования фракции, содержащей hPTH(1-34). В эту фракцию добавляли уксусную кислоту до 3% (об/об) и раствор наносили на колонку (5 л) для обращеннофазовой хроматографии ODS низкого давления (Soken ODS-W фирмы Soken Chemicals Co.), предварительно уравновешенную 3% уксусной кислотой, и элюировали hPTH(1-34) с помощью 30% (об/об) ацетонитрила, содержащего 3% уксусной кислоты.
Содержащий hPTH(1-34) элюат концентрировали при пониженном давлении и фильтровали через фильтр с размером пор 0,22  м, а фильтрат наносили на колонку для обращеннофазовой ВЭЖХ (TSK ODS 80Ts 20 м, а фильтрат наносили на колонку для обращеннофазовой ВЭЖХ (TSK ODS 80Ts 20  m размером 105 мм × 550 мм фирмы Tosoh Corp.) и использовали градиент концентрации ацетонитрила в присутствии 3% (об/об) уксусной кислоты для элюирования hPTH(1-34). Несколько полученных таким образом элюатов объединяли, из раствора удаляли ацетонитрил упариванием при пониженном давлении и получали 10,4 л конц. раствора hPTH(1-34), содержащего 70 г hPTH(1-34) с чистотой 99,6%. Из остальных 3 кг телец включения 2 кг подвергали такому же процессу очистки, получая 11,6 л конц. раствора hPTH(1-34), содержащего hPTH(1-34) с чистотой 99,6%. m размером 105 мм × 550 мм фирмы Tosoh Corp.) и использовали градиент концентрации ацетонитрила в присутствии 3% (об/об) уксусной кислоты для элюирования hPTH(1-34). Несколько полученных таким образом элюатов объединяли, из раствора удаляли ацетонитрил упариванием при пониженном давлении и получали 10,4 л конц. раствора hPTH(1-34), содержащего 70 г hPTH(1-34) с чистотой 99,6%. Из остальных 3 кг телец включения 2 кг подвергали такому же процессу очистки, получая 11,6 л конц. раствора hPTH(1-34), содержащего hPTH(1-34) с чистотой 99,6%.
Ссылочный пример 3. Получение hPTH(1-84)
Экспрессионную плазмиду pGP#19 (Japanese Patent Laid-Open No. 9-29660), содержащую ген, кодирующий химерный белок hPTH(1-84), полученный присоединением фрагмента ДНК, кодирующего производное  -галактозидазы Е.coli, к фрагменту ДНК, кодирующему hPTH(1-84), через промежуточный фрагмент ДНК, кодирующий линкер, содержащий мотив (Lys-Arg) для расщепления протеазой Кех2 или ферментом процессинга, вводили в клетки Е.coli штамма М25. Трансформированные клетки Е.coli штамма М25 культивировали при 37°С в сосуде объемом 3 л. Культивирование продолжали, пока культура не достигала плотности по OD660=1. После этого добавляли изопропил- -галактозидазы Е.coli, к фрагменту ДНК, кодирующему hPTH(1-84), через промежуточный фрагмент ДНК, кодирующий линкер, содержащий мотив (Lys-Arg) для расщепления протеазой Кех2 или ферментом процессинга, вводили в клетки Е.coli штамма М25. Трансформированные клетки Е.coli штамма М25 культивировали при 37°С в сосуде объемом 3 л. Культивирование продолжали, пока культура не достигала плотности по OD660=1. После этого добавляли изопропил- -тиогалактозид (IPTG) до 1 мМ. -тиогалактозид (IPTG) до 1 мМ.
Культивирование продолжали еще 4 часа. Клетки собирали центрифугированием, а затем суспендировали в ТЕ-буфере (10 мМ трис и 1 мМ ЭДТА, рН 8,0). Клетки разрушали с помощью пресса Френча, подвергали повторному центрифугированию и ресуспендированию, промывали и получали тельца включения. Суспензию телец включения вносили для растворения в раствор (рН 8,0), содержащий 8,0 М мочевину и 10 мМ трис, центрифугировали, супернатант наносили на колонку с Toyopearl (Toso Corp.) и элюировали обогащенный hPTH(1-84) с помощью градиента концентрации NaCl (0-0,4 М). Раствор, обогащенный растворенными тельцами включения, дополнительно концентрировали с помощью ультрафильтрации с пределом исключения по молекулярному весу в 10000. Его разбавляли так, чтобы получить раствор, содержащий 50 мМ Бис-Трис при рН 6,8, 1,0 мМ CaCl2 и 5 мг/мл химерного белка. Добавляли Кех2-660 до концентрации 2000 Ед/мл и проводили реакцию расщепления при 30°С в течение 1 часа для получения hPTH(1-84).
Реакционную смесь доводили до рН 5,0 с помощью уксусной кислоты и разбавляли в 2 раза деионизированной водой, что вызывало выпадение в осадок непрореагировавшего химерного белка и производного  -галактозидазы, после чего смесь центрифугировали и получали супернатант, содержащий hPTH(1-84). В супернатант добавляли уксусную кислоту до 3% (об/об) и раствор наносили для очистки на колонку с гелем TSK ODS 80Ts (21 мм × 250 мм, Tosoh Corporation), предварительно уравновешенную 3%-й уксусной кислотой (об/об). Фракции, содержащие 98% или больше hPTH(1-84), объединяли, и из этого раствора удаляли растворитель, а остаток лиофилизировали, получая 500 мг hPTH(1-84). Молекулярный вес и аминокислотный состав этого вещества указаны ниже. На основании этих данных вещество было идентифицировано как hPTH(1-84). -галактозидазы, после чего смесь центрифугировали и получали супернатант, содержащий hPTH(1-84). В супернатант добавляли уксусную кислоту до 3% (об/об) и раствор наносили для очистки на колонку с гелем TSK ODS 80Ts (21 мм × 250 мм, Tosoh Corporation), предварительно уравновешенную 3%-й уксусной кислотой (об/об). Фракции, содержащие 98% или больше hPTH(1-84), объединяли, и из этого раствора удаляли растворитель, а остаток лиофилизировали, получая 500 мг hPTH(1-84). Молекулярный вес и аминокислотный состав этого вещества указаны ниже. На основании этих данных вещество было идентифицировано как hPTH(1-84).
Результаты масс-спектрометрического анализа ESI: 9424,7 (теоретическое значение 9424,7).
Аминокислотный состав после гидролиза в 6 N HCl: Asx-10,1(10); Thr-1,1(1); Ser-6,3(7); Glx-11,0(11); Pro-2,9(3); Gly-4,1(4); Ala-7,0(7); Val-8,0(8): Met-1,9(2); Ile-1,0(1); Leu-10; Phe-1,0(1); Lys-8,9(9); His-3,9(4); Arg-5,0(5); Trp не обнаруживается (1).
Пример 1. Удаление уксусной кислоты из hPTH(1-34) (1)
(1) Порцию препарата, соответствующую 150 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 5 мг/мл hPTH(1-34) (pH 4,7). Этот раствор диализовали против дистиллированной воды (100 мл) при помощи Micro Acilyzer GI (Asahi Kasei Corp.) с электродиализной мембраной AC-130-10 (Asahi Kasei Corp.). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение pH диализного раствора не достигало 5,0. Обогащенный раствор, содержащий 6,8% уксусной кислоты, лиофилизировали и получали сухую массу, соответствующую примерно 150 мг hPTH(1-34), с содержанием уксусной кислоты в 4,8%.
(2) Порцию препарата, соответствующую 150 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 5 мг/мл hPTH(1-34) с pH 4,7. Этот раствор подвергали электродиализу, как описано в Примере 1: диализ для удаления уксусной кислоты проводили до тех пор, пока значение pH диализного раствора не достигало 5,5. Обогащенный раствор, содержащий 4,6% уксусной кислоты, лиофилизировали и получали сухую массу, соответствующую примерно 150 мг hPTH(1-34), с содержанием уксусной кислоты в 3,8%.
(3) Порцию препарата, соответствующую 150 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 5 мг/мл hPTH(1-34) с pH 4,7. Этот раствор подвергали электродиализу, как описано в примере 1: диализ для удаления уксусной кислоты проводили до тех пор, пока значение pH диализного раствора не достигало 5,9. Обогащенный раствор, содержащий 3,1% уксусной кислоты, лиофилизировали и получали сухую массу, соответствующую примерно 150 мг hPTH(1-34), с содержанием уксусной кислоты в 2,9%.
(4) Порцию препарата, соответствующую 150 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 5 мг/мл hPTH(1-34) с рН 4,7. Этот раствор подвергали электродиализу, как описано в примере 1: диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 7,0. Обогащенный раствор, содержащий 1,6% уксусной кислоты, лиофилизировали и получали сухую массу, соответствующую примерно 150 мг hPTH(1-34), с содержанием уксусной кислоты в 1,6%.
Вышеприведенные результаты показывают, что чем меньше исходное содержание уксусной кислоты, тем меньше снижается ее содержание при лиофилизации, и чем меньше исходное содержание уксусной кислоты, тем более уменьшается относительное снижение ее содержания. Соответственно, снижение содержания уксусной кислоты в компоненте на основе hPTH может быть использовано для получения фармацевтического компонента hPTH, содержащего заданное количество уксусной кислоты, чего было трудно достичь общепринятыми методами.
Пример 2. Удаление уксусной кислоты из hPTH(1-34) (2)
В раствор, содержащий примерно 150 г препарата hPTH(1-34), полученного в ссылочном примере 2, добавляли 5 N NaOH до рН 5,5. Четвертую часть этого раствора наносили на колонку для обращеннофазовой хроматографии ODS низкого давления (800 мл, Soken ODS-W фирмы Soken Chemicals Co.), предварительно уравновешенную 5% водным раствором ацетонитрила, чтобы hPTH(1-34) адсорбировался на колонке. Пропускали 4 л 5% водного раствора ацетонитрила для вымывания ацетата натрия, а затем элюировали hPTH(1-34) 50% водным раствором ацетонитрила. Этот процесс повторяли с каждой из остальных четвертых частей и обогащенные hPTH(1-34) фракции объединяли, получая 8,2 л почти свободной от уксусной кислоты фракции, содержащей 122,5 г hPTH(1-34) с содержанием уксусной кислоты 1,13% по отношению к hPTH(1-34).
В эту фракцию добавляли дистиллированную воду, получая раствор hPTH(1-34) с концентрацией 10 мг/мл; в этот раствор добавляли 2,3 г уксусной кислоты с тем, чтобы он содержал 122,5 г hPTH при содержании уксусной кислоты в 3%; эту смесь хорошо перемешивали. Раствор разливали во флаконы так, чтобы каждый флакон содержал 150 мг hPTH(1-34), и раствор hPTH(1-34) во флаконах лиофилизировали, получая hPTH(1-34) с содержанием уксусной кислоты в 2,1%.
Пример 3. Удаление уксусной кислоты из hPTH(1-34) (3)
(1) Порцию препарата, соответствующую 300 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 10 мг/мл hPTH(1-34). Этим раствором с рН 4,7, содержащим 9,5% уксусной кислоты, заполняли три стеклянных флакона, по 2 мл на флакон, которые помещали в лиофилизатор FZ-6 (Labconco Corp.), внутреннее давление в котором поддерживали на уровне 0,13 мбар или ниже, и подвергали первичному высушиванию при температуре на полке -20°С, на которой они находились 12 часов) и вторичному высушиванию при температуре на полке 25°С в течение 48 часов) с целью получения лиофилизованного препарата. По завершении вторичной сушки использовавшуюся для лиофилизации камеру заполняли азотом и флаконы автоматически укупоривали. В каждый флакон вносили по 2 мл дистиллированной воды и определяли содержание уксусной кислоты в растворе методом ионообменной ВЭЖХ. Результаты представлены в табл.1.
(2) Порцию препарата, соответствующую 300 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 10 мг/мл hPTH(1-34), Этот раствор (рН 4,7) подвергали электродиализу при помощи Micro Acilyzer (Asahi Kasei Corp.) с электродиализной мембраной AC-130-10 (Asahi Kasei Corp.). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 5,0 (содержание уксусной кислоты в подвергнутом диализу растворе составило 7,3%). После удаления уксусной кислоты этим раствором заполняли три стеклянных флакона, по 2 мл на флакон, которые лиофилизировали как в примере (1) и определяли содержание уксусной кислоты в каждом образце методом ионообменной ВЭЖХ. Результаты представлены в табл.1.
(3) Порцию препарата, соответствующую 300 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 10 мг/мл hPTH(1-34). Этот раствор (рН 4,7) подвергали электродиализу при помощи Micro Acilyzer (Asahi Kasei Corp.) с электродиализной мембраной AC-130-10 (Asahi Kasei Corp.). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 5,5 (содержание уксусной кислоты в подвергнутом диализу растворе составило 4,6%). После удаления уксусной кислоты этим раствором заполняли три стеклянных флакона, по 2 мл на флакон, которые лиофилизировали как в примере (1) и определяли содержание уксусной кислоты в каждом образце методом ионообменной ВЭЖХ. Результаты представлены в табл.1.
(4) Порцию препарата, соответствующую 300 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 10 мг/мл hPTH(1-34). Этот раствор (рН 4,7) подвергали электродиализу при помощи Micro Acilyzer (Asahi Kasei Corp.) с электродиализной мембраной АС-130-10 (Asahi Kasei Corp.). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 6,3 (содержание уксусной кислоты в подвергнутом диализу растворе составило 2,0%). После удаления уксусной кислоты этим раствором заполняли три стеклянных флакона, по 2 мл на флакон, которые лиофилизировали как в примере (1) и определяли содержание уксусной кислоты в каждом образце методом ионообменной ВЭЖХ. Результаты представлены в табл.1.
(5) Порцию препарата, соответствующую 300 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 10 мг/мл hPTH(1-34). Этот раствор (рН 4,7) подвергали электродиализу при помощи Micro Acilyzer (Asahi Kasei Corp.) с электродиализной мембраной AC-130-10 (Asahi Kasei Corp.). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 7,0 (содержание уксусной кислоты в подвергнутом диализу растворе составило 1,1%). После удаления уксусной кислоты этим раствором заполняли три стеклянных флакона, по 2 мл на флакон, которые лиофилизировали как в примере (1) и определяли содержание уксусной кислоты в каждом образце методом ионообменной ВЭЖХ, Результаты представлены в табл.1.
(6) Порцию препарата, соответствующую 300 мг hPTH(1-34), полученного в ссылочном примере 1, растворяли в дистиллированной воде (30 мл), получая водный раствор 10 мг/мл hPTH(1-34), Этот раствор (рН 4,7) подвергали электродиализу при помощи Micro Acilyzer (Asahi Kasei Corp.) с электродиализной мембраной АС-130-10 (Asahi Kasei Corp.). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 7,6 (содержание уксусной кислоты в подвергнутом диализу растворе составило 0,5%). После удаления уксусной кислоты этим раствором заполняли три стеклянных флакона, по 2 мл на флакон, которые лиофилизировали как в примере (1) и определяли содержание уксусной кислоты в каждом образце методом ионообменной ВЭЖХ. Результаты представлены в табл.1.
Как видно из табл.1, чем меньше содержание уксусной кислоты в образце до лиофилизации, тем меньше снижается ее содержание при лиофилизации, и чем меньше содержание уксусной кислоты в образцах до лиофилизации, тем меньшим становится разброс в ее содержании между отдельными образцами или партиями после лиофилизации. Соответственно, это показывает, что препараты ПРТН с низким содержанием уксусной кислоты могут быть использованы для получения фармацевтического компонента hPTH, содержащего заданное количество уксусной кислоты, что трудно допустимо при использовании общепринятых методов.
Таблица 1.
Изменение содержания уксусной кислоты в результате лиофилизации |
| рН диализного раствора |
Содержание уксусной кислоты до лиофилизации (%) |
Содержание уксусной кислоты после лиофилизации (%) |
Среднее значение (%) |
Различия в содержании уксусной кислоты до и после лиофилизации (%) |
| |
|
6,7 |
|
|
| 4,7 |
9,5 |
6,5 |
6,6 |
2,9 |
| |
|
6,6 |
|
|
| |
|
5,5 |
|
|
| 5,0 |
7,3 |
5,4 |
5,5 |
1,8 |
| |
|
5,5 |
|
|
| |
|
4,9 |
|
|
| 5,5 |
4,6 |
4,9 |
4,9 |
-0,3 |
| |
|
4,8 |
|
|
| |
|
2,1 |
|
|
| 6,3 |
2,0 |
2,1 |
2,1 |
-0,1 |
| |
|
2,1 |
|
|
| |
|
0,8 |
|
|
| 7,0 |
1,1 |
0,8 |
0,8 |
0,3 |
| |
|
0,8 |
|
|
| |
|
0,4 |
|
|
| 7,6 |
0,5 |
0,4 |
0,4 |
0,1 |
| |
|
0,5 |
|
|
Пример 4. Удаление уксусной кислоты из hPTH(1-34)
Такие же микроорганизмы, как в ссылочном примере 1, выращивали в ферментере объемом 200 л. Клетки разрушали, центрифугировали, промывали и получали 4,8 кг телец включения химерного белка. Из них 2,4 кг подвергали расщеплению с помощью Кех2-660, как в ссылочном примере 2, для получения hPTH(1-34). Затем его подвергали очистке посредством катионообменной хроматографии, обессоливали с помощью обращеннофазовой хроматографии ODS и подвергали окончательной очистке методом обращеннофазовой ВЭЖХ. После этого, как в примере 2, к очищенной фракции добавляли 5 N NaOH до рН 5,5 и раствор наносили на колонку для обращеннофазовой хроматографии ODS низкого давления. Пропускали 5% водный раствор ацетонитрила для удаления ацетата натрия, а затем элюировали hPTH(1-34) 50% водным раствором ацетонитрила. При этом получили 5,4 л раствора, содержащего 58 г hPTH(1-34), с содержанием уксусной кислоты в 1,2% относительно hPTH(1-34). В этот раствор добавляли 1,0 г уксусной кислоты с тем, чтобы он содержал 58 г hPTH при содержании уксусной кислоты в 3%; эту смесь хорошо перемешивали. Раствор разливали во флаконы так, чтобы каждый флакон содержал 150 мг hPTH(1-34), и все растворы hPTH(1-34) во флаконах лиофилизировали, получая 57,8 г hPTH(1-34) с содержанием уксусной кислоты в 2,5% (385 флаконов).
(2) Порцию препарата, соответствующую 150 мг hPTH(1-34), полученного в примере (1), растворяли в 3 мл трифторэтанола и добавляли 30 мл диэтилового эфира для осаждения. Полученный при этом порошок высушивали в течение 24 часов в эксикаторе при пониженном давлении в присутствии гранул NaOH, получая 130 мг hPTH(1-34) с содержанием уксусной кислоты в 2,0%.
(3) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34), полученного в примере (1), вносили 1,53 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 3,6%.
(4) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34), полученного в примере (1), вносили 3,78 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 5,1%.
(5) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34), полученного в примере (1), вносили 5,28 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 6,2%.
Ссылочный пример 4
(1) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34), полученного в примере 4(1), вносили 7,23 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 7,5%.
(2) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34), полученного в примере 4(1), вносили 9,48 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 9,1%.
(3) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34), полученного в примере 4(1), вносили 10,53 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 7,5%.
(4) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34). полученного в примере 4(1), вносили 14,28 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 12,5%.
(5) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34), полученного в примере 4(1), вносили 16 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 13,7%.
(6) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34), полученного в примере 4(1), вносили 22,6 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 18,3%.
(7) Во флакон с препаратом, соответствующим 150 мг hPTH(1-34), полученного в примере 4(1), вносили 100 мкл уксусной кислоты по внутренней стенке флакона с помощью микрошприца, стараясь избежать контакта с hPTH(1-34). Уксусную кислоту упаривали, нагревая флакон при 80°С в течение 5 минут, затем флакон встряхивали на вибромешалке, и hPTH(1-34) превращался в мелкозернистый порошок, при этом получали препарат hPTH(1-34) с содержанием уксусной кислоты в 72,5%.
Пример 5. Удаление уксусной кислоты из hPTH(1-84) (1)
Порцию препарата, соответствующую 50 мг hPTH(1-84), полученного в ссылочном примере 3, с содержанием уксусной кислоты 5,4% растворяли в дистиллированной воде (10 мл), так что получался водный раствор (рН 4,7) с концентрацией 5 мг/мл hPTH(1-84). Этот раствор диализовали при комнатной температуре против дистиллированной воды (100 мл) при помощи Micro Acilyzer GI (Asahi Kasei Corp.) с электродиализной мембраной AC-130-10 (Asahi Kasei Corp.). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 5,0. Обогащенный раствор лиофилизировали и получали препарат, соответствующий примерно 50 мг hPTH(1-84) с содержанием уксусной кислоты в 3,9%.
(2) Порцию препарата, соответствующую 50 мг hPTH(1-84), полученного в ссылочном примере 3, с содержанием уксусной кислоты 5,4% растворяли в дистиллированной воде (10 мл), так что получался водный раствор (рН 4,7) с концентрацией 5 мг/мл hPTH(1-84), Этот раствор подвергали электродиализу таким же образом, как в примере (1). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 6,0. Обогащенный раствор лиофилизировали и получали препарат, соответствующий примерно 50 мг hPTH(1-84) с содержанием уксусной кислоты в 2,5%.
(3) Порцию препарата, соответствующую 50 мг hPTH(1-84), полученного в ссылочном примере 3, с содержанием уксусной кислоты 5,4% растворяли в дистиллированной воде (10 мл), так что получался водный раствор (рН 4,7) с концентрацией 5 мг/мл hPTH(1-84). Этот раствор подвергали электродиализу таким же образом, как в примере (1). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 7,0. Обогащенный раствор лиофилизировали и получали препарат, соответствующий примерно 50 мг hPTH(1-84) с содержанием уксусной кислоты в 1,3%.
(4) Порцию препарата, соответствующую 50 мг hPTH(1-84), полученного в ссылочном примере 3, с содержанием уксусной кислоты 5,4% растворяли в дистиллированной воде (10 мл), так что получался водный раствор (рН 4,7) с концентрацией 5 мг/мл hPTH(1-84). Этот раствор подвергали электродиализу таким же образом, как в примере (1). Диализ для удаления уксусной кислоты проводили до тех пор, пока значение рН диализного раствора не достигало 8,0. Обогащенный раствор лиофилизировали и получали препарат, соответствующий примерно 50 мг hPTH(1-84) с содержанием уксусной кислоты в 0,9%.
Пример 6. Удаление уксусной кислоты из hPTH(1-84) (2)
(1) Порцию препарата, соответствующую 100 мг hPTH(1-84), полученного в ссылочном примере 3, с содержанием уксусной кислоты 5,4% растворяли в 500 мкл трифторэтанола и добавляли 20 мл диэтилового эфира для осаждения. Осадок собирали фильтрованием и подвергали сушке в течение 24 часов в эксикаторе при пониженном давлении в присутствии гранул NaOH, получая сухую массу, соответствующую примерно 90 мг hPTH(1-84) с содержанием уксусной кислоты в 1,6%.
(2) Делали точную навеску в 5,49 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 0,3 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 2,2%.
(3) Делали точную навеску в 5,58 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 0,6 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 2,7%.
(4) Делали точную навеску в 4,96 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 1,0 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 3,8%.
Ссылочный пример 5
(1) Делали точную навеску в 5,05 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 1,7 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 5,2%.
(2) Делали точную навеску в 5,59 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 2,5 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 6,4%.
(3) Делали точную навеску в 5,01 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 3,0 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 8,0%.
(4) Делали точную навеску в 5,48 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 4,4 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 10,2%.
(5) Делали точную навеску в 5,47 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 5,5 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 12,3%.
(6) Делали точную навеску в 5,10 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 10,2 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 22,9%.
(7) Делали точную навеску в 5,53 мг сухой массы, полученной в примере 6(1), вносили во флакон на 5 мл и добавляли 16,6 мкл 10% (об/об) уксусной кислоты/метиленхлорида с помощью микрошприца, получая препарат с содержанием уксусной кислоты в 33,6%.
Опыт 1. Стабильность hPTH(1-34) (1)
Тестировали на стабильность препарат hPTH, из которого уксусная кислота, находящаяся в виде составной части соли hPTH или примеси, была удалена.
Порцию препарата, соответствующую примерно 150 мг hPTH(1-34) с содержанием уксусной кислоты 9,5%, находящуюся в герметично укупоренном стеклянном флаконе, как описано в ссылочном примере 1, помещали в хранилище LH-30-14 (Nagano Science Со.) при 40±1°С на 6 месяцев. Часть флаконов перед хранением, а остальные после хранения подвергали обращеннофазовой ВЭЖХ, чтобы выделить продукты разложения (побочные продукты) до и после хранения для структурного анализа. Результаты представлены в табл.2.
Результаты хроматографического анализа этого образца после хранения обращеннофазовой ВЭЖХ приведены на фиг.1. После большого пика, соответствующего hPTH(1-34), следуют три пика со временами удержания от 13 до 17 минут, обозначенные В, С и D. Площади этих пиков составляют 3,9% для пика В, 6,9% для пика С и 3,0% для пика D, как указано в табл.2. В сумме их доля весьма значительна: 13,8%, что является главной причиной ухудшения качества препарата. С помощью структурного анализа были установлены соединения, соответствующие этим пикам: пик В представляет собой смесь [N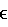 -ацетил-Lys18]-hPTH(1-34) и [N -ацетил-Lys18]-hPTH(1-34) и [N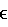 -ацетил-Lys26]-hPTH(1-34), пик С – [N -ацетил-Lys26]-hPTH(1-34), пик С – [N -ацетил-Ser1]-hPTH(1-34) и пик D – [N -ацетил-Ser1]-hPTH(1-34) и пик D – [N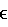 -ацетил-Lys27]-hPTH(1-34). -ацетил-Lys27]-hPTH(1-34).
Затем стабильность препарата hPTH(1-34) с содержанием уксусной кислоты 2,9%, полученного в примере 1(3), исследовали таким же образом, как и стабильность предыдущего.
Порцию препарата, соответствующую примерно 150 мг hPTH(1-34) с содержанием уксусной кислоты 2,9%, находящуюся в герметично укупоренном закрытом стеклянном флаконе, помещали в хранилище LH-30-14 (Nagano Science Co.) при 40±1°С на 6 месяцев. Часть флаконов перед хранением, а остальные – после хранения подвергали обращеннофазовой ВЭЖХ, чтобы выделить продукты разложения (побочные продукты) до и после хранения для структурного анализа. Результаты представлены в табл.3.
Результаты хроматографического анализа этого образца после хранения методом обращеннофазовой ВЭЖХ приведены на фиг.2. Как видно из фиг.2, по сравнению с хроматограммой препарата hPTH(1-34) с содержанием уксусной кислоты 9,5%, уменьшились площади всех пиков В, С и D. До хранения площади пиков В, С и D в сумме составляют 0,2%, что близко к соответствующему значению для препарата hPTH(1-34) с содержанием уксусной кислоты 9,5%. После хранения сумма площадей тех же пиков равна 3,6%, что значительно меньше соответствующего значения (13,8%) для препарата hPTH(1-34) с содержанием уксусной кислоты 9,5%.
Из предыдущего следует, что ацетилированные производные являются основными продуктами разложения hPTH, и что уменьшение содержания уксусной кислоты, находящейся в виде составной части соли hPTH(1-34) или примеси, приводит к улучшению стабильности hPTH. Итак, снижение содержания уксусной кислоты в препарате hPTH ведет к получению фармацевтического компонента на основе hPTH, обладающего отличной стабильностью.
Таблица 2.
Стабильность hPTH (1-34) (содержание уксусной кислоты 9,5%, хранение при 40°С в течение 6 месяцев) |
| Пик |
Продукты разложения (побочные продукты) |
До хранения (площадь пика, %) |
После хранения (площадь пика, %) |
| X1 |
[Met(O)8]-hPTH(1-34) |
0,1% или меньше |
0,1% |
| Х2 |
[Met(O)18]-hPTH(1-34) |
0,1% или меньше |
0,1% |
| В* |
[N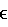 -AcLys18]-hPTH(1-34) [N -AcLys18]-hPTH(1-34) [N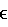 -AcLys26]-hPTH(1-34) -AcLys26]-hPTH(1-34) |
не определяется |
3,9% |
| С |
[N -AcSer1]-hPTH(1-34) -AcSer1]-hPTH(1-34) |
0,2% |
6,9% |
| D |
[N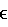 -AcLys27]-hPTH(1-34) -AcLys27]-hPTH(1-34) |
не определяется |
3,0% |
| Другие |
Неустановленные продукты разложения |
0,1% |
4,9% |
| hPTH(1-34) |
|
99,6% |
81,1% |
| Сумма |
|
100,0% |
100,0% |
| *: пик В представляет собой смесь. |
Таблица 3.
Стабильность hPTH (1-34) (содержание уксусной кислоты 2,9%, хранение при 40°С в течение 6 месяцев) |
| Пик |
Продукты разложения (побочные продукты) |
До хранения (площадь пика, %) |
После хранения (площадь пика, %) |
| X1 |
[Met(O)8]-hPTH(1-34) |
0,1% |
0.1% |
| Х2 |
[Met(O)18]-hPTH(1-34) |
0,1% |
0,1% |
| В* |
[N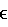 -AcLys18]-hPTH(1-34) [N -AcLys18]-hPTH(1-34) [N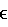 -AcLys26]-hPTH(1-34) -AcLys26]-hPTH(1-34) |
не определяется |
1,4% |
| С |
[N -AcSer1]-hPTH(1-34) -AcSer1]-hPTH(1-34) |
0,2% |
1,0% |
| D |
[Ne-AcLys27]-hPTH(1-34) |
не определяется |
1,2% |
| Другие |
Неустановленные продукты разложения |
0,1% |
3,9% |
| hPTH(1-34) |
|
99,5% |
92,3% |
| Сумма |
|
100,0% |
100,0% |
| *: пик В представляет собой смесь. |
Опыт 2. Стабильность hPTH(1-34) (2)
Препараты hPTH(1-34), полученные в примере 4 и ссылочном примере 4, с содержанием уксусной кислоты, указанным в примере 4 и ссылочном примере 4, хранили при 80°С в течение 15 часов. В каждый из препаратов добавляли 15 мл дистиллированной воды с помощью шприца и определяли содержание продуктов разложения (побочных продуктов) до и после хранения. Результаты представлены в табл.4. На фиг.3 приведен график зависимости содержания (в %) ацетилированных производных (В, С и D) в каждом препарате hPTH(1-34) после хранения от содержания уксусной кислоты.
Как видно из табл.4 и фиг.3, с уменьшением содержания уксусной кислоты снижается уровень продуктов разложения В, С, D, представляющих собой ацетилированные производные.
График зависимости чистоты препаратов hPTH(1-34) от содержания уксусной кислоты приведен на фиг.4. Как видно из фиг.4, эта зависимость имеет вид сигмоидной кривой с точкой излома, соответствующей уровню химического эквивалента (при содержании уксусной кислоты около 7,3%), и когда содержание уксусной кислоты находится ниже химического эквивалента, то стабильность препарата быстро улучшается.
Итак, снижение содержания уксусной кислоты в препарате hPTH ведет к получению фармацевтического компонента на основе hPTH, обладающего отличной стабильностью.

Опыт 3. Стабильность hPTH(1-84)
Для хранения при 80°С в течение 15 часов использовали препараты hPTH(1-84), полученные в примере 6 и ссылочном примере 5, с содержанием уксусной кислоты, указанным в примере 6 и ссылочном примере 5. Препараты оставляли при комнатной температуре на 1 минуту, чтобы испарился метиленхлорид, а затем закрывали. Эти препараты hPTH(1-84) с соответствующим содержанием уксусной кислоты хранили при 80°С в течение 15 часов; в каждый препарат для растворения добавляли 1 мл дистиллированной воды с помощью шприца и определяли содержание продуктов разложения (побочных продуктов) до и после хранения. Результаты представлены в табл.5. Результаты хроматографического анализа образца после хранения методом обращеннофазовой ВЭЖХ приведены на фиг.5. Кроме того, на фиг.6 приведен график зависимости содержания (%) продуктов разложения (побочных продуктов) в каждом препарате hPTH(1-84) после хранения от содержания уксусной кислоты.
Как показывает фиг.5, в результате хранения образовались продукты разложения (побочные продукты), обозначенные как R1-R6. Из табл.5 и фиг.6 видно, что продукты разложения, за исключением одного (R5), возрастали в зависимости от содержания уксусной кислоты.
График зависимости чистоты препаратов hPTH(1-84) после хранения от содержания в них уксусной кислоты приведен на фиг.7. Чистота препаратов hPTH(1-84) возрастает с уменьшением содержания в них уксусной кислоты и резко повышается, когда содержание уксусной кислоты падает ниже химического эквивалента (около 4,5%). Вышеприведенные результаты свидетельствуют, что, хотя препараты hPTH(1-84) содержат определенные продукты разложения, содержание которых не зависит от содержания уксусной кислоты, однако в образовании большинства продуктов разложения непосредственно участвует уксусная кислота, которая находится в виде составной части соли hPTH(1-84) или примеси, как и в случае hPTH(1-34), Итак, снижение содержания уксусной кислоты в препарате hPTH ведет к получению фармацевтического компонента на основе hPTH, обладающего отличной стабильностью.
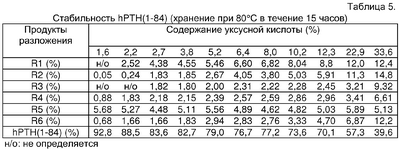
Опыт 4. Сенсорный тест (1)
Оценку ощущений при применении лекарственного компонента на основе hPTH осуществляли путем введения его в носовую полость.
Препарат hPTH(1-34), полученный в ссылочном примере 1, растворяли в 0,6% (вес/об) водном растворе лимонной кислоты или в воде в концентрации 10 мг/мл, раствор переносили в стеклянный флакон с резьбой и вставляли распылительную насадку (50 мкл) (Valois Co.). В одну ноздрю вводили 50 мкл раствора и оценивали запах и вызванное распылением в носовую полость раздражение (группа испытуемых состояла из 12 здоровых нормальных взрослых мужчин). Запах оценивали по 4 градациям: “ощущается запах кислоты”, “слегка ощущается запах кислоты”, “ощущается слабый запах” и “запах не ощущается” согласно обонятельным ощущениям испытуемого. Раздражение оценивали по 4 градациям: “болезненное раздражение”, “сильное раздражение”, “слабое раздражение” и “очень слабое раздражение”. Затем ставили оценки по запаху и раздражению согласно этим градациям. В качестве контроля использовали физиологический раствор. Результаты представлены в табл.6.
Как видно из табл.6, препараты hPTH(1-34), растворенные в водном растворе лимонной кислоты или в воде, издавали сильный запах кислоты, который вызывал чувство дискомфорта у испытуемых.
После этого были приготовлены водные растворы различных органических кислот, чтобы установить, какие факторы ответственны за запах и вызванное введением препарата в носовую полость раздражение. Использовали следующие органические кислоты: уксусную, лимонную и винно-каменную кислоту, щавелевую, яблочную, фталевую, аскорбиновую, адипиновую и гликолевую кислоты.
Были приготовлены 0,1%, 0,2%, 0,3% и 0,4% водные растворы (об/об) уксусной кислоты и 0,6% водные растворы (вес/об) лимонной, винно-каменной, щавелевой, яблочной, фталевой, аскорбиновой, адипиновой и гликолевой кислоты. Эти растворы распыляли в носовую полость и оценивали запах и раздражение таким же образом, как описано выше (группа испытуемых состояла из 4 здоровых нормальных взрослых мужчин). Результаты представлены в табл.6. Как видно из табл.6, водные растворы уксусной кислоты в концентрации 0,3% и выше издавали сильный запах кислоты, а их раздражающее действие также быстро возрастало при повышении концентрации уксусной кислоты до 0,3% и выше.
С другой стороны, водные растворы других органических кислот не издавали ощутимого запаха, а раздражение, вызванное введением в носовую полость водных растворов лимонной кислоты, а также аскорбиновой, адипиновой и гликолевой кислоты, было таким же, как от физраствора.
Препарат hPTH(1-34) с содержанием уксусной кислоты в 9,5%, полученный в ссылочном примере 1, содержал приблизительно столько же уксусной кислоты, как и соответствующий раствор hPTH(1-34) и 0,1% водный раствор уксусной кислоты, использовавшийся в этом испытании.
Вышеприведенные результаты свидетельствуют, что, поскольку 0,6% водный раствор лимонной кислоты сам по себе не издает ощутимого запаха, то запах, издаваемый препаратом hPTH, растворенным в 0,6% водном растворе лимонной кислоты, можно приписать уксусной кислоте, находящейся в виде составной части соли hPTH(1-34) или примеси в препарате этой соли, даже если содержащаяся в препарате hPTH уксусная кислота не издает ощутимого запаха, когда она находится в водном растворе, то есть в сочетании с водой.
Препарат hPTH(1-34) с содержанием уксусной кислоты в 2,9%, полученный в примере 1(3), растворяли в 0,4% (вес/об) водном растворе лимонной кислоты в концентрации 5 мг/мл. Таким же образом, как описано выше, в носовую полость вводили тестируемый раствор и оценивали запах и вызванное этим раздражение (группа испытуемых состояла из 12 здоровых нормальных взрослых мужчин). Результаты представлены в табл.6. Как видно из табл.6, уменьшение содержания уксусной кислоты в препарате подавляет запах и раздражающее действие препарата, и, следовательно, препарат с пониженным содержанием уксусной кислоты является тем фармацевтическим компонентом, который обеспечит отличные ощущения при применении в составе фармацевтической композиции для практического применения.
Таблица 6.
Раздражающее действие и запах водных растворов hPTH(1-34) и различных органических кислот |
| hPTH/ органическая кислота |
Раздражающее действие |
Запах |
| hPTH(1-34)*1 |
++ |
Ощущается запах кислоты |
| hPTH(1-34)*2 |
+ |
Ощущается запах кислоты |
| Физиологический раствор |
4- |
Запах не ощущается |
| Уксусная кислота (0,6% водный раствор) |
+++ |
Ощущается запах кислоты |
| Уксусная кислота (0,3% водный раствор) |
+++ |
Ощущается запах кислоты |
| Уксусная кислота (0,2% водный раствор) |
+ |
Слегка ощущается запах кислоты |
| Уксусная кислота (0,1% водный раствор) |
+ |
Почти никакого запаха |
| Лимонная кислота (0,6% водный раствор) |
+ |
Запах не ощущается |
| Винно-каменная кислота (0,6% водный раствор) |
++++ |
Запах не ощущается |
| Щавелевая кислота (0,6% водный раствор) |
++++ |
Запах не ощущается |
| Яблочная кислота (0,6% водный раствор) |
++++ |
Запах не ощущается |
| Фталевая кислота (0,6% водный раствор) |
+++ |
Запах не ощущается |
| Аскорбиновая кислота (0,6% водный раствор) |
+ |
Запах не ощущается |
| Адипиновая кислота (0,6% водный раствор) |
+ |
Запах не ощущается |
| Гликолевая кислота (0,6% водный раствор) |
+ |
Запах не ощущается |
| hPTH(1-34)*3 |
+ |
Слегка ощущается запах кислоты |
| ++++: болезненное раздражение |
| +++: сильное раздражение |
| ++: слабое раздражение |
| +: очень слабое раздражение |
| *1: раствор 10 мг/мл hPTH(1-34) (содержание уксусной кислоты 9,5%) в 0,6% водном растворе лимонной кислоты |
| *2: раствор 10 мг/мл hPTH(1-34) (содержание уксусной кислоты 9.5%) в воде |
| *3 раствор 5 мг/мл hPTH(1-34) (содержание уксусной кислоты 2,9%) в 0,4% водном растворе лимонной кислоты |
Опыт 5. Сенсорный тест (2)
(1) Приготовление тестируемых растворов
Порцию препарата, соответствующую 300 мг hPTH(1-34), полученного в ссылочном примере 1, с содержанием уксусной кислоты около 9,5%, растворяли в дистиллированной воде (30 мл), получая водный раствор 10 мг/мл hPTH(1-34). Этот раствор (рН 4,7) подвергали электродиализу для удаления уксусной кислоты при помощи Micro Acilyzer (Asahi Kasei Corp.) с электродиализной мембраной AC-130-10 (Asahi Kasei Corp.), пока значение рН диализного раствора не достигало 5,0 (содержание уксусной кислоты 7,3%). Получали водный раствор hPTH(1-34) со значительно пониженным содержанием уксусной кислоты.
Другую порцию водного раствора hPTH(1-34) аналогичным образом подвергали электродиализу до тех пор, пока значение рН диализного раствора не достигало 6,0 (содержание уксусной кислоты 2,9%), получая водный раствор hPTH(1-34) со значительно пониженным содержанием уксусной кислоты. Еще одну порцию того же раствора подвергали аналогичной обработке, пока значение рН диализного раствора не достигало 7,6 (содержание уксусной кислоты 0,5%), получая водный раствор hPTH(1-34) с сильно пониженным содержанием уксусной кислоты.
(2) Сенсорный тест
К 1,5 мл каждого из тестируемых растворов, полученных в данном примере (1), добавляли 1,5 мл водного раствора, содержащего 270 мг очищенной сахарозы, 12 мг лимонной кислоты и 0,3 мг бензалконийхлорида, и использовали эту смесь в качестве тестируемого раствора для интраназального введения. Раствор переносили в стеклянный флакон с резьбой и пробкой и вставляли распылительную насадку (50 мкл) (Valois) для тестирования (группа испытуемых состояла из 5 здоровых нормальных взрослых мужчин). Запах оценивали как “А – почти не ощущается запах уксусной кислоты”, “В – ощущается слабый запах уксусной кислоты” и “С – ощущается сильный запах уксусной кислоты” Раздражение оценивали как “А – раздражение не ощущается”, “В – ощущается некоторое раздражение” и “С – ощущается сильное раздражение”. Затем ставили оценки по запаху и раздражению согласно этой классификации. Результаты представлены в табл.7.
Как видно из табл.7, уменьшение содержания уксусной кислоты в препарате подавляет запах и раздражающее действие препарата, следовательно, препарат с пониженным содержанием уксусной кислоты является тем фармацевтическим компонентом, который обеспечит отличные ощущения при применении и будет пригодным для продолжительного применения при включении его в фармацевтическую композицию для практического применения.
Таблица 7.
Сенсорный тест фармацевтических препаратов на основе hPTH(1-34), содержащих различное количество уксусной кислоты |
| Испытуемый |
Содерж. уксусной кислоты: 9,5% |
Содерж. уксусной кислоты: 7,3% |
Содерж. уксусной кислоты: 2,9% |
Содерж. уксусной кислоты: 0,5% |
| |
Запах |
Раздраж. действие |
Запах |
Раздраж. действие |
Запах |
Раздраж. действие |
Запах |
Раздраж. действие |
| 1 |
В |
В |
В |
В |
В |
В |
А |
А |
| 2 |
В |
В |
А |
В |
А |
В |
А |
В |
| 3 |
С |
В |
В |
А |
А |
А |
А |
А |
| 4 |
С |
В |
В |
А |
А |
А |
А |
А |
| 5 |
А |
В |
В |
А |
В |
А |
А |
А |
Запах
А: почти не ощущается запах уксусной кислоты
В: ощущается слабый запах уксусной кислоты
С: ощущается сильный запах уксусной кислоты
Раздражающее действие
А: раздражение не ощущается
В: ощущается некоторое раздражение
С: ощущается сильное раздражение
Опыт 6. Влияние различных органических кислот на стабильность препаратов hPTH
Удаление уксусной кислоты из препаратов hPTH может осуществляться не только с помощью электродиализа, как указано выше, но также путем замещения уксусной кислоты другой органической кислотой.
Исследовали, как повлияет включение новой органической кислоты на стабильность препаратов hPTH, если уксусная кислота в препарате hPTH(1-34) будет заменена другой органической кислотой.
В этом испытании использовали следующие органические кислоты: адипиновую, лимонную и гликолевую, которые известны как вещества, усиливающие всасывание, и которые при тестировании в опыте 4 давали хорошие ощущения при применении. Органические кислоты, добавление которых осуществлялось с целью замещения уксусной кислоты, связанной с hPTH, добавляли в концентрации, равной химическому эквиваленту уксусной кислоты. Молекула hPTH(1-34) содержит 9 остатков основных аминокислот и 4 остатка кислых аминокислот, то есть в молекуле hPTH(1-34) имеется 5 положительных зарядов, доступных для связывания с кислотой и образования соли. Так, при образовании соли 1 моль hPTH(1-34) (м.в. 4117,8) будет связывать 5/2 моль адипиновой кислоты (м.в. 146,14), 5/3 моль лимонной кислоты (м.в, 192,13) или 5 моль гликолевой кислоты (м.в. 75,05). Адипиновую, лимонную или гликолевую кислоты добавляли в тестируемые препараты hPTH таким образом, чтобы выполнялись соответствующие молярные пропорции, описанные выше.
Для получения водного раствора 5 мг/мл hPTH(1-34) использовали полученный в примере 1(3) препарат hPTH(1-34) с содержанием уксусной кислоты в 2,9%.
К 2 мл этого раствора (10 мг hPTH(1-34) или 2,43 мкмоль) добавляли 888 мкг адипиновой кислоты (2,43×5/2 мкмоль), 778 мкг лимонной кислоты (2,43×5/3 мкмоль) или 924 мкг гликолевой кислоты (2,43×5 мкмоль). Объем каждого раствора доводили дистиллированной водой таким образом, чтобы получить раствор, содержащий пептид в концентрации 1 мг/мл. Раствор лиофилизировали, получая лиофилизованный образец, содержащий 10 мг hPTH(1-34). Некоторые из полученных при этом образцов подвергали обращеннофазовой ВЭЖХ для определения чистоты hPTH перед хранением, а другие хранили при 60°С в течение 3 недель, после чего их также подвергали обращеннофазовой ВЭЖХ для определения чистоты hPTH после хранения; для оценки стабильности препарата hPTH сравнивали чистоту до и после хранения. В качестве контроля использовали препарат hPTH(1-34) с содержанием уксусной кислоты в 2,9%, полученный в примере 1(3). Результаты представлены в табл.8.
Чистота препарата hPTH(1-34) с содержанием уксусной кислоты в 2,9% составила 92,7% после хранения, тогда как чистота того же препарата с добавлением перед хранением адипиновой, лимонной или гликолевой кислоты составила после хранения 92,0, 93,9 и 90,3%, соответственно. Это значит, что фармацевтический компонент на основе hPTH с добавлением адипиновой, лимонной или гликолевой кислоты будет весьма стабильным и обеспечит хорошие ощущения при применении, как и фармацевтический компонент на основе hPTH с пониженным содержанием уксусной кислоты, находящейся в виде составной части соли hPTH или примеси.
Это также означает, что фармацевтический компонент, полученный при замещении уксусной кислоты, находящейся в препарате hPTH в виде составной части соли hPTH или примеси, определенной органической кислотой, может служить фармацевтическим компонентом наравне с препаратами hPTH с пониженным содержанием уксусной кислоты. Это также означает, что данный компонент, который весьма стабилен и обеспечивает отличные ощущения при применении в составе фармацевтической композиции, также обладает свойством совместимости с органическими кислотами, которые можно добавлять для улучшения всасывания этого компонента.
Таблица 8.
Влияние различных органических кислот на стабильность hPTH (хранение 3 недели при 60°С) |
| hPTH(1-34) |
Уксусная кислота |
Адипиновая кислота |
Лимонная кислота |
Гликолевая кислота |
| Содержание кислоты |
9,5% |
2,9% |
8,8% |
7,7% |
9,2% |
| Чистота до хранения (%) |
99,8% |
99,8% |
100,0% |
100,0% |
100,0% |
| Чистота после хранения(%) |
73,2% |
92,7% |
92,0% |
93,9% |
90,3% |
| *: содержание кислоты = вес кислоты × 100%/вес пептида hPTH |
Опыт 7. Тест на всасывание через слизистую носовой полости
При разработке фармацевтической композиции для интраназального введения на основе препарата важным фактором становится всасывание этого препарата через слизистую носовой полости. Ввиду этого исследовали всасывание препарата через слизистую носовой полости. Влияние лимонной и аскорбиновой кислоты, которые, как было показано в опыте 4, давали хорошие ощущения при применении при включении в препарат hPTH, на интраназальное всасывание hPTH оценивали путем определения площади под кривой (AUC) на графике зависимости концентрации hPTH в плазме крови от времени, а также биодоступности hPTH,
Препарат hPTH(1-34) с содержанием уксусной кислоты в 2,9%, полученный в примере 1(3), растворяли в 0,3 и 0,6% водных растворах аскорбиновой кислоты и в 0,2, 0,3, 0,4 и 0,6% водных растворах лимонной кислоты, получая растворы hPTH с концентрацией 5 мг/мл. Аналогичным образом препарат hPTH(1-34) с содержанием уксусной кислоты в 0,9%, полученный в примере 5(4), растворяли в 0,6% водном растворе лимонной кислоты, получая раствор пептида с концентрацией 10 мг/мл. В качестве контроля использовали препарат hPTH(1-34) с содержанием уксусной кислоты в 2,9%, полученный в примере 1(3), и препарат hPTH(1-34) с содержанием уксусной кислоты в 0,9%, полученный в примере 5(4), которые растворяли в физиологическом растворе.
Кроме того, препарат hPTH(1-34) с содержанием уксусной кислоты в 2,9%, полученный в примере 1(3), растворяли в 0,3% или 0,6% (вес/об) водных растворах лимонной кислоты, в эти растворы добавляли Camostat Mesylate до 0,3% (вес/об), который известен как ингибитор протеиназ, и полученные растворы использовали при тестировании.
Самцов крыс Sprague-Dawley (Crj:CD, Charles River Japan, Inc.) в возрасте 7-9 недель содержали в металлических клетках при 22±5°С и относительной влажности 30-70%, со сменой цикла день-ночь через 12 часов, со свободным доступом к пище в гранулах и водопроводной воде. За 24 часа до тестирования их лишали пищи (группа из 5 крыс).
При интраназальном введении крысам под пентобарбиталовым наркозом вставляли канюлю в бедренную артерию, а затем в носовую полость вводили 5 мкл тестируемого раствора или 10 мкл бензалконийхлорида с сахарозой с помощью пипетки Pipetman . Пробы крови собирали через канюлю в пробирки с антикоагулянтом и ингибитором протеиназ и центрифугировали, отбирая плазму. Концентрации hPTH(1-34) и hPTH(1-84) в плазме определяли методом радиоиммунного анализа с помощью антител против РТН(1-34) (Chemicon International Inc.). . Пробы крови собирали через канюлю в пробирки с антикоагулянтом и ингибитором протеиназ и центрифугировали, отбирая плазму. Концентрации hPTH(1-34) и hPTH(1-84) в плазме определяли методом радиоиммунного анализа с помощью антител против РТН(1-34) (Chemicon International Inc.).
При подкожном введении крысам делали инъекцию тестируемого раствора в дозе 1 мл/кг под кожу на спине и определяли концентрацию hPTH в плазме таким же образом, как при интраназальном введении.
Биодоступность hPTH(1-34) и hPTH(1-84) рассчитывали как соотношение между концентрацией в плазме через 3 часа (hPTH(1-34)) или 6 часов (hPTH(1-84)) после подкожного введения и соответствующим значением AUC на графике зависимости концентрации в плазме от времени. Результаты представлены в табл.9.
Хотя биодоступность hPTH(1-34) при подкожном введении составила 1,4%, когда вводили один hPTH(1-34), она возрастала до 5-10% или до 12-19%, когда hPTH(1-34) вводили в 0,3-0,6% растворе аскорбиновой кислоты или в 0,2-0,6% растворе лимонной кислоты.
Биодоступность hPTH(1-84) составила около 30%, когда его вводили в 0,6% водном растворе лимонной кислоты.
Более того, когда hPTH(1-34) вводили растворенным в растворе, содержащем Camostat Mesylate или ингибитор протеиназ, его биодоступность составила 27-31%.
Все это означает, что добавление органических кислот в небольшой концентрации заметно улучшает всасывание препаратов hPTH через слизистую носовой полости. При этом подтвердилось, что добавление этих усилителей всасывания еще больше улучшает интраназальное всасывание препаратов hPTH. В заключение отметим, что фармацевтическая композиция на основе hPTH, включающая фармацевтический компонент на основе hPTH, предназначенный для интраназального применения, можно использовать в этом качестве, так как этот фармацевтический компонент очень стабилен и обеспечивает отличные ощущения при применении при интраназальном введении, поскольку в нем намеренно было снижено содержание уксусной кислоты, находящейся в виде составной части соли или в виде примеси.
Таблица 9.
Интраназальное всасывание hPTH(1-34) и hPTH(1-84) у крыс |
| Состав препарата |
Доза |
Способ |
AUC |
Биодоступность |
| |
|
введения |
(пгхч/мл) |
(% от дозы) |
| hPTH(1-34) в физрастворе |
25 мкг/кг |
подкожно |
1356,5±503,4 |
(100) |
| hPTH(1-34) в физрастворе |
125 мкг/кг |
в нос |
93,7±61,3 |
1,4 |
| в 0,3% аскорбиновой к-те |
125 мкг/кг |
в нос |
357,4±308,3 |
5,2 |
| в 0,6% аскорбиновой к-те |
125 мкг/кг |
в нос |
687,3±281,9 |
9,9 |
| в 0,2% лимонной к-те |
125 мкг/кг |
в нос |
838,4±407,9 |
12,2 |
| в 0,3% лимонной к-те |
125 мкг/кг |
в нос |
1208,9±618,6 |
17,6 |
| в 0,4% лимонной к-те |
125 мкг/кг |
в нос |
1285,2±572,4 |
18,7 |
| в 0,6% лимонной к-те |
125 мкг/кг |
в нос |
1254,9±526,1 |
18,3 |
| в 0,3% лимонной к-те |
125 мкг/кг |
в нос |
2118,0±860,4 |
30,8 |
| + 0,3% Camostat |
|
|
|
|
| в 0,6% лимонной к-те |
125 мкг/кг |
в нос |
1829,4±1072,7 |
27,0 |
| + 0,3% Camostat |
|
|
|
|
| hPTH(1-84) в физрастворе |
285 мкг/кг |
подкожно |
46833,3±15667 |
(100) |
| hPTH(1-84) |
285 мкг/кг |
в нос |
14166,7±6833 |
30,2 |
| в 0,6% лимонной к-те |
|
|
|
|
Пример состава 1
40,5 г очищенной сахарозы (Japanese Pharmacopoeia) растворяли в 124,2 г очищенной воды (Japanese Pharmacopoeia) и получали 150 мл 27% водного раствора очищенной сахарозы. С другой стороны, порцию препарата, соответствующую 1,5 г hPTH(1-34) с содержанием уксусной кислоты в 2,1% (10 флаконов), полученного в примере 2, растворяли в 75 мл очищенной воды (Japanese Pharmacopoeia) в качестве фармацевтического компонента. Концентрация hPTH(1-34) в растворе составила 20,4 мг/мл по данным обращеннофазовой ВЭЖХ. К 72 мл раствора добавляли 25,9 мл очищенной воды, чтобы довести концентрацию hPTH(1-34) до 15 мг/мл. Отбирали 97 мл полученного раствора hPTH(1-34) с концентрацией 15 мг/мл и смешивали с 48,5 мл приготовленного ранее 27% раствора очищенной сахарозы, получая около 145 мл водного раствора hPTH(1-34) с концентрацией сахарозы 9% и концентрацией hPTH(1-34) 10 мг/мл. По 3 мл раствора вносили в каждый из 47 флаконов и лиофилизировали в лиофилизаторе модели FZ-6 (Labconco Corporation), получая стабильную фармацевтическую композицию, содержащую 270 мг очищенной сахарозы и 30 мг hPTH(1-34) на флакон.
Пример состава 2
40,5 г очищенной сахарозы (Japanese Pharmacopoeia) растворяли в 124,2 г очищенной воды (Japanese Pharmacopoeia) и получали 150 мл 27% водного раствора очищенной сахарозы. С другой стороны, в качестве фармацевтического компонента порцию препарата, соответствующую 750 мг hPTH(1-34) с содержанием уксусной кислоты в 2,1% (5 флаконов), полученного в примере 2, растворяли в 146 мл очищенной воды (Japanese Pharmacopoeia), получая водный раствор hPTH(1-34) с концентрацией hPTH(1-34) 5,1 мг/мл. Далее в этот водный раствор добавляли 54 мл очищенной воды (Japanese Pharmacopoeia) и тщательно перемешивали, чтобы довести концентрацию hPTH(1-34) до 3,8 мг/мл (200 мл). 200 мл полученного раствора hPTH(1-34) с концентрацией 3,8 мг/мл смешивали со 100 мл приготовленного ранее 27% раствора очищенной сахарозы, получая около 300 мл водного раствора hPTH(1-34) с концентрацией сахарозы 9% и концентрацией hPTH(1-34) 2,5 мг/мл. По 3 мл раствора вносили в каждый из 90 флаконов и лиофилизировали в лиофилизаторе модели FZ-6 (Labconco Corporation), получая стабильную фармацевтическую композицию, содержащую 270 мг очищенной сахарозы и 7,5 мг hPTH(1-34) на флакон.
Пример состава 3
22,5 г маннита (Japanese Pharmacopoeia) растворяли в 124,2 г очищенной воды (Japanese Pharmacopoeia) и получали 150 мл 15% водного раствора маннита. С другой стороны, порцию препарата, соответствующую 1,5 г hPTH(1-34) с содержанием уксусной кислоты в 2,1% (10 флаконов), полученного в примере 2, растворяли в 75 мл очищенной воды (Japanese Pharmacopoeia) в качестве фармацевтического компонента. Концентрация hPTH(1-34) в растворе составила 20,4 мг/мл по данным обращеннофазовой ВЭЖХ. К 72,0 мл раствора добавляли 25,9 мл очищенной воды, чтобы довести концентрацию hPTH(1-34) до 15 мг/мл. Отбирали 97 мл полученного раствора hPTH(1-34) с концентрацией 15 мг/мл и смешивали с 48,5 мл приготовленного ранее 15% водного раствора маннита, получая около 145 мл водного раствора hPTH(1-34) с концентрацией маннита 5% и концентрацией hPTH(1-34) 10 мг/мл. По 3 мл раствора вносили в каждый из 47 флаконов и лиофилизировали в лиофилизаторе модели FZ-6 (Labconco Corporation), получая стабильную фармацевтическую композицию, содержащую 150 мг маннита и 30 мг hPTH(1-34) на флакон.
Пример состава 4
В качестве фармацевтического компонента взвешивали 805 мг порошка лиофилизованного препарата hPTH(1-34) с содержанием уксусной кислоты в 2,1%, полученного в примере 2, и растворяли в 360 мл очищенной воды (Japanese Pharmacopoeia), получая водный раствор hPTH(1-34) в концентрации 2 мг/мл по данным обращеннофазовой ВЭЖХ. С другой стороны, взвешивали 1 г маннита (Japanese Pharmacopoeia) и растворяли в 50 мл очищенной воды (Japanese Pharmacopoeia), получая водный раствор маннита.
Все 50 мл водного раствора маннита смешивали с 50 мл приготовленного ранее водного раствора hPTH(1-34) (2 мг/мл) и хорошо перемешивали. В каждый из флаконов вносили по 1 мл раствора и лиофилизировали в лиофилизаторе модели FZ-6 (Labconco Corporation), получая стабильную лекарственную композицию, содержащую 1 мг hPTH(1-34) и 10 мг маннита на флакон.
Пример состава 5
В качестве фармацевтического компонента взвешивали 805 мг порошка лиофилизованного препарата hPTH(1-34) с содержанием уксусной кислоты в 2,1%, полученного в примере 2, и растворяли в 360 мл очищенной воды (Japanese Pharmacopoeia), получая водный раствор hPTH(1-34) в концентрации 2 мг/мл по данным обращеннофазовой ВЭЖХ. С другой стороны, взвешивали 5 г маннита (Japanese Pharmacopoeia) и растворяли в 50 мл очищенной воды (Japanese Pharmacopoeia), получая водный раствор маннита.
Все 50 мл водного раствора маннита смешивали с 50 мл приготовленного ранее водного раствора hPTH(1-34) (2 мг/мл) и хорошо перемешивали. В каждый из флаконов вносили по 1 мл раствора и лиофилизировали в лиофилизаторе модели FZ-6 (Labconco Corporation), получая стабильную лекарственную композицию, содержащую 1 мг hPTH(1-34) и 50 мг маннита на флакон.
Пример состава 6
В качестве фармацевтического компонента взвешивали 11 мг порошка лиофилизованного препарата hPTH(1-34) с содержанием уксусной кислоты в 2,1%, полученного в примере 2, и добавляли к нему воду для инъекций (ВДИ) (Japanese Pharmacopoeia) до объема 500 мл, получая водный раствор hPTH(1-34) в 20 мкг/мл по данным обращеннофазовой ВЭЖХ (раствор А). 5 г очищенной сахарозы (Japanese Pharmacopoeia) и 100 мг бензетонийхлорида растворяли в ВДИ (Japanese Pharmacopoeia) и доводили объем до 100 мл (раствор В). Смешивали по 30 мл растворов А и В. Полученный раствор разливали во флаконы по 1 мл на флакон и лиофилизировали в лиофилизаторе модели FZ-6 (Labconco Corporation), получая стабильную фармацевтическую композицию, содержащую 10 мкг hPTH(1-34), 25 мг очищенной сахарозы и 0,5 мг бензетонийхлорида на флакон.
Пример состава 7
В качестве фармацевтического компонента взвешивали 50 мг порошка лиофилизованного препарата hPTH(1-34) с содержанием уксусной кислоты в 2,5%, полученного в примере 5(2), и добавляли к нему растворитель для инъекций (Japanese Pharmacopoeia), получая водный раствор hPTH(1-84) в 2 мг/мл по данным обращеннофазовой ВЭЖХ (25 мл).
С другой стороны, к 2 г очищенной сахарозы (Japanese Pharmacopoeia) добавляли ВДИ (Japanese Pharmacopoeia), получая 100 мл водного раствора очищенной сахарозы. Смешивали 20 мл водного раствора hPTH(1-84) (2 мг/мл) с 20 мл приготовленного водного раствора (2% вес/об) очищенной сахарозы. Полученный раствор разливали в 35 флаконов по 1 мл на флакон и лиофилизировали в лиофилизаторе модели FZ-6 (Labconco Corporation), получая стабильную фармацевтическую композицию, содержащую 1 мг hPTH(1-84) и 10 мг очищенной сахарозы на флакон.
Пример состава 8
Прилагаемый растворитель для фармацевтических композиций, полученных в вышеприведенных композиционных примерах 1-7, который предназначается для растворения препаратов по мере необходимости, получали следующим образом.
Взвешивали 0,35 г бензалконийхлорида (Japanese Pharmacopoeia) и 21,0 г лимонной кислоты (Japanese Pharmacopoeia) и растворяли в 3500 мл очищенной воды. По 3 мл полученного раствора разливали в полипропиленовые флаконы, получая прилагаемый растворитель.
Пример состава 9
Прилагаемый растворитель для фармацевтических композиций, полученных в вышеприведенных композиционных примерах 1-7, который предназначается для растворения препаратов по мере необходимости, получали следующим образом.
Взвешивали 0,70 г бензэтонийхлорида (Japanese Pharmacopoeia) и 14,0 г лимонной кислоты (Japanese Pharmacopoeia) и растворяли в 3500 мл очищенной воды. По 3 мл полученного раствора разливали в полипропиленовые флаконы, получая прилагаемый растворитель.
Пример состава 10
Прилагаемый растворитель для фармацевтических композиций, полученных в вышеприведенных композиционных примерах 1-7, который предназначается для растворения препаратов по мере необходимости, получали следующим образом.
Взвешивали 0,35 г бензэтонийхлорида (Japanese Pharmacopoeia) и 21,0 г адипиновой кислоты (Japanese Pharmacopoeia) и растворяли в 3500 мл очищенной воды. По 3 мл полученного раствора разливали в полипропиленовые флаконы, получая прилагаемый растворитель.
Пример состава 11
Прилагаемый растворитель для фармацевтических композиций, полученных в вышеприведенных композиционных примерах 1-7, который предназначается для растворения препаратов по мере необходимости, получали следующим образом.
Взвешивали 0,70 г цетилпиридинийхлорида (Japanese Pharmacopoeia) и 14,0 г адипиновой кислоты (Japanese Pharmacopoeia) и растворяли в 3500 мл очищенной воды. По 3 мл полученного раствора разливали в полипропиленовые флаконы, получая прилагаемый растворитель.
Пример состава 12
В качестве фармацевтического компонента порцию препарата, соответствующую 900 мг hPTH(1-34) с содержанием кислоты в 2,5%, полученного в примере 4(1) (6 флаконов), растворяли в 18 мл ВДИ (Japanese Pharmacopoeia) (50 мг/мл). С другой стороны, 12 г лимонной кислоты (Japanese Pharmacopoeia) растворяли в растворителе для инъекций (Japanese Pharmacopoeia), получая 1000 мл 1,2% (вес/об) водного раствора лимонной кислоты. С помощью этих растворов получали жидкие медикаменты следующим образом.
1. Получение раствора 5 мг/мл hPTH(1-34), 0,6% (вес/об) лимонной кислоты, рН 3
Смешивали 6 мл 1,2% (вес/об) водного раствора лимонной кислоты и 1,2 мл водного раствора hPTH(1-34) с концентрацией 50 мг/мл и образовавшийся раствор доводили до рН 3 добавлением 95 мкл 1 N NaOH. Затем в раствор добавляли ВДИ до объема 12 мл. Полученный раствор фильтровали через фильтр с размером пор 0,22  м. получая указанную в заголовке фармацевтическую композицию. м. получая указанную в заголовке фармацевтическую композицию.
2. Получение раствора 5 мг/мл hPTH(1-34), 0,6% (вес/об) лимонной кислоты, рН 3,5
Смешивали 6 мл 1,2% (вес/об) водного раствора лимонной кислоты и 1,2 мл водного раствора hPTH(1-34) с концентрацией 50 мг/мл и образовавшийся раствор доводили до рН 3,5 добавлением 210 мкл 1 N NaOH. Затем в раствор добавляли ВДИ до объема 12 мл. Полученный раствор фильтровали через фильтр с размером пор 0,22  м, получая указанную в заголовке фармацевтическую композицию. м, получая указанную в заголовке фармацевтическую композицию.
3. Получение раствора 5 мг/мл hPTH(1-34), 0,6% (вес/об) лимонной кислоты, рН 4
Смешивали 6 мл 1,2% (вес/об) водного раствора лимонной кислоты и 1,2 мл водного раствора hPTH(1-34) с концентрацией 50 мг/мл и образовавшийся раствор доводили до рН 4,0 добавлением 350 мкл 1 N NaOH. Затем в раствор добавляли ВДИ до объема 12 мл. Полученный раствор фильтровали через фильтр с размером пор 0,22  м, получая указанную в заголовке фармацевтическую композицию. м, получая указанную в заголовке фармацевтическую композицию.
4. Получение раствора 5 мг/мл hPTH(1-34), 0,6% (вес/об) лимонной кислоты, РН 4,5
Смешивали 4 мл 1,2% (вес/об) водного раствора лимонной кислоты, 0,24 мл водного раствора hPTH(1-34) с концентрацией 50 мг/мл и 5 мл очищенной воды, и раствор доводили до рН 4,5 добавлением 335 мкл 1 N NaOH. Затем в раствор добавляли ВДИ до объема 12 мл. Полученный раствор фильтровали через фильтр с размером пор 0,22  м, получая указанную в заголовке фармацевтическую композицию. м, получая указанную в заголовке фармацевтическую композицию.
Промышленная применимость
Согласно настоящему изобретению, предусматривается фармацевтический компонент, который, обладая пониженным содержанием уксусной кислоты, очень стабилен и обеспечивает отличные ощущения при применении в составе фармацевтической композиции для применения.
Фармацевтический компонент настоящего изобретения обладает совместимостью с соответствующими количествами различных функциональных компонентов, а также с носителями и наполнителями, обычно применяемыми при изготовлении фармацевтических препаратов, и может быть включен в фармацевтические композиции самых разных дозовых форм, либо может сам образовывать разнообразные дозовые формы.
Согласно настоящему изобретению, предусматривается фармацевтическая композиция для интраназального введения, которая может применяться в течение длительного времени.

Формула изобретения
1. Высокостабильный фармацевтический компонент, включающий пептид паратиреоидного гормона человека или его производное и уксусную кислоту, содержащуюся в количестве, меньшем ее химического эквивалента по отношению к пептиду паратиреоидного гормона человека или его производному.
2. Фармацевтический компонент по п.1, включающий соль паратиреоидного гормона человека или его производного с уксусной кислотой, в которой уксусная кислота содержится в количестве, меньшем ее химического эквивалента по отношению к пептиду паратиреоидного гормона человека или его производному.
3. Фармацевтический компонент по п.1 или 2, в котором, если пептид паратиреоидного гормона человека или его производное представлены пептидом, состоящим из аминокислотных остатков, обозначаемых как аминокислоты №1-84, то фармацевтический компонент содержит 3% или меньше уксусной кислоты по отношению к весу пептида, а если пептид паратиреоидного гормона человека или его производное представлены пептидом, состоящим из аминокислотных остатков, обозначаемых как аминокислоты №1-34, то фармацевтический компонент содержит 6% или меньше уксусной кислоты по отношению к весу пептида, а также сам пептид.
4. Фармацевтический компонент по пп.1-3, в котором, если пептид паратиреоидного гормона человека или его производное представлены пептидом, состоящим из аминокислотных остатков, обозначаемых как аминокислоты №1-34, то фармацевтический компонент содержит 4% или меньше уксусной кислоты по отношению к весу пептида, а также сам пептид.
5. Фармацевтический компонент по любому из пп.1-4, в котором фармацевтический компонент представляет собой лиофилизованную композицию.
6. Фармацевтический компонент по любому из пп.1-5, в котором фармацевтический компонент предназначен для интраназального введения.
7. Фармацевтическая композиция для интраназального введения, включающая пептид паратиреоидного гормона человека или его производное в качестве активного ингредиента и фармацевтически приемлемый носитель или наполнитель, отличающаяся тем, что фармацевтическая композиция включает фармацевтический компонент по любому из пп.1-6.
8. Фармацевтический продукт в растворимой по требованию форме, состоящий из лиофилизованной части и прилагаемой к ней растворяющей части (растворителя), причем фармацевтический компонент по любому из пп.1-6 содержится в лиофилизованной части.
РИСУНКИ
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Асубио Фарма Ко., Лтд. (JP)
Адрес для переписки:
103735, Москва, ул. Ильинка, 5/2, ООО «Союзпатент»
Извещение опубликовано: 10.10.2008 БИ: 28/2008
|
|