|
|
(21), (22) Заявка: 2001133343/15, 10.05.2000
(24) Дата начала отсчета срока действия патента:
10.05.2000
(30) Конвенционный приоритет:
14.05.1999 DK PA1999 00668
20.10.1999 DK PA1999 01508
(43) Дата публикации заявки: 27.08.2003
(46) Опубликовано: 27.01.2007
(56) Список документов, цитированных в отчете о
поиске:
МА Y., SHIDA Н., KAWASAKI Т. Functional expression of human mannan-binding proteins (MBPs) in human hepatoma cell lines infected by recombinant vaccinia virus: post translational modification, molecular assembly, and differentiation serum and liver MBP., J. Biochem (Tokyo), 1997, oct, 122(4), pp.810-818. МА YOLG et al., Antitumor activity of
(85) Дата перевода заявки PCT на национальную фазу:
14.12.2001
(86) Заявка PCT:
DK 00/00246 (10.05.2000)
(87) Публикация PCT:
WO 00/70043 (23.11.2000)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
ТИЭЛЬ Стеффен (DK),
ДЖЕНСЕНИУС Дженс Христиан (DK),
ДЖЕНСЕН Томас Воруп (DK)
(73) Патентообладатель(и):
ТИЭЛЬ Стеффен (DK),
ДЖЕНСЕНИУС Дженс Христиан (DK),
ДЖЕНСЕН Томас Воруп (DK)
|
(54) РЕКОМБИНАНТНЫЙ МАННАН-СВЯЗЫВАЮЩИЙ ЛЕКТИН ЧЕЛОВЕКА
(57) Реферат:
Изобретение относится к способу приготовления состава, включающего маннан-связывающий лектин, и к лечению состояний, связанных с дефицитом маннан-связывающего пектина, что связано с повышенной предрасположенностью к инфекциям. Изобретение также относится к приготовлению новой структуры экспрессии, кодирующей маннан-связывающий лектин человека, и новому рекомбинантному способу приготовления маннан-связывающего лектина человека. Преимущество изобретения заключается в разработке способа получения нового рекомбинантного маннан-связывающего лектина человека. 8 н. и 39 з.п. ф-лы, 5 ил.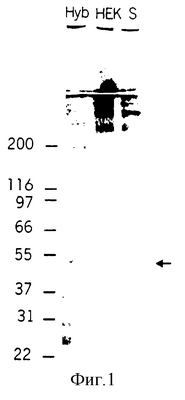
(56) (продолжение):
CLASS=”b560m”mannan-binding protein in vivo as revealed by a virus expression-system: mannan binding protein dependent cell-mediated cytotoxicity. Proc. of Natl. Academy of Sciences of USA, 1999 (19 January), v.96, №2, pp.371-375. KURATA HIROSHI et al., Structure and function of mannan-binding proteins isolated from human liver and serum, J. Biochem (Tokyo), 1994, v.115(6), pp.1148-1154.
Настоящее изобретение относится к способу приготовления композиции/смеси/состава, включающей маннан-связывающий лектин, и к лечению болезней и расстройств иммунной системы, включающему лечение состояний, связанных со снижением иммунитета. В частности, настоящее изобретение относится к лечению состояний или латентных состояний, связанных с дефицитом маннан-связывающего лектина, что связано с повышенной предрасположенностью к инфицированию. Настоящее изобретение также относится к приготовлению/созданию новой конструкции для экспрессии гена, кодирующего маннан-связывающий лектин человека, новому рекомбинантному способу приготовления маннан-связывающего лектина человека и, кроме того, к применению этого соединения в способах лечения состояний, относящихся к иммуноподавляющей химиотерапии, и/или состояний, связанных с дефицитом маннан-связывающего лектина, включая латентные состояния, т.е. те, которые не проявляются в настоящем времени. Такое лечение применяется к людям и к животным, у которых иммунная система функционирует так же, как и иммунная система человека.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Иммунная система включает множество клеточных и молекулярных механизмов, которые распознают и атакуют патогенный микроорганизм или инфицированные им клетки. Недавно к маннан-связывающему лектину стали проявлять большой интерес как к важной части врожденной иммунной системы, которая является иммунной системой, уже функционирующей в момент рождения, в противоположность адаптивной иммунной защите, которая формируется/начинает активно функционировать только во время раннего детства (Janeway и др., 1999 г.). После связывания углеводородов на поверхности микробов маннан-связывающий пектин стимулирует активацию комплемента, запускающего ферментативный каскад, который в результате наносит метки на цель для разрушения фагоцитозом или лизисом микроорганизма (Law и Reid. 1995 г.). Система комплемента активируется посредством, по крайней мере, трех отдельных путей, представляющих классический путь, альтернативный путь и путь маннан-связывающего лектина (Janeway и др., 1999 г.). Классический путь включается, когда фактор комплемента (С1) распознает поверхностно-связанный иммуноглобулин. Комплекс С1 состоит из двух протеолитических ферментов С1r и С1s и неферментативной части C1q, которая содержит распознающие иммуноглобулин домены. В электронный микроскоп видно, что структуры обеих молекул, как C1q, так и маннан-связывающего лектина, напоминают букет. Так же, как и C1q, маннан-связывающий лектин находится в составе комплекса с двумя протеолитическими ферментами – протеазами. ассоциированными (связанными) с маннан-связывающим лектином. Все три пути воспроизводят конвертазу фактора комплемента 3 (С3 конвертаза), связанного с активирующей поверхностью целевого патогенного микроба. Превращение С3 в поверхностно-связанный С3b является основным в процессе уничтожения патогенных микробов путем фагоцитоза или лизиса (Janeway и др., 1999 г.).
Маннан-связывающий лектин, известный также как маннан-связывающий белок или манноза-связывающий белок, впервые был идентифицирован у кроликов (Kawasaki и др., 1978 г.). Маннан-связывающий лектин принадлежит к группе растворимых Са2+-зависимых (типа С) пектинов, содержащих С-концевой домен распознавания углеводорода и коплагеноподобную область, характеризуемую повторением тройных звеньев глицина (Gly), за которыми следуют две неглициновые аминокислоты. Таким образом, маннан-связывающий лектин принадлежит к группе коллектинов. т.е. лектинам типа С с коллагеноподобными областями, которые дополнительно содержат поверхностно-активные белки легких А и D, а также конглютинин и CL-43, которые, однако, были идентифицированы только у крупного рогатого скота (Holmskov и др., 1994 г.). Белок маннан-связывающего лектина человека состоит из идентичных полипептидных цепей молекулярной массой по 32 кДа каждая, общим числом до 18 (Lu и др., 1990 г.). в состав каждой из которых входит короткий N-концевой сегмент из 21 аминокислоты, включая три остатка цистеина, за которыми следует 7 повторов коллагенового звена Gly-X-Y, прерванных остатками Gln, за которыми следуют другие повторы из 12 звеньев Gly-X-Y. Маленькая область из 34 остатков соединяет С-концевой домен Са2+-зависимого лектина из 93 аминокислот с коллагеновой частью молекулы (Sastry и др., 1989 г.). Эти цепи из белка маннан-связывающего лектина объединяются в субъединицу маннан-связывающего лектина. Маннан-связывающий лектин состоит из ветвей, включающих субъединицы маннан-связывающего лектина, объединенных в основании букета, при этом длина ветвей достигает 15 нм, а их число доходит до шести. Позже маннан-связывающий лектин был идентифицирован у грызунов (Mizono и др., 1981 г., Oka и др., 1985 г.), у крупного рогатого скота (Holmskov и др., 1993 г., Kawai и др., 1997 г.) и у цыплят (Oka и др., 1985 г., Laursen и др., 1995 г., Lamsen и др., 1998 г.). У грызунов (Drickamer и др., 1986 г.) и у макак резус (Mgues и др., 1996 г.) были идентифицированы два типа генов маннан-связывающего лектина, обычно обозначаемых в виде А и С. У крыс был обнаружен псевдоген «В» маннан-связывающего лектина (Drickamer и др., 1986 г.), а недавно псевдоген маннан-связывающего лектина был также клонирован из генома человека, в результате анализа последовательности был сделан вывод о том, что это остатки гена А маннан-связывающего лектина приматов (Guo и др., 1998 г.). Маннан-связывающий лектин человека был идентифицирован Kawasaki и др. в 1983 г. Был идентифицирован только один ген маннан-связывающего лектина человека, в состав которого входило четыре экзона с тремя промежуточными интронами гена маннан-связывающего лектина, охватывающего приблизительно 6 kb, который расположен в области 10q11.2-q21 (Sastry и др., 1989 г., Taylor и др., 1989 г.).
Коллагеновые области трех полипептидных цепей образуют субъединицу. которая ковалентно стабилизирована дисульфидными мостиковыми связями. Отдельные субъединицы объединяются с помощью дисульфидных мостиковых связей, а также с помощью нековалентных взаимосвязей (Lu и др., 1990 г.).
Положение этих дисульфидных мостиковых связей не совсем определено. Анализ методом SDS-PAGE в среде маннан-связывающего лектина, не обладающей восстановительной способностью, выявил связки с молекулярной массой более 200 кДа. предположительно представленные блоками из 3, 4, 5 и даже 6 объединенных субъединиц (Lu и др., 1990 г.).
Действительное число субъединиц в естественном белке маннан-связывающего лектина человека остается спорным. Авторы Lipscombe и др. в 1995 г. с помощью ультрацентрифугирования получили данные, из которых можно предположить, что 25% маннан-связывающего лектина сыворотки человека образуют связки, состоящие из 2-3 субъединиц и только малая доля из них достигает 6 субъединиц. Относительный количественный анализ был выполнен денситометрией вестерн-блотов. полученных хемилюминистцентным способом. Более низкая эффективность, получаемая при передаче белка большой молекулярной массы на мембраны, в сравнении с белками меньшей молекулярной массы усложняла анализ с помощью данной методологии. Авторы Lu и др. в 1990 г. с помощью анализа фракций ионообменной хроматографии методом SDS-PAGE обнаружили, что преобладающие виды цепей ковалентно связанных суьединиц маннан-связывающего лектина состояли из тетрамеров, в то время как комплемент активировали только пентамерные или гексамерные комплексы. В противоположность этому анализ методом гельпроникающей хроматографии показал, что размер маннан-связывающего лектина сравним с размером комплекса С1. Анализ методом гельпроникающей хроматографии может выполняться при условиях, позволяющих изучение важности слабых взаимодействий белка с белком при образовании молекул маннан-связывающего лектина и в комбинации со стандартным анализом маннан-связывающего лектина, также позволяет беспристрастно определить содержания маннан-связывающего лектина во фракциях гельпроникающей хроматографии.
Очевидно, что ин-виво маннан-связывающий лектин по отношению к врожденной иммунной системе выполняет роль гуморального фактора, стимулирующего некоторую антимикробную активность, для которой не нужно формирование, способствующее само/несаморазличению, как у адаптивной системы иммунной защиты, основанной на распознавании Т- и В-клеток (Janeway и др., 1999 г, Vorup-Jensen и др., 1998 г). Распознавание целей для связывания маннан-связывающего лектина происходит посредством домена лектина типа С. Кальций-зависимые домены типа С были обнаружены в белках, широко распространенных как при филогенезе, так и при дальнейшем функционировании. В случае с маннан-связывающим лектином кальций-зависимый домен распознает преимущественно гексозы с экваториальными группами 3-и 4-ОН, например, маннозный глюкозамин и N-ацетилглюкозамин, в то время как углеводороды, которые не выполняют это требование, например, галактоза и D-фукоза, остаются несвязанными (Weis и др., 1992 г.).
Терминальные кальций-зависимые домены распределены таким образом, чтобы позволить связывание целевых поверхностей всех трех доменов, представляющих связывающие сайты (участки) со спейсерной областью около 53 Å (Sheriff и др., 1994 г., Weis и Drickamer, 1994 г.). Это свойство “распознавания образов” может в дальнейшем внести свой вклад в избирательное связывание поверхностей микробов. Избирательность/селективность углеводорода является действительно важным аспектом само/несаморазличения посредством маннан-связывающего лектина и, возможно, опосредована разницей в преобладании N-ацетилглюкозамина на поверхностях микробов, одним из примеров которого является высокое содержание маннозы в стенке клетки дрожжей типа Saccharomyces ceravisiae и Candida albicans. Углеводородные структуры при гликолизировании белков млекопитающих обычно завершаются сиаловой кислотой, которая предотвращает связывание маннан-связывающего лектина с этими олигомерными углеводородами и, таким образом, препятствуют распознаванию «своих» поверхностей маннан-связывающим лектином. Также трехмерная структура каждой субъединицы маннан-связывающего лектина может быть очень важна для распознавания цели.
Структура и биосинтез маннан-связывающего лектина исследовались с использованием ин витро систем синтеза. Структура кальций-зависимого домена маннан-связывающего лектина А крысы определялась с помощью кристаллизации рекомбинантного белка, вырабатываемого бактериями Е.coli. (Weis и др., 1992 г.), а структура маннан-связывающего лектина С крысы определялась с помощью рекомбинантного материала (Ng и др., 1996 г.). В более поздних исследованиях кристаллическая структура тримера кальций-зависимых доменов собиралась с помощью экспрессии как области «шейки», так и кальций-зависимого домена, что подтвердило результаты более ранних исследований, в соответствии с которыми область «шейки» образуется в результате сведения вместе трех цепей с помощью водородных связей между скрученными  -спиралями (Sheriff и др., 1994 г., Weis и Drickamer, 1994 г.). Кальций-зависимые домены и фрагменты кальций-зависимого домена области «шейки» других коллектинов также были экспресированны в системах на основе бактерий Е.coli. без требования усилить функциональную активность. Таким образом, ин-витро синтез доменов маннан-связывающего лектина может относиться как к функциональным свойствам распознавания углеводорода, так и структурным свойствам тримеризации, эффективно осуществляемой в прокариотных или простых эукариотных системах экспрессии. -спиралями (Sheriff и др., 1994 г., Weis и Drickamer, 1994 г.). Кальций-зависимые домены и фрагменты кальций-зависимого домена области «шейки» других коллектинов также были экспресированны в системах на основе бактерий Е.coli. без требования усилить функциональную активность. Таким образом, ин-витро синтез доменов маннан-связывающего лектина может относиться как к функциональным свойствам распознавания углеводорода, так и структурным свойствам тримеризации, эффективно осуществляемой в прокариотных или простых эукариотных системах экспрессии.
Ин-витро синтез полных коллектинов с помощью рекомбинантной методики был предпринят в основном с использованием клеточных линий млекопитающих, например, клеток яичника китайского хомячка или COS-клеток, в качестве клеток хозяина. Попытки экспрессировать маннан-связывающий пектин в клетках насекомых приводили к получению маннан-связывающего лектина малой молекулярной массы (Ма и др., 1996 г.), при этом рекомбинантные белки почти полностью состояли из субъединиц, димеров и тримеров цепи субъединиц маннан-связывающего лектина.
Было выполнено несколько исследований рекомбинантного синтеза маннан-связывающего лектина человека в клеточных линиях млекопитающих. В исследованиях опсонических функций, т.е. способности улучшать уровень поглощения с помощью макрофагов маннан-связывающего лектина, авторы Kuhlman и др. в 1989 г. использовали рекомбинантный маннан-связывающий лектин, полученный в клетках яичника китайского хомячка, который продемонстрировал такую же опсоническую активность, как и естественный маннан-связывающий лектин. Идентификация структуры и посттрансляционных модификаций рекомбинантного маннан-связывающего лектина не проводилась. Точно также авторы Schweinie и др. в 1993 г. путем стабильной трансфекции клеток яичника китайского хомячка получили рекомбинантный маннан-связывающий лектин и его укороченную форму без коллагенового хвоста. Активность рекомбинантных белков измерялась осаждением С3 на Salmonella montevideo, предварительно выдерживаемых с маннан-связывающим лектином и разведенных сывороткой человека, обедненной антителами против Salmonella montevideo как источника комплемента. Неожиданно активность рекомбинантного полноразмерного маннан-связывающего лектина оказалась такой же высокой, как и активность природного маннан-связывающего лектина, хотя анализ иодированного рекомбинантного маннан-связывающего лектина с применением ультрацентрифугирования показал, что у большей части белка молекулярная масса была небольшой. Не проводилось сравнение размера рекомбинантного маннан-связывающего лектина, полученного из клеток яичника китайского хомячка с размером природного маннан-связывающего лектина, ни методом SDS-PAGE, ни ультрацентрифугированием, ни гельпроникающей хроматографией. При исследовании авторов Super и др. в 1992 г. клеток гибридомы мыши Sp2/0Ag14 были получены профили гельтпроникающей хроматографии рекомбинантного маннан-связывающего лектина, с помощью которых было показано, что распределение размеров молекул рекомбинантного маннан-связывающего лектина, очищенного от супернатанта культуры с помощью углеводородной аффинной хроматографии, значительно отличалось от распределения размеров молекул рекомбинантного маннан-связывающего лектина, выделенного с помощью аффинной хроматографии на основе антител против маннан-связывающего лектина.
В 1999 г. авторы Ohtani и др. опубликовали данные по рекомбинантному маннан-связывающему лектину, полученному в клетках яичника китайского хомячка, выход которого составил 120 мкг на 1 мл культуральной среды. Результаты были получены с использованием вектора экспрессии, предусматривающего отбор трансфектантов по G418 резистентности и дальнейшей амплификации гена посредством селекции сульфоксимином метионина. Функциональная активность по углеводородной селективности была идентична активности природного белка, однако измерения путем лизиса эритроцитов показали некоторые различия в способности активировать комплемент. Оба метода, как гельпроникающая хроматография, так и метод SDS-PAGE показали наличие форм маннан-связывающего лектина с большей молекулярной массой, хотя, как отметили авторы, наблюдалось слишком большое (огромное, тотальное) расхождение размеров в сравнении с маннан-связывающим лектином, очищенным от плазмы. Интересно, что механизм гидроксилирования существенным образом был схож с профилем гидроксилирования природного маннан-связывающего лектина даже в отсутствие добавки аскорбиновой кислоты. Что касается пост-трансляционных модификаций, то следует отметить, что исследования гидроксилирования свойственного рекомбинантному маннан-связывающему лектину не подтверждает подобность (схожесть) его структуры со структурой природного маннан-связывающего лектина.
Локус маннан-связывающего лектина человека полиморфен и имеет три известные мутации, расположенные в области кодирования белка (Sumia и др., 1991 г., Lipscombe и др., 1992а, 1992b, Madsen и др., 1994 г.) и другие влияющие на регуляцию элементы гена (Madsen и др., 1994 г.). Очевидно, что все мутации приводят к существенно более низкому уровню содержания маннан-связывающего лектина в жидкостях тела у пораженных болезнью млекопитающих. Таким образом, по результатам измерений разброс содержания маннан-связывающего лектина составляет около трех порядков от 2-5 мкг маннан-связывающего лектина на 1 мл менее до 10 нг маннан-связывающего лектина на 1 мл у гомозиготных млекопитающих, подверженных мутациям, влияющим на области кодирования белка. Экспериментальные данные по дефициту маннан-связывающего лектина, связанные с рецидивными инфекциями у детей, которые диагностировались как страдающие опсоническим дефектом (Super и др., 1989 г., Sumia и др., 1991 г.), продемонстрировали наличие корреляции между уровнями дефицита маннан-связывающего лектина и снижением защиты от микроорганизмов. Дополнительно было получено подтверждение того, что при взаимодействии с микроорганизмами коллектины стимулируют антивирусную защиту (Hartshorn и др., 1993 г., Malhotra и др., 1994 г.). Ин-витро исследования по взаимодействию с вирусом иммунодефицита человека показали, что маннан-связывающий лектин подавляет инфекцию Т-положительных клеток CD4 и клеток U937. Клинические исследования также подтвердили, что маннан-связывающий лектин играет роль защиты первой линии против вируса иммунодефицита человека. Период времени от начала проявления симптомов СПИДа до заключительной стадии у пациентов с дефицитом маннан-связывающего лектина отличается от периода времени, характерного для пациентов с нормальным уровнем содержания маннан-связывающего лектина. Также очевидно, что подверженность заражению инфекциями значительно выше среди индивидуумов с дефицитом маннан-связывающего лектина, так как дефицит маннан-связывающего лектина присутствует чаще у пациентов, инфицированных вирусом иммунодефицита человека, чем у здоровых пациентов контрольной группы (Neilsen и др., 1995 г., Garred и др., 1997 а). Как было показано для случаев дефицита С1, С2 и С4 (анализ авторов Tan и Amett. 1998 г.) в развитие системной красной волчанки вносит свой вклад наследственный дефицит комплемента. По результатам некоторых исследований было получено подтверждение того, что при развитии системной красной волчанки дефицит маннан-связывающего лектина также является фактором риска (Davies и др., 1995, Lau и др. 1996 г., Ip и др., 1998 г.), хотя роль маннан-связывающего лектина не совсем определена. В соответствии с одним предположением, следующим за объяснениями других дефицитов комплемента как причинных для системной красной волчанки, дефект связывания комплемента, вызванный дефицитом маннан-связывающего лектина, приводит к приводит к низкоэффективной работе иммунного комплекса (Ip и др., 1998 г.), что указывает на маннан-связывающий лектин как на участника в поддержании гомеостаза. В соответствии с другими данными клинических исследований маннан-связывающий лектин играет важную роль в репродуктивной биологии. Как показали последние отчеты, существует связь между рецидивными выкидышами и уровнем содержания маннан-связывающего лектина (Kilpatric и др., 1995 г., Christiansen и др., 1999 г.).
Стратегия лечения млекопитающих с симптоматикой дефицита маннан-связывающего лектина, направленная на восстановление пути маннан-связывающего лектина, описана только в двух исследования. Опсонический дефект, наблюдаемый у некоторых детей только во время клинического проявления частых инфекций, лечился введением плазмы (Soothill и Harvey, 1976 г.), в то время как в более поздних исследованиях двухлетней девочке был введен маннан-связывающий лектин, полученный из плазмы (Valdimarsson и др., 1998 г.). В обоих исследованиях было отмечено улучшение здоровья, хотя небольшое число пациентов, принимавших участие в этих исследованиях, не позволяет рассматривать маннан-связывающем лектин как терапевтический агент. Не проводились клинические исследования с рекомбинантным маннан-связывающим лектином. Исследования авторов Ма и др. в 1999 г. показали противоопухолевую активность рекомбинантного маннан-связывающего лектина у мышей, стимулированную системой экспрессии вируса.
Из вышесказанного очевидно, что были попытки получения в ин-витро системах рекомбинантного маннан-связывающего лектина либо в форме идентичного природному белка, либо в форме обладающей высокой степенью сходства (сродства) с ним было предпринято несколько попыток. Однако получение такого рекомбинантного маннан-связывающего лектина в известных в настоящее время ин-витро системах синтеза натолкнулось на существенные ограничения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения предусмотрена новая форма маннан-связывающего лектина, который приготовляется по технологии рекомбинантной ДНК ин-витро или ин-виво. Более конкретно настоящее изобретение относится к рекомбинантному маннан-связывающему лектину в новой форме, открытой авторами изобретения при синтезе в соответствии со следующим способом.
Способ получения состава рекомбинантного маннан-связывающего лектина человека с таким профилем распределением размеров молекул, при котором не менее чем 50% идентичны профилю распределения размеров молекул естественного маннан-связывающего лектина человека, включающий:
– создание конструкции для экспрессии гена, кодирующего пептид маннан-связывающего лектина человека или его функциональный эквивалент;
– трансформацию культуры клетки-хозяина с помощью этой конструкции;
– культивирование культуры клетки-хозяина, получая с выделением полипептида в культуральную среду,
– афинную хроматографию указанной культуральной среды с использованием матрицы, полученной из углеводорода, при этом сродство данной матрицы с тетрамерами, пентамерами и/или гексамерами субъединицы маннан-связывающего лектина, по крайней мере, в два раза больше, чем с димерами субъединицы маннан-связывающего лектина;
– получение элюата, содержащего состав рекомбинантного маннан-связывающего лектина человека.
Под функциональным эквивалентом маннан-связывающего лектина человека понимается молекула, выполняющая функцию маннан-связывающего лектина человека, например, связывание с углеводородами микробов, стимулирование опсонизирующей активности и/или активация комплемента, что можно продемонстрировать осаждением С4 на поверхности, покрытой маннаном.
Функциональная активность маннан-связывающего лектина может быть оценена по его способности образовывать комплексы (маннан-связывающий лектин)/МА8Р, приводящие к активации системы комплементов. При расщеплении комплемента С4 комплексом (маннан-связывающий лектин)/MASP выделяется эфир тиола и комплемент С4 образует ковалентную связь с ближайшими нуклеофильными группами. Значительная часть комплемента С4b образует связи с лункой, покрытой пластиком, и может быть обнаружена антителом против комплемента С4.
Количественный анализ TRIFMA, используемый для определения функциональной активности маннан-связывающего лектина, включает следующие этапы: 1) нанесение слоя маннана на микротитровальные лунки из расчета 1 мг маннана на 100 мл буферного раствора; 2) блокировка с помощью Tween-20: 3) нанесение образцов, например, препаратов из разбавленного раствора маннан-связывающего лектина; 4) нанесение сыворотки с дефицитом маннан-связывающего лектина (это приводит к образованию комплекса (маннан-связывающий лектин)/MASP); в другом случае перед нанесением на поверхность микротитровальных лунок маннан-связывающий пектин и сыворотка с дефицитом маннан-связывающего лектина могут смешиваться; 5) нанесение фактора комплемента С4 концентрацией 5 мг/мл; 6) выдержка в течение одного часа при 37°С: 7) нанесение антитела против комплемента С4, меченного Eu: 8) нанесение усиливающего раствора; 9) считывание Eu с помощью временного флуоресцентного анализатора. Между каждыми двумя этапами пластина выдерживается при комнатной температуре и промывается за исключением этапов 8 и 9.
Оценка с помощью метода ELISA может быть выполнена таким же образом, например, путем нанесения меченного биотином антикомплемента С4 на этапе 7; 8) нанесения авидина, меченного щелочной фосфатазой; 9) нанесения субстрата; 10) считывания интенсивности цветов. Калибровочная кривая может быть выстроена с использованием разведении, взятых из одной нормальной плазмы. В настоящем изобретении в качестве примера используется сыворотка plasma pool (плазма пул) LJ 6,57 28/04/97. Функциональность может быть выражена в качестве специфической активности маннан-связывающего лектина, такой как единицы активности маннан-связывающего лектина на 1 нг маннан-связывающего лектина.
Другим критерием функционального эквивалента маннан-связывающего лектина является способность образовывать на клетках связи с рецептором/рецепторами.
Взаимодействие маннан-связывающего лектина с рецептором (рецепторами) на клетках можно проанализировать с помощью цитофлюорометрии. 1) Маннан-связывающий лектин при концентрации 50 мкм/мл выдерживается с 2×105 клетками. Связывание осуществляется в забуференном фосфатном соляном растворе, содержащем 1% FCS и 0,1% азида натрия. 2) Для обнаружения связанного клеткой маннан-связывающею лектина применяется биотинилированное антитело против маннан-связывающего лектина. 3) После этого добавляется стрепавидин-ПТС и 4) полученная смесь исследуется с помощью флуоресцентного анализа.
Функциональный эквивалент по настоящему изобретению соответствует хотя бы одному из критериев, рассмотренных выше, например, либо активации С4, либо взаимодействию с рецептором/рецепторами на клетках соответственно. В предпочтительном варианте изобретения выполняются оба критерия.
Под «рекомбинантным маннан-связывающим лектином человека» понимается маннан-связывающий лектин человека, который экспрессируют из созданных генной инженерией нуклеиновых кислот, а под иными конструкциями для экспрессии гена маннан-связывающего лектина» понимается вектор экспрессии, подходящий для экспрессии в клетках хозяина.
Под термином «состав с таким профилем распределения размеров молекул, при котором не менее 50% идентично профилю распределения размеров молекул естественного маннан-связывающего лектина человека» понимается, что в соответствии с анализом SDS-PAGE распределение размеров молекул различных олигомеров маннан-связывающего лектина на 50% идентично распределению размеров молекул естественного маннан-связывающего лектина человека, очищенного от плазмы с использованием углеводородной аффинной хроматографии. Под идентичностью 50% понимается, что средняя молекулярная масса хотя бы 50% олигомеров, полученная с помощью метода SDS-PAGE и/или с помощью вестерн-блоттинга, превышает 200 кДа. При определении количества маннан-связывающего лектина средней молекулярной массой, превышающей 200 кДа, может применяться денситометрия. в которой на геле SDS-PAGE окрашиваются полосы белка, например, серебром или Coomassie Blue (кумассией бриллиантово голубой), или происходит специфическое окрашивание вестерн-блотов с использованием антитела, специфического для маннан-связывающего лектина.
Под термином «очищенный рекомбинантный маннан-связывающий пектин» понимается рекомбинантный маннан-связывающий лектин, очищенный от супернатанта или жидкостей тела или ткани трансгенных животных с использованием углеводородной аффинной хроматографии.
В настоящем изобретении предложена форма маннан-связывающего лектина, которая сходна с естественным маннан-связывающим лектином человека профилем распределения размеров молекул его очищенной формы, которая ближе к профилю распределения размеров молекул естественного маннан-связывающего лектина человека, чем это наблюдалось у других форм, известных на сегодняшний день. Таким образом, другой аспект настоящего изобретения связан с составом рекомбинантного маннан-связывающего лектина человека, который содержит олигомеры субъединиц маннан-связывающего лектина, при этом профиль распределения размеров молекул олигомеров, по крайней мере, на 50% идентичен распределению размеров молекул маннан-связывающего лектина плазмы человека.
В данном контексте термин «олигомер» относится к различным «…мерам» маннан-связывающего лектина, таким как мономер, димер, тример, тетрамер, пентамер и гексамер. Мономер состоит из трех идентичных пептидных цепей и в данном контексте рассматривается как субъединица. Другие олигомеры образуются как комбинации из 2-6 субъединиц.
Что касается экспрессии рекомбинантного маннан-связывающего лектина, то настоящее изобретение относится к конструкции для экспрессии гена, кодирующего рекомбинантный полипептид маннан-связывающего лектина человека, включающей
– по крайней мере, одну интронную последовательность гена маннан-связывающего лектина человека или его функционального эквивалента;
– по крайней мере, одну экзонную последовательность гена маннан-связывающего лектина человека или его функционального эквивалента;
– область промотора, отличную от промотора маннан-связывающего лектина человека;
– вектор экспрессии.
Предпочтительно, чтобы экспрессия осуществлялась, например, в клетках мелкопитающих, при этом препарат по настоящему изобретению получается при использовании вектора экспрессии, включающего интронную последовательность (последовательности) гена маннан-связывающего лектина человека и, по крайней мере, одну экзонную последовательность. Касательно трансгенных животных как системы экспрессии, то этот термин в данном контексте означает генетически модифицированных животных, клетки которых содержат и экспрессируют ген маннан-связывающего лектина человека или его подобие.
Под термином «рекомбинантный маннан-связывающий лектин со структурными свойствами в условиях, не приводящих к денатурации, сходный с естественным маннан-связывающим лектином человека» понимается рекомбинантный маннан-связывающий лектин, извлекаемый сходным способом с помощью гельпроникающей хроматографии в виде маннан-связывающего лектина человека, присутствующего в сыворотке. Под термином «рекомбинантный маннан-связывающий лектин со структурными свойствами в условиях денатурации, сходный с естественным маннан-связывающим лектином человека» понимается очищенный маннан-связывающий лектин с распределением размеров молекул, полученным способом SDS-PAGE, на 50% идентичным распределению размеров молекул маннан-связывающего лектина человека, очищенного от плазмы путем углеводородной аффинной хроматографии (см. фигуру 1). Таким образом, под термином «рекомбинантный маннан-связывающий лектин» понимается маннан-связывающий лектин, в значительной степени свободный от любых примесей, которые обычно присутствуют в маннан-связывающем лектине, очищенном от плазмы.
В этой связи протеазы, ассоциированные с маннан-связывающим лектином (MASP), не рассматриваются как примеси.
Поэтому другой аспект настоящего изобретения относится к способу получения рекомбинантного маннан-связывающего лектина человека, включающему, следующие этапы:
– создание конструкции для экспрессии гена, кодирующего пептид маннан-связывающего лектина человека или его функциональный эквивалент;
– трансформация культуры клетки-хозяина с помощью этой конструкции;
– культивирование культуры клетки-хозяина, с выделением полипептида в культуральную среду, с
– получением культуральной среды, содержащей рекомбинантный маннан-связывающий лектин.
Еще одним аспектом настоящего изобретения является способ выделения или очистки маннан-связывающего лектина человека для того, чтобы получить состав полипептидов с распределением размеров молекул, которое, по крайней мере, на 50% идентично распределению размеров молекул маннан-связывающего лектина плазмы человека. Таким образом, изобретение относится к способу выделения состава олигомеров маннан-связывающего лектина человека, не менее 50% которых имеет распределение размеров идентично натуральным (естественным), содержащимся в плазме человека, включающему:
– получение препарата олигомеров маннан-связывающего лектина человека;
– аффинную хроматографию указанного препарата с использованием матрицы, полученной из углеводорода, при этом сродство данной матрицы с тетрамерами, пентамерами и/или гексамерами субъединицы маннан-связывающего лектина, по крайней мере, в два раза больше, чем с димерами субъединицы маннан-связывающего лектина;
– получение элюата, содержащего состав выделенного рекомбинантного маннан-связывающего лектина человека.
Еще один аспект настоящего изобретения относится к маннан-связывающему лектину, включая рекомбинантный маннан-связывающий лектин, его фрагменты или его подобие/имитацию, для применения при терапии рака и заболеваний и расстройств, например, иммунной системы и репродуктивной системы, при этом указанная терапия включает создание, реконструкцию, усиление и/или стимулирование опсонического влияния и бактерицидной активности системы комплемента, т.е. усиление способности иммунной защиты распознавать и убивать патогенных микробов. Применение рекомбинантного маннан-связывающего лектина, сходного с естественным маннан-связывающим лектином, при указанной терапии представляет большое продвижение вперед по сравнению с применением известного маннан-связывающего лектина, в частности маннан-связывающего лектина плазмы человека, так как эта терапия с применением рекомбинантного маннан-связывающего лектина намного снижает риск вирусных инфекций.
Указанная терапия может включать лечение и/или профилактику заболеваний, расстройств и/или состояний в случае необходимости применения терапии рака и заболеваний и расстройств, например, иммунной системы и репродуктивной системы у человека или животного, при этом упомянутые функциональные единицы активированы в этой связи так же, как и у человека. Под состоянием, требующим терапии, понимается любое состояние, связанное с существующей и/или предполагаемой необходимостью лечения или с необходимостью улучшить нормальное состояние. В частности, к такой терапии относится терапия состояния, связанного с дефицитом маннан-связывающего лектина.
Настоящее изобретение также относится к фармацевтическим составам, содержащим маннан-связывающий лектин, приготовленный в соответствии с настоящим изобретением.
Еще один аспект настоящего изобретения относится к применению маннан-связывающего лектина, приготовленного в соответствии с настоящим изобретением, включая его фрагменты или его подобие/иммитацию при изготовлении лекарственного препарата или фармацевтического состава для терапии, включая лечение и/или профилактику заболеваний и расстройств, например, иммунной системы и репродуктивной системы у человека или животного, при этом упомянутые функциональные единицы, действуют в этой связи так же, как и у человека.
При упомянутых заболеваниях, расстройствах и/или состояниях применяется терапия с использование составов по настоящему изобретению, например, терапия состояний, связанных с дефицитом маннан-связывающего лектина, терапия рака и инфекций, связанных с иммуноподавляющей химиотерапией, включая, в частности, инфекции, связанные с состояниями, возникающими в процессе терапии рака или с имплантацией и/или трансплантацией органов. Настоящее изобретение также включает терапию состояний, связанных с рецидивными выкидышами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Иммунная система обладает важной способностью предотвращать возникновение инфекций, что очень важно для гомеостаза и последующего выживания и сохранения жизни. Поэтому интересно идентифицировать составы, которые проявляют активность в таких процессах. Интенсивные исследования последнего десятилетия позволили открыть маннан-связывающий лектин, который является очень универсальной макромолекулой, проявляющей, по всей видимости, свою активность, например, в собственной (врожденной) иммунной системе.
В соответствии с настоящим изобретением можно получать состав/смесь/композицию рекомбинантного маннан-связывающего лектина человека с распределением размеров молекул, которое, как описано выше, по крайней мере, на 50% идентично распределению размеров молекул естественного маннан-связывающего лектина человека.
Сначала описанным выше способом получают состав/смесь/композицию маннан-связывающего лектина, а затем для отделения высших олигомеров маннан-связывающего лектина от других олигомеров выполняют аффинную хроматографию.
Культуральная среда, включающая разнообразные олигомеры маннан-связывающего лектина, подвергается аффинной хроматографии на матрице, полученной из углеводорода.
Аффинная хроматография является хорошо известным способом очистки белков от белковой матрицы. Сродство матрицы, полученной из углеводорода, с тетрамерами, пентамерами и/или гексамерами субъединицы маннан-связывающего лектина, по крайней мере, в два раза больше, чем с димерами субъединиц маннан-связывающего лектина. В предпочтительном варианте данного изобретения сродство матрицы, полученной из углеводорода, с тетрамерами, пентамерами и/или гексамерами субъединиц маннан-связывающего лектина, по крайней мере, в три раза больше, чем с димерами маннан-связывающего лектина. Также сродство матрицы, полученной из углеводорода, с тетрамерами, пентамерами и/или гексамерами субъединиц маннан-связывающего лектина может быть, по крайней мере, в два раза больше, чем с субъединицами маннан-связывающего лектина.
Таким образом, состав/смесь/композиция маннан-связывающего лектина имеет распределение размеров молекул, по крайней мере, на 50, 60, 70, 80, 90, 95% совпадающее с распределением размеров молекул естественного маннан-связывающего лектина. Предпочтительно, чтобы распределение размеров молекул как можно больше совпадало с распределением размеров молекул естественного маннан-связывающего лектина, что означает совпадение, по крайней мере, на 99%.
Матрица, полученная из углеводорода, по существу не имеет сродства с субъединицами и/или димерами субъединиц маннан-связывающего лектина. Предпочтительно, чтобы матрица, полученная из углеводорода, была в значительной степени идентична только тетрамерным, пентамерным и/или гексамерным субъединицам рекомбинантного маннан-связывающего лектина.
Предпочтительно, чтобы в составе/смеси/композиции преобладали высшие олигомеры субъединицы типа тетрамеров, пентамеров и/или гексамеров. Таким образом, желательно, чтобы в таком составе отношение числа тетрамеров, пентамеров и/или гексамеров к числу субъединиц и/или димеров было не менее 2:1, предпочтительно не менее 5:1.
В предпочтительном варианте изобретения желательно, чтобы отношение суммы тетрамеров, пентамеров и/или гексамеров к сумме субъединиц и димеров было не менее 2:1, но лучше не менее 5:1.
Матрица может быть получена от любого углеводорода или смеси углеводородов, с которыми связан маннан-связывающий пектин и для которых связывание высших олигомеров маннан-связывающего лектина является предпочтительным. Предпочтительно, чтобы углеводородная матрица, была матрицей, полученной от гексозы, такой как манноза или N-ацетил-глюкозаминной матрицы, но предпочтительной является маннозная матрица.
Избирательность матрицы, полученной из углеводорода, обеспечивается тем, что матрица как таковая, т.е. матрица полученная не из углеводорода, не имеет сродства с субъединицами маннан-связывающего лектина, в частности не имеет сродства с тримерами или более мелкими олигомерами маннан-связывающего лектина. Это обеспечивается тогда, когда матрица свободна от углеводородов. В частности матрица не должна содержать сефарозу. Предпочтительно, чтобы матрица состояла из полимерных материалов, не содержащих углеводородов, типа гранул Fractogel®TSK.
Матрица может иметь любую форму, подходящую для хроматографии, в большинстве случаев в виде гранул типа пластмассовых шариков.
После нанесения источника маннан-связывающего лектина колонка промывается, предпочтительно с использованием буферных растворов, не приводящих к денатурации, состав, значение рН и ионная сила которых обеспечивают отсутствие белков без элюирования высших олигомеров маннан-связывающего лектина. В качестве буферного раствора может использоваться трис-забуференный соляной раствор (TBS). Выполняется элюирование маннан-связывающего лектина с помощью селективного десорбирующего агента, способного к эффективному элюированию высших олигомеров маннан-связывающего лектина, такого как трис-забуференный солевой раствор, содержащий десорбирующий агент типа ЭДТК (например, ЭДТК концентрацией 5 мМ) или маннозы (например, раствор маннозы концентрацией 50 мМ) и затем олигомеры маннан-связывающего лектина собираются.
В соответствии с настоящим изобретением последовательности гена маннан-связывающего лектина могут быть получены из гена маннан-связывающего лектина человека или из генов маннан-связывающего лектина других видов животных, у которых иммунная система в этом отношении действует как иммунная система человека. Предпочтительный вариант получения рекомбинантного маннан-связывающего лектина в соответствии с настоящим изобретением описан в примере 1, приведенном ниже, в соответствии с которым указанный рекомбинантный маннан-связывающий лектин получают с применением вектора экспрессии, в состав которого входят последовательности гена маннан-связывающий лектин человека. Вектор экспрессии указанного предпочтительного варианта способа получения рассмотрен в примере 1 и на фигуре 2.
Настоящее изобретение также относится к применению векторов экспрессии, в состав которых входят последовательности, которые являются функциональными производными последовательностей гена маннан-связывающего лектина человека. Под указанными функциональными производными понимаются последовательности, в которых чередуются основные пары, что вызывает функциональные или, главным образом, нефункциональные отклонения характеристик вектора экспрессии, и функциональность полученного таким образом маннан-связывающего лектина, сравнима с функциональностью маннан-связывающего лектина, полученного с использованием вектора экспрессии, в состав которого входят неизмененные последовательности гена маннан-связывающего лектина человека.
Предпочтительно, чтобы помимо способа очистки получение высших олигомеров, обеспечивалось бы также и ионной конструкцией экспрессии и клеткой хозяина.
Следовательно, предпочтительно, чтобы в состав конструкции для экспрессии гена входила, по крайней мере, одна интронная последовательность гена маннан-связывающего лектина человека или его функционального эквивалента.
Кроме того, в состав конструкции для экспрессии гена могут входить, по крайней мере, две экзонные последовательности гена маннан-связывающего лектина человека или его функционального эквивалента. Наиболее предпочтительно, если в состав конструкции для экспрессии гена входят, по крайней мере, три экзонные последовательности гена маннан-связывающего лектина человека или его функциональный эквивалент. В случае более чем с одним экзоном предпочтительно, чтобы экзонные последовательности выстраивались таким же образом, как и в гене маннан-связывающего лектина человека.
Хотя предпочтительно также, чтобы в состав такой последовательности входили интронные последовательности, в некоторых случаях может быть удобно, чтобы в состав структуры экспрессии входила последовательность ДНК, комплементарная кодирующей субъединицу маннан-связывающего лектина или его функциональный эквивалент.
Настоящее изобретение относится к использованию скорее конструкций экспрессии гена маннан-связывающего лектина, чем конструкций ДНК, комплементарной кодирующей маннан-связывающий лектин для экспрессии рекомбинантного маннан-связывающего лектина в клеточной линии млекопитающих или трансгенных животных, с целью получения рекомбинантного маннан-связывающего лектина со структурными свойствами при условиях, не приводящих и приводящих к денатурации, который в значительной степени схож с естественным маннан-связывающим лектином человека. Под «рекомбинантным маннан-связывающим лектином человека» понимается маннан-связывающий лектин человека, который экспрессирует из созданных генной инженерией нуклеиновых кислот, а под «конструкцией для экспрессии гена маннан-связывающего лектина» понимается вектор экспрессии, подходящий для экспрессии в клеточных линиях клетки хозяина, в состав которых входят экзонные последовательности и, по крайней мере, одна интронная последовательность гена маннан-связывающего лектина человека или генов маннан-связывающего лектина других видов животных, к которым относятся (но не ограничиваются ими) шимпанзе и резус макаки.
Предпочтительно, чтобы последовательности ДНК кодировали полипептидную последовательность (например, последовательность №1) или ее функциональный эквивалент, при этом понятие функционального эквивалента определено выше. Последовательность №1 соответствует последовательности маннан-связывающего лектина с доступом к базе данных № Р11226. Эквивалент можно получить путем модификации пептидной последовательности, показанной в виде последовательности №1, например, изменением соответствующих свойств последовательностей по настоящему изобретению, у которых замещена одна или большее число аминокислот.
Предпочтительно, чтобы в состав функционального эквивалента входили консервативные замещения, т.е. замещения одной или большего числа аминокислот аминокислотой, обладающей подобными свойствами, например, специалисты по химии протеинов могут получить вторичные и третичные структуры белка, который не изменяется. Аминокислоты, подходящие для консервативных замещений, включают те цепи, которые имеют функциональное подобие указанным цепям. Например, гидрофобные остатки, глицин, аланин, валин, лейцин, изолейцин и метионин могут заместить другие подобные остатки. Точно также консервативные замещения могут включать взаимозаменяемые гидрофильные остатки (например, аргинин и лизин, глютамин и аспарагин, треонин и серин), основные остатки (например, лизин, аргинин и гистидин), и/или кислотные остатки (например, аспарагиновая кислота и глютаминовая кислота). Функциональные эквиваленты могут быть также модифицированы, например, путем исключения или добавления аминокислот или химической модификацией аминокислот, при сохранении функции полипептида.
Выделенный пептид маннан-связывающего лектина, включая любой из его функциональных эквивалентов, может в одном из вариантов изобретения включать в свой состав, по крайней мере, 80 аминокислотных остатков, по крайней мере, 100 аминокислотных остатков, по крайней мере, 150 аминокислотных остатков, по крайней мере, 200 аминокислотных остатков, по крайней мере, 220 аминокислотных остатков, по крайней мере, 250 аминокислотных остатков.
В предпочтительном варианте настоящего изобретения вектор экспрессии подходит для экспрессии в клеточных линиях млекопитающих или трансгенных животных, клетки которых содержат экзонные последовательности и, по крайней мере, одну интронную последовательность гена маннан-связывающего лектина человека или генов маннан-связывающего лектина других видов животных, к которым относятся (но не ограничиваются ими) шимпанзе и резус макаки. В одном из примеров настоящего изобретения культура клетки-хозяина выращивается в клетках трангенного животного. Под трансгенными животными в данном контексте понимают генетически модифицированное животное, клетки которого содержат и экспрессируют ген маннан-связывающего лектина человека или его фрагменты или его подобие/иммитацию.
В предпочтительном варианте настоящего изобретения в состав конструкции для экспрессии гена по настоящему изобретению входит вирусный вектор типа вирусного вектора ДНК, вирусного вектора РНК или химерного вирусного вектора. Примерами вирусов ДНК являются цитомегаловирус, вирус простого герпеса, вирус Эпштейна-Барра, обезьяний вирус SV-40, вирус папилломы крупного рогатого скота, аденоассоциированный вирус, аденовирус, вирус коровьей оспы, Кьюнджин (Kunjin) вирус, Сендай (Sendai) вирус и бакуловирус.
В клетках хозяина млекопитающих можно использовать целый ряд систем на основе вирусов. В тех случаях когда в качестве вектора экспрессии используется аденовирус, молекула нуклеиновой кислоты по настоящему изобретению может сшиваться с контрольным комплексом транскрипции/трансляции аденовируса, например, поздним промотором и трехраздельной лидерной последовательностью. Затем этот химерный ген может вставляться в геном аденовируса путем ин-витро или ин-виво рекомбинации. Эта вставка в неглавную/неэссенциальную область вирусного генома (например, область Е1 или Е3) приводит к рекомбинантному вирусу в инфицированных клетках хозяина (например, см. Logan and Shenk, Proc. Natl. Acad. Sci. USA 81:3655-3659, 1984). Для эффективной трансляции вставленных молекул нуклеиновых кислот могут также потребоваться специфические сигналы начала. Эти сигналы включают кодон, инициирующий антитимоцитарный глобулин (ATG), и соседние последовательности. В тех случаях когда целый ген или комплементарная ДНК, включая ее собственный инициирующий кодон и соседние последовательности, вставляется в соответствующий вектор экспрессии, отпадает необходимость в дополнительных трансляционных управляющих сигналах. Однако в тех случаях, когда вставляется только часть кодирующей последовательности, необходимы экзогенные трансляционные управляющие сигналы, включая, возможно, кодон (ATG). Кроме того, для обеспечения трансляции всей вставки инициирующий кодон должен быть в одной фазе с рамкой считывания требуемой кодирующей последовательности. Эти экзогенные трансляционные управляющие сигналы и инициирующие кодоны могут иметь самое разное происхождение, включая как природное, так и синтетическое. Эффективность экспрессии может быть усилена путем включения соответствующих усиливающих трансляцию элементов, терминаторов транскрипции и т.п. (см. Bitter et al., Methods in Enzymol. 153:516-544, 1987).
Примерами вируса РНК являются вирус Simlike Forest, Sindbis, Poko, вирус бешенства, вирус гриппа, SV5, респираторно-синтициальный вирус, вирус энцефалита венесуэльской лошади, вирус везикулярного стоматита, Сендай вирус, Кьюнджин (Kunjin) вирус и ретровирусы.
Примерами химерных вирусов являются аденовирус, вирус Sindbis и аденовирус – аденоассоциированный вирус.
Что касается специфических векторов, то о них сказано в работе автора Markides S.C. “Components of vectors for gene transfer and expression in mammalian cells” (Составляющие векторов для переноса и экспрессии гена в клетках млекопитающих).
В частности, используется ориджин репликации вируса Эпштейна-Барра или его функциональные производные, или его подобие/иммитация, включая вектор pREP9.
В одном аспекте настоящего изобретения предусмотрена конструкция для экспрессии гена, кодирующего маннан-связывающий лектин человека, отличительной чертой которой является содержание одной или большего числа интронных последоваетльностей гена маннан-связывающего лектина человека, включая его функциональные производные. Кроме того, в ее состав входит область промотора, взятая из генов вируса или эукариотов, включая млекопитающих и насекомых.
Предпочтительно, чтобы область промотора отличалась от промотора маннан-связывающего лектина человека. В вопросе оптимизации выхода маннан-связывающего лектина и распределения размеров олигомеров маннан-связывающего лектина предпочтительно область промотора выбирать таким образом, чтобы обеспечивать ее наиболее оптимальное функционирование с вектором и клетками хозяина.
В предпочтительном варианте изобретения область промотора выбирается из группы, включающей промотор длинного концевого повтора вируса саркомы Rous, и немедленно ранний промотор цитомегаловируса, и альфа промотор фактора элонгации 1.
В другом примере изобретения область промотора выбирается из генов микроорганизмов, например, вирусов, дрожжей и бактерий.
Для увеличения выхода рекомбинантного маннан-связывающего лектина область промотора может включать усиливающие элементы, например, элемент QBI SP163, состоящий из 5′-концевой нетранслируемой области сосудистого эндотелиального гена фактора роста мыши. Эта структура используется для преобразования клеток хозяина с целью получения клеточной культуры хозяина, способной к экспрессии маннан-связывающего лектина.
Синтез рекомбинантного маннан-связывающего лектина может быть использована культурами ин-виво или ин-витро. Предпочтительно, чтобы культура клетки-хозяина была эукариотной. В данном контексте под преобразованием эукариотной культуры клетки понимается внедрение рекомбинантной ДНК в клетки. Конструкция для экспрессии гена, применяемая в данном способе, характеризуется наличием области, кодирующей маннан-связывающий пектин, взятый из генов млекопитающих, включая гены человека и гены, сильно их напоминающие, например, гены шимпанзе. Применяемая конструкция для экспрессии гена также характеризуется областью промотора, взятой из генов вирусов или эукариотов, включая клетки млекопитающих и клетки насекомых.
В настоящем изобретении рассматривается такой рекомбинантный маннан-связывающий лектин, который является формой маннан-связывающего лектина, сходного с естественным маннан-связывающим лектином человека тем, что распределение размеров молекул его очищенной формы наиболее близко естественному профилю распределения размеров молекул среди всех известных форм.
Способ получения рекомбинантного маннан-связывающего лектина по настоящему изобретению характеризуется тем, что культура клетки-хозяина является эукариотной и, например, культурой клетки млекопитающего. Предпочтительно, чтобы культура клетки-хозяина была культурой клеток почек человека, но еще более предпочтительным является, чтобы эта культура клетки-хозяина состояла из эмбриональных клеток почек человека (клетки НЕК). В изобретении рассматривается применение клеточной линии НЕК293 для получения рекомбинантного маннан-связывающего лектина человека. Под термином «клеточные линии НЕК293» понимается любая клеточная линия, полученная из эмбриональной клетки почек человека (но не ограниченная ими) типа клеточных линий, хранящихся в American Type Culture Collection под номерами CRL-1573 и CRL-10852.
Другими клетками могут быть эмбриональный фибробласт, клетки яичника хомяка, клетки почек молодого хомяка, клетки карциномы матки человека, клетки меланомы человека, клетки печени человека, эндотелиальные клетки пупочных сосудов человека, эндотелиальные клетки мозга человека, опухолевые клетки полости рта человека, клетки почек обезьяны, фибробласт мыши, клетки почек мыши, клетки соединительных тканей мыши, олигодендритные клетки мыши, макрофаг мыши, фибробласт мыши, клетки нейробластомы мыши, пре-В-клетки мыши, В клетки лимфомы мыши, клетки плазмацитомы мыши, клетки тератокарциномы мыши, клетки астроцитомы крысы, эпителиальные клетки молочной железы крысы, клетки COS, CHO, ВНК, 293, VERO, HeLa, MDCK, WI38 и IH3T3.
Кроме того, может быть выбран такой штамм клетки хозяина, который модулирует экспрессию вставленной последовательности или специальным образом изменяет и обрабатывает генный продукт. Такие модификации (например, гликозилирование) генного продукта и обработка (например, расщепление) белковых продуктов могут быть очень важны для функций протеина. Различные клетки хозяина обладают характерными и специфическими механизмами для пост-трансляционной обработки и модификации белков и генных продуктов. Для обеспечения правильной модификации и обработки экспрессированного чужеродного белка могут подбираться соответствующие клеточные линии или системы хозяина. Для соответствующей обработки типа первичной транскрипции, гликозилирования и фосфорилирования генного продукта могут использоваться эукариотные клетки хозяина, обладающие соответствующими клеточными механизмами. Перечисленные выше типы клеток млекопитающих относятся к типам клеток, которые могут использоваться в качестве клеток хозяина.
В другом аспекте настоящего изобретения рассмотрен маннан-связывающий лектин, который получают по технологии рекомбинантной ДНК, например, в клетках млекопитающих или трансгенных животных. В частности настоящее изобретение относится к рекомбинантному маннан-связываюшему лектину, который синтезируется путем:
– создания описанным выше способом конструкции для экспрессии гена, кодирующего полипептид маннан-связывающего лектина человека или его функционального эквивалента;
– трансляции культуры клетки-хозяина с помощью этой конструкции;
– культивирования культуры клетки-хозяина, получая, с выделение полипептида в культуральную среду, с
– получением культуральной среды, содержащей рекомбинантный маннан-связывающий лектин.
Кроме того, настоящее изобретение относится к синтезу маннан-связывающего лектина, осуществляемому путем:
(a) создания конструкции для экспрессии гена. кодирующего маннан-связывающий лектин человека;
(b) трансформации культуры эукариотных клеток с применением упомянутой структуры экспрессии и получения, таким образом, культуры эукариотных рекомбинантных клеток хозяина;
(c) выращивания указанной культуры эукариотных рекомбинантных клеток хозяина либо ин-витро, либо в виде клеток трансгенных животных и экспрессии, таким образом, указанного маннан-связывающего лектина человека;
(d) сбора указанного маннан-связывающего лектина человека и его очистки с помощью описанной выше аффинной хроматографии.
Культура клетки-хозяина может выращиваться в соответствующей культуральной среде. Примером культуральной среды могут служить RPMI-1640 или DMEM, дополненные, например, инсулином, трансферрином. селеном и фетальной телячьей сывороткой.
Настоящее изобретение также включает этап очистки или выделения маннан-связывающего лектина человека, например, маннан-связывающего лектина человека из культуральных супернатантов или жидкостей тела или тканей трансгенных животных путем использования углеводородной аффинной хроматографии, как описано выше. В предпочтительном варианте изобретения аффинная хроматография выполняется с помощью матриц маннозы, гексозы или матрицы, полученной из N-цетилглюкозимина, которые подходят для аффинной хроматографии, описанной выше. В частности, применяется такая аффинная хроматография, матрицы которой получают с помощью маннозы. Прежде матрицы, полученные с помощью маннана, применялись для сбора рекомбинантного маннан-связывающего лектина из супернатанта культуры. В то время как матрицы, полученные из маннана, связывают как формы маннан-связывающего лектина с большой, так и с малой молекулярной массой, применение матриц, полученных описанным выше способом, например, с использованием маннозы, обеспечивает существенные преимущества в очистке рекомбинантного маннан-связывающего лектина, так как эти матрицы избирательно связывают формы рекомбинантного маннан-связывающего лектина, схожего с естественным маннан-связывающим лектином. Степень сродства с естественным маннан-связывающим лектином, полученная при измерении распределения размеров молекул с помощью метода SDS-PAGE, должна составлять более 50%, после чего следует белковое окрашивание геля, как описано, например, у авторов Ма и др. в 1997 г.
Очищенный рекомбинантный маннан-связывающий лектин в данном контексте должен пониматься как рекомбинантный маннан-связывающий лектин, очищенный от культуры клеток супернатантов, или жидкостей тела, или тканей трансгенных животных, очищение производят с использованием углеводородной аффинной хроматографии.
Предпочтительно, чтобы процесс выделения или очистки состава олигомеров маннан-связывающего лектина человека с распределением размеров молекул, по крайней мере, на 50% идентичным распределению размеров молекул естественного маннан-связывающего лектина плазмы, включал:
– получение препарата олигомеров маннан-связывающего лектина человека;
– аффинную хроматографию указанного препарата с использованием матрицы, полученной из производной углеводорода, при этом сродство данной матрицы с тетрамерами, пентамерами и/или гексамерами субъединицы маннан-связывающего лектина, по крайней мере, в два раза больше, чем с димерами субъединицы маннан-связывающего лектина;
– получение элюата, содержащего состав выделенного рекомбинантного маннан-связывающего лектина человека.
В настоящем изобретении предлагается новая форма состава рекомбинантного маннан-связывающего лектина, содержащего олигомеры субъединиц маннан-связывающего лектина, при этом профиль распределения размеров молекул данных олигомеров, по крайней мере, на 50% идентичен профилю распределения размеров молекул маннан-связывающего лектина плазмы человека. В предпочтительном варианте изобретения распределение размеров молекул данных олигомеров, по крайней мере, на 50%, по крайней мере, на 60%, по крайней мере, на 70%, по крайней мере, на 80%, по крайней мере, на 90%, по крайней мере, на 95%, совпадает с распределением размеров молекул естественного маннан-связывающего лектина человека.
Предпочтительно, чтобы в настоящем составе преобладали высшие олигомеры субъединиц, такие как тетрамеры, пентамеры и/или гексамеры. Таким образом, предпочтительно, чтобы в таком составе отношение числа тетрамеров, пентамеров и/или гексамеров к числу субъединиц и/или димеров было не менее 2:1, хотя предпочтительно было не менее 5:1.
В предпочтительном варианте изобретения желательно, чтобы отношение суммы тетрамеров, пентамеров и/или гексамеров к сумме субъединиц и димеров было не менее 2:1, но лучше, чтобы это отношение было не менее 5:1.
При оценке распределения размеров молекул олигомеров маннан-связывающего лектина применялся метод вестерн-блоттинга по SDS-PAGE. Таким образом очевидно, что под идентичностью 50% понимается, что средняя молекулярная масса хотя бы 50% олигомеров, полученная с помощью метода SDS-PAGE и/или с помощью вестерн-блоттинга, превышает 200 кДа.
Состав рекомбинантного маннан-связывающего лектина может быть очищен любым средством, подходящим для культуральной среды, таким как любой физико-химический метод выделения, включающий, но не ограничивающийся методами фильтрации, хроматографии, такой как йоннобменная хроматография, базирующаяся на размере, гель проникающая афинная хроматография. Состав рекомбинантного маннан-связывающего лектина предпочтительно очищать от культуральной среды посредством афинной хроматографии, как описано выше.
Предпочтительно, чтобы состав рекомбинантного маннан-связывающего лектина обеспечивал бы функциональность, схожую с функциональностью маннан-связывающего лектина плазмы или сыворотки. В данном контексте под функциональностью маннан-связывающего лектина понимается способность активировать систему комплемента, что рассмотрено выше в отношении функциональных эквивалентов. Функциональность может быть выражена как специфическая (удельная) активность маннан-связывающего лектина в виде единицы активности маннан-связывающего лектина на 1 нг маннан-связывающего лектина. Желательно, чтобы функциональность состава рекомбинантного маннан-связывающего лектина, выраженная в единицах удельной активности, была не менее 25% удельной активности маннан-связывающего лектина, очищенного от сыворотки, не менее 50% удельной активности маннан-связывающего лектина, очищенного от сыворотки, не менее 75% удельной активности маннан-связывающего лектина, очищенного от сыворотки.
Состав маннан-связывающего лектина по настоящему изобретению в значительной степени свободен от любых примесей, естественным образом ассоциированных с маннан-связывающим лектином, получаемым в собственном организме хозяина, также от любых примесей, естественным образом ассоциированных с маннан-связывающим лектином, очищенным от сыворотки. Под термином собственный организм хозяина понимается то, что маннан-связывающий лектин вырабатывается клеткой, нормальным образом экспрессирующей маннан-связывающий лектин.
Элюат, получаемый с помощью аффинной хроматографии, можно использовать для приготовления фармацевтических составов, или же этот элюат перед применением может быть подвергнут дополнительной очистке в несколько этапов.
Состав маннан-связывающего лектина, полученный по настоящему изобретению, можно использовать для приготовления фармацевтических составов для профилактики и/или терапии различных вирусных заболеваний или состояний.
Помимо олигомеров маннан-связывающего лектина эти фармацевтические составы могут содержать фармацевтически приемлемые вещества-носители и/или средства доставки.
В частности для стабилизации белков маннан-связывающего лектина может дополнительно вводиться стабилизирующий агент. В качестве стабилизирующего агента можно использовать спирт, полученный из сахара, сахарид, белок и/или аминокислоты. Примером стабилизирующего агента может быть альбумин или мальтоза.
В зависимости, например, от формы введения препарата, в качестве добавок можно использовать другие традиционные добавки к фармацевтическим составам.
В одном из вариантов настоящего изобретения фармацевтический состав вводится в форме, подходящей для инъекции. Могут применяться также такие традиционные вещества-носители как изотонические соляные растворы.
В другом варианте настоящего изобретения фармацевтический состав применяется в форме, подходящей для введения через легкие, или для введения в виде порошка для ингаляции, или крема, или жидкости для местного применения.
Настоящее изобретение основано на синтезе новой формы рекомбинантного маннан-связывающего лектина, которая более близка к естественному маннан-связывающему лектину человека, чем известные по сих пор формы, и которая может быть синтезирована при использовании ин-виво или ин-витро технологии. Эта предлагаемая форма рекомбинантного маннан-связывающего лектина обеспечивает большие возможности для терапии таких заболеваний, как рак и инфекции, связанные с иммунноподавляющей химиотерапией. Структурные отличия ранее известных препаратов из рекомбинантного маннан-связывающего лектина от препаратов из естественных форм маннан-связывающего лектина делают такую терапию малообещающей. Кроме того, применение рекомбинантного маннан-связывающего лектина, сходного с естественным маннан-связывающим лектином, при упомянутой терапии представляет большое продвижение вперед по сравнению с применением известного маннан-связывающего лектина, в частности, маннан-связывающего лектина плазмы человека, так как эта терапия с применением рекомбинантного маннан-связывающего лектина намного снижает риск вирусных инфекций.
Такая терапия не должна быть терапией продиагностированного заболевания, расстройства или состояния в случае немедленного или очевидного применения терапии, а может применяться для профилактики болезни или состояния.
Под терапией в данном контексте понимается лечение и/или профилактика, например, иммунной системы и репродуктивной системы у человека или животного, при этом механизм действия указанных функциональных единиц, является идентичным подобным механизмам у человека. Под состоянием, требующим терапии, не обязательно понимается состояние, которое необходимо лечить в настоящее время, а скорее состояние, связанное с существующей и/или предполагаемой необходимостью или с необходимостью улучшить нормальное состояние. В частности, к такой терапии относится терапия состояния, связанного с дефицитом маннан-связывающего лектина.
Еще один аспект настоящего изобретения относится к изготовлению лекарственного препарата, состоящего из упомянутых фармацевтических составов маннан-связывающего лектина, включая составы фрагментов и подобия рекомбинантного маннан-связывающего лектина, предназначенных для терапии состояний, включая лечение и/или профилактику заболеваний и расстройств, например, иммунной системы и репродуктивной системы у человека или животного, при этом упомянутые функциональные единицы действуют в этой связи у животного так же, как и у человека.
При указанных заболеваниях, расстройствах и/или состояниях применяется терапия с использование составов по настоящему изобретению, например, терапия состояний, связанных с дефицитом маннан-связывающего лектина, терапия рака и инфекций, связанных с иммуноподавляющей химиотерапией, включая, в частности, инфекции, связанные с состояниями, возникающими в процессе терапии рака или с имплантацией и/или трансплантацией органов. Настоящее изобретение также включает терапию состояний, связанных с рецидивными выкидышами.
Таким образом, фармацевтический состав может использоваться для терапии и/или профилактики клинических заболеваний типа инфекций, дефицита маннан-связывающего лектин, рака, заболеваний, связанных с химиотерапией, типа инфекций, состояний связанных с вирусом иммунодефицита человека (ВИЧ), состояний, связанных с врожденным или приобретенным иммунодефицитом. В частности, таких заболеваний как хроническая воспалительная демиелинизирующая полиневропатия, полифокальная моторная невропатия, множественный склероз, тяжелая миастения, синдром Итена-Ламберта, воспаление зрительного нерва, эпилепсия, синдром первичного антифосфолипида. ревматоидный артрит, системная красная волчанка, системная склеродермия, васкулит, гранулематоз Вернера, синдром Шегрена, хронический ревматоидный полиартрит у детей, автоиммунная нейтропения, автоиммунная гемолитическая анемия, нейтропения, болезнь Крона, язвенный колит, кишечная патология, астма, синдром септического шока, синдром хронического утомления, псориаз, синдром тоскического шока, диабет, синусит, расширенная кардиомиопатия, эндокардит, атеросклероз, первичная гипо/агаммаглобулинемия, включая обычный вариабельный иммунодефицит, синдром Вискота-Алдриха и комбинированный иммунодефицит, вторичная гипо/агаммаглобулинемия у пациентов с хроническим лимфатическим лейкозом и множественной миеломой, острая и хроническая идиопатическая тромбоцитопеническая пурпура, аллогенная трансплантация костного мозга, болезнь Кавасаки, и синдром Гийена-Барре.
Препарат может вводиться любым подходящим способом, таким как, внутривенный, внутримышечный, подкожный или внутрикожный. Также может применяться введение препарата через легкие или местное введение препарата.
В частности состав маннан-связывающего лектина может вводиться для профилактики и/или терапии инфекций у пациентов с клиническими синдромами, связанными с врожденным или приобретенным дефицитом маннан-связывающего лектина или при риске развития таких синдромов. При различных условиях возникающих, например, в результате химиотерапии или других видов цитотоксической терапии, рака, СПИДа, генетической предрасположенности, хронических инфекций и нейропении, у индивидуумов с дефицитом маннан-связывающего лектина может увеличиваться предрасположенность к инфекциям.
Очевидно, что больные с опухолью, проходящие химиотерапию, бывают часто предрасположенны к инфекции, вызванной побочным действием лекарственных препаратов на клетки иммунной системы, что является основанием для терапии с применением маннан-связывающего лектина с целью лечения такого заболевания. В соответствии с наблюдениями низкие концентрации (ниже 500 нг/мл) маннан-связывающего лектина в плазме указывают на повышенную предрасположенность к клиническим инфекциям и иммунная защита этих пациентов может быть усилена путем введения рекомбинантного или натурального (естественного) маннан-связывающего лектина полученного из плазмы.
Таким образом, фармацевтический состав может вводиться в течение периода, предшествующего началу химиотерапии, или во время, по крайней мере, какой-то части химиотерапии.
В частности в состав маннан-связывающего лектина может вводиться в качестве основной «бустер-инъекции» перед проведением химиотерапии или только пациентам, склонным к риску развития дефицита маннан-связывающего лектина. Перед терапией пациенты группы риска определяются путем измерения уровня содержания маннан-связывающего лектина и терапия проводится с теми из них, у кого уровень содержания маннан-связывающего лектина ниже заданного. Для большинства групп нижний предел содержания маннан-связывающего лектина оценивается величиной, не превышающей 500 нг/мл. Уровень содержания маннан-связывающего лектина может определяться методом TRIFMA (time resolved immunofluorescent assay – иммунофлуоресцентный анализ с разрешением по времени), как описано в примере 9, методом ELISA, RIA или нефелометрией.
Другим показанием для введения маннан-связывающего лектина является уровень содержания маннан-связывающего лектина ниже 50% от нормального уровня содержания, или ниже 300 нг/мл, или ниже 200 нг/мл.
Состав маннан-связывающего лектина вводится соответствующими дозами, в частности обычно через определенные интервалы времени, например, один или два раза в неделю во время курса химиотерапии.
Обычно одна доза содержит от 1 до 100 мг препарата, или от 2 до 10 мг, или чаще всего от 5 до 10 мг. Вводится обычно 0,1 мг препарата на 1 кг массы тела пациента.
Таким образом, еще один аспект настоящего изобретения относится к маннан-связывающему лектину, включая рекомбинантный маннан-связывающий лектин, его фрагменты или подобия для применения при терапии рака и заболеваний и расстройств, например, иммунной системы и репродуктивной системы, при этом упомянутая терапия включает создание, реконструкцию, усиление и/или стимулирование опсонического влияния и бактерицидной активности системы комплемента, т.е. усиление способности иммунной защиты распознавать и убивать патогенные микробы.
Кроме того, один из аспектов настоящего изобретения относится к применению рекомбинантного состава по настоящему изобретению в составе других лекарственных препаратов. В частности таким лекарственным препаратом может быть противомикробный лекарственный препарат типа антибиотика.
Что касается выкидышей, то было отмечено, что у пациентов с рецидивными выкидышами чаще наблюдается низкий уровень содержания маннан-связывающего лектина в плазме, что является фоном, на котором в случае восстановления уровня содержания маннан-связывающего лектина путем введения рекомбинантного маннан-связывающего лектина предрасположенность к выкидышам уменьшается.
Что касается природы составов по настоящему изобретению, очевидно, что в широком аспекте настоящее изобретение относится к составам, действующим в качестве опсонинов, способных усиливать поглощение макрофагами, либо путем непосредственного взаимодействия между составом и макрофагом, либо через промежуточное осаждение комплемента на целевой поверхности. Конкретным примером такого состава является маннан-связывающий лектин, его фрагмент или подобие. Настоящее изобретение основывается на раскрытии синтеза рекомбинантного маннан-связывающего лектина человека, структура которого, очевидно, ближе к структуре естественного маннан-связывающего лектина, чем структуры ранее известных форм маннан-связывающего лектина.
В настоящем изобретении даются объяснения и оценки различных аспектов и деталей, и кроме того на фигурах 1 и 2 приводятся иллюстрации настоящего изобретения; рассмотрены также примеры предпочтительных вариантов изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 показан сравнительный анализ очищенного рекомбинантного маннан-связывающего лектина и естественного маннан-связывающего лектина в несокращенном виде, полученных с помощью метода SDS-PAGE и серебряного окрашивания (включая концентрирующий гель). На дорожке «S» виден естественный маннан-связывающий лектин в количестве 24 нг (МО-04, (Государственный институт сыворотки, Копенгаген, Дания). На дорожке «НЕК» виден рекомбинантный маннан-связывающий лектин в количестве 60 нг, полученный в клетках НЕК 293EBNA, и на дорожке «Hyb» виден рекомбинантный маннан-связывающий лектин в количестве 12 нг, полученный в клетках Sp2/0Ag14 (представлен д-ром R.A.B.Ezekowitz). Стрелка указывает на положение преобладающей формы рекомбинантного маннан-связывающего лектина, полученного из клеток гибридомы. Хотя количество рекомбинантного маннан-связывающего лектина на дорожке «НЕК» в пять раз больше количества рекомбинантного маннан-связывающего лектина на дорожке «Hyb», на дорожке «НЕК» не наблюдают полосы величиной 55 кДа, из чего можно предположить, что имеются серьезные различия в образовании дисульфидных мостиков этих двух субъединиц рекомбинантного маннан-связывающего лектина (см. пример 6).
На фигуре 2 схематично изображена конструкция экспрессии в соответствии с настоящим изобретением, а именно конструкция (маннан-связывающий лектин)/pREP9, рассмотренная в примере 1.
На фигуре 3 представлены концентрации маннан-связывающего лектина во фракциях (объем элюирования), полученных путем гельпроникающей хроматографии (пример 7).
На фигуре 4 показаны результаты анализа рекомбинантного маннан-связывающего лектина методом вестерн-блоттинга, при этом рекомбинантный маннан-связывающий лектин очищался с помощью гранул манноза-TSK, гранул маннан-TSK, гранул манноза-сефароза, гранул маннан-сефароза и непроизводных гранул сефароза 4 В. Для сравнения был включен супернатант нефракционированной культуры из клеток трансфицированных конструкцией (маннан-связывающий лектин)/pREP9 (пример 3).
На фигуре 5 показаны результаты анализа методом вестерн-блоттинга двух препаратов рекомбинантного маннан-связывающего лектина в невосстановленном виде: 50 нг рекомбинантного маннан-связывающего лектина, полученного в соответствии с натоящим изобретением (клетки 293 EBNA) и 50 нг препаратов рекомбинантного маннан-связывающего лектина, полученного в соответствии со способом, описанным авторами Super и др., 1992 г. (клетки Sp2/0Ag14). Естественный маннан-связывающий лектин, очищенный от сыворотки человека, описан авторами Lu и др., 1990 г. (“Natural MBL”) (пример 6).
ПРИМЕРЫ
ПРИМЕР 1
Конструкция для экспрессии гена маннан-связывающего лектина
Геномная ДНК человека выделялась из 20 мл крови, введенной в этилендиаминтетрауксусную кислоту (ЭДТК). ЭДТК и кровь смешивались с 80 мл холодного (4°С) расвора Трис-HCl (концентрацией 10 мМ), MgCl2 концентрацией 5 мМ, 1% (об.) Triton Х-100, сахарозы концентрацией 0,32 мМ, и все это выдерживалось при 4°С в течение 30 минут при периодическом перемешивании. Образцы центрифугировались при ускорении 1000 g в течение 30 минут при 4°С, после чего отделялся супернатант и ядросодержащий остаток промывали в 10 мл раствора NaCl концентрацией 0,9% (отношение массовой доли к объемной). Собранные ядра клеток были ресуспендированы в 6 мл раствора NaCl концентрацией 75 мМ, ЭДТК концентрацией 24 мМ (рН 8,0) и 460 мкл 10% раствора (отношение массовой доли к объемной) дедоцилсульфата натрия и добавлялся 1 мг проназы (кат. №165921, Boehringer-Mannheim, Mannheim, Германия). После выдержки при комнатной температуре при слабом помешивании добавлялось 2 мл насыщенного раствора (6 М) NaCl. После интенсивного перемешивания остатки удалялись центрифугированием при ускорении 1000 g. К супернатанту при соотношении 1:1 добавлялся изопропанол и содержимое сосуда слегка взбалтывалось до тех пор, пока не появлялся осадок ДНК. Нитевидный осадок собирался пипеткой Пастера, промывался в 70% (об.) растворе этанола, сушился на воздухе и ресуспендировался в 1 мл буферного раствора ТЕ. Выполнялась PCR амплификация гена маннан-связывающего лектина с участием сенс-праймера, модифицированного для того, чтобы в его состав входил сайт XhoI: 5′-AGATTAACCTTCCtcGAGTTTTCTCACACC-3′. Анти-сенс-праймер был модифицирован для того, чтобы в его состав входил сайт BamHI: 5′-TTACggaTCCACTCCATTATACATACAC-3′ (рестрикционные сайты (подчеркнуты), введенные в последовательность с помощью генной инженерии, модифицированы попарно в сравнении с естественной последовательностью генов в соответствии с публикацией авторов Sastry и др., 1989 г. и показаны в виде строчных букв в обоих последовательностях праймеров. Праймеры получены по ДНК технологии, Aarhus, Дания). Сенс-праймеры и анти-сенс-праймеры располагаются соответственно в 5′ и 3′ UTR. Условия реакции для PCR состояли из 200 мкМ dATP. 200 мкМ dCTP, 200 мкМ dGTP, 200 мкМ dTTP (кат. №1969064, Boehringer-Mannheim, Mannheim, Германия), буфера реакции с величиной ионной силы равной 1, 0,75 мкл фермента (кат. №1732641, Expand High Fidelity , Boehringer-Mannheim, буфер для реагирования, подаваемый вместе с ферментом), геномной ДНК (100 нг), и воды, доведенной до конечного объема 50 мкл. Термическая программа PCR выполнила 1 цикл при 96°С в течение 3 мин, 10 циклов при 94°С в течение 15 с, при 60°С в течение 30 с, при 72°С в течение 5 мин, а затем 20 циклов при 94°С в течение 15 с, при 60°С в течение 30 с, при 68°С в течение 5 мин с приращением по времени, равным 20 с на цикл, после чего следовал этап окончательного удлинения при 72°С в течение 5 мин (датчик термических циклов Omn-Е , Boehringer-Mannheim, буфер для реагирования, подаваемый вместе с ферментом), геномной ДНК (100 нг), и воды, доведенной до конечного объема 50 мкл. Термическая программа PCR выполнила 1 цикл при 96°С в течение 3 мин, 10 циклов при 94°С в течение 15 с, при 60°С в течение 30 с, при 72°С в течение 5 мин, а затем 20 циклов при 94°С в течение 15 с, при 60°С в течение 30 с, при 68°С в течение 5 мин с приращением по времени, равным 20 с на цикл, после чего следовал этап окончательного удлинения при 72°С в течение 5 мин (датчик термических циклов Omn-Е , Hydaib, Эшфорд, Великобритания). В соответствии с рекомендациями изготовителя выполнялось клонирование продукта 6,2 kb PCR в вектор pCR2 с использованием набора для клонирования ТА (кат. № К2000-01, Invitrogen, Leek, Нидерланды). Путем переваривания вектора ферментами NotI и BumHI (кат. №15441-025 и 15201-023, GibcoBRL, Paisley, Великобритания) в течение 6 ч при 37°С в соответствующем буфере из вектора pCR2 выделялся ген маннан-связывающего лектина. Вставка ДНК (т.е. фрагмент 5′ – NotI – маннан-связывающий лектин – BamHI – 3′) выделялась из 1-процентного геля агарозы (отношение массовой доли к объемной) с использованием набора Pharmacia’s Bandprep , Hydaib, Эшфорд, Великобритания). В соответствии с рекомендациями изготовителя выполнялось клонирование продукта 6,2 kb PCR в вектор pCR2 с использованием набора для клонирования ТА (кат. № К2000-01, Invitrogen, Leek, Нидерланды). Путем переваривания вектора ферментами NotI и BumHI (кат. №15441-025 и 15201-023, GibcoBRL, Paisley, Великобритания) в течение 6 ч при 37°С в соответствующем буфере из вектора pCR2 выделялся ген маннан-связывающего лектина. Вставка ДНК (т.е. фрагмент 5′ – NotI – маннан-связывающий лектин – BamHI – 3′) выделялась из 1-процентного геля агарозы (отношение массовой доли к объемной) с использованием набора Pharmacia’s Bandprep (кат.№27-9285-01, Pharmacia, Упсала, Швеция). Вектор pREP9 (кат. № V009-50, Invitrogen) переваривался, как это описано для вектора (маннан-связывающий лектин)/рСР2 и рестрикционный продукт, т.е. линеаризованный вектор, был также выделен из агарозы с целью минимизации загрязнений неусвоенным вектором. В окончательном объеме 10 мкл, 1 мкл (100 нг) переваренного вектора pREP9, 4 мкл (400 нг) фрагмента 5′ – NotI – маннан-связывающий лектин – BamHI – 3′, буфер для лигирования с величиной ионной силы, равной 1, и 20 единиц лигазы Т4 (кат. №202S, New England Biolabs, Беверли, буфер для реагирования поданный вместе с ферментом) выдерживались при 14°С. Клетки Е.coli. TOPF10 готовились к преобразованию путем проникновения CaCl2 и преобразовывались продуктом лигирования с помощью теплового удара, как описано Hanahan (1983 г.). Бактерии высевались на пластины со средой LB-агар с добавлением 50 мкг ампициллина на 1 л среды и после выдержки при 37°С появлялись колонии. (кат.№27-9285-01, Pharmacia, Упсала, Швеция). Вектор pREP9 (кат. № V009-50, Invitrogen) переваривался, как это описано для вектора (маннан-связывающий лектин)/рСР2 и рестрикционный продукт, т.е. линеаризованный вектор, был также выделен из агарозы с целью минимизации загрязнений неусвоенным вектором. В окончательном объеме 10 мкл, 1 мкл (100 нг) переваренного вектора pREP9, 4 мкл (400 нг) фрагмента 5′ – NotI – маннан-связывающий лектин – BamHI – 3′, буфер для лигирования с величиной ионной силы, равной 1, и 20 единиц лигазы Т4 (кат. №202S, New England Biolabs, Беверли, буфер для реагирования поданный вместе с ферментом) выдерживались при 14°С. Клетки Е.coli. TOPF10 готовились к преобразованию путем проникновения CaCl2 и преобразовывались продуктом лигирования с помощью теплового удара, как описано Hanahan (1983 г.). Бактерии высевались на пластины со средой LB-агар с добавлением 50 мкг ампициллина на 1 л среды и после выдержки при 37°С появлялись колонии.
На фигуре 2 показан схематично предпочтительный вариант конструкции по настоящему изобретению, а именно структуры (маннан-связывающий лектин)/pREP9. Амплифицированная путем PCR часть гена маннан-связывающего лектина (расположение сенс-праймеров и анти-сенс-праймеров показано черными стрелками) содержала четыре экзона, включающая весь известный экзон 3 нетранслированныи экзона 4, как описано авторами Sastry и др., 1989 г. Фрагмент объединялся с вектором экспрессии pREP9 на рестрикционных сайтах (участках) эндонуклеазы NotI и BamHI (показаны рестрикционные сайты эндонуклеазы EcoRV, XbaI, Bg/II, XmnI, ClaI, StuI и SacI векторной последовательности). Транскрипция фрагмента маннан-связывающего лектина, клонированного в вектор экспрессии pREP9, контролировалась промотором длинного концевого повтора вируса саркомы Rous (PRVS), расположенного выше сайта клонирования (стрелками указано направление транскрипции элементов вектора) и сайта полиаденилирования вируса обезьяны (SV40). Размножение бактерий, являющихся продуктом вектора ДНК в бактерии Е.coli., было получено с помощью маркера устойчивости к ампициллину (Amp) и прокариотного «ориджинрепликатора» CoIE1. Сохранение вектора в клетках HEK293EBNA обеспечивалось ориджинрепликатором вируса Эпштейна-Барра (OriP) и экспрессией ядерного антигена 1 вируса Эпштейна-Барра (EBNA-1), который прикрепляет вектор к хромосомам клетки хозяина.
ПРИМЕР 2
Экспрессия рекомбинантного маннан-связывающего лектина в клетках млекопитающих
Клетки HEK293EBNA, выращиваемые до слияния в колбе с площадью 150 см2 (кат. №9075, TPPAG), содержащей DMEM (Biological Industries), с добавлением 10% FBS, глютамина, 200 мкл 0418/мл (Gneticin , кат. № G9516, Sigma) и антибиотиков (10000 единиц пенициллина и 1% стрептомицина (отношение массовой доли к объемной)), собирались с помощью обработки трипсином и за 24 часа до трансфекции высевались при плотности в четыре раза ниже прежней (25% от состояния слияния) в колбу с площадью 150 см2 (кат. №90150, ТРР). За три часа до трансфекции вся среда обновлялась. При полном объеме 1680 мкл смешивалось 60 мкг конструкции (маннан-связывающий лектин)/pREP плазмида ДНК (см. пример 1) с раствором NaCl концентрацией 150 мМ, ЭДТК концентрацией 1 мМ. Трис-HCl концентрацией 10 мМ (рН 7,12), CaCl2 концентрацией 268 мМ. Раствор ДНК с кальцием добавлялся в раствор, объемом 1680 мкл, содержащий HEPES концентрацией 50 мМ, NaCl концентрацией 250 мМ, Na2HPO4+NaH2PO4 концентрацией 1,5 мМ с уровнем рН, доведенным до 7,12. Клетки выдерживались в течение 14-16 ч с осаждением ДНК/Са·PO4, дважды промывались в фосфатном буфере и вновь выдерживались в среде RPMI-1640 (50 мл на емкость) с добавлением глютамина, антибиотиков (пенициллина и стрептомицина) и раствора инсулин-трансферрин-селен (ITS) (кат. №51300-44, GibcoBRL) в течение 6-8 суток. , кат. № G9516, Sigma) и антибиотиков (10000 единиц пенициллина и 1% стрептомицина (отношение массовой доли к объемной)), собирались с помощью обработки трипсином и за 24 часа до трансфекции высевались при плотности в четыре раза ниже прежней (25% от состояния слияния) в колбу с площадью 150 см2 (кат. №90150, ТРР). За три часа до трансфекции вся среда обновлялась. При полном объеме 1680 мкл смешивалось 60 мкг конструкции (маннан-связывающий лектин)/pREP плазмида ДНК (см. пример 1) с раствором NaCl концентрацией 150 мМ, ЭДТК концентрацией 1 мМ. Трис-HCl концентрацией 10 мМ (рН 7,12), CaCl2 концентрацией 268 мМ. Раствор ДНК с кальцием добавлялся в раствор, объемом 1680 мкл, содержащий HEPES концентрацией 50 мМ, NaCl концентрацией 250 мМ, Na2HPO4+NaH2PO4 концентрацией 1,5 мМ с уровнем рН, доведенным до 7,12. Клетки выдерживались в течение 14-16 ч с осаждением ДНК/Са·PO4, дважды промывались в фосфатном буфере и вновь выдерживались в среде RPMI-1640 (50 мл на емкость) с добавлением глютамина, антибиотиков (пенициллина и стрептомицина) и раствора инсулин-трансферрин-селен (ITS) (кат. №51300-44, GibcoBRL) в течение 6-8 суток.
ПРИМЕР 3
Очистка рекомбинантного маннан-связывающего лектина с использованием матриц, полученных из углеводородов
Гранулы Fractogel®TSK HW-75 (кат. №14985, Merck KgaA, Дармштат, Германия) активировались смешиванием 50 мл гранул с 50 мл раствора Na2CO3 концентрацией 0,5 мМ (рН 11) и 10 мл винилсульфона (кат. № V370-0, Alrich, Милуоки, шт.Висконсин, США) с последующей выдержкой с перемешиванием в течение 1,5 ч при комнатной температуре. Гранулы собирались на стеклянном фильтре и один раз промывались в воде и один раз в растворе Na2СО3 концентрацией 0,5 мМ (рН 11). Затем гранулы ресуспендировались в растворе Na2СО3 концентрацией 0,5 мМ (рН 11) и добавлялась манноза до получения конечной концентрации 10% (отношение массовой доли к объемной). Смесь выдерживалась с перемешиванием при комнатной температуре. После этого смесь промывалась в воде, остатки химически активных групп блокировались с помощью выдержки гранул в растворе этаноламина концентрацией 0,1 М (рН 9) в течение 2 ч. После промывки в воде и растворе TBS (трис-забуференный соляной раствор) гранулы TSK-75 набивались в хроматографическую колонку и промывались в 15 мл раствора глицина концентрацией 0,1 М (рН 3,0) и приводились в равновесие в растворе TBS-Tween 20 (трис-забуференный соляной раствор, содержащий 0,05% Tween 20 (трис-забуференный соляной раствор, содержащий 0,05% Tween 20 (отношение массовой доли к объемной)) и растворе CaCl2 до тех пор, пока не стабилизировалось поглощение излучения ультрафиолетового спектра. Культуральная среда из клеток трансфицированных конструкцией (маннан-связывающий лектин)/pREP9, очищенной центрифугированием при ускорении 5000 g, пропускалась через хроматографическую колонку с расходом 0,4 мл/мин. Колонка промывалась с использованием 75 мл раствора TBS и раствором CaCl2 концентрацией 2 мМ, и связанный рекомбинантный маннан-связывающий лектин элюировался в растворе TBS и ЭДТК концентрацией 5 мМ и собирался в фракции по 500 мкл. Для получения гранул Fractogel®TSK, с маннаном (очищенным от дрожжей как описано у Nakajima и Ballou, 1974 г.) гранулы активировались, как описано выше, и выдерживались в растворе Na2CO3 концентрацией 0,5 М (рН 11), содержащем 25 мг маннана на 1 мл раствора, после чего следовала такая же обработка, что и для приготовления гранул, полученных из маннозы. Гранулы сефарозы 4 В (кат. №17-0120-01, Pharmacia, Упсала, Швеция) были получены с маннозой и манноном, как это описано для гранул Fractogel®TSK. Элюат из трех матриц анализировался с помощью вестерн-блоттинга, как описано в примере А, путем загрузки 7 нг рекомбинантного маннан-связывающего лектина, очищенного гранулами манноза-TSK, гранулами маннан-TSK, гранулами манноза-сефароза и гранулами маннан-сефароза, на отдельные дорожки геля SDS-PAGE. Для сравнения на одну из дорожек был загружен ультрафракционированный супернатант культуры, соответствующий 7 нг рекомбинантного маннан-связывающего лектина. Результаты вестерн-блоттинга показаны на фигуре 4. (отношение массовой доли к объемной)) и растворе CaCl2 до тех пор, пока не стабилизировалось поглощение излучения ультрафиолетового спектра. Культуральная среда из клеток трансфицированных конструкцией (маннан-связывающий лектин)/pREP9, очищенной центрифугированием при ускорении 5000 g, пропускалась через хроматографическую колонку с расходом 0,4 мл/мин. Колонка промывалась с использованием 75 мл раствора TBS и раствором CaCl2 концентрацией 2 мМ, и связанный рекомбинантный маннан-связывающий лектин элюировался в растворе TBS и ЭДТК концентрацией 5 мМ и собирался в фракции по 500 мкл. Для получения гранул Fractogel®TSK, с маннаном (очищенным от дрожжей как описано у Nakajima и Ballou, 1974 г.) гранулы активировались, как описано выше, и выдерживались в растворе Na2CO3 концентрацией 0,5 М (рН 11), содержащем 25 мг маннана на 1 мл раствора, после чего следовала такая же обработка, что и для приготовления гранул, полученных из маннозы. Гранулы сефарозы 4 В (кат. №17-0120-01, Pharmacia, Упсала, Швеция) были получены с маннозой и манноном, как это описано для гранул Fractogel®TSK. Элюат из трех матриц анализировался с помощью вестерн-блоттинга, как описано в примере А, путем загрузки 7 нг рекомбинантного маннан-связывающего лектина, очищенного гранулами манноза-TSK, гранулами маннан-TSK, гранулами манноза-сефароза и гранулами маннан-сефароза, на отдельные дорожки геля SDS-PAGE. Для сравнения на одну из дорожек был загружен ультрафракционированный супернатант культуры, соответствующий 7 нг рекомбинантного маннан-связывающего лектина. Результаты вестерн-блоттинга показаны на фигуре 4.
ПРИМЕР 4
Анализ маннан-связывающего лектина в условиях, не приводящих к денатурации, с помощью гельпроникающей хроматографии
На хроматографической колонне Superose-6 (Superose-6 HR 10/30, кат. №17-0537-01, Pharmacia) выполнялась проникающая хроматография очищенного рекомбинантного маннан-связывающего лектина или культуральной среды, содержащей рекомбинантный маннан-связывающий лектин, приведенный в состояние равновесия в растворе ЭДТК концентрацией 5 мМ, и растворе TBS-Tween 20 HR 10/30, кат. №17-0537-01, Pharmacia) выполнялась проникающая хроматография очищенного рекомбинантного маннан-связывающего лектина или культуральной среды, содержащей рекомбинантный маннан-связывающий лектин, приведенный в состояние равновесия в растворе ЭДТК концентрацией 5 мМ, и растворе TBS-Tween 20 (трис-забуференный соляной раствор, содержащий 0,01% (об.) Tween 20 (трис-забуференный соляной раствор, содержащий 0,01% (об.) Tween 20 ) (рН 7,4). Образцы объемом 100 мкл пропускались через колонку с расходом 0,5 мл/мин. Фракции по 5 мл собирались в объемы по 250 мл. ) (рН 7,4). Образцы объемом 100 мкл пропускались через колонку с расходом 0,5 мл/мин. Фракции по 5 мл собирались в объемы по 250 мл.
ПРИМЕР 5
Анализ маннан-связывающего лектина в условиях, приводящих к денатурации, с помощью метода SDS-PAGE с серебряным окрашиванием
SDS-PAGE-гели с градиентом от 4 до 20% были приготовлены и использованы в электрофорезе, как это описано у авторов Jensen и др., 1997 г. Процедура серебряного окрашивания была заимствована у авторов Нестеренко и др., (1994 г.). Гели PAGE фиксировались в 100 мл 50% (об.) раствора ацетона, 6,25 мл трихлоруксусной кислоты, 0,85% (об.) формальдегида в течение 15 мин с последующей тройной промывкой в воде и еще одной промывкой в воде в течение 15 мин. Гель выдерживался в 100 мл 50% (об.) раствора ацетона в течение 15 мин, после чего выдерживался в течение 1 ч в растворе Na2S2О3 концентрацией 0,67 мМ и трижды промывался в воде. Пропитывание геля нитратом серебра выполнялось в растворе AgNO3 концентрацией 15 мМ, содержащего 0,9% (об.) формальдегида с последующей тройной промывкой в воде. Гель получали с помощью выдержки в растворе Na2CO3 концентрацией 0,19 мМ, включающего 0,9% (об.) формальдегида и Na2S2CO3 концентрацией 0,67 мМ, в течение приблизительно 3 мин. Процесс осаждения прекращался путем выдержки геля в течение 3 мин в 1% (об.) растворе уксусной кислоты с консервацией в 25% (об.) растворе этанола, 3% (об.) глицерина.
ПРИМЕР 6
Анализ рекомбинантного маннан-связывающего лектина с помощью метода SDS-PAGE с последующим вестерн-блоттингом
В соответствии с описанием, приведенным авторами Sambrook и др., были приготовлены трис-забуференный соляной раствор (TBS) и забуференный фосфатный соляной раствор (PBS) с уровнем рН, доведенным до 7,4. Для блокировки неспецифических белковых взаимодействий в забуференные растворы вводился раствор, содержащий 0,05% (об.) Tween 20 . SDS-PAGE-гели с градиентом от 4 до 20% были приготовлены и использованы в электрофорезе, как это описано у авторов Jensen и др., 1997 г. Рекомбинантный маннан-связывающий пектин массой 50 нг, полученный в соответствии с натоящим изобретением в клетках НЕК 293EBNA, рекомбинантный маннан-связывающий лектин массой 50 нг, полученный в соответствии со способом, описанным авторами Super и др., 1992 г., и маннан-связывающий лектин массой 50 нг, полученный из плазмы человека (МO012, (Государственный институт сыворотки, Копенгаген. Дания), были погружены в гель в среде, не обладающей восстановительной способностью. С помощью полусухого блоттинга в течение 60 В·ч в растворе на основе препарата трис концентрацией 50 мМ, содержащего 40 мМ глицина, 3,7% (отношение массовой доли к объемной) додецилсульфата натрия, 20% (об.) этанола выполнялась трансфекция белков на мембране Amersham’s Hybond . SDS-PAGE-гели с градиентом от 4 до 20% были приготовлены и использованы в электрофорезе, как это описано у авторов Jensen и др., 1997 г. Рекомбинантный маннан-связывающий пектин массой 50 нг, полученный в соответствии с натоящим изобретением в клетках НЕК 293EBNA, рекомбинантный маннан-связывающий лектин массой 50 нг, полученный в соответствии со способом, описанным авторами Super и др., 1992 г., и маннан-связывающий лектин массой 50 нг, полученный из плазмы человека (МO012, (Государственный институт сыворотки, Копенгаген. Дания), были погружены в гель в среде, не обладающей восстановительной способностью. С помощью полусухого блоттинга в течение 60 В·ч в растворе на основе препарата трис концентрацией 50 мМ, содержащего 40 мМ глицина, 3,7% (отношение массовой доли к объемной) додецилсульфата натрия, 20% (об.) этанола выполнялась трансфекция белков на мембране Amersham’s Hybond P. Неспецифические белковые взаимодействия блокировались путем выдержки мембраны в течение 1,5 ч в 0,1% растворе Tween 20 P. Неспецифические белковые взаимодействия блокировались путем выдержки мембраны в течение 1,5 ч в 0,1% растворе Tween 20 . Для обнаружения маннан-связывающего лектина мембрана выдерживалась при комнатной температуре в растворе, содержащем моноклональное антитело, выращенное против маннан-связывающего лектина человека (гибрид 131-1, (Государственный институт сыворотки, Копенгаген. Дания), разбавленное до концентрации 1 мкг/мл в трис-забуференном соляном растворе, содержащем 0,05% Tween 20 . Для обнаружения маннан-связывающего лектина мембрана выдерживалась при комнатной температуре в растворе, содержащем моноклональное антитело, выращенное против маннан-связывающего лектина человека (гибрид 131-1, (Государственный институт сыворотки, Копенгаген. Дания), разбавленное до концентрации 1 мкг/мл в трис-забуференном соляном растворе, содержащем 0,05% Tween 20 , 1 мМ ЭДТК, 1 мг HSA/мг (кат. №440511, (Государственный институт сыворотки, Копенгаген, Дания), 1 мг иммуноглобулина человека на 1 мл (кат. №007740, Centeon Pharma GmbH, Марбург, Германия). После трех промывок в трис-забуференном соляном растворе, содержащем Tween 20 , 1 мМ ЭДТК, 1 мг HSA/мг (кат. №440511, (Государственный институт сыворотки, Копенгаген, Дания), 1 мг иммуноглобулина человека на 1 мл (кат. №007740, Centeon Pharma GmbH, Марбург, Германия). После трех промывок в трис-забуференном соляном растворе, содержащем Tween 20 , мембрану выдерживали в течение 2 ч при комнатной температуре с пероксидазой хрена, конъюгированной с кроличьим антимышиным иммуноглобулином G (кат. № Р0260, Dako A/S, Копенгаген, Дания), разбавленной в соотношении 1:2500 в трис-забуференном соляном растворе, содержащем Tween 20 , мембрану выдерживали в течение 2 ч при комнатной температуре с пероксидазой хрена, конъюгированной с кроличьим антимышиным иммуноглобулином G (кат. № Р0260, Dako A/S, Копенгаген, Дания), разбавленной в соотношении 1:2500 в трис-забуференном соляном растворе, содержащем Tween 20 , 1 мМ ЭДТК и 100 мкг иммуноглобулина человека на 1 мл раствора. Наконец, мембрана промывалась 5 раз в трис-забуференном соляном растворе, содержащем Tween 20 , 1 мМ ЭДТК и 100 мкг иммуноглобулина человека на 1 мл раствора. Наконец, мембрана промывалась 5 раз в трис-забуференном соляном растворе, содержащем Tween 20 и проявлялась с помощью хемилюминисцентного субстрата фирмы Pierce’s (SuperSignal и проявлялась с помощью хемилюминисцентного субстрата фирмы Pierce’s (SuperSignal , кат. №34080, Pierce, Рокфорд, шт.Иллинойс, США) на фотографической пленке Кодак. , кат. №34080, Pierce, Рокфорд, шт.Иллинойс, США) на фотографической пленке Кодак.
ПРИМЕР 7
Анализ рекомбинантного маннан-связывающего лектина с помощью гельпроникающей хроматографии
На хроматографической колонне Superose-6 (Superose-6 HR 10/30, кат. №17-0537-01, Pharmacia) выполнялась гельпроникающая хроматография очищенного рекомбинантного маннан-связывающего лектина или культурной среды, содержащей рекомбинантный маннан-связывающий лектин, приведенный в состояние равновесия в растворе ЭДТК концентрацией 5 мМ, и растворе TBS-Tween 20 HR 10/30, кат. №17-0537-01, Pharmacia) выполнялась гельпроникающая хроматография очищенного рекомбинантного маннан-связывающего лектина или культурной среды, содержащей рекомбинантный маннан-связывающий лектин, приведенный в состояние равновесия в растворе ЭДТК концентрацией 5 мМ, и растворе TBS-Tween 20 (трис-забуференный соляной раствор, содержащий 0,01% (об.) Tween 20 (трис-забуференный соляной раствор, содержащий 0,01% (об.) Tween 20 ) (рН 7,4). Образцы объемом 100 мкл (соответствующие 100 нг рекомбинантного маннан-связывающего лектина или естественного маннан-связывающего лектина) пропускались через колонну с расходом 0,5 мл/мин. Фракции по 5 мл собирались в объемы по 250 мл. Фракции разбавлялись в соотношении 1:2 в трис-забуференном соляном растворе, содержащем Tween 20 ) (рН 7,4). Образцы объемом 100 мкл (соответствующие 100 нг рекомбинантного маннан-связывающего лектина или естественного маннан-связывающего лектина) пропускались через колонну с расходом 0,5 мл/мин. Фракции по 5 мл собирались в объемы по 250 мл. Фракции разбавлялись в соотношении 1:2 в трис-забуференном соляном растворе, содержащем Tween 20 . 10 мМ ЭДТК и анализировались методом TRIFMA (time resolved immunofluorescent assay – иммунофлуоресцентный анализ с разрешением по времени), как описано в примере 8. . 10 мМ ЭДТК и анализировались методом TRIFMA (time resolved immunofluorescent assay – иммунофлуоресцентный анализ с разрешением по времени), как описано в примере 8.
ПРИМЕР 8
Анализ рекомбинантного маннан-связывающего лектина с помощью метода TRIFMA (time resolved immunofluorescent assay – иммунофлуоресцентный анализ с разрешением по времени)
Микротировальные пластины Fluorosorp (кат. №437958, Nunc, Камструп, Дания) покрывались 100 мкл (на лунку) моноклонального антитела 131-1 против маннан-связывающего лектина (Государственный институт сыворотки. Копенгаген, Дания) при концентрации 5 мкг на 1 мл забуференного фосфатного соляного раствора (PBS) и трижды промывались в трис-забуференном соляном растворе, содержащем Tween 20 (кат. №437958, Nunc, Камструп, Дания) покрывались 100 мкл (на лунку) моноклонального антитела 131-1 против маннан-связывающего лектина (Государственный институт сыворотки. Копенгаген, Дания) при концентрации 5 мкг на 1 мл забуференного фосфатного соляного раствора (PBS) и трижды промывались в трис-забуференном соляном растворе, содержащем Tween 20 . Стандартная сыворотка с известным маннан-связывающим лектином концентрацией 3,6 мкг на 1 мл раствора разбавлялась в соотношении 1:20 в 20 мМ ЭДТК, трис-забуференном соляном растворе, содержащем Tween 20 . Стандартная сыворотка с известным маннан-связывающим лектином концентрацией 3,6 мкг на 1 мл раствора разбавлялась в соотношении 1:20 в 20 мМ ЭДТК, трис-забуференном соляном растворе, содержащем Tween 20 и при дальнейшем разбавлении в соотношении 1:5 использовалась в дублирующих лунках, содержащих по 100 мкл раствора. Использовались три контрольные сыворотки, разбавленные в соотношении 1:20 в трис-забуференном соляном растворе, содержащем Tween 20 и при дальнейшем разбавлении в соотношении 1:5 использовалась в дублирующих лунках, содержащих по 100 мкл раствора. Использовались три контрольные сыворотки, разбавленные в соотношении 1:20 в трис-забуференном соляном растворе, содержащем Tween 20 , ЭДТК: одна с высокой концентрацией маннан-связывающего лектина (1,2 мкг на 1 мл раствора), одна со средней концентрацией маннан-связывающа о лектина (250 нг на 1 мл раствора) и одна с низкой концентрацией маннан-связываюшего лектина (50 нг на 1 мл раствора). Сыворотка с дефицитом маннан-связывающего лектина также была разбавлена в соотношении 1:20 и добавлена на пластину в качестве контрольной пробы с отрицательным результатом. , ЭДТК: одна с высокой концентрацией маннан-связывающего лектина (1,2 мкг на 1 мл раствора), одна со средней концентрацией маннан-связывающа о лектина (250 нг на 1 мл раствора) и одна с низкой концентрацией маннан-связываюшего лектина (50 нг на 1 мл раствора). Сыворотка с дефицитом маннан-связывающего лектина также была разбавлена в соотношении 1:20 и добавлена на пластину в качестве контрольной пробы с отрицательным результатом.
Супернатанты культуры, либо содержащие FBS. либо не содержащие сыворотку, как обычно, разбавлялись в соотношении 1:20 и 1:100. После выдержки пластины трижды промывались в трис-забуференном соляном растворе, содержащем Tween 20 , и каждая лунка покрывалась 100 мкл моноклонального антитела 131-1 против маннан-связывающего лектина, меченного изотопом Eu3+ при концентрации 125 мкг на 1 мл трис-забуференноого соляного раствора, содержащего Tween 20 , и каждая лунка покрывалась 100 мкл моноклонального антитела 131-1 против маннан-связывающего лектина, меченного изотопом Eu3+ при концентрации 125 мкг на 1 мл трис-забуференноого соляного раствора, содержащего Tween 20 , 25 мкг ЭДТК. Меченое антитело получали в соответствии с протоколом фирмы Wallac (Wallac, Турку, Финляндия). Разработка и измерение связанного европия выполнялись в соответстви со стандартной процедурой для метода TRIFMA (Hemmila и др., 1993 г.). , 25 мкг ЭДТК. Меченое антитело получали в соответствии с протоколом фирмы Wallac (Wallac, Турку, Финляндия). Разработка и измерение связанного европия выполнялись в соответстви со стандартной процедурой для метода TRIFMA (Hemmila и др., 1993 г.).
Источники информации
Davies, E.J., Snowden, N., Hiliarby, M.C., Carthy, D., Grennan, D.M., Thomson, W. & W.E.Oilier (1995) Mannose-binding protein gene polymorphism in systemic lupus erythematosus. Arthritis. Rheum. 38:110-114.
Drickamer, K., J., Dordal, M.S. & L.Reynolds (1986) Mannose-binding proteins isolated from rat liver contain carbohydrate-recognition domains linked to collagenous tails. J. Biol. Chem. 261: 6878-6887.
Christiansen, O.B, Kilpatrick, D.C., Souter, V., Warming, K., Thiel, S. &J.C, Jensenius (1999) Mannan-binding lectin deficiency is associated with unexplained recurrent miscarriage. Scand. J. Immunol. 49:193-196.
van Emmerik, LC-.Kuijper, E.J., Fijen, C.A.P., Dankert, J. & S. Thiel (1994) Binding of mannan-binding protein to various bacterial pathogens of menigitis. Clin. Exp. Immunol. 97:411-416.
Garred, P., Richter, C., Andersen, A.B., Madsen, H.О., Mtoni, I., Svejgaard, A, & J. Shao (1997a) Mannan-binding lectin in the sub-saharan HIV and tuberculosis epidemics. Scand. J. Immunol. 46:204-208.
Garred, P., Madsen, H.О., Balslev, U., Hofmann, В., Pedersen, C., Gerstoft, J. &A. Svejgaard (1997b) Susceptibility to HIV infection and progression of AIDS in relation to variant alleles of mannose-binding lectin. Lancet 349:236-240.
Guo, N., Mogues, Т., Weremowicz, S., Morton, C.C. & K.N. Sastry (1998) The human ortholog of rhesus mannose-binding protein-A gene is an expressed pseudo-gene that localizes to chromosome 10. Mamm. Genome 9:246-249.
Hanahan, D. (1983) Studies on transformation of Escherichia coli with plasmids. J. Mol. Biol. 166:557-580.
Hartshorn, K.L., Sastry, K., Brown, D., White, M.R., Okarma, T.B-, Lee, Y.-M. &A.I. Tauber (1993) Conglutinin acts as an opsonin for influenza A viruses. J. Immunol. 151:6265-6273.
Haurum, J., Thiel, S., Jones, I.M., Fischer, P., Laursen, S.B. & J.C. Jensenius (1993) Complement activation upon binding of mannan-binding protein to HIV envelope glycoporteins. A/DS 7:1307-1313.
Hemmila, I., Mukkala, V.M., Latva, M. & P. Kiilholma (1993) Di- and tetracarboxylate derivatives of pyridines, bipyridines and terpyridines as luminogenic reagents for time-resolved fluorometric determination of terbium and dysprosium. J. Biochem. Biophys. Methods. 26:283-290
Holmskov, U., Holt, P., Reid, K.B.M., Willis, A.C., Teisner, B. & J.C. Jensenius (1993 a) Purification and characterization of bovine mannan-binding protein, Gtycobiology 3:147-153.
Holmskov, U., Malhotra, R., Sim, R.B. &J.C. Jensenius (1994) Coliectins: collagenous C-type lectins of the innate immune defense system. Immunol. Today 15:67-74.
Huang, Y., Kong, Y., Wang, Y., Qi, G. & C. Lu (1996) Stable expression of anti-HPV 16 E7-ribozyme in CV-1 cell lines. Chin. J. Biotechnol. 12:215-20.
lobst, S.T, Wormald, M.R., Weis, W.I., Dwek, R.A. & K. Drickamer (1994) Binding of sugar ligands to Ca(2+)-dependent animal lectins. 1. Analysis of mannose binding by site-directed mutagenesis and NMR. J. Biol. Chem. 269:15505-15511.
Ip, W.K-, Chan, S.Y., Lau, C.S. & Y. L lau (1998) Association of systemic lupus erythematosus with promoter polymorphisms of mannose-binding lectin gene. Arthritis Rheum 41:1663-1668.
Janeway, С.A., Travers, P., Walport, M. & J.D. Capra (1999) Immunobiology (4th ed.). Churchill Livingston, Edinburg, 634 pp.
Ji, Y.-H., Fujita, Т., Hatsuse, H., Takahashi, A., Matsushita, M. & M. Kawakami (1993) Activation of the C4 and C2 components of complement by a proteinase in serum bactericidal factor, ra-reactive factor. J. Immunol. 150:571-578.
Kawai, T., Su2uki, Y., Eda, S., Ohtani, K., Kase, Т., Sakamoto, Т., Uemura, H. & N. Wakamiya (1998) Molecular and biological characterization of rabbit mannan-binding protein. Glycobiology 8:237-244.
Kawasaki, Т., Etoh, R. & I. Yamashina (1978) Isolation and characterisation of a mannan-binding protein from rabbit liver. Biochem. Biophys. Res. Comm. 3:1018-1024.
Kilpatrick, D.C. (1997) Mannan binding protein is sera positive for rheumatoid factor. Br. J. Rhenmatol. 36:207-209.
Kuhlman, M., Joiner, K. & R.A.B. Ezekowitz (1989) The human mannose-binding protein function as an opsonin. J. Exp.Med. 169:1733-1745.
Kurata, H., Cheng. H.M., Kozutsumi, Y., Yokota, Y. & T. Kawasaki (1993) Role of the collagen-like domain of the human serum mannan-binding protein in the activation of complement and the secretion of this lectin. Biochem. Biophys. Res. Comm. 191:1204-1210.
Kurata, H., Sannoh, Т., Kozutsumi, Y., Yokota, Y. &T. Kawasaki (1994) Structure and function of mannan-binding proteins isolated from human liver and serum. J Biochem. 115:1148-1154.
Lau. Y.L, Lau, C.S-, Chan, S.Y., Karlberg, J. & M.W. Turner (1996) Mannose-binding protein in Chinese patients with systemic lupus erythematosus. Arthritis Rheum 39 706-708.
Laursen, S.B., Hedemand, J.E., Thiel, S., Wiilis, A.C., Skriver, E., Madsen, P.S. & J.C. Jensenius (1995) Collectin in a non-mammalian species: isolation and characterization of mannan-binding protein (MBP) from chicken serum. Glycobiology 5:553-561.
Laursen, S.B., Dalgaard, T.S., Thiel, S., Urn, B.L, Jensen, TV., Juul-Madsen, H.R., Takahashi, A., Hamana, Т., Kawakami, M. & J.C. Jensenius (1998) Cloning and sequencing of a cDNA encoding chicken mannan-binding lectin (MBL) and comparison with mammalian analogues. Immunology 93:421-430.
Law, S, K. A. & K.B.M. Reid (1995) Complement, IRL Press, Oxford.
Lipscombe, R.J., Lau, Y.L, Levinsky, R.J., Sumiya, M., Summerfield, J.A. & M.W. Turner (1992a) Identical point mutation leadjng to low levels of mannose binding protein and poor C3b mediated opsonisation in Chinese and Caucasian populations. Immunol. Lett. 32:253-257.
Lipscombe, R.J., Sumiya, M., Hill, A.V., Lau, Y.L, Levinsky, R.J., Summerfield, J.A. & M.W. Turner (1992b) High frequencies in African and non-African populations of independent mutations in the mannose binding protein gene. Hum. Mol. Genet. 1:709-715.
Lipscombe, R.J., Sumiya, M., Summerfield, J.A. & M.W. Turner (1995) Distinct physicochemical characteristics of human mannose-binding protein expressed by individuals of differing genotype, Immunology 85:660-667.
Lu, J, Thiel, S., Wiedemann, H., TimpI, R. & K.B.M. Reid (1990) Binding of the pentamer/hexamer forms of mannan-binding protein to zymosan activates the pro-enzyme C1r;?C1s2 complex, of the classical pathway of complement without involvement of C1q. J. Immumol. 144:2287-2294.
Ma, Y., Yokota, Y., Kozutsumi, Y. & T. Kawasaki (1996) Structural and functional roles of the amino-terminal region and collagen-like domain of human serum mannan-binding protein. Biochem. Mol. Biol. Int. 40:965-974.
Ma, Y., H. Shida & T. Kawasaki (1997) Functional expression of human mannan-binding proteins (MBPs) in human hepatoma cell lines infected by recombinant vaccinia virus: post-translationat modification, molecular assembly, and differentiation of serum an liver MBP. J.Biochem. (Tokyo) 122: 810-818.
Ma, Y., Uemura, K., Oka, S., Kozutsumi, Y., Kawasaki, N. & T. Kawasaki (1999) Antitumor activity of mannan-binding protein in vivo as revealed by a virus expression system: mannan-binding protein-dependent cell-mediated cytotoxicity. PNAS 96:371-375.
Madsen, H.O, Garred, P., Kurtzhals, J.A., Lamm, L.U., Ryder, L.P., Thiel, S. & A. Svejgaard (1994) A new frequent allele is the missing link in the structural polymorphism of the human mannan-binding protein. Immunogenetics 40:37-44.
Madsen, H.O., Garred, P., Thiel, S., Kurtzhals, J.A., Lamm, L.U., Ryder, L.P., &A. Svejgaard (1995) Interplay between promoter and structural gene variants control basal serum level of mannan-binding protein. J. Immunol. 155:3013-3020.
Malhotra, R., Haurum, J.S., Thiel, S. & R.B. Sim (1994) Binding of human collectins (SP-A and MBP) to influenza virus, Biochem. J. 304:455-461.
Matsushita, M. & T. Fujita (1992a) Activation of the classical complement pathway by mannose-binding protein in association with a novel ds-like protease. J. Exp.Med. 176:1497-1502.
Matsushita, M., Ezekowitz. R.A.B. & T. Fujita (1995a) The Gly-54  Asp allelic form of human mannose-binding protein (MBP) fails to bind MBL-associated serine pro-tease. B/oc/7em.J. 311:1021-1023. Asp allelic form of human mannose-binding protein (MBP) fails to bind MBL-associated serine pro-tease. B/oc/7em.J. 311:1021-1023.
Mizuno, Y., Kozutmi, Y,, Kawasaki, T. & I. Yamashina (1981) Isolation and characterization of a mannan-binding protein from rat liver. J. Biol. Chem. 256:4247-4252.
Mogues, Т., Ota, Т., Tauber, A.I. & K.N. Sastry (1996) Characterization of two man-nose-binding protein cDNAs from rhesus monkey (Macaca mulatta): structure and evolutionary implications. Glycobiology 6:543-550.
Makrides, S.C., “Components of vectors for Gene Transfer and Expression in Mammalian Cells”.
Nakajima, T. & C.E. Ballou (1974) Characterization of the carbohydrate fragments obtained from Saccharomyces cerevisiae mannan by alkaline degradation. J. Biol. Chem. 249:7679-7684.
Ng, K.K., Drickamer, K. & W.I. Weis (1996) Structural analysis of monosaccharide recognition by rat fiver mannose-binding protein. J. Biol. Chem. 271:663-674.
Nielsen, S.L, Andersen, P.L, Koch, C., Jensenius, J.C. & S. Thiel (1995) The level of the serum opsonin, mannan-binding protein in HIV-1 antibody-positive patients. Clin. Exp.Med. 100:219-222.
Ohta, M., Okada, M., Yamashina, I. & T. Kawasaki (1989) The mechanism of carbo-hydrate-mediated complement activation by the serum mannan-binding protein. J. Biol. Chem. 265:1980-1984.
Ohtani, K., Suzuki, Y., Eda, S., Kawai, Т., Kase, Т., Keshi, H., Sakai, Y., Yamamoto, S., Sakamoto, T. & N. Wakamiya (1999) High-level and effective production of human mannan-binding lectin (MBL) in Chinese hamster ovary (CHO) cells. J. Immunol. Methods. 222:135-44.
Oka, S., Ikeda, K., Kawasaki, T. & I. Yamashina (1985) Isolation and characterization of mannan-binding proteins from chicken liver. Arch. Biochem. Biophys. 241:95-105.
Oka, S., Ikeda, K., Kawasaki, Т. & I. Yamashina (1988) Isolation and characterization of two distinct mannan-binding proteins from rat serum. Arch. Biochem. Biophys. 260:257-266.
Pastinen, Т., Liitsola, К,, Niini, P., Saiminen, M. & A.-C. Syvanen (1998) Contribution of the CCR5 and MBL genes to susceptibility to HIV type 1 infection in the Finnish population. AIDS Res. Hum. Retroviruses 14:695-698.
Reddy, P.S. & R.B. Corley (1998) Assembly, sorting, and exit of oligomeric proteins from the endoplasmic reticulum. Bioassays 20:546-554.
Sastry, K., Herman, G.A., Day, L., Deignan, E., Bruns, G., Morton, C.C. & R.A.B, Ezekowitz (1989) The human mannose-binding protein gene. J. Exp.Med. 170:1175-1189.
Sato, Т., Endo, Y., Matsushita, M. & T. Fujita (1994) Molecular characterization of a novel serine protease involved in activation of the complement system by mannose-binding protein. Inf. Immunol. 6:665-669.
Schweinie, J.E., Nishiyasu, M., Ding, T.Q., Sastry, K., Gillies, S.D. & R.A.B, Ezekowitz (1993) Truncated forms of mannose-binding protein multimerize and bind to mannose-rich salmonella montevideo but fail to activate complement in vitro. J. Biol. Chem. 268:364-370.
Sheriff, S., Cnang, C.Y. & R.A.B. Ezekowitz (1994) Human mannose-binding protein carbohydrate recognition domain trimerizes through a triple a-helical coiled-coil. Structural biol. 1:789-794.
Soothill, J.F. & B.A. Harvey (1976) Defective opsonization. A common immunity deficiency. Arch. Dis. Child. 51:91-99.
Stover, C.M., Thiel, S., Thelen, M., Lynch, N.J., Vorup-Jensen, Т., Jensenius. J.C. & W.J. Schwaeble (1999) Two constituents of the initiation complex of the mannan-binding lectin activation pathway of complement are encoded by a single structural gene. J. Immunol. 162:3481-3490.
Sumiya, S., Super, M., Tabona, P., Levinsky, R.J., Arai, Т., Turner, M.W. & J.A. Summerfield (1991) Molecular basis of opsonic defect in immunodeficient children. Lancet 337:1569-1570.
Super, M., Thiel, S., Lu, J., Levinsky, R.J. & M.W. Turner (1989) Association of low levels of mannan-binding protein with a common defect opsonisation. Lancet ii: 1236-1239.
Super, M., Gillies, S.D., Foley, S., Sastry, K., Schweinie, J.E., Silverman, V.J. and R.A.B. Ezekowitz (1992) Distinct and overlapping functions of allelic forms for human mannose-binding protein. Nature Genet. 2:50-55.
Tabona, P., Mellor, A. & J.A. Summerfield (1995) Mannose binding protein is involved in first-line host defence: evidence from transgenic mice. Immunology 85:153-159.
Takada, F., Takayama, Y., Hatsuse, H. & M. Kawakami (1993) A new member of the С1s family of complement proteins found in a bactericidal factor, ra-reactive factor, in human serum. Biochem. Biophys. Res. Commun. 196:1003-1009.
Takayama, Y., P.Takada, Takahashi, A. and M.Kawakami (1994) A 100-kDa protein in the C4-activating component of ra-reactive factor is a new serine protease having module organisation similar to Cirand С Is. J. Immuriol. 152: 2308-2316.
Tan, F.K. & F.C.Arnett (1998) The genetics of lupus. Curr. Opin. Rheumafol. 10:399-408.
Taylor, M.E., Brickell, P.M., Craig, R.K. & J.A. Summerfield (1989) Structure and evolutionary origin of the gene encoding a human serum mannose-binding protein. Biochem. J. 262:763-771.
Thiel, S., Vorup-Jensen, Т., Stover, CM, Schwaeble, W., Laursen, S.B., Poulsen, K., Willis, A.C-, Eggleton, P., Hansen, S., Holmskov, U, Reid, K.B. &J.C. Jensenius (1997). A second serine protease associated with mannan-binding lectin that activates complement. Nature 386:506-510.
Turner, M.W. (1996) Mannose-binding Iectin: the pluripotent molecule of the innate immune system. Immunol. Today 17:532-540.
Valdimarsson, H., Stefansson, M., Vikingsdottir, Т., Arason, G.J., Koch, C., Thiel, S. & J.C. Jensenius (1998) Reconstitution of opsonizing activity by infusion of mannan-binding lectin (MBL) to MBL-deficient humans. Scand. J. Immunol. 48:116-23.
Vorup-Jensen, Т., Jensenius, J.C. & S. Thiel (1998) MASP-2, the C3 convertase generating protease of the MBLectin complement activating pathway. Immunobiology 199: 348-357.
Voss, Т., Melcher&, К., Scheirle, G. &-K.P,-Schafer (1991) Structural comparison of recombinant pulmonary surfactant protein SP-A derived from two human coding sequences: implications for the chain composition of natural human SP-A. Am. J. Respir. Cell Mol. Biol. 4:88-94.
Weis, W.I., Drickamer, K. & W.A. Hendrickson (1992) Structure of a C-type mannose-binding protein complexed with an oligosaccharide. Nature 360:127-134.
Weis, W.I. & K. Drickamer (1994) Trimeric structure of a C-type mannose-binding protein. Structure 2:1227-1240.
Надписи к фигурам
Фиг.1, Фиг. 2, Фиг.3
1 – концентрация маннан-связывающего лектина, мкг/мл
2 – объем элюирования, мл
3 – клетки Sp2/0Ag14
4 – НЕК 293EBNA
5 – естественный маннан-связывающий лектин
Фиг.4.
1 – гранулы манноза-TSK
2 – гранулы маннан-TSK
3 – сефароза 4В
4 – гранулы манноза-сефароза
5 – гранулы маннан-сефароза
6 – супернатант нефракционированной культуры из клеток трансфицированных структурой (маннан-связывающий лектин)/pREP9
Фиг.5.
1 – клетки Sp2/0Ag14
2 – НЕК 293EBNA
3 – естественный маннан-связывающий лектин


Формула изобретения
1. Способ получения состава рекомбинантного маннан-связывающего лектина человека с таким профилем распределения размеров молекул, при котором средняя молекулярная масса, по крайней мере, 50% олигомеров превышает 200 кДа, включающий следующие этапы:
создание конструкции для экспрессии гена, кодирующего пептид маннан-связывающего лектина человека или его функциональный эквивалент;
трансформацию культуры клетки-хозяина с помощью этой конструкции;
культивирование культуры клетки-хозяина таким образом, что происходит экспрессия и выделение полипептида в культуральную среду;
афинную хроматографию указанной культуральной среды с использованием матрицы, производной углеводорода, не имеющей по существу сродства с субъединицами маннан-связывающего лектина человека и/или димерами субъединиц, где указанная матрица, полученная из углеводорода, имеет по существу сродство только с тетрамерами, пентамерами и/или гексамерами субъединиц рекомбинантного маннан-связывающего лектина человека, или матрицы, свободной от углеводорода;
получение элюата, содержащего состав рекомбинантного маннан-связывающего лектина человека, где средняя молекулярная масса по крайней мере 50% олигомеров превышает 200 кДа.
2. Способ по п.1, отличающийся тем, что конструкция для экспрессии гена включает в себя, по крайней мере, одну интронную последовательность из гена маннан-связывающего лектина человека или его функционального эквивалента.
3. Способ по п.1, отличающийся тем, что конструкция для экспрессии гена включает в себя, по крайней мере, две экзонные последовательности из гена маннан-связывающего лектина человека или его функционального эквивалента.
4. Способ по п.1, отличающийся тем, что конструкция для экспрессии гена содержит последовательность, комплементарную последовательности ДНК, кодирующей субъединицу маннан-связывающего лектина или его функционального эквивалента.
5. Способ по п.1, отличающийся тем, что культуру клетки-хозяина выращивают in vitro.
6. Способ по п.1, отличающийся тем, что культура клетки-хозяина является эукариотом.
7. Способ по п.1, отличающийся тем, что культура клетки-хозяина является клеткой млекопитающего.
8. Способ выделения состава олигомеров маннан-связывающего лектина человека с таким профилем распределения размеров молекул, при котором средняя молекулярная масса хотя бы 50% олигомеров превышает 200 кДа, предусматривающий:
получение состава олигомеров маннан-связывающего лектина человека;
аффинную хроматографию упомянутого состава с использованием матрицы, полученной из углеводорода, не имеющей по существу сродства с субъединицами маннан-связывающего лектина человека и/или димерами субъединиц, где указанная матрица, полученная из углеводорода, имеет по существу сродство только с тетрамерами, пентамерами и/или гексамерами субъединиц рекомбинантного маннан-связывающего лектина человека, или матрицы, свободной от углеводорода;
получение элюата, содержащего состав выделенного рекомбинантного маннан-связывающего лектина человека.
9. Способ по любому из предыдущих пунктов, отличающийся тем, что матрица как таковая свободна от углеводорода.
10. Способ по п.9, отличающийся тем, что матрица состоит из не углеводородного полимерного материала.
11. Способ по п.10, отличающийся тем, что матрица состоит из пластиковых гранул.
12. Способ по любому из предыдущих пунктов, отличающийся тем, что выделение полипептидного состава выполняется на матрице, полученной из гексозы.
13. Способ по любому из предыдущих пунктов, отличающийся тем, что выделение полипептидного состава выполняется на матрице, полученной из маннозы.
14. Способ по любому из предыдущих пунктов, отличающийся тем, что матрица, полученная из углеводорода, не имеет по существу сродства с димерами субъединиц маннан-связывающего лектина.
15. Способ по любому из предыдущих пунктов, отличающийся тем, что матрица, полученная из углеводорода, имеет по существу сродство только с тетрамерами, пентамерами и/или гексамерами субъединиц рекомбинантного маннан-связывающего лектина.
16. Способ по любому из предыдущих пунктов, отличающийся тем, что матрица, полученная из углеводорода, имеет по существу сродство только с тетрамерами субъединиц рекомбинантного маннан-связывающего лектина.
17. Способ по любому из предыдущих пунктов, отличающийся тем, что матрица, полученная из углеводорода, имеет по существу сродство только с пентамерами субъединиц рекомбинантного маннан-связывающего лектина.
18. Способ по любому из предыдущих пунктов, отличающийся тем, что матрица, полученная из углеводорода, имеет по существу сродство только с гексамерами субъединиц рекомбинантного маннан-связывающего лектина.
19. Способ по любому из предыдущих пунктов, отличающийся тем, что средняя молекулярная масса, по крайней мере, 70% олигомеров превышает 200 кДа.
20. Способ по любому из предыдущих пунктов, отличающийся тем, что средняя молекулярная масса, по крайней мере, 80% олигомеров превышает 200 кДа.
21. Способ по любому из предыдущих пунктов, отличающийся тем, что средняя молекулярная масса, по крайней мере, 90% олигомеров превышает 200 кДа.
22. Способ по любому из предыдущих пунктов, отличающийся тем, что средняя молекулярная масса, по крайней мере, 99% олигомеров превышает 200 кДа.
23. Способ получения состава рекомбинантного маннан-связывающего лектина человека с таким профилем распределения размеров молекул, при котором средняя молекулярная масса хотя бы 50% олигомеров превышает 200 кДа, включающий следующие этапы:
создание конструкции для экспрессии гена, кодирующего полипептид маннан-связывающего лектина человека, в состав которой входят:
по крайней мере, одна интронная последовательность гена маннан-связывающего лектина человека или его функционального эквивалента;
по крайней мере, одна экзонная последовательность гена маннан-связывающего лектина человека или его функционального эквивалента;
область промотора, отличная от промотора маннан-связывающего лектина человека; и
вектор экспрессии;
трансформацию культуры клетки-хозяина с помощью этой конструкции;
культивирование культуры клетки-хозяина, таким образом, что происходит экспрессия и выделение полипептида в культуральную среду, после чего следует;
получение культуральной среды, содержащей рекомбинантный маннан-связывающий лектин человека;
очистка рекомбинантного маннан-связывающего лектина человека от указанной культуральной среды.
24. Конструкция для экспрессии гена, кодирующего полипептид рекомбинантного маннан-связывающего лектина человека, который является компонентом состава маннан-связывающего лектина, имеющего такой профиль распределения размеров молекул, при котором средняя молекулярная масса хотя бы 50% олигомеров превышает 200 кДа, в состав которой входят:
по крайней мере, одна интронная последовательность гена маннан-связывающего лектина человека или его функционального эквивалента.
по крайней мере, одна экзонная последовательность гена маннан-связывающего лектина человека или его функционального эквивалента;
область промотора, отличная от промотора маннан-связывающего лектина человека;
вектор экспрессии.
25. Конструкция для экспрессии гена по п.24, отличающаяся тем, что область промотора выбирают из генов эукариотов, таких как млекопитающие и насекомые.
26. Конструкция для экспрессии гена по п.24, отличающаяся тем, что область промотора выбирают из вирусных генов.
27. Конструкция для экспрессии гена по п.26, отличающаяся тем, что область промотора выбирают из группы, включающей промотор длинного концевого (терминального) повтора вируса саркомы Rous, предранний промотор цитомегаловируса и альфа промотор фактора элонгации 1.
28. Конструкция для экспрессии гена по п.24, отличающаяся тем, что область промотора выбирают из генов микроорганизмов, таких как вирусы, дрожжи или бактерии.
29. Конструкция для экспрессии гена по п.24, отличающаяся тем, что область промотора содержит энхансерные элементы.
30. Конструкция для экспрессии гена по п.24, отличающаяся тем, что в качестве вектора используют вектор pREP9.
31. Способ получения рекомбинантного маннан-связывающего лектина человека, который является компонентом состава маннан-связывающего лектина, имеющего такой профиль распределения размеров молекул, при котором средняя молекулярная масса хотя бы 50% олигомеров превышает 200 кДа, предусматривающий следующие этапы:
создание конструкции для экспрессии гена по одному из пп.24-30, кодирующей полипептид маннан-связывающего лектина человека или его функциональный эквивалент;
трансформацию культуры клетки-хозяина с помощью этой конструкции;
культивирование культуры клетки-хозяина таким образом, что происходит экспрессия и выделение полипептида в культуральную среду, после чего следует:
получение культуральной среды, содержащей рекомбинантный маннан-связывающий лектин человека.
32. Фармацевтическая композиция для лечения состояний, ассоциированных с дефицитом маннан-связывающего пектина, содержащая фармацевтически приемлемое вещество-носитель и состав рекомбинантного маннан-связывающего лектина человека, по крайней мере 50% олигомеров которого имеют молекулярный вес более 200 кДа и где указанная композиция является по существу свободной от примесей, естественным образом ассоциированных с маннан-связывающим пектином человека, получаемом в собственном организме хозяина.
33. Фармацевтическая композиция по п.32, отличающаяся тем что, по крайней мере, 70% олигомеров имеют молекулярный вес более 200 кДа.
34. Фармацевтическая композиция по п.32, отличающаяся тем, что, по крайней мере, 80% олигомеров имеют молекулярный вес более 200 кДа.
35. Фармацевтическая композиция по п.32, отличающаяся тем, что, соотношение тетрамеров, пентамеров и/или гексамеров к димерам субъединиц маннан-связывающего лектина человека составляет, по крайней мере, 2:1, преимущественно, по крайней мере, 5:1.
36. Фармацевтическая композиция по любому из пп.32-35, отличающаяся тем, что распределение размера молекул оценивается с помощью метода SDS-PAGE и/или вестерн блоттинга.
37. Фармацевтическая композиция по любому из пп.32-36, находящаяся в не-денатурированном состоянии.
38. Фармацевтическая композиция по любому из пп.32-36, находящаяся в денатурированном состоянии.
39. Фармацевтическая композиция по п.32, отличающаяся тем, что субъединица маннан-связывающего лектина состоит из трех пептидных последовательностей, в состав которых входит последовательность SEQ ID NO:1 или ее функциональный эквивалент.
40. Композиция по п.32 в форме, подходящей для инъекций.
41. Композиция по п.32 в форме, отличающаяся тем, что веществом носителем является соляной раствор, альбумин сыворотки человека или манноза.
42. Композиция по п.32 в форме, подходящей для введения через легкие.
43. Композиция по п.32 в форме порошка для ингаляции.
44. Композиция по п.32 в форме крема или лосьона для местного применения.
45. Композиция по любому из пп.32-40 для внутривенного, внутримышечного, подкожного или внутрикожного введения.
46. Конструкция для экспрессии гена, охарактеризованная в пп.24-30 для получения состава рекомбинантного маннан-связывающего лектина человека.
47. Состав рекомбинантного маннан-связывающего лектина человека, полученный способом по любому из пп.1-7, 23 или 31 для профилактики или лечения состояний, ассоциированных с дефицитом маннан-связывающего лектина.
Приоритет по пунктам:
14.05.1999 по пп.1, 7-8, 23-25, 27, 31-32, 42, 45-46;
10.05.2000 по пп.2-6, 9-22, 26, 28-30, 33-41, 43-44;
20.10.1999 по п.47.
РИСУНКИ
|
|