Патент на изобретение №2292206
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ТЕРАПЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АМЛОДИПИНА И БЕНАЗЕПРИЛА/БЕНАЗЕПРИЛАТА
(57) Реферат:
Описана комбинация амлодипина и ингибитора ангиотензинконвертирующего фермента, выбранного из беназеприла и беназеприлата, для изготовления лекарственного средства, предназначенного для лечения гипертензии. Количество амлодипина соответствует количеству свободного основания от 6 мг до 10 мг и количество беназеприла/беназеприлата соответствует количеству гидрохлорида беназеприла до 40 мг. Комбинация амлодипина и беназеприла обеспечивает более эффективную регуляцию кровяного давления по сравнению с использованием только одного из компонентов. 8 н. и 20 з.п. ф-лы.
Блокаторы кальциевых каналов (БКК) и ингибиторы ангиотензинконвертирующего фермента (ИАКФ) находят широкое применение при лечении гипертензии и связанных с ней заболеваний и состояний. Представителем класса БКК является амлодипин, а представителем класса ИАКФ является беназеприл или беназеприлат. Амлодипин представляет собой 3-этиловый 5-метиловый эфир 2-[(2-аминоэтокси)метил]-4-(2-хлорфенил)-1,4-дигидро-6-метил-3,5-пиридиндикарбоновой кислоты. Он поступает в продажу в форме соли безилата под торговой маркой NORVASCR в качестве гипотензивного средства. Амлодипин можно вводить в свободной форме или в форме фармацевтически приемлемой соли. Если не указано иное, лекарственные формы амлодипина, указанные в описании заявки, содержат амлодипин в количестве, эквивалентном свободному основанию амлодипина, независимо от типа используемой соли. Известно, что гипотензивная терапия хронической гипертензии амлодипином часто связана с побочным действием, таким как дозозависимый периферический отек, прежде всего голеностопного сустава. Амлодипин индуцирует отек голеностопного сустава, например, благодаря предпочтительному расширению предкапиллярных артериол нижних конечностей и как следствие оттоку жидкости в интерстициальное пространство. Верхний предел доз при монотерапии амлодипином составляет 10 мг в сутки, а более низкие дозы предпочтительны при лечении хронических заболеваний. Составы, содержащие дозу выше 10 мг в сутки, не утверждены контролирующими органами или не поступают в продажу, поскольку у многих чувствительных индивидов амлодипин вызывает побочные действия, такие как указанные выше, что в конечном счете может привести к прекращению лечения. Термин “высокая доза” или “более высокая доза” амлодипина, используемый в описании заявки, означает суточные дозы выше 5 мг амлодипина, предпочтительно от 6 до 40 мг, более предпочтительно 7,5-20 мг, например 7,5, 10, 15 или 20 мг, более предпочтительно по меньшей мере 10 мг, например, 10, 12,5, 15 или 20 мг, наиболее предпочтительно 10 или 20 мг. Для ежедневного введения предпочтительны дозы 10-60 мг, предпочтительно от 20 до 40 мг, например 20, 30 или 40 мг, прежде всего 40 мг. Беназеприл представляет собой [S-(R*,R*)]-3-[[1-(этоксикарбонил)-3-фенилпропил]амино]-2,3,4,5-тетрагидро-2-оксо-1Н-1-беназепин-1-уксусную кислоту. Он поступает в продажу в форме соли гидрохлорида под торговой маркой LOTENSINR или CIBACENR в качестве гипотензивного средства. Беназеприлат представляет собой дикарбоновую кислоту, образующуся при расщеплении сложноэфирной группы беназеприла, и является активным метаболитом беназеприла. Беназеприл и беназеприлат можно вводить в свободной форме или в форме фармацевтически приемлемой соли. Если не указано иное, лекарственные формы беназеприла, указанные в описании заявки, содержат беназеприл или беназеприлат в количестве, эквивалентном гидрохлориду беназеприла, независимо от типа используемой соли. При терапии с использованием беназеприла или его фармацевтически приемлемой соли или беназеприлата доза составляет от 10 мг до 80 мг в сутки. Однако, ингибиторы АКФ малоэффективны в организме некавказских популяций, прежде всего в организме афроамериканцев и пациентов с уже ослабленной системой ренин-ангиотензин-альдостерон (РААС). Термин “высокая доза” или “более высокая доза” беназеприла, используемый в описании заявки, означает дозы, соответствующие количеству гидрохлорида беназеприла выше 20 мг, предпочтительно от 21 мг до 160 мг, предпочтительно от 40 мг до 80 мг, например, 40 мг или 80 мг. Дозы этого лекарственного средства можно вводить ежедневно в сочетании с амлодипином в тот же день или на следующий день после введения амлодипина. В обоих случаях количество беназеприла предпочтительно остается постоянным. Комбинации стандартных доз амлодипина и беназеприла являются коммерческими продуктами под торговым названием LotrelR. Соответствующие количества активных ингредиентов составляют 2,5 мг амлодипина и 10 мг беназеприла, 5 мг амлодипина и 10 мг беназеприла, 5 мг амлодипина и 20 мг беназеприла, причем количество амлодипина соответствует количеству свободного основания, а количество беназеприла соответствует количеству его гидрохлрида. Термин “комбинация LotrelR“, используемый в описании заявки, относится к указанным комбинациям. Существует очевидная необходимость в разработке комбинации, включающей более высокое количество БКК и/или ИАКФ, не только более эффективно регулирующей кровяное давление, но и обладающей неожиданными и даже более ценными преимуществами по сравнению с комбинациями, содержащими более низкие дозы амлодипина и беназеприла. Такие преимущества включают возможность применения комбинации при терапии хронических заболеваний, например, исключение побочных действий, вызванных высокими дозами амлодипина, и достижения других положительных эффектов. Неожиданно оказалось, что введение комбинации, содержащей высокие дозы амлодипина и беназеприла, обладает существенно более ценными преимуществами по сравнению с известными комбинациями низких доз, выпускаемыми различными фирмами. Лечебная комбинация амлодипина и беназеприла, приведенная в описании заявки, включает введение указанных соединений таким образом, что комбинацию амлодипина и беназеприла можно вводить ежедневно. Если комбинация вводится ежедневно, на следующий день необязательно можно вводить лишь один беназеприл. Соответственно, пациенты получают лекарственные формы, включающие (I) комбинации амлодипина и беназеприла и (II) лекарственные формы, включающие беназеприл в качестве активного ингредиента, или плацебо, причем в каждом случае две лекарственные формы могут выпускаться в виде набора компонентов, как описано ниже. Например, упаковки могут включать суточные дозы соответствующих активных ингредиентов в дозирующем устройстве, блистерной упаковке или в другой пригодной упаковке, и инструкции, в которых рекомендуется прием соответствующих таблеток через день или другой способ введения в соответствии с назначенной схемой приема лекарственного средства. В другом варианте изобретения высокая доза амлодипина может чередоваться с более низкими дозами этого лекарственного средства в суточном режиме в сочетании с ежедневным приемом беназеприла. Обычно суточный уровень доз беназеприла в этом режиме должен оставаться постоянным. Комбинация, включающая высокие дозы амлодипина и беназеприла или беназеприлата, соответственно, указанная в описании заявки, обеспечивает при полном отсутствии побочных действий неожиданно благоприятные эффекты, включающие, без ограничения перечисленным, например, (I) более эффективную регуляцию кровяного давления (систолического или диастолического кровяного давления в отдельности или вместе), прежде всего в организме пациентов, у которых не наблюдается нормального или оптимального уровней кровяного давления в соответствии с методическими рекомендациями ВОЗ по лечению гипертензии; (II) подавление, предотвращение, ослабление или замедление побочных эффектов, связанных с использованием амлодипина, таких как дозозависимое образование периферического отека, например, отека голеностопа; (III) снижение нагрузки; (IV) защита чувствительных окончаний, прежде всего при лечении стенокардии; и (V) подавление, предотвращение, ослабление или снижение риска или частоты заболеваемости или случаев смертности, прежде всего заболеваемости и смертности, связанной с атеросклерозом. Предпочтительную группу больных для применения комбинации по настоящему изобретению выбирают среди (I) пациентов, у которых не наблюдается нормального или оптимального уровней кровяного давления в соответствии с методическими рекомендациями ВОЗ по лечению гипертензии от 1999 г. (см. J. Hypertens, 17, 151-183 (1999)); (II) пациентов со стенокардией, которые нуждаются в более тщательном лечении стенокардии или регуляции кровяного давления, или в том и другом; (III) пациентов с сердечной недостаточностью, прежде всего с застойной сердечной недостаточностью, которые нуждаются в более эффективном регулировании кровяного давления; (IV) пациентов, страдающих от заболевания легких или легочной гипертензии. Эти неожиданные и ценные эффекты можно доказать при проведении соответствующих клинических испытаний или в опытах на соответствующих моделях при испытании на животных. Например, на клинических испытаниях при введении комбинации по настоящему изобретению в сравнении с комбинацией LotrelR выявляется положительный ответ, наблюдается снижение побочного действия и более явно выраженный эффект снижения кровяного давления у пациентов с различными категориями гипертензии, такими как острая гипертензия (Согласно ВОЗ, пациенты, у которых наблюдается систолическое кровяное давление (СКД) Соответствующие клинические испытания можно проводить, например, с использованием двойного контроля, методом случайной выборки, при контроле с использованием плацебо, методом динамического титрования, методом параллельных групп. Например, после двух недель промывки организма и двух недель подготовки к испытаниям при одноразовом приеме плацебо со случайной выборкой, пациенты в течение 6 недель методом случайной выборки получают комбинацию LotrelR (например, 5 мг амлодипина в расчете на свободное основание и 20 мг беназеприла в расчете на гидрохлорид беназеприла) или комбинацию по настоящему изобретению (например, 10 мг амлодипина в расчете на свободное основание и 20 мг беназеприла в расчете на свободное основание); пациенты, получавшие плацебо, продолжают получать плацебо в течение всех 8 недель. Затем определяют эффективность действия, т.е. изменение кровяного давления от базовой линии до конечного значения, а также оценивают безопасность лечения, например признаки возможных побочных действий. Комбинацию по настоящему изобретению можно использовать для лечения (острых и прежде всего хронических заболеваний) или профилактики или замедления развития состояния, выбранного из группы, включающей гипертензию (злокачественную, первичную артериальную, вазоренальную, диабетическую, изолированную систолическую или прочие симптоматические, вторичного типа), сердечную недостаточность, такую как застойная сердечная недостаточность, стенокардию (стабильную или нестабильную), инфаркт миокарда, атеросклероз, диабетическую нефропатию, диабетическую сердечную миопатию, почечную недостаточность, заболевание периферических сосудов, дисфункцию левого желудочка, такую как гипертрофия левого желудочка, дисфункцию познавательной способности (такую, как болезнь Альцгеймера и т.п.), цереброваскулярное заболевание, связанное с нарушением кровяного давления, инсульт, легочное заболевание или легочную гипертензию и головную боль. Комбинацию по изобретению можно использовать для профилактики, подавления, ослабления или замедления развития побочных эффектов, связанных с применением высоких доз амлодипина; и для защиты чувствительных окончаний (органов), включая почки и сердце, например, защиту от левой вентрикулярной гипертрофии, правой вентрикулярной гипертрофии, например, связанной с легочной гипертензией, и т.п. Настоящее изобретение относится к применению комбинации, включающей (1) ингибитор АКФ, выбранный из группы, включающей беназеприл, беназеприлат и их фармацевтически приемлемые соли, и (2) амлодипин или его фармацевтически приемлемую соль, для изготовления лекарственного средства, предназначенного для лечения или профилактики или замедления развития состояния, выбранного из группы, включающей гипертензию, застойную сердечную недостаточность, стенокардию, инфаркт миокарда, атеросклероз, диабетическую нефропатию, диабетическую сердечную миопатию, почечную недостаточность, заболевание периферических сосудов, дисфункцию левого желудочка, дисфункцию познавательной способности, цереброваскулярное заболевание, связанное с нарушением кровяного давления, инсульт, легочное заболевание или легочную гипертензию и головную боль; где (I) количество амлодипина или его фармацевтически приемлемой соли составляет высокую дозу, указанную выше, например соответствует содержанию свободного основания от 6 мг до 40 мг, а (II) количество ингибитора АФК или его фармацевтически приемлемой соли составляет высокую дозу, указанную выше, например соответствует содержанию гидрохлорида беназеприла от 20 мг до 160 мг. Кроме того, изобретение относится к композиции, такой как фармацевтическая композиция, например, для лечения или профилактики или замедления развития состояния, выбранного из группы, включающей гипертензию, застойную сердечную недостаточность, стенокардию, инфаркт миокарда, атеросклероз, диабетическую нефропатию, диабетическую сердечную миопатию, почечную недостаточность, заболевание периферических сосудов, дисфункцию левого желудочка, дисфункцию познавательной способности, цереброваскулярное заболевание, связанное с нарушением кровяного давления, инсульт, легочное заболевание или легочную гипертензию и головную боль, причем указанная композиция включает (1) ингибитор АКФ, выбранный из группы, включающей беназеприл, беназеприлат и их фармацевтически приемлемые соли, и (2) амлодипин или его фармацевтически приемлемую соль, и (3) фармацевтически приемлемый носитель, причем (I) количество амлодипина или его фармацевтически приемлемой соли составляет высокую дозу, указанную выше, например соответствует содержанию свободного основания от 6 мг до приблизительно 40 мг, и (II) количество ингибитора АФК или его фармацевтически приемлемой соли составляет высокую дозу, указанную выше, например соответствует содержанию гидрохлорида беназеприла от 20 мг до 160 мг. Таким образом, стандартные композиции амлодипина и беназеприла по настоящему изобретению включают комбинации высокой дозы амлодипина и высокой дозы беназеприла в указанном выше интервале, а также комбинации более высоких доз амлодипина, которые разрешены к применению и предлагаются в композициях LotrelR, например, комбинации, содержащие количества, соответствующие 10-60 мг амлодипина и 20-160 мг беназеприла, например, комбинации, соответствующие (I) 10-40 мг свободного основания амлодипина, например, 10, 15 или 20 мг, и (II) 20-80 мг гидрохлорида беназеприла, например, комбинации, соответствующие 10 мг свободного основания амлодипина и 20 мг гидрохлорида беназеприла, 10 мг свободного основания амлодипина и 40 мг гидрохлорида беназеприла, 20 мг свободного основания амлодипина и 40 мг гидрохлорида беназеприла и 20 мг свободного основания амлодипина и 80 мг гидрохлорида беназеприла. Амлодипин предпочтительно находится в форме безилата амлодипина, а беназеприл предпочтительно находится в форме гидрохлорида беназеприла. Термин “фармацевтически приемлемый носитель”, используемый в описании заявки, включает соединения, известные специалисту в данной области техники, и означает эксципиенты и добавки, которые облегчают переработку активных соединений в лекарственные препараты, которые могут использоваться в фармацевтике. Подробное описание методов приготовления лекарственных средств и способов их введения можно найти в последнем издании Remington’s Pharmaceutical Sciences (Maack Publishing Co., Easton, PA). Кроме того, настоящее изобретение относится к способу лечения или профилактики или замедления развития состояния, выбранного из группы, включающей гипертензию, застойную сердечную недостаточность, стенокардию, инфаркт миокарда, атеросклероз, диабетическую нефропатию, диабетическую сердечную миопатию, почечную недостаточность, заболевание периферических сосудов, дисфункцию левого желудочка, дисфункцию познавательной способности, цереброваскулярное заболевание, связанное с нарушением кровяного давления, инсульт, легочное заболевание или легочную гипертензию и головную боль, причем указанный способ включает введение теплокровному животному, включая человека, нуждающемуся в лечении, эффективного количества комбинации, включающей (1) ИАКФ, выбранный из группы, включающей беназеприл, беназеприлат и их фармацевтически приемлемые соли, и (2) амлодипин или его фармацевтически приемлемую соль, причем (I) количество амлодипина или его фармацевтически приемлемой соли составляет высокую дозу, указанную выше, например, соответствует содержанию свободного основания от 6 мг до приблизительно 40 мг, и (II) количество ингибитора АКФ или его фармацевтически приемлемой соли составляет высокую дозу, указанную выше, например, соответствует содержанию гидрохлорида беназеприла от 20 мг до 160 мг. Соответствующие активные ингредиенты или их фармацевтически приемлемые соли можно также использовать в форме сольвата, такого как гидрат или с включением других растворителей, используемых при кристаллизации обычными методами. Соединения, включенные в композицию, могут присутствовать в форме фармацевтически приемлемых солей. Поскольку эти соединения содержат по меньшей мере одну основную группу, они могут образовывать кислотно-аддитивные соли. Предпочтительной фармацевтически приемлемой солью амлодипина является безилат, который является объектом изобретения US 4879303, а также малеат, который является объектом изобретения US 4572909. Оба патента введены в качестве ссылки в текст заявки. Предпочтительно ИАКФ означает беназеприл или его соль, наиболее предпочтительно его гидрохлорид. Пригодные соли беназеприла и беназеприлата можно найти в US 4410520, который введен в качестве ссылки в текст заявки. Для целей настоящего изобретения наиболее предпочтителен гидрохлорид ИАКФ, наиболее предпочтительным конкретным соединением ИАКФ является гидрохлорид беназеприла. Наиболее предпочтительными активными соединениями по настоящему изобретению являются безилат амлодипина и гидрохлорид беназеприла. Предпочтительные диапазоны доз в комбинациях по настоящему изобретению включают количество амлодипина или его фармацевтически приемлемой соли от 21 мг до 40 мг, предпочтительно от 6 мг до 40 мг, и количество ИАКФ или его фармацевтически приемлемой соли от 81 мг до 160 мг, в каждом случае в пересчете на свободное основание. В таких комбинациях количество амлодипина или его фармацевтически приемлемой соли предпочтительно составляет от 6 мг до 20 мг, прежде всего 10 мг, во всех указанных случаях в пересчете на свободное основание. Предпочтительное количество беназеприла или беназеприлата, соответственно, или в каждом случае его фармацевтически приемлемой соли составляет от 20 мг до 80 мг, предпочтительно от 20 мг до 40 мг, например, 20, 30 или 40 мг, прежде всего 20 мг, наиболее предпочтительно от 40 мг до 80 мг, например, 40, 50, 60, 70 или 80 мг, прежде всего 40 мг, во всех указанных случаях в пересчете на гидрохлорид беназеприла. Предпочтительное количество амлодипина или его фармацевтически приемлемой соли составляет 10 или 20 мг, а предпочтительное количество беназеприла или его фармацевтически приемлемой соли составляет 20 мг, 40 мг или 80 мг. Наиболее предпочтительно все указанные дозы означают суточные дозы. Термин “суточная доза”, используемый в описании заявки, означает общее количество лекарственного средства, введенного в течение 24 ч, причем предпочтительным способом лечения является однократное введение. Активные ингредиенты фармацевтической композиции по настоящему изобретению, описанные в тексте заявки, можно использовать одновременно или последовательно в любом порядке, причем для раздельного введения наиболее предпочтительны стандартные композиции. БКК и ИАКФ можно вводить в разное время, однако наиболее препочтительно их следует вводить одновременно. Наиболее удобной является лекарственная форма в виде единой стандартной композиции. Однако БКК можно вводить отдельно от ИАКФ и тем самым реализовать еще одно преимущество изобретения. При введении в разное время БКК и ИАКФ следует вводить не позднее приблизительно 16 ч после введения первого компонента, предпочтительно не позднее приблизительно 12 ч, более предпочтительно не позднее приблизительно 8 ч, наиболее предпочтительно не позднее приблизительно 4 ч. Естественно, эти промежутки увеличиваются, если лекарственная форма содержит агенты, предназначенные для пролонгированного действия. Если БКК и ИАКФ вводят в основном одновременно, их можно вводить в виде единой стандартной лекарственной формы или, если необходимо, в виде нескольких лекарственных форм. Если их вводят в виде нескольких лекарственных форм, то способ введения каждого из агентов может быть одинаковым или различным. Для реализации настоящего изобретения приемлемым является любой известный способ введения индивидуальных агентов. Наиболее предпочтительно, агенты вводят в виде стандартной композиции, или по меньшей мере в основном одновременно, т.е. не позднее чем через 1 ч после введения первого компонента. Кроме того, наиболее предпочтительной лекарственной формой является форма для перорального введения, поскольку пероральное введение представляет собой клинически приемлемый способ. Один из вариантов осуществления настоящего изобретения относится к “набору компонентов”, например, в том смысле, что компоненты по настоящему изобретению можно вводить определенными дозами по отдельности или с использованием различных стандартных композиций, содержащих известные количества компонентов, т.е. одновременно или в разное время. Затем компоненты набора можно, например, вводить одновременно или периодически, т.е. в разное время и через равные или различные промежутки времени для любой части набора компонентов. Предпочтительно промежутки времени выбирают таким образом, чтобы действие на заболевание или состояние при комбинированном применении компонентов было более эффективным, чем действие, оказанное при использовании только одного из компонентов. Дозы двух агентов включают все дозировки, в которых агенты используются в отдельности. Соответствующие дозировки других солей амлодипина, свободного беназеприла и других солей беназеприла, в также беназеприлата и его солей вполне очевидны для специалиста в данной области. В каждой из доз, указанных в описании заявки, диапазон является приемлемым для взрослого млекопитающего массой приблизительно от 50 кг до приблизительно 70 кг. Модифицированные диапазоны доз для млекопитающих другой массы и возраста очевидны для специалиста в данной области. Беназеприл и амлодипин являются обычно физически несовместимыми соединениями. Следовательно, при включении в единую лекарственную форму их отделяют друг от друга физически. Разделение осуществляют по любому из бесчисленного множества известных способов, таких как двухслойные таблетки, пилюли в оболочке, содержащие один агент и включенные в таблетку с другим агентом, пилюли с каждым агентом в оболочке в капсуле или таблетке, пилюли с одним агентом в оболочке, помещенные в капсулу с порошком другого агента, каждый агент, микрокапсулированный отдельно, а затем смешанный вместе для использования в таблетке или капсуле, использование двойных или многокамерных устройств для чрескожной доставки и т.п. Из-за несовместимости комбинация продуктов двух агентов в инъекционном растворе невозможна. Установлено, что наиболее приемлемой пероральной формой являются прессованные таблетки с беназеприлом в оболочке, помещенные в капсулу с порошкообразным амлодипином. Например, фармацевтическая композиция по настоящему изобретению включает от приблизительно 20 мг до приблизительно 160 мг гидрохлорида беназеприла, от приблизительно 3,4 мг до приблизительно 25,843 мг моногидрата лактозы, от приблизительно 3,4 мг до приблизительно 6,801 мг предварительно желатинизированного крахмала, от приблизительно 0,068 мг до приблизительно 1,360 мг коллоидного SiO2, от приблизительно 1,360 мг до приблизительно 5,440 мг кросповидона, от приблизительно 23,4 мг до приблизительно 185,843 мг микрокристаллической целлюлозы, от приблизительно 1,340 мг до приблизительно 8,4 мг стеарата магния, от приблизительно 6 мг до приблизительно 40 мг безилата амлодипина, от приблизительно 20 мг до приблизительно 160 мг двухосновного фосфата кальция и от приблизительно 2 мг до приблизительно 16 мг крахмалгликолята натрия. В композицию необязательно добавляют от приблизительно 1,5 мг до приблизительно 7,5 мг гидроксипропилметилцеллюлозы, очищенной воды, от приблизительно 0,075 мг до приблизительно 0,375 мг полисорбата 80 и следы талька. Предпочтительно фармацевтическая композиция представляет собой капсулу, включающую ядро, содержащее от приблизительно 20 мг до приблизительно 160 мг гидрохлорида беназеприла, от приблизительно 3,4 мг до приблизительно 25,843 мг моногидрата лактозы, от приблизительно 3,4 мг до приблизительно 6,801 мг предварительно желатинизированного крахмала, от приблизительно 0,068 мг до приблизительно 1,360 мг коллоидного SiO2, от приблизительно 1,360 мг до приблизительно 5,440 мг кросповидона, от приблизительно 3,4 мг до приблизительно 25,843 мг микрокристаллической целлюлозы, от приблизительно 0,340 мг до приблизительно 3,4 мг стеарата магния, и порошок, содержащий от приблизительно 6 мг до приблизительно 40 мг безилата амлодипина, от приблизительно 20 мг до приблизительно 160 мг микрокристаллической целлюлозы, от приблизительно 20 мг до приблизительно 160 мг двухосновного фосфата кальция, от приблизительно 2 мг до приблизительно 16 мг крахмалгликолята натрия и от приблизительно 1 мг до приблизительно 5 мг стеарата магния. В композицию необязательно добавляют от приблизительно 1,5 мг до приблизительно 7,5 мг гидроксипропилметилцеллюлозы, очищенной воды, от приблизительно 0,075 мг до приблизительно 0,375 мг полисорбата 80 и следы талька. По настоящему изобретению предпочтительными млекопитающими являются кролики, собаки, козы, свиньи, овцы, лошади, кошки и приматы, более предпочтительно приматы, наиболее предпочтительно человек. Кроме того, изобретение относится к упаковке, включающей комбинацию по настоящему изобретению вместе с инструкциями по одновременному, раздельному или последовательному применению. Настоящее изобретение иллюстрируется следующими примерами, не ограничивающими его объем. Пример 1 Одну тысячу капсул, содержащих 20 мг гидрохлорида беназеприла и безилата амлодипина в количестве, эквивалентном 5 мг основания амлодипина, для применения по настоящему изобретению получают следующим образом. Ядра, содержащие гидрохлорид беназеприла, получают следующим образом:
Компоненты 1-3 размалывают и смешивают, а затем добавляют воду для гранулирования смеси. Влажные гранулы собирают на сите и высушивают в сушильном шкафу. Затем сухие гранулы измельчают в смеси с компонентами 5-7. Компонент 4 просеивают и смешивают с другими ингредиентами. Затем полученную смесь прессуют с образованием ядра. Полученные ядра покрывают раствором компонентов оболочки, который получают следующим образом:
Компонент 10 растворяют в воде и добавляют компонент 9. Приготовленным раствором покрывают полученные ядра и влажные таблетки в оболочке высушивают. Затем сухие таблетки припудривают компонентом 12. Безилат амлодипина для включения в композицию готовят следующим образом:
Компоненты 13-16 смешивают, полученную смесь просеивают и вновь перемешивают. Компонент 17 просеивают отдельно, а затем смешивают с приготовленной смесью, содержащей амлодипин. Для инкапсулирования ядра в оболочке, содержащего гидрохлорид беназеприла и 200 мг порошкообразного безилата амлодипина, используют твердые желатиновые капсулы №1. Пример 2 Одну тысячу капсул, содержащих 40 мг гидрохлорида беназеприла и безилата амлодипина в количестве, эквивалентном 10 мг основания амлодипина, для применения по настоящему изобретению получают следующим образом. Ядра, содержащие гидрохлорид беназеприла, получают следующим образом:
1. Активное соединение на основе беназеприла, моногидрат лактозы и желатинизированный крахмал смешивают в соответствующем грануляторе с низким срезом в течение 20 мин (от приблизительно 5 мин до приблизительно 30 мин). 2. Приготовленную порошкообразную смесь гранулируют добавлением 26% (от приблизительно 16% до приблизительно 30%) очищенной воды. 3. После добавления воды продолжают гранулирование в течение 15 мин (от приблизительно 5 мин до приблизительно 30 мин). 4. Влажный гранулят измельчают с использованием соответствующего сепаратора. 5. Влажный гранулят сушат с использованием соответствующего оборудования, например, в кипящем слое, до остаточного содержания воды менее 1% (от приблизительно 0,5% до приблизительно 2%). 6. Высушенный гранулят измельчают с использованием соответствующего сепаратора в смеси с коллоидным диоксидом кремния, кросповидоном и микрокристаллической целлюлозой. 7. Измельченный гранулят помещают в соответствующий смеситель. 8. В смеситель добавляют стеарат магния (просеянный через соответствующее сито) и перемешивают в течение 5 мин (от прибилизительно 2 мин до приблизительно 10 мин). 9. Полученную смесь прессуют в ядра таблеток на соответствующем прессе роторного типа. Полученные ядра необязательно покрывают раствором компонентов оболочки, который получают следующим образом:
Компонент 10 растворяют в воде и добавляют компонент 9. Приготовленным раствором покрывают полученные ядра и влажные таблетки в оболочке высушивают. Затем сухие таблетки припудривают компонентом 12. Безилат амлодипина для включения в композицию готовят следующим образом:
Компоненты 13-16 смешивают, полученную смесь просеивают и вновь перемешивают. Компонент 17 просеивают отдельно, а затем смешивают с приготовленной смесью, содержащей амлодипин. Для инкапсулирования ядра в оболочке, содержащего гидрохлорид беназеприла и 200 мг порошкообразного безилата амлодипина (от приблизительно 196 мг до приблизительно 218 мг) на одну капсулу, используют твердые желатиновые капсулы №1.
Формула изобретения
1. Фармацевтическая комбинация, включающая (1) ИАКФ, выбранный из группы, включающей беназеприл, беназеприлат, и их фармацевтически приемлемые соли, и (2) амлодипин или его фармацевтически приемлемую соль для изготовления лекарственного средства, предназначенного для лечения гипертензии, где (I) количество амлодипина или его фармацевтически приемлемой соли соответствует количеству свободного основания от 6 до 10 мг, и (II) количество ингибитора АКФ или его фармацевтически приемлемой соли соответствует количеству гидрохлорида беназеприла до 40 мг. 2. Фармацевтическая комбинация по п.1, где амлодипин означает безилат амлодипина. 3. Фармацевтическая комбинация по п.1, где беназеприл означает гидрохлорид беназеприла. 4. Фармацевтическая комбинация по п.1, где количество амлодипина или его фармацевтически приемлемой соли соответствует количеству свободного основания 6 мг и 10 мг. 5. Фармацевтическая комбинация по п.1, где количество беназеприла или его фармацевтически приемлемой соли соответствует содержанию гидрохлорида беназеприла 40 мг. 6. Фармацевтическая комбинация по п.1, где количество беназеприла или его фармацевтически приемлемой соли соответствует содержанию гидрохлорида беназеприла до 40 мг. 7. Фармацевтическая комбинация по п.1, где амлодипин или его фармацевтически приемлемую соль и беназеприл или его фармацевтически приемлемую соль вводят в виде единой лекарственной формы, в которой амлодипин и беназеприл физически отделены друг от друга. 8. Способ лечения или профилактики гипертензии, включающий введение терапевтически эффективного количества (1) ИАКФ, выбранного из группы, включающей беназеприл, беназеприлат, и их фармацевтически приемлемых солей, и (2) амлодипина или его фармацевтически приемлемой соли, и (3) фармацевтически приемлемого носителя, где (I) количество амлодипина или его фармацевтически приемлемой соли соответствует количеству свободного основания от 6 мг до 10 мг, а (II) количество ингибитора АКФ или его фармацевтически приемлемой соли соответствует количеству гидрохлорида беназеприла до 40 мг. 9. Способ по п.8, где амлодипин означает безилат амлодипина. 10. Способ по п.8, где беназеприл означает гидрохлорид беназеприла. 11. Способ по п.8, где амлодипин означает безилат амлодипина, а беназеприл означает гидрохлорид беназеприла. 12. Способ по п.8, где количество амлодипина или его фармацевтически приемлемой соли соответствует количеству амлодипина в виде свободного основания от 6 до 10 мг, а количество беназеприла или его фармацевтически приемлемой соли выбирают из количества, соответствующего количеству гидрохлорида беназеприла до 40 мг. 13. Способ по п.8 для одновременного или последовательного применения в любом порядке, для раздельного применения или наиболее предпочтительно в форме фиксированной комбинации. 14. Способ по п.8, где амлодипин и беназеприл вводятся в виде единой лекарственной формы, в которой амлодипин и беназеприл физически отделены друг от друга. 15. Способ по п.8, где единичная лекарственная доза представляет собой капсулу, включающую (а) порошкообразный амлодипин и (б) прессованную таблетку в оболочке, содержащую беназеприл. 16. Способ по п.8, где амлодипин или его фармацевтически приемлемую соль вводят во вторую композицию, которая не содержит беназеприла или его фармацевтически приемлемой соли, а беназеприл вводят в первую композицию, которая не содержит амлодипина. 17. Способ по п.8, где указанную первую композицию и указанную вторую композицию вводят приблизительно через час после введения одной из них. 18. Способ по п.8, где количество амлодипина или его фармацевтически приемлемой соли и беназеприла или его фармацевтически приемлемой соли в каждом случае означает суточную дозу. 19. Коммерческая упаковка, включающая комбинацию по п.1 вместе с инструкциями по одновременному, раздельному или последовательному применению. 20. Фармацевтический состав, включающий: до приблизительно 40 мг гидрохлорида беназеприла, от приблизительно 3,4 мг до приблизительно 25,843 мг моногидрата лактозы, от приблизительно 3,4 мг до приблизительно 6,801 мг предварительно желатинизированного крахмала, от приблизительно 0,068 мг до приблизительно 1,360 мг коллоидного SiO2, от приблизительно 1,360 мг до приблизительно 5,440 мг кросповидона, от приблизительно 23,4 мг до приблизительно 185,843 мг микрокристаллической целлюлозы, от приблизительно 1,340 мг до приблизительно 8,4 мг стеарата магния, от приблизительно 6 мг до приблизительно 10 мг безилата амлодипина, от приблизительно 20 мг до приблизительно 160 мг двухзамещенного фосфата кальция и от приблизительно 2 мг до приблизительно 16 мг крахмалгликолята натрия. 21. Фармацевтический состав по п.20, дополнительно включающий: от приблизительно 1,5 мг до приблизительно 7,5 мг гидроксипропилметилцеллюлозы, воду, от приблизительно 0,075 мг до приблизительно 0,375 мг полисорбата 80 и следы талька. 22. Состав капсулы, включающий ядро, содержащее до приблизительно 40 мг гидрохлорида беназеприла, от приблизительно 3,4 мг до приблизительно 25,843 мг моногидрата лактозы, от приблизительно 3,4 мг до приблизительно 6,801 мг предварительно желатинизированного крахмала, от приблизительно 0,068 мг до приблизительно 1,360 мг коллоидного SiO2, от приблизительно 1,360 мг до приблизительно 5,440 мг кросповидона, от приблизительно 3,4 мг до приблизительно 25,843 мг микрокристаллической целлюлозы, от приблизительно 0,340 мг до приблизительно 3,4 мг стеарата магния, и порошок, содержащий от приблизительно 6 мг до приблизительно 10 мг безилата амлодипина, от приблизительно 20 мг до приблизительно 160 мг микрокристаллической целлюлозы, от приблизительно 20 мг до приблизительно 160 мг двухосновного фосфата кальция, от приблизительно 2 мг до приблизительно 16 мг крахмалгликолята натрия и от приблизительно 1 мг до приблизительно 5 мг стеарата магния. 23. Состав капсулы по п.22, дополнительно содержащий раствор компонентов оболочки, включающий: от приблизительно 1,5 мг до приблизительно 7,5 мг гидроксипропилметилцеллюлозы, воду, от приблизительно 0,075 мг до приблизительно 0,375 мг полисорбата 80 и следы талька. 24. Способ покрытия ядра раствором компонентов оболочки по п.23, включающий: растворение полисорбата 80 в воде и добавление гидроксипропилметилцеллюлозы с получением раствора, покрытие ядра полученным раствором, высушивание ядра в оболочке и припудривание высушенного ядра тальком. 25. Способ получения фармацевтического состава, включающий: предварительное перемешивание гидрохлорида беназеприла, моногидрата лактозы и предварительно желатинизированного крахмала в течение от приблизительно 5 мин до приблизительно 30 мин, гранулирование предварительно смешанного порошка в от приблизительно 16% до приблизительно 30% воды, после добавления воды гранулирование в течение от приблизительно 5 мин до приблизительно 30 мин, измельчение влажного гранулята, высушивание влажного гранулята до содержания остаточной воды менее чем приблизительно от 0,5% до приблизительно 2%, измельчение высушенного гранулята совместно с коллоидным диоксидом кремния, кросповидоном и микрокристаллической целлюлозой, смешивание со стеаратом магния в течение от приблизительно 2 мин до приблизительно 10 мин, прессование полученной смеси в ядра таблеток и инкапсулирование ядер с безилатом амлодипина. 26. Способ по п.25, дополнительно включающий покрытие ядер раствором компонентов оболочки перед инкапсулированием с безилатом амлодипина. 27. Способ по п.26, где раствор компонентов оболочки включает: от прибилизительно 1,5 мг до приблизительно 7,5 мг гидроксипропилметилцеллюлозы, воду, от приблизительно 0,075 мг до приблизительно 0,375 мг полисорбата 80 и следы талька. 28. Способ покрытия ядра раствором компонентов оболочки по п.27, включающий: растворение полисорбата 80 в воде и добавление гидроксипропилметилцеллюлозы с получением раствора, покрытие ядра полученным раствором, высушивание влажного ядра в оболочке и припудривание высушенного ядра тальком.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

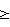 180 мм ртутного столба или диастолическое кровяное давление (ДКД)
180 мм ртутного столба или диастолическое кровяное давление (ДКД)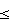 115 мм ртутного столба), которые получали комбинацию по настоящему изобретению, наблюдается более высокий уровень чувствительности по сравнению с пациентами, которые получали комбинацию LotrelR. Предпочтительным прежде всего является лечение пациентов с умеренной или острой гипертензией (по указанному определению ВОЗ умеренная гипертензия характеризуется ДКД приблизительно 100 мм ртутного столба), более предпочтительно лечение пациентов с острой гипертензией (например, средний уровень диастолического кровяного давления = MSDBP>105 мм ртутного столба по сравнению с базовой линией).
115 мм ртутного столба), которые получали комбинацию по настоящему изобретению, наблюдается более высокий уровень чувствительности по сравнению с пациентами, которые получали комбинацию LotrelR. Предпочтительным прежде всего является лечение пациентов с умеренной или острой гипертензией (по указанному определению ВОЗ умеренная гипертензия характеризуется ДКД приблизительно 100 мм ртутного столба), более предпочтительно лечение пациентов с острой гипертензией (например, средний уровень диастолического кровяного давления = MSDBP>105 мм ртутного столба по сравнению с базовой линией).