|
|
(21), (22) Заявка: 2003136768/15, 22.05.2002
(24) Дата начала отсчета срока действия патента:
22.05.2002
(30) Конвенционный приоритет:
22.05.2001 GB 0112428.8
(43) Дата публикации заявки: 10.02.2005
(46) Опубликовано: 20.01.2007
(56) Список документов, цитированных в отчете о
поиске:
GOH S.H. et. al. J. of Clinical Microbiology. V.34, no.4, 1 April 1996, p.818-823. BLASCO R. et al. J. of Applied microbiology. V.84, no.4, 04.1998, p.661-666. SU 649751, 28.02.1979. RU 2146368 C1, 10.03.2000.
(85) Дата перевода заявки PCT на национальную фазу:
22.12.2003
(86) Заявка PCT:
GB 02/02208 (22.05.2002)
(87) Публикация PCT:
WO 02/095416 (28.11.2002)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
ТИТБОЛЛ Ричард Вилльям (GB),
ДЕСПЕЙРУ Доминик (GB)
(73) Патентообладатель(и):
ДЗЕ СЕКРЕТЭРИ ОФ СТЕЙТ ФОР ДЕФЕНС ДСТЛ (GB)
|
(54) ИДЕНТИФИКАЦИЯ МИКРООРГАНИЗМОВ
(57) Реферат:
Изобретение относится к медицине. Способ быстрой идентификации неизвестных микроорганизмов посредством масс-спектрометрии биологических маркеров, выделенных из лизатов микроорганизмов на основе их структурного сходства у ряда видов. Также описаны указанные биологические маркеры, особенно Hsp60 или аденилаткиназу и устройство для автоматического выполнения способа. Изобретение позволяет быстро осуществить способ идентификации. 2 н. и 12 з.п. ф-лы, 7 ил., 3 табл.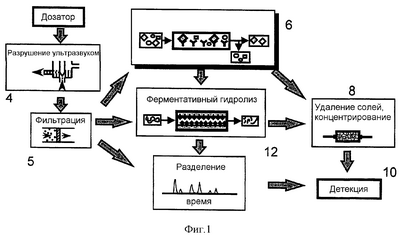
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к быстрой идентификации микроорганизмов, таких как бактерии.
ПРЕДПОСЫЛКИ
Существует множество ситуаций, в которых желательно иметь возможность быстро идентифицировать потенциально патогенные организмы, такие как бактерии или вирусы. Современные лабораторные способы обычно включают культивирование организмов и использование иммунодиагностических тестов или приготовление гистологических образцов и использование специализированного окрашивания и/или иммуногистохимических способов. Такие способы требуют в лучшем случае часы, а при необходимости культивировать организмы – дни. Основанная на ДНК идентификация, например, ПЦР, хотя и более чувствительна, но ее постановка также занимает часы, также требуя значительного лабораторного оборудования и квалификации.
Идентификация конкретного микроорганизма посредством специфических поликлональных антисывороток или моноклональных антител представляет собой стандартный способ. Иммуногистохимические методы позволяют идентифицировать организмы, находящиеся в тканях, а для определения патогенных микроорганизмов или происходящих из них антигенов в жидкостях организма применяют способы, такие как твердофазный иммуноферментный анализ (ELISA). Однако, за исключением использования только для подтверждения присутствия конкретного патогенного микроорганизма, подозреваемого на основании других диагностических критериев (обычная ситуация), данные способы диагностики требуют применения совокупности антител с различной специфичностью и плохо подходят для идентификации конкретного патогенного микроорганизма из большого количества потенциальных мишеней. Иммуноаффинная очистка клеточных компонентов также хорошо известна в данной области, но, как правило, не подходит для целей идентификации, так как обычно требует знания об интересующем организме.
Ранее сообщалось о применении для идентификации микроорганизмов перекрестно реагирующих сывороток (Bonenberger et al, 2001). В данном случае для окрашивания большого многообразия микроорганизмов в образцах биопсии применяли поликлональную антисыворотку, полученную против штамма BCG Mycobacterium bovis. Данный способ не позволял идентифицировать конкретных индивидуальных организмов, но, в общем, окрашивал ряд бактериальных, грибковых и протозойных патогенных микроорганизмов.
В последние годы для биологических применений в большей мере применяли масс-спектрометрию (MS). Новые разработки позволили анализировать большие биологические молекулы (рассмотрено у Bakhtier and Tse, 2000). В частности, для применений в области белков особенно хорошо подходят опосредованная матрицей десорбция-ионизация (MALDI) и электроспрейная MS, с их относительно мягкими способами ионизации (рассмотрено у Rowley et al, 2000). Совсем недавно начало использования MS с ионной ловушкой уменьшило время, необходимое для анализа смесей биологических молекул, особенно когда доступны малые количества (Henderson et al, 1999).
В WO 00/29987 (Demirev/University of Maryland) раскрыт способ измерения молекулярных масс различных компонентов микроорганизмов и применение поиска в базе данных в попытке идентифицировать их. Однако такой подход обладает неудобствами необходимости обработки больших количеств информации и необходимости различать большое количество компонентов сходной молекулярной массы. Попытки упростить масс-спектрометрию посредством любой предварительной выборки информативных биологических маркеров нет.
В WO 96/37777 (Nelson et al) раскрыт способ анализа комплексов антитело/антиген с использованием масс-спектрометрии. Однако объект применения представляет собой определение присутствия или отсутствия специфических антител и/или антигенов и при положительном ответе измерение присутствующих количеств. Указания на способ, который можно было бы использовать для однозначной идентификации неизвестного организма, нет.
В комбинации с применением специфических моноклональных антител и иммуноаффинной очистки MS позволила проводить подробное структурное картирование многих молекул (рассмотрено у Downard, 2000). В частности, анализ интересующих молекул посредством иммуноаффинной хроматографии с последующим анализом изолированных молекул посредством MS провели для многих белков, например, калнексина (Yamashita et al, 1999). В некоторых случаях иммуноаффинно очищенные белки затем подвергали ферментативному гидролизу для получения набора определенных пептидов, которые затем анализировали посредством MS, например, белок Ty1 Gag из Saccharomyces cerevisiae (Yu et al, 1998). Lacey et al (2001) сообщают об анализе изоформ трансферрина посредством иммуноаффинной очистки с последующим анализом посредством MS для установления структуры модификаций углеводов, ответственных за гетерогенность трансферрина. Однако это включает применение специфических поликлональных антител против трансферрина, связывающихся с молекулами с одинаковой аминокислотной последовательностью. Различия между молекулами находились в углеводной части гликопротеинов, и антитела не являлись перекрестно реагирующими.
Аффинную очистку молекул, несущих общие структурные признаки, можно провести с лигандами, отличными от иммобилизованных антител, и она представляет собой хорошо известный в данной области способ. Bundy and Fenselau (2001) сообщают о применении и лектинов для захвата множества комплексных углеводов из множества микроорганизмов, и определенных углеводов для захвата бактерий, экспрессирующих молекулы лектина. Захваченные молекулы или производные из них посредством кислотного гидролиза пептиды затем анализировали посредством MS. Хотя их можно описать как общие лиганды, применяемые для захвата множества молекул для последующего анализа MS, способ не применяют для идентификации неизвестных организмов. Для такого применения не существует выбора подходящих биологических маркеров. Не существует руководства о том, как можно идентифицировать такие биологические маркеры. Не существует никакого указания на то, что предложенные лиганды обладали бы достаточной специфичностью, чтобы позволить очистку необходимого специфического биологического маркера, или о том, что пригодные биологические маркеры конститутивно присутствовали бы у необходимого множества организмов, необходимых для настоящего изобретения. Не существует никакого указания на то, что применение одного биологического маркера или малого набора биологических маркеров позволит быструю идентификацию широкого множества микроорганизмов.
Хотя более быстрая идентификация патогенных микроорганизмов являлась бы сама по себе выгодной в лабораторных условиях, существует дополнительная потребность в переносных полевых системах, которые можно было бы применять и в мирное время во время эпидемий заболеваний у людей или животных, и в военной ситуации как часть мер противодействия биологическому оружию. В данном контексте патологические микроорганизмы, такие как возбудители чумы или сибирской язвы, которые мог бы применять агрессор, обычно доставляют в виде аэрозоля. Для обнаружения присутствия аэрозоля можно применять лазерный контроль, но данный аэрозоль может оказаться просто туманом, например, водным, выпускаемым как ложное оружие (Willeke and Baron, 1993). Существует потребность в способности быстро проделать точную идентификацию в поле любым образом доставленного, вещества, которое заподозрено в том, что является биологическим оружием. Ранее сообщали о подходах для идентификации бактерии с помощью MS с ионной ловушкой (Krishnamurthy et al, 1999). В данном случае после разделения обратно-фазовой микрокапиллярной хроматографией непосредственно анализировали и правильно идентифицировали на основе генерируемого спектра целые бактерии. Хотя авторы высказывают мнение о возможности для миниатюризации оборудования для полевого применения, предложений о применении любой формы иммуноаффинной селекции для упрощения необходимого анализа MS и практического проведения такого анализа для быстрой идентификации большого диапазона организмов не существует. Кроме того, нет сведений об идентификации конкретных белков для применения в качестве биологических маркеров и нет данных о воспроизводимости полученного спектра MS в разных условиях окружающей среды. Без характеристики используемых биологических маркеров данный способ также неустойчив к непостоянству поведения биологических маркеров, например, в характеристиках ионизации, что дополнительно уменьшает его надежность.
Также сообщали о прямом анализе MS вирусных белков (WO 99/58727), но опять же аффинная очистка или применение общих биологических маркеров не описаны. Также сообщали об анализе MS лизатов бактериальных клеток (Chong et al, 1997). Перед анализом посредством MALDI-TOF MS бактериальные образцы растворяли в гуанидингидрохлориде и Triton X-100. Не применяли никакой формы аффинной очистки, а цель представляла собой скорее построение профиля индукции и репрессии синтеза белков у Escherichia coli, чем идентификацию неизвестных организмов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способу идентификации микроорганизма, предусматривающему определение молекулярной массы, по меньшей мере, одного белка, извлеченного из множества белков, которые составляют микроорганизм.
Изобретение следует из открытия того, что из всех тысяч белков, которые обычно составляют микроорганизм, идентификацию можно провести посредством оценки относительно очень малой выборки белков, даже настолько малой, как один. В данной области хорошо известно, что ряд белков, зачастую те, которые выполняют какую-либо повсеместную и жизненно важную метаболическую функцию в клетке, являются структурно высококонсервативными у широкого диапазона видов. Тот факт, что они выполняют очень сходные функции у различных видов, участвуя в общих метаболических путях, приводит к эволюционному давлению, сохраняя структурные особенности, от которых зависят функциональные свойства. Такие высококонсервативные белки включают ферменты, вовлеченные в основные клеточные процессы, такие как гликолиз (например, фосфотриозоизомераза) и метаболизм нуклеотидов (например, аденилаткиназа), ДНК-полимеразы и белки теплового шока.
Консервативные области таких белков проявляют высокую степень гомологии аминокислотной последовательности. Как результат, они несут общие иммунологические эпитопы, с которыми могут связываться перекрестно реагирующие антитела так, что можно использовать одно моноклональное антитело для идентификации или выделения любого из семейства таких консервативных белков из множества видов. В некоторых случаях одно антитело может связываться с таким очень широко распространенным консервативным эпитопом и, значит, являться пригодным для выделения белков из многих видов. Однако во многих случаях ряд таких антител, связывающихся с разными эпитопами на одном и том же или разных белках, можно применять в комбинации для максимизации числа идентифицируемых видов и минимизации шанса того, что присутствующий микроорганизм останется необнаруженным. Удивительно, но, несмотря на высококонсервативную структуру, настоящее изобретение демонстрирует, что малые различия между такими белками позволяют быстро и непротиворечиво идентифицировать виды, из которых получены данные белки посредством точного определения их массы. Разрешение, полученное при масс-спектрометрии, способно без труда идентифицировать различия в одну аминокислоту между белками или происходящими из них пептидами. Таким образом, комбинация аффинной очистки высококонсервативных белков, несущих общие эпитопы, с последующим масс-спектроскопическим анализом таких белков или происходящих из них пептидов могут формировать основу быстрого и надежного способа идентификации микроорганизмов, из которых они получены. Белки или другие биологические молекулы, которые используют в данном способе, известны как биологические маркеры.
Данный способ зависит от доступности базы данных биологических маркеров, связывая точные молекулярные массы известных биологических маркеров с видами, из которых они получены. В некоторых случаях для однозначной идентификации видов, подвидов или штаммов может являться необходимым использовать более чем один биологический маркер. Такие базы данных формируют посредством выращивания соответствующих микроорганизмов при ряде условий, картировании протеомов посредством двухмерного электрофореза в геле и вестерн-блоттинга с использованием антител, полученных против клеточного лизата целого микроорганизма. Интересующие маркеры, отобранные по указанным ниже критериям, можно быстро идентифицировать, точно определить их массы посредством масс-спектроскопии и ввести массу в базу данных.
Важным фактором в выборе биологических маркеров является то, что их массы должны оставаться постоянными вне зависимости от изменяющихся факторов, таких как клеточный цикл или условия роста, такие как температура или доступность питательных веществ. Это особенно важно для идентификации микроорганизмов в окружающей среде, такой как биологическое оружие, где условия для интересующего организма могут являться далекими от оптимальных, и в ответ на такой стресс он может изменить профиль генной экспрессии или посттрансляционной модификации. Поэтому предпочтительно, чтобы они не являлись кратковременно модифицируемыми посредством фосфорилирования, липоилирования или рибозилирования, хотя, если такие модификации известны и являются стойкими, они не препятствовали бы использованию таких молекул для идентификации. Биологические маркеры также должны экспрессироваться конститутивно, во всех условиях, на достаточно высоких уровнях, чтобы позволить провести экстракцию и выделение достаточно больших количеств для проведения практической идентификации.
Принимая во внимания такие рассуждения, особенно подходящие биологические маркеры представляют собой молекулы семейств белка теплового шока (Hsp). Молекулы, такие как Hsp60, являются высококонсервативными у видов, не подвергаются посттрансляционным модификациям и конститутивно и повсеместно экспрессированы. В действительности, так как их экспрессия связана с клеточным стрессом, она увеличена, когда организмы находятся в субоптимальных условиях окружающей среды. Hsp60 (GroEL, шаперонин) вместе с его кошаперонином Hsp10 (GroES) вовлечены в АТФ-зависимую посттрансляционную укладку возникающих полипептидов в их правильные третичные структуры, а также обратную укладку неестественных белков в их правильную естественную конформацию (Sigler et al, 1998).
В дополнение к применению перекрестно реагирующих антител для выделения подходящих биологических маркеров из ряда микроорганизмов для аффинного захвата таких биологических маркеров можно применять другие лиганды. Для захвата гликопротеинов из гликолипидов, несущих специфические структурные особенности в своих углеводных модификациях, можно применять лектины. Для захвата связывающих ДНК белков можно применять иммобилизованные нуклеиновые кислоты. В зависимости от используемого лиганда они могут представлять собой общие связывающие ДНК белки (такие как полимеразы) или могут представлять собой белки, связывающие специфические последовательности (такие как транскрипционные факторы или эндонуклеазы рестрикции). Для связывания специфических целевых структур можно также применять иммобилизованные аптамеры РНК и рибозимы (рассмотрено у Hoffman et al, 2001). Лиганды с искусственным красителем способны к связыванию различных молекул, характеризующихся общей структурной особенностью, такой как участок для связывания кофактора (см. Affinity Chromatography: principles and methods, Pharmacia LKB Biotechnology, 1988). В качестве примера Cibacron Blue F3G-A связывает множество ферментов, требующих NAD или NADP, и ферментов, обладающих специфичностью в отношении субстратов аденилирования, таких как аденилаткиназа, которая представляет собой пригодный консервативный биологический маркер для настоящего изобретения.
Комбинация иммуноаффинной очистки одного или нескольких высококонсервативных биологических маркеров из клеточных лизатов с применением перекрестно реагирующих антител или какого-либо другого общего связывающего лиганда с последующим масс-спектроскопическим анализом, предпочтительно посредством масс-спектроскопии с ионной ловушкой, одного или нескольких используемых биологических маркеров посредством обращения к базе данных предоставляет быстрый, надежный и воспроизводимый способ для идентификации микроорганизмов для множества применений.
В альтернативном осуществлении захваченный биологический маркер можно подвергнуть ферментативному расщеплению для получения предсказуемого набора пептидов, согласующихся с применяемым ферментом и известной аминокислотной последовательностью кандидатных молекул из ряда зарегистрированных видов. Спектр полученных масс представляет собой характеристику фингерпринта биологического маркера, из которого он произошел, и его можно использовать в качестве перекрестной ссылки к базе данных для идентификации вовлеченного организма. Применение иммобилизованных ферментов представляет собой подходящее направление упрощения способа для автоматизации, а также уменьшения запутанности молекул ферментов, присутствующих в смеси пептидов для анализа.
Для применений в мерах противодействия полевой биологической войне предусматривают, что весь процесс от отбора проб окружающей среды вплоть до концентрирования и лизиса клеток, аффинной очистки интересующего(их) биологического(их) маркера(ов), элюирования указанных биологических маркеров, доставки их в масс-спектрометр, записи полученного масс-спектра, сопоставления спектра с лучшим из подобранных в базе данных и, наконец, перекрестной ссылки данной информации для идентификации обнаруженного организма автоматизируют в одном переносном устройстве. Дополнительные стадии, такие как ферментативное расщепление захваченных биологических маркеров, могли бы вызываться автоматически, если из первого анализа не следует окончательная идентификация. Для этой цели сохранят часть исходного элюата со стадии аффинной очистки. В зависимости от точности применения окончательная индикация данных может представлять собой точную идентификацию организма или его штамма. Для военных применений индикацию данных можно просто представить в виде “безопасно” или “небезопасно”.
Для других применений можно разработать дополнительные автоматические устройства. Например, настольное устройство для анализа крови или образцов ткани для применения в госпитале и лаборатории.
Таким образом, настоящее изобретение предоставляет биологический маркер, характеризующийся тем, что видовые гомологи указанного биологического маркера, полученные из большинства видов, по меньшей мере, у двух родов микроорганизмов, по существу являются структурно сходными так, что указанное структурное сходство позволяет выделить указанные биологические маркеры из различных видов микроорганизмов и что каждый биологический маркер, полученный из каждого вида микроорганизмов указанных родов, обладает уникальной молекулярной массой.
Предпочтительно, указанный биологический маркер характеризуется тем, что он представляет собой белок, и тем, что указанное структурное сходство заключается в существенном сходстве аминокислотной последовательности. Также предпочтительно, чтобы указанные микроорганизмы представляли собой бактерии.
Предпочтительно, указанный биологический маркер характеризуется тем, что, по меньшей мере, три видовых гомолога несут, по меньшей мере, один общий эпитоп, что позволяет выделение посредством иммуноаффинной хроматографии. Более предпочтительно, что, по меньшей мере, один общий эпитоп несут, по меньшей мере, пять видов. Даже более предпочтительно, он представляет собой белок теплового шока, и более предпочтительно, он представляет собой Hsp60.
Альтернативно, указанный биологический маркер может представлять собой аденилаткиназу.
Также раскрыт способ идентификации микроорганизмов, предусматривающий:
a. идентификацию биологического маркера, характеризующегося тем, что видовые гомологи указанного биологического маркера, полученные из большинства видов, по меньшей мере, двух родов микроорганизмов по существу являются структурно сходными так, что указанное структурное сходство позволяет выделить указанные биологические маркеры из различных видов микроорганизмов и что каждый биологический маркер, полученный из каждого вида микроорганизмов указанных родов, обладает уникальной молекулярной массой;
b. выделение указанных биологических маркеров посредством аффинной хроматографии, направленной к областям структурного сходства;
c. измерение массы указанных биологических маркеров посредством масс-спектрометрии и
d. анализирование комбинации полученных данных о молекулярной массе посредством обращения к базе данных и, таким образом, установление присутствующего вида микроорганизма.
Предпочтительно, указанные биологические маркеры выделяют из клеточного лизата.
Более предпочтительно, указанные биологические маркеры выделяют посредством иммуноаффинной хроматографии и, более предпочтительно, посредством иммобилизованных антител, которые специфически связываются с перекрестно реагирующими эпитопами, присутствующими на молекулах маркеров, полученных из множества видов микроорганизмов.
Альтернативно, способ может включать дополнительную стадию расщепления выделенных биологических маркеров на определенные фрагменты перед определением их молекулярной массы посредством масс-спектроскопии. Предпочтительно, указанное расщепление биологических маркеров достигается посредством ферментативного гидролиза.
Предпочтительно, определение молекулярной массы биологических маркеров или их фрагментов проводят посредством масс-спектрометрии с ионной ловушкой.
Также раскрыт способ идентификации макромолекулярных токсинов, предусматривающий:
a. выделение одного или нескольких токсинов посредством аффинной хроматографии;
b. измерение молекулярной массы указанного(ых) токсина(ов) посредством масс-спектрометрии и
c. анализирование комбинации полученных данных о молекулярной массе посредством обращения к базе данных и, таким образом, установление природы присутствующего(их) токсина(ов).
Другое осуществление данного изобретения представляет собой устройство для автоматического выполнения любого из указанного выше, включающее:
a. средство для выделения указанных биологических маркеров или токсинов;
b. блок, содержащий масс-спектрометр, способный к определению молекулярных масс указанных биологических маркеров или токсинов;
c. устройство обработки данных, способное сравнить полученные данные с базой данных известных молекулярных масс и, таким образом, установить природу обнаруженного микроорганизма или токсина.
Альтернативно, указанное устройство дополнительно включает устройство, включающее один или несколько иммобилизованных протеолитических ферментов, способных к расщеплению указанных биологических маркеров.
Определения
Как используют здесь, “биологический маркер” означает биохимический параметр окружающей среды, выявление или определение количества которого можно использовать в качестве средства идентификации потенциальной биологической опасности. В данном случае он конкретно относится к структурно консервативным биологическим макромолекулам, включающим белки, которые можно изолировать из широкого диапазона микроорганизмов и применять для идентификации указанных микроорганизмов.
Как используют здесь, “аффинная хроматография” означает “тип адсорбционной хроматографии, в котором молекула для очистки специфически и обратимо адсорбируется посредством комплементарного связывающего вещества (лиганда), иммобилизованного на нерастворимой подложке (матрице)” (см. Affinity Chromatography: principles and methods, Pharmacia LKB Biotechnology, 1988).
Как используют здесь, “иммуноаффинная хроматография” означает форму аффинной хроматографии, в которой иммобилизованный лиганд представляет собой антитело или его эпитоп – связанное производное.
Как используют здесь, “видовой гомолог” означает эквивалентный ген или продукт гена из другого вида. Такие гомологи выполняют эквивалентные функции и характеризуются степенью сходства последовательности на уровне аминокислот. Как используют здесь, не делают никаких предположений относительно эволюционной связи между вовлеченными организмами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее изобретение описано посредством примера со ссылкой к чертежам, в которых:
Фиг.1 представляет собой схематическое представление расположения функциональных элементов в системе, основанной на способе по изобретению.
На фиг.2 приведено графическое сравнение масс белка Hsp60 из ряда потенциально патогенных бактерий.
На фиг.3 проиллюстрировано измерение аффинностей связывания моноклонального IgG1 A57-E4 с рекомбинантными белками Hsp60 из Francisella tularensis и Burkholderia pseudomallei непрямым ELISA.
На фиг.4 представлено графическое сравнение пептидных фингерпринтов, получающихся из гидролизованных Arg-C белков Hsp60 из Brucella abortus и Staphylococcus epidermidis.
На фиг.5 представлено графическое сравнение молекулярных масс аденилаткиназ из ряда потенциально патогенных микроорганизмов в сравнении с человеческим Hsp60.
Пример 1. Автоматическая система отбора образцов и идентификации
В отношении фиг.1 вакуумное устройство (не показано) применяют для забора пробы аэрозоля, который подозревают в содержании патогенных бактерий. Аэрозоль смешивают с жидким носителем и суспензию помещают в систему (1) через дозатор (2). Оттуда суспензия доставляется в ультразвуковое устройство (4), в котором для разрушения клеточной стенки любых бактерий в суспензии применяют ультразвук, таким образом высвобождая образующие бактериальные белки в лизат. Неизбежно лизат будет также содержать отходы, поэтому ниже по потоку от ультразвукового устройства (4) расположен фильтр (5), который предотвращает прохождение нежелательного материала. В некоторых случаях лизис можно усилить посредством применения детергента, хотя это не должно служить помехой иммуноаффинной стадии, расположенной ниже по току. Подходящие мягкие неионные детергенты хорошо известны в данной области и включают детергенты, основанные на полиоксиэтилене (такие как Triton X-100 и X-114 Nonidet P40 и ряд Brij), и N-октил- -D-глюкопиранозид. -D-глюкопиранозид.
Далее следует иммуноаффинный модуль (6), который изолирует один или несколько бактериальных биологических маркеров, если они присутствуют в суспензии. В модуле (6) находятся одно или несколько иммобилизованных антител, специфичных к указанному(ым) биологическому(им) маркеру(ам). Проходящие биологические маркеры, таким образом, связываются, пока оставшаяся жидкость проходит мимо и отбрасывается. Данная стадия не только изолирует релевантные биологические маркеры, но эффективно концентрирует их из, может быть, очень разбавленного лизата. После прохождения лизата для снятия связанных биологических маркеров в устройство вводят малый объем буфера для элюции.
Высвобожденные биологические маркеры доставляются в устройство (8) удаления солей, после чего из них удаляют соли перед прохождением в масс-спектрометр (10) с ионной ловушкой, в котором определяют их индивидуальные молекулярные массы. Комбинация полученных молекулярных масс затем перекрестно ссылается на базу данных молекулярных масс соответствующих биологических маркеров у ряда бактерий с тем, чтобы идентифицировать любое совпадение. Вывод может представлять собой специфическую идентификацию, или оператора можно просто уведомить, что область является или “безопасной”, или “небезопасной”, и тогда необходимы соответствующие защитные меры.
В случае, если белки биологических маркеров являются слишком большими для отдельного анализа, элюированные белки можно отправить в устройство (8) удаления солей через ферментативную камеру (12) для расщепления, в которой ферменты расщепляются в предсказуемых точках их аминокислотной последовательности, и анализируют получающиеся в результате пептиды. Полученный профиль молекулярных масс пептидов диагностируют, когда сравнивают с базой данных таких предсказанных пептидов (см. пример 3).
Пример 2. Применение Hsp60 в качестве биологического маркера для идентификации потенциально патогенных бактерий
Среднюю молекулярную массу Hsp60 из обширного множества организмов можно и предсказать с высокой степенью соответствия из известной аминокислотной последовательности (скорректированной на присутствие смеси изотопов), и непосредственно измерить с применением соответствующего очищенного рекомбинантного белка. Хотя Hsp60 является высоко консервативным у многих видов, и не только у бактерий, масс-спектрометрия позволяет с высокой точностью определить массу и позволяет отличить молекулы белков, различающиеся только тремя массовыми единицами. Сравнение таких измеренных значений с базой данных известных величин позволяет идентифицировать вовлеченные виды, как показано в таблице 1.
| Таблица 1 |
| Hsp60 Mr |
Бактерия |
| 58015,3 Да |
Chlamydia trachomatis |
| 57301,7 Да |
Francisella tularensis |
| 57154,8 Да |
Salmonella typhimurium |
| 56757,3 Да |
Burkholderia pseudomallei |
Фиг.2 демонстрирует графическое сравнение масс Hsp60 из широкого диапазона организмов, иллюстрируя то, что многие виды можно идентифицировать только на основе масс их Hsp60, как измеряют посредством масс-спектрометрии.
Однако для уменьшения фона других белков, некоторые из которых могут обладать создающими помехи сходными массами, предпочтительна аффинная очистка соответствующих биологических маркеров. В случае Hsp60 возможна иммуноаффинная очистка белка из клеточных лизатов посредством перекрестно реагирующих антител. В качестве примера моноклональное антитело A57-E4 (Affinity Bioreagents Inc) связывается с линейным эпитопом RGIDKA, существующим в Hsp60 многих потенциально патологических организмов, включая Bordetella pertussis, Burkholderia cepacia, Burkholderia pseudomallei, Chlamydia trachomatis, Chlamydophila pneumoniae, Chlamydophila psittaci, Coxiella burnetii, Haemophilus influenzae, Escherichia coli, Francisella tularensis, Klebsiella pneumoniae, Legionella pneumophila, Neisseria meningitidis, Pseudomonas aeruginosa, Salmonella typhi, Vibrio cholerae, Yersinia enterocolitica.
Поэтому применение такого антитела позволило бы очистку и идентификацию Hsp60 из широкого диапазона потенциальных патогенных микроорганизмов. Связывание данного антитела с белками Hsp60 из Francisella tularensis и Burkholderia pseudomallei подтвердили и измерили посредством стандартного колориметрического непрямого ELSIA, как показано на фиг.3.
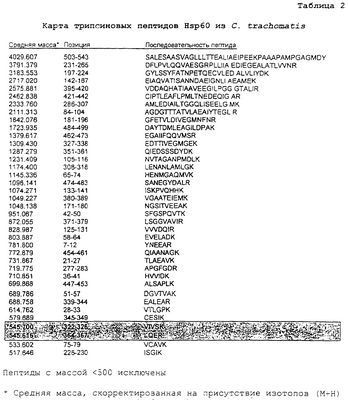 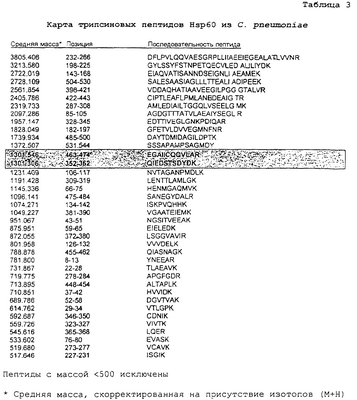
Пример 3. Карты пептидов Hsp60, полученные из Hsp60 посредством гидролиза трипсином
Как показано в таблицах 2 и 3 выше, ферментативный гидролиз близкородственных белков Hsp60 со сходной общей молекулярной массой дает отличные профили пептидов, которые можно разрешить посредством масс-спектрометрии. Трипсин расщепляет пептиды на карбокси-пептидных связях остатков аргинина и лизина (за исключением того, когда следующий остаток представляет собой пролин). При допуске погрешности массы в размере 0,01% немногие пептиды являлись слишком сходными для различения (выделены). В других случаях результатом расщеплений являются некоторые слишком короткие пептиды, характеризующиеся идентичным составом и, таким образом, обладающие идентичными массами, а также единичные свободные аминокислоты. Даже при учете данного обстоятельства каждый набор пептидов образует уникальный фингерпринт, определяющий конкретный организм, из которого получен белок.
Пример 4. Сравнение Arg-C пептидов Hsp60 из Brucella abortus и Staphylococcus epidermidis
Эндопептидаза Arg-C (клострипаин), как подсказывает ее имя, расщепляет карбокси-пептидные связи аргинина. Фиг.4 показывает графическое сравнение пептидных фингерпринтов, полученных после гидролиза Hsp60 посредством Arg-C из B. abortus и S. epidermidis. Как показано на фиг.3, массы целых белков Hsp60 из данных организмов являются сходными (соответственно, 57649 и 57529, включая N-концевые метионины). Однако полученные наборы пептидов являются вполне различными и характерны для вовлеченных организмов.
Пример 5. Применение аденилаткиназы в качестве диагностического биологического маркера
Фиг.5 показывает сравнение масс высококонсервативного внутриклеточного фермента аденилаткиназы из множества микроорганизмов (бактерий и протозойного паразита Shistosoma mansoni), а также белка человека. Аденилаткиназа представляет собой нуклеозидмонофосфаткиназу, которая катализирует обратимые фосфотрансферазные реакции между аденозинмонофосфатом, -дифосфатом и -трифосфатом. Фермент играет важную роль в синтезе нуклеотидов и необходим для множества метаболических процессов в клетке, а также для синтеза РНК и ДНК. Аденилаткиназа удовлетворяет критерию для пригодного биологического маркера для раскрываемого изобретения, так как она является высококонсервативной у видов, и однако каждый вид обладает уникальным белком, отличимым по массе. Она также конститутивно экспрессируется и существенна для метаболизма.
Пример 6. Идентификация E.coli по измерению молекулярной массы целого биологического маркера Hsp60 посредством электроспрейной масс-спектрометрии
Для демонстрации практичности изобретения для идентификации бактерии применяли иммуноаффинную колонку против Hsp60 вместе с электроспрейной масс-спектрометрией, как изложено ниже.
Способы
Подготовка колонок с антителом
Перед связыванием с колонкой лиганд (моноклональное антитело A57-E4 (Affinity Bioreagents Inc)) подвергли диализу в 0,2 М NaHCO3, 0,5 М NaCl, pH 8,3 (связывающий буфер). Оптимальный объем составлял 1 мл с оптимальной концентрацией между 1 и 10 мг/мл.
Использовали 1 мл активированной NHC сефарозы 4 в колонке быстрого протока Hi-Trap (Pharmacia Biotech). Колонку отмыли 3×2 мл объемами 1 мМ HCl для удаления раствора хранения (изопропанол), соблюдая скорость потока менее капли каждые две секунды, чтобы избежать сдавливания матрицы. В колонку внесли раствор лиганда и инкубировали 30 минут при комнатной температуре. Колонку отмыли и дезактивировали посредством поочередной отмывки 0,5 М этаноламином, 0,5 М NaCl, pH 8,3 (буфер A) и 0,1 М ацетатом, 0,5 М NaCl, pH 4,0 (буфер B) (3×2 мл буфера A, 3×2 мл буфера B с последующими 3×2 мл буфера A). Затем колонку уравновесили и хранили в фосфатном буфере, содержащем 0,1% (мас./об.) азида натрия.
Способ очистки образца
Все образцы пропускали через активированные NHC колонки на AKTA prime system (Pharmacia Biotech). Образцы наносили в 20 мМ фосфате натрия, pH 7,5, и элюировали в 3 М мочевины или при pH 8,0, или при pH 2,0. Объем образца в размере 1 мл нанесли на колонку посредством пробоотборной петли, а примеси отмывали 5 мл фосфатного буфера. Через колонку пропускали 6 мл буфера для элюции, начальному 1 мл буфера позволяли стечь в сток, тогда как следующие 2 мл собирали для анализа посредством электроспрейной масс-спектроскопии. Колонку восстанавливали посредством отмывки 4 мл фосфатного буфера с последующими 10 мл 3 М мочевины и затем 10 мл фосфатного буфера в качестве подготовки для следующего образца. Скорость потока для всех стадий составляла 1 мл/мин.
Экспериментальная процедура масс-спектрометрии
Элюент из иммуноаффинной колонки собирали как фракции объемом 2 мл и хранили ночь при 4°C. Образцы наносили на 2 мл удерживающей петли. Содержимое удерживающей петли затем наносили на кассету C8 (Hichrom) при потоке 1 мл/мин в 20% B (A=0,1% TFA в воде B=0,1% TFA в ацетонитриле/воде 90/10 (об./об.)). После отмывки для удаления солей буфера белок элюировали в двойном квадрупольном масс-спектрометре Quattro II (Micromass UK Ltd), используя 90% B при потоке 25 мкл/мин. Обнаружение проводили в непрерывном режиме. Сканирующий диапазон м/з составил 700-2000 при 5 с на сканирование. Напряжение в капилляре составляло 3 кВ, а напряжение конуса линейно изменяли от 33 В до 74 В выше сканированного диапазона м/з. Температура источника составляла 80°C, а LM Res и HM Res установили на 15,5. Пик элюции из кассеты по продолжительности составил примерно 1 мин. Устройство калибровали с использованием миоглобина сердечной мышцы лошади.
Результаты
Перекрестная реактивность антитела с биологическими маркерами Hsp60
Как показано на фиг.6, стандартный анализ связывания демонстрирует, что Hsp60 из ряда бактериальных видов перекрестно реагирует с моноклональным антителом, полученным против Hsp60 Chlamydia trachomatis и связывающим консервативный эпитоп (RGIDKA). Кривые связывания показывают, что такое антитело пригодно для иммунной очистки биологических маркеров Hsp60 из ряда бактериальных видов.
Идентификация Hsp60 E. coli K12 по молекулярной массе
Фиг.7 демонстрирует масс-спектр, определенный для элюата из иммуноаффинной колонки против Hsp60, на которую нанесли бактериальный белок. Указанный пик молекулярной массы при 57203,1±1,8 Да соответствует пику Hsp60 из варианта K12 E.coli, указанному Burland et al (1995). Стандартная масса Hsp60 E.coli, как детализировано в записи P06130 базы данных Swiss-Prot, составляет 57137 Да. Однако вариант, указанный Burland et al, имел две мутации, А261L и I261М, которые вместе давали ожидаемую массу 57197. Это находится в пределах известной массовой погрешности устройства (±0,01%) и позволяет однозначно идентифицировать не только организм, но и индивидуальный штамм и/или мутанта.
Источники информации
Bakhtier R and Tse FL. Biological mass spectrometry: a primer. Mutagenesis 15: 415-430 (2000).
Bonenberger ТЕ, Ihrke PJ, Naydan DK and Affolter VK. Rapid identification of tissue micro-organisms in skin biopsy specimens from domestic animals using polyclonal BCG antibody. Vet Dermatot 12:41-47 (2001).
Bundy JL and Fenselau C. Lectin and carbohydrate affinity capture surfaces for mass spectroscopic analysis of microorganisms. Anal Chem 73:751-757 (2001).
Buriand VD, PIunkett G, Sofia HJ. Daniels DL and Blattner FR. Analysis of the Escherichia coli genome VI: DNA sequence of the region from 92.8 through 100 minutes. Nucleic Acids Res 23: 2105-2119 (1995).
Chong BE, Wall DB, Lubman DM and Flynn SJ. Rapid profiling of E. coli proteins up to 500kDa from whole cell lysates using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. Rapid Commun Mass Spectrom 11:1900-1908 (1997).
Downard KM. Contributions of mass spectrometry to structural immunology. J Mass Spectrom 35: 493-503 (2000).
Henderson SC. Valentine SJ, Counterman AE and Clemmer DE. ESI/ion mobility/time-of-flight mass spectrometry for rapid and sensitive analysis of biomarker mixtures. Anal Chem 71:291-301 (1999).
Hoffman D, Hesselberth J and Ellington AS. Switching nucleic acids for antibodies. Nature Biotechnol 19: 313-314 (2001).
Krishnamurthy Т, David МТ, Stahl DC and Lee TD. Liquid chromatography / microspray mass spectrometry for bacterial investigations. Rapid Commun Mass Spectrom 13: 39-49 (1999).
Lacey JM, Bergen HR, Magera MJ, Naylor S and O’Brien JF. Rapid determination of transferrin isoforms by immunoaffinity liquid chromatography and electrospray mass spectrometry. Clin Chem 47: 513-518 (2001).
Rowley A, Choudhary JS, Marzioch M, Ward MA, Weir M, Solari RCE and Blackstock WP. Applications of protein mass spectrometry in cell biology. Methods 20: 383-397 (2000).
Sigler PB, Xu Z, Rye HS, Burston SG, Fenton WA and Horwich AL. Structure and function in GroEL-mediated protein folding. Annu Rev Biochem 67: 581-608 1998).
Willeke К and Baron PA. Aerosol Measurement – Principles, Techniques and Applications. Van Nostrand Reinhold (1993).
Yamashita T, Kiyoki E, Tomita Y and Taira H. Immunoaffinity purification and identification of the molecular chaperone calnexin. Biosci Biotechnol Biochem 63: 1491-1493 (1999).
Формула изобретения
1. Способ идентификации микроорганизмов, предусматривающий
а. идентификацию биологического маркера, характеризующегося тем, что видовые гомологи указанного биологического маркера, полученные из большинства видов, по меньшей мере, двух родов микроорганизмов, являются существенно структурно сходными настолько, что указанное структурное сходство позволяет выделить указанный биологический маркер из различных видов микроорганизмов и что каждый биологический маркер, полученный из каждого вида микроорганизмов указанных родов, обладает уникальной молекулярной массой;
b. выделение указанного биологического маркера посредством аффинной хроматографии, направленной к областям структурного сходства;
с. измерение массы указанного биологического маркера посредством масс-спектрометрии; и
d. анализ данных о молекулярной массе, полученных посредством обращения к базе данных, и установления таким образом представленного вида микроорганизма.
2. Способ по п.1, предусматривающий дополнительную/альтернативную стадию перед/до стадией(и) с расщепления выделенного биологического маркера на определенные фрагменты и определение их молекулярной массы посредством масс-спектрометрии.
3. Способ по п.2, в котором указанное расщепление проводят посредством ферментативного расщепления.
4. Способ по п.1, в котором масс-спектрометрию проводят посредством масс-спектрометрии с ионной ловушкой.
5. Способ по любому из пп.1-4, в котором на стадии b указанный биологический маркер выделяют из клеточного лизата.
6. Способ по любому из пп.1-4, в котором на стадии b указанный биологический маркер выделяют посредством иммуноафинной хроматографии.
7. Способ по п.6, в котором иммобилизованные антитела специфически связываются с перекрестие взаимодействующими эпитопами, присутствующими на видовых гомологах указанного маркера.
8. Способ по любому из пп.1-4, в котором биологический маркер представляет собой белок и указанное структурное сходство заключается в существенном сходстве аминокислотной последовательности.
9. Способ по любому из пп.1-4, в котором микроорганизмы представляют собой бактерии.
10. Способ по любому из пп.1-4, в котором биологический маркер представляет собой белок теплового шока.
11. Способ по п.10, в котором белок теплового шока представляет собой Hsp60.
12. Способ по любому из пп.1-4, в котором биологический маркер представляет собой аденилаткиназу.
13. Устройство для автоматического выполнения способа по любому из пп.1-4, содержащее
а. средства для выделения указанного биологического маркера посредством аффинной хроматографии;
b. блок, приспособленный для приема и анализа указанного выделенного биологического маркера, содержащий масс-спектрометр, функционирующий для определения молекулярной массы указанного биологического маркера;
с. устройство обработки данных, приспособленное для приема данных, полученных из указанного масс-спектрометра, и сравнения их с базой данных известных молекулярных масс биологического маркера и установления таким образом природы обнаруженного микроорганизма.
14. Устройство по п.13, дополнительно содержащее устройство, содержащее один или несколько иммобилизованных протеолитических ферментов и приспособленное для приема биологических маркеров и расщепления их на пептиды для анализа посредством масс-спектрометрии.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 23.05.2008
Извещение опубликовано: 27.07.2010 БИ: 21/2010
|
|