Патент на изобретение №2290922
|
|||||||||||||||||||||||||||||||||||||||||||||
(54) СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНЕЙ СУСТАВОВ
(57) Реферат:
Изобретение относится к области химико-фармацевтической промышленности, а именно для создания средств, используемых при лечении болезней суставов. Средство представляет собой лиофилизат, содержащий глюкозамина соль, хондроитинсульфат и трисамин при определенном соотношении компонентов. Средство повышает удельную концентрацию активного ингредиента в составе препарата и, как следствие, увеличение скорости и эффективности диффузии активной субстанции в зону сустава. 1 з.п. ф-лы, 1 табл.
Изобретение относится к области медицины, а именно к препаратам для лечения болезней суставов. Болезнями суставов страдают около 70% населения старше 45 лет. Они выражаются в виде болей в суставе, усиливающихся при движении, ощущении скованности. Воспалительные процессы сопровождаются припухлостью, изменением формы и очертаний суставов. Кроме того, при артрологических заболеваниях суставов постепенно разрушается хрящ, покрывающий суставные поверхности, а также костная ткань и внутренняя поверхность суставной сумки. В настоящее время широкое распространение в мировой медицинской практике для лечения болезней суставов (артритов, артрозов, остеохондроза и т.п.) получили препараты на основе сахаридов (соли глюкозамина, хондроитинсульфат), в основном в форме таблеток, капсул и в виде инъекций. Лечение этими препаратами не только уменьшает воспаление и боли в суставах, но и продуцирует восстановление разрушенной хрящевой ткани [Насонов Е.Л. Клинические рекомендации и алгоритмы для практикующих врачей, Ревматология, М., 2004; K.Pavelka, Archives Internal Medicine, №10, 2002, №7, 2003]. Известен инъекционный препарат, содержащий в качестве активного ингредиента полисахарид-хондроитинсульфат с молекулярной массой 8000÷16000 Дальтон (8÷12 мас.%), консервант – бензиновый спирт (0,8÷1,2 мас.%) и воду (остальное) [патент РФ №2021812]. Его недостатки состоят в том, что при использовании в качестве хондропротективной составляющей полисахарида-хондроитинсульфата, обладающего полидисперсной высокой молекулярной массой (8000÷16000 Дальтон), ограничена диффузия активного ингредиента в зону сустава, что существенно снижает фармакокинетику поступления препарата в кровяное русло и хрящ сустава при его внутримышечном введении, и, как следствие, невысоки биодоступность и эффекты ингибирования процесса разрушения хрящевой ткани и ее регенерации (препарат квалификации Long). Наиболее близким к заявляемому средству по составу является инъекционный препарат, содержащий в качестве активного ингредиента сахарид-глюкозамина гидрохлорид (кислый сахарид с рН водного раствора 1,2÷2,5), нейтрализующее средство – этилендиамин, местноанестезирующее средство – тримекаин и вспомогательные вещества [патент РФ №2118156]. Низкая молекулярная масса глюкозамина гидрохлорида (215,0 Дальтон) и его высокая фармакологическая активность [Е.С.Цветкова, Научно-практическая ревматология, №2, 2003] в лечении болезней суставов обеспечивают создание эффективного хондропротективного препарата. Недостатки указанного препарата состоят в следующем: – препарат содержит в качестве активного ингредиента мономер соль глюкозамина с коротким периодом полувыведения из организма (Т1/2 около двух часов), что позволяет отнести препарат только к квалификации Rapid; – препарат состоит из двух ампул: ампулы с раствором глюкозамина гидрохлорида и ампулы с раствором этилендиамина. Приготовление препарата для введения больному заключается в смешивании содержимого двух ампул в шприце непосредственно перед введением инъекции; – нейтрализующий агент – этилендиамин – жидкость с температурой кипения 116°С и, следовательно, не может быть использован для приготовления монофазного препарата (ГА + нейтрализующий агент) в виде лиофилизата; – применение этилендиамина в препарате в сравнительно высокой концентрации (более 3 мас.% по отношению к глюкозамину) требует дополнительного введения в состав препарата местно-анестезирующего средства – тримекаина, что, в свою очередь, обуславливает ряд побочных нежелательных эффектов. Задача, решаемая предлагаемым изобретением, – разработка монофазного инъекционного препарата для лечения болезней суставов в виде лиофилизата, сочетающего хондропротективное действие мономера – глюкозамина и полимера – хондроитинсульфата с высокими фармакокинетическими показателями и биодоступностью с исключением недостатков прототипа. Технический результат от использования изобретения заключается в создании препарата квалификации Mikst, повышении удельной концентрации активного ингредиента в составе препарата и, как следствие, увеличении скорости и эффективности диффузии активной субстанции в зону сустава. Для достижения поставленного результата предлагается средство для лечения болезней суставов, представляющее собой лиофилизат, содержащий сахарид – глюкозамина соль, полисахарид – хондроитинсульфат и нейтрализующий агент алифатический амин – трометамол при следующем соотношении компонентов, мас.%:
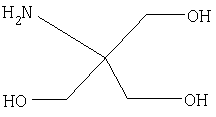
Одномоментное включение в состав препарата смеси моносахарида – соли глюкозамина и полисахарида – хондроитинсульфата обеспечивает достижение синергетического эффекта в лечении артрологических заболеваний, поскольку экзогенный глюкозамин дополнительно продуцирует синтез хондроцитами эндогенных хондроитинсульфатов и протеогликанов, являясь их универсальным предшественником [Международный Медицинский журнал, №3, 2000 г.]. Варьирование в составе препарата в широком интервале соотношения моносахарид/полисахарид обеспечивает свободу выбора в создании конкретных лекарственных форм квалификаций Rapid, Mikst, Long с различной концентрацией активных ингредиентов и, как следствие, заданными фармакологической активностью, фармакокинетическими и фармакодинамическими характеристиками. В качестве соли глюкозамина могут быть использованы известные фармацевтические субстанции (зарегистрированные в РФ или импортные, соответствующие требованиям Фармакопеи США 27 издания): гидрохлорид глюкозамина, натриевые или калиевые соли сульфата глюкозамина. Предпочтительным является использование динатриевой соли сульфата глюкозамина и гидрохлорида глюкозамина. В качестве хондроитинсульфата могут быть использованы известные фармацевтические субстанции хондроитинсульфата, например зарегистрированные в РФ, или импортные субстанции, соответствующие требованиям USP27 – Фармакопеи США 2004 г. издания. Нейтрализующий агент – трисамин (торговое название) зарегистрирован в качестве фармацевтической субстанции в России за №78/702/1. Международное название – трометамол. Химическое название -2-Амино-2-(гидроксиметил)-1,3-пропандиол Количество добавляемого к смеси активных ингредиентов трисамина определяется кислотностью коммерческого образца используемой соли и устанавливается в каждом опыте конкретно до получения перед розливом исходного раствора с физиологическим значением рН 5,0-8,0. Экспериментально установлено, что введение в состав инъекционного препарата антацидного средства системного действия – трисамина, обладающего буферными свойствами и местно-анестезирующим действием, существенно ускоряет транспорт активного вещества в кровяное русло живого организма. Трисамин, проникая через клеточные мембраны, повышает транспорт, биодоступность и удельное содержание сахарида в зоне сустава. Указанное увеличение биодоступности активного ингредиента и усиление противовоспалительных свойств препарата связано также со способностью предлагаемой супрамолекулярной структуры изменять состояние среды в микроокружении сахарида. Фармакологическая группа – 8.8. Корректор метаболизма костной и хрящевой ткани (Регистр лекарственных средств России, 2005 г. издания). Технология производства препарата осуществляется известными методами и заключается в растворении активных ингредиентов в воде, стерильной фильтрации с последующими расфасовкой в ампулы и лиофильной сушкой раствора. Контроль количественного содержания активных ингредиентов (глюкозамин, хондроитинсульфат, трисамин) в препаратах проводится по известным методикам, принятым для аналогичных лекформ, зарегистрированных в РФ и содержащих активные ингредиенты (спектрофотометрически, нефелометрическое титрование). Пример 1. 95,0 г глюкозамина сульфата ×2NaCI и 5,0 г хондроитинсульфата растворяют при температуре не выше 40°С в 400 мл дистиллированной воды, добавляют при перемешивании около 0,5 г трисамина (до рН 6,0÷7,5). Раствор стерильно фильтруют через стерилизующие фильтры 0,22 мкм и разливают в стерильные ампулы по 2 мл. Режим лиофильной сушки препарата включает его замораживание при -80°С и высушивание в вакууме при комнатной температуре в течение 10 часов. В конечном препарате в 1 ампуле содержится 380 мг глюкозамина сульфата ×2NaCI, 20 мг хондроитинсульфата и 2,0 мг (0,5 мас.%) трисамина. Пример 2. 5 г глюкозамина сульфата ×2КСl и 95 г хондроитинсульфата растворяют при температуре не выше 70°С в 400 мл дистиллированной воды, добавляют при перемешивании около 0,1 г трисамина (до рН 6,0÷7,5). Раствор стерильно фильтруют через стерилизующие фильтры 0,22 мкм и разливают в стерильные ампулы по 2 мл. Режим лиофилизации по примеру 1. В конечном препарате в 1 ампуле содержится 20 мг глюкозамина сульфата ×2КСl, 380 мг хондроитинсульфата и 2,0 мг трисамина (0,1 мас.%). Пример 3. 50 г глюкозамина гидрохлорида и 50 г хондроитинсульфата растворяют при температуре не выше 40°С в 400 мл дистиллированной воды, добавляют при перемешивании около 2 г трисамина (до рН 6,0÷7,5). Раствор стерильно фильтруют через стерилизующие фильтры 0,22 мкм и разливают в стерильные ампулы по 2 мл. Режим лиофилизации по примеру 1. В конечном препарате в 1 ампуле содержится 200 мг глюкозамина гидрохлорида, 200 мг хондроитинсульфата и 8,0 мг трисамина (2,0 мас.%). Эффективность действия препарата изучали на моделях посттравматического остеоартроза, коллапса ушных раковин кроликов и асептического воспаления конечности крыс. При субхондральных дефектах головки бедренной кости крыс, вызванных хирургическим повреждением суставного хряща, предлагаемый препарат существенно уменьшает размер дефекта по сравнению с * контрольными животными. При внутривенном введении папаина у кроликов наблюдается коллапс ушных раковин – провисание их периферического конца. Использование предлагаемого препарата позволяет восстановить тургор ушных раковин, что свидетельствует об ингибировании разрушения хрящевой ткани ушных раковин. Сравнительная оценка хондропротективного действия препаратов Глюсат-1, Глюсат-2, Глюсат-3 (полученных соответственно по примерам 1-3 описания) и Глюсат-4 (получен по примеру 1 описания к патенту РФ №2118156) изучена в опытах на кроликах рентгенографически по изменению размера суставной щели по принятой методике (таблица 1).
Как следует из данных таблицы 1, введение в состав препарата хондроитинсульфата и нового нейтрализующего агента трисамина существенно повышает хондропротективную активность препарата по принятому объективному показателю “Изменение размера суставной щели”. Проведенные биологические исследования безвредности препарата показали, что при однократном введении препарата в дозах, в 100÷200 раз превышающих минимальные терапевтические для человека, он практически не токсичен. Препарат стабилен в течение 2 лет наблюдения. Предварительные клинические испытания препарата подтвердили его высокую хондропротективную активность и хорошую переносимость при лечении артрозов и остеохондроза.
Формула изобретения
1. Средство для лечения болезней суставов, представляющее собой лиофилизат, содержащий глюкозамина соль, отличающееся тем, что оно содержит дополнительно хондроитинсульфат и трометамол при следующем соотношении компонентов, мас.%:
2. Средство по п.1, отличающееся тем, что в качестве солей глюкозамина используют гидрохлорид глюкозамина, или натриевую, или калиевую соли сульфата глюкозамина.
PC4A – Регистрация договора об уступке патента СССР или патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Договор № РД0019385 зарегистрирован 09.03.2007
Извещение опубликовано: 20.04.2007 БИ: 11/2007
PC4A – Регистрация договора об уступке патента СССР или патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Договор № РД0032927 зарегистрирован 19.02.2008
Извещение опубликовано: 27.03.2008 БИ: 09/2008
QB4A – Регистрация лицензионного договора на использование изобретения
Лицензиар(ы): Общество с ограниченной ответственностью “Байкал”
Вид лицензии*: НИЛ
Лицензиат(ы): Общество с ограниченной ответственностью “Медицинский центр “Эллара”
Договор № РД0032885 зарегистрирован 18.02.2008
Извещение опубликовано: 27.03.2008 БИ: 09/2008
* ИЛ – исключительная лицензия НИЛ – неисключительная лицензия
PC4A – Регистрация договора об уступке патента СССР или патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Договор № РД0055988 зарегистрирован 22.10.2009
Извещение опубликовано: 10.12.2009 БИ: 34/2009
|
|||||||||||||||||||||||||||||||||||||||||||||