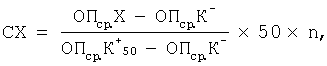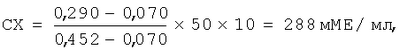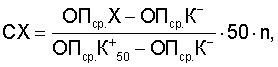Патент на изобретение №2290642
|
||||||||||||||||||||||||||
(54) ТЕСТ-СИСТЕМА ДЛЯ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АНТИ-HBS В БИОЛОГИЧЕСКОМ ОБРАЗЦЕ
(57) Реферат:
Изобретение относится к иммунологии. Предложена тест-система для количественного определения анти-HBs в биологическом образце методом иммуноферментного анализа. Тест-система содержит планшет стрипированный, сорбированный HbsAg, HBsAg-конъюгат, положительный контрольный образец, отрицательный контрольный образец, промывающий раствор, субстратный буферный раствор с перекисью водорода, хромоген, стоп-реагент. В качестве антигена для сорбирования планшета и изготовления HBsAg, конъюгата, состоящего из HbsAg, конъюгированного непосредственно с ферментом пероксидазой, используют вирусбезопасный HBsAg, очищенный из плазмы осаждением иммунного комплекса. Положительным контролем является иммуноглобулин человека нормальный с концентрацией анти-HBs 50 мМЕ/мл, стабилизированный нормальной донорской плазмой и мальтозой в конечной концентрации 2-20%, оттитрованный по международному стандарту содержания анти-HBs. Субстратный раствор и хромоген-0,2% раствор 3, 3′, 5, 5′ тетраметилбензидина в диметилсульфоксиде, разбавленный в 5 раз цитратным буфером с содержанием гидроперита в конечной концентрации 0,015% и 2-хлорацетамида в конечной концентрации 0,1%. Расчет количественного содержания антител к HbsAg осуществляют по формуле: СХ=((ОПср.Х-ОПср.К–)/(ОПср.К50 +-ОПср.К–))·50n, где СХ-концентрация анти-HBs в исследуемом образце (мМЕ/мл), ОПср.Х – среднее значение оптической плотности исследуемого образца, ОПср.К– – среднее значение оптической плотности контрольного отрицательного образца, ОПср.К50 + – среднее значение оптической плотности контрольного положительного образца, 50-концентрация анти-HBs в K50 +(мМЕ/мл), n – кратность разведения исследуемого образца. Результаты оценивают, если ОПср.К–
Изобретение относится к вирусологии, биотехнологии и иммунологии и касается разработки тест-системы для количественного определения антител к поверхностному антигену вируса гепатита В. Известна тест-система для определения антител к поверхностному антигену вируса гепатита В: «Monolisa anti – HBs 3.0». Код 72400. 96 тестов. Franch National Centre for Blood Transfusion, 2000, описанная в инструкции по применению (09/95). При использовании известной тест-системы иммуноферментный анализ (ИФА) проводится в 2 стадии, что неудобно в применении. Наиболее близкой к заявляемой по технической сущности и достигаемому результату является тест-система для определения антител к HBs-антигену, защищенная патентом РФ №2206095, кл. C 12 N 15/51, G 01 N 33/576, А 61 К 39/29, опубл. 06.10.2003. Известная тест-система для определения антител к HBsAg содержит стрипированный планшет, сенсибилизированный дрожжевым рекомбинантным HBsAg серотипов ау и/или ad, промывающий раствор, конъюгат биотин-HBsAg, конъюгат авидин-пероксидазу или стрептавидин-пероксидазу, субстратный буфер с перекисью водорода, хромоген, стоп-реагент, отрицательный контроль, положительный контроль в виде сыворотки крови, полученной иммунизацией здоровых доноров рекомбинантной дрожжевой вакциной против гепатита В, оттитрованной по международному стандарту содержания анти-HBs, или отраслевой стандартный образец иммуноглобулина человека против вируса гепатита В, блокатор, в виде 5%-ного раствора казеината натрия в натрий-боратном буфере с рН 8,3, референс-стандарт для количественного определения антител к HBs-антигену в виде сыворотки крови, полученной иммунизацией здоровых доноров рекомбинантной дрожжевой вакциной против гепатита В, оттитрованной по международному стандарту содержания анти-HBs, или отраслевой стандартный образец иммуноглобулина человека против вируса гепатита В и таблицу логарифмов для расчета количественного содержания антител к HBs-антигену. При изготовлении известной тест-системы используется сложная биотин-стрептавидиновая технология введения ферментной метки, а также усложнен расчет концентрации анти-HBs – необходимо построение калибровочного графика. В известной тест-системе для определения антител к HBs-антигену для получения иммуносорбента используется дрожжевой рекомбинантный HBsAg, в котором присутствует определенное количество белков штамма-продуцента, приводящее к повышению процента ложноположительных результатов, что требует введения дополнительного реагента – блокатора. Кроме того, положительный контрольный образец представлен лиофилизированной формой, что усложняет его производство и применение. Задача, решаемая предлагаемым изобретением, – совершенствование тест-системы для определения анти-HBs в биологическом образце. Технический результат от использования изобретения заключается в упрощении технологии производства тест-системы и способа ее применения при сохранении высокой чувствительности и специфичности. Указанный результат достигается тем, что в тест-системе для количественного определения анти-HBs в биологическом образце методом иммуноферментного анализа, содержащая планшет стрипированный, сорбированный HBsAg, HBsAg-конъюгат, положительный контрольный образец, отрицательный контрольный образец, промывающий раствор, субстратный буферный раствор с перекисью водорода, хромоген, стоп-реагент, в качестве антигена для сорбирования планшета и для изготовления HBsAg-конъюгата, состоящего из HBsAg, конъюгированного непосредственно с ферментом пероксидазой. используют вирусбезопасный HBsAg, очищенный из плазмы осаждением иммунного комплекса, в качестве положительного контрольного образца используют иммуноглобулин человека нормальный, содержащий анти-HBs в концентрации 50 мМЕ/мл. стабилизирований нормальной донорской плазмой и мальтозой в конечной концентрации 2-20%, оттитрованный по международному стандарту содержания анти-HBs, в качестве субстратного раствора и хромогена используют 0,2%-ный раствор 3, 3′,5, 5′ – тетраметилбензидина в диметилсульфоксиде, разбавленный в 5 раз цитратным буфером с содержанием гидроперита в конечной концентрации 0,015% и 2-хлорацетамида в конечной концентрации 0,1%, а расчет количественного содержания антител к HbsAg осуществляют по формуле: где СХ – концентрация анти-HBs в исследуемом образце (мМЕ/мл), ОПср.Х – среднее значение оптической плотности исследуемого образца, ОПср.К– – среднее значение оптической плотности контрольного отрицательного образца, ОПср.К+ 50 – среднее значение оптической плотности контрольного положительного образца, 50 – концентрация анти-HBs в К+ 50 (мМЕ/мл), n – кратность разведения исследуемого образца, при этом, результаты оценивают, если ОПср.К– Предлагаемая тест-система представляет собой набор реагентов, необходимых для количественного определения антител к поверхностному антигену возбудителя гепатита В методом ИФА в сыворотке крови или плазме, а также препаратах иммуноглобулинов. В состав тест-системы входят: иммуносорбент, конъюгат, контрольный отрицательный образец (К-), контрольный положительный образец (К+ 50), оттитрованный по ОСО 42-28-320 до концентрации 50 мМЕ/мл, цитратный буферный раствор (ЦБ), содержащий водорода перекись, тетраметилбензидин (ТМБ), фосфатно-солевой буферный раствор (ФСР-Т) и раствор серной кислоты (стоп-реагент). Для приготовления иммуносорбента и конъюгата с пероксидазой хрена используют HBsAg, очищенный из донорской плазмы оригинальным способом, позволяющим упростить технологию их изготовления и исключить риск заражения при работе с данной тест-системой с сохранением высокой специфичности и чувствительности иммуноферментного анализа ИФА. Приготовление компонентов тест-системы осуществляют следующим образом. 1. Получение HBsAg. Пулируют 2 л плазмы крови доноров, содержащей HBsAg в конечной концентрации 50-100 мкг/мл, и прогревают на водяной бане при температуре 60°С в течение 1 ч. К плазме, охлажденной до температуры (2-8)°С добавляют ПЭГ-6000 до конечной концентрации 2,5-4%, выдерживают в течение ночи при температуре (2-8)°С, затем осветляют центрифугированием (ЦФ) при 15000-20000 об/мин в течение 30 мин. К 20 объемам осветленной плазмы добавляют 1 объем козьей антисыворотки против HBsAg с титром анти-HBs 1:64-1:128 в РПГ и выдерживают в течение суток при температуре (2-8)°С. Образовавшийся осадок, состоящий из иммунного комплекса HBsAg-aHra-HBs, отделяют ЦФ, и промывают от примесей других белков ресуспендированием в 40-50 мл 0,9%-ного раствора натрия хлорида с последующим ЦФ. Процедуру промывки иммунного комплекса повторяют 3 раза. Промытый осадок растворяют в 40-50 мл 2%-ного раствора лимонной кислоты, содержащего пепсин в конечной концентрации 1 мг/мл, выдерживают при температуре 37°С в течение суток, затем рН смеси доводят до 7,0 добавлением 1 М раствора натрия гидроокиси. К раствору добавляют твин-80 до конечной концентрации 2%, выдерживают при температуре (2-8)°С в течение суток, затем осветляют ЦФ. Раствор ультрацентрифугируют на ступенчатом градиенте плотности 20-50% раствора сахарозы при 27000 об/мин (70000 g) и температуре (18-22)°С в течение 20 ч. Собирают зону над 50%-ным раствором сахарозы, содержащую HBsAg, и диализуют против 0,9%-ным раствора натрия хлорида при температуре (2-8)°С в течение суток, затем фильтруют через стерилизующую мембрану с диаметром пор 0,22 мкм. Полученный данным способом препарат очищенного HBsAg имеет вид слегка опалесцирующей жидкости желтоватого цвета. Концентрация белка – 2-4 мг/мл, титр HBsAg в реакции обратной пассивной гемагглютинации – 1:200000-1:400000. Препарат не взаимодействует с антисывороткой к белкам сыворотки крови человека в реакции преципитации в геле и не содержит ДНК вируса гепатита В в ПЦР-анализе. Препарат HBsAg используют в приготовлении иммуносорбента и конъюгата. 2. Приготовление иммуносорбента. HBsAg, разведенный в 0,9%-ном растворе натрия хлорида до концентрации белка 2-4 мкг/мл вносят по 150 мкл в каждую лунку 96-луночного разборного полистиролового планшета фирмы “Costar” (США, кат. №92592) или другого аналогичного качества. Планшет герметично закрывают и выдерживают в течение суток при комнатной температуре, затем содержимое лунок удаляют. Полученный иммуносорбент высушивают на воздухе в течение суток при комнатной температуре и герметично запаивают под вакуумом в пакет из пленки металлизированной. 3. Приготовление HBsAg-конъюгата (HBsAg-ПХ). К раствору, содержащему 4 мг пероксидазы хрена (RZ 3,0) в 1 мл воды дистиллированной, добавляют 0,2 мл свежеприготовленного 0,02 М раствора перйодата натрия и перемешивают в течение 20 мин при комнатной температуре. Полученный раствор диализуют против 0,001 М Na-ацетатного буфера (рН 4,4) в течение ночи при температуре 4°С. К раствору пероксидазы добавляют 20 мкл 0,2 М Na-карбонатного буфера (рН 9,5) и 8 мг HBsAg в 2 мл того же буфера. Раствор перемешивают в течение 2 ч при комнатной температуре, добавляют 0,1 мл свежеприготовленного водного раствора натрия боргидрида (4 мг/мл) и перемешивают в течение 2 ч при температуре 4°С. Конъюгат диализуют против 0,9%-ного раствора натрия хлорида в течение суток при температуре 4°С, затем добавляют равный объем глицерина. 4. Приготовление контрольных образцов (К– и К+ 50). Нормальную донорскую плазму, не содержащую HBsAg, антител к HBsAg, к вирусам иммунодефицита человека ВИЧ-1, ВИЧ-2 и вирусу гепатита С, прогревают на водяной бане при температуре 60°С в течение 1 ч. Затем к плазме, охлажденной до 2-8°С, добавляют консервант фенол до конечной концентрации 0,2% и осветляют ЦФ. Используют для приготовления К–. Для приготовления К+ 50 (содержащего анти-HBs в концентрации 50 мМЕ/мл; коэффициент вариации не более±10%) используют иммуноглобулин человека нормальный, содержащий анти-HBs в концентрации 50 мМЕ/мл, нормальную донорскую плазму и мальтозу до конечной концентрации 2-20%. На протяжении срока наблюдения (12 месяцев) не было выявлено статистически достоверных изменений концентрации анти-HBs в К+ 50 при содержании мальтозы в диапазоне от 2 до 20%. При хранении К+ 50 без стабилизации наблюдалось снижение концентрации анти-HBs более чем на 10%. При внесении мальтозы более 20% наблюдалось снижение ее растворимости. 5. Приготовление ЦБ. К 0,05 М цитратному буферному раствору (рН 4,0±0,1), добавляют гидроперит в конечной концентрации 0,015% и 2-хлороацетамид конечной концентрации 0,1%. 6. Приготовление ТМБ (концентрат). Готовят 0,2%-ный раствор 3,3′,5,5′-тетраметилбензидина на диметилсульфоксиде (димексиде). 7. Приготовление ФСР-Т (концентрат). Готовят фосфатно-солевой раствор (рН 7,5±0,3) с детергентом: натрия хлорид – 250,0 г; натрий фосфорнокислый 2-замещенный 12-водный – 25,0 г; твин 80 – 50,0 мл; вода дистиллированная до 1,0 л. 8. Приготовление стоп-реагента. Готовят 1 М раствор кислоты серной. ИФА проводят следующим образом. Иммуносорбент перед использованием промывают 2 раза добавлением в лунки по 250-350 мкл раствора ФСР-Т, полученного разведением концентрата в 25 раз водой дистиллированной. К+ 50 и К– вносят по 100 мкл в 3 лунки каждый. В оставшиеся лунки вносят по 100 мкл исследуемых образцов. Затем во все использованные лунки добавляют по 50 мкл раствора конъюгата и содержимое лунок перемешивают осторожным постукиванием по краям планшета в течение 20-30 сек. Планшет накрывают крышкой и выдерживают во влажной камере в течение 2 ч при температуре (40±2)°С, затем промывают 6 раз раствором ФСР-Т. Свежеприготовленный субстратный раствор, полученный разведением концентрата ТМБ в 5 раз раствором ЦБ, вносят в лунки по 150 мкл и выдерживают в течение 20-25 мин при температуре от 18 до 25°С в защищенном от света месте. Ферментативную реакцию останавливают добавлением в лунки по 50 мкл стоп-реагента и немедленно производят учет результатов ИФА. Результаты рассчитывают следующим образом. Проводят двухволновое измерение оптической плотности (ОП) раствора в лунках планшета с помощью анализатора иммуноферментного «SUNRISE» фирмы TECAN (Австрия) или аналогичного, установив “0” прибора по воздуху. Тест-фильтр 450 нм, референс-фильтр – 620-680 нм. Результаты ИФА оценивают, если ОПср.К– Расчет значения ОП критического уровня (ОПкрит.) производят по формуле: ОПкрит.=ОПср.К–+0,060. Значения ОП неразведенных образцов ниже ОПкрит.считают отрицательными. Концентрацию анти-HBs определяют для образцов со значением ОП, находящейся в диапазоне ОПкрит. и 1,500 оптических единиц (о.е.). Если ОП образца выходит за верхнюю границу указанного диапазона, эмпирически подбирают его разведение. Разведение готовят на растворе ФСР-Т. Концентрацию анти-HBs в исследуемом образце вычисляют по формуле: где СХ – концентрация анти-HBs в исследуемом образце (мМЕ/мл); ОПср.Х – среднее значение оптической плотности исследуемого образца; ОПср.К– – среднее значение оптической плотности контрольного отрицательного образца; ОПср.К+ 50 – среднее значение оптической плотности контрольного положительного образца; 50 – концентрация анти-HBs в К+ 50 (мМЕ/мл); n – кратность разведения исследуемого образца. Пример конкретного применения. Если ОП исследуемого образца, разведенного в 10 раз, равна 0,290 о.е., ОПср.К– равна 0,070 о.е., а ОПср.К+ 50 равна 0,452, о.е., то концентрация анти-HBs в неразведенном исследуемом образце, рассчитанная по вышеприведенной формуле будет равна: При сравнении результатов определения уровня анти-HBs в 25 образцах плазмы донорской крови и в 20 образцах препаратов иммуноглобулинов с использованием калибровочного графика и формулы статистически достоверных различий между значениями концентраций антител, рассчитанными двумя способами не установлено. Оценка специфической активности разработанной тест-системы проводилась при помощи прямого твердофазного иммуноферментного анализа (ИФА) с использованием стандартного образца иммуноглобулина человека против вируса гепатита В ОСО-42-28-320-00 и контрольных образцов для оценки качества выявления суммарных антител к вирусу гепатита В ФСВОК (Федеральной системы внешней оценки качества). Показатель чувствительности разработанной тест-системы по ОСО составил не менее 10 мМЕ/мл. Зависимость между логарифмом показателей оптической плотности (ОП) ОСО и логарифмом его концентраций носила линейный характер (коэффициент корреляции более 0,995). Специфическая активность тест-системы с контрольными образцами ФСВОК составила 100%. Преимуществами разработанной тест-системы являются высокая специфическая активность, сокращение стадий анализа, простота и удобство в применении и расчете концентрации анти-HBs. Использование HBsAg, очищенного из плазмы осаждением иммунного комплекса, позволяет избежать использования дополнительных реагентов (блокаторов) для устранения неспецифических реакций. Конъюгирование HBsAg непосредственно с ферментом упрощает технологию производства тест-системы. Преимуществом изобретения является более экономичная технология получения тест-системы для количественного определения анти-HBs с высокой специфической активностью, что обеспечивается использованием реагентов, полученных из природных источников, а также более простые методики проведения ИФА и расчета количественного содержания анти-HBs. Разработанная тест-система может быть использована для количественного определения анти-HBs с целью изучения иммунного статуса населения, при отборе плазмы с высоким содержанием антител для производства специфического иммуноглобулина, для контроля препаратов иммуноглобулина.
Формула изобретения
Тест-система для количественного определения анти-HBs в биологическом образце методом иммуноферментного анализа, содержащая планшет стрипированный, сорбированный HBsAg, HBsAg- конъюгат, положительный контрольный образец, отрицательный контрольный образец, промывающий раствор, субстратный буферный раствор с перекисью водорода, хромоген, стоп-реагент, отличающаяся тем, что в качестве антигена для сорбирования планшета и для изготовления HBsAg-конъюгата, состоящего из HBsAg, конъюгированного непосредственно с ферментом пероксидазой, используют вирусбезопасный HBsAg, очищенный из плазмы осаждением иммунного комплекса, в качестве положительного контрольного образца используют иммуноглобулин человека нормальный, содержащий анти-HBs в концентрации 50 мМЕ/мл, стабилизированный нормальной донорской плазмой и мальтозой в конечной концентрации 2-20%, оттитрованный по международному стандарту содержания анти-HBs, в качестве субстратного раствора и хромогена используют 0,2%-ный раствор 3, 3′, 5,5′ – тетраметилбензидина в диметилсульфоксиде, разбавленный в 5 раз цитратным буфером с содержанием гидроперита в конечной концентрации 0,015% и 2-хлорацетамида в конечной концентрации 0,1%, а расчет количественного содержания антител к HBsAg осуществляют по формуле: где СХ – концентрация анти-HBs в исследуемом образце (мМЕ/мл), ОПср.Х – среднее значение оптической плотности исследуемого образца, ОПср.К– – среднее значение оптической плотности контрольного отрицательного образца, ОПср.K50 +– среднее значение оптической плотности контрольного положительного образца, 50 – концентрация анти-HBs в K50 +(мМЕ/мл), n – кратность разведения исследуемого образца, при этом результаты оценивают, если Опср.К–
|
||||||||||||||||||||||||||

 0,150 опт.ед., ОПср.K50 +>2,5 (ОПкрит.), где ОПкрит.=ОПср.К–+0,06. Концентрацию анти-HBs определяют, если значения ОП исследуемого образца находятся в диапазоне от ОПкрит. до 1,500 о.е., если ОП образца выходит за верхнюю границу указанного диапазона, то эмпирически подбирают его разведение. Использование изобретения позволяет упростить расчет количественного содержания анти HBs при чувствительности не менее 10 мМЕ/мл по стандарту ОСО-42-28-320-00.
0,150 опт.ед., ОПср.K50 +>2,5 (ОПкрит.), где ОПкрит.=ОПср.К–+0,06. Концентрацию анти-HBs определяют, если значения ОП исследуемого образца находятся в диапазоне от ОПкрит. до 1,500 о.е., если ОП образца выходит за верхнюю границу указанного диапазона, то эмпирически подбирают его разведение. Использование изобретения позволяет упростить расчет количественного содержания анти HBs при чувствительности не менее 10 мМЕ/мл по стандарту ОСО-42-28-320-00.