|
|
(21), (22) Заявка: 2005107579/13, 21.03.2005
(24) Дата начала отсчета срока действия патента:
21.03.2005
(43) Дата публикации заявки: 10.09.2006
(46) Опубликовано: 27.12.2006
(56) Список документов, цитированных в отчете о
поиске:
NAGANO M. et al., Retrovirus – mediated gene delivery into male germ Line stem cells, FEBS Lett., 2000, v.475, n.1, p.7-10. RU 2168337 C2, 10.06.2001, весь документ,. КУЗНЕЦОВ А.В. и др. Перколяция чужеродной ДНК в геном при оплодотворении. Проблемы репродукции, 1998, №1, с.1-7.
Адрес для переписки:
142132, Московская обл., Подольский р-н, п. Дубровицы, ВНИИ животноводства, директору ВИЖ В.Н.Виноградову
|
(72) Автор(ы):
Новгородова Инна Петровна (RU),
Зиновьева Наталия Анатольевна (RU),
Эрнст Лев Константинович (RU)
(73) Патентообладатель(и):
Всероссийский государственный научно-исследовательский институт животноводства (ВИЖ) (RU)
|
(54) СПОСОБ ТРАНСФОРМАЦИИ СТВОЛОВЫХ КЛЕТОК СЕМЕННИКОВ ЖИВОТНЫХ IN VIVO
(57) Реферат:
Изобретение относится к биотехнологии. Для трансформации используют 8-9-недельных самцов кроликов, которым в паренхиму семенника инъецируют векторную конструкцию pX-RSVhGH кодирующую гормон роста человека или pX-Ins, кодирующую инсулин человека. Эффективность трансформации генных конструкций определяют при помощи иммуногистохимического набора Novocastra (Sigma, США). Способ позволяет повысить эффективность генетической трансформации клеток семенников кроликов. 3 ил.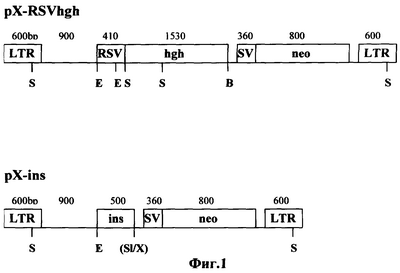
Изобретение относится к биотехнологии, в частности к генной инженерии, а именно к способам трансформации стволовых клеток семенников (СКС) кроликов in vivo путем введения в них чужеродного генетического материала в виде векторных систем.
При создании настоящего изобретения задача заключалась в разработке способа генетической трансформации стволовых клеток семенников кроликов in vivo с использованием опосредованного ретровирусами переноса генов.
Технический результат предлагаемого изобретения достигается тем, что предложен способ трансформации стволовых клеток семенников кроликов in vivo, включающий инъецирование векторных систем непосредственно в семенники и определение эффективности трансформации генных конструкций, отличающийся тем, что для трансформации используют 8-9-недельных самцов кроликов, которым в паренхиму семенника инъецируют векторную конструкцию pX-RSVhGH, кодирующую гормон роста человека, или pX-Ins, кодирующую инсулин человека, а эффективность трансформации определяют при помощи иммуногистохимического набора Novocastra (Sigma, США).
Схема используемых генных конструкций, приведена на фигуре 1. При этом RSV – промотор вируса саркомы Рауса; SV – промотор ранних генов вируса SV40; neo – ген неомицинфосфотрансферазы из транспозона Тп5 (где В – BamHI, Е – EcoRI, S – Sad, SI – SalI, X – Xhol) (фиг.1).
Пример. Трансформированные стволовые клетки сперматогонии на гистосрезах выявляли путем применения следующих процедур.
Изучали морфологию семенников разновозрастных групп самцов-кроликов в возрасте от 10 дней до 6 месяцев (с интервалом 7-14 дней при убое или кастрации) путем исследований гистосрезов семенных канальцев с целью выявления возраста с максимальным числом сперматогний для проведения биоинженерных манипуляций.
На основании полученных результатов проводили трансфекцию клеток сперматогенного эпителия кроликов in vivo в возрастной период 8-9 недель путем множественного введения (5-8 инъекций на семенник) генных конструкций в паренхиму семенников. Для генетической трансформации половых клеток семенников кроликов in vivo сформировали группы животных в зависимости от используемой генной конструкции (pX-Ins – ген инсулина человека под контролем промотора цитомегаловируса и pX-RSVhGH – ген гормона роста человека под контролем промотора вируса саркомы Рауса) и типа ретровирусного препарата. Для каждой из используемых генных конструкций были сформированы две опытные группы: 1-я – введение клеток-упаковщиц, 2-я – введение культуральной жидкости (n=3 для каждой опытной группы). Клетки-упаковщицы и культуральную жидкость инъецировали в количестве соответственно 1 млн и 0,5 мл (1×105) на семенник.
Через 7 и 14 дней после инъекции от животных при кастрации или убое отбирали пробы тканей семенников для анализа наличия трансформированных клеток. Экспрессию рекомбинантных генов на срезах тканей семенников кроликов определяли иммуногистохимическим методом при помощи набора Novocastra (Sigma, США). Выполняли анализ 20-и гистологических срезов (толщиной 4-5 мкм) с интервалом 50 мкм и определяли частоту генетической трансформации генных конструкций. Клетки, синтезирующие рекомбинантный вирус, окрашивались в красно-коричневый цвет.
Обработку полученных данных проводили на микроскопе «Opton» (Германия, объектив х40, окуляр х15) с использованием системы цифровой визуализации изображений (ООО «Система для микроскопии и анализа»).
Использование данного метода позволило показать успешную трансформацию клеток сперматогоний при использовании обоих генных конструкций.
Среднее значение частоты интеграции генной конструкции, содержащей гормон роста человека (число трансформированных сперматогоний к общему числу сперматогоний в трансформированных семенных канальцах, выраженное в процентах) при использовании культуры клеток, составило 3,1±0,1%. Эффективность генетической трансформации клеток семенников кролика in vivo (отношение числа трансформированных сперматогоний к общему их числу на срезе) при использовании рекомбинантного вектора pX-RSVhGH на 7 день после инъекции достигала 2,7·10-3.
Частота интеграции генной конструкции, содержащей ген инсулина человека (pX-Ins), при трансформации клеток семенников кроликов in vivo составила 3,5±0,1 и 3,4±0,1 соответственно при использовании клеток-упаковщиц и культуральной жидкости. Эффективность трансформации клеток семенников кроликов первой группы при использовании клеток-упаковщиц на 7 день составила 2,3·10-3 и была в 3,1 раза выше, по сравнению с показателями, полученными при инъекции культуральной жидкости. На 14 день после инъекции, частота генетической трансформации при использовании клеток-упаковщиц составила 4,1·10-3, что было 2,7 раз выше по сравнению с использованием супернатанта.
На фигуре 2-3 показана возможность эффективной трансформации СКС кролика при использовании генных конструкций pX-RSVhGH и pX-Ins (фиг.2-3). При этом на фигуре 2 в семенном канальце заметны три сперматогония, трансформированных генной конструкцией pX-RSVhGH (клетки указаны стрелками). На фигуре 3 в семенном канальце представлены два сперматогония, трансформированных генной конструкцией pX-Ins (клетки указаны стрелками). Окраска гематоксилин-эозин. Увеличение: объектив х40, окуляр х10.
Таким образом, при использовании генной конструкции pX-RSVbGH трансформированными оказались одна из 2500 клеток, в то время как при использовании генной конструкции pX-Ins – одна из 434 клеток.
Полученные результаты подтверждают возможность успешной трансформации клеток семенников кролика in vivo с использованием ретровирусных генных конструкций, при этом эффективность генетической трансформации клеток семенников кроликов зависит от генной конструкции, типа используемого препарата и времени после инъекции в семенники.
Предложенный способ может быть использован в экспериментальной медицине и ветеринарии, в том числе для генетической трансформации стволовых клеток сперматогоний с целью получения трансгенных животных.
Формула изобретения
Способ трансформации стволовых клеток семенников кроликов in vivo, включающий инъецирование векторных систем непосредственно в семенники и определение эффективности трансформации генных конструкций, отличающийся тем, что для трансформации используют 8-9-недельных самцов кроликов, которым в паренхиму семенника инъецируют векторную конструкцию pX-RSVhGH, кодирующую гормон роста человека, или pX-InS, кодирующую инсулин человека, а эффективность трансформации определяют при помощи иммуногистохимического набора Novocastra (Sigma, США).
РИСУНКИ
|
|