Патент на изобретение №2290219
|
||||||||||||||||||||||||||
(54) СПОСОБ ОБРАБОТКИ КЛЕТОК IN VITRO
(57) Реферат:
Изобретение относится к медицине, конкретно к патофизиологии, биотехнологии и лабораторному делу, касается негативной регуляции жизнедеятельности клеток in vitro и может быть использовано при лечении онкологических, онкогематологических и других заболеваний. Способ обработки клеток in vitro осуществляют путем воздействия импульсным током помещенного в клеточную взвесь электростимулятора, выполненного в виде капсулы, части которой представляют собой электроды, с размещенными внутри капсулы генератором импульсов и источником питания, при этом проводят комбинированное электрическое и ионное воздействие в течение не менее, чем 30 минут, а электроды содержат микроэлемент или микроэлементы. Использование изобретения позволяет упростить условия обработки клеток in vitro, предупредить загрязнения материала нежелательными примесями, повысить воспроизводимость результатов. 3 табл.
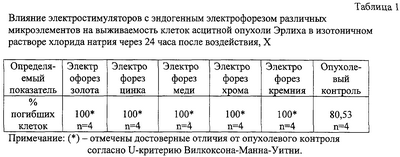
Изобретение относится к патофизиологии, биотехнологии и лабораторному делу, касается негативной регуляции жизнедеятельности клеток in vitro и может быть использовано для регуляции жизнедеятельности клеток in vivo при онкологических, онкогематологических и других заболеваниях. Известен широкий спектр веществ природного и синтетического происхождения, способных оказывать негативное влияние на жизнедеятельность клеток in vivo и in vitro. Существующий арсенал фармакологических средств предполагает использование их стимулирующего либо ингибирующего эффекта на те или иные клетки. В настоящее время преимущественное негативное влияние на рост клеток большинства тканей оказывают фактор некроза опухоли, интерфероны, трансформирующий фактор роста – бета [1,2]. Физические и химические факторы, в частности радиационное [3,4] и ультрафиолетовое [5] излучения, термическое воздействие [6], цитостатические препараты [7], ионы металлов [8], обладают в основном негативным эффектом на жизнедеятельность клеток. Известно влияние на рост клеток in vitro электрического поля, создаваемого во взвеси клеток при помощи источника внешнего магнитного поля [9], при помещении взвеси клеток между электродами генератора импульсов [10]. Однако данные воздействия имеют следующие недостатки: 1) отсутствует универсальность, т.е. в каждом конкретном случае в зависимости от прибора, способа воздействия и вида клеток требуется точная калибровка параметров ингибиции клеток, часто не соответствующих физиологическому диапазону; 2) громоздкость аппаратуры, неэкономичность воздействия и обслуживания вследствие увеличения времени подготовки и выполнения требуемой процедуры, необходимости наличия дорогостоящего оборудования; 3) трудность сохранения стерильности взвеси клеток вследствие введения электродов и необходимости их соединения с внешним источником напряжения. Наиболее близким (прототипом) к способу обработки клеток in vitro является способ регуляции роста клеток in vitro [11] с помощью устройства, представляющего из себя электростимулятор желудочно-кишечного тракта (ЭС ЖКТ), выполненного в виде лекарственной капсулы, в которой электроды представляют собой изолированные части лекарственной капсулы, а генератор импульсов и источник питания размещены внутри капсулы. Способ регуляции роста клеток in vitro, согласно [11], заключается в электрическом воздействии, осуществляемом ЭС ЖКТ импульсным током с длительностью импульсов 5-7 мс, силой тока 9-16 мА и амплитудой напряжения между электродами не более 4,5 В, причем для ингибиции клеток in vitro воздействуют в течение не менее 180 минут. Однако данный способ обработки клеток in vitro имеет недостатки: 1) для ингибиции клеток требуется длительная экспозиция прибора в реактивной среде, каковой является взвесь клеток, что вызывает выраженную коррозию электродов, выполненных из нержавеющей хромоникелевой стали [12], и неконтролируемое загрязнение клеточной среды нежелательными продуктами (хром, никель, железо), изменяющими ее биологические свойства и затрудняющими ее применение в биомедицинской практике; 2) низкая экономическая эффективность вследствие значительного времени подготовки и выполнения требуемой процедуры ингибиции жизнедеятельности клеток; 3) не применяется комбинированное воздействие электрического поля контролируемого электрофореза ионов, усиливающего ингибицию клеток. В то же время известно, что ионы микроэлементов в минимальных концентрациях способны ингибировать функцию всего организма и составляющих его клеток [13]; 4) Проведенный нами эксперимент показал, что известный способ регуляции роста клеток in vitro [11] дает нестабильные результаты ингибиции опухолевых клеток при приближении культуральной среды к составу биологических жидкостей. Так обработка in vitro в течение 180 мин клеток асцитной опухоли Эрлиха, культивируемых в изотоничном растворе хлорида натрия, при помощи ЭС ЖКТ без эндогенного ионофореза согласно прототипу показывает, что через 24 часа после обработки погибает 100% клеток согласно тесту с трипановым синим. Однако при добавлении в среду эмбриональной телячьей сыворотки в концентрации 5% и последующей обработке ЭС ЖКТ без эндогенного ионофореза в течение 180 мин выживает практически 84% опухолевых клеток (процент окрашенных (погибших) клеток составляет всего 16,57±0,53%). Новая техническая задача – создание условий для повышения воспроизводимости результатов ингибиции клеток in vitro, предупреждения загрязнения материала нежелательными примесями, достижение универсальности, экономичности и удобства пользования. Для решения поставленной задачи в способе обработки клеток in vitro проводят воздействие импульсным током помещенного в клеточную взвесь электростимулятора, выполненного в виде капсулы, части которой представляют собой электроды с размещенными внутри капсулы генератором импульсов и источником питания, причем проводят комбинированное электрическое и ионное воздействие в течение не менее, чем 30 минут, при этом электроды содержат микроэлемент или микроэлементы. Новым в способе обработки клеток in vitro является то, что проводят комбинированное электрическое и ионное воздействие в течение не менее, чем 30 минут, при этом электроды содержат микроэлемент или микроэлементы. Экспериментально установлено, что присутствие электростимулятора с эндогенным электрофорезом ионов, выполненного в виде капсулы, электроды которой представляют собой части лекарственной капсулы с нанесенным микроэлементом (микроэлементами), в клеточной взвеси оказывает ингибирующее влияние на клетки различных гистогенетических линий в течение не мене 30 минут. Существует избирательность различных клеток и тканей, как здоровых, так и опухолевых, к определенным микроэлементам [16,17]. При этом микроэлементы и ионы металлов способны ингибировать функции целостного организма и его частей [8]. Степень усвоения организмом минеральных веществ составляет всего 10-40% вследствие существования барьерных функций мембран клеток и значительно усиливается при использовании ЭС ЖКТ с эндогенным электрофорезом [18]. Исследования показали, что интервала времени менее 30 минут недостаточно, чтобы осуществить достоверную ингибицию различных типов клеток in vitro. Для проведения экспериментов были использованы различные виды электростимуляторов (АЭС ЖКТ-02 с электрофорезом ионов хрома; АЭС-ЖКТ-01, АЭС ЖКТ-01 с электрофорезом ионов золота, цинка, меди, хрома, кремния; АЭС ЖКТ-01 с эндогенным электрофорезом ионов цинка или хрома), генерирующих импульсный ток в широком диапазона параметров (длительность импульсов 5-7 мс, амплитуда импульсов 5-25 мА, длительность пакета 16 импульсов 320 мс – 58 с) [19], выполненных в виде капсулы, электроды которой представляют собой части капсулы с нанесенным микроэлементом (золото, цинк, медь, хром, кремний). Эффективность способа обработки клеток in vitro раскрывается следующими примерами. Пример 1. Электростимуляторы с эндогенным электрофорезом, выполненные в виде капсулы, в которой генератор импульсов и источник питания размещены внутри капсулы, а электроды представляют собой части капсулы, содержащие микроэлемент, культивировали в течение 30 мин в изотоничном растворе хлорида натрия, содержащем клетки перевиваемой асцитной опухоли Эрлиха в концентрации 2×106/мл. Электростимуляторы генерировали импульсный ток с длительностью импульсов 5-7 мс, амплитуда импульсов 9-15 мА, длительностью пакета 16 импульсов 320-450 мс. В каждую из 4-х пробирок добавляли один из электростимуляторов, покрытых одним из микроэлементов из следующего ряда: золото, цинк, медь, хром, кремний. После удаления электростимуляторов из пробирок обработанную клеточную взвесь отмывали путем добавления свежего раствора хлорида натрия и центрифугировали при 1500 об/мин в течение 10 мин, супернатант удаляли. Затем взвесь клеток раскапывали в лунки иммунологических планшетов в концентрации 5×105/мл и культивировали при 37°С, 100% влажности и 5% СО2 в течение 24 часов. Результаты показали (табл.1), что электростимуляторы с эндогенным электрофорезом различных микроэлементов вызывают 100%-ную гибель опухолевых клеток по данным теста на окрашиваемость 0,4% трипановым синим согласно рекомендациям международного стандарта ISO 10993-5. Пример 2. Применяли электростимуляторы с эндогенным электрофорезом, выполненные в виде капсулы, в которой генератор импульсов и источник питания размещены внутри капсулы, а электроды представляют собой части капсулы, содержащие микроэлемент. Клетки перевиваемой асцитной опухоли Эрлиха культивировали в концентрации 2×106/мл в среде RPMI-1640, содержащей 5% эмбриональной телячьей сыворотки для имитации состава биологической жидкости. В каждую из 4-х пробирок на 60 либо 120 мин добавляли электростимулятор, покрытый цинком. Контролем служили электростимуляторы без эндогенного электрофореза. Электростимуляторы генерировали импульсный ток с длительностью импульсов 5-7 мс, амплитуда импульсов 9-15 мА, длительностью пакета 16 импульсов 320-450 мс.После удаления электростимуляторов из пробирок обработанную клеточную взвесь отмывали путем добавления свежего раствора хлорида натрия и центрифугировали при 1500 об/мин в течение 10 мин, супернатант удаляли. Клетки раскапывали в лунки иммунологических планшетов в концентрации 5×105/мл и культивировали в среде RPMI-1640, содержащей 5% эмбриональной телячьей сыворотки, при 37°С, 100% влажности и 5% CO2 в течение 24 часов. По окончании культивирования погибшие клетки определяли в тесте на окрашиваемость 0,4% трипановым синим. Результаты показали (табл.2), что число погибших опухолевых клеток, обработанных электростимуляторами с ионофорезом цинка, приближается к 100% уже после 60 мин воздействия. При этом содержание белков и биологически активных веществ в среде не влияет на результаты обработки. В то же время электростимуляторы без эндогенного электрофореза малоэффективны независимо от времени обработки. Пример 3. В качестве объектов исследования использовали лейкоциты периферической крови, клетки костного мозга больного хроническим миелолейкозом в стадии обострения и солидных опухолей различной локализации (почка, поджелудочная железа, легкие) человека. Взвесь тех или иных клеток обрабатывали in vitro в среде RPMI-1640 в течение 120 мин следующими электростимуляторами с эндогенным электрофорезом ионов, выполненными в виде капсулы, в которой генератор импульсов и источник питания размещены внутри капсулы, а электроды представляют собой части капсулы, содержащие микроэлемент: – клетки периферической крови обрабатывали электростимуляторами с эндогенным электрофорезом ионов цинка или хрома, выполненными в виде капсулы, в которой генератор импульсов и источник питания размещены внутри капсулы, а электроды представляют собой части капсулы, генерирующие импульсный ток с длительностью импульсов 5-7 мс, амплитудой импульсов 6 мА, длительностью пакета 16 импульсов 320-450 мс; – клетки костного мозга больного хроническим миелолейкозом в стадии обострения обрабатывали электростимулятором с эндогенным электрофорезом ионов хрома, выполненным в виде капсулы, в которой генератор импульсов и источник питания размещены внутри капсулы, а электроды представляют собой части капсулы, генерирующие импульсный ток с длительностью импульсов 5-7 мс, амплитудой импульсов 9-15 мА, длительностью пакета 16 импульсов 320-450 мс; – клетки солидных опухолей обрабатывали электростимуляторами с эндогенным электрофорезом ионов цинка или хрома, выполненными в виде капсулы, в которой генератор импульсов и источник питания размещены внутри капсулы, а электроды представляют собой части капсулы, генерирующие импульсный ток с длительностью импульсов 5-7 мс, амплитудой импульсов 20-25 мА, длительностью пакета 16 импульсов 40-58 с. После удаления электростимуляторов из пробирок обработанную клеточную взвесь взвесь отмывали путем добавления свежего раствора хлорида натрия и центрифугировали при 1500 об/мин в течение 10 мин, супернатант удаляли. Клетки раскапывали в лунки иммунологических планшетов в концентрации 5×105/мл и культивировали при 37°С, 100% влажности и 5% CO2 в течение 24 часов. По окончании культивирования погибшие клетки определяли в тесте на окрашиваемость 0,4% трипановым синим. Результаты показали (табл.3), что независимо от типа обрабатываемых клеток и параметров импульсного тока, предлагаемый способ обработки клеток in vitro позволяет достичь 100%-ной ингибиции клеток in vitro по данным теста на окрашиваемость трипановым синим. Известно, что тест с трипановым синим занижает действительные результаты гибели клеток [20], что наряду с полученными данными свидетельствует в пользу полной ингибиции нормальных и опухолевых клеток in vitro. Таким образом, предлагаемый способ обработки клеток in vitro в широком диапазоне состава среды, вида нанесенного микроэлемента, параметров и времени обработки независимо от типа клеток позволяет достичь 100%-ной ингибиции клеток in vitro. При этом повышается воспроизводимость результатов ингибиции клеток in vitro, предупреждается загрязнение материала нежелательными примесями, достигаются универсальность, экономичность и удобство пользования. Источники информации 1. Иващенко Ю.Д., Быкорез А.И. Полипептидные факторы роста и канцерогенез. – Киев, 1990. – С.65. 2. Гольдберг Е.Д., Дыгай A.M. Удут В.В. и др. Закономерности структурной организации систем жизнеобеспечения в норме и при развитии патологического процесса. – Томск, 1996, С.34-36. 3. Коноплянников А.Г. Радиобиология стволовых клеток. – М., 1984. – С.39-55. 4. Переверзев А.Е. Кроветворные колониеобразующие клетки и физические стресс-факторы. – Л., 1986. – С.95-102. 6. Переверзев А.Е. Кроветворные колониеобразующие клетки и физические стресс-факторы. – Л., 1986. – С.61-64. 7. Гершанович М.Л. Осложнения при химио- и гормонотерапии злокачественных опухолей. – М., 1982. – 224 с. 8. Злобинский Б.М., Иоффе В.Г., Злобинский В.Б. Воспламеняемость и токсичность металлов и сплавов. – М., 1972. – С.226-259. 11. Дамбаев Г.Ц., Агафонников В.Ф., Хлусов И.А., Загребин Л.В. Регулятор роста клеток in vitro и способ регуляции роста клеток in vitro: Патент РФ №2179578 от 20.02.2002 г (заявка №2000109887 от 17.04.2000). 12. Агафонников В.Ф., Дамбаев Г.Ц., Романовский М.Н. Автономные электростимуляторы желудочно-кишечного тракта: Монография. – Томск, 1999. – С.52-58. 13. Георгиевский В.И., Анненков Б.Н., Самохин В.Т. Минеральное питание животных. – М., 1979. – C.11-46. 14. Агафонников В.Ф., Дамбаев Г.Ц., Романовский М.Н. Автономные электростимуляторы желудочно-кишечного тракта: Монография. – Томск, 1999. – С.26-27. 15. Агафонников В.Ф., Дамбаев Г.Ц., Романовский М.Н. Автономные электростимуляторы желудочно-кишечного тракта: Монография. – Томск, 1999. – c.144. 18. Агафонников В.Ф., Дамбаев Г.Ц., Романовский М.Н. Автономные электростимуляторы желудочно-кишечного тракта: Монография. – Томск, 1999. – c.155-180. 19. Агафонников В.Ф., Дамбаев Г.Ц., Романовский М.Н. Автономные электростимуляторы желудочно-кишечного тракта: Монография. – Томск, 1999. – c.136-180. 20. Франкфурт О.С.Клеточные механизмы химиотерапии опухолей. – М., 1976. – С.9.
Формула изобретения
Способ обработки клеток in vitro путем воздействия импульсным током помещенного в клеточную взвесь электростимулятора, выполненного в виде капсулы, части которой представляют собой электроды, с размещенными внутри капсулы генератором импульсов и источником питания, отличающийся тем, что проводят комбинированное электрическое и ионное воздействие в течение не менее чем 30 мин, при этом электроды содержат микроэлемент или микроэлементы.
(73) Патентообладатель:
Адрес для переписки:
Извещение опубликовано: 20.10.2009 БИ: 29/2009
|
||||||||||||||||||||||||||