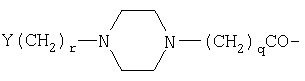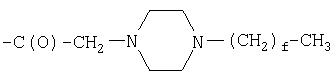Патент на изобретение №2288232
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) АНАЛОГИ GLP-1
(57) Реферат:
Настоящее изобретение относится к новым пептидным аналогам глюкагон-подобного пептида-1 и его фармацевтически приемлемым солям, которые применяют для лечения млекопитающих. 7 н. и 3 з.п. ф-лы, 1 табл.
Предпосылки создания изобретения Настоящее изобретение направлено на пептидные аналоги глюкагон-подобного пептида-1, его фармацевтически приемлемые соли, способы применения таких аналогов для лечения млекопитающих и фармацевтические композиции, применяющиеся для этого, включающие упомянутые аналоги. Амид (GLP-1) глюкагон-подобного пептида-1 (7-36) синтезируется в L-клетках кишечника в течение тканеспецифичного посттрансляционного процессинга препроглюкагона, предшественника глюкагона (Varndell, J.M., et al., J. Histochem Cytochem, 1985:33:1080-6) и высвобождается в кровоток в ответ на прием пищи. Концентрация GLP-1 в плазме увеличивается от уровня, определяемого на голодный желудок, составляющего приблизительно 15 пмоль/л, до максимального послеобеденного уровня, составляющего 40 пмоль/л. Было продемонстрировано, что для данного увеличения концентрации глюкозы в плазме увеличение уровня инсулина в плазме приблизительно в три раза выше при пероральном введении глюкозы, чем при внутривенном (Kreymann, В., et al., Lancet 1987:2, 1300-4). Это связанное с питанием увеличение высвобождения инсулина, известное как эффект инкреции, является в основном гуморальным, и GLP-1 в настоящее время считается наиболее эффективным инкретином у людей. В добавление к инсулинотропному эффекту GLP-1 подавляет секрецию глюкагона, замедляет опорожнение желудка (Wettergren A., et al., Dig Dis Sci 1993:38:665-73) и может улучшать периферийное распределение глюкозы (D’Alessio, D.A. et al., J. Clin Invest 1994:93:2293-6). В 1994 г. возможность терапевтического применения GLP-1 была предложена на основании наблюдения, что однократная подкожная доза (п/к) GLP-1 может полностью нормализовать послеобеденные уровни глюкозы у пациентов с инсулиннезависимым сахарным диабетом (NIDDM) (Gutniak, M.K., et al., Diabetes Care 1994:17:1039-44). Считалось, что данный эффект опосредуется как увеличением высвобождения инсулина, так и уменьшением секреции глюкагона. Кроме того, было показано, что внутривенное вливание GLP-1 замедляет послеобеденное опорожнение желудка у пациентов с NIDDM (Williams, В., et al., J. Clin Endo Metab 1996:81:327-32). В отличие от сульфонилмочевин инсулинотропное действие GLP-1 зависит от концентрации глюкозы в плазме (Holz, G.G. 4th, et al., Nature 1993:361:362-5). Так, прекращение GLP-1-опосредованного высвобождения инсулина при низкой концентрации глюкозы в плазме защищает от тяжелой гипогликемии. Данное сочетание активностей дает GLP-1 уникальные эффективные терапевтические преимущества по сравнению с другими агентами, использующимися в настоящее время для лечения NIDDM. Многочисленные исследования показали, что, если GLP-1 давать здоровым субъектам, то он эффективно влияет на гликемические уровни, а также на концентрации инсулина и глюкагона (Orskov, C, Diabetologia 35:701-711, 1992; Holst, J.J., et al., Potential of GLP-1 in diabetes management in Glucagon III, Handbook of Experimental Pharmacology, Lefevbre PJ, Ed. Berlin, Springer Verlag, 1996, p.311-326), данные эффекты являются глюкозозависимыми (Kreymann, В., et al., Lancet ii: 1300-1304, 1987; Weir, G.C., et al., Diabetes 38:338-342, 1989). Более того, он также является эффективным для пациентов с диабетом (Gutniak, M., N. Engl J Med 226:1316-1322, 1992; Nathan, D.M., et al., Diabetes Care 15:270-276, 1992), нормализуя уровни глюкозы в крови у субъектов, страдающих диабетом типа 2 (Nauck, MA, et al., Diagbetologia 36:741-744, 1993), и улучшая гликемический контроль у пациентов типа 1 (Creutzfeldt, W.O., et al., Diabetes Care 19:580-586, 1996), что повышает возможность его применения в качестве терапевтического агента. GLP-1 является, однако, метаболически нестабильным, имеет полупериод жизни в плазме (t1/2), составляющий только 1-2 мин in vivo. Экзогенно введенный GLP-1 тоже быстро разрушается (Deacon, C.F., et al., Diabetes 44:1126-1131, 1995). Такая метаболическая нестабильность ограничивает терапевтическую эффективность природного GLP-1. Следовательно, существует потребность в аналогах GLP-1, которые являются более активными, или метаболически более стабильными, чем природный GLP-1. Краткое содержание изобретения В одном аспекте настоящее изобретение направлено на соединение формулы (I) (R2R3)-A7-A8-A9-A10-A11-A12-A13-A14-A15-A16-A17-A18-A19-A20-A21-A22-A23-A24-A25-A26-A27-A28-A29-A30-A31-A32-A33-A34-A35-A36-A37-A38-A39-R1, (I) где A7 представляет собой L-His, Ura, Paa, Pta, Amp, Tma-His, дезамино-His, или удален; A8 представляет собой Ala, D-Ala, Aib, Acc, N-Me-Ala, N-Me-D-Ala или N-Me-Gly; A9 представляет собой Glu, N-Me-Glu, N-Me-Asp или Asp; A10 представляет собой Gly, Acc, A11 представляет собой Thr или Ser; A12 представляет собой Phe, Acc, Aic, Aib, 3-Pal, 4-Pal, A13 представляет собой Thr или Ser; A14 представляет собой Ser или Aib; A15 представляет собой Asp или Glu; A16 представляет собой Val, Acc, Aib, Leu, Ile, Tle, Nle, Abu, Ala или Cha; A17 представляет собой Ser или Thr; A18 представляет собой Ser или Thr; A19 представляет собой Tyr, Cha, Phe, 3-Pal, 4-Pal, Acc, A20 представляет собой Leu, Acc, Aib, Nle, Ile, Cha, Tle, Val, Phe или X1-Phe; A21 представляет собой Glu или Asp; A22 представляет собой Gly, Acc, A23 представляет собой Gln, Asp, Asn или Glu; A24 представляет собой Ala, Aib, Val, Abu, Tle или Acc; A25 представляет собой Ala, Aib, Val, Abu, Tle, Acc, Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-CH((CH2)e-X3)-C(O); A26 представляет собой Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-CH((CH2)e-X3)-C(O); A27 представляет собой Glu, Asp, Leu, Aib или Lys; A28 представляет собой Phe, Pal, A29 представляет собой Ile, Acc, Aib, Leu, Nle, Cha, Tle, Val, Abu, Ala или Phe; A30 представляет собой Ala, Aib или Acc; A31 представляет собой Trp, A32 представляет собой Leu, Acc, Aib, Nle, Ile, Cha, Tle, Phe, X1-Phe или Ala; A33 представляет собой Val, Acc, Aib, Leu, Ile, Tle, Nle, Cha, Ala, Phe, Abu, Lys или X1-Phe; A34 представляет собой Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-CH((CH2)e-X3)-C(О); A35 представляет собой Gly, A36 представляет собой L- или D-Arg, D- или L-Lys, D- или L-hArg, D- или L-Orn, HN-CH((CH2)n-N(R10R11))-C(O), HN-CH((CH2)e-X3)-C(O) или удален; A37 представляет собой Gly, A38 представляет собой D- или L-Lys, D- или L-Arg, D- или L-hArg, D- или L-Orn, HN-CH((CH2)n-N(R10R11))-C(O), HN-CH((CH2)е-X3)-C(O), Ava, Ado, Aec, или удален; A39 представляет собой D- или L-Lys, D- или L-Arg, HN-CH((CH2)n-N(R10R11))-C(O), Ava, Ado, или Aec; X1 в каждом случае независимо выбирают из группы, состоящей из (C1-C6)алкила, OH и галогена; R1 представляет собой OH, NH2, (C1-C30)алкокси или NH-X2-CH2-Z0, где X2 представляет собой (C1-C12)углеводородный фрагмент, а Z0 представляет собой H, OH, CO2H или CONH2; или -C(O)-NHR12, где X4 представляет собой, в каждом случае независимо, -C(O)-, -NH-C(O)- или -CH2-, и где f представляет собой, в каждом случае независимо, целое число от 1 до 29 включительно; каждый из R2 и R3 независимо выбирают из группы, состоящей из H, (C1-C30)алкила, (С2-С30)алкенила, фенил(C1-C30)алкила, нафтил(C1-C30)алкила, гидрокси(C1-C30)алкила, гидрокси(C2-C30)алкенила, гидроксифенил(C1-C30)алкила и гидроксинафтил(C1-C30)алкила; или один из R2 и R3 представляет собой где Y представляет собой H, OH или NH2; r равно числу от 0 до 4; q равно числу от 0 до 4; и X5 представляет собой (C1-C30)алкил, (C2-C30)алкенил, фенил(C1-C30)алкил, нафтил(C1-C30)алкил, гидрокси(C1-C30)алкил, гидрокси(C2-C30)алкенил, гидроксифенил(C1-C30)алкил или гидроксинафтил(C1-C30)алкил; e представляет собой, в каждом случае независимо, целое число от 1 до 4 включительно; m представляет собой, в каждом случае независимо, целое число от 5 до 24 включительно; n представляет собой, в каждом случае независимо, целое число от 1 до 5 включительно; каждый из R10 и R11 представляет собой, в каждом случае независимо, H, (C1-C30)алкил, (C1-C30)ацил, (C1-C30)алкилсульфонил, -C((NH)(NH2)) или R12 и R13 каждый представляет собой, в каждом случае независимо, (C1-C30)алкил; при условии, что: если A7 представляет собой Ura, Paa или Pta, то R2 и R3 удалены; если R10 представляет собой (C1-C30)ацил, (C1-C30)алкилсульфонил, -C((NH)(NH2)) или (i) по меньшей мере одна аминокислота соединения формулы (I) отличается от соответствующей аминокислоты нативной последовательности hGLP-1(7-36, -37 или -38)NH2 или hGLP-1(7-36, -37 или -38)ОН; (ii) соединение формулы (I) не является аналогом hGLP-1(7-36, -37 или -38)NH2 или hGLP-1(7-36, -37 или -38)ОН, где в единственной позиции произведено замещение на Ala; (iii) соединение формулы (I) не является (Arg26,34, Lys38)hGLP-1(7-38)-E, (Lys26(N (iv) соединение формулы (I) не является Z1-hGLP-1(7-36, -37 или -38)ОН, Z1-hGLP-1(7-36, -37 или -38)-NH2, где Z1 выбран из группы, состоящей из: (а)(Arg26), (Arg34), (Arg26,34), (Lys36), (Arg26, Lys36), (Arg34, Lys36), (D-Lys36), (Arg38), (D-Arg36), (Arg26,34, Lys36) или (Arg26,36, Lys34); (b) (Asp21); (c) по меньшей мере одного из (Aib8), (D-Ala8) и (Asp9); и (d) (Tyr7), (N-ацил-His7), (N-алкил-His7), (N-ацил-D-His7) или (N-алкил-D-His7); (v) соединение формулы (I) не является сочетанием любых двух замещений, перечисленных в группах от (a) до (d); и (vi) соединение формулы (I) не является (N-Me-Ala8)hGLP-1(8-36 или -37), (Glu15)hGLP-1(7-36 или -37), (Asp21)hGLP-1(7-36 или -37) или (Phe31)hGLP-1(7-36 или -37), или его фармацевтически приемлемую соль. К предпочтительной группе соединений, относящихся к упомянутому непосредственно выше соединению, относятся такие соединения, где А11 представляет собой Thr; А13 представляет собой Thr; А15 представляет собой Asp; А17 представляет собой Ser; А18 представляет собой Ser или Lys; А21 представляет собой Glu; А23 представляет собой Gln или Glu; А27 представляет собой Glu, Leu, Aib или Lys; и А31 представляет собой Trp, Phe или К предпочтительной группе соединений, относящихся к упомянутой непосредственно выше группе соединений, относятся такие соединения, где А9 представляет собой Glu, N-Me-Glu или N-Me-Asp; А12 представляет собой Phe, Acc, К предпочтительной группе соединений, относящихся к упомянутой непосредственно выше группе соединений, относятся такие соединения, где A8 представляет собой Ala, D-Ala, Aib, A6c, A5c, N-Me-Ala, N-Me-D-Ala или N-Me-Gly; A10 представляет собой Gly; A12 представляет собой Phe, К предпочтительной группе соединений, относящихся к упомянутой непосредственно выше группе соединений, относятся такие соединения, где X4 в каждом случае представляет собой -C(O)-; и R1 представляет собой OH или NH2; или их фармацевтически приемлемые соли. К предпочтительной группе соединений, относящихся к упомянутой непосредственно выше группе соединений, относятся такие соединения или их фармацевтически приемлемые соли, где R2 представляет собой H и R3 представляет собой (C1-C30)алкил, (С2-С30)алкенил, (C1-C30)ацил, (C1-C30)алкилсульфонил, или Предпочтительным соединением формулы (I) является такое соединение, где A8 представляет собой Ala, D-Ala, Aib, A6c, A5c, N-Me-Ala, N-Me-D-Ala или N-Me-Gly; A10 представляет собой Gly; A12 представляет собой Phe, Более предпочтительным из приведенных непосредственно выше соединений является такое, где R10 представляет собой (C4-С20)ацил, (C4-C20)алкилсульфонил или Более предпочтительным соединением формулы (I) является соединение формулы: (Aib8,35)hGLP-1(7-36)NH2, ((N ((N (Aib8, (Aib8,35, Arg26,34, Lys36(N (Aib8,35, Arg26, Lys34(N (Aib8,35,37, Arg26,34, Lys38(N (Aib8,35, Arg26,34, Lys36(N (Aib8,35, Arg26,34, Lys36(N (Aib8,35, Arg26,34, Lys36(N (Aib8,35, Arg26,34, Asp36(1-(4-тетрадецил-пиперазин)))hGLP-1(7-36)NH2, (Aib8,35, Arg26,34, Asp36(1-тетрадециламино))hGLP-1(7-36)NH2, (Aib8,35, Arg26,34, Lys36(N (Aib8,35, Arg26,34, Lys36(N или его фармацевтически приемлемая соль. Более предпочтительным из приведенной непосредственно выше группы соединений является соединение формулы: (Aib8,35)hGLP-1(7-36)NH2, (Aib8, (Aib8,35, Arg26, Lys34(N (Aib8,35,37, Arg26,34, Lys38(N (Aib8,35, Arg26,34, Lys36(N (Aib8,35, Arg26,34, Lys36(N или его фармацевтически приемлемая соль. Другим более предпочтительным соединением формулы (I) является соединение формулы: (Aib8,35, A6c32)hGLP-1(7-36)NH2; (Aib8,35, Glu23)hGLP-1(7-36)NH2; (Aib8,24,35)hGLP-1(7-36)NH2; (Aib8,35, Glu23, A6c32)hGLP-1(7-36)NH2; (Aib8, Glu23, (Aib8,35, Arg26,34)hGLP-1(7-36)NH2; (Aib8,35, Arg26,34, Lys36(N (Aib8,35, Arg26,34, Lys36(N (Aib8,35, Lys25, Arg26,34, Lys36(N (Aib8, Arg26,34, (Aib8,35, Arg26,34, Ava37, Ado38)hGLP-1(7-38)NH2; (Aib8,35, Arg26,34, Asp37, Ava38, Ado39)hGLP-1(7-39)NH2; (Aib8,35, Arg26,34, Aun37)hGLP-1(7-37)NH2; (Aib8,17,35)hGLP-1(7-36)NH2; (Aib8, Arg26,34, (Gly8, (Ser8, (Aib8, Glu22,23, (Gly8, Aib35)hGLP-1(7-36)NH2; (Aib8, Lys18, (Aib8, Leu27, (Aib8, Lys33, (Aib8, Lys18, Leu27, (Aib8, D-Arg36)hGLP-1(7-36)NH2; (Aib8, (Aib8,27, (Aib8,27, (Aib8,27, (Aib8, Lys18,27, (Aib8, Lys27, (Aib8, (Aib8, Arg26,34, (Aib8, D-Arg35)hGLP-1(7-36)NH2; (Aib8, (Aib8, Phe31, (Aib8,35, Phe31)hGLP-1(7-36)NH2; (Aib8,35, Nal31)hGLP-1(7-36)NH2; (Aib8,35, Nal28,31)hGLP-1(7-36)NH2; (Aib8,35, Arg26,34, Nal31)hGLP-1(7-36)NH2; (Aib8,35, Arg26,34, Phe31)hGLP-1(7-36)NH2; (Aib8,35, Nal19,31)hGLP-1(7-36)NH2; (Aib8,35, Nal12,31)hGLP-1(7-36)NH2; (Aib8,35, Lys36(N (Aib8,35, Arg34, Lys26(N (Aib8,35, Arg26,34, Lys36(N (Aib8, B-Ala35, Ser37(O-деканоил))hGLP1(7-37)-NH2; (Aib8,27, (Aib8, Arg26,34, (Aib8, Arg26,34, (Aib8, Arg28,34, или его фармацевтически приемлемая соль. Другим более предпочтительным соединением формулы (I) является каждое из соединений, которые отдельно пронумерованы в данном документе ниже в разделе Примеры настоящего описания, или его фармацевтически приемлемая соль. В другом аспекте настоящее изобретение предоставляет фармацевтическую композицию, включающую эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, как определено в данном документе выше, и фармацевтически приемлемый носитель или разбавитель. В следующем аспекте настоящее изобретение предоставляет способ индуцирования агонистического эффекта по отношению к рецептору GLP-1 у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы (I), как определено в данном документе выше, или его фармацевтически приемлемой соли. В дальнейшем аспекте настоящее изобретение предоставляет способ лечения заболевания, выбранного из группы, включающей диабет типа I, диабет типа II, ожирение, глюкагономы, секреторные нарушения дыхательных путей, метаболические нарушения, артрит, остеопороз, заболевания центральной нервной системы, рестеноз, нейродегенеративные заболевания, почечную недостаточность, застойную сердечную недостаточность, нефротический синдром, цирроз, легочный отек, гипертонию и заболевания, при которых желательно уменьшение потребления пищи, у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы (I), как определено в данном документе выше, или его фармацевтически приемлемой соли. Предпочтительным вариантом упомянутого непосредственно выше способа является такой способ, где подлежащим лечению заболеванием является диабет типа I или II. За исключением N-концевой аминокислоты, все аббревиатуры (например, Ala) аминокислот в данном описании относятся к структуре -NH-CH(R)-CO-, где R обозначает боковую цепь аминокислоты (например, CH3 для Ala). Для N-концевой аминокислоты аббревиатура относится к структуре (R2R3)-N-CH(R)-CO-, где R обозначает боковую цепь аминокислоты, а R2 и R3 являются такими, как определены выше, за исключением случая, когда A7 представляет собой Ura, Paa или Pta, в данном случае R2 и R3 не присутствуют, так как Ura, Paa и Pta рассматриваются в данном документе как дез-амино аминокислоты. Amp, Под Acc подразумевается аминокислота, выбранная из группы, состоящей из 1-амино-1-циклопропанкарбоновой кислоты (A3c); 1-амино-1-циклобутанкарбоновой кислоты (A4c); 1-амино-1-циклопентанкарбоновой кислоты (A5c); 1-амино-1-циклогексанкарбоновой кислоты (A6c); 1-амино-1-циклогептанкарбоновой кислоты (A7c); 1-амино-1-циклооктанкарбоновой кислоты (A8c); и 1-амино-1-циклононанкарбоновой кислоты (A9c). В приведенной выше формуле гидроксиалкил, гидроксифенилалкил и гидроксинафтилалкил могут содержать 1-4 гидроксильных заместителей. COX5 относится к -C=O·X5. Примеры -C=O·X5 включают, не ограничиваясь ими, ацетил и фенилпропионил. Соединения, обозначаемые Lys(N Соединения, обозначаемые Lys(N Соединения, обозначаемые Lys(N Соединения, обозначаемые Asp(1-(4-алкил-пиперазин)), представлены следующей структурой: Соединения, обозначаемые Asp(1-алкиламино), представлены следующей структурой: Соединения, обозначаемые Lys(N Переменная n в вышеприведенных структурах равна 1-30. Соединения, обозначаемые Lys(N Полные названия, соответствующие другим аббревиатурам, использующимся в данном документе, являются следующими: Boc обозначает т-бутилоксикарбонил, HF обозначает фтористый водород, Fm обозначает формил, Xan обозначает ксантил, Bzl обозначает бензил, Tos обозначает тозил, DNP обозначает 2,4-динитрофенил, DMF обозначает диметилформамид, DCM обозначает дихлорметан, HBTU обозначает гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония, DIEA обозначает диизопропилэтиламин, HOAc обозначает уксусную кислоту, TFA обозначает трифторуксусную кислоту, 2CIZ обозначает 2-хлорбензилоксикарбонил, 2BrZ обозначает 2-бромбензилоксикарбонил, OcHex обозначает O-циклогексил, Fmoc обозначает 9-флуоренилметоксикарбонил, HOBt обозначает N-гидроксибензотриазол и РАМ смола обозначает смолу 4-гидроксиметилфенилацетамидометил. Термин “галоген” охватывает фтор, хлор, бром и иод. Термин “(C1-C30)углеводородный фрагмент” охватывает алкил, алкенил и алкинил, но в случае алкенила и алкинила имеет место С2-С30. Пептид данного изобретения также обозначают здесь в другом формате, например, (A5c8)hGLP-1(7-36)NH2, с замещенными аминокислотами природной последовательности в первых круглых скобках (например, A5c8 для Ala8 в hGLP-1). Аббревиатура GLP-1 обозначает глюкагон-подобный пептид-1; hGLP-1 обозначает человеческий глюкагон-подобный пептид-1. Числа в круглых скобках относятся к числу аминокислот, присутствующих в пептиде (например, hGLP-1(7-36) обозначает аминокислоты от 7 до 36 в пептидной последовательности человеческого GLP-1). Последовательность hGLP-1(7-37) приведена в Mojsov, S., Int. J. Peptide Protein Res,. 40, 1992, pp. 333-342. Обозначение “NH2” в hGLP-1(7-36)NH2 означает, что C-конец пептида является амидированным. hGLP-1(7-36) означает, что C-конец является свободной кислотой. В hGLP-1(7-38) остатки в положениях 37 и 38 представляют собой Gly и Arg соответственно. Подробное описание Пептиды данного изобретения могут быть получены с помощью стандартного твердофазного пептидного синтеза. См., например, Stewart, J.M., et al., Solid Phase Synthesis (Pierce Chemical Co., 2d ed. 1984). Заместители R2 и R3 приведенной выше общей формулы могут быть присоединены к свободной аминогруппе N-концевой аминокислоты с помощью стандартных методов, известных в данной области. Например, алкильные группы, такие как (С1-С30)алкил, могут быть присоединены с помощью восстановительного алкилирования. Гидроксиалкильные группы, такие как (C1-C30)гидроксиалкил, могут быть также присоединены с помощью восстановительного алкилирования, где свободная гидроксильная группа защищена т-бутиловым эфиром. Ацильные группы, такие как СОЕ1, могут быть присоединены путем конденсации свободной кислоты, например E1COOH со свободной аминогруппой N-концевой аминокислоты, путем смешивания готовой смолы с 3 молярными эквивалентами как свободной кислоты, так и диизопропилкарбодиимида, в метиленхлориде в течение одного часа. Если свободная кислота содержит свободную гидроксильную группу, например п-гидроксифенилпропионовая кислота, то конденсацию нужно проводить с 3 дополнительными молярными эквивалентами HOBT. Если R1 представляет собой NH-X2-CH2-CONH2, (т.e. Z0=CONH2), синтез пептида начинают с BocHN-X2-CH2-COOH, которую присоединяют к смоле MBHA. Если R1 представляет собой NH-X2-CH2-COOH (т.e. Z0=COOH), синтез пептида начинают с Boc-HN-X2-CH2-COOH, которую присоединяют к смоле РАМ. Для данной конкретной стадии используют 4 молярных эквивалента Boc-HN-X2-COOH, HBTU и HOBt, и 10 молярных эквивалентов DIEA. Время конденсации составляет приблизительно 8 часов. Защищенную аминокислоту 1-(N-трет-бутоксикарбониламино)-1-циклогексанкарбоновую кислоту (Boc-A6c-OH) синтезируют следующим образом. 19,1г (0,133 моль) 1-амино-1-циклогексанкарбоновой кислоты (Acros Organics, Fisher Scientific, Pittsburgh, PA) растворяют в 200 мл диоксана и 100 мл воды. Добавляют 67 мл 2н NaOH. Раствор охлаждают на бане, содержащей воду со льдом. К этому раствору добавляют 32,0 г (0,147моль) ди-трет-бутилдикарбоната. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Затем диоксан удаляют при пониженном давлении. К оставшемуся водному раствору добавляют 200 мл этилацетата. Смесь охлаждают на бане, содержащей воду со льдом. рН водного слоя доводят приблизительно до 3, добавляя 4н. HCl. Органический слой отделяют. Водный слой экстрагируют этилацетатом (1х100мл). Два органических слоя объединяют и промывают водой (2х150 мл), сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Остаток перекристаллизовывают в смеси этилацетат/гексаны. Получают 9,2 г чистого продукта, выход 29%. Boc-A5c-OH синтезируют аналогично Boc-A6c-OH. Другие защищенные аминокислоты Acc могут быть получены средним специалистом в данной области аналогичным способом с помощью приведенных в данном документе инструкций. При синтезе аналога GLP-1 данного изобретения, содержащего A5c, A6c 10 и/или Aib, время конденсации составляет 2 ч для данных остатков и остатков, следующих непосредственно за ними. Для синтеза (Tma-His7)hGLP-1(7-36)NH2 используют HBTU (2 ммоль) и DIEA (1,0 мл) в 4 мл DMF для взаимодействия с N-концевой свободной амногруппой пептида-смолы в последней реакции конденсации; время конденсации составляет приблизительно 2 часа. Заместители R2 и R3 вышеприведенной общей формулы могут быть присоединены к свободной аминогруппе N-концевой аминокислоты с помощью стандартных методов, известных в данной области. Например, алкильные группы, такие как (С1-С30)алкил, могут быть присоединены с помощью восстановительного алкилирования. Гидроксиалкильные группы, такие как (C1-C30)гидроксиалкил, могут быть также присоединены с помощью восстановительного алкилирования, где свободная гидроксильная группа защищена т-бутиловым эфиром. Ацильные группы, например СОХ1, могут быть присоединены путем конденсации свободной кислоты, например Х1COOH со свободной аминогруппой N-концевой аминокислоты, путем смешивания готовой смолы с 3 молярными эквивалентами как свободной кислоты, так и диизопропилкарбодиимида, в метиленхлориде в течение одного часа. Если свободная кислота содержит свободную гидроксильную группу, например п-гидроксифенилпропионовая кислота, то конденсацию нужно проводить с 3 дополнительными молярными эквивалентами HOBT. Соединение настоящего изобретения можно анализировать на активность как GLP-1 связывающее соединение в соответствии со следующей процедурой. Клеточная культура: Клетки крысиной инсулиномы RIN 5F (ATCC # CRL-2058, Американская коллекция типов культур, Manassas, VA), экспрессирующие рецептор GLP-1, культивируют в модифицированной по Дульбекко среде Игла (DMEM), содержащей 10% фетальную телячью сыворотку, и выдерживают при приблизительно 37°C во влажной атмосфере 5% СО2/95% воздух. Связывание радиоактивно меченого лиганда: Для изучения связывания радиоактивно меченого лиганда получают мембраны путем гомогенизации клеток RIN в 20 мл охлажденного во льду 50 мМ Трис-HCl с помощью Brinkman Polytron (Westbury, NY) (настройка 6, 15 сек). Гомогенаты дважды промывают с помощью центрифугирования (39000 g/10 мин), и конечные осадки ресуспендируют в 50 мМ Трис-HCl, содержащем 2,5 мМ MgCl2, 0,1 мг/мл бацитрацина (Sigma Chemical, St. Louis, MO), и 0,1% BSA. Для анализа аликвоты (0,4 мл) инкубируют с 0,05 нМ (125I)GLP-1(7-36) (2200 Ки/ммоль, New England Nuclear, Boston, MA), в присутствии или отсутствие 0,05 мл немеченных конкурирующих тестируемых пептидов. После 100 мин инкубации (25°C), связанный (125I)GLP-1(7-36) отделяют от свободного путем быстрой фильтрации через GF/C фильтры (Brandel, Gaithersburg, MD), которые были предварительно смочены в 0,5% полиэтиленимине. Затем фильтры промывают три раза аликвотами объемом 5 мл охлажденного во льду 50 мМ Трис-HCl, и связанную радиоактивность, задержанную на фильтре, считают с помощью гамма-спектрометрии (Wallac LKB, Gaithersburg, MD). Специфичное связывание определяют как разность общего связанного (125I)GLP-1(7-36) и связанного в присутствии 1000 нМ GLP1(7-36) (Bachem, Torrence, CA). Пептиды данного изобретения могут быть предоставлены в виде фармацевтически приемлемых солей. Примеры таких солей включают, не ограничиваясь ими, соли, образованные органическими кислотами (например, уксусной, молочной, малеиновой, лимонной, яблочной, аскорбиновой, янтарной, бензойной, метансульфоновой, толуолсульфоновой или памоевой кислотой), неорганическими кислотами (например, хлористоводородной кислотой, серной кислотой или фосфорной кислотой), и полимерными кислотами (например, танниновой кислотой, карбоксиметилцеллюлозой, полимолочной, полигликолевой, или сополимерами полимолочной-гликолевой кислот). Типичный метод получения соли пептида настоящего изобретения является хорошо известным в данной области и может сопровождаться стандартными методами солевого обмена. Соответственно соль TFA и пептида настоящего изобретения (соль TFA получают в результате очистки пептида с помощью препаративной ВЭЖХ, с элюированием буферными растворами, содержащими TFA) может быть превращена в другую соль, такую как соль уксусной кислоты, путем растворения пептида в небольшом количестве 0,25н. водного раствора уксусной кислоты. Полученный раствор наносят на колонку для полупрепаративной ВЭЖХ (Zorbax, 300 SB, C-8). Вещество с колонки элюируют (1) 0,1н. водным раствором ацетата аммония в течение 0,5 ч, (2) 0,25н. водным раствором уксусной кислоты в течение 0,5 ч и (3) в линейном градиенте (от 20% до 100% раствора В в течение 30 мин) при скорости потока 4 мл/мин (раствор A представляет собой 0,25н. водный раствор уксусной кислоты; раствор В представляет собой 0,25н. раствор уксусной кислоты в смеси ацетонитрил/вода, 80:20). Фракции, содержащие пептид, собирают и лиофилизируют досуха. Как хорошо известно специалистам в данной области, известные и возможные применения GLP-1 являются разнообразными и многочисленными (см., Todd, J.F., et al., Clinical Science, 1998, 95, pp.325-329; и Todd, J.F. et al., European Journal of Clinical Investigation, 1997, 27, pp.533-536). Таким образом, введение соединений данного изобретения с целью получения агонистического эффекта может иметь такие же эффекты и применения, как сам GLP-1. Данные разнообразные применения GLP-1 могут быть суммированы следующим образом, для лечения: диабета типа I, диабета типа II, ожирения, глюкагономы, секреторных нарушений дыхательных путей, метаболических нарушений, артрита, остеопороза, заболеваний центральной нервной системы, рестеноза, нейродегенеративных заболеваний, почечной недостаточности, застойной сердечной недостаточности, нефротического синдрома, цирроза, легочного отека, гипертонии и заболеваний, при которых желательно уменьшение потребления пищи. Аналоги GLP-1 настоящего изобретения, которые вызывают антагонистический эффект у субъекта, могут использоваться для лечения следующих заболеваний: гипогликемии и синдрома малабсорбции, связанного с гастроэктомией или резекцией тонкого кишечника. Соответственно в объем настоящего изобретения входят фармацевтические композиции, включающие, в качестве активного ингредиента, по меньшей мере одно из соединений формулы (I) в сочетании с фармацевтически приемлемым носителем. Доза активного ингредиента в композициях данного изобретения может варьировать; однако, необходимо, чтобы количество активного ингредиента было таким, чтобы получить подходящую дозированную форму. Выбранная доза зависит от желаемого терапевтического эффекта, от способа введения и от продолжительности лечения. В основном эффективная доза для проявления активностей данного изобретения находится в интервале от 1·10-7 до 200мг/кг/день, предпочтительно, от 1·10-4 до 100 мг/кг/день, данная доза может быть введена как разовая доза, или может быть разделена на множество доз. Соединения данного изобретения могут быть введены с помощью перорального, парентерального (например, с помощью внутримышечной, интраперитонеальной, внутривенной или подкожной инъекции или имплантата), назального, вагинального, ректального, подъязычного или наружного способов введения, они могут входить в состав вместе с фармацевтически приемлемыми носителями, для предоставления дозировочных форм, соответствующих каждому способу введения. Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозировочных формах активное соединение смешано по меньшей мере с одним инертным фармацевтически приемлемым носителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы могут также включать, как это имеет место в обычной практике, дополнительные вещества, отличающиеся от таких инертных разбавителей, например смазывающие агенты, такие как стеарат магния. В случае капсул, таблеток и пилюль, дозировочные формы могут также включать забуферивающие агенты. Таблетки и пилюли могут быть также получены с энтеропокрытием. Жидкие дозированные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры, содержащие инертные разбавители, обычно использующиеся в данной области, такие как вода. Кроме таких инертных разбавителей, композиции могут также включать адъюванты, такие как увлажняющие агенты, эмульгирующие и суспендирующие агенты, а также подслащивающие, ароматизирующие агенты и отдушки. Препараты в соответствии с данным изобретением для парентерального ведения включают стерильные водные или неводные растворы, суспензии или эмульсии. Примерами неводных растворителей или сред для лекарства являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое и кукурузное масло, желатин и органические эфиры, подходящие для инъекций, такие как этилолеат. Такие дозировочные формы могут также содержать адъюванты, такие как консервирующие, увлажняющие, эмульгирующие и диспергирующие агенты. Они могут быть стерилизованы, например, путем фильтрации через фильтр, удерживающий бактерии, путем введения в композиции стерилизующих агентов, путем облучения композиций, или путем нагревания композиций. Они могут быть также получены в виде стерильных твердых композиций, которые непосредственно перед использованием могут быть растворены в стерильной воде, или в какой-нибудь другой стерильной среде, подходящей для инъекций. Композиции для ректального или вагинального введения предпочтительно представляют собой свечи, которые могут содержать, кроме активного вещества, эксципиенты, такие как кокосовое масло или суппозиторийный воск. Композиции для назального и подъязычного введения также получают с использованием стандартных эксципиентов, хорошо известных в данной области. Кроме того, соединение данного изобретения может быть введено в композицию с замедленным высвобождением, такую как композиции, описанные в следующих патентах и патентных заявках. Патент США № 5672659 описывает композиции с замедленным высвобождением, включающие биоактивный агент и полиэфир. Патент США № 5595760 описывает композиции с замедленным высвобождением, включающие биоактивный агент в гель-образующей форме. Заявка США № 08/929363, поданная 9 сентября 1997, описывает полимерные композиции с замедленным высвобождением, включающие биоактивный агент и хитозан. U.S. Заявка США № 08/740778, поданная 1 ноября 1996, описывает композиции с замедленным высвобождением, включающие биоактивный агент и циклодекстрин. Заявка США № 09/015394, поданная 29 января 1998, описывает способные к абсорбции композиции с замедленным высвобождением, включающие биоактивный агент. Заявка США № 09/121653, поданная 23 июля 1998, описывает способ получения микрочастиц, включающих терапевтический агент, такой как пептид, в способе масло-в-воде. Заявка США № 09/131472, поданная 10 августа 1998, описывает комплексы, включающие терапевтический агент, такой как пептид, и фосфорилированный полимер. Заявка США № 09/184413, поданная 2 ноября 1998, описывает комплексы, включающие терапевтический агент, такой как пептид, и полимер, несущий неполимеризуемый лактон. Описания вышеприведенных патентов и заявок включены в данный документ в качестве ссылок. Если не определено иначе, все технические и научные термины имеют такие же значения, которые соответствуют общепринятым в понимании среднего специалиста в области, к которой принадлежит данное изобретение. Кроме того, все публикации, патентные заявки, патенты и другие ссылки, упомянутые в данном документе, включены в качестве ссылки. Следующие примеры описывают синтетические способы получения пептида данного изобретения, данные способы хорошо известны специалистам в данной области. Другие способы также известны специалистам в данной области. Примеры приведены с целью иллюстрации и не являются ограничивающими область настоящего изобретения каким-либо образом. Boc- Пример 1 (Aib8,35)hGLP-1(7-36)NH2 Указанный в заголовке пептид синтезируют на пептидном синтезаторе Applied Biosystems (Foster City, CA) модель 430A, который модифицировали для ускорения Boc-химии твердофазного пептидного синтеза. См. Schnolzer, et al., Int. J. Peptide Protein Res., 90:180 (1992). Используют 4-метилбензгидриламиновую (MBHA) смолу (Peninsula, Belmont, CA) со степенью замещения 0,91 ммоль/г. Boc-аминокислоты (Bachem, CA, Torrance, CA; Nova Biochem., LaJolla, CA) используют со следующей защитой боковых цепей: Boc-Ala-OH, Boc-Arg(Tos)-OH, Boc-Asp(OcHex)-OH, Boc-Tyr(2BrZ)-OH, Boc-His(DNP)-OH, Boc-Val-OH, Boc-Leu-OH, Boc-Gly-OH, Boc-Gln-OH, Boc-Ile-OH, Boc-Lys(2CIZ)-OH, Boc-Thr(Bzl)-OH, Boc-Ser(Bzl)-OH, Boc-Phe-OH, Boc-Aib-OH, Boc-Glu(OcHex)-OH и Boc-Trp(Fm)-OH. Синтез проводят в масштабе 0,20 ммоль. Boc-группы удаляют путем обработки 100% TFA в течение 2×1мин. Boc-аминокислоты (2,5 ммоль) предварительно активируют с использованием HBTU (2,0 ммоль) и DIEA (1,0 мл) в 4 мл DMF и проводят конденсацию без предварительной нейтрализации TFA соли пептидной смолы. Время конденсации составляет 5 мин, за исключением остатков Boc-Aib-OH и следующих остатков, Boc-Lys(2CIZ)-OH и Boc-His(DNP)-OH, для которых время конденсации составляет 2 часа. В конце сборки пептидной цепи смолу обрабатывают раствором 20% меркаптоэтанол/10% DIEA в DMF в течение 2×30 мин для удаления группы DNP боковой цепи His. N-концевую Boc-группу затем удаляют путем обработки 100% TFA в течение 2×2 мин. После нейтрализации пептидной смолы с помощью 10% DIEA в DMF (1×1 мин) формильную группу боковой цепи Trp удаляют путем обработки раствором 15% этаноламин/15% вода/70% DMF в течение 2×30 мин. Пептидную смолу промывают DMF и DCM и сушат при пониженном давлении. Конечное расщепление проводят путем перемешивания пептидной смолы в 10 мл HF, содержащем 1 мл анизола и дитиотреитола (24 мг) при 0°C в течение 75 мин. HF удаляют в токе азота. Остаток промывают простым эфиром (6·10мл) и экстрагируют 4н. HOAc (6·10 мл). Пептидную смесь в водном экстракте очищают с помощью обращенно-фазовой препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ), используя колонку с обращенной фазой VYDAC® C18 (Nest Group, Southborough, MA). Элюирование колонки проводят при линейном градиенте (от 20 до 50% раствора В в течение 105 мин) со скоростью потока 10 мл/мин (раствор A – вода, содержащая 0,1% TFA; раствор В – ацетонитрил, содержащий 0,1% TFA). Фракции собирают и проверяют с помощью аналитической ВЭЖХ. Фракции, содержащие чистый продукт, объединяют и лиофилизируют досуха. Получают 135 мг белого твердого вещества. Чистота составляет 98,6% на основании анализа с помощью аналитической ВЭЖХ. Анализ методом масс-спектрометрии с электронным распылением (MS(ES))S дает молекулярную массу, равную 3339,7 (что согласуется с рассчитанным молекулярным весом, составляющим 3339,7). Пример 2 ((N Указанное в заголовке соединение (HEPES представляет собой (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту)) можно синтезировать следующим образом: после сборки пептида (Aib8,35)hGLP-1(7-36)NH2 на смоле MBHA (0,20 ммоль) по способу примера 1 пептидную смолу обрабатывают 100% TFA (2×2 мин) и промывают DMF и DCM. Затем смолу нейтрализуют 10% DIEA в DMF в течение 2 мин. После промывки DMF и DCM смолу обрабатывают 0,23 ммоль 2-хлор-1-этансульфонилхлорида 0,7 ммоль DIEA в DMF в течение приблизительно 1 часа. Смолу промывают DMF и DCM и обрабатывают 1,2 ммоль 2-гидроксиэтилпиперазина в течение приблизительно 2 часов. Смолу промывают DMF и DCM и обрабатывают различными реагентами ((1) 20% меркаптоэтанол/10% DIEA в DMF и (2) 15% этаноламин/15% вода/70% DMF) для удаления DNP-группы с боковой цепи His и формильной группы с боковой цепи Trp, как описано выше, перед конечным HF-отщеплением пептида со смолы. Пример 3 ((N Указанное в заголовке соединение (HEPA представляет собой (4-(2-гидроксиэтил)-1-пиперазинацетил)) можно получить, по существу, следуя методике, описанной в примере 2 для получения ((N Пример 4 (Aib8, Указанное в заголовке соединение синтезируют, по существу, следуя методике, описанной в примере 1, используя соответствующие защищенные аминокислоты. MS (ES) дает молекулярную массу, равную 3325,7, рассчитанный МВ=3325,8, чистота=99%, выход=85 мг. Синтез других соединений настоящего изобретения может быть проведен по существу по способу, описанному выше для синтеза (Aib8,35)hGLP-1(7-36)NH2 в примере 1, но с использованием соответствующих защищенных аминокислот в зависимости от целевого пептида. Пример 5 (Aib8,35, Arg26,34, Lys36(N Используют такие же Boc-аминокислоты, как в синтезе (Aib8,35)hGLP-1(7-36)NH2, описанном в примере 1, за исключением того, что в данном примере используют Fmoc-Lys(Boc)-OH. Первый аминокислотный остаток присоединяют к смоле вручную на шейкере. 2,5 ммоль Fmoc-Lys(Boc)-OH растворяют в 4 мл 0,5н. HBTU в DMF. К раствору добавляют 1мл DIEA. Смесь встряхивают в течение приблизительно 2 мин. Затем к раствору добавляют 0,2 ммоль смолы MBHA (степень замещения=0,91ммоль/г). Смесь встряхивают в течение приблизительно 1 ч. Смолу промывают DMF и обрабатывают 100% TFA в течение 2×20 мин для удаления защитной группы Boc. Смолу промывают DMF. Миристиновую кислоту (2,5 ммоль) предварительно активируют с использованием HBTU (2,0 ммоль) и DIEA (1,0мл) в 4 мл DMF в течение 2 мин и проводят конденсацию с Fmoc-Lys-смолой. Время конденсации составляет приблизительно 1 ч. Смолу промывают DMF и обрабатывают 25% пиперидином в DMF в течение 2×20 мин для удаления защитной группы Fmoc. Смолу промывают DMF и переносят в реакционный сосуд пептидного синтезатора. Следующие стадии синтеза и процедуры очистки данного пептида были такими же, как в случае синтеза (Aib8,35)hGLP-1(7-36)NH2 в примере 1. Получают 43,1 мг указанного в заголовке соединения в виде белого твердого вещества. Чистота составляет 98% на основании анализа методом аналитической ВЭЖХ. Анализ методом масс-спектрометрии с электронным распылением дает значение молекулярного веса, составляющее 3577,7, которое согласуется с рассчитанным значением молекулярного веса, равным 3578,7. Примеры 6-8 Примеры 6-8 синтезируют по существу по способу, описанному для примера 5, используя соответствующую защищенную аминокислоту и соответствующую кислоту вместо миристиновой кислоты, использующейся в примере 5. Пример 6: (Aib8,35, Arg28, Lys34(N Пример 7: (Aib8,35,37, Arg26,34, Lys38(N Пример 8: (Aib8,35, Arg26,34, Lys36(N Синтез других соединений настоящего изобретения, содержащих остаток Lys(N Пример 9 (Aib8,35, Arg26,34, Lys36(N В данном синтезе используются такие же Boc-аминокислоты, как и в синтезе примера 5. Первый аминокислотный остаток присоединяют к смоле вручную на шейкере. 2,5 ммоль Fmoc-Lys(Boc)-OH растворяют в 4 мл 0,5н. HBTU в DMF. К раствору добавляют 1 мл DIEA. Смесь встряхивают в течение приблизительно 2 мин. Затем к раствору добавляют 0,2 ммоль смолы MBHA (степень замещения=0,91 ммоль/г). Смесь встряхивают в течение приблизительно 1 ч. Смолу промывают DMF и обрабатывают 100% TFA в течение 2×2 мин для удаления защитной группы Boc. Смолу промывают DMF и к ней добавляют 0,25 ммоль 1-додекансульфонилхлорида в 4 мл DMF и 1 мл DIEA. Смесь встряхивают в течение приблизительно 2 ч. Смолу промывают DMF и обрабатывают 25% пиперидином в DMF в течение 2×20 мин для удаления защитной группы Fmoc. Смолу промывают DMF и переносят в реакционный сосуд пептидного синтезатора. Синтез остального пептида и процедуры очистки были такими же, как в примере 1. Синтез других соединений настоящего изобретения, содержащих остаток Lys(N 1-додекансульфонилхлорид, 1-гексадекансульфонилхлорид и 1-октадецилсульфонилхлорид. Пример 10 (Aib8,35, Arg26,34, Lys36(N В данном примере используются такие же Boc-аминокислоты, как и в синтезе примера 5. Первый аминокислотный остаток присоединяют к смоле вручную на шейкере. 2,5 ммоль Fmoc-Lys(Boc)-OH растворяют в 4 мл 0,5н. HBTU в DMF. К раствору добавляют 1 мл DIEA. Смесь встряхивают в течение приблизительно 2 мин. Затем к раствору добавляют 0,2 ммоль смолы MBHA (степень замещения=0,91 ммоль/г). Смесь встряхивают в течение приблизительно 1 ч. Смолу промывают DMF и обрабатывают 100% TFA в течение 2×2 мин для удаления защитной группы Boc. Смолу промывают DMF. 2-Бромуксусную кислоту (2,5 ммоль) предварительно активируют с использованием HBTU (2,0 ммоль) и DIEA (1,0 мл) в 4 мл DMF в течение приблизительно 2 мин и добавляют к смоле. Смесь встряхивают в течение приблизительно 10 мин и промывают DMF. Затем смолу обрабатывают 1,2 ммоль пиперазина в 4 мл DMF в течение приблизительно 2 ч. Смолу промывают DMF и обрабатывают 2 ммоль 1-иодтетрадекана в течение приблизительно 4 ч. После промывания с использованием DMF смолу обрабатывают 3 ммоль уксусного ангидрида и 1 мл DIEA в 4 мл DMF в течение приблизительно 0,5 ч. Смолу промывают DMF и обрабатывают 25% пиперидином в DMF в течение 2×20 мин. Смолу промывают DMF и переносят в реакционный сосуд пептидного синтезатора для продолжения синтеза. Остальной синтез и процедуры очистки данного пептида являются такими же, как в примере 1. Синтез других соединений настоящего изобретения, содержащих остаток Lys(N Пример 11 (Aib8,35, Arg26,34, Asp36(1-(4-тетрадецилпиперазин)))hGLP-1(7-36)NH2 В данном примере используются такие же Boc-аминокислоты, как и в синтезе примера 5, за исключением того, что в 36 позиции используют Fmoc-Asp(O-tBu)-OH. Первый аминокислотный остаток присоединяют к смоле вручную на шейкере. 2,5 ммоль Fmoc-Asp(O-tBu)-OH растворяют в 4 мл 0,5н. HBTU в DMF. К раствору добавляют 1 мл DIEA. Смесь встряхивают в течение приблизительно 2 мин. Затем к раствору добавляют 0,2 ммоль смолы MBHA (степень замещения=0,91 ммоль/г). Смесь встряхивают в течение приблизительно 1 ч. Смолу промывают DMF и обрабатывают 100% TFA в течение 2×15 мин для удаления защитной группы tBu. Смолу промывают DMF и обрабатывают HBTU (0,6 ммоль) и DIEA (1 мл) в 4 мл DMF в течение приблизительно 15 мин. К реакционной смеси добавляют 0,6 ммоль пиперазина и смесь встряхивают в течение приблизительно 1 ч. Смолу промывают DMF и обрабатывают 3 ммоль 1-иодтетрадекана в течение приблизительно 4 ч. После промывания с использованием DMF смолу обрабатывают 3 ммоль уксусного ангидрида и 1 мл DIEA в 4 мл DMF в течение приблизительно 0,5 ч. Смолу промывают DMF и обрабатывают 25% пиперидином в DMF в течение 2×20 мин для удаления защитной группы Fmoc. Смолу промывают DMF и переносят в реакционный сосуд пептидного синтезатора для продолжения синтеза. Остальной синтез и процедуры очистки данного пептида являются такими же, как в синтезе примера 1. Синтез других соединений настоящего изобретения, включающих остаток Asp(1-(4-алкилпиперазин)) или Glu(1-(4-алкилпиперазин)), проводят по способу, описанному для синтеза примера 11. Аминокислоты Fmoc-Asp(O-tBu)-OH или Fmoc-Glu(O-tBu)-OH используют для остатка Asp(1-(4-алкилпиперазин)) или Glu(1-(4-алкилпиперазин)) в пептиде, тогда как аминокислоту Boc-Asp(OcHex)-OH или Boc-Glu(OcHex)-OH используют для остатка Asp или Glu. В процессе стадии алкилирования для остатка Lys(N Пример 12 (Aib8,35, Arg26,34, Asp36(1-тетрадециламино))hGLP-1(7-36)NH2 В данном примере используются такие же Boc-аминокислоты, как и в примере 5. Первый аминокислотный остаток присоединяют к смоле вручную на шейкере. 2,5 ммоль Fmoc-Asp(O-tBu)OH растворяют в 4 мл 0,5н. HBTU в DMF. К раствору добавляют 1 мл DIEA. Смесь встряхивают в течение приблизительно 2 мин. Затем к раствору добавляют 0,2 ммоль смолы MBHA (степень замещения=0,91 ммоль/г). Смесь встряхивают в течение приблизительно 1 ч. Смолу промывают DMF и обрабатывают 100% TFA в течение 2×15 мин для удаления защитной группы tBu. Смолу промывают DMF и обрабатывают HBTU (0,6 ммоль) и DIEA (1 мл) в 4 мл DMF в течение приблизительно 15 мин. К реакционной смеси добавляют 0,6 ммоль 1-тетрадеканамина и смесь встряхивают в течение приблизительно 1 ч. Смолу промывают DMF и обрабатывают 25% пиперидином в DMF в течение 2×20 мин для удаления защитной группы Fmoc. Смолу промывают DMF и переносят в реакционный сосуд пептидного синтезатора для продолжения синтеза. Остальной синтез и процедуры очистки данного пептида являются такими же, как в синтезе примера 1. Синтез других соединений настоящего изобретения, содержащих остаток Asp(1-алкиламино) или Glu(1-алкиламино), проводят по способу, описанному для синтеза примера 12. Аминокислоту Fmoc-Asp(O-tBu)-OH или Fmoc-Glu(O-tBu)-OH используют для остатка Asp(1-алкиламино) или Glu(1-алкиламино) соответственно в пептиде, тогда как аминокислоту Boc-Asp(OcHex)-OH или Boc-Glu(OcHex)-OH используют для остатка Asp или Glu соответственно. Если остаток Asp(1-алкиламино) или Glu(1-алкиламино) не является C-концевым, вначале на смоле на пептидном синтезаторе собирают пептидный фрагмент, находящийся сразу перед остатком Asp(1-алкиламино) или Glu(1-алкиламино). Пример 13 (Aib8,35, Arg26,34, Lys36(N
Используют такие же Boc-аминокислоты, как в синтезе (Aib8,35, Arg26,34, Lys36(N Пример 14 (Aib8,35, Arg26,34, Lys36(N Используют такие же Boc-аминокислоты, как в синтезе (Aib8,35, Arg26,34, Lys36(N Синтез других аналогов hGLP-1(7-36)-OH, hGLP-1(7-37)-OH и hGLP-1(7-38)-OH настоящего изобретения, которые содержат остаток Lys(N Пример 366 (Aib8, Смесь смолы MBHA (0,2 ммоль, степень замещения=0,91 ммоль/г), Fmoc-Aec-OH (0,40 г, 0,829 ммоль), HBTU (1,5 мл @ 0,5 M в DMF) и DIEA (O,5 мл) в реакционном сосуде встряхивают на шейкере в течение 4 ч при комнатной температуре. Смолу промывают DMF и обрабатывают 25% пиперидином в DMF в течение 2×20 мин. Смолу промывают DMF и DCM и переносят в реакционный сосуд пептидного синтезатора для продолжения сборки остальной части пептида, следуя методике, описанной в примере 1. Процедура очистки является такой же, как в примере 1. Анализ методом масс-спектрометрии с электронным распылением дает молекулярную массу, равную 3494,8, что согласуется с рассчитанной массой, составляющей 3494,99. Чистота 93%; выход 79,1 мг. Пример 367 (Aib8, Пример 367 синтезируют по существу по способу примера 366. MS(ES)=3551,7, рассчитанный МВ=3552,04; чистота 97%; выход 97,4 мг. Пример 368 (Aib8, Смесь смолы MBHA (0,2 ммоль, степень замещения=0,91 ммоль/г), Fmoc-Aec-OH (0,289 г, 0,6 ммоль), HBTU (1,12 мл @ 0,5 M в DMF) и DIEA (0,4 мл) в реакционном сосуде встряхивают на шейкере в течение 2 ч при комнатной температуре. Смолу промывают DMF и обрабатывают 30% пиперидином в DMF в течение 2×15 мин. Смолу промывают DMF. В реакционный сосуд добавляют Fmoc-Aec-OH (0,289 г, 0,6 ммоль), HBTU (1,12 мл @ 0,5 M в DMF) и DIEA (0,4 мл). Смесь встряхивают при комнатной температуре в течение 2 ч. Смолу промывают DMF и обрабатывают 30% пиперидином в DMF в течение 2×15 мин. Смолу промывают DMF и DCM и переносят в реакционный сосуд пептидного синтезатора для продолжения сборки остальной части пептида, следуя методике, описанной в примере 1. Процедура очистки является такой же, как в примере 1. Анализ методом масс-спектрометрии с электронным распылением дает молекулярную массу, равную 3663,9, что согласуется с рассчитанной массой, составляющей 3664,26. Чистота 100%; выход 75,3 мг. Пример 369 (Aib8, Arg26,34, Смесь смолы MBHA (0,2 ммоль, степень замещения=0,91 ммоль/г), Boc-Lys(Fmoc)-OH (1,17 г, 2,5 ммоль), HBTU(4 мл @ 0,5 M в DMF) и DIEA (1 мл) в реакционном сосуде встряхивают на шейкере при комнатной температуре в течение 10 мин. Смолу промывают DMF и обрабатывают 25% пиперидином в DMF в течение 2·15 мин. Смолу промывают DMF. В реакционный сосуд добавляют Fmoc-Aec-OH (0,289 г, 0,6 ммоль), HBTU (1,12 мл @ 0,5 M в DMF) и DIEA (0,4 мл). Смесь встряхивают при комнатной температуре в течение 10 мин. Смолу промывают DMF и обрабатывают 30% пиперидином в DMF в течение 2×15 мин. Смолу промывают DMF и обрабатывают смесью декановой кислоты (431 мг, 2,5 ммоль), HBTU (4 мл @ 0,5 М в DMF) и DIEA (1 мл) в течение 10 мин. Смолу промывают DMF и обрабатывают 100% TFA в течение 2×2 мин. Смолу промывают DMF и DCM и переносят в реакционный сосуд пептидного синтезатора для продолжения сборки остальной части пептида, следуя методике, описанной в примере 1. Процедура очистки является такой же, как в примере 1. Анализ методом масс-спектрометрии с электронным распылением дает молекулярную массу, равную 3677,0, что согласуется с рассчитанной молекулярной массой, составляющей 3677,25. Чистота 97,6%; выход 44,8 мг. Следующие примеры могут быть осуществлены с помощью соответствующих способов, описанных в данном документе выше. Пример 15: (Aib35)hGLP-1(7-36)NH2 Пример 16: ( Пример 17: ((N Пример 18: ((N Пример 19: ((N Пример 20: ((Na-Me-His)7, Aib8, Arg26,34, Пример 21:(Aib8, A6с35)hGLP-1(7-36)NH2 Пример 22: (Aib8, A5c35)hGLP-1(7-36)NH2 Пример 23: (Aib8, D-Ala35)hGLP-1(7-36)NH2 Пример 24: (Aib8,35, A6c32)hGLP-1(7-36)NH2 Пример 25: (Aib8,35, A5c32)hGLP-1(7-36)NH2 Пример 26: (Aib8,35, Glu23)hGLP-1(7-36)NH2 Пример 27: (Aib8,24,35)hGLP-1(7-36)NH2 Пример 28: (Aib8,30,35)hGLP-1(7-36)NH2 Пример 29: (Aib8,25,35)hGLP-1(7-36)NH2 Пример 30: (Aib8,35, A6c16,20)hGLP-1(7-36)NH2 Пример 31: (Aib8,35, A6c16,29,32)hGLP-1(7-36)NH2 Пример 32: (Aib8,35, A6c20,32)hGLP-1(7-36)NH2 Пример 33: (Aib8,35, A6c20)hGLP-1(7-36)NH2 Пример 34: (Aib8,35, Lys25)hGLP-1(7-36)NH2 Пример 35: (Aib8,24,35, A6c20)hGLP-1(7-36)NH2 Пример 36: (Aib8,35, A6c29,32)hGLP-1(7-36)NH2 Пример 37: (Aib8,24,35, A6c29,32)hGLP-1(7-36)NH2 Пример 38: (Aib8,35, A6c12)hGLP-1(7-36)NH2 Пример 39: (Aib8,35, Cha20)hGLP-1(7-36)NH2 Пример 40: (Aib8,35, A6c33)hGLP-1(7-36)NH2 Пример 41: (Aib8,35, A6c20,32)hGLP-1(7-36)NH2 Пример 42: (Aib8, A6c16,20, Пример 43: (Aib8,35, Пример 44: (Aib8,22,35)hGLP-1(7-36)NH2 Пример 45: (Aib8,35, Glu23, A6c32)hGLP-1(7-36)NH2 Пример 46: (Aib8,24,35, Glu23, A6c32)hGLP-1(7-36)NH2 Пример 47: (Aib8,24,25,35, Glu23, A6c32)hGLP-1(7-36)NH2 Пример 48: (Aib8,24,25,35, A6c16,20,32, Glu23)hGLP-1(7-36)NH2 Пример 49: (Aib8, A6c32, Пример 50: (Aib8, A5c32, Пример 51: (Aib8, Glu23, Пример 52: (Aib8,24, Пример 53: (Aib8,30, Пример 54: (Aib8,25, Пример 55: (Aib8, A6c16,20, Пример 56: (Aib8, A6c16,29,32, Пример 57: (Aib8, A6c20,32, Пример 58: (Aib8, A6c20, Пример 59: (Aib8, Lys25, Пример 60: (Aib8,24, A6c20, Пример 61: (Aib8, A6c29,32, Пример 62: (Aib8,24, A6c29,32, Пример 63: (Aib8, A6c12, Пример 64: (Aib8, Cha20, Пример 65: (Aib8, A6c33, Пример 66: (Aib8, A6c20,32, Пример 67: (Aib8, Пример 68: (Aib8,22, Пример 69: (Aib8, Glu23, A6c32, Пример 70: (Aib8,24, Glu23, A6c32, Пример 71: (Aib8,24, Glu23, A6c32, Lys34(N Пример 72: (Aib8,24,25, Glu23, A6c32, Пример 73: (Aib8,24,25, A6c16,20,32, Glu23, Пример 74: (Aib8,35, D-Arg36)hGLP-1(7-36)NH2 Пример 75: (Aib8,35, D-Lys36)hGLP-1(7-36)NH2 Пример 76: (Aib8, Пример 77: (Aib8, Пример 78: (Aib8,35, Arg26,34)hGLP-1(7-36)NH2 Пример 79: (Aib8, Arg26,34, Пример 80: (Aib8,35, Arg25,26,34)hGLP-1(7-36)NH2 Пример 81: (Aib8, Arg25,26,34, Пример 82: (Aib8, Arg26,34, Пример 83: (Aib8,35, Arg26,34, Lys36(N Пример 84: (Aib8,35,37, Arg26,34, Lys36(N Пример 85: (Aib8,35, Arg26,34, Lys36(N Пример 86: (Aib8,35,37, Arg26,34, Lys38(N Пример 87: (Aib8,35, Arg26,34, Пример 88: (Aib8,35, Arg26,34, Lys38(N Пример 89: (Aib8, Arg26,34, Lys36(N Пример 90: (Aib8,37, Arg26,34, Lys36(N Пример 91: (Aib8,35, Arg26,34, Ado37)hGLP-1(7-37)ОН Пример 92: (Aib8,35, Arg26,34, Ado37)hGLP-1(7-37)NH2 Пример 93: (Aib8, Arg26,34, Lys36(N Пример 94: (Aib8,37, Arg26,34, Lys38(N Пример 95: (Aib8, Arg26,34, Пример 96: (Aib8,35, Lys26(N Пример 97: (Aib8,35, Lys26(N Пример 98: (Aib8,35, Lys26(N Пример 99: (Aib8, Lys26(N Пример 100: (Aib8, Lys26(N Пример 101: (Aib8, Lys26(N Пример 102: (Aib8,35, Lys26(N Пример 103: (Aib8,35, Lys26(N Пример 104: (Aib8,35, Lys26(N Пример 105: (Aib8,35, Lys26(N Пример 106: (Aib8,35, Lys25, Lys26(N Пример 107: (Aib8,35, Lys25, Lys26(N Пример 108: (Aib8,35, Lys25, Lys26(N Пример 109: (Aib8,35, Arg25,34, Lys26(N Пример 110: (Aib8,35, Arg25,34, Lys26(N Пример 111: (Aib8,35, Arg25,34, Lys26(N Пример 112: (Aib8,35, Arg25,34, Lys26(N Пример 113: (Aib8, Lys26(N Пример 114: (Aib8, Lys26(N Пример 115: (Aib8, Lys26(N Пример 116: (Aib8, Lys26(N Пример 117: (Aib8,35, Lys34(N Пример 118: (Aib8,35, Lys34(N Пример 119: (Aib8,35, Lys34(N Пример 120: (Aib8,35, Arg26, Lys34(N Пример 121: (Aib8,35, Arg26, Lys34(N Пример 122: (Aib8,35, Arg26, Lys34(N Пример 123: (Aib8,35, Arg25,26, Lys34(N Пример 124: (Aib8,35, Arg25,26, Lys34(N Пример 125: (Aib8,35, Arg25,26, Lys34(N Пример 126: (Aib8,35, Arg25,26, Lys34(N Пример 127: (Aib8,35, Lys25, Arg26, Lys34(N Пример 128: (Aib8,35, Lys25, Arg26, Lys34(N Пример 129: (Aib8,35, Lys25, Arg26, Lys34(N Пример 130: (Aib8,35, Lys36(N Пример 131: (Aib8,35, Lys36(N Пример 132: (Aib8,35, Lys36(N Пример 133: (Aib8,35, Arg26, Lys36(N Пример 134: (Aib8,35, Arg26, Lys36(N Пример 135: (Aib8,35, Arg26, Lys36(N Пример 136: (Aib8,35, Arg26,34, Lys36(N Пример 137: (Aib8,35, Arg26,34, Lys36(N Пример 138: (Aib8,35, Arg26,34, Lys38(N Пример 139: (Aib8,35, Arg26,34, Lys38(N Пример 140: (Aib8,35, Arg26,34, Lys38(N Пример 141: (Aib8,35, Arg26,34, Lys38(N Пример 142: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 143: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 144: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 145: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 146: (Aib8,35,37, Arg26,34, Lys38(N Пример 147: (Aib8,35,37, Arg26,34, Lys38(N Пример 148: (Aib8,35,37, Arg26,34, Lys38(N Пример 149: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 150: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 151: (Aib8,35,37, Arg25,26,34, Lys38(N Пример152: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 153: (Aib8,35, Lys25, Arg26,34, Lys36(N Пример154: (Aib8,35, Lys25, Arg26,34, Lys36(N Пример155: (Aib8,35, Lys25, Arg26,34, Lys36(N Пример 156: (Aib8,35, Arg25,26,34, Lys36(N Пример 157: (Aib8,35, Arg25,26,34, Lys36(N Пример 158: (Aib8,35, Arg25,26,34, Lys36(N Пример 159: (Aib8,35, Arg25,26,34, Lys36(N Пример 160: (Aib8, Lys34(N Пример 161: (Aib8, Lys34(N Пример 162: (Aib8, Lys34(N Пример 163: (Aib8, А6с32, Lys34(N Пример 164: (Aib8, Glu23, Lys34(N Пример 165: (Aib8, Glu23, А6с32, Lys34(N Пример 166: (Aib8, Arg26, Lys34(N Пример 167: (Aib8, Arg26, Lys34(N Пример 168: (Aib8, Arg26, Lys34(N Пример 169: (Aib8, Arg26, Lys34(N Пример 170: (Aib8, Arg25,26, Lys34(N Пример 171: (Aib8, Arg25,26, Lys34(N Пример 172: (Aib8, Arg25,26, Lys34(N Пример 173: (Aib8, Arg25,26, Lys34(N Пример 174: (Aib8, Lys25, Arg26, Lys34(N Пример 175: (Aib8, Lys25, Arg26, Lys34(N Пример 176: (Aib8, Lys25, Arg26, Lys34(N Пример 177: (Aib8, Пример 178: (Aib8, Пример 179: (Aib8, Пример 180: (Aib8, Arg26, Пример 181: (Aib8, Arg26, Пример 182: (Aib8, Arg26, Пример 183: (Aib8, Arg26,34, Пример 184: (Aib8, Arg26,34, Пример 185: (Aib8, Arg26,34, Пример 186: (Aib8, Arg26,34, Пример 187: (Aib8, Lys25, Arg26,34, Пример 188: (Aib8, Lys25, Arg26,34, Lys36(N Пример 189: (Aib8, Lys25, Arg26,34, Пример 190: (Aib8, Arg25,26,34, Пример 191: (Aib8, Arg25,26,34, Пример 192: (Aib8, Arg25,26,34, Пример 193: (Aib8, Arg25,26,34, Пример 194: (Aib8,35, Lys26(N Пример 195: (Aib8,35, Lys26(N Пример 196: (Aib8,35, Lys26(N Пример 197: (Aib8,35, А6с32, Lys34(N Пример 198: (Aib8,35, А6с32, Lys34(N Пример 199: (Aib8,35, А6с32, Lys34(N Пример 200: (Aib8,35, Arg26, А6с32, Lys34(N Пример 201: (Aib8,35, Arg26, А6с32, Lys34(N Пример 202: (Aib8,35, А6с32, Lys36(N Пример 203: (Aib8,35, А6с32, Lys36(N Пример 204: (Aib8,35, А6с32, Lys36(N Пример 205: (Aib8,35, Arg26, А6с32, Lys36(N Пример 206: (Aib8,35, Arg26, А6с32, Lys36(N Пример 207: (Aib8,35, Arg26, А6с32, Lys36(N Пример 208: (Aib8,35, Arg26,34, А6с32, Lys36(N Пример 209: (Aib8,35, Arg26,34, А6с32, Lys36(N Пример 210: (Aib8,35, Arg26,34, А6с32, Lys36(N Пример 211: (Aib8,35, Arg26,34, А6с32, Lys36(N Пример 212: (Aib8,24,35, Lys26(N Пример 213: (Aib8,24,35, Lys26(N Пример 214: (Aib8,24,35, Lys26(N Пример 215: (Aib8,24,35, Arg26, Lys34(N Пример 216: (Aib8,24,35, Arg26, Lys34(N Пример 217: (Aib8,24,35, Arg26, Lys34(N Пример 218: (Aib8,24,35, Arg26,34, Lys36(N Пример 219: (Aib8,24,35, Arg26,34, Lys36(N Пример 220: (Aib8,24,35, Arg26,34, Lys36(N Пример 221: (Aib8,24,35, Glu23, A6c32, Lys34(N Пример 222: (Aib8,35, Glu23, Lys26(N Пример 223: (Aib8,35, Glu23, Lys26(N Пример 224: (Aib8,35, Glu23, Lys26(N Пример 225: (Aib8,35, Glu23, Lys34(N Пример 226: (Aib8,35, Glu23, A6c32, Lys34(N Пример 227: (Aib8,35, Glu23, Arg26, Lys34(N Пример 228: (Aib8,35, Glu23, Arg26, Lys34(N Пример 229: (Aib8,35, Glu23, Arg26, Lys34(N Пример 230: (Aib8,35, Glu23, Lys36(N Пример 231: (Aib8,35, Glu23, Lys36(N Пример 232: (Aib8,35, Glu23, Lys36(N Пример 233: (Aib8,35, Glu23, Arg26,34, Lys36(N Пример 234: (Aib8,35, Glu23, Arg26,34, Lys36(N Пример 235: (Aib8,35, Glu23, Arg26,34, Lys36(N Пример 236: (Aib8,30,35, Lys26(N Пример 237: (Aib8,30,35, Lys26(N Пример 238: (Aib8,30,35, Lys26(N Пример 239: (Aib8,30,35, Arg26, Lys34(N Пример 240: (Aib8,30,35, Arg26, Lys34(N Пример 241: (Aib8,30,35, Arg26, Lys34(N Пример 242: (Aib8,30,35, Arg26,34, Lys36(N Пример 243: (Aib8,30,35, Arg26,34, Lys36(N Пример 244: (Aib8,30,35, Arg26,34, Lys36(N Пример 245: (Aib8,35, Glu23, A6c32, Lys36(N Пример 246: (Aib8,35, Glu23, A6c32, Lys36(N Пример 247: (Aib8,35, Glu23, A6c32, Lys36(N Пример 248: (Aib8,35, Glu23, Arg26,34, A6c32, Lys36(N Пример 249: (Aib8,35, Glu23, Arg26,34, A6c32, Lys36(N Пример 250: (Aib8,35, Glu23, Arg26,34, A6c32, Lys36(N Пример 251: (Aib8,24,35, Glu23, Arg26,34, A6c32, Lys36(N Пример 252: (Aib8,24,35, Glu23, Arg26,34, A6c32, Lys36(N Пример 253: (Aib8,24,35, Glu23, Arg26,34, A6c32, Lys36(N Пример 254: (Aib8,24,30,35, Glu23, Arg26,34, A6c32, Lys36(N Пример 255: (Aib8,24,30,35, Glu23, Arg26,34, A6c32, Lys36(N Пример 256: (Aib8,24,30,35, Glu23, Arg26,34, A6c32, Lys36(N Пример 257: ((N Пример 258: ((N Пример 259: ((N Пример 260: ((N Пример 261: ((N Пример 262: ((N Пример 263: ((N Пример 264: ((N Пример 265: ((N Пример 266: ((N Пример 267: ((N Пример 268: ((N Пример 269: ((N Пример 270: ((N Пример 271: ((N Пример 272: ((N Пример 273: ((N Пример 274: (Aib8,35, Lys26(N Пример 275: (Aib8,35, Lys26(N Пример 276: (Aib8,35, Lys26(N Пример 277: (Aib8,35, Arg26, Lys34(N Пример 278: (Aib8,35, Arg26, Lys34(N Пример 279: (Aib8,35, Arg26, Lys34(N Пример 280: (Aib8,35, Arg26,34, Lys36(N Пример 281: (Aib8,35, Arg26,34, Lys36(N Пример 282: (Aib8,35, Asp26(1-(4-децилпиперазин)), Arg34)hGLP-1(7-36)NH2 Пример 283: (Aib8,35, Asp26(1-(4-додецилпиперазин)), Arg34)hGLP-1(7-36)NH2 Пример 284: (Aib8,35, Asp26(1-(4-тетрадецилпепиразин)), Arg34)hGLP-1(7-36)NH2 Пример 285: (Aib8,35, Asp26(1-(4-гексадецилпепиразин)), Arg34)hGLP-1(7-36)NH2 Пример 286: (Aib8,35, Arg26, Asp34(1-(4-децилпиперазин)))hGLP-1(7-36)NH2 Пример 287: (Aib8,35, Arg26, Asp34(1-(4-додецилпиперазин)))hGLP-1(7-36)NH2 Пример 288: (Aib8,35, Arg26, Asp34(1-(4-тетрадецилпиперазин)))hGLP-1(7-36)NH2 Пример 289: (Aib8,35, Arg26, Asp34(1-(4-гексадецилпиперазин)))hGLP-1(7-36)NH2 Пример 290: (Aib8,35, Arg26,34, Asp36(1-(4-децилпиперазин)))hGLP-1(7-36)NH2 Пример 291: (Aib8,35, Arg26,34, Asp36(1-(4-додецилпиперазин)))hGLP-1(7-36)NH2 Пример 292: (Aib8,35, Arg26,34, Asp36(1-(4-гексадецилпиперазин)))hGLP-1(7-36)NH2 Пример 293: (Aib8,35, Arg26,34, Asp38(1-(4-децилпиперазин)))hGLP-1(7-38)NH2 Пример 294: (Aib8,35, Arg26,34, Asp38(1-(4-додецилпиперазин)))hGLP-1(7-38)NH2 Пример 295: (Aib8,35, Arg26,34, Asp38(1-(4-тетрадецилпиперазин)))hGLP-1(7-38)NH2 Пример 296: (Aib8,35, Arg26,34, Asp38(1-(4-гексадецилпиперазин)))hGLP-1(7-38)NH2 Пример 297: (Aib8,35,37, Arg26,34, Asp38(1-(4-децилпиперазин)))hGLP-1(7-38)NH2 Пример 298: (Aib8,35,37, Arg26,34, Asp38(1-(4-додецилпиперазин)))hGLP-1(7-38)NH2 Пример 299: (Aib8,35,37, Arg26,34, Asp38(1-(4-тетрадецилпиперазин)))hGLP-1(7-38)NH2 Пример 300: (Aib8,35,37, Arg26,34, Asp38(1-(4-гексадецилпиперазин)))hGLP-1(7-38)NH2 Пример 301: (Aib8,35, Arg25,34, Asp26(1-(4-децилпиперазин)))hGLP-1(7-36)NH2 Пример 302: (Aib8,35, Arg25,34, Asp26(1-(4-додецилпиперазин)))hGLP-1(7-36)NH2 Пример 303: (Aib8,35, Arg25,34, Asp26(1-(4-тетрадецилпиперазин)))hGLP-1(7-36)NH2 Пример 304: (Aib8,35, Arg25,34, Asp26(1-(4-гексадецилпиперазин)))hGLP-1(7-36)NH2 Пример 305: (Aib8,35, Arg25,26, Asp34(1-(4-децилпиперазин)))hGLP-1(7-36)NH2 Пример 306: (Aib8,35, Arg25,26, Asp34(1-(4-додецилпиперазин)))hGLP-1(7-36)NH2 Пример 307: (Aib8,35, Arg25,26, Asp34(1-(4-тетрадецилпиперазин)))hGLP-1(7-36)NH2 Пример 308: (Aib8,35, Arg25,26, Asp34(1-(4-гексадецилпиперазин)))hGLP-1(7-36)NH2 Пример 309: (Aib8,35, Arg25,26,34, Asp36(1-(4-децилпиперазин)))hGLP-1(7-36)NH2 Пример 310: (Aib8,35, Arg25,26,34, Asp36(1-(4-додецилпиперазин)))hGLP-1(7-36)NH2 Пример 311: (Aib8,35, Arg25,26,34, Asp36(1-(4-тетрадецилпиперазин)))hGLP-1(7-36)NH2 Пример 312: (Aib8,35, Arg25,26,34, Asp36(1-(4-гексадецилпиперазин)))hGLP-1(7-36)NH2 Пример 313: (Aib8,35, Arg25,26,34, Asp38(1-(4-децилпиперазин)))hGLP-1(7-38)NH2 Пример 314: (Aib8,35, Arg25,26,34, Asp38(1-(4-додецилпиперазин)))hGLP-1(7-38)NH2 Пример 315: (Aib8,35, Arg25,26,34, Asp38(1-(4-тетрадецилпиперазин)))hGLP-1(7-38)NH2 Пример 316: (Aib8,35, Arg25,26,34, Asp38(1-(4-гексадецилпиперазин)))hGLP-1(7-38)NH2 Пример 317: (Aib8,35,37, Arg25,26,34, Asp38(1-(4-децилпиперазин)))hGLP-1(7-38)NH2 Пример 318: (Aib8,35,37, Arg25,26,34, Asp38(1-(4-додецилпиперазин)))hGLP-1(7-38)NH2 Пример 319: (Aib8,35,37, Arg25,26,34, Asp38(1-(4-тетрадецилпиперазин)))hGLP-1(7-38)NH2 Пример 320: (Aib8,35,37, Arg25,26,34, Asp38(1-(4-гексадецилпиперазин)))hGLP-1(7-38)NH2 Пример 321: (Aib8,35, Arg26,34, Glu36(1-додециламино))hGLP-1(7-36)NH2 Пример 322: (Aib8,35, Glu26(1-додециламино), Arg34)hGLP-1(7-36)NH2 Пример 323: (Aib8,35, Arg26, Glu34(1-додециламино))hGLP-1(7-36)NH2 Пример 324: (Aib8,35,37, Arg26,34, Glu38(1-додециламино))hGLP-1(7-38)NH2 Пример 325: (Aib8,35, Arg34, Lys26(N Пример 326: (Aib8,35, Arg34, Lys26(N Пример 327: (Aib8,35, Arg34, Lys26(N Пример 328: (Aib8,35, Arg34, Lys26(N Пример 329: (Aib8,35, Arg26, Lys34(N Пример 330: (Aib8,35, Arg26, Lys34(N Пример 331: (Aib8,35, Arg26, Lys34(N Пример 332: (Aib8,35, Arg26, Lys34(N Пример 333: (Aib8,35, Arg26,34, Lys36(N Пример 334: (Aib8,35, Arg26,34, Lys36(N Пример 335: (Aib8,35, Arg26,34, Lys36(N Пример 336: (Aib8,35, Arg26,34, Lys38(N Пример 337: (Aib8,35, Arg26,34, Lys38(N Пример 338: (Aib8,35, Arg26,34, Lys38(N Пример 339: (Aib8,35, Arg26,34, Lys38(N Пример 340: (Aib8,35,37, Arg26,34, Lys38(N Пример 341: (Aib8,35,37, Arg26,34, Lys38(N Пример 342: (Aib8,35,37, Arg26,34, Lys38(N Пример 343: (Aib8,35,37, Arg26,34, Lys38(N Пример 344: (Aib8,35, Arg25,34, Lys26(N Пример 345: (Aib8,35, Arg25,34, Lys26(N Пример 346: (Aib8,35, Arg25,34, Lys26(N Пример 347: (Aib8,35, Arg25,34, Lys26(N Пример 348: (Aib8,35, Arg25,26, Lys34(N Пример 349: (Aib8,35, Arg25,26, Lys34(N Пример 350: (Aib8,35, Arg25,26, Lys34(N Пример 351: (Aib8,35, Arg25,26, Lys34(N Пример 352: (Aib8,35, Arg25,26,34, Lys36(N Пример 353: (Aib8,35, Arg25,26,34, Lys36(N Пример 354: (Aib8,35, Arg25,26,34, Lys36(N Пример 355: (Aib8,35, Arg25,26,34, Lys36(N Пример 356: (Aib8,35, Arg25,26,34, Lys38(N Пример 357: (Aib8,35, Arg25,26,34, Lys38(N Пример 358: (Aib8,35, Arg25,26,34, Lys38(N Пример 359: (Aib8,35, Arg25,26,34, Lys38(N Пример 360: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 361: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 362: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 363: (Aib8,35,37, Arg25,26,34, Lys38(N Пример 364: (Aib8,35, Arg26,34, Lys36(N Пример 365: (Aib8,35, Lys25, Arg26,34, Lys36(N Пример 370: (Aib8,35, Arg26,34, Ava37, Ado38)hGLP-1(7-38)NH2 Пример 371: (Aib8,35, Arg26,34, Asp37, Ava38, Ado39)hGLP-1(7-39)NH2 Пример 372: (Aib8,35, Arg26,34, Aun37)hGLP-1(7-37)NH2 Пример 373: (Aib8,17,35)hGLP-1(7-36)NH2 Пример 374: (Aib8, Arg26,34, Пример 375: (Gly8, Пример 376: (Ser8, Пример 377: (Aib8, Glu22,23, Пример 378: (Gly8, Aib35)hGLP-1(7-36)NH2 Пример 379: (Aib8, Lys18, Пример 380: (Aib8, Leu27, Пример 381: (Aib8, Lys33, Пример 382: (Aib8, Lys18, Leu27, Пример 383: (Aib8, D-Arg36)hGLP-1(7-36)NH2 Пример 384: (Aib8, Пример 385: (Aib8,27, Пример 386: (Aib8,27, Пример 387: (Aib8,27, Пример 388: (Aib8, Lys18,27, Пример 389: (Aib8, Lys27, Пример 390: (Aib8, Пример 391: (Aib8, Arg26,34, Пример 392: (Aib8, D-Arg35)hGLP-1(7-36)NH2 Пример 393: (Aib8, Пример 394: (Aib8, Phe31, Пример 395: (Aib8,35, Phe31)hGLP-1(7-36)NH2 Пример 396: (Aib8,35, Nal31)hGLP-1(7-36)NH2 Пример 397: (Aib8,35, Nal28,31)hGLP-1(7-36)NH2 Пример 398: (Aib8,35, Arg26,34, Nal31)hGLP-1(7-36)NH2 Пример 399: (Aib8,35, Arg26,34, Phe31)hGLP-1(7-36)NH2 Пример 400: (Aib8,35, Nal19,31)hGLP-1(7-36)NH2 Пример 401: (Aib8,35, Nal12,31)hGLP-1(7-36)NH2 Пример 402: (Aib8,35, Lys36(N Пример 403: (Aib8,35, Arg34, Lys26(N Пример 404: (Aib8,35, Arg26,34, Lys36(N Пример 405: (Aib8, Пример 406: (Aib8,27, Пример 407: (Aib8, Arg26,34, Пример 408: (Aib8, Arg26,34, Пример 409: (Aib8, Arg26,34, Пример 410: (Aib8, Arg26,34, Пример 411: (Aib8, Arg26,34, Физические данные для выборки типичных соединений из соединений, примеры которых приведены в данном документе, показаны в таблице 1.
Формула изобретения
1. Способ индуцирования агонистического эффекта по отношению к рецептору GLP-1 у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы (I) (R2R3)-A7-A8-A9-A10-A11-A12-A13-A14-A15-A16-A17-A18-A19-A20-A21-A22-A23-A24-A25-A26-A27-A28-A29-A30-A31-A32-A33-A34-A35-A36-A37-A38-A39-R1, (I) где А7 представляет собой L-His, Ura, Paa, Pta, Amp, Tma-His, дезамино-His или удален; А8 представляет собой Ala, D-Ala, Aib, Асе, N-Me-Ala, N-Me-D-Ala или N-Me-Gly; А9 представляет собой Glu, N-Me-Glu, N-Me-Asp или Asp; А10 представляет собой Gly, Acc, А11 представляет собой Thr или Ser; А12 представляет собой Phe, Acc, Aic, Aib, 3-Pal, 4-Pal, А13 представляет собой Thr или Ser; А14 представляет собой Ser или Aib; А15 представляет собой Asp или Glu; А16 представляет собой Val, Acc, Aib, Leu, Ile, Tle, Nle, Abu, Ala или Cha; А17 представляет собой Ser или Thr; А18 представляет собой Ser или Thr; А19 представляет собой Tyr, Cha, Phe, 3-Pal, 4-Pal, Acc, А20 представляет собой Leu, Acc, Aib, Nle, Ile, Cha, Tle, Val, Phe или X1-Phe; А21 представляет собой Glu или Asp; А22 представляет собой Gly, Acc, А23 представляет собой Gln, Asp, Asn или Glu; А24 представляет собой Ala, Aib, Val, Abu, Tle или Acc; А25 представляет собой Ala, Aib, Val, Abu, Tle, Acc, Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-СН((СН2)е-Х3)-С(O); А26 представляет собой Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-СН((СН2)е-Х3)-С(O); А27 представляет собой Glu, Asp, Leu, Aib или Lys; А28 представляет собой Phe, Pal, А29 представляет собой Ile, Acc, Aib, Leu, Nle, Cha, Tle, Val, Abu, Ala или Phe; А30 представляет собой Ala, Aib или Acc; А31 представляет собой Trp, А32 представляет собой Leu, Acc, Aib, Nle, Ile, Cha, Tle, Phe, X1-Phe или Ala; А33 представляет собой Val, Acc, Aib, Leu, Ile, Tle, Nle, Cha, Ala, Phe, Abu, Lys или X1-Phe; А34 представляет собой Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-СН((СН2)е-Х3)-С(O); А35 представляет собой Gly, А36 представляет собой L- или D-Arg, D- или L-Lys, D- или L-hArg, D- или L-Orn, HN-CH((CH2)n-N(R10R11))-C(O), HN-СН((СН2)е-Х3)-С(O) или удален; А37 представляет собой Gly, А38 представляет собой D- или L-Lys, D- или L-Arg, D- или L-hArg, D- или L-Orn, HN-СН((СН2)n-N(R10R11))-C(O), HN-СН((СН2)е-Х3)-С(O) Ava, Ado, Aec или удален; А39 представляет собой D- или L-Lys, D- или L-Arg, HN-CH((CH2)n-N(R10R11))-C(O), Ava, Ado, или Aec; Х1 в каждом случае независимо выбирают из группы, состоящей из (C1-С6)алкила, ОН и галогена, R1 представляет собой ОН, NH2, (С1-С30)алкокси или NH-X2-СН2-Z0, где Х2 представляет собой (C1-C12)углеводородную группу, а Z0 представляет собой H, ОН, CO2H или CONH2; X3 представляет собой или -C(O)-NHR12, где X4 представляет собой в каждом случае независимо -С(O)-, -NH-C(O)- или -СН2– и где f представляет собой в каждом случае независимо целое число от 1 до 29 включительно; каждый из R2 и R3 независимо выбирают из группы, состоящей из Н, (C1-С30)алкила, (С2-С30)алкенила, фенил(С1-С30)алкила, нафтил(С1-С30)алкила, гидрокси(С1-С30)алкила, гидрокси(С2-С30)алкенила, гидроксифенил(С1-С30)алкила и гидроксинафтил(С1-С30)алкила; или один из R2 и R3 представляет собой
где Y представляет собой Н, ОН или NH2; r равно числу от 0 до 4; q равно числу от 0 до 4; X5 представляет собой (С1-С30)алкил, (С2-С30)алкенил, фенил(С1-С30)алкил, нафтил(С1-С30)алкил, гидрокси(С1-С30)алкил, гидрокси(С2-С30)алкенил, гидроксифенил(С1-С30)алкил или гидроксинафтил(С1-С30)алкил; е представляет собой в каждом случае независимо целое число от 1 до 4 включительно; m представляет собой в каждом случае независимо целое число от 5 до 24 включительно; n представляет собой в каждом случае независимо целое число от 1 до 5 включительно; каждый из R10 и R11 представляет собой в каждом случае независимо Н, (C1-С30)алкил, (С1-С30)ацил, (С1-С30)алкилсульфонил, -C((NH)(NH2)) или R12 и R13 каждый представляет собой в каждом случае независимо (С1-С30)алкил, при условии, что если А7 представляет собой Ura, Раа или Pta, то R2 и R3 удалены; если R10 представляет собой (С1-С30)ацил, (С1-С30)алкилсульфонил, -C((NH)(NH2)) или то R11 представляет собой Н или (С1-С30)алкил; (i) по меньшей мере одна аминокислота соединения формулы (I) отличается от соответствующей аминокислоты нативной последовательности hGLP-1(7-36, -37 или -38)NH2 или hGLP-1(7-36, -37 или -38)ОН; (ii) соединение формулы (I) не является аналогом hGLP-1(7-36, -37 или -38)NH2 или hGLP-1(7-36, -37 или -38)ОН, где в единственной позиции произведено замещение на Ala; (iii) соединение формулы (I) не является (Arg26,34, Lys38)hGLP-1(7-38)-E, (Lys26(N (iv) соединение формулы (I) не является Z1-hGLP-1(7-36, -37 или -38)-ОН, Z1-hGLP-1(7-36, -37 или -38)-NH2, где Z1 выбран из группы, состоящей из (a) (Arg26), (Arg34), (Arg26,34), (Lys36), (Arg26, Lys36), (Arg34, Lys36), (D-Lys36), (Arg36), (D-Arg36), (Arg26,34, Lys36) или (Arg26,36, Lys34); (b) (Asp21); (c) по меньшей мере одного из (Aib8), (D-Ala8) и (Asp9) и (d) (Tyr7), (N-ацил-His7), (N-алкил-His7), (N-ацил-D-His7) или (N-алкил-D-His7); (v) соединение формулы (I) не является сочетанием любых двух замещений, перечисленных в группах от (а) до (d); и (vi) соединение формулы (I) не является (N-Me-Ala8)hGLP-1(8-36, или -37), (Glu15)hGLP-1(7-36, или -37), (Asp21)hGLP-1(7-36, или -37) или (Phe31)hGLP-1(7-36, или -37), или его фармацевтически приемлемой соли. 2. Способ лечения заболевания, выбранного из группы, включающей диабет типа I, диабет типа II, ожирение, глюкагономы, секреторные нарушения дыхательных путей, метаболические нарушения, артит, остеопороз, заболевание центральной нервной системы, рестеноз и нейродегенеративные заболевания у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. 3. Способ по п.2, где указанным заболеванием является диабет типа I или диабет типа II. 4. Применение соединения формулы (I) для лечения заболеваний, выбранных из группы, состоящей из диабета типа I, диабета типа II, ожирения, глюкагономы, секреторных нарушений дыхательных путей, метаболических нарушений, артрита, остеопороза, заболеваний центральной нервной системы, рестеноза и нейродегенеративных заболеваний. 5. Способ индуцирования агонистического эффекта по отношению к рецептору GLP-1 у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы [Aib8,35]hGLP-1(7-36)NH2 или его фармацевтически приемлемой соли. 6. Способ лечения заболевания, выбранного из группы, включающей диабет типа I, диабет типа II, ожирение, глюкагоному, секреторные нарушения дыхательных путей, метаболические нарушения, артрит, остеопороз, заболевания центральной нервной системы, рестеноз и нейродегенеративные заболевания у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы [Aib8,35]hGLP-1(7-36)NH2 или его фармацевтически приемлемой соли. 7. Способ по п.6, где указанным заболеванием является диабет типа I или диабет типа II. 8. Способ индуцирования агонистического эффекта по отношению к рецептору GLP-1 у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы [Aib8,35, Arg26,34, Phe31]hGLP-1(7-36)NH2 или его фармацевтически приемлемой соли. 9. Способ лечения заболевания, выбранного из группы, включающей диабет типа I, диабет типа II, ожирение, глюкагономы, секреторные нарушения дыхательных путей, метаболические нарушения, артрит, остеопороз, заболевания центральной нервной системы, рестеноз и нейродегенеративные заболевания у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы [Aib8,35, Arg26,34, Phe31]hGLP-1(7-36)NH2 или его фармацевтически приемлемой соли. 10. Способ по п.9, где указанным заболеванием является диабет типа I или диабет типа II.
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция текста описания изобретения
Извещение опубликовано: 20.04.2007 БИ: 11/2007
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 08.12.2007
Извещение опубликовано: 20.05.2010 БИ: 14/2010
NF4A – Восстановление действия патента СССР или патента Российской Федерации на изобретение
Дата, с которой действие патента восстановлено: 27.05.2010
Извещение опубликовано: 27.05.2010 БИ: 15/2010
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -Ala или Aib;
-Ala или Aib;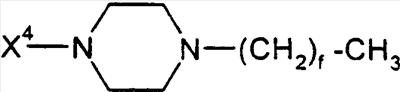



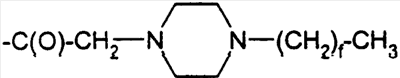
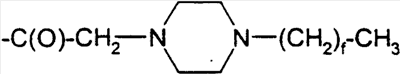
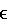 -алканоил))hGLP-1(7-36, -37 или -38)-Е, (Lys34(N
-алканоил))hGLP-1(7-36, -37 или -38)-Е, (Lys34(N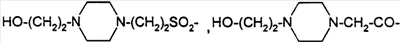
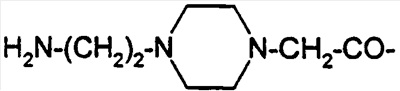
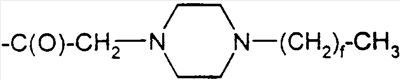
 -HEPES-His)7, Aib8,35)hGLP-1(7-36)NH2,
-HEPES-His)7, Aib8,35)hGLP-1(7-36)NH2, -аминомасляную кислоту; Ava обозначает 5-аминовалериановую кислоту; Ado обозначает 12-аминододекановую кислоту, Aic обозначает 2-аминоиндан-2-карбоновую кислоту; Aun обозначает 11-аминоундекановую кислоту; и Aec обозначает 4-(2-аминоэтил)-1-карбоксиметилпиперазин, представленный структурой:
-аминомасляную кислоту; Ava обозначает 5-аминовалериановую кислоту; Ado обозначает 12-аминододекановую кислоту, Aic обозначает 2-аминоиндан-2-карбоновую кислоту; Aun обозначает 11-аминоундекановую кислоту; и Aec обозначает 4-(2-аминоэтил)-1-карбоксиметилпиперазин, представленный структурой: 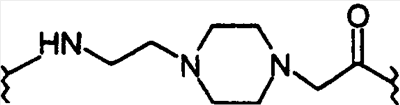
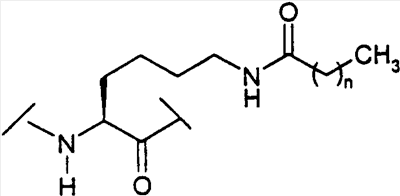
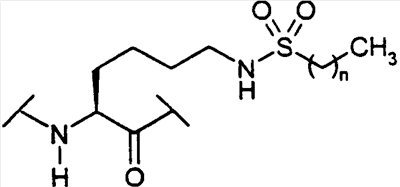
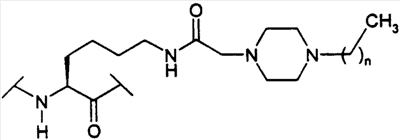
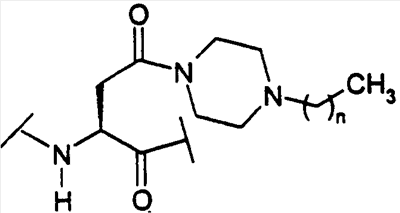
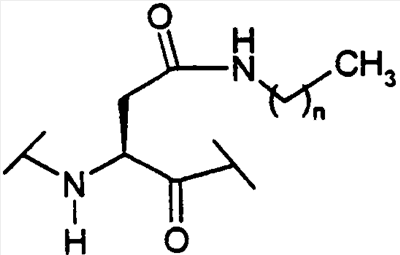
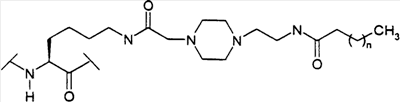
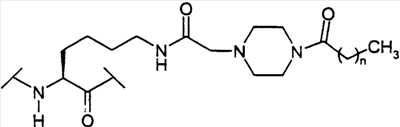























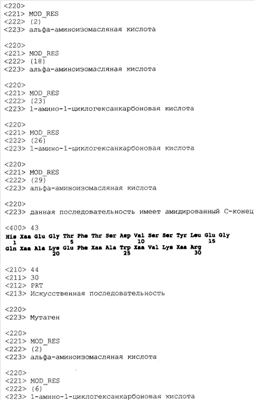





























































































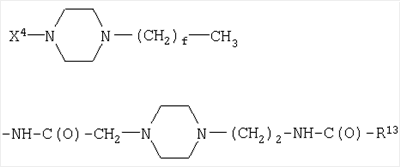
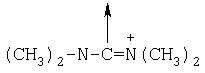 (С1-С30)ацил, (С1-С30)алкилсульфонил, С(O)Х5
(С1-С30)ацил, (С1-С30)алкилсульфонил, С(O)Х5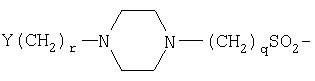 или
или