Патент на изобретение №2156807
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ АНТИЛАКТОФЕРРИНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ
(57) Реферат: Изобретение относится к микробиологии и может быть использовано в лабораториях научно-исследовательских институтов и бактериологических лабораториях клинических учреждений, занимающихся вопросами определения персистентных характеристик микроорганизмов (в эксперименте), а также установления их этиологической значимости при патологических процессах (в клинике). Способ осуществляют выращиванием исследуемой культуры в жидкой питательной среде и получением супернатанта выросших культур с добавлением раствора лактоферрина. Параллельно готовят две контрольные пробы, инкубируют и добавляют в опытную и контрольные пробы тест-культуру M.luteus ГИСК N 211001. Затем замеряют их оптическую плотность и по изменению оптических плотностей в опыте и контролях рассчитывают антилактоферриновую активность исследуемой культуры. Способ позволяет выявить новое свойство микроорганизмов – антилактоферриновую активность, а как следствие, повысить точность диагностики и прогнозирования заболеваний микробной этиологии. Предлагаемый способ способствует выбору рациональной антибактериальной терапии, изучению механизмов персистенции микроорганизмов и формирования бактерионосительства. 1 табл. Изобретение относится к микробиологии и может быть использовано в исследовательской работе НИИ и практической работе бактериологических лабораторий клинических учреждений, определяющих персистентные характеристики микроорганизмов для установления их этиологической значимости при патологических процессах. В настоящее время характер течения большинства инфекций изменился в сторону увеличения доли затяжных и хронических форм [1]. Длительное переживание бактерий в организме хозяина (бактерионосительство), а также переход инфекционного процесса в хроническую форму обеспечивают механизмы персистенции микроорганизмов, инактивирующие ряд факторов естественной противоинфекционной резистентности: лизоцим, комплемент, интерферон [2], тромбоцитарный катионный белок [3] и др. В настоящее время все большее внимание уделяется изучению свойств патогенных микроорганизмов, направленных на инактивацию факторов естественной резистентности организма хозяина. Известны способы определения антилизоцимной [4], “антиинтерфероновой” [5] , антииммуноглобулиновой [6] , антикомплементарной [7] и антитромбоцитарной катионно-белковой [3] активностей микроорганизмов. В настоящее время установлено, что природный гликопротеин лактоферрин обладает рядом защитных свойств: бактериостатическим и бактерицидным действием [8] , принимает участие в процессах местной защиты слизистых оболочек [9] , в регуляции гуморальных и клеточных иммунологических реакций, в противовоспалительных процессах, воздействует на систему комплемента, регулирует гранулоцитопоэз [10], гемопоэз по принципу обратной связи [11]. Актуальность разработки способа определения антилактоферриновой активности микроорганизмов определяется открывающейся при этом возможностью повышения точности диагностики и прогнозирования заболеваний микробной этиологии, а также выбора рациональной антибактериальной терапии для борьбы с бактерионосительством. Задачей заявляемого технического решения является создание способа определения антилактоферриновой активности (АЛфА) микроорганизмов. Для решения указанной задачи в заявляемом способе исследуемую культуру микроорганизмов выращивают в жидкой питательной среде, выросшие культуры обрабатывают хлороформом, отделяют супернатант и смешивают его с лактоферрином, параллельно с опытной готовят две контрольные пробы, при этом в контроль 1 вместо супернатанта исследуемых культур микроорганизмов добавляют жидкую питательную среду, а контроль 2 готовят из забуференного физиологического раствора и жидкой питательной среды, опытную и контрольные пробы инкубируют, после инкубации добавляют тест-культуру M.luteus ГИСК N 211001 и проводят первое измерение оптической плотности в опыте и контролях непосредственно по достижении режима термостатирования (37oC) и второе измерение через 18-24 часа инкубации, затем рассчитывают антилактоферриновую активность по формуле 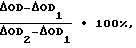 где  OD – изменение оптической плотности в опыте между 1 и 2 измерениями; OD – изменение оптической плотности в опыте между 1 и 2 измерениями; OD1– изменение оптической плотности в контроле 1 между 1 и 2 измерениями; OD1– изменение оптической плотности в контроле 1 между 1 и 2 измерениями; OD2 – изменение оптической плотности в контроле 2 между 1 и 2 измерениями.
Аналогов изобретения в патентной и научно-технической литературе не обнаружено.
Авторами экспериментально установлено, что микроорганизмы независимо от их видового происхождения способны инактивировать бактерицидное действие лактоферрина. В результате проведенных исследований было сделано предположение о наличии у бактерий определенных механизмов защиты от влияния лактоферрина. Данное предположение было подтверждено проведенными экспериментами. Культуры E. coli, S.aureus, S.epidermidis выращивали на мясопептонном агаре при температуре 37oC в течение 24 часов, готовили их взвесь в концентрации 1 млрд/мл. Далее в равных объемах смешивали взвесь и раствор, содержащий 2 мг/мл (суббактериостатическая концентрация) лактоферрина, смесь инкубировали в течение 30 минут, центрифугировали при 3000 об/мин в течение 20 минут, получали бесклеточный супернатант, в котором с помощью микробиологического анализатора iEMS-MF (Labsystems, Финляндия) определяли остаток лактоферрина. Оказалось, что культура E.coli инактивировала (75.6 OD2 – изменение оптической плотности в контроле 2 между 1 и 2 измерениями.
Аналогов изобретения в патентной и научно-технической литературе не обнаружено.
Авторами экспериментально установлено, что микроорганизмы независимо от их видового происхождения способны инактивировать бактерицидное действие лактоферрина. В результате проведенных исследований было сделано предположение о наличии у бактерий определенных механизмов защиты от влияния лактоферрина. Данное предположение было подтверждено проведенными экспериментами. Культуры E. coli, S.aureus, S.epidermidis выращивали на мясопептонном агаре при температуре 37oC в течение 24 часов, готовили их взвесь в концентрации 1 млрд/мл. Далее в равных объемах смешивали взвесь и раствор, содержащий 2 мг/мл (суббактериостатическая концентрация) лактоферрина, смесь инкубировали в течение 30 минут, центрифугировали при 3000 об/мин в течение 20 минут, получали бесклеточный супернатант, в котором с помощью микробиологического анализатора iEMS-MF (Labsystems, Финляндия) определяли остаток лактоферрина. Оказалось, что культура E.coli инактивировала (75.6  5.3)% препарата, S. aureus – (68.8 5.3)% препарата, S. aureus – (68.8  7.5)%, S.epidermidis – (54.6 7.5)%, S.epidermidis – (54.6  3.7)% лактоферрина.
При разработке настоящего способа авторами были проведены исследования по выбору индикаторной культуры, позволяющей тестировать наличие или отсутствие в среде лактоферрина, поскольку для осуществления способа необходим высокочувствительный к лактоферрину штамм микроорганизма.
Авторами с помощью анализа кривых роста различных видов микроорганизмов в среде с лактоферрином экспериментально отобрана тест-культура. Для этого взвесь суточных агаровых культур исследуемых микроорганизмов (106 КОЕ/мл; 50 мкл) и раствор лактоферрина в 0,01 М фосфатном буфере (2 мг/мл, 50 мкл) инокулировали в питательный бульон (300 мкл). Контролем служили пробы без лактоферрина (50 мкл 0,01М фосфатного буфера). Параметры роста (OD) определяли с помощью автоматизированной фотометрии на микробиологическом анализаторе iEMS-MF (Labsystems, Финляндия). По окончании инкубации в термостатируемом блоке ридера (через 18 часов) оценивали изменение оптической плотности в опытной пробе по сравнению с контролем (таблица).
Таким образом, в результате проведенных исследований авторами в качестве тест-культуры был выбран штамм M.luteus, проявляющий наибольшую чувствительность к бактерицидному действию лактоферрина. Штамм депонирован в ГИСК им. Л.А.Тарасевича под регистрационным номером 211001 [12].
Предлагаемый штамм M.luteus растет на простых питательных средах, клетки сферические, 0,5-3,5 мкм в диаметре, неподвижный, грамположительный, аэроб, образует каталазу, не сбраживает глюкозу.
Для осуществления способа используется лактоферрин из коровьего молока, кристаллический, производства фирмы “Fluka” (Швейцария), степень чистоты препарата (по данным гель-электрофореза) более 75%, растворимость 10 мг/мл H2O, номер по каталогу 61323 [13].
Способ осуществляется следующим образом.
1) Исследуемые культуры микроорганизмов выращиваются в 3 мл жидкой питательной среды (для каждого вида микроорганизмов используется соответствующий тип питательной среды) при 37oC в течение 24-36 часов.
2) Во все пробы добавляют 0,1 мл хлороформа, перемешивают и инкубируют при комнатной температуре в течение 40-60 минут, периодически встряхивая.
3) Супернатант отделяют от бактериальных клеток центрифугированием в течение 20 минут при 3000 об/мин.
4) На забуференном физиологическом растворе (Sigma, P4417. Состав: 0.01М фосфатный буфер, 0.0027М KCl, 0.137М NaCl, pH 7,4 при 25oC) готовят раствор лактоферрина с концентрацией 2,5 мг/мл.
5) Супернатант исследуемых культур микроорганизмов объемом 0,8 мл смешивают с 0,1 мл приготовленного раствора лактоферрина.
6) Параллельно с опытными готовят 2 контрольные пробы: 3.7)% лактоферрина.
При разработке настоящего способа авторами были проведены исследования по выбору индикаторной культуры, позволяющей тестировать наличие или отсутствие в среде лактоферрина, поскольку для осуществления способа необходим высокочувствительный к лактоферрину штамм микроорганизма.
Авторами с помощью анализа кривых роста различных видов микроорганизмов в среде с лактоферрином экспериментально отобрана тест-культура. Для этого взвесь суточных агаровых культур исследуемых микроорганизмов (106 КОЕ/мл; 50 мкл) и раствор лактоферрина в 0,01 М фосфатном буфере (2 мг/мл, 50 мкл) инокулировали в питательный бульон (300 мкл). Контролем служили пробы без лактоферрина (50 мкл 0,01М фосфатного буфера). Параметры роста (OD) определяли с помощью автоматизированной фотометрии на микробиологическом анализаторе iEMS-MF (Labsystems, Финляндия). По окончании инкубации в термостатируемом блоке ридера (через 18 часов) оценивали изменение оптической плотности в опытной пробе по сравнению с контролем (таблица).
Таким образом, в результате проведенных исследований авторами в качестве тест-культуры был выбран штамм M.luteus, проявляющий наибольшую чувствительность к бактерицидному действию лактоферрина. Штамм депонирован в ГИСК им. Л.А.Тарасевича под регистрационным номером 211001 [12].
Предлагаемый штамм M.luteus растет на простых питательных средах, клетки сферические, 0,5-3,5 мкм в диаметре, неподвижный, грамположительный, аэроб, образует каталазу, не сбраживает глюкозу.
Для осуществления способа используется лактоферрин из коровьего молока, кристаллический, производства фирмы “Fluka” (Швейцария), степень чистоты препарата (по данным гель-электрофореза) более 75%, растворимость 10 мг/мл H2O, номер по каталогу 61323 [13].
Способ осуществляется следующим образом.
1) Исследуемые культуры микроорганизмов выращиваются в 3 мл жидкой питательной среды (для каждого вида микроорганизмов используется соответствующий тип питательной среды) при 37oC в течение 24-36 часов.
2) Во все пробы добавляют 0,1 мл хлороформа, перемешивают и инкубируют при комнатной температуре в течение 40-60 минут, периодически встряхивая.
3) Супернатант отделяют от бактериальных клеток центрифугированием в течение 20 минут при 3000 об/мин.
4) На забуференном физиологическом растворе (Sigma, P4417. Состав: 0.01М фосфатный буфер, 0.0027М KCl, 0.137М NaCl, pH 7,4 при 25oC) готовят раствор лактоферрина с концентрацией 2,5 мг/мл.
5) Супернатант исследуемых культур микроорганизмов объемом 0,8 мл смешивают с 0,1 мл приготовленного раствора лактоферрина.
6) Параллельно с опытными готовят 2 контрольные пробы:Контроль 1. К 0,1 мл лактоферрина добавляют 0,8 мл жидкой питательной среды. Контроль 2. К 0,1 мл забуференного физиологического раствора добавляют 0,8 мл жидкой питательной среды. 7) Инкубируют пробы в течение 2 часов при 37oC. 8) После инкубации в опытные и контрольные пробы добавляют по 0,1 мл взвеси тест-культуры M.luteus ГИСК N 211001. Для этого 16-18-часовую агаровую культуру M.luteus смывают забуференным физиологическим раствором и готовят взвесь с оптической плотностью 0,160 при длине волны 450 нм. Полученную взвесь разводят в 10000 раз. 9) Далее по 100 мкл опытной и контрольной проб инокулируют в лунки полистиролового планшета с 200 мкл питательного бульона. Планшет помещают в термостатируемый блок микробиологического анализатора iEMS-MF (Labsystems, Финляндия) и проводят первое измерение оптической плотности в опыте и контролях непосредственно по достижении режима термостатирования (37oC) и второе измерение через 18-24 часа инкубации (по достижении максимальной оптической плотности индикаторной культуры в соответствии с общепринятыми микробиологическими стандартами [14]), затем рассчитывают антилактоферриновую активность по формуле 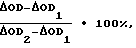 где  OD – изменение оптической плотности в опыте между 1 и 2 измерениями; OD – изменение оптической плотности в опыте между 1 и 2 измерениями; OD1 – изменение оптической плотности в контроле 1 между 1 и 2 измерениями; OD1 – изменение оптической плотности в контроле 1 между 1 и 2 измерениями; OD2 – изменение оптической плотности в контроле 2 между 1 и 2 измерениями.
Антилактоферриновая активность выражается в процентах (%) инактивации лактоферрина в опыте по сравнению с контролем.
Примеры конкретного выполнения способа.
Пример 1. У больной К. с диагнозом “острый мастит” был выделен в монокультуре Staphylococcus aureus. Однако отсутствие гемолитической активности, а также антилизоцимной, “антиинтерфероновой” и антикомплементарной активности поставило под сомнение этиологическую роль данного микроорганизма в развитии воспалительного процесса. Для решения вопроса об этиологической значимости выделенного микроорганизма у золотистого стафилококка была определена способность к инактивации лактоферрина. Наличие подобного свойства даже в отсутствие иных факторов персистенции определяет возможность этиологического агента длительно находиться в организме и инициировать воспалительный процесс.
Для достижения поставленной цели исследуемую культуру выращивали в мясопептонном бульоне при 37oC в течение 24 часов. В пробирки с выросшей культурой добавляли по 0,1 мл хлороформа, перемешивали и выдерживали в течение 40 минут. Супернатант отделяли от бактериальных клеток центрифугированием при 3000 об/мин в течение 20 минут. На забуференном физиологическом растворе готовили раствор лактоферрина с концентрацией 2,5 мг/мл. Супернатант исследуемой культуры объемом 0,8 мл смешивали с 0,1 мл приготовленного раствора лактоферрина. Параллельно готовили 2 контрольные пробы: а) контроль 1. К 0,1 мл лактоферрина в указанной выше концентрации добавляли 0,8 мл жидкой питательной среды. б) контроль 2. К 0,1 мл забуференного физиологического раствора добавляли 0,8 мл жидкой питательной среды. Все пробы инкубировали в течение 2 часов при 37oC. После инкубации в опытные и контрольные пробы добавляли по 0,1 мл взвеси тест-культуры M.luteus ГИСК N 211001. Для этого 16-18-часовую агаровую культуру M.luteus смывали забуференным физиологическим раствором и готовили взвесь с оптической плотностью 0,160 при длине волны 450 нм, полученную взвесь разводили в 10000 раз. Далее 100 мкл смеси инокулировали в лунки полистиролового планшета с 200 мкл питательного бульона. Планшет помещали в термостатируемый блок микробиологического анализатора iEMS-MF (Labsystems, Финляндия) и проводили первое измерение оптической плотности в опыте и контролях непосредственно по достижении режима термостатирования (37oC) и второе измерение через 18 часов инкубации, затем рассчитывали антилактоферриновую активность по формуле: OD2 – изменение оптической плотности в контроле 2 между 1 и 2 измерениями.
Антилактоферриновая активность выражается в процентах (%) инактивации лактоферрина в опыте по сравнению с контролем.
Примеры конкретного выполнения способа.
Пример 1. У больной К. с диагнозом “острый мастит” был выделен в монокультуре Staphylococcus aureus. Однако отсутствие гемолитической активности, а также антилизоцимной, “антиинтерфероновой” и антикомплементарной активности поставило под сомнение этиологическую роль данного микроорганизма в развитии воспалительного процесса. Для решения вопроса об этиологической значимости выделенного микроорганизма у золотистого стафилококка была определена способность к инактивации лактоферрина. Наличие подобного свойства даже в отсутствие иных факторов персистенции определяет возможность этиологического агента длительно находиться в организме и инициировать воспалительный процесс.
Для достижения поставленной цели исследуемую культуру выращивали в мясопептонном бульоне при 37oC в течение 24 часов. В пробирки с выросшей культурой добавляли по 0,1 мл хлороформа, перемешивали и выдерживали в течение 40 минут. Супернатант отделяли от бактериальных клеток центрифугированием при 3000 об/мин в течение 20 минут. На забуференном физиологическом растворе готовили раствор лактоферрина с концентрацией 2,5 мг/мл. Супернатант исследуемой культуры объемом 0,8 мл смешивали с 0,1 мл приготовленного раствора лактоферрина. Параллельно готовили 2 контрольные пробы: а) контроль 1. К 0,1 мл лактоферрина в указанной выше концентрации добавляли 0,8 мл жидкой питательной среды. б) контроль 2. К 0,1 мл забуференного физиологического раствора добавляли 0,8 мл жидкой питательной среды. Все пробы инкубировали в течение 2 часов при 37oC. После инкубации в опытные и контрольные пробы добавляли по 0,1 мл взвеси тест-культуры M.luteus ГИСК N 211001. Для этого 16-18-часовую агаровую культуру M.luteus смывали забуференным физиологическим раствором и готовили взвесь с оптической плотностью 0,160 при длине волны 450 нм, полученную взвесь разводили в 10000 раз. Далее 100 мкл смеси инокулировали в лунки полистиролового планшета с 200 мкл питательного бульона. Планшет помещали в термостатируемый блок микробиологического анализатора iEMS-MF (Labsystems, Финляндия) и проводили первое измерение оптической плотности в опыте и контролях непосредственно по достижении режима термостатирования (37oC) и второе измерение через 18 часов инкубации, затем рассчитывали антилактоферриновую активность по формуле: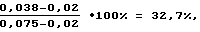 где 0,038 – изменение оптической плотности в опыте между 1 и 2 измерениями; 0,02 – изменение оптической плотности в контроле 1 между 1 и 2 измерениями; 0,075 – изменение оптической плотности в контроле 2 между 1 и 2 измерениями. Выявлено, что Staphylococcus aureus инактивировал 32,7% лактоферрина, т. е. его антилактоферриновая активность равна 32,7%. У штамма Staphylococcus aureus методом индикаторных дисков установлена чувствительность к гентамицину, бензилпенициллину, эритромицину, мономицину, рифампицину. Курс антибиотикотерапи с использованием мономицина по 1 млн.ЕД 2 раза в день не привел к элиминации возбудителя и не сопровождался положительной динамикой клинических симптомов. В связи с этим было изучено влияние субингибиторных концентраций названных антибиотиков на антилактоферриновую активность S. aureus. Установлено, что мономицин и бензилпенициллин не оказывают на нее выраженного действия (что, очевидно, объясняет неэффективность использования мономицина в данном случае); эритромицин и рифампицин снижают антилактоферриновую активность незначительно, а гентамицин оказывает выраженное ингибирующее влияние: штамм стафилококка, выращенный в контакте с суббактериостатической концентрацией гентамицина, утрачивал способность к инактивации лактоферрина. Проведение курса антибиотикотерапии с использованием гентамицина как препарата, снижающего антилактоферриновую активность возбудителя, привело к клиническому выздоровлению. Таким образом, выявление у S.aureus способности инактивировать лактоферрин позволило установить его этиологическую значимость, а изучение спектра чувствительности к антибиотикам и проведение целенаправленной антибиотикотерапии привело к элиминации возбудителя. Пример 2. При обследовании 52 сотрудников родильного отделения медико-санитарной части АО “Оренбурггазпром” на стафилококковое бактерионосительство было выделено 52 штамма стафилококков. Поскольку основную опасность представляют бактерионосители резидентного типа, возникла необходимость в их дифференциации. Для этого у всех штаммов была определена способность к инактивации лактоферрина. Определение антилактоферриновой активности микроорганизмов осуществлено согласно примеру 1. В результате у 12 штаммов была выявлена антилактоферриновая активность в пределах от 1,8 до 25,4%, тогда как другие штаммы не имели этого признака. Двукратное повторное обследование данных пациентов с интервалом 10 дней и последующее фаготипирование подтвердило идентичность выделенных штаммов и позволило отнести их к резидентным, тогда как у остальных пациентов произошло замещение одного вида стафилококка на другой. Санация резидентных бактерионосителей масляным раствором витамина А, снижающим антилактоферриновую активность стафилококков, оказалась положительной в 95% случаев, что явилось подтверждением значимости данного признака в развитии и поддержании стафилококкового бактерионосительства. Таким образом, использование предлагаемого способа позволяет выявить новое свойство микроорганизмов – антилактоферриновую активность, а как следствие, повысить точность диагностики и прогнозирования заболеваний микробной этиологии. Также заявляемый способ способствует выбору рациональной антибактериальной терапии, изучению механизмов персистенции микроорганизмов и формирования бактерионосительства. СПИСОК ЛИТЕРАТУРЫ 1. Бухарин О.В., Усвяцов Б.Я. Бактерионосительство (медико-экологический аспект).- Екатеринбург; УрО РАН, 1996, – 208 с. 3. RU 2120999 C1, МПК 6 С 12 Q 1/02, 1/04, 27.10.98. 4. RU 2126051 С1, МПК 6 С 12 Q 1/02, 10.02.99. 7. RU 2010860 С1, МПК 6 С 12 Q 1/02, 1/04, 15.04.94. 12. Каталог штаммов Всесоюзного музея патогенных бактерий. Вып. 1. – М., 1982. 13. Каталог фирмы “Sigma” (chemical company): Biochemicals organic compounds and diagnostic reagents. – 1996. – С. 222. 14. Справочник по микробиологическим и вирусологическим методам исследования. /М.О.Биргер.-М., 1992. – С.114. Формула изобретения
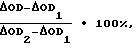 где  OD – изменение оптической плотности в опыте между 1 и 2 измерениями; OD – изменение оптической плотности в опыте между 1 и 2 измерениями; OD1 – изменение оптической плотности в контроле 1 между 1 и 2 измерениями; OD1 – изменение оптической плотности в контроле 1 между 1 и 2 измерениями; OD2 – изменение оптической плотности в контроле 2 между 1 и 2 измерениями. OD2 – изменение оптической плотности в контроле 2 между 1 и 2 измерениями.
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 17.08.2001
Номер и год публикации бюллетеня: 12-2003
Извещение опубликовано: 27.04.2003
|
||||||||||||||||||||||||||
