Патент на изобретение №2287275
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
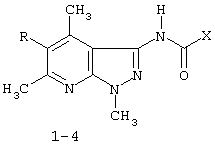
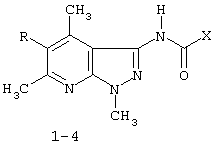
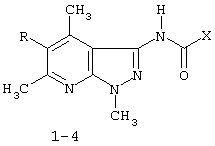
(54) ПРИМЕНЕНИЕ 3[(ЗАМЕЩЕННЫЙ ФЕНИЛ) КАРБОКСАМИДО]-1,4,6-ТРИМЕТИЛ-5-R ПИРАЗОЛО [4,5-b]ПИРИДИНОВ В КАЧЕСТВЕ АНТИДОТОВ 2,4-Д
(57) Реферат:
Описывается применение 3-[(замещенный фенил)карбоксамидо]-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинов формулы 1-4: 1 R=H, Х=4-метилфенил; 2 R=H, Х=2-метоксифенил; 3 R=Cl, X=2-метоксифенил; 4 R=Cl, X-этил в качестве антидота по отношению к 2,4-дихлорфеноксиуксусной кислоте на подсолнечнике. Технический результат – расширение ряда биологически активных веществ, полученных синтетическим путем, для их применения в сельском хозяйстве в качестве антидотов гербицида 2,4-Д. Это достигается обработкой 3-[(замещенный фенил)карбоксамидо]-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинами поврежденных гербицидом проростков подсолнечника. 1 табл.
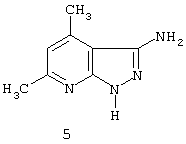
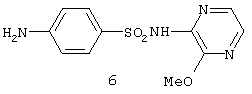
Изобретение относится к синтетическим, химическим биологически активным веществам из ряда гетероциклических соединений формулы 1-4: 1 – R=H, Х=4-метилфенил; 2 – R=H, Х=2-метоксифенил; 3 – R=Cl, Х=2-метоксифенил; 4 – R=Cl, Х=этил, в качестве средств защиты растений от фитотоксического действия гербицида 2,4-дихлорорфеноксиуксусной кислоты (антидотов). Заявляемые соединения известны ранее (Каталог Chemical Blok Stok Library, Cas Registry №728887-44-3, 10.08.2004; №728888-08-2, 10.08.2004; №727667-16-5, 10.08.2004 и №728887-48-7, 10.08.2004 соединения 1-4 соответственно),однако их антидотные свойства выявлены впервые. Как известно, подсолнечник является чрезвычайно чувствительной культурой к гербицидам группы 2,4-Д, и в случаях непреднамеренного попадания гербицида на его посевы потери могут составлять в зависимости от дозы до 100% [Д.И.Чкаников, М.С.Соколов. Гербицидное действие 2,4-Д и других галоидфеноксикислот. М.: Наука, 1973]. До сих пор защита вегетирующих растений подсолнечника от повреждающего действия 2,4-Д остается актуальной и нерешенной. К наиболее близким аналогам по структуре заявляемых соединений может быть отнесен 3-амино-4,6-диметил-1Н-пиразоло[4,5-b]-пиридин 5 [Lacan М., Tabakovic К. Syntesis of pirazolo-, and tetrazolopyridines. /Croat. cem. Acta/ 1975, 47, №2, s.127-133]. В качестве аналога по свойствам известен Сульфален [«Антидот гербицидов гормонального действия 2,4-дихлорфеноксиуксусной кислоты и 4-амино-3,5,6-трихлорпи-колиновой кислот» пат. РФ №2043021 от 10.09.95,заявка №5042089 от 14.05.92] 6 Сульфален формулы 6 используется в качестве средства снижения негативного действия гербицида 2,4-Д, он в дозе 200 г/га применяется по поврежденным вегетирующим растениям. В то же время Сульфален широко применяется в качестве антибактериального средства в медицинской практике, его синтез описан в литературе [В.Г.Беликов. Фармацевтическая химия. – М.: Высшая школа. 1985. с.383, 768.] Однако антидотная активность Сульфалена является недостаточно высокой. Задачей настоящего изобретения является расширение арсенала биологически активных веществ, полученных синтетическим путем, для применения их в сельском хозяйстве в качестве антидотов. Это достигается применением 3-[(замещенный фенил)-карбоксамидо]-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинов 1-4 на проростках подсолнечника. При этом заявляемые соединения получают известным методом – ацилированием 3-амино-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинов хлорангидридами ароматических и алифатических карбоновых кислот при температуре 10-12°С в среде безводного бензола в присутствии триэтиламина в качестве акцептора хлороводорода [см. Вейганд Хильгетаг.Методы эксперимента в органической химии. – М.: Химия. 1969. с.431]. Исходные 3-амино-1,4,6-триметил-5R-пиразоло[4,5-b]пиридины также получают известным методом [см. З.А.Бомика, М.Б.Андабурская, Ю.Э.Пелчер, Г.Я.Дубур. Некоторые реакции нуклеофильного замещения в ряду 2-хлор-3-цианопиридинов. – ХГС, 1976, №8, с.1085-1088]. Использованный бензол и ацетон абсолютируют известным способом [см.А.Вайсбергер, Э.Проскауэр, Дж.Риддик, Э.Тупс.Органические растворители. М.: Иностранная литература, 1958, с.518]. Изобретение иллюстрируется следующими примерами: Пример 1. 3[-(4-метилфенил)-карбоксамидо]-1,4,6-триметил-пиразоло[4,5-b]пиридин (соединение 1) К суспензии из 0,7 г (0,00370 моль) 3-амино-1,4,6-триметилпиразоло[4,5-b]-пиридина и 0,38 (0,00370 моль) триэтиламина в 20 мл абсолютного бензола прикапывают в течение 40-50 минут раствор 0,69 г(0,00440 моль) 4-метилбензоилхлорида в 10 мл абсолютного бензола, поддерживая температуру реакционной смеси в интервале 10-12°С. По окончании прибавления перемешивают при этой же температуре еще 10-20 минут, затем при комнатной температуре 3 часа. Из реакционной массы осадок отделяют фильтрованием, промывают его теплой водой (3×20 мл), сушат. Маточный раствор упаривают досуха, остаток обрабатывают 15 мл серного эфира, сушат. Оба осадка объединяют, перекристаллизовывают из этанола, получают 1,1 г (72%) целевого продукта 1 в виде белых кристаллов с т.пл. 236-237°С. Найдено, %: С 69,61; Н 6,27; N 18,54. C17H18N4O Вычислено, %: С 69,35; Н 6,18; N18,36. ПМР, Масс-спектр; m/z (относ. интенсивность): 294 М+(28); 134(3); 119(100); 104(5); 91(30); 65(12). Пример 2. 3-[(2-метоксифенил)-карбоксамидо]-1,4,6-триметил-пиразоло [4,5-b]пиридин (соединение 2) К суспензии из 0,6 г (0,00320 моль) 3-амино-1,4,6-триметилпиразоло[4,5-b]-пиридина и 0,32 (0,00320 моль) триэтиламина в 18 мл абсолютного бензола прикапывают в течение 40 минут раствор 0,52 г (0,00380 моль) 2-метоксибензоилхлорида в 10 мл абсолютного бензола, поддерживая температуру реакционной смеси в интервале 10-12°С. По окончании прибавления перемешивают при этой же температуре еще 10-20 минут, затем при комнатной температуре 2 часа. Реакционную массу отделяют от осадка (гидрохлорид триэтиламина), упаривают досуха, остаток обрабатывают 10 мл Et2O. После перекристаллизации из этилацетата получают 0,66 г (68%) целевого соединения 2, в виде белых кристаллов с т.пл. 158-159°С. Найдено %: С 65,51; Н 5,72; N 18.28; C17H18N4O; Вычислено, %: С 65,78; Н 5,86; N 18,05. ПМР, Масс-спектр, m/z (относ. интенсивность): 310 М+(16); 135(100); 104(4); 92(12); 77(22) Пример 3. 3-[(2-метоксифенил)-карбоксамидо]-1,4,6-триметил-5-хлорпиразоло[4,5-b]пиридин (соединение 3). К суспензии из 0,8 г (0,00380 моль) 3-амино-1,4,6-триметил-5-хлорпиразоло[4,5-b]-пиридина и 0,38 (0,00380 моль) триэтиламина в 25 мл абсолютного бензола прикапывают в течение 40-50 минут раствор 0,78 г (0,00456 моль) 2-метоксибензоилхлорида в 10 мл абсолютного бензола, поддерживая температуру реакционной смеси в интервале 10-12°С. По окончании прибавления перемешивают при этой же температуре еще 10-20 минут, затем при комнатной температуре 3 часа. Реакционную массу отделяют от осадка (гидрохлорид триэтиламина), упаривают досуха, остаток обрабатывают 10 мл Et2O. После перекристаллизации из этилацетата получают 0,84 г (64%) целевого соединения 3, в виде белых кристаллов с т.пл. 173-174°С. Найдено, %: С 59,44; Н 4,79; N 16.41; С17Н17ClN4О Вычислено, %: С 59,20; Н 4,98; N 16,25. ПМР, Масс-спектр, m/z (относ. интенсивность): 344 M+(7); 135(100); 92(11); 77(24). Пример 4. 3-(этилкарбоксамидо)-1,4,6-триметил-5-хлорпиразоло [4,5-b] пиридин (соединение 4) К суспензии из 0,8 г (0,00380 моль) 3-амино-1,4,6-триметил-5-хлорпиразоло[4,5-b]-пиридина и 0,38 (0,00380 моль) триэтиламина в 25 мл абсолютного бензола прикапывают в течение 40-50 минут раствор 0,33 г (0,0043 моль) пропионилхлорида в 10 мл абсолютного бензола, поддерживая температуру реакционной смеси в интервале 10-12°С. По окончании прибавления перемешивают при этой же температуре еще 10-20 минут, затем при комнатной температуре 3 часа. Реакционную массу отделяют от осадка (гидрохлорид триэтиламина), упаривают досуха, остаток обрабатывают 10 мл Et2O. После перекристаллизации из этанола получают 0,67 г (71%) целевого соединения 4, в виде белых кристаллов с т.пл. 194-195°С. Найдено, %: С 54,30; Н 5,52; N 21.18; С12Н15ClN4О Вычислено, %: С 54,03; Н 5,68; N 21,01. ПМР, Масс-спектр, m/z (относ. интенсивность): 266 М+(5); 210(35); 77(6); 44(100). Пример 5. 3-амино-1,4,6-триметилпиразоло[4,5-b]пиридин (соединение 5) Смесь 1,0 г (0,0061 моль) 2-хлор-3-циано 4,6-диметилпиридина, 1,22 г (0,0244 моль) гидразингидрата и 25 мл безводного этанола кипятят в течение 9 часов. После охлаждения реакционной массы осадок отфильтровывают, промывают на фильтре спиртом, перекристаллизовывают из метанола, получают 0,72 г (73%) целевого соединения 5 в виде кристаллов светло-желтого цвета с т.пл. 239-240°С Найдено %: С 59,39; Н 6,12; N 34,40; C8H10N4 Вычислено, %: С 59,22; Н 6,23; N 34,55. ПМР, Масс-спектр, m/z (относ. интенсивность): 162 М+(100); 133(24); 107(40); 105(32); 92(5); 84(12). Пример 6. Оценка соединений 1-6 на антидотную активность на проростках подсолнечника Проросшие семена подсолнечника с длиной зародышевого корешка 2-4 мм помещали на 1 ч в раствор 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) в концентрации 10-3% в расчете получения 40-60% ингибирования роста гипокотиля. После гербицидного воздействия проростки промывали водой и помещали в растворы испытываемых на антидотную активность веществ в концентрациях 10-2, 10-3, 10-4, 10-5 (вариант гербицид + антидот). Спустя 1 ч семена промывали водой и раскладывали на полосы фильтровальной бумаги (размер 10×75 см) по 20 штук, которые сворачивали в рулоны и помещали в стаканы с 50 мл воды. Дальнейшее проращивание семян проводили в термостате в течение 3 суток при температуре 28°С. Температура растворов и промывной воды 28°С. Семена варианта «гербицид» (эталон сравнения) выдерживали 1 ч в растворе 2,4-Д в концентрации 10-3 и 1 ч в воде. Семена контрольного варианта 2 часа выдерживали в воде. Повторность опыта трехкратная. В каждой повторности использовали по 20 штук семян. Защитный (антидотный) эффект определяли по увеличению длины гипокотиля и корня в варианте гербицид + антидот относительно названных величин в варианте «гербицид» (эталон). Статистическая обработка экспериментальных данных проведена с использованием t-критерия Стьюдента при Р=0,95. Результаты исследований приведены в таблице. Как видно из данных таблицы, применение на фоне воздействия гербицида предлагаемых в качестве антидотов 3-(замещенный фенилкарбоксамидо)-1,4,6-триметил-1-R-пиразоло[4,5-b]пиридинов 1-4 резко ослабляет токсическое действие гербицида. Соединения 1-4 снижали отрицательное действие 2,4-Д на гипокотиле проростков подсолнечника на 28-41% при использовании в основном в трех и более концентрациях, в то время как соединение 5 (аналог по структуре) защитного действия не проявлял, а величина антидотного эффекта Сульфалена (прототипа) составляла 12-20%. Соединения 1-4 снижали ингибирующее действие 2,4-Д на корни проростков на 29-55% также при использовании в трех и более концентрациях, соединение 5 не увеличивало длину корня проростков, а Сульфален (прототип) проявлял антидотный эффект на уровне 18-28%. Таким образом, применение заявляемых 3-(замещенный фенилкарбоксамидо)-1,4,6-триметил-1-R-пиразоло[4,5-b]пиридинов в качестве антидотов позволяет эффективно защитить подсолнечник от отрицательного воздействия 2,4-Д, а также расширить ассортимент известных антидотов.
Формула изобретения
Применение 3-[(замещенный фенил)карбоксамидо]-1,4,6-триметил-5-R-пиразоло[4,5-b]пиридинов формулы 1-4 где 1. R=H, Х=4-метилфенил; 2. R=H, Х=2-метоксифенил; 3. R=Cl, Х=2-метоксифенил; 4. R=Cl, X-этил, в качестве антидота по отношению к 2,4-дихлорфеноксиуксусной кислоте на подсолнечнике.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 24.06.2007
Извещение опубликовано: 27.01.2009 БИ: 03/2009
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 , м.д.(группа): 2,35 (3Н, с, СН3 Ph); 2,55 (3H, с, 4-СН3 Ру); 2,65 (3Н, с, 6-СН3 Ру); 3,98 (3Н, с, N-СН3); 6,88 (1Н, с, 5-Н Ру); 7,35…7,93 (4Н, м, СН-Ph); 10,45 (1H, c, N-H).
, м.д.(группа): 2,35 (3Н, с, СН3 Ph); 2,55 (3H, с, 4-СН3 Ру); 2,65 (3Н, с, 6-СН3 Ру); 3,98 (3Н, с, N-СН3); 6,88 (1Н, с, 5-Н Ру); 7,35…7,93 (4Н, м, СН-Ph); 10,45 (1H, c, N-H).