|
|
(21), (22) Заявка: 2004112593/15, 27.04.2004
(24) Дата начала отсчета срока действия патента:
27.04.2004
(43) Дата публикации заявки: 10.10.2005
(46) Опубликовано: 10.11.2006
(56) Список документов, цитированных в отчете о
поиске:
СанПин 2.1.4.116-02. RU 2001134665 А, 27.08.2003. RU 2001134666 А, 27.08.2003. RU 2171863 С2, 10.08.2001. RU 2140881 С1, 10.11.1999. DE 19825559 А1, 16.12.1999. DE 19847826 А1, 02.11.2000. US 6284293 В1, 04.09.2001.
Адрес для переписки:
350062, г.Краснодар, ул. Атарбекова, 22, кв.19, Е.Д. Зыкову
|
(72) Автор(ы):
Зыков Евгений Дмитриевич (RU),
Зыкова Тамара Николаевна (RU)
(73) Патентообладатель(и):
Зыков Евгений Дмитриевич (RU),
Зыкова Тамара Николаевна (RU)
|
(54) КОНДИЦИОНИРОВАННАЯ ПИТЬЕВАЯ ВОДА ВЫСШЕЙ КАТЕГОРИИ КАЧЕСТВА
(57) Реферат:
Изобретение относится к области химии водных растворов и водоподготовки. Кондиционированную питьевую воду высшей категории качества получают за счет пересыщения кислородом исходной питьевой воды. Синтезированные химотронной плазмой в парогазовой смеси Н2O2+О2 водно-кислородные комплексы позволяют при смешивании в нормальных условиях парогазовой смеси с исходной питьевой водой получить пересыщенную кислородом экологически чистую питьевую воду с концентрацией растворенного кислорода 10-40 мг О2/л Н2О. Экспериментально подтверждены аномальные физико-химические свойства пересыщенной кислородом парогазовой смеси питьевой воды, эффект повышения концентрации кислорода и длительное сохранение во времени пересыщенного кислородом состояния питьевой воды. Изобретение может быть использовано в пищевой промышленности, медицине, водных хозяйствах, а также в производстве бутилированных кислородосодержащих питьевых вод. Изобретение обеспечивает повышение качества питьевой воды, отвечающей требованиям СаНПиН 2.1.4.1116-02 Российской Федерации, по жизненно необходимым для организма человека нейтральным и активным формам кислорода и, кроме того, увеличение срока сохранности растворенного в кондиционированной питьевой воде кислорода. 7 ил., 5 табл.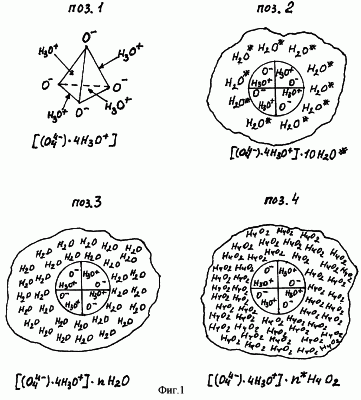
Глобальное по масштабам антропогенное загрязнение окружающей среды в XX веке привело к необратимым изменениям климата Земли и, как следствие, к ухудшению здоровья людей. Поэтому в развитых государствах, поддерживающих в своей политике высокий жизненный уровень населения, стратегической задачей в области здравоохранения XXI века является создание реальных производств жизнеобеспечения человека высококачественными экологически чистыми воздухом, водой и продуктами питания.
Изобретение относится к областям: физической химии водных растворов и водоподготовки, более конкретно – к питьевой воде, технике и технологиям ее кондиционирования.
Изобретение может быть использовано в питьевой промышленности для приготовления высококачественных: питьевой воды, напитков и соков, а также в рыбном, сельском и коммунальном хозяйствах – для улучшения, жизнедеятельности биосистем, использующих растворенные формы кислорода.
Конкретно, изобретение находится на стадии внедрения в промышленных производствах, выпускающих бутилированные кислородосодержащие питьевые воды с торговыми марками: “Супервода – O2“, “ОКСИ” и других, имеющих высокую категорию качества по растворенному кислороду и его активным формам, увеличенный срок сохранности во времени высоких концентраций растворенного в воде кислорода (не ниже 9 мг O2/л H2O при н.у.).
Критерии, по которым оценивалось качество кондиционированной питьевой воды в 1980-1990 годах были определены ГОСТ 2874-82 [1, 2].
В их состав входили [2, гл.5]:
– микробиологическая загрязненность;
– токсикологический показатель;
– органолептический показатель;
– радиационная безопасность;
– эпидемиологическая безопасность.
Показатели, по которым производился контроль качества питьевой воды [2, гл.5, с.494-512]:
1. Физические:
– температура;
– запах;
– вкус и привкус,
– прозрачность;
– взвешенные вещества;
– цветность.
2. Химические:
– окисляемость;
– минеральные азотосодержащие вещества;
– растворенные в воде газы (CO2, H2S, O2);
– сухой остаток (степень минерализации);
– общая жесткость;
– общая щелочность;
– кальций, магний, натрий, калий;
– микроэлементы (Mn, Pb, Cu, F и другие);
– сульфаты, хлориды, гидрокарбонаты;
– кремневая кислота;
– активная реакция среды (pH);
– коагулируемость, стабильность, хлорируемость.
3. Микробиологические:
– коли-индекс;
– общее микробное число;
– наличие гельминтов.
4. Радиологические:
– наличие “ ” и “ ” и “ ” активных веществ в воде. ” активных веществ в воде.
Каждый из приведенных выше показателей был исследован и определен количественно (см. [2, гл.5, с.494-512]).
Недостатки в качестве кондиционированной питьевой воды [1, 2] для потребителей:
– отсутствие критерия оценки “физиологическая полноценность питьевой воды”;
– неопределенность в значениях интервалов количественных показателей: “степень минерализации”, “общая щелочность”, “ионный состав жизненно важных элементов”;
– отсутствие количественного показателя, определяющего минимальное значение растворенного в воде кислорода для кондиционированной питьевой воды высшей категории качества;
– отсутствие показателей, определяющих растворимые в воде активные формы кислорода, водорода и их соединений;
– отсутствие показателей, определяющих сохранность высокого качества питьевой воды во времени.
Указанные выше недостатки частично были устранены в 1995-2000 г.г. в кислородонасыщенных бутилированных питьевых водах [3, 4].
В отличие от технического решения [1, 2], кондиционированная питьевая вода [3, 4] была предварительно опреснена и активирована электролизом с целью разрыхления ее жидкостной структуры. Затем опресненную разрыхленную питьевую воду кондиционировали кислородным газом под давлением с применением известных методов смешивания газа с жидкостью (эжекция, барботаж, абсорбция и другие). Насыщенную кислородом питьевую воду под давлением разливали в пластиковые или стеклянные бутыли и закупоривали герметично пробками. Для достижения высоких концентраций кислорода питьевая вода содержала количество солей на уровне их концентраций в дистиллированной воде.
Согласно данным исследования [3, 4] физиологическая полноценность бутилированной кислородонасыщенной питьевой воды заключалась в следующем:
1. Вода снимала усталость и утомляемость организма человека при повышенных нагрузках;
2. Вода улучшала работу систем водно-солевого баланса, кровообращения, дыхания, пищеварения;
3. Вода утоляла жажду при нагрузках и высоких температурах окружающей среды.
Основные недостатки в качестве кондиционированной кислородонасыщенной питьевой воды [3, 4]:
– низкое солесодержание;
– отсутствие экологической безопасности примененных физико – химических методов кондиционирования питьевой воды кислородом (воздействие на воду электрического поля, продуктов электролиза, продуктов электрохимической коррозии электродов и другие);
– падение концентрации растворенного в воде кислорода, как в герметичных, так и разгерметизированных емкостях во время хранения питьевой воды;
– отсутствие показателей, определяющих растворимые в воде активные формы кислорода, водорода и их соединений;
Наиболее близким аналогом заявленного технического решения является кондиционированная питьевая вода, критерии и параметры которой определены в 2002 году СаНПиН 2.1.4.1116-02 [5].
Параметры высококачественной питьевой воды [5] регламентируются как с точки зрения вкусовых характеристик, так и с точки зрения воздействия воды на организм человека (см. Методические указания МУ 2.1.4.1184-03).
В СаНПиН 2.1.4.1116-02 впервые введен критерий качества кондиционированной питьевой воды “физиологическая полноценность”, который определяет не отметку параметра “не более”, как в ГОСТ 2874-82, а интервал концентраций жизненно важного природного элемента или соединений, благоприятно воздействующих на организм человека.
Жизненно важным для организма человека при кондиционировании воды высокого питьевого качества определены:
| – общая минерализация |
100-1000 мг/л |
| – жесткость |
1,5-7,0 мг – экв /л |
| – щелочность |
0,5-6,5 мг – экв /л |
| – содержание ионов Na+ |
20-200 мг/л |
| – содержание ионов K+ |
2-20 мг/л |
| – удержание ионов Са2+ |
25-130 мг/л |
| – содержание ионов Mg2+ |
5-50 мг/л |
| – содержание ионов НСО3– |
30-400 мг/л |
| – содержание ионов F– |
0,5-1,5 мг/л |
| – содержание ионов I– |
0,01-0,125 мг/л |
| – pH |
6,5-8,5 |
| – растворенный в воде кислород: |
|
| I категории качества |
5 мг О2/л H2O при н.у. |
| Высшая категория качества |
9 мг O2/л H2O при н.у |
Кондиционированная питьевая вода [5] содержит минимальное (по отношению к известным техническим решениям) количество микроорганизмов и “ “, “ “, “ ” активных радионуклидов (включая радон). ” активных радионуклидов (включая радон).
Она разливается в стерилизованные бутыли, так же как кондиционированная питьевая вода [3, 4].
В отличие от технического решения [3, 4] кондиционированная питьевая вода [5] разливается в бутыли и герметизируется под атмосферным давлением, содержит от 100 до 1000 мг/л минеральных веществ, имеет сбалансированный ионный состав, pH, кислородно-газовый состав, благоприятно воздействующий на организм человека.
Концентрация растворенного кислорода в кондиционированной питьевой воде [5] высшей категории качества соответствует предельному насыщению воды кислородом воздуха – 9,0±0,1 мг O2/л H2O при 20°С и атмосферном давлении.
Основные недостатки в качестве кондиционированной питьевой воды [5]:
– низкое качество по активным формам кислорода, водорода и их соединений и, как следствие, невозможность получения при нормальных условиях перенасыщенного кислородом состояния питьевой воды;
– невозможность сохранения во времени для бутилированной питьевой воды высшей категории качества параметра “растворенный в воде кислород с концентрацией 9 мг O2/л H2O” при нормальных условиях розлива и хранения воды;
– отсутствие показателей определяющих растворенные в кондиционированной питьевой воде активные формы кислорода, водорода и их соединений.
Целью поставленной заявки технической задачи является:
– повышение качества кондиционированной питьевой воды, отвечающей требованиям СаНПиН 2.1.4.1116-02, по жизненно необходимым для организма человека нейтральным и активным (энергообогащенным) формам кислорода, водорода и их соединений;
– увеличение срока сохранности концентрации растворенного в бутилированной питьевой воде кислорода, отвечающей высшей категории качества (не ниже 9 мг O2/л H2O при н.у.).
Решение поставленной в заявке технической задачи достигается за счет синтезированных химотронной плазмой в кислородосодержащей парогазовой смеси H2O2+O2 водно-кислородных комплексов [(O4 4-)·4H3O+]·nH2O, позволяющих при смешивании в нормальных условиях парогазовой смеси с исходной питьевой водой получить пересыщенную кислородом экологически чистую для организма человека питьевую воду высшей категории качества.
Возможность использования химотронной плазмы и кислородосодержащей парогазовой смеси H2O2+O2 [6] для достижения технического результата поставленной выше задачи основывается на теории биполярного плазменного электрода [6, 7]. Проведенное нами дальнейшее развитие теории [6, 7] показывает, что при потенциалах в плазмохимотроне от 140 до 220 В в химотронной плазме возможно образование активированных плазмой комплексных газожидкостных соединений кислорода, водорода и воды, которые должны быть устойчивы вне плазмы. Их построение определяет физико-химическая реакция биполярных кластерных комплексов, формирующих химотронную плазму (см. уравнение 7 патента [6]) с растворенным в водном растворе электролитом, активированным плазмой кислородным газом.
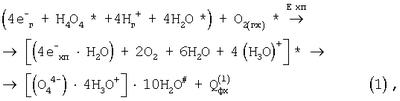
где: 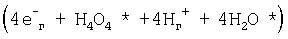 – биполярный кластерный комплекс химотронной плазмы [6]; – биполярный кластерный комплекс химотронной плазмы [6];
O2 (гж)* – растворенный в водном растворе электролита кислородный газ;
Нг + (H+·H2O) (H+·H2O) (H3O)+ – гидратированный протон (ион гидроксония); (H3O)+ – гидратированный протон (ион гидроксония);
е– г (е– хп·H2O) – гидратированный электрон; (е– хп·H2O) – гидратированный электрон;
Е хп и Qфх – соответственно энергия химотронной плазмы и энергия физико-химической реакции, определенная уравнением (1);
индексы (*) и (#) – относятся к активированному химотронной плазмой веществу соответственно в пленке (слое) плазмы и выходящего из пленки химотронной плазмы в парогазовую смесь H2O2+O2.
Водно-кислородный комплекс [(O4 4-)·4H3O+]·10Н2O#, сформированный неоднородным электрическим полем в пленке химотронной плазмы, равновероятно выделяется из химотронной плазмы как в парогазовую смесь H2O2+O2, так и в кислородонасыщенный водный раствор электролита, циркулирующий в плазмохимотроне.
Анализ уравнения (1) показывает, что кислородосодержащее ядро газожидкостного комплекса должно образовываться в химотронной плазме при физико-химическом взаимодействии четырех атомов кислородосодержащего газа, насыщенного электронами плазмы:
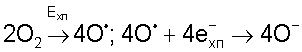
Насыщенные электронами четыре атома кислорода (4O–) способны формировать дополнительные химические связи и образовывать в плазме объемное атомно-молекулярное соединение, имеющее структурную формулу O4 4- (см. фиг.1, поз.1).
Силами атомно-молекулярного взаимодействия четыре иона гидроксония связаны как с ядром комплекса, так и с десятью молекулами активированной химотронной плазмой химически чистой воды (10 H2O#). Они образуют вокруг ядра комплекса предельно энергонасыщенную водно-гидратную оболочку (см. фиг.1, поз.2).
Водно-гидратная оболочка определяет устойчивость ядра биполярного газожидкостного комплекса [(O4 4-)·4H3O+] в окружающей среде (в химотронной плазме, парогазовой смеси и водных растворах электролитов).
Фигурой 1 (поз.2, поз.3, поз.4) схематично представлено построение устойчивых водно-гидратных оболочек биполярных газожидкостных комплексов соответственно в пленке химотронной плазмы, парогазовой смеси H2O2+O2 [6] и в жидкой питьевой воде.
Поскольку энергия активированного состояния компонентов газожидкостного комплекса [(O4 4-)·4H3O+]·10H2O# известна и равна соответственно:
 (2O2-4O·)=2·5,12 эВ=10,24 эВ [8, с.37]; (2O2-4O·)=2·5,12 эВ=10,24 эВ [8, с.37];
 (4H3O+)=4·4,77 эВ=19,08 эВ [9, с.56]; (4H3O+)=4·4,77 эВ=19,08 эВ [9, с.56];
 (4е– хп) (4е– хп)  (4Н+ г) (4Н+ г)  (HO2 (HO2 Н++O2 –) Н++O2 –) 4·11,5 эВ=46,0 эВ [9, с.56; 10, 4·11,5 эВ=46,0 эВ [9, с.56; 10,
табл. ионизации HO2],
то дополнительная энергия, переданная химотронной плазмой молекулам химически чистой воды может быть определена количественно двумя независимыми методами:
1. Спектроскопическим (из условия спонтанного появления и устойчивого существования в кислородонасыщенном водном растворе электролита, циркулирующего в плазмотроне, химотронной плазмы):
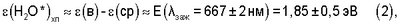 где где  (в) и (в) и  (cp) – соответственно энергия активации водородосодержащего катодного газа и кислородонасыщенного водного раствора электролита, циркулирующего в плазмохимотроне, необходимые для зажигания и устойчивого существования на межфазной границе “газ – жидкость” химотронной плазмы; (cp) – соответственно энергия активации водородосодержащего катодного газа и кислородонасыщенного водного раствора электролита, циркулирующего в плазмохимотроне, необходимые для зажигания и устойчивого существования на межфазной границе “газ – жидкость” химотронной плазмы;
Е( заж=667±2 нм) – энергия квантов монохроматического розового света, излучаемого химотронной плазмой, при ее спонтанном появлении на межфазной границе: водородсодержащий катодный газ – кислородонасыщенный раствор электролита. заж=667±2 нм) – энергия квантов монохроматического розового света, излучаемого химотронной плазмой, при ее спонтанном появлении на межфазной границе: водородсодержащий катодный газ – кислородонасыщенный раствор электролита.
2. Расчетным (на основе структурной формулы газожидкостного комплекса [(O4 4-)·4H3O+]·10 H2O# выходящего из пленки химотронной плазмы (см. фиг.1, поз.2):
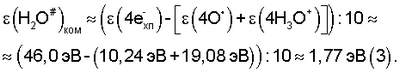
Результаты значений  в уравнениях (2), (3) позволяют с точностью ±5% оценить энергию водной гидратной оболочки газожидкостного комплекса или, иными словами, энергию гидратации ядра комплексного кислородосодержащего соединения [(O4 4-)·4H3O+]: в уравнениях (2), (3) позволяют с точностью ±5% оценить энергию водной гидратной оболочки газожидкостного комплекса или, иными словами, энергию гидратации ядра комплексного кислородосодержащего соединения [(O4 4-)·4H3O+]:
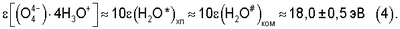
Энергия гидратации ядра комплексного кислородосодержащего соединения [(O4 4-)·4H3O+] соответствует энергии гидратации двухзарядных ионов Са2+, Cu2+, Mg2+, Mn2+, Fe2+ и других, определяющих энергообменные процессы в живых клетках.
Данные об энергии гидратации биполярного водно-кислородного комплекса [(O4 4-)·4H3O+]·10H2O# и об энергии водяного пара в критической точке воды (Р=225 атм, t=373°С,  конд= конд= пара=0,323 г/см 3, см. фиг.1, поз.3) позволяют с точностью ±3% определить количество активированных (энергообогащенных) ядром комплекса [(O4 4-)·4H3O+] молекул воды в парогазовой смеси H2O2+O2 (см. фиг.1, поз.3) в критической “газожидкостной” для паров воды точке: пара=0,323 г/см 3, см. фиг.1, поз.3) позволяют с точностью ±3% определить количество активированных (энергообогащенных) ядром комплекса [(O4 4-)·4H3O+] молекул воды в парогазовой смеси H2O2+O2 (см. фиг.1, поз.3) в критической “газожидкостной” для паров воды точке:
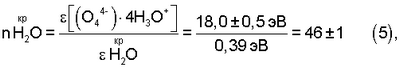
где: 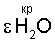 – энергосодержание (удельная энтальпия) 1 моля паров – энергосодержание (удельная энтальпия) 1 моля паров
(конденсата) воды в критической точке воды, равное:
2100 кДж/моль; 55,56 моль/кг=37,8 кДж/моль (0,39 эВ).
Определенный выше состав биполярного газожидкостного ядра водно-кислородного комплекса, данные о плотности водяного пара [11, с.523-524] позволяют также определить предельную концентрацию активного кислорода водно-кислородных комплексов в парогдзовой смеси H2O2+O2 в критической точке воды:
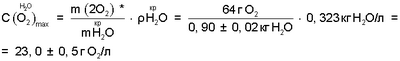
где: 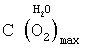 и и 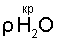 – соответственно максимально возможная концентрация кислорода водно-кислородных комплексов в парогазовой смеси и плотность водяного пара в критической точке воды, равная плотности конденсата; – соответственно максимально возможная концентрация кислорода водно-кислородных комплексов в парогазовой смеси и плотность водяного пара в критической точке воды, равная плотности конденсата;
m(2O2)*=m(4O·)=64 г O2;
m(4Н·)=4 г; 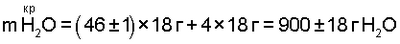
Рассчитанное по данным [11, с.523-524] значение  H2O во всем диапазоне температуры и давления водяного пара показывает, что H2O во всем диапазоне температуры и давления водяного пара показывает, что
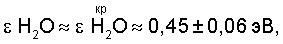 а значение а значение  H2O=Var. Иными словами, предельный размер и вес в парогазовой смеси H2O2+O2 газожидкостных микрокапель пара, содержащих активный кислород и водород, с точностью, не превышающей ±15%, можно определить, используя формулу расчета предельно кислородонасыщенных водно-кислородных комплексов [(O4 4-)·4H3O+]·46 H2O в критической “газожидкостной” точке воды. H2O=Var. Иными словами, предельный размер и вес в парогазовой смеси H2O2+O2 газожидкостных микрокапель пара, содержащих активный кислород и водород, с точностью, не превышающей ±15%, можно определить, используя формулу расчета предельно кислородонасыщенных водно-кислородных комплексов [(O4 4-)·4H3O+]·46 H2O в критической “газожидкостной” точке воды.
На основании сказанного следует, что в интервале температур парогазовой смеси H2O2+O2 от 70°С до 98°С, с учетом, что 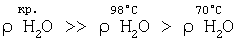 , концентрация активного кислорода водно-кислородных комплексов в парогазовой смеси равна: , концентрация активного кислорода водно-кислородных комплексов в парогазовой смеси равна:
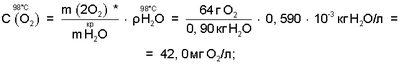
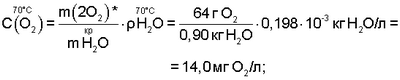
где: 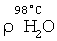 и и 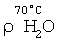 – соответственно плотность пара при t=98°С и t=70°С [11, с.523-524]. – соответственно плотность пара при t=98°С и t=70°С [11, с.523-524].
Температура парогазовой смеси H2O2+O2 98°С, равная температуре кипения водного раствора электролита в плазмохимотроне при атмосферном давлении, является предельной. Она ниже на 2°С температуры кипения чистой воды и является также предельной температурой парогазожидкостной смеси, выходящей из плазмохимотрона, при нормальных условиях.
Температура парогазовой смеси 70°±10°С (С(O2) 20±10 мг O2/л) является наиболее экологически безопасной, т.к. обеспечивает минимальный унос паров щелочи (кислоты) из подщелоченной или подкисленной воды плазмохимотронного парогазового блока системы кондиционирования питьевой воды нейтральными и активными формами кислорода и водорода. 20±10 мг O2/л) является наиболее экологически безопасной, т.к. обеспечивает минимальный унос паров щелочи (кислоты) из подщелоченной или подкисленной воды плазмохимотронного парогазового блока системы кондиционирования питьевой воды нейтральными и активными формами кислорода и водорода.
Для водных растворов электролитов на основании экспериментальных данных об энергии реакции синтеза молекул жидкой воды (Н4O2) из анионов (ОН–) и катионов (H3O+) сильных оснований и сильных кислот:
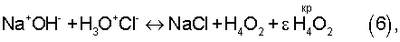
в критической точке ионно-нейтрального состояния жидкой воды:
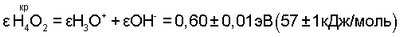
Адекватное значение 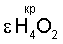 получено при рассмотрении физико-химического процесса синтеза ассоциированной молекулы жидкой воды из двух молекул водяного пара: получено при рассмотрении физико-химического процесса синтеза ассоциированной молекулы жидкой воды из двух молекул водяного пара:
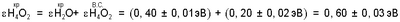
где: 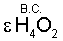 – энергия водородной связи ассоциированных молекул жидкой воды, обусловленная взаимодействием межмолекулярных сил Ван-дер-Ваальса [12, с.104]. – энергия водородной связи ассоциированных молекул жидкой воды, обусловленная взаимодействием межмолекулярных сил Ван-дер-Ваальса [12, с.104].
На основании уравнения (6) значение для биполярных газожидкостных ядер в водных растворах электролитов (см. фиг.1, поз.4) определяется величиной:
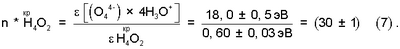
Из анализа уравнений (5) и (7) следует, что растворимость газожидкостных водно-кислородных комплексов в водных растворах электролитов увеличивается по отношению к парогазовой смеси:
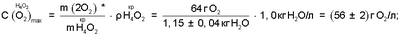
где: 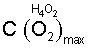 – максимально возможная концентрация активного кислорода водно-кислородных комплексов в водных растворах электролитов, – максимально возможная концентрация активного кислорода водно-кислородных комплексов в водных растворах электролитов,
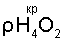 – плотность жидкой воды – плотность жидкой воды 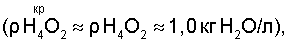
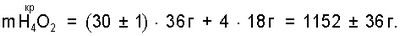
В отличие от парогазовой смеси H2O2+O2, для водного раствора
электролита 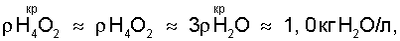 а значение а значение  Н4O2=Var. В этих условиях газожидкостное ядро водно-кислородного комплекса взаимодействует с молекулами воды на ионно-молекулярном уровне за счет сил электромагнитного поля спонтанно возникающего между биполярно заряженным ядром [(O4 4-)·4H3O+] комплекса и диполями ассоциированных молекул жидкой воды [12, с.104]. Н4O2=Var. В этих условиях газожидкостное ядро водно-кислородного комплекса взаимодействует с молекулами воды на ионно-молекулярном уровне за счет сил электромагнитного поля спонтанно возникающего между биполярно заряженным ядром [(O4 4-)·4H3O+] комплекса и диполями ассоциированных молекул жидкой воды [12, с.104].
Водную оболочку ядра [(O4 4-)·4H3O+] в водном растворе электролита можно представить как “водный домен” активированных через магнитную составляющую электромагнитного поля ядра комплекса ассоциированных молекул жидкой воды, граница которого в объеме водного раствора электролита ограничена минимальной энергией диполь-дипольного взаимодействия сил Ван-дер-Ваальса между молекулами воды [12, с.318].
На основании сказанного выше, n* Н4O2 (см. фиг.1, поз.4) и, как следствие, концентрация кислорода водно-кислородных комплексов в водном растворе электролита, 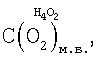 оцениваются значениями: оцениваются значениями:
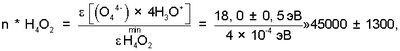
где:  – минимальная энергия межмолекулярного взаимодействия сил Ван-дер-Ваальса [12, с.318]. – минимальная энергия межмолекулярного взаимодействия сил Ван-дер-Ваальса [12, с.318].
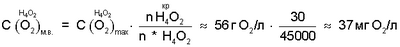
Так как 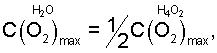 n* Н4O245000, рассчитанная через n* Н4O245000, рассчитанная через 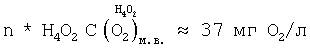 , то для интервала температур парогазовой смеси H2O2+O2 70°±10°С, примененном в заявленном техническом решении, значение n H2O для водно-кислородных комплексов [(O4 4-)·4H3O+]·nH2O оценивается величиной 40000±20000. , то для интервала температур парогазовой смеси H2O2+O2 70°±10°С, примененном в заявленном техническом решении, значение n H2O для водно-кислородных комплексов [(O4 4-)·4H3O+]·nH2O оценивается величиной 40000±20000.
n H2O=40000±20000 соответствует 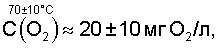 определяющую уровень пересыщения питьевой воды кислородом парогазовой смеси H2O2+O2 при их смешивании равный 20±10 мг O2/л. определяющую уровень пересыщения питьевой воды кислородом парогазовой смеси H2O2+O2 при их смешивании равный 20±10 мг O2/л.
Помимо биполярных ядер [(O4 4-)·4H3O+] в химотронной плазме при энергетических потенциалах в плазмохимотроне, превышающих 2Е °=112,5 эВ возможен также синтез таутомерных водно-кислородных комплексов “Супервода – O2” 2(Н10O8)* [7, 13], содержащих как активный кислород (O4)*, так и активный водород (4Н·)#, находящийся в предельном энергонасыщенном ионно-атомном (таутомерном) состоянии: °=112,5 эВ возможен также синтез таутомерных водно-кислородных комплексов “Супервода – O2” 2(Н10O8)* [7, 13], содержащих как активный кислород (O4)*, так и активный водород (4Н·)#, находящийся в предельном энергонасыщенном ионно-атомном (таутомерном) состоянии:
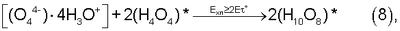
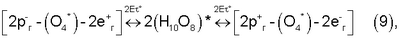
где: Е °=1,3601·10-18 Дж (56,25 эВ) и V °=1,3601·10-18 Дж (56,25 эВ) и V °=1,3601·10 16 Гц – °=1,3601·10 16 Гц –
фундаментальные постоянные нулевого квантово-механического уровня [(n=±1; 0; 1); 0; (n*=1; 0; ±1)] построения вещества и среды [13];
(Н4O4)* – кластерный пероксид водорода, синтезированный
в химотронной плазме [6],
2(Н10O8)* [2(Н4O4)*-(4Н·)#-2(O4Н4)*], [2(Н4O4)*-(4Н·)#-2(O4Н4)*],
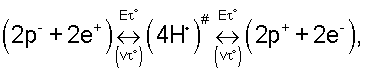
(4H·)# – ионно-атомный (таутомерный) водород формирующий ядро таутомерного комплекса 2(Н10O8)*,
е– – электрон, e+ – позитрон, p+ – протон, р– – антипротон,
е– г и е+ г – соответственно гидратированные электрон и позитрон;
р+ г и р– г – соответственно гидратированные протон и антипротон.
Так же как пероксид водорода (H2O2) является окисленной кислородом, энергообогащенной формой воды (H2O), таутомерный газожидкостной комплекс “Супервода – O2” 2(Н10O8)* является окисленной кислородом и энергообогащенной химотронной плазмой формой газожидкостного ядра кластерной кислородопересыщенной воды [(O4 4-)·4H3O+]·nH2O.
В отличие от известных таутомеров [14, с.51] предельно энергонасыщенное таутомерное вещество 2(Н10O8)* имеет физико-химическое соединение его элементов с одной и той же мерой энергии, у массы и величины заряда, состоящие из частиц вещества и антивещества (см. уравнение 9)
При времени контакта антивещества с веществом соизмеримым (или меньшим) времени пребывания элементарных частиц (е–, е+, р+, р–) на нулевом квантово-механическом уровне (  1/V 1/V ° ° 7,4·10-17 секунды) аннигиляция антивещества в веществе не происходит. 7,4·10-17 секунды) аннигиляция антивещества в веществе не происходит.
Теория гидролиза таутомерных комплексов 2(Н10O8)* в водных растворах электролитов отсутствует. Можно предположить, что наиболее вероятен механизм гидролиза 2(Н10O8)* в присутствии многозарядных ионов Si4+, С4+ и других с энергией гидратации соизмеримой с Е °: °:
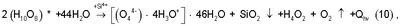
где: Qhv 4,5 эВ – энергия излучения при распаде кластерного пероксида водорода (Н4O4) 4,5 эВ – энергия излучения при распаде кластерного пероксида водорода (Н4O4) (Н4O2+O2 (Н4O2+O2 +Qhv) в водном растворе электролита (см. патент [6]). +Qhv) в водном растворе электролита (см. патент [6]).
Теория расчета концентрации активных форм кислорода и водорода, кластерного пероксида водорода H4O4, входящей в состав водно-кислородных комплексов [(O4 4-)·4H3O+]·nH2O, отсутствует. Поэтому диапазон концентраций активных форм кислорода и водорода (Н4O4)* в пересыщенной кислородом питьевой воде можно определить только экспериментально с применением методов анализа фотохимических или биофотохимических реакций взаимодействия комплексов с ионными компонентами водного раствора электролита (питьевой воды).
Из анализа рассмотренных выше теорий следует, что при смешивании парогазовой смеси [6], содержащей водно-кислородные комплексы, с кондиционированной питьевой водой должно происходить пересыщение питьевой воды растворимым кислородом по отношению к типовым методам насыщения ( на 10÷40 мг O2/л H2O) и появление аномальных физико – химических свойств в кондиционируемой питьевой воде.
Для экспериментального подтверждения предсказанных теорией аномальных физико-химических свойств парогазовой смеси [6], используемой в заявленном техническом решении, нами была разработана документация и создана опытно-промышленная установка, принципиальная схема которой представлена фигурой 2.
Установка состояла из двух систем: “Системы очистки и обеззараживания артезианской воды до уровня отвечающего питьевой воде СаНПиН 2.1.4.1116-02” и “Система кондиционирования очищенной и обеззараженной артезианской воды кислородосодержащими смесями”, взаимосвязанных гидравлическим трубопроводом с очищенной и обеззараженной артезианской воды -2- (см. фиг.2).
Типовая система очистки и обеззараживания артезианской воды включала:
трубопровод подачи артезианской воды -1-; теплообменник поз.1, фильтр грубой очистки поз.2; фильтр тонкой очистки поз.3; аппарат ультрафиолетового обеззараживания воды поз.4; трубопровод очищенной и обеззараженной воды -2-; шаровый кран с наконечником поз.5; приемную, сменную емкость E1 поз.6 с крышкой для герметизации емкости поз.7; приборы контроля (при фиксированной температуре, t) концентрации растворенного в воде кислорода (С О2) и pH воды поз.8.
Соответствие качества очистки и обеззараживания артезианской воды требованиям питьевой воды СаНПиН 2.1.4.1116-02 было подтверждено полным химическим анализом питьевой воды, проведенным Центром испытаний питьевой воды г.Краснодара,
Опытно – промышленная система кондиционирования питьевой воды кислородосодержащими смесями (кислородным газом) состояла из жидкостного и газового (парогазового) блоков взаимосвязанных в технологической схеме установки узлом эжекторов из поз.16 (см. фиг.2), в котором происходило смешивание кислородсодержащей газовой (парогазовой) смеси с кондиционируемой питьевой водой.
Жидкостной блок системы включал: регулятор расхода кондиционируемой питьевой воды поз.9; трубопровод подачи кондиционируемой питьевой воды -2- в циркуляционно – проточный гидравлический контур, образованный трубопроводом -3-; химостойкой емкостью Ео поз.10; химостойким насосом поз.12; теплообменником поз.14; датчиком расхода поз.15; узлом эжекторов поз.16; шаровым краном с наконечником поз.18;. сменную емкость E1* поз.19 с крышкой для герметизации поз.7; приборы контроля концентрации растворенного в воде кислорода и pH воды (лабораторные кислородомер АЖА – 101 и pH – метр pH – 420) поз.8.
Емкость Ео, входящая в состав гидравлического контура жидкостного блока системы (см. фиг.2) дополнительно была оснащена в верхней части:
трубопроводом -4- для вывода отработанного кислородсодержащего газа (парогазовой смеси H2O2+O2) из емкости Ео в атмосферу, трубопровод -5- с шаровым краном поз.20 для ввода жидкого реагента (использовался для исследования влияния на процесс кондиционирования питьевой воды кислородом водного раствора H2O2); в нижней части: трубопроводом -6-, соединяющим датчик уровня (объема) питьевой воды поз.21 с порционно – проточным датчиком кислорода поз.22, подсоединенного к промышленному прибору АЖА – 101 М (порционную подачу воды через датчик поз.22 обеспечивал клапан поз.23).
Газовый (парогазовый) блок системы кондиционирования питьевой воды включал: узел подготовки кислородосодержащего газа поз.24 (в состав узла входили типовые: воздуходувка, фильтр и озонатор воздуха, баллон сжатого кислородного газа с редуктором, вентиль регулировки расхода газа с ротаметром, на фиг.2 не показаны); трубопровод подачи кислородосодержащего газа -7-, соединенный с трехходовым краном поз.26; узел подготовки парогазовой смеси [6] поз.25 (в состав плазмохимотронного узла входили: емкость с водным раствором электролита, датчик уровня (объема) раствора электролита в емкости, вентиль, регулирующий расход электролита в плазмохимотронном аппарате, жидкостной ротаметр, баллон сжатого кислородного газа с редуктором, вентиль регулировки расхода газа с ротаметром, плазмохимотронный аппарат с пультом управления, парогазожидкостной сепаратор, на фиг.2 не показаны); трубопровод подачи парогазовой смеси -8-, соединенный с трехходовым краном поз.26; трубопровод – 7, 8 – соединяющий узел эжекторов поз.16 циркуляционно-проточного гидравлического контура системы с трехходовым краном поз.26, шаровой кран поз.27, датчик давления в газовом (парогазовом) трубопроводе поз.28 (мановакуометр), датчик температуры в газовом (парогазовом) трубопроводе поз.29 (с исполнительным цифровым показывающим прибором), индикатор расхода газовой (парогазовой) смеси поз.30, шаровый кран поз.31 трубопровод -9- с шаровым краном поз.32, соединяющий газовый (парогазовый) трубопровод -7, 8- с атмосферой.
Исследование процесса кондиционирования питьевой воды на опытно-промышленной установке и экспериментальную проверку физико-химический свойств парогазовой смеси H2O2+O2 [6] проводили в следующей последовательности:
1. Заполняли в течение 5-6 минут емкость Ео в количестве V H2O=200±4 литра питьевой воды из трубопровода -2-, открыв регулятор расхода поз.9.
2. Предварительно выставляли:
– расход кондиционируемой воды в циркуляционно-проточном гидравлическом контуре жидкостного блока химостойким насосом поз.12 и регулирующими вентилями поз.11, поз.13, поз.17 на уровне G H2O=1500±30 л/час (давление питьевой воды в напорной части контура Р H2O=15,0±0,15 м вод. столба);
– разряжение в смесительной камере эжекторов поз.16 на уровне  Р H2O=0,90±0,15 м вод. столба при давлении питьевой воды в напорной части контура 15,0±0,15 м вод. столба. Р H2O=0,90±0,15 м вод. столба при давлении питьевой воды в напорной части контура 15,0±0,15 м вод. столба.
3. Включали систему кондиционирования питьевой воды опытно-промышленной установки (в следующей последовательности)
– газовый блок с заданным расходом кислородосодержащей газовой (парогазовой) смеси при закрытом шаровом кране поз.31 и открытом кране поз.32 (без подачи газа в жидкостной блок);
– жидкостной блок с расходом кондиционируемой питьевой воды в трубопроводе -3- циркуляционно-проточного гидравлического контура 1500±30 л/час;
– после включения жидкостного блока с интервалом времени не более 5-10 секунд открывали кран поз.31 и закрывали кран поз.32 (см. фиг.2), направляя поток кислородосодержащей газовой (парогазовой) смеси в узел эжекторов поз.16, где происходило смешивание газовой (парогазовой) смеси с кондиционируемой питьевой водой.
4. Снимали экспериментальные данные:
– насыщения кондиционируемой питьевой воды в циркуляционно-проточном гидравлическом контуре установки кислородом (включая формы кислорода и водорода активированные химотронной плазмой);
– по физико-химическим свойствам кондиционированной питьевой воды и исходной (контрольной), разлитых в опытно-промышленной установке в бутыли E1* и E1 через краны поз.18 и поз.5 трубопроводов -3- и -2- и загерметизированных пробками поз.7.
С учетом времени, затраченного на получение и розлив экспериментальной партии кондиционированной и исходной питьевой воды, не превышающего 50±10 минут, точность определения данных, снятых на установке, составила:
 pH H2O=±0,25 ед; pH H2O=±0,25 ед;  C O2=±0, 5 мг O2/л H2O; C O2=±0, 5 мг O2/л H2O;  G H2O=±2%; G H2O=±2%;  t H2O=±1°С (поддерживали включением теплообменников поз.1 и поз.14 см. фиг.2); t H2O=±1°С (поддерживали включением теплообменников поз.1 и поз.14 см. фиг.2);
 G газа =±6%; G газа =±6%;  t газа =±3%; (где t газа =±3%; (где  G – изменение в показаниях, расхода, G – изменение в показаниях, расхода,  t газа – изменения в показаниях температуры). t газа – изменения в показаниях температуры).
На основании данных [2, 9, 15] максимально возможный уровень насыщения дистиллированной воды растворенным кислородом, полученный с применением типовых методов смешивания газа с жидкостью, известен и зависит непосредственно от парциального давления свободного кислорода (Ро2) в кислородосодержащей газовой смеси [15, с.154, см. законы Генри-Дальтона].
Для воздуха при нормальных условиях (20°С и атмосферном давлении) – 9,0±0,1 мг O2/л H2O, для кислородного газа 44±1 мг O2/л H2O.
Для парогазовой смеси H2O2+O2 [6] такие данные отсутствуют.
Поэтому нами были проведены при нормальных условиях (атмосферном давлении и температуре 21±1°С) комплексные исследования процессов насыщения питьевой воды с фиксированным содержанием растворенного кислорода (С O2=2,0±0,5 мг O2/л H2O) кислородосодержащими газовыми (парогазовыми) смесями:
1. Воздух (содержание кислорода Р O2 21 объемных %); 21 объемных %);
2. Смесь (воздух + озон, Р О2=21%, С О3 20-30 мг О3/ л-воздуха): 20-30 мг О3/ л-воздуха):
3. Смесь (воздух + кислородный газ, Р O2 40%); 40%);
4. Смесь (воздух + кислородный газ, Р O2 60%); 60%);
5. Кислородный газ (Р O2 100%); 100%);
6. Парогазовая смесь [6] 1: 1 (получена при температуре 75±5°С и соотношении массового расхода кислородного газа к расходу химически чистой воды раствора электролита, циркулирующего в плазмохимотронном узле установки фиг.2, равным 1:1);
7. Парогазовая смесь [6] 2:1 (получена при температуре 65±5°С и соотношении массового расхода кислородного газа к расходу химически чистой воды раствора электролита, циркулирующего в плазмохимотронном узле установки фиг.2, равным 2:1).
Контроль свободного кислорода (Р O2) в кислородсодержащих смесях осуществляли фотометрическим методом с использованием блока, принципиальная схема которого представлена фигурой 3 и типовыми индикаторными трубками O2 (1,0÷25%).
Блок (см. фиг.3) состоял из узла источника света, использующего процесс горения углеводородов в свободном кислороде, включающего: корпус с газопроводящим штуцером и каналами поз.1, распределитель, газового (парогазового) потока (сетки + вата) поз.2, парафиновую (восковую) свечу поз.3, тонкое прозрачное стекло поз.4, съемный кожух поз.5 и фотометрический прибор контроля освещенности – люксметр поз.6. Тарировка блока фиг.3 была проведена по воздушно-кислородной смеси при Р О2 от 20% до 100%. Точность определения Р О2:
для воздуха  Р О2 Р О2 ±15%, для кислородсодержащей смеси ±15%, для кислородсодержащей смеси  Р O2 Р O2 ±20%. Фигурой 4 представлены экспериментальные данные о содержании свободного кислорода Р O2 в исследуемых нами кислородсодержащих смесях. ±20%. Фигурой 4 представлены экспериментальные данные о содержании свободного кислорода Р O2 в исследуемых нами кислородсодержащих смесях.
Анализ полученных данных показывает, что парогазовая смесь [6] 1:1 содержала свободный кислород на уровне чувствительности прибора 4-6%, парогазовая смесь [6] 2:1 в количестве, близком к содержанию свободного кислорода в воздухе (Р О2 18±4%, см. фиг.4). 18±4%, см. фиг.4).
Данные фиг.4 показывают, что для количественной оценки пересыщения питьевой воды кислородом парогазовой смеси H2O2+O2, на основании равенства парциальных давлений кислорода при н.у. парогазовой смеси и воздушной смеси, должен быть выбран воздух или воздушно-озоновая смесь.
Экспериментальные данные процессов насыщения питьевой воды кислородом, снятые при нормальных условиях в опытно-промышленной установке кондиционирования питьевой воды, представлены на фигуре 5. Данные фиг.5 получены при фиксированных объемах кондиционируемой питьевой воды V H2O=200±4 л, фиксированном расходе и давлении воды в напорной части циркуляционно-проточного гидравлического контура установки G H2O=1500±30 л/час,  Р=15,0±0,15 м вод. столба, водородном показателе и концентрации растворенного кислорода в исходной воде pH ко=7,5-8 ед., С O2=2,0±0,5 мг O2/л H2O, водородном показателе конденсата парогазовой смеси [6] pH конд=8,50±0,50 ед., водородном показателе кондиционированной (кислородонасыщенной) питьевой воды Р=15,0±0,15 м вод. столба, водородном показателе и концентрации растворенного кислорода в исходной воде pH ко=7,5-8 ед., С O2=2,0±0,5 мг O2/л H2O, водородном показателе конденсата парогазовой смеси [6] pH конд=8,50±0,50 ед., водородном показателе кондиционированной (кислородонасыщенной) питьевой воды
pH H2O=8,25±0,25 ед.
Объем кислородсодержащей газовой, Vгс (парогазовой, Vnгc) смеси, используемый в процессе насыщения кондиционируемой питьевой воды кислородом изменяли во времени (Vгс=Var, Vпгс=Var) при постоянном, (зафиксированном во времени эксперимента) расходе газовой, Gгс, (парогазовой, Gпгс) смеси.
Из анализа данных фигуры 5 следует:
– процессы насыщения питьевой воды воздухом и воздушно-озоновой смесью были адекватными в пределах ошибки эксперимента (по типовой методике СаНПиН 2.1.4.1116-02 озон в питьевой воде установки был определен при температуре воды 21±1°С на уровне С О3 0,5 мг О3/л H2O 0,5 мг О3/л H2O
– кондиционируемая питьевая вода насыщалась кислородом воздуха и кислородом парогазовой смеси [6] 1:1 и 2:1 примерно в одном и том же интервале времени (см. фиг.5);
– процессы насыщения парогазовой смеси [6] 1:1 и парогазовой смеси [6] 2:1 были адекватны в пределах ошибки эксперимента;
– не наблюдалось полного насыщения кондиционируемой питьевой воды кислородом кислородного газа (P O2=100%) в интервале 0,01 Vгс/V H2O Vгс/V H2O 10; 10;
– пересыщение питьевой воды кислородом парогазовой смеси [6] 1:1 и 2:1 по отношению к известным кислородсодержащим смесям составило от 5 до 22 мг О2/лН2O.
Конкретно: по отношению к кислородсодержащей воздушной и воздушно-озоновой смеси – 20-22 мг О2/л H2O, по отношению к воздушно-кислородной смеси (Р О2=40÷60%) – 7÷14 мг O2/л H2O, по отношению к кислородному газу (0 Vгс/V H2O Vгс/V H2O 10) – 5÷6 мг O2/л H2O. 10) – 5÷6 мг O2/л H2O.
В теоретическом обосновании аномальных физико-химических свойств парогазовой смеси [6], лежащих в основе заявленного технического решения, концентрация кислорода в водно-кислородных комплексах водного раствора электролита, циркулирующего в плазмохимотронном узле установки кондиционирования питьевой воды, должна не менее чем в 2 раза превышать концентрацию кислорода в водно-кислородных комплексах конденсата парогазовой смеси (см. уравнения 5 и 7).
Это означает, что должно происходить увеличение пересыщения питьевой воды парогазовой смесью [6] при использовании ранее обработанного в плазмохимотронном узле установки водного раствора электролита по отношению к свежеприготовленному.
Экспериментальные данные о влиянии обработанного водного раствора на уровень пересыщения кислородом кондиционируемой питьевой воды парогазовой смесью [6] 1:1 представлены в таблице 1.
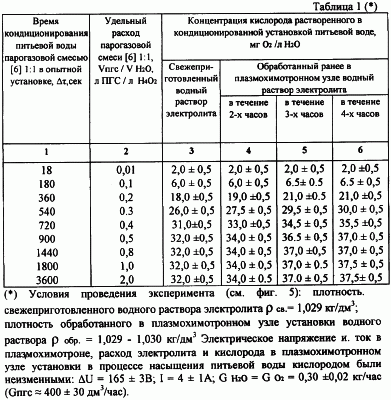
Анализ экспериментальных данных таблицы 1 показывает, что увеличение пересыщения кислородом кондиционированной питьевой воды при использовании парогазовой смеси [6], приготовленной на обработанном ранее в плазмохимотронном узле установки водном растворе электролита, по отношению к процессу насыщения с применением парогазовой смеси, приготовленной на свежем водном растворе электролита реально существует и составляет 4±2 мг O2/л H2O.
На основании экспериментальных данных фиг.5 и табл.1 пересыщение питьевой воды кислородом парогазовой смеси [6] по отношению к известным кислородсодержащим смесям составило от 9±2 мг O2/л H2O до 26±2 мг O2/л H2O, что подтверждает ранее проведенный нами теоретический расчет концентрации водно-кислородных комплексов в парогазовой смеси [6] и наличие аномальных физико – химических свойств у парогазовой смеси H2O2+O2 по отношению к известным.
Процесс пересыщения кислородом кондиционированной питьевой воды (нейтральными и активными формами) необходимо контролировать одновременно по параметрам качества воды “растворенный в воде кислород”, “pH воды”, “Активные формы кислорода, водорода и их соединений, растворенные в воде”.
В техническом решении [5] показатель качества воды “Активные формы кислорода, водорода и их соединений, растворенные в воде” отсутствует. В СаНПиН 2.1.4.1116-02 определен только параметр концентрации в бутилированной питьевой воде, растворенной в воде активной формы газообразного кислорода – “озона”, С О3 0,1 мг О3/л H2O (быстрораспадающейся при температуре воды 20°С). 0,1 мг О3/л H2O (быстрораспадающейся при температуре воды 20°С).
Для заявленной кондиционированной кислородосодержащей питьевой воды высшей категории качества помимо С O2, С О3, pH необходимо определить наличие в воде активных форм кислорода, водорода и их соединений, связанных как с концентрацией в воде известного пероксида водорода (H2O2), так и кластерного пероксида водорода (Н4O4), входящего в состав водно – кислородных комплексов [(O4 4-)·4H3O+]·nH2O.
Из проведенного нами анализа научно – технической литературы и нормативной документации о свойствах H2O2 в водных растворах и биосистемах, находящихся в пероксидных водных растворах, благоприятно действующая на обменные процессы в живых клетках концентрация H2O2 (С H2O2) находится в пределах от 3·10-6 до 10-4 М [16, 17, 18]. Нижнее значение С H2O2 3·10-6 М (0,1 мг H2O2/л H2O) нормируется СаНПиН 2.1.4.1074-01 на питьевую воду, верхнее значение С H2O2 3·10-6 М (0,1 мг H2O2/л H2O) нормируется СаНПиН 2.1.4.1074-01 на питьевую воду, верхнее значение С H2O2 10-4 М (3 мг H2O2/л H2O) определено [18] по отсутствию изменений при действии добавки пероксида водорода на биохимические реакции в живых клетках. 10-4 М (3 мг H2O2/л H2O) определено [18] по отсутствию изменений при действии добавки пероксида водорода на биохимические реакции в живых клетках.
Из-за отсутствия данных о количественном анализе активных форм кислорода, водорода и их соединений в кондиционированной установкой питьевой воде (см. фиг.2) нами были проведены исследования этого важного для живых клеток (организма человека) показателя качества воды с применением:
1. Типовой методики физико-химических методов анализа пероксида водорода [16, с.448];
2. Опытной методики коллоидно-химического метода анализа активных форм кислорода, водорода и их соединений, разработанной предприятием “Экосервис”, г.Краснодар.
В основе методики коллоидно-химического метода анализа активных форм кислорода, водорода и их соединений, разработанной предприятием “Экосервис” лежат аномальные физико – химические свойства кондиционированной парогазовой смесью H2O2+O2 [6] на установке фиг.2 питьевой воды (высшая категория качества, марка “ОКСИ”) по отношению к исходной питьевой воде, насыщенной кислородом воздуха (С O2 9 мг O2/л H2O) увеличивать не менее чем в 2-3 раза время устойчивого коллоидно – химического состояния освещенной УФ-светом ртутной лампы ( 9 мг O2/л H2O) увеличивать не менее чем в 2-3 раза время устойчивого коллоидно – химического состояния освещенной УФ-светом ртутной лампы ( =254 нм) водной суспензии хлористого серебра AgCl, приготовленной смешиванием водного раствора AgNO3 с исследуемой питьевой водой. =254 нм) водной суспензии хлористого серебра AgCl, приготовленной смешиванием водного раствора AgNO3 с исследуемой питьевой водой.
Нижняя граница чувствительности метода определена растворимостью суспензии соли AgCl в питьевой воде – 1,3·10-5 М, верхняя – растворимостью Ag2O в питьевой воде – 1,3·10-4 М.
Точность количественного определения по шкале фоточувствительных ионов Ag* активных форм кислорода, водорода и их соединений коллоидно-химическим методом не превышает ±30%.
3. Опытной методики биохимического метода анализа активных форм кислорода, водорода и их соединений, разработанного Биологическим факультетом МГУ им. М.В.Ломоносова [19].
В основе методики биохимического метода анализа активных форм кислорода, водорода и их соединений, лежат аномальные физико – химические свойства кондиционированной парогазовой смеси H2O2+O2 [6] на установке фиг.2 питьевой воды (высшая категория качества, марка “ОКСИ”) по отношению к исходной питьевой воде формировать превышающее более чем на порядок фоновое излучение (фиксируется прибором БИОТОКС от исходной питьевой воды и материала пробирки) вспышки хемилюнесцентного света из активных центров растворенного в воде люминофора (люминола) при добавлении в воду двухзарядных ионов
(Cu2+, Fe2+ и других).
Так как длина наблюдаемого в водном растворе с люминофором, приготовленным на кондиционированной питьевой воде “ОКСИ”, излучения находятся в области   275 нм (Е hv 275 нм (Е hv 4,5 эВ), что точно определено уравнением реакции: 4,5 эВ), что точно определено уравнением реакции:

где: 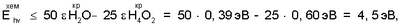
то диапазон концентраций ионов Fe2+, разряжающих активные центры люминофора, связанные в питьевой воде “ОКСИ” с водно-кислородными комплексами, в первом приближении, позволяет оценить концентрацию активных форм кислорода, водорода и их соединений в питьевой воде.
Нижняя граница чувствительности биохимического метода 10 М-8, верхняя 10-5 М [19]. Концентрация ионов Fe2+, при которой амплитуда вспышки из воды с люминофором имеет наибольшее значение (обеспечивает наиболее полное взаимодействие активных центров люминола с ионами Fe2+) находится в пределах 10-6-10-5 М.
В таблице 2 и фиг.6 представлены экспериментальные данные количественного анализа С О2, pH, активных форм кислорода, водорода и их соединений в кондиционированной установкой фиг.2 питьевой воде.
| Таблица 2 (*). |
| № поз. |
Параметр качества питьевой воды, метод |
Кондиционированная на опытно – промышленной установке питьевая вода |
| |
анализа параметра |
Кислородосодержащая смесь |
примечание |
| |
|
воздух |
Кислородный газ |
парогазовая смесь [6] 1:1, |
|
| 1 |
2 |
3 |
4 |
5 |
6 |
| 1 |
Растворенный в воде кислород, мг O2/л H2O |
|
|
|
|
| |
Типовой физико – химический метод. Паспорт прибора АЖА-101 pH воды |
9.0±0,5 |
27,0±0.5 |
34,0±0,5 |
|
| 2. |
Типовой физико – химический метод. Паспорт прибора pH-420 |
8,0±0.25 |
8,0±0,25 |
8,25±0,25 |
|
| 3 |
Растворенный в воде пероксид водорода, моль Н2O2/л H2O Типовой физико – химический метод [16, с.448] |
Нет воспроизведенных данных (С Н2O2 5·10-4 М)** 5·10-4 М)** |
Нет воспроизведенных данных (С H2O2 5·10-4 M)** 5·10-4 M)** |
Нет воспроизведенных данных (С Н2O2 5·10-4 М)** 5·10-4 М)** |
(**) пороговая концентрация H2O2 5·10-4 M определена количественно в табл.3 |
| 4 |
Активированные формы кислорода, водорода и их соединений |
|
|
|
|
| 4.1 |
Коллоидно-химический метод “Экосервис” |
Менее 10-5 М |
Менее 10-5 М |
(3.0±1,0)·10-5 М |
|
| 4.2 |
Биохимичесикй метод Биофака МГУ им. М.В.Ломоносова |
– |
– |
10-6÷10-5 М |
|
| (*) Условия кондиционирования питьевой воды см. данные фиг.5 и табл.1 Концентрация О3, определенная во всех пробах воды по типовой методике СаНПиН 2.1.4.1116-02 не превышала 0,1 мг О3/л H2O (2·10-6 М) |
Анализ данных табл.2 показывает, что в кондиционированной питьевой воде количественное значение концентраций пероксида водорода известным физико – химическим методом [16, с.484] не определяется.
Невоспроизводимость результатов анализов при низких концентрациях H2O2 связана с колебанием микроколичеств активной формы соединения H2O2 между устойчивыми соединениями: жидкой водой Н4O2 и водно-кислородными комплексами, находящимися в кондиционированной кислородосодержащей питьевой воде.
Для выявления пороговой концентрации в кондиционированной опытно-промышленной установкой питьевой воде, при которой методом [16, с.448] можно количественно определить С Н2O2, нами было проведено исследование влияния добавки в кондиционированную питьевую воду фиксированного объема 3% раствора H2O2 (с использованием трубопровода -5- и шарового крана поз.20 опытно-промышленной установки см. фиг.2).
Полученные экспериментальные данные представлены в таблице 3.
| Таблица 3 (*). |
| Параметр качества питьевой воды, |
Кондиционированная на опытно – промышленной установке питьевая вода |
| метод анализа параметра |
Кислородный газ |
Кислородосодержащая парогазовая смесь [6] 1:1 |
| |
Добавка в воду 50 мг Н2O2 на 1 л H2O |
Добавка в воду 30 мг H2O2 на 1 л H2O |
Добавка в воду 20 мг H2O2 на 1 л H2O |
Добавка в воду 50 мг H2O2 на 1 л H2O |
Добавка вводу 30 мг H2O2 на 1 л H2O |
Добавка в воду 20 мг H2O2 на 1 л H2O |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
| Концентрация в кондиционированной питьевой воде Н2O2, мг H2O2/л H2O, определенная методом [16, с.484] |
30±20 |
15±15 |
Пороговая концентрация 5·10-4 М |
30±20 |
15±15 |
Пороговая концентрация 5·10-4 М |
| (*) условия кондиционирования питьевой воды см. фиг.5 и табл.1 |
Анализ данных табл. 3 показывает, что метод [16, с.484] определяет количественно концентрацию пероксида водорода в пересыщенной кислородом питьевой воде при навеске H2O2, не превышающей 20 мг H2O2/л H2O. При концентрациях ниже этого значения метод не имеет воспроизводимых результатов анализа.
Отметим, что для артезианской воды (С О22,0±0,5 мг O2/л H2O) порог количественного определения С H2O2 физико – химическим методом [16, с.484] смещает в сторону увеличения навески H2O2 в 1,5 раза (до 30 мг H2O2/л H2O), что указывает о высокой чистоте пересыщенной кислородом питьевой воды.
Данные по определению активных форм кислорода, водорода и их соединений высокочувствительным коллоидно-химическим методом анализа предприятия “Экосервис” представлены фиг.6.
Нами был использован интервал концентраций AgCl суспензии метода анализа предприятия “Экосервис” от 6,0 до 1,4 мг Ag+ на 1 л питьевой воды. Концентрация ионов Ag+ измеряли титрометрическим методом, предварительно отделив коллоидно-механический осадок, ультрафильтрационной мембраной (с последующим его смыванием с мембраны и растворением в водном растворе HNO3). Пробы кондиционированной питьевой воды, насыщенной кислородом воздуха (9 мг O2/л H2O) и пересыщенной кислородом парогазовой смеси H2O2+O2 (34±2 мг O2/л H2O, см. табл.1), ставили на анализ одновременно. Пробы воды поз.1, 2 (см. фиг.6) помещали в темноту, пробы воды поз.1*, 2* – под УФ-свет ртутной лампы ( =254 нм). Зависимость поз.1,1* фиг.6 относятся к питьевой воде насыщенной кислородом воздуха, зависимость поз.2,2* к питьевой воде, пересыщенной кислородом парогазовой смеси [6] 1:1 =254 нм). Зависимость поз.1,1* фиг.6 относятся к питьевой воде насыщенной кислородом воздуха, зависимость поз.2,2* к питьевой воде, пересыщенной кислородом парогазовой смеси [6] 1:1
Концентрацию активных форм кислорода, водорода и их соединений в пересыщенной кислородом питьевой воде ( С акт) определяли при полном просветлении коллоидно-механического раствора соли AgCl в воде насыщенной кислородом воздуха (проба поз.1*). С акт) определяли при полном просветлении коллоидно-механического раствора соли AgCl в воде насыщенной кислородом воздуха (проба поз.1*).
Количественно концентрацию  С акт. рассчитывали по формуле: С акт. рассчитывали по формуле:
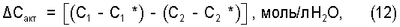
где: C1 и С2 – соответственно концентрация суспензии AgCl в питьевой воде неосвещенных УФ-светом пробах;
C1* и С2* – соответственно концентрация суспензии AgCl в питьевой воде освещенных УФ-светом пробах;
Индексы “1” и “2” относятся соответственно к насыщенной и пересыщенной кислородом питьевой воде.
Полученные в табл.3, фиг.6, работе [19], экспериментальные данные показывают, что аномальные свойства парогазовой смеси [6] реально проявляются при ее смешивании с питьевой водой. В первом приближении количественно уровень концентраций активных форм кислорода, водорода и их соединений определен величиной от 10-6 до 3·10-5 М. На основании биохимических исследований [18] эта концентрация безопасна для живых клеток.
Аномальные свойства пересыщенной кислородом парогазовой смеси H2O2+O2 питьевой, воды должны проявляться при розливе воды в нормальных условиях в герметичную пластмассовую или стеклянную тару, в первую очередь по показателю “увеличение срока сохранности концентрации растворенного в воде кислорода”.
Из-за отсутствия сопоставимых данных о сроках сохранности растворенного в питьевой воде высшей категории кислорода нами было проведено исследование этого важного для потребителей, с точки зрения качества питьевой воды, показателя на установке кондиционирования и розлива питьевых вод фиг.2.
При розливе на установке фиг.2 кондиционированной кислородосодержащей питьевой воды в бутыли были использованы: трубопровод -3-, кран-дозатор, поз.18, типовые прозрачные пластмассовые бутыли емкостью до 5,0 л поз.19, пластмассовые пробки для герметизации бутыли, поз.7 (см. фиг.2).
Предварительно бутыли и крышки были стерилизованы реагентами, рекомендованными СаНПиН 2.1.4.1116-02.
Для кондиционирования питьевых вод кислородом в установке, фиг.2, были использованы ранее исследованные кислородосодержащие смеси: воздух, кислородный газ, парогазовая смесь [6] 1:1.
Экспериментальные данные изменения концентраций растворенного в воде кислорода (СО2) во времени (  ) при хранении кондиционированной кислородосодержащей питьевой воды в герметичных бутылях представлены на фиг.7. ) при хранении кондиционированной кислородосодержащей питьевой воды в герметичных бутылях представлены на фиг.7.
Зависимость C O2=f (  ), поз.1 (см. фиг.7), получена для воздуха, зависимость C O2=f ( ), поз.1 (см. фиг.7), получена для воздуха, зависимость C O2=f (  ), поз.2 и поз.3 – соответственно для кислородного газа и парогазовой смеси [6] 1:1. ), поз.2 и поз.3 – соответственно для кислородного газа и парогазовой смеси [6] 1:1.
Анализ экспериментальных данных, фиг.7, показывает, что в пересыщенной кислородом парогазовой смеси [6] 1:1 бутилированной питьевой воде гарантирован срок сохранности высшей категории качества питьевой воды
СаНПиН 2.1.4.1116-02 по растворенному кислороду не менее 6 месяцев при хранении в нормальных условиях (см. зависимость CO2=f (  ), поз.3 фиг.7). С применением известных кислородосодержащих смесей [3÷5] бутилированная кислородосодержащая питьевая вода имела срок сохранности растворенного в воде кислорода (не менее 9 мг O2/л H2O при н.у.) не более 1 месяца (см. зависимость CO2=f ( ), поз.3 фиг.7). С применением известных кислородосодержащих смесей [3÷5] бутилированная кислородосодержащая питьевая вода имела срок сохранности растворенного в воде кислорода (не менее 9 мг O2/л H2O при н.у.) не более 1 месяца (см. зависимость CO2=f (  ) поз.1 и поз.2 фиг.7) ) поз.1 и поз.2 фиг.7)
Поскольку аномально длительный во времени срок сохранности высоких концентраций растворенного в воде кислорода (не менее 9 мг O2/л H2O при н.у.) из полученных данных, фиг.7, связан с водно-кислородными комплексами и активными формами кислорода, водорода, то возникла необходимость дополнительного исследования свойств известной активной формы соединения кислорода с водородом H2O2 выделять в жидкую воду кислород [16, с.60-61].
Контрольные испытания влияния добавки водного 3% раствора H2O2 в кондиционируемую питьевую воду, исходя из возможности количественного анализа пероксида водорода (см. данные табл.3), представлены в таблица 4.
| Таблица 4 (*). |
| Время хранения бутилированной питьевой |
Количество добавки H2O2 в кондиционированную воду 30 мг H2O2/л H2O (С H2O2=15±15 мг H2O2/л H2O) |
Количество добавки H2O2 в кондиционированную воду 50 мг H2O2/л H2O (С Н2O2=30±20 мг H2O2/л H2O) |
воды,   , часы, дни , часы, дни |
С О2 в бутилированной питьевой воде, кондиционированной кислородным газом, мл O2/л H2O |
С O2 в бутилированной питьевой воде, кондиционированной парогазовой смесью [6] 1:1 мл O2/л H2O |
C O2 в бутилированной питьевой воде, кондиционированной кислородным газом, мл O2/л H2O |
C O2 в бутилированной питьевой воде, кондиционированной парогазовой смесью [6] 1:1 мл O2/Л H2O |
| 1 |
2 |
3 |
4 |
5 |
| 0-0,5 часов |
29,0±0,5 |
32,0±0,5 |
30,5±0,5 |
34,0±0,5 |
| 0.5-1,0 час |
28,0±0,5 |
34,0±0,5 |
29,0±0,5 |
35,5±0,5 |
| 1.0-2,0 часа |
27,0±0,5 |
33,0±0,5 |
28,0±0,5 |
34,5±0,5 |
| 12 часов |
24,0±0,5 |
31,0±0,5 |
25,0±0,5 |
32,5±0,5 |
| 1 день |
22,0±0,5 |
29,0±0,5 |
23,0±0,5 |
30,5±0,5 |
| 5 дней |
18,0±0,5 |
25,0±0,5 |
19,0±0,5 |
26,0±0,5 |
| 10 дней |
14,0±0,5 |
22,0±0,5 |
15,0±0,5 |
23,0±0,5 |
| 20 дней |
12,0±0,5 |
18,0±0,5 |
13,0±0,5 |
19,0±0,5 |
| 30 дней |
8,0±0,5 |
16,0±0,5 |
8,0±0,5 |
16,0±0,5 |
| 60 дней |
7,0±0,5 |
14,0±0,5 |
7,0±0,5 |
14,0±0,5 |
| 90 дней |
7,0±0,5 |
13,0±0,5 |
7,0±0,5 |
13,0±0,5 |
| 120 дней |
6,0±0,5 |
11,0±0,5 |
6,0±0,5 |
11,0±0,5 |
| 180 дней |
6,0±0,5 |
10,0±0,5 |
6,0±0,5 |
10,0±0,5 |
| (*) Условия эксперимента см. табл.3, фиг.7 |
С H2O2 замерена в свежеприготовленной бутилированной питьевой воде (   24 часов). 24 часов). |
Анализ данных табл.4 показывает, что добавка H2O2 в кондиционируемую установкой фиг.2 питьевую воду в количестве до 30 мг O2/л H2O (С H2O210-3 М) не влияет на пересыщение бутилированной питьевой воды кислородом парогазовой смеси [6] 1:1 при их смешивании и не влияет на высокий срок сохранности высокой концентрации растворенного в воде кислорода (не менее 9 мг O2/л H2O при н.у.).
При добавке в кондиционируемую питьевую воду 50 мг H2O2/л H2O и более, наблюдается прирост по отношению к контрольному образцу (для добавки 50 мг H2O2/л H2O – около 3%, см. табл.4).
Так как минимальная концентрация H2O2 в кондиционируемой питьевой воде, оказывающая влияние на пересыщение питьевой воды кислородом была равна 10-3 М (на 2-3 порядка превышала уровень концентрации активных форм кислорода, водорода и их соединений в парогазовой смеси [6], см. данные табл.2), то полученные экспериментальные данные табл.4 доказывают, что основной механизм пересыщения жидкой воды парогазовой смесью [6] и ее аномальные свойства определяют устойчивые в питьевой воде водно-кислородные комплексы [(O4 4-)·4H3O+]·n H2O и 2(Н10O8)* предсказанные теорией.
Физико-химические свойства кондиционированной питьевой воды заявленного технического решения в сравнении с физико-химическими исходной питьевой воды представлены экспериментальными данными таблицы 5, полученных нами с участием Центра испытаний питьевых вод г.Краснодара.
| Таблица 5 (*). |
| № поз. |
Физико-химический параметр бутилированной питьевой воды (при н.у.) |
Исходная питьевая вода |
Кондиционированная парогазовой смесью [6] 1:1 питьевая вода |
Примечание |
| 1 |
2 |
3 |
4 |
5 |
| 1 |
Плотность, г/см3 |
0,995±0,003 |
0,995±0,003 |
|
| 2 |
Удельное электрическое сопротивление. кОм см |
1,7±0,2 |
1,7±0,3 |
|
| 3 |
Температура кипения, °С |
99,5±0,5 |
99,0±1,0 |
|
| 4 |
Температура замерзания воды в прозрачной пластиковой бутыли емкостью 5,0 литров (время замораживания 7 дней), °С |
-(1÷3) (*) |
-(5÷7) (*) |
(*) – пробы поставлены в холодильную камеру одновременно. Содержание незамороженной в течение 7 дней в герметичной бутыли воды определено уровнем 10±5% |
| 5 |
Привкус питьевой воды |
Без привкуса |
Привкус свежей талой снеговой воды |
|
| 6 |
Образование осадка при кипячении в Эмалированном сосуде |
Образуется белый осадок на дне и стенках сосуда |
Образуется белый осадок на дне и стенках сосуда |
Анализ солей жесткости и соединений кремния проведен типовыми методами рекомендованными СаНПиН 2.1.4.1116-02 РФ |
| Таблица 5 (*) (продолжение). |
| l |
2 |
3 |
4 |
5 |
| 7 |
Основной состав осадка, полученного при кипячении воды п.6 (начальный объем воды 5,0 л, объем выпаренной воды 4,6 л) |
Са(ОН)2 Mg(OH)2 SiO2 (Ca2++Mg2+)–(15±3) мг SiO2 – следы |
Са(ОН)2 Mg(OH)2 SiO2 – 20% (Ca2++Mg2+)–(10±3) мг SiO2-(2±l) мг |
|
| 8 |
Образование осадка в бутилированной питьевой воде после размораживания льда в герметичной полимерной бутыли при нормальных условиях (бутилированная питьевая вода была заморожена в течение суток при t=-(20±1)°С в холодильной камере |
(**) Следы рыхлого (аморфного) бело-серого осадка (Са+ Mg+Si) |
Рыхлый бело-серый осадок |
(**) Концентрация основных компонентов осадка не менее 0,1 мг/л в размороженной H2O |
| |
|
|
(***) |
(***) |
| 9 |
Основной состав осадка, полученного после размораживания бутилированной питьевой воды, п.8 |
– |
Са(ОН)2 Mg(OH)2 SiO2 – 30% |
Концентрация (Ca2++Mg2+)-4÷6 мг/л H2O Концентрация SiO2 1÷3 мг/л в размороженной H2O |
| (*) Условия получения кислородосодержащей питьевой воды, табл.1 и фиг.5. |
На основании экспериментальных данных табл.5 (поз.4) пересыщенная кислородом парогазовой смеси [6] кондиционированная питьевая вода находится в переохлажденном на 3÷5°С состоянии. Рассчитанное по данным таблицы 5 значение  Н4O2 Н4O2 (5±1)·10-4 эВ совпадает с точностью ±25% с использованным в теории (5±1)·10-4 эВ совпадает с точностью ±25% с использованным в теории 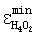 [12, с.318], подтверждая экспериментально интервал n H2O [12, с.318], подтверждая экспериментально интервал n H2O 40000±20000. 40000±20000.
Данные табл.5 (поз.4) говорят о наличии в кондиционированной питьевой воде заявленного технического решения “горячих” (энергообогащенных) водно-кислородных комплексов, поддерживающих жидкое состояние воды в интервале температур от 0 до -7°С.
Для “перегрева” жидкой воды известным энергообогащенным, кислородовыделяющим веществом H2O2 с 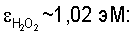 [16, с.63] необходимо n*·Н4O2=1,02 эВ:(5·10-4) эВ=2·103 молекул Н4O2. Иными словами, концентрация молекул пероксида водорода H2O2 в питьевой воде, обеспечивающая “перегрев” жидкой воды на 3÷5°С, должна превышать 10-2 М. [16, с.63] необходимо n*·Н4O2=1,02 эВ:(5·10-4) эВ=2·103 молекул Н4O2. Иными словами, концентрация молекул пероксида водорода H2O2 в питьевой воде, обеспечивающая “перегрев” жидкой воды на 3÷5°С, должна превышать 10-2 М.
Полученный результат доказывает, что известными техническими решениями невозможно достигнуть в пересыщенной кислородом питьевой воде экологически безопасного для живых клеток уровня активных форм кислорода, водорода и их соединений.
На основании рассмотренного выше материала заявители считают, что техническая задача решена в полном объеме.
Техническое решение подготовлено для сертификации на уровне органов надзора за питьевыми водами Российской Федерации и к внедрению в промышленном производстве высококачественных кислородосодержащих питьевых вод.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Кульский Л.А. Теоретические основы и технология кондиционирования воды. – Киев, “Наукова Думка”, 1983, 528 с.
2. Кульский Л.А. Основы химии и технологии воды. – Киев, “Наукова Думка”, 1991, 568 с.
3. Джеффери Крандеил и другие. Метод для получения оксигенированной воды. Патент США №6284293 В1 (НКИ 426/67) 04.09.2001 г.;
Хехтль Кристиан. Производство питьевой воды длительного хранения, разлитой в бутыли, насыщенной кислородом воздуха. Патент Германии №1047826, C 02 F 1/68 (НКИ BG 7 D 1/00 Н 4 С), 16.10.1998 г.
4. Обзоры компаний “Aqua Rush”, “Aqua Clara”, “Life – O22 com.
5. Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества: Санитарно-эпидемиологические правила и нормативы. – М.: Федеральный центр госсанэпидемнадзора Минздрава России, 2002, 27 с. (СаНПиН 2.1.4.1116-02). Методические указания по внедрению и применению санитарных правил и нормативов СаНПиН 2.1.4.1116-02 “Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества” МУ 2.1.4.1184-03. – М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2003, 63 с.
6. Зыков Е.Д., Щербаков В.Н. Плазмохимотронный способ получения парогазовой смеси H2O2+O2. Патент России №2171863 (С2) С 25 В 1/30, С 25 В 1/04, C 02 F 1/46, 30.07.1998 г.
7. Гришин В.Г., Давыдов А.Д. Плазмодинамический реактор для нейтрализации протонов и дейтронов в природной воде. Мат. 9-й Росс. конф. по холодной трансмутации ядер химических элементов (РХТЯ – 9), Дагомыс, Сочи 30 сентября – 7 октября 2001 г. – М., 2002, с.109.
8. Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л., Изд-во “Химия”, 1977, 376 с.
9. Краткий справочник физико-химических величин. Под. ред. Мищенко К.П. и Равделя А.А. – Л.: Химия, 1977, 376 с.
10. Протасов Ю.С., Чувашев С.Н. Физическая электроника газоразрядных устройств (ч.I, Плазменная электроника). – М.: Высшая школа, 1993, 240 с.
11. Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов химической технологии. – Л.: Химия, 1976, 552 с.
12. Химия. Большой энциклопедический словарь. – М.: Большая Российская энциклопедия, 1998, 791 с.
13. Международный симпозиум “Перестройка естествознания”, Москва 20-24 апреля 2001 г. Зыков Е.Д. и сотрудники. Доклад “Супервода – O2 – новое состояние вещества”. Аннотация доклада опубликована в журнале “На грани невозможного”, №13, 2001, с.9. (“Супервода H10O8“).
14. Охлобыстин О.Ю. Жизнь и смерть химических идей. – М.: Наука, 1989, 192 с.
15. Михайленко Я. II. Курс общей и неорганической химии. – М.: Высшая школа, 1966, 664 с.
16. Перекись водорода и перекисные соединения. Под ред. Позина М.Е. М. – Л.: ГНТИ химической литературы, 1951, 432 с.
17. Уильям Дуглас. Целительные свойства перекиси водорода. – Санкт-Петербург: Питер, 1998, 192 с.
18. Коургио Эн-мэрик и другие. Перекись водорода (H2О2) индуцирует актин и некоторые белки теплового шока в клетках дрозофилы. “Eur J. Biochem”., 1988, 171, №1-2, р.163-170 (Аннотация статьи, см. Реферативный журнал “Биология”, 7Т440, 1988 г.).
19. Воейков В.Л., Новиков К.Н. Хемилюминесцентный анализ питьевой воды, оксигенированной в плазмохимотронном реакторе. Международная конференция “Новые технологии в защите биоразнообразия в водных экосистемах” – М., МГУ им. М.В.Ломоносова (тезисы докладов), 2002, с.16-22.
Формула изобретения
Кондиционированная питьевая вода высшей категории качества, включающая жизненно важные для организма человека показатели:
| Общая минерализация |
100-1000 мг/л |
| Жесткость |
1,5-7,0 мг-экв/л |
| Щелочность |
0,5-6,5 мг-экв/л |
| Содержание ионов Na+ |
20-200 мг/л |
| Содержание ионов K+ |
2-20 мг/л |
| Содержание ионов Са2+ |
25-130 мг/л |
| Содержание ионов Mg2+ |
5-50 мг/л |
| Содержание ионов НСО3– |
30-400 мг/л |
| Содержание ионов F– |
0,5-1,5 мг/л |
| Содержание ионов I– |
0,01-0,125 мг/л |
| рН |
6,5-8,5 |
а также растворенный в воде кислород, отличающаяся тем, что растворенный кислород находится при нормальных условиях в пересыщенном состоянии с концентрацией 10-40 мг О2/л Н2О, полученном в результате смешивания исходной воды с кислородсодержащей парогазовой смесью, синтезированной плазмохимотронным методом.
РИСУНКИ
|
|