|
|
(21), (22) Заявка: 2005118734/04, 16.06.2005
(24) Дата начала отсчета срока действия патента:
16.06.2005
(46) Опубликовано: 20.09.2006
(56) Список документов, цитированных в отчете о
поиске:
HUNGUANG ZHU et al., Biomaterials, 2002, V.23, p.3141-3148. RU 2004108141 A, 20.04.2005. RU 2164149 C2, 20.03.2001. RU 2003109617 А, 27.08.2004.
Адрес для переписки:
450075, г.Уфа, пр-т Октября, 141, ИНК РАН, патентная группа
|
(72) Автор(ы):
Понеделькина Ирина Юрьевна (RU),
Одиноков Виктор Николаевич (RU),
Лукина Елена Сергеевна (RU),
Валиева Лилия Валерьевна (RU),
Джемилев Усеин Меметович (RU),
Башкатов Сергей Александрович (RU),
Суфиярова Роза Шайхальнуровна (RU),
Парфенова Тамара Ильинична (RU),
Серик Евгений Михайлович (RU)
(73) Патентообладатель(и):
Институт нефтехимии и катализа РАН Республика Башкортостан (RU)
|
(54) СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТОВ АЛЬГИНОВОЙ КИСЛОТЫ
(57) Реферат:
Описан способ получения конъюгатов альгиновой кислоты путем взаимодействия ее с аминосодержащими соединениями (RNH2) в присутствии конденсирующего реагента 1-этил-3-[3-(диметиламино)пропил]карбодиимида в водной среде при комнатной температуре, рН 4.7-4.8. В качестве аминосодержащих соединений используют ряд фармакологически значимых аминов: n- и о-аминофенолы, 5- и 4-аминосалициловые, антраниловую и n-аминобензойную кислоты, этиловый эфир n-аминобензойной кислоты (анестезин),  -диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин), 1-фенил-2,3-диметил-4-аминопиразолон-5(4-аминоантипирин), гидразид изоникотиновой кислоты (изониазид), 2-аминоэтансульфоновую кислоту (таурин), 7-аминоцефалоспориновую кислоту, а также сульфаниламидные препараты, такие как n-аминобензолсульфамид (стрептоцид), n-аминобензолсульфацетамид-натрий (сульфацил-натрий). Производные альгиновой кислоты могут быть использованы в медицине и фармакологии. 1 табл. -диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин), 1-фенил-2,3-диметил-4-аминопиразолон-5(4-аминоантипирин), гидразид изоникотиновой кислоты (изониазид), 2-аминоэтансульфоновую кислоту (таурин), 7-аминоцефалоспориновую кислоту, а также сульфаниламидные препараты, такие как n-аминобензолсульфамид (стрептоцид), n-аминобензолсульфацетамид-натрий (сульфацил-натрий). Производные альгиновой кислоты могут быть использованы в медицине и фармакологии. 1 табл.
Изобретение относится к области химии и биохимии, в частности к способу получения новых веществ, производных альгиновой кислоты, которые могут быть использованы в медицине, фармакологии.
Альгиновая кислота, полисахарид линейного строения, содержится в бурых водорослях, впервые выделена Е.Стендфордом в 1881 году и состоит из остатков  -D-маннуроновой и L-гулуроновой кислот, связанных между собой (1 -D-маннуроновой и L-гулуроновой кислот, связанных между собой (1 4)-гликозидными связями. В природе альгиновая кислота находится в виде натриевой соли – альгината натрия. Химический состав и молекулярная масса альгината зависят от вида водорослей, используемых в качестве сырья, а также от способов выделения, при этом выход альгината составляет не менее 30% в расчете на высушенное сырье [Методы химии углеводов. Под редакцией чл.-корр. АН СССР Кочеткова Н.К. – Москва: 1967. – 317 С.]. Из альгинатов производятся натрий-, кальций-альгинатные, кальциево-хромовые волокна; последние устойчивы к воспламенению. Альгинаты включают в состав ряда композиционных материалов. 4)-гликозидными связями. В природе альгиновая кислота находится в виде натриевой соли – альгината натрия. Химический состав и молекулярная масса альгината зависят от вида водорослей, используемых в качестве сырья, а также от способов выделения, при этом выход альгината составляет не менее 30% в расчете на высушенное сырье [Методы химии углеводов. Под редакцией чл.-корр. АН СССР Кочеткова Н.К. – Москва: 1967. – 317 С.]. Из альгинатов производятся натрий-, кальций-альгинатные, кальциево-хромовые волокна; последние устойчивы к воспламенению. Альгинаты включают в состав ряда композиционных материалов.
На основе альгиновой кислоты или ее натрий-кальциевых солей известны фармакопейные препараты: «Альгимаф» (в сочетании с сульфаниламидным препаратом «Мафенид») и «Альгипор» (в сочетании с антисептиком фурацилином) – ранозаживляющие средства с резорбтивным и регенерирующим действием [Машковский М.Д. Лекарственные средства. – Харьков: Торсинг, 1997. – Т.1, 2. – 590 С.]. Из альгинатного волокна производятся стерильные повязки для обработки раневых поверхностей с обильным отделением экссудата: «Супрасорб-А», «Мелгисорб» и «Калтостат».
В последние годы проявляется большой интерес к получению и исследованию биологических свойств кислых полисахаридов, химически модифицированных по карбоксильной функции. Модификация полисахаридов позволяет изменить их физико-химические и биологические свойства. Конъюгаты полисахаридов с лекарственными субстанциями могут обладать большей растворимостью или продолжительностью действия по сравнению с самими лекарствами, могут использоваться как препараты комбинированного действия. В результате ковалентного связывания с полимерной матрицей может снизиться токсичность аминосодержащих соединений.
Для ковалентного связывания аминосодержащих соединений с кислыми полисахаридами (ПС-СООН) в качестве водоотнимающих реагентов применяются водорастворимые карбодиимиды, например 1-этил-3-[3-(диметиламино)пропил]карбодиимид (EDC). При этом образуются соответствующие амиды

Наиболее близким к предлагаемому изобретению является способ получения конъюгатов альгиновой кислоты (альгината) с некоторыми 
Авторами предлагается способ получения конъюгатов альгиновой кислоты с соединениями, содержащими первичную аминогруппу, путем их взаимодействия с альгиновой кислотой в водной среде (рН 4.7-4.8) в присутствии 1-этил-3-[3-(диметиламино)пропил]карбодиимида. Предварительного активирования карбоксигрупп альгиновой кислоты не требуется. Реакция протекает при комнатной температуре в течение 30 минут с образованием соответствующих конъюгатов с высокой конверсией карбоксильных групп альгиновой кислоты. В качестве аминосодержащих соединений были использованы фармакологически значимые n- и о-аминофенолы, 5- и 4-аминосалициловые, антраниловая и n-аминобензойная кислоты, этиловый эфир n-аминобензойной кислоты (анестезин),  -диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин), 1-фенил-2,3-диметил-4-аминопиразолон-5 (4-аминоантипирин), гидразид изоникотиновой кислоты (изониазид), 2-аминоэтансульфоновая кислота (таурин), 7-аминоцефалоспориновая кислота, а также сульфаниламидные препараты, содержащие свободную аминогруппу, такие как n-аминобензолсульфамид (стрептоцид), n-аминобензолсульфацетамид-натрий (сульфацил-натрий) и др. (биологические свойства перечисленных соединений приведены в таблице). -диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин), 1-фенил-2,3-диметил-4-аминопиразолон-5 (4-аминоантипирин), гидразид изоникотиновой кислоты (изониазид), 2-аминоэтансульфоновая кислота (таурин), 7-аминоцефалоспориновая кислота, а также сульфаниламидные препараты, содержащие свободную аминогруппу, такие как n-аминобензолсульфамид (стрептоцид), n-аминобензолсульфацетамид-натрий (сульфацил-натрий) и др. (биологические свойства перечисленных соединений приведены в таблице).
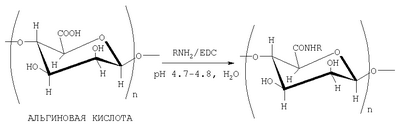
где R=С6Н4ОН (остатки п- или о-аминофенола), С6Н4СООН (остатки п-аминобензойной и антраниловой кислот), C6Н3(ОН)СООН (остатки 4- или 5-аминосалициловых кислот), С6Н4СООС2Н5 (остаток этилового эфира п-аминобензойной кислоты), C6H4COO(CH2)2N(C2H5)2 (остаток бета-диэтиламиноэтилового эфира п-аминобензойной кислоты), C5H4NCONH (остаток гидразида изоникотиновой кислоты), CH2CH2SO3H (остаток 2-аминоэтансульфоновой кислоты), C9O5NSH10 (остаток 7-аминоцефалоспориновой кислоты), C9ON2H11 (остаток 1-фенил-2,3-диметил-4-аминопиразолона-5 (4-аминоантипирина), а также остатки сульфаниламидных препаратов, содержащих свободную аминогруппу, таких как C6H4SO2NH2 (остаток п-бензолсульфамида), C6H4SO2N(Na)COCH, (остаток п-аминобензолсульфацетамид-натрия).
| Таблица |
| Характеристика аминосодержащих соединений RNH2 |
Характеристика конъюгатов альгиновой кислоты |
| Формула |
УФ-спектр: (Н2О,  max, нм) max, нм) |
Свойства |
УФ-спектр: (Н2О,  max, нм) max, нм) |
Химические сдвиги* протонов в остатках аминов, м.д. |
Свойства |
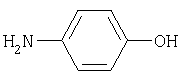
n-аминофенол (1) |
297 |
Производное n-аминофенола – N-ацетил-n-аминофенол (парацетамол) является противовоспалительным и жаропонижающим средством. |
253 |
7.1 и 7.5 уш.с |
противовоспалительные и антимикробные |
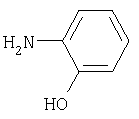
о-аминофенол (2) |
284 |
Участвует в метаболических путях триптофана |
281 и 308 |
7.1, 7.3 и 7.6 уш.с |
антимикробные |
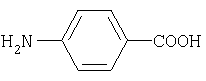
п-аминобензойная кислота(3) |
272 |
n-аминобензойная кислота является физиологическим веществом, необходимым для роста многих микроорганизмов (например, молочнокислых бактерий) и некоторых животных (например, цыплят); является витамином H1. n-аминобензойная кислота является антагонистом многих сульфамидов. Содержится в дрожжах, является компонентом пептидов с несколькими (6-11) остатками глютаминовой кислоты и участвует в построении молекулы фолиевой (птероилглутаминовой) кислоты. В виде эфиров применяется как местноанестезирующее средство (этиловый эфир n-аминобензойной кислоты – анестезин). В качестве действующего вещества (0.007%) входит в состав глазных капель «Актипол» с антивирусным, иммуномодулирующим (индуктор интерферона), радиопротекторным и репаративным действием. |
289 |
7.8 и 8.0 уш.с |
антивирусные, иммуномодулирующие, радиопротекторные и репаративные |
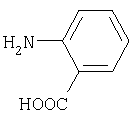
антраниловая кислота (4) |
259 и 303 |
Участвует в метаболизме триптофана. Производное антраниловой кислоты – препарат «мефенамовая кислота» (N-(2,3-диметилфенил)-антраниловая кислота) обладает анальгезирующей, жаропонижающей и противовоспалительной активностью (превосходит салицилаты). |
320 |
7.3, 7.6, 8.1 и 8.5 уш.с |
противовоспалительные |
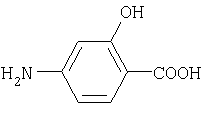
4-аминосалициловая кислота(5) |
265 и 299 |
В виде натриевой соли (ПАСК-натрий) – противотуберкулезное средство. |
267 и 304 |
6.9-7.5 уш. с |
противотуберкулезные |
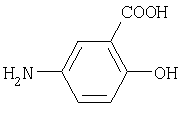
5-аминосалициловая кислота(6) |
301 |
Препарат «Месалазин». Применяется для лечения острого язвенного колита и болезни Крона. Как и ацетилсалициловая кислота, является ингибитором синтеза простагландинов и обладает противовоспалительной активностью. |
313 |
7.0, 7.7 и 8.1 уш. с |
противовоспалительные, антисептические, гемостатические |
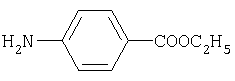
этиловый эфир n-аминобензойной кислоты (анестезин) (7) |
285 |
Является активным поверхностным местноанестезирующим средством. Широко используется в виде мазей, присыпок и других лекарственных форм для обезболивания. |
271 |
7.8 и 8.1 уш.с |
анестезирующие |
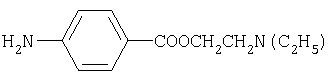  -диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин) (8) -диэтиламиноэтиловый эфир n-аминобензойной кислоты (новокаин) (8) |
291 |
Местноанестезирующее средство. Широко используется для местной анестезии, главным образом, для инфильтрационной и спинномозговой. Иногда также назначается для внутрикостной анестезии. |
274 |
7.8 и 8.1 уш.с |
анестезирующие |
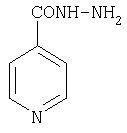
гидразид изоникотиновой кислоты (изониазид) (9) |
266 |
Противотуберкулезное средство. Также является составной частью раствора «Изонидез», применяемого как средство профилактики спаечной болезни после хирургических вмешательств на органах брюшной полости. |
263 |
8.0 и 8.9 уш.с |
противотуберкулезные |
Н2N-СН2СН2SO3Н
2-аминоэтансульфоновая кислота (таурин) (10) |
– |
Средство, регулирующее метаболические процессы. Способствует улучшению энергетических процессов, играет большую роль в обмене жиров, входит в состав парных желчных кислот (таурохолевой, тауродезоксихолевой), способствующих эмульгированию жиров в кишечнике. В мозге таурин играет роль нейромедиаторной аминокислоты, тормозящей синаптическую передачу, обладает противосудорожной активностью, оказывает кардиотропное действие. Характерной особенностью таурина является способность |
– |
** |
противовоспалительные и репаративные |
| |
|
стимулировать репаративные процессы при дистрофических нарушениях сетчатки глаза, травматических поражениях тканей глаза. |
|
|
|
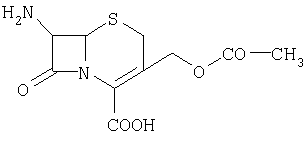
7-аминоцефалоспориновая кислота (11) |
262 |
Прекурсор для производства цефалоспориновых антибиотиков |
262 |
2.0 с (для метильных протонов СОСН3-группы) |
противомикробные |
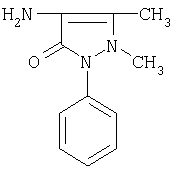
1-фенил-2,3-диметил-4-аминопиразолон-5(4-аминоантипирин) (12) |
245 и 281 |
1-фенил-2,3-диметил-4-аминопиразолон-5 (4-аминоантипирин) – структурный аналог анальгина, бутадиона (анальгезирующих и жаропонижающих средств). |
262 |
8.0 и 8.9 уш. с |
анальгезирующие |
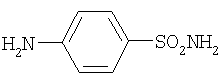
n-бензолсульфамид (стрептоцид) (13) |
259 |
Противомикробное средство. |
259 |
7.6 и 7.9 уш. с |
антимикробные |
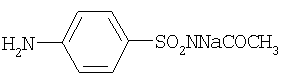
п-аминобензолсульфацетамид-натрий (сульфацил-натрий, альбуцид)(14) |
260 |
Противовирусное и противопаразитарное средство. Препарат эффективен при стрептоккоковых, гонококковых, пневмококковых и коли-бациллярных инфекциях. |
263 |
7.8 и 8.0 уш. с |
противовирусные и антимикробные |
* Кроме сигналов ароматических протонов, в спектрах конъюгатов альгиновой кислоты наблюдаются все сигналы, соответствующие остаткам аминосодержащих соединений (в таблице не приводятся).
** Конверсию карбоксигрупп АК, модифицированной таурином, определяли по содержанию серы. |
Пример 1. К смеси 29.7 мг (0.15 ммоль) альгината (АК) и 16.4 мг (0.15 ммоль) n-аминофенола в 15 мл Н2О добавляют 0.1 н. NaOH (или, если требуется, 0.1 н. HCl) до рН 4.7-4.8, затем при интенсивном перемешивании и температуре 20-22°С вносят 28.8 мг (0.15 ммоль) карбодиимида (соотношение реагентов АК:RNH2:EDC=1:1:1), поддерживая рН 4.7-4.8 титрованием 0.1 н. HCl. Через 0.5 ч к охлажденной до 0°С реакционной смеси последовательно добавляют 0.1 н. NaOH (до рН 7-8), 2-3 мл насыщенного раствора NaCl и 15-20 мл охлажденного этанола. Выпавший осадок отделяют центрифугированием, растворяют в 10 мл 6% NaCl, добавляют 10-15 мл этанола. Вновь выпавший осадок центрифугируют, промывают этанолом (10×3 мл), затем эфиром (10×3 мл) и сушат при температуре  60°С и пониженном давлении. Получают 30 мг конъюгата в виде белого порошка. Конверсия карбоксигрупп альгиновой кислоты в конъюгате с n-аминофенолом – 100%. 60°С и пониженном давлении. Получают 30 мг конъюгата в виде белого порошка. Конверсия карбоксигрупп альгиновой кислоты в конъюгате с n-аминофенолом – 100%.
Конверсию карбоксильных групп альгиновой кислоты определяют по данным 1Н-ЯМР-спектроскопии из соотношения приведенных к одному протону суммарных интенсивностей сигналов протонов, отвечающих остаткам аминов, и сигналов в области 3.5-4.5 м.д. (Н и ОН-групп пиранозного цикла альгиновой кислоты).
Спектры 1Н-ЯМР регистрировали для растворов в D2O на спектрометре Bruker АМХ-300 (рабочая частота для 1Н-ЯМР-300.13 МГц), в качестве внутреннего стандарта использовали натриевую соль 3-(триметилсилил)-1-пропансульфоновой кислоты. УФ-спектры получали на спектрофотометре Specord M-40. Контроль рН растворов проводили с помощью рН-метра «рН-340».
Пример 2-14. Реакцию альгиновой кислоты с соответствующим амином (2-14) и очистку продуктов проводят аналогично примеру 1. Конверсия карбоксигрупп альгиновой кислоты во всех случаях составляла 100%.
В таблице для каждого конъюгата АК приведены сигналы ароматических протонов (кроме таурина и 7-аминоцефалоспориновой кислоты), отвечающих остаткам аминов, относительно которых определяют конверсию карбоксигрупп альгиновой кислоты. Также приведены данные УФ-спектроскопии и охарактеризованы свойства конъюгатов.
Формула изобретения
Способ получения конъюгатов альгиновой кислоты (АК) путем ее взаимодействия с аминосодержащими соединениями в водной среде, рН 4,7-4,8, в присутствии конденсирующего реагента 1-этил-3-[3-(диметиламино)пропил]карбодиимида (EDC), отличающийся тем, что в качестве аминосодержащих веществ используют соединения общей формулы RNH2, где R=С6Н4OH (остатки n- или о-аминофенола), С6H4СООН (остатки n-аминобензойной или антраниловой кислот), С6Н3(ОН)СООН (остатки 4- или 5-аминосалициловых кислот), С6Н4СООС2Н5 (остаток этилового эфира n-аминобензойной кислоты), C6H4COO(CH2)2N(C2H5)2 (остаток  -диэтиламиноэтилового эфира n-аминобензойной кислоты), C5H4NCONH (остаток гидразида изоникотиновой кислоты), CH2СН2SO3Н (остаток 2-аминоэтансульфоновой кислоты), C9O5NSH10 (остаток 7-аминоцефалоспориновой кислоты), C9ON2H11 (остаток 1-фенил-2,3-диметил-4-аминопиразолона-5(4-аминоантипирина), а также остатки сульфаниламидных препаратов, содержащих свободную аминогруппу, таких как C6H4SO2NH2 (остаток n-бензолсульфамида), C6H4SO2N(Na)COCH3 (остаток n-аминобензолсульфацетамид-натрия) при мольном соотношении реагентов AK:RNH2:EDC=1:1:1. -диэтиламиноэтилового эфира n-аминобензойной кислоты), C5H4NCONH (остаток гидразида изоникотиновой кислоты), CH2СН2SO3Н (остаток 2-аминоэтансульфоновой кислоты), C9O5NSH10 (остаток 7-аминоцефалоспориновой кислоты), C9ON2H11 (остаток 1-фенил-2,3-диметил-4-аминопиразолона-5(4-аминоантипирина), а также остатки сульфаниламидных препаратов, содержащих свободную аминогруппу, таких как C6H4SO2NH2 (остаток n-бензолсульфамида), C6H4SO2N(Na)COCH3 (остаток n-аминобензолсульфацетамид-натрия) при мольном соотношении реагентов AK:RNH2:EDC=1:1:1.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 17.06.2007
Извещение опубликовано: 10.02.2009 БИ: 04/2009
|
|