|
(21), (22) Заявка: 2005109767/04, 04.04.2005
(24) Дата начала отсчета срока действия патента:
04.04.2005
(46) Опубликовано: 27.08.2006
(15) Информация о коррекции:
Версия коррекции № 1 (
Ia R=Н, R1-Н; Iб R=Br, R1=Н; Iв R=Cl, R1=Н; Iг R=Н, R1=Br; Iд R=Н, R1=CL; Ie R=-0-CH3, R1=H,
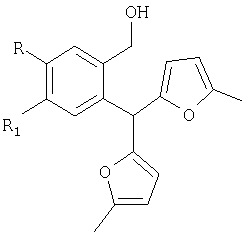
заключающийся в образовании конденсированной тетрациклической системы в результате последовательного протекания реакций рециклизации фуранового кольца производных 2-бис(5-метил-2-фурил)метил) фенилметанола и вторичной циклизации образующегося изохроменового кетона, при кипячении раствора производных 2-бис(5-метил-2-фурил)метил)фенилметанола.
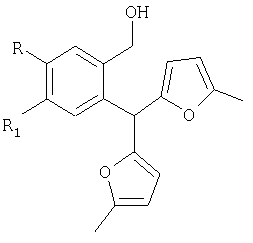
в этаноле в присутствии спиртового раствора хлороводорода в течение 15-40 минут. Технический результат – получение новых производных изохроменов, обладающих потенциальной противовоспалительной активностью. 2 табл.
Изобретение относится к области органической химии – синтезу гетероциклических соединений – тетрациклических производных изохроменов.
Изобретение относится к разработке способа получения 1,11-диалкил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохроменов общей формулы I, которые могут найти применение как вещества, обладающие потенциальной противовоспалительной активностью [E.F. da Silva, E.J. Barreiro. J.Braz. Chem. Soc. 1993, vol.4, №1, 40-44.], а также в качестве анальгетиков [M.R.L. Santos, E.J. Barreiro, R. Braz-Filho and A.L.P. Miranda, J. Braz. Chem. Soc. 1997, vol.8, №5, 471-478.
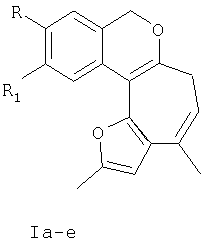
Ia R=H, R1=H; Iб R=Br, R1=H; Iв R=Cl, R1=H; Iг R=H, R1=Br; Iд R=H, R1=Cl; Ie R=-O-СН3, R1=H.
Синтез веществ подобной структуры в литературе не описан.
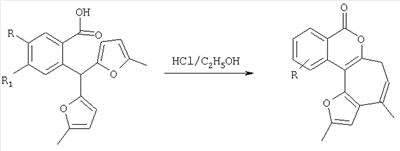
Нами предложен метод синтеза производных изохромена рециклизацией 2-бис(5-метил-2-фурил)метил)фенилметанолов в аналогичных условиях.
Задача изобретения – разработка способа получения тетрациклических производных изохромена – 1,11-диалкил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохроменов I, снижение времени конверсии исходного вещества, уменьшение осмоления реакционной массы и, как следствие, повышение выхода целевых продуктов.
Поставленная задача решается таким образом, что способ получения 1,11-диалкил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохроменов общей формулы I,
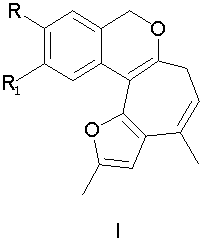
включающий образование конденсированной тетрациклической системы в результате последовательного протекания реакций рециклизации фуранового кольца производных 2-бис(5-метил-2-фурил)метил)фенилметанола и вторичной циклизации образующегося изохроменового кетона, осуществляют при кипячении раствора производных 2-бис(5-метил-2-фурил)метил)фенилметанола в этаноле в присутствии спиртового раствора хлороводорода в течение 15-40 минут.
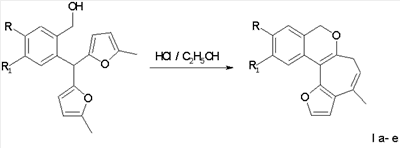
Ia R=H, R1=H; Iб R=Br, R1=H; Iв R=Cl, R1=H; Iг R=H, R1=Br; Iд R=H, R1=Cl; Ie R=-O-СН3, R1=H.
Применение в качестве растворителя этанола объясняется лучшей растворимостью в нем исходных соединений.
Использование в качестве кислотного катализатора этанола, насыщенного хлороводородом, дает возможность поддерживать необходимую концентрацию кислого катализатора в ходе реакции, тем самым снизить осмоление реакционной массы.
С целью сокращения времени конверсии исходного вещества, снижения степени осмоления реакционной смеси за счет уменьшения времени контакта с кислым катализатором и увеличения выхода целевого продукта целесообразно проводить реакцию при более высокой температуре (табл.1, пп.1-5)
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Индивидуальность и строение синтезированных соединений I подтверждены данными ПМР-спектроскопии и элементного анализа.
Примеры осуществления заявляемого способа получения 1,11-диалкил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохроменов I:
Пример 1.
1,11-диметил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохромен (Ia)
13 г (0,046 моль) 2-ди(5-метил-2-фурил)метилфенилметанола растворяют в 150 мл этанола и добавляют 60 мл раствора HCl в этаноле (100 г HCl (газ) на 200 г этанола). Смесь термостатируют при 20°С в течение 10 ч. По окончании реакции (контроль ТСХ) реакционную смесь выливают в воду и нейтрализуют NaHCO3, экстрагируют CH2Cl2. Экстракт сушат над Na2SO4 и упаривают досуха при пониженном давлении. Масло растворяют в 100-150 мл петролейного эфира, добавляют активированный уголь и пропускают через слой силикагеля. Раствор оставляют кристаллизоваться при температуре ниже 0°С. Выход 37% (4,3 г) соединения Ia.
tпл=92-93°С.
Найдено для C18H16О2,%: С 81,82; Н 6,13; О 12,09; вычислено: С 81,79; Н 6,10; О 12,11.
ПМР спектр (250 МГц, CDCl3,): 2.06 (с, 3Н, СН3), 2.46 (с, 3Н, СН3), 2.68 (д, J=6.7 Hz, 2Н, СН2), 5.02 (с, 2Н, СН2), 5.29 (t, J=6.7 Hz, 1H,=CH), 6.23 (с, 1H, HFur), 7.05-7.09 (м, 1H, НAr), 7.15-7.22 (м, 1H, НAr), 7.29-7.36 (м, 1Н,НAr), 7.97-8.01 (м, 1Н, НАг).
Пример 2.
1,11-диметил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохромен (1а) получают аналогичным образом, используя 13 г (0,046 моль) 2-ди(5-метил-2-фурил)метилфенилметанола и 150 мл этанола при добавлении 60 мл раствора HCl в этаноле (100 г на 200 г). Смесь термостатируют при t=35°С в течение 6 ч. Выход продукта реакции в этом случае составляет 40% (4,6 г).
Пример 3.
1,11-диметил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохромен (1а) получают аналогичным образом, используя 13 г (0,046 моль) 2-ди(5-метил-2-фурил)метилфенилметанола и 150 мл этанола при добавлении 60 мл раствора HCl в этаноле (100 г на 200 г). Смесь термостатируют при t=55°С в течение 1,5 ч. Выход продукта реакции в этом случае составляет 44% (5,1 г).
Пример 4.
1,11-диметил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохромен (la) получают аналогичным образом, используя 13 г (0,046 моль) 2-ди(5-метил-2-фурил)метилфенилметанола и 150 мл этанола при добавлении 60 мл раствора HCl в этаноле (100 г на 200 г). Смесь термостатируют при 1=65°С в течение 0,4 ч. Выход продукта реакции в этом случае составляет 53% (6,1 г).
Пример 5.
1,11-диметил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохромен (Ia) получают аналогичным образом, используя 13 г (0,046 моль) 2-ди(5-метил-2-фурил)метилфенилметанола и 150 мл этанола при добавлении 60 мл раствора HCl в этаноле (100 г на 200 г). Смесь кипятят в течение 0,25 ч. Выход продукта реакции в этом случае составляет 58% (6,7 г).
В таблице 1 приведены данные о влиянии температуры проведения реакции на выход 1,11-диметил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохромена (1а) и время конверсии исходного 2-ди(5-метил-2-фурил)метилфенилметанола (примеры 1-5).
| Таблица 1 |
| № |
Температура реакции, °С |
Время конверсии исходного спирта, 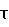 ч ч |
Выход продукта реакции, % |
| 1 |
20 |
10,0 |
37 |
| 2 |
35 |
6,0 |
40 |
| 3 |
55 |
1,5 |
44 |
| 4 |
65 |
0,40 |
53 |
| 5 |
кипение |
0,25 |
58 |
Как видно из таблицы, при повышении температуры выход целевого продукта повышается, так как уменьшается время конверсии исходного вещества и снижается степень осмоления реакционной смеси.
Таким образом, оптимальный выход 1,11-диметил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохромена (Ia) достигается при проведении реакции при кипячении. Общая продолжительность реакции составляет 15 мин.
Заявляемым способом получен ряд 1,11-диалкил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохроменов Iб-е, выходы, температуры плавления и спектральные характеристики которых приведены в таблице 2.
Таблица 2
Выходы и физико-химические характеристики 1,11-диалкил-3,5-дигидрофуро[2′,3′:3,4]циклогепта[с]изохроменов Iб-е |
| № |
Заместители |
Выход, % |
Время реакции, мин. |
tпл, °C |
Найдено, % Вычислено, % |
ПМР-спектр (250 МГц, CDCl3), 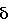 (м.д.), КССВ (J, Гц) (м.д.), КССВ (J, Гц) |
| |
| R |
R1 |
С |
Н |
Hal |
| Iб |
Br |
Н |
40,0 |
20 |
92-93 |
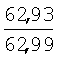 |
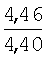 |
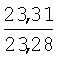 |
2.05 (с, 3Н, СН3), 2.44 (с, 3Н, СН3), 2.66 (д, J=6.7 Hz, 2Н, СН2), 4.97 (с, 2Н, CH2), 5.28 (т, J=6.7 Hz, 1H, =СН), 6.22 (с, 1H, HFur), 7.21 (д, J=2.1 Hz, 1H, HAr), 7.43 (д.д, J=2.1, 8.4 Hz, 1H, НAr), 7.87 (д, J=8.4 Hz, 1Н,HAr) |
| Iв |
Cl |
Н |
42,0 |
20 |
110-112 |
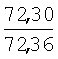 |
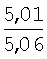 |
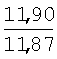 |
2.05 (с, 3Н, СН3), 2.44 (с, 3Н, СН3), 2.66 (д, J=6.7 Hz, 2Н, СН2), 4.97 (с, 2Н, СН2), 5.28 (т, J=6.7 Hz, 1H,=СН), 6.23 (с, 1H, HFur), 7.06 (д, J=2.2 Hz, 1H, НAr), 7.28 (д.д, J=2.2, 8.4 Hz, 1H, НAr), 7.93 (д, J=8.4 Hz, 1Н,HAr) |
| Iг |
Н |
Br |
36,8 |
40 |
120-121 |
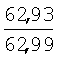 |
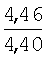 |
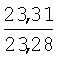 |
2.05 (с, 3Н, СН3), 2.46 (с, 3Н, СН3), 2.66 (д, J=6.7 Hz, 2Н, CH2), 4.96 (с, 2Н, СН3), 5.27 (т, J=6.7 Hz, 1H,=СН), 6.22 (с, 1H, HFur), 6.92 (д. J=7.9 Hz, 1H, НAr), 7.30 (д.д, J=1.6, 7.9 Hz, 1H, НAr), 8.12 (д, J=1.6 Hz, 1Н,НAr) |
| Iд |
Н |
Cl |
39,8 |
40 |
99-101 |
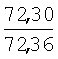 |
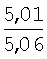 |
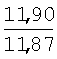 |
2.05 (с, 3Н, СН3), 2.44 (с, 3Н, СН3), 2.66 (д, J=6.7 Hz, 2Н, СН2), 4.98 (с, 2Н, СН2), 5.27 (т, J=6.7 Hz, 1H,=СН), 6.23 (с, 1H, HFur), 6.98 (д, J=7.9 Hz, 1H, HAr), 7.14 (д.д,.7=2.0, 7.9 Hz, 1H, НAr), 7.9 (д,.7=2.0 Hz, 1H, НAr) |
| Ie |
-O-СН3 |
Н |
70,0 |
20 |
89-90 |
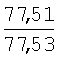 |
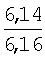 |
|
2.05 (с, 3Н, СН3), 2.44 (с, 3Н, СНз), 2.65 (д,.7=6.7 Hz, 2Н, СН2), 3.82 (с, 3Н, ОСН3), 4.99 (с, 2Н, СН2), 5.28 (т,.7=6.7 Hz, 1H,=СН), 6.22 (с, 1H, HFur), 6.64 (д,.7=2.6 Hz, 1H, НAr), 6.87 (д.д, 7=2.6, 8.6 Hz, 1H, НAr), 7.93 (д, J=8.6 Hz, 1H, HAr) |
Формула изобретения
Способ получения 1,11 -диалкил-3,5-дигидрофуро-[2′,3′:3,4]циклогепта[с]изохроменов I общей формулы
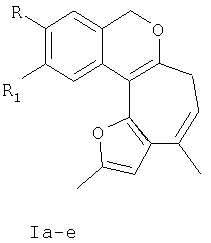
Ia R=H, R1-H; Iб R=Br, R1=H; Iв R=Cl, R1=H; Iг R=H, R1=Br; Iд R=H, R1=Cl; Ie R=-O-CH3, R1=Н,
заключающийся в образовании конденсированной тетрациклической системы в результате последовательного протекания реакций рециклизации фуранового кольца производных 2-бис(5-метил-2-фурил)метил) фенилметанола и вторичной циклизации образующегося изохроменового кетона при кипячении раствора производных 2-бис(5-метил-2-фурил)метил)фенилметанола
в этаноле в присутствии спиртового раствора хлороводорода в течение 15-40 мин.
TH4A – Переиздание описаний изобретений к патентам Российской Федерации
Причина переиздания: Коррекция текстов реферата, описания и формулы изобретения
Извещение опубликовано: 20.01.2007 БИ: 02/2007
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 05.04.2007
Извещение опубликовано: 20.07.2008 БИ: 20/2008
|
|