Патент на изобретение №2156255
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ПРЕГНАНОВ
(57) Реферат: Изобретение относится к области органического синтеза. Описывается синтез стероидных лекарственных препаратов из стеринов растительного и животного происхождения. Способ получения прегнанов заключается в том, что цианированные производные 17-кетостероидов подвергают защите 17  -OH-группы и алкилированию 17 СN-группы с последующим гидролизом. В качестве 17-кетостероидов используют 3,17-дикетоандростаны общей формулы -OH-группы и алкилированию 17 СN-группы с последующим гидролизом. В качестве 17-кетостероидов используют 3,17-дикетоандростаны общей формулы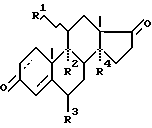 где R1 –  или или  -OH-группа или атом Н, R2– H или ОН-группа или вместо R1 и R2 двойная связь, R3 – Н или СН3-группа, R4 – Н или ОН-группа. Перед алкилированием осуществляют защиту 3-кетогруппы с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя. Для защиты 17 -OH-группа или атом Н, R2– H или ОН-группа или вместо R1 и R2 двойная связь, R3 – Н или СН3-группа, R4 – Н или ОН-группа. Перед алкилированием осуществляют защиту 3-кетогруппы с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя. Для защиты 17 -OH группы в качестве защитной группы используют алкилвиниловый эфир. Способ позволяет повысить выход основного продукта. 1 з.п. ф-лы. -OH группы в качестве защитной группы используют алкилвиниловый эфир. Способ позволяет повысить выход основного продукта. 1 з.п. ф-лы.
Изобретение относится к области органического синтеза, а именно к синтезу стероидных лекарственных препаратов из стеринов растительного и животного происхождения. 17-Кетостероиды – ключевые полупродукты в синтезе стероидных лекарственных препаратов из стеринов растительного и животного происхождения (ситостерина или холестерина), которые являются наиболее доступным и дешевым источником стероидного сырья. Известно несколько стереоселективных способов получения прегнанов, но наибольший интерес представляют ацетиленовый и циангидринный методы. Ацетиленовый синтез заключается в конденсации 17-кетостероидов с ацетиленидами щелочных металлов избирательно по 17-кетогруппе с последующим превращением образовавшейся 17  -этинильной группы в оксипрегнановую или диоксиацетоновую боковую цепь (Nitta Y. et al. Bull. Chem. Soc. Ypn. 1985, 58 (3), 981 – 986; Tetrahedron Lett., 1980, v. 21, p. 2665 – 2666).
Циангидринный синтез как метод введения боковой прегнановой цепи в замещенные 17-кетостероиды в последние годы приобрел больший интерес (патент ГДР N 147669, 1997; US 4.500.461, 1985).
Наиболее близким к предложенному является способ получения прегнанов, заключающийся в том, что цианированные производные 17-кетостероидов подвергают защите 17 -этинильной группы в оксипрегнановую или диоксиацетоновую боковую цепь (Nitta Y. et al. Bull. Chem. Soc. Ypn. 1985, 58 (3), 981 – 986; Tetrahedron Lett., 1980, v. 21, p. 2665 – 2666).
Циангидринный синтез как метод введения боковой прегнановой цепи в замещенные 17-кетостероиды в последние годы приобрел больший интерес (патент ГДР N 147669, 1997; US 4.500.461, 1985).
Наиболее близким к предложенному является способ получения прегнанов, заключающийся в том, что цианированные производные 17-кетостероидов подвергают защите 17 -OH-группы, защите 3-кетогруппы и алкилированию 17 CN-группы с последующим гидролизом, приводящим к образованию 17 -OH-группы, защите 3-кетогруппы и алкилированию 17 CN-группы с последующим гидролизом, приводящим к образованию 17 – гидроксипрегнановой боковой цепи (JP 62296, 1982, СО 7 J 7/00).
В данном способе защита 3-кетогруппы осуществляется образованием 3,3-этилендиоксикеталя, поэтому используемая в синтезе реакция алкилирования сопровождается алкилированием по 3-му положению, что приводит к образованию побочного продукта.
Техническим результатом, достигаемым в предложенном способе, является увеличение выхода целевого продукта путем снижения вероятности протекания побочной реакции.
Технический результат достигается тем, что в способе получения прегнанов, заключающемся в том, что цианированные производные 17-кетостероидов подвергают защите 17 – гидроксипрегнановой боковой цепи (JP 62296, 1982, СО 7 J 7/00).
В данном способе защита 3-кетогруппы осуществляется образованием 3,3-этилендиоксикеталя, поэтому используемая в синтезе реакция алкилирования сопровождается алкилированием по 3-му положению, что приводит к образованию побочного продукта.
Техническим результатом, достигаемым в предложенном способе, является увеличение выхода целевого продукта путем снижения вероятности протекания побочной реакции.
Технический результат достигается тем, что в способе получения прегнанов, заключающемся в том, что цианированные производные 17-кетостероидов подвергают защите 17 -OH- группы, защите 3-кетогруппы и алкилированию 17 CN-группы с последующим гидролизом, в качестве 17-кетостероидов используют 3,17-дикетоандростаны общей формулы -OH- группы, защите 3-кетогруппы и алкилированию 17 CN-группы с последующим гидролизом, в качестве 17-кетостероидов используют 3,17-дикетоандростаны общей формулы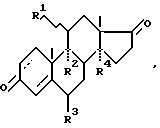 где R1 –  – или – или  -OH-группа или атом H, -OH-группа или атом H,R2 – H или ОН-группа или вместо R1 и R2 – двойная связь, R3 – H или CH3-группа, R4 – H или ОН-группа, a защиту 3-кетогруппы осуществляют с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя. Кроме того, для защиты 17  -ОН-группы можно использовать алкилвиниловый эфир.
Защита -ОН-группы можно использовать алкилвиниловый эфир.
Защита  4-3-кетогруппы может быть осуществлена образованием енол-эфира (метилового или этилового), или кеталя (как в прототипе), или енамина. При этом наиболее предпочтительным кеталем был признан этиленкеталь [US 4500461] . Однако при этом защита 3-кетогруппы обеспечивается образованием пятичленного 1,3-диоксоланового цикла. Пятичленный цикл является несколько более напряженным, чем шестичленный (ДЖ.Марч. Органическая химия, T.1, с. 192, Изд-во “Мир”, М. 1987). Кроме того, известно, что алкилирование CN-группы 17-циангидрина с защитой 3-кетогруппы этиленкеталем, а 17-ОН-группы триметилсилиловым эфиром, требует достаточно жестких условий (длительное кипячение в тетрагидрофуране (ТГФ) или применение высококипящих растворителей (например, анизола) и сопровождается побочной реакцией по 1, 3-диоксолановому кольцу с образованием продукта его расщепления по C-O-связи 3 4-3-кетогруппы может быть осуществлена образованием енол-эфира (метилового или этилового), или кеталя (как в прототипе), или енамина. При этом наиболее предпочтительным кеталем был признан этиленкеталь [US 4500461] . Однако при этом защита 3-кетогруппы обеспечивается образованием пятичленного 1,3-диоксоланового цикла. Пятичленный цикл является несколько более напряженным, чем шестичленный (ДЖ.Марч. Органическая химия, T.1, с. 192, Изд-во “Мир”, М. 1987). Кроме того, известно, что алкилирование CN-группы 17-циангидрина с защитой 3-кетогруппы этиленкеталем, а 17-ОН-группы триметилсилиловым эфиром, требует достаточно жестких условий (длительное кипячение в тетрагидрофуране (ТГФ) или применение высококипящих растворителей (например, анизола) и сопровождается побочной реакцией по 1, 3-диоксолановому кольцу с образованием продукта его расщепления по C-O-связи 3 -метил-3 -метил-3 -(оксиэтокси)-прегн-5-ен-17 -(оксиэтокси)-прегн-5-ен-17 -ол-20-она с высоким выходом (Е.В. Попова, В. А. Андрюшина, Г.С.Гриненко “Синтез производных прогнана”, Химия природных соединений (ХПС), 1984, 3, с. 324 – 327).
С учетом изложенного в предложенном способе применена защита -ол-20-она с высоким выходом (Е.В. Попова, В. А. Андрюшина, Г.С.Гриненко “Синтез производных прогнана”, Химия природных соединений (ХПС), 1984, 3, с. 324 – 327).
С учетом изложенного в предложенном способе применена защита  4-3-кетогруппы в стероидной молекуле с образованием 1, 3-диоксана, а именно незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя, с помощью, например, 2,2-диметил-1,3-пропандиола (неопентилгликоля).
Образование 1,3-диоксана более предпочтительно в качестве защитной группировки, так как протекает легче с образованием термодинамически более выгодной структуры: выход пятичленного циклического кеталя составляет 84,2% [ХПС N 4 (1984), с. 324], а по предложенному способу – 95 – 98%.
При этом предложенная защита более устойчива в условиях проведения реакций алкилирования и позволяет проводить эти реакции как в мягких условиях с применением метиллития в качестве метилирующего агента, так и в более жестких условиях реакции Гриньяра. При этом предложенная 1,3-диоксановая защита имеет значительное преимущество в выходе целевого продукта: выход 17-гидроксипрогестерона с применением 1,3-диоксолановой защиты составляет 88,5% [Ряховская М.И. и др. Химико-фармацевтический журнал (ХФЖ), 1987, 21 (4), с. 478 -481] , в прототипе – 95,7%, а 1,3- диоксановой защиты по предложенному способу – 99,4%.
В конце описпния приведена схема получения прегнана (17 4-3-кетогруппы в стероидной молекуле с образованием 1, 3-диоксана, а именно незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя, с помощью, например, 2,2-диметил-1,3-пропандиола (неопентилгликоля).
Образование 1,3-диоксана более предпочтительно в качестве защитной группировки, так как протекает легче с образованием термодинамически более выгодной структуры: выход пятичленного циклического кеталя составляет 84,2% [ХПС N 4 (1984), с. 324], а по предложенному способу – 95 – 98%.
При этом предложенная защита более устойчива в условиях проведения реакций алкилирования и позволяет проводить эти реакции как в мягких условиях с применением метиллития в качестве метилирующего агента, так и в более жестких условиях реакции Гриньяра. При этом предложенная 1,3-диоксановая защита имеет значительное преимущество в выходе целевого продукта: выход 17-гидроксипрогестерона с применением 1,3-диоксолановой защиты составляет 88,5% [Ряховская М.И. и др. Химико-фармацевтический журнал (ХФЖ), 1987, 21 (4), с. 478 -481] , в прототипе – 95,7%, а 1,3- диоксановой защиты по предложенному способу – 99,4%.
В конце описпния приведена схема получения прегнана (17 -гидроксипрогестерона) из андростендиона (АД).
Примеры получения прогестерона из АД.
Пример 1. Получение 17 -гидроксипрогестерона) из андростендиона (АД).
Примеры получения прогестерона из АД.
Пример 1. Получение 17 -гидрокси-17 -гидрокси-17 -цианандрост-4ен-3-она (II).
К раствору 1,63 г NaOH в 280 мл метанола добавляют 100 г андростендиона (I). Суспензию нагревают до 40oC и добавляют последовательно 13,8 мл воды и 47,8 мл ацетонциангидрина. Реакционную массу выдерживают при температуре 35 – З6oC в течение часа и добавляют медленно по каплям 59 мл воды, затем выдерживают при комнатной температуре. По окончании реакции добавляют медленно 217 мл воды и выдерживают 2 часа при комнатной температуре. Осадок отфильтровывают, промывают на фильтре смесью воды и метанола (2:1 соответственно) и водой до рН 7.
Получают 104,45 г соединения (II) с выходом 95,5%, с температурой плавления 174 – 176oC.
Пример 2. Получение 17 -цианандрост-4ен-3-она (II).
К раствору 1,63 г NaOH в 280 мл метанола добавляют 100 г андростендиона (I). Суспензию нагревают до 40oC и добавляют последовательно 13,8 мл воды и 47,8 мл ацетонциангидрина. Реакционную массу выдерживают при температуре 35 – З6oC в течение часа и добавляют медленно по каплям 59 мл воды, затем выдерживают при комнатной температуре. По окончании реакции добавляют медленно 217 мл воды и выдерживают 2 часа при комнатной температуре. Осадок отфильтровывают, промывают на фильтре смесью воды и метанола (2:1 соответственно) и водой до рН 7.
Получают 104,45 г соединения (II) с выходом 95,5%, с температурой плавления 174 – 176oC.
Пример 2. Получение 17 -гидрокси-3,3(2,2-диметилпропилендиокси)-андрост-5 ен-17 -гидрокси-3,3(2,2-диметилпропилендиокси)-андрост-5 ен-17 -(карбонитрила (III).
Суспензию 104,45 г соединения (II) в 522 мл хлористого метилена охлаждают до температуры 0…-5oC и в токе азота добавляют последовательно 105 мл триэтилового эфира ортомуравьиной кислоты, 156,7 г неопентилгликоля и 15,67 г п-толуолсульфокислоты. Реакционную массу перемешивают в течение 8 часов. По окончании реакции медленно добавляют раствор 68,3 г гидрокарбоната натрия в 1,3 л воды. Суспензию охлаждают до температуры 0… +5oC и выдерживают в течение часа. Осадок отфильтровывают, промывают водой до pH 7.
Получают 130,52 г хроматографически чистого соединения (III) с выходом 98% с температурой плавления 252oC (с разложением).
Пример 3. Получение 17 -(карбонитрила (III).
Суспензию 104,45 г соединения (II) в 522 мл хлористого метилена охлаждают до температуры 0…-5oC и в токе азота добавляют последовательно 105 мл триэтилового эфира ортомуравьиной кислоты, 156,7 г неопентилгликоля и 15,67 г п-толуолсульфокислоты. Реакционную массу перемешивают в течение 8 часов. По окончании реакции медленно добавляют раствор 68,3 г гидрокарбоната натрия в 1,3 л воды. Суспензию охлаждают до температуры 0… +5oC и выдерживают в течение часа. Осадок отфильтровывают, промывают водой до pH 7.
Получают 130,52 г хроматографически чистого соединения (III) с выходом 98% с температурой плавления 252oC (с разложением).
Пример 3. Получение 17 -гидроксипрогестерона (V).
К суспензии 130,52 г соединения (III) и 2, 61 г п-толуолсульфокислоты в 1,175 л тетрагидрофурана в токе сухого азота при комнатной температуре добавляют 130,52 мл винилэтилового эфира. Суспензию перемешивают до растворения осадка и добавляют 3, 26 мл триэтиламина (pH 8). Реакционную массу охлаждают до температуры – 30oC и медленно по каплям добавляют 784 мл 1,4 М раствора метиллития в эфире. Реакционную массу медленно подогревают до комнатной температуры и перемешивают в течение 2 часов. По окончании реакции реакционную смесь охлаждают до температуры 0… +5oC и добавляют медленно по каплям смесь 260 мл соляной кислоты, 260 мл воды и 650 мл метанола (pH 2). Реакционную массу перемешивают до окончания реакции гидролиза кетальной группы при C-3 и затем разбавляют 1,83 л воды. По окончании выдержки (1 час при комнатной температуре) осадок отфильтровывают.
После перекристаллизации из ацетона с углем получают 107,3 г соединения (V) с выходом 99,4%, с температурой плавления 234oC.
Пример 4. Получение 17 -гидроксипрогестерона (V).
К суспензии 130,52 г соединения (III) и 2, 61 г п-толуолсульфокислоты в 1,175 л тетрагидрофурана в токе сухого азота при комнатной температуре добавляют 130,52 мл винилэтилового эфира. Суспензию перемешивают до растворения осадка и добавляют 3, 26 мл триэтиламина (pH 8). Реакционную массу охлаждают до температуры – 30oC и медленно по каплям добавляют 784 мл 1,4 М раствора метиллития в эфире. Реакционную массу медленно подогревают до комнатной температуры и перемешивают в течение 2 часов. По окончании реакции реакционную смесь охлаждают до температуры 0… +5oC и добавляют медленно по каплям смесь 260 мл соляной кислоты, 260 мл воды и 650 мл метанола (pH 2). Реакционную массу перемешивают до окончания реакции гидролиза кетальной группы при C-3 и затем разбавляют 1,83 л воды. По окончании выдержки (1 час при комнатной температуре) осадок отфильтровывают.
После перекристаллизации из ацетона с углем получают 107,3 г соединения (V) с выходом 99,4%, с температурой плавления 234oC.
Пример 4. Получение 17 -гидрокси-3,3(2,2-диметилпропилендиокси)-прегн-5-ен-20-она (VI).
Реакцию метилирования соединения (III) (20 г) проводят в условиях примера 3. По окончании реакции реакционную массу охлаждают до температуры 0… +5oC, добавляют медленно по каплям смесь 0,6 мл соляной кислоты и 0,6 мл воды, затем разбавляют 180 мл воды и перемешивают в течение часа. Осадок отфильтровывают.
После перекристаллизации из хлористого метилена с углем получают 20,64 г хроматографически чистого соединения (V) с выходом 99%.
Пример 5. Получение 17 -гидрокси-3,3(2,2-диметилпропилендиокси)-прегн-5-ен-20-она (VI).
Реакцию метилирования соединения (III) (20 г) проводят в условиях примера 3. По окончании реакции реакционную массу охлаждают до температуры 0… +5oC, добавляют медленно по каплям смесь 0,6 мл соляной кислоты и 0,6 мл воды, затем разбавляют 180 мл воды и перемешивают в течение часа. Осадок отфильтровывают.
После перекристаллизации из хлористого метилена с углем получают 20,64 г хроматографически чистого соединения (V) с выходом 99%.
Пример 5. Получение 17 -гидроксипрогестерона (V).
К раствору 20 г соединения (Vl) в смеси 400 мл этанола и 100 мл хлористого метилена при перемешивании и комнатной температуре добавляют медленно по каплям смесь 2,5 мл соляной кислоты и 2,5 мл воды (pH 2). По окончании реакции реакционную массу упаривают в вакууме до объема 300 мл. К остатку при перемешивании и комнатной температуре добавляют 600 мл воды. Суспензию охлаждают до температуры 0…+5oC и выдерживают в течение 2 часов. Осадок отфильтровывают, промывают на фильтре водой до pH 7.
Получают 15,5 г соединения (V) с выходом 98%, с температурой плавления 232-233oC. -гидроксипрогестерона (V).
К раствору 20 г соединения (Vl) в смеси 400 мл этанола и 100 мл хлористого метилена при перемешивании и комнатной температуре добавляют медленно по каплям смесь 2,5 мл соляной кислоты и 2,5 мл воды (pH 2). По окончании реакции реакционную массу упаривают в вакууме до объема 300 мл. К остатку при перемешивании и комнатной температуре добавляют 600 мл воды. Суспензию охлаждают до температуры 0…+5oC и выдерживают в течение 2 часов. Осадок отфильтровывают, промывают на фильтре водой до pH 7.
Получают 15,5 г соединения (V) с выходом 98%, с температурой плавления 232-233oC.
Формула изобретения
 -OH-группы, защите 3-кетогруппы и алкилированию 17 CN-группы с последующим гидролизом, отличающийся тем, что в качестве 17-кетостероидов используют 3,17-дикетоандростаны общей формулы -OH-группы, защите 3-кетогруппы и алкилированию 17 CN-группы с последующим гидролизом, отличающийся тем, что в качестве 17-кетостероидов используют 3,17-дикетоандростаны общей формулы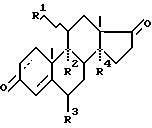 где R1 –  – или – или  -OH-группа или атом Н; -OH-группа или атом Н;R2 – Н или ОН-группа или вместо R1 и R2 – двойная связь; R3 – Н или СН3-группа; R4 – Н или ОН-группа, а защиту 3-кетогруппы осуществляют с помощью незамещенного, или 2-замещенного, или 2,2-дизамещенного пропиленкеталя. 2. Способ по п.1, отличающийся тем, что для защиты 17  -OH-группы в качестве защитной группы используют алкилвиниловый эфир. -OH-группы в качестве защитной группы используют алкилвиниловый эфир.
РИСУНКИ
|
||||||||||||||||||||||||||
