Патент на изобретение №2156237
|
||||||||||||||||||||||||||
(54) ИНГИБИТОРЫ ПРОЦЕССОВ, СВЯЗАННЫХ С DР-IV
(57) Реферат: Описываются ингибиторы процессов, связанных с DP-IV, выбранные из соединений с общей формулой А-В (группа I), где В означает формулу (I), n равно 1 или 2; m равно 0, 1 или 2; X означает СН2, S, SO, SO2, О; Y означает N; R означает H, CN, СНО, В(ОН)2; А прикрепляется к Y, и а) когда R означает H, А является альфа-аминоацильной группой, полученной из альфа-аминокислоты, несущей циклоалифатическую боковую цепь, или представляет собой бета-аминоацильную группу общей формулы (II), где р принимает значения от 1 до 6, при этом кольцо в любом случае может содержать ненасыщенные связи и/или замещение гетероатомом; б) когда R означает CN, А соответствует определению, данному в (а), и, кроме того, может быть получен из любой L-альфааминокислоты, несущей липофильную боковую цепь, и в) когда R означает СНО или В(ОН)2, А означает бета-аминоацильную группу, определяемую в (а); (группа II): В, n, m, Х – как указано выше; R означает H, CN; А прикрепляется к Y, при этом А представляет собой (i), где а = 1-5; D означает G – (СН2)b – (R4) – R3; G означает NH или NMe; b = 1-12; q = 0 или 1; R4 означает Z – NH – (CH2)c или NH – Z – (CH2)c-, где с = 1-12; Z означает СО, СН2; R3 = СО2Н или его эфир, CONH2, CONR5R6, SO2NH2, SO2NR5R6, ОН, OR5, замещенный или незамещенный арил, NH2, NR5R6, NHCOR5, NHSO2R5, NH-CH(:NR5)NR5R6; R5 и R6 выбирают, независимо друг от друга, из Н, низших алкильных, фторалкильных групп, или R5 и R6 вместе с атомом азота, к которому они присоединены, составляют цепь C3-C8; или А представляет собой (ii), где R1 = Н, Me; Е = J-(СН2)b-(R4)q – R3; J = СО; a, b, q, R3 и R4 соответствуют определению, данному в (i), или представляет собой (iii), где R2 = Н, Me; L означает (CH2)d-(CO)г-(CH2)b-(R4)q-R3, где r = 1, d = 1-4; b, q, R3 и R4 соответствуют определению, данному в (i). Вышеописанные ингибиторы являются высокоактивными конкурентными ингибиторами DP-IV (со значениями К в диапазоне от 10-6 до 10-10), и характеризуются химической стабильностью (t1/2 > 24 ч). 3 з.п. ф-лы, 20 табл. 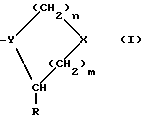 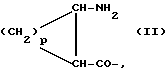 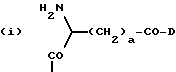 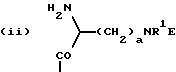 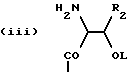
Предпосылки создания изобретения DP-IV (КФ 3.4.14.5) – связанная с мембраной сериновая протеаза – была впервые индентифицирована в почках крыс по ее способности расщеплять дипептиды на N-конце некоторых пептидов (Hopsu-Havu V.K. and Glenner G.G., Histochemie, 1966, 7, 197). Дипептиды при этом должны относиться к типу X-Pro или X-Ala, где X обозначает любую аминокислоту. Показано, что X-Пролин расщепляется более эффективно, чем X-Ala. DP-IV широко распространена в тканях млекопитающих, отмечены большие количества ее в почках, эпителии кишечника и плаценте (Yaron A. and Naider F. , Critical Reviews in Biochem. Mol. Biol., 1993, 28 (1). 31). В иммунной системе человека фермент экспрессируется практически только при активации T-лимфоцитов CD4 типа, в этом случае показано, что фермент синонимичен поверхностному антигену клеток CD26. Точная роль DP-IV в физиологии человека не совсем ясна, однако последние исследования показали, что фермент играет важную роль в физиологии и патофизиологии человека, в частности в приведенных ниже процессах. (а) Иммунный ответ: экспрессия DP-IV увеличивается в T- клетках при митогенной или антигенной стимуляции (Mattern Т. et al., Scand. J. Immunol., 1991, 33, 737). Показано, что ингибиторы DP-IV и антитела к DP-IV подавляют пролиферацию митоген- и антиген-стимулируемых T-клеток зависимым от дозы способом (Schon Е. et al. Biol. Chem. Hoppe-Seyler, 1991, 372, 305 и имеющиеся в работе ссылки). Показано, что другие разнообразные функции T-лимфоцитов, такие, как продуцирование цитокина, опосредованная ИЛ-2 (IL-2) пролиферация клеток и хелперная активность B-клеток зависят от активности DP-IV (Schon Е. et al., Scand. J. Immunol. 1989, 29, 127). Недавно появилось сообщение об ингибиторах DP-IV, полученных на основе борпролина (Flentke G.R. et al., Proc. Natl. Acad. Sci. USA, 1991, 88, 1556), которые, несмотря на свою нестабильность, оказались эффективными в ингибировании антиген-индуцированной пролиферации лимфоцитов и продукции ИЛ-2 в CD4* T-хелперных клетках мышей. Было показано, что такие ингибиторы борной кислоты эффективны in vivo у мышей, вызывая супрессию антител, образования индуцированного иммунным стимулятором (Kubota T. et al., Clin. Exp. Immunol., 1992,89, 192). Также недавно в ряде других работ были представлены доказательства участия DP-IV в генерации иммунного ответа (например, Tanaka Т. et al., Proc. Natl. Acad. Sci. NY, 1993, 90, 4586; Hegen M. et al., Cell Immun., 1993, 146, 249, Subramanyan M. et at., J. Immunol., 1993, 150, 2544). Ряд исследователей объясняют важное значение DP-IV тем, что она связывается на клеточной поверхности с трансмембранной фосфатазой CD45 (Torimoto Y. et al., J. Immunol., 1991, 147, 2514). Связь CD45-DP-IV может разрушаться под действием ингибиторов DP-IV или лигандов неактивного сайта. Известно, что CD45 представляет собой интегральный компонент T-клеточной сигнальной системы. (б) Недавно появилось сообщение в пресс-релизе Пастеровского Института в Париже (и впоследствии на презентации работы А.Г. Гованессяна на 8-ой конференции Сент Гарда в Париже, 25-27 октября 1993 г. (Hovanessian A.G., 8th Cent Gardes Meeting) о том, что DP-IV необходим для проникновения вирусов ВИЧ-1 и ВИЧ-2 в CD4+ T-клетки и их инфицирования. Исследователи из французской группы заявили, что DP-IV взаимодействует с ними и может расщеплять при этом V3 петлю гликопротеина gp120 вирусной оболочки. Они также сообщили, что ингибиторы или антитела к DP-IV успешно препятствуют входу вируса в клетку. Ранее было известно о селективном снижении экспрессии CD26 в T-клетках у ВИЧ-1 инфицированных пациентов (Valle-Blazquez М. et al., J. Immunol. , 1992. 149, 3073), а также о том, что Tat белок ВИЧ-1 связывается с DP-IV (Subramanyam М. et al., J. Immunol., 1993, 150, 2544). (в) Недавно было показано, что DP-IV в легочном эндотелии представляет собой адгезионную молекулу для клеток метастазы легкого и карциномы простаты крысы (Johnson R.C. et al., J. Cell. Biol., 1993, 121. 1423). Известно, что DP-IV связывается с фибронектином, при этом некоторые опухолевые клетки метастаз несут на своей поверхности большие количества фибронектина. (г) Было показано, что DP-IV связывается с ферментом аденозиндезаминазой [АДА (ADA)] на поверхности T-клеток (Kameoka J. et al., Science, 1993. 261, 466). Недостаток АДА вызывает у человека тяжелый комбинированный иммунодефицит (ТКИД (SCID)]. Взаимодействие AДA-CD26 может пролить свет на патофизиологию ТКИД. (д) В фибробластах кожи человека, больного псориазом, ревматоидным артритом (РА) и красным плоским лишаем, был обнаружен высокий уровень экспрессии DP-IV (Raynaud F. et al., J. Cell Physiol., 1992, 151, 378). (e) В тканевых гомогенатах, взятых от пациентов с доброкачественной гипертрофией простаты и в простатосомах была обнаружена высокая активность DP-IV. Простатосомы представляют собой производные от простаты органеллы, важные для придания сперме большей подвижности (Vanhoof G et al., Eur J. Clin Chem. Clin. Biochem., 1992. 30. 333). (ж) Было показано, что DP-IV ответственна за деградацию и инактивацию циркулирующих в крови пептидов, имеющих в качестве предпоследней аминокислоты на N-конце пролин или аланин, т.е. вещества P, рилизинг-фактора ростового гормона и представителей семейства глюкагон/вазоактивных кишечных пептидов (Mentheim R. et al., Eur. J. Biochem., 1993, 214,829). (з) У пациентов с периодонтитом отмечен повышенный уровень DP-IV в деснах (Сох S.W. et al., Arch. Oral. Biol. 1992, 37, 167). (и) Имеется множество других данных, указывающих на повышенный (а иногда и пониженный) уровень DP-IV при различных патологических состояниях. Из вышесказанного следует, что потенциальные ингибиторы DP-IV могут использоваться как лекарственные средства для лечения заболеваний человека. Такие ингибиторы могут применяться в качестве: (а) Иммуносупрессоров, например, при трансплантации органов; супрессоров высвобождения цитокина, в частности, при различных аутоиммунных заболеваниях, таких, как воспаление кишечника, множественный склероз, ревматоидный артрит. (б) Препаратов, препятствующих внедрению ВИЧ в T-клетки, а следовательно, могут использоваться для профилактики и лечения СПИДа. (в) Препаратов для предупреждения развития метастаз, особенно при опухолях молочной железы и простаты, в легкие. (г) Средств для лечения кожных болезней, таких как псориаз, красный плоский лишай. (д) Средств для подавления подвижности спермы и, следовательно, в качестве мужских контрацептивов. (е) Средств, полезных для применения при доброкачественной гипертрофии простаты. Ингибиторы DP-IV К числу конкурентных ингибиторов ферментной активности DP-IV относятся только упомянутые выше нестабильные борные кислоты (t1/2 30-90 мин при pH 7) (Bachovchin et al. , WO 91/16339, октябрь 1991 г.), имеющие значения K для DP-IV в наномолярном диапазоне, и простые аминокислотные пирролидиды или тиазолиды (Neubert et al., DD 296075 A5, ноябрь 1991 г.), обладающие очень небольшой силой (Ki > 0,1 мкМ). Заявленные в том же Германском патенте аминоацильные альдегиды пролина не могут быть синтезированы вследствие легкой внутримолекулярной конденсации N- концевой аминогруппы с альдегидной группировкой. В настоящем изобретении раскрываются высокоактивные конкурентные ингибиторы DP-IV (со значениями Ki в диапазоне от 10-6 до 10-10), характеризующиеся химической стабильностью (t1/2 24 час). Они относятся к трем группам соединений (Группы I, II и III). Группа I Эти молекулы имеют структуру, позволяющую им прочно связываться с активным центром DP-IV и ингибировать его протеолитическую активность, не препятствуя прикреплению любых дополнительных лигандов, способных связываться с поверхностью DP-IV (т.е. не на его активном центре). Такие соединения Группы I могут использоваться в качестве иммуносупрессоров: противоинфекционных агентов относительно ВИЧ: средств, подавляющих высвобождение некоторых цитокинов (например, ИЛ-2, ИЛ-6,  -INF) из активированных клеток. В эту категорию попадают также борные кислоты и пирролидиды, упомянутые ранее.
Группа II -INF) из активированных клеток. В эту категорию попадают также борные кислоты и пирролидиды, упомянутые ранее.
Группа IIЭти соединения происходят из соединений Группы I, однако они содержат, в отличие от последних, расширения длинной цепи к боковым цепям аминокислоты, обозначенной в общей структуре как А. Полученные соединения прикрепляются прочно к активному центру DP-IV, однако расширения длинной цепи выступают из активного центра фермента и препятствуют прикреплению любого другого лиганда, способного связываться с поверхностью DP-IV. Такие соединения могут иметь те же самые области применения, что и соединения Группы I, но в дополнение к ним могут также блокировать взаимодействие DP-IV с (i) CD45, (ii) V3 петлей gp120 ВИЧ-1, (iii) фибронектином поверхности опухолевой клетки и (iv) любым другим лигандом, важным для активации T-клеток, внедрения вируса в T-клетки или адгезии опухолевых клеток. Группа III Эта группа включает новые димеры, в которых два ингибитора DP-IV, направленных на активный центр фермента, связаны длинной цепью через боковые цепи аминокислотных остатков, обозначенных в общей формуле как A. Такие димеры могут конкурентно ингибировать две молекулы DP-IV и также препятствовать связыванию дополнительных лигандов с поверхностью DP-IV. Описываемые димеры имеют такие же области применения, как и соединения Группы II, но могут быть более эффективными. Изобретение относится к ингибиторам процессов, опосредованных действием DP-IV, которые характеризуются общей формулой: A-B (Группы I и II) или  где В представляет собой 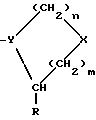 n = 1 или 2; m = 0, 1 или 2; NH или NR, где R = низший алкил(C-C); A прикрепляется к Y; -Y = -N, -CH или C (когда -CO группа в A замещена группой CH= или CF=), R=H, CN, CHO, B(ОН)2, C  C-R7 или CH=N-R8; C-R7 или CH=N-R8;R7=H, F, низший алкил(C1-C6), CN, NO2, OR9, CO2R9 или COR9; R8=Ph, ОН, OR9, OCOR9 или OBn; R9 = низший алкил (C1-C6); и либо один  , либо оба , либо оба  могут отсутствовать.
Структура A зависит от природы R в части B и от природы группы, к которой принадлежит полученное соединение.
Соединения Группы I могут отсутствовать.
Структура A зависит от природы R в части B и от природы группы, к которой принадлежит полученное соединение.
Соединения Группы I(a) R=H A обозначает аминоацильную группу, полученную из  -аминокислоты, несущей циклоалифатическую боковую цепь (т.е. от C4 до C10, моно- или бициклическую), в которой кольцо может содержать один или более гетероатомов, например, L-циклогексилглицин, L-циклопентилглицин, L-декагидронафтилглицин, L-пиперидилглицин; -аминокислоты, несущей циклоалифатическую боковую цепь (т.е. от C4 до C10, моно- или бициклическую), в которой кольцо может содержать один или более гетероатомов, например, L-циклогексилглицин, L-циклопентилглицин, L-декагидронафтилглицин, L-пиперидилглицин;или A представляет собой  -аминоацильную группу общей формулы -аминоацильную группу общей формулы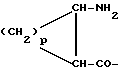 где p= 1-6, а кольцо может содержать один или более гетероатомов, замещающих группу(ы) CH2. Как  , так и , так и  -аминоацильные группы в (a), указанном выше, могут содержать ненасыщенные связи в своих кольцах, т.е. -аминоацильные группы в (a), указанном выше, могут содержать ненасыщенные связи в своих кольцах, т.е.
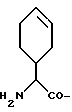 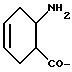 а также могут включать один или более гетероатомов. (б) R=CN; C=C-R7 или CH=N-R8 A соответствует определению, данному ранее в (a), и может быть также получен из L-  – аминокислот, несущих липофильную боковую цепь, например, lle.
(в) R=CHO или B(OH)2 – аминокислот, несущих липофильную боковую цепь, например, lle.
(в) R=CHO или B(OH)2A представляет собой  -аминоацильную группу, соответствующую определению, данному в (а). Полученные A-B соединения являются стабильными, непохожими на -аминоацильную группу, соответствующую определению, данному в (а). Полученные A-B соединения являются стабильными, непохожими на  -аминоацильные производные того же типа, которые подвергаются небольшой внутримолекулярной циклизации. В соединениях (В) В(ОН2) может быть представлен в виде, например, боронатного эфира. -аминоацильные производные того же типа, которые подвергаются небольшой внутримолекулярной циклизации. В соединениях (В) В(ОН2) может быть представлен в виде, например, боронатного эфира.
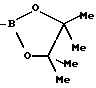 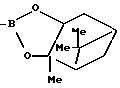 приведенные соединения лабильны в воде, образуя свободные борные кислоты. Соединения Группы II Когда R= H, C  C-R7 или CH=N-R8, А является производным C-R7 или CH=N-R8, А является производным  -аминокислоты, боковая цепь которой несет функциональную группу, которая изменена таким образом, чтобы образовалась длинная цепь, терминирующая в различных группах R3. А может иметь структуру, относящуюся к трем следующим типам: -аминокислоты, боковая цепь которой несет функциональную группу, которая изменена таким образом, чтобы образовалась длинная цепь, терминирующая в различных группах R3. А может иметь структуру, относящуюся к трем следующим типам: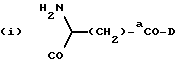 или 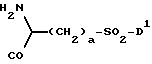 где a = 1-5: D=G-(CH2)b-(R4)q-R3; G=0, NH или NMe; b = 0-12; q= 0-5; D1=D, где G  0; 0;R4= Z-NH-(CH2)c– или NH-Z-(CH2)c-, где с = 1-12, a Z=CO, CH2 или SO2, и R3= CO2H или его эфир [т.е. любой низший алкил, фторалкил или циклоалкил(C1 – C8), а также ароматический или гетероароматический (5- или 6-членные кольца, моно- или бициклические) эфир] , CONH2; CONHNH2; CONR5R6; CONHNR5R6, PO3H (или его эфир, в соответствии с определением, данным для CO2Н), SO3H; SO2NH2, SO2NR5R6, ОН, CR5, арил или гетероарил (т.е. 5- или 6-членные кольца, моноциклические или бициклические) [включая замещенный арил или гетероарил с заместителями, выбранными из F, Cl, I, Br, ОН, OR5, NO2, SO3H, SO2NH2, SO2NR5R6, NH2, NR5R6, CO2R5, CF3, CN, CONH2, CONR5R6, NHCO2R5, CH(NR5)NR5R6, NH-CH(: NR5)NR5R6 и R5] ; NH2; NR5R6; NHCO2R5; NHSO2NR5R6; NHCOR5, NH-SO2R5; NH-CH(:NR5)NR5R6; NHCONR5R6, сахар (который может присоединяться через эфирную или гликозидную связь); CO-аминосахар (присоединенный через -NH2), например, глюкозамин или галактозамин; NHCO- аминосахар; или NHCS-аминосахар. В вышеприведенном определении R3 термин “сахар” относится к любому углеводу или олигосахариду, а R5 и R6 отбираются независимо друг от друга из H и алкильных, фторалкильных и циклоалкильных групп (до 8 атомов), арильных, гетероарильных и алкилгетероарильных групп (до 11 атомов) или R5 и R6 вместе составляют цепь (от C3 до C8) 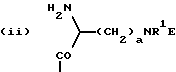 или 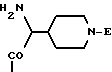 где R1= H, Me; кольцо может также содержать большее число гетероатомов; E= J-(CH2)b-(R4)q -R3, J=CO, CH2 или SO2; при этом a, b, q, R3, R4 соответствуют определению, данному в п. (i) 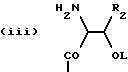 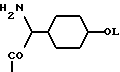 где R2 = H или Me; кольцо может также содержать один или более гетероатомов, L = (CH2)d-[CO] r– (CH2)b– (R4)q-R3 или (CH2)e-NR1– (CH2)b-(R4)q-R3; r = 0 или 1; d = 0-4; e = 2-4; b, q, R3 и R4 соответствуют определению, данному в п. (i). Группа III Соединения группы III определяются общей формулой: 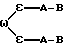 где  = CH2, О, NH, CO, S, SO2, Ph или NMe и независимо = CH2, О, NH, CO, S, SO2, Ph или NMe и независимо = CH2, О, NH, CO, S, SO2, Ph или NMe.
Приведенные соединения представляют собой симметричные димеры. Они могут иметь любую B структуру, в соответствии с данным выше определением. А может отбираться из любой структуры группы II [(i), (ii) или (iii)], однако, в этом случае концевую группу R3 в каждом остатке A удаляют и замещают защищенной симметричной группой [ = CH2, О, NH, CO, S, SO2, Ph или NMe.
Приведенные соединения представляют собой симметричные димеры. Они могут иметь любую B структуру, в соответствии с данным выше определением. А может отбираться из любой структуры группы II [(i), (ii) или (iii)], однако, в этом случае концевую группу R3 в каждом остатке A удаляют и замещают защищенной симметричной группой [ – – – – ], которая связывает две половинки димера; ], которая связывает две половинки димера;  может отсутствовать, и в этом случае оба может отсутствовать, и в этом случае оба  соединяются вместе с образованием цепи, связывающей две A – B части; альтернативно, оба соединяются вместе с образованием цепи, связывающей две A – B части; альтернативно, оба  могут отсутствовать, и в этом случае только присоединяется к двум A – B частям.
Структура типа могут отсутствовать, и в этом случае только присоединяется к двум A – B частям.
Структура типа  – – – – химически легко достижима, например, в виде NH-CO-NH, CO-NH-CO-, SO2-NMe-SO2; для каждого специалиста со средним уровнем знаний в данной области очевидно также, какие структуры недостижимы, например, типа -NH-NH-NH-. Конкретные примеры возможных соединений приведены в Таблице 7.
Во всех соединениях, описанных в Группе II и Группе III, определенные -CH2-группы, имеющиеся в длинных цепях, могут быть замещены с соблюдением биоизостерии, например, с помощью -О-, т.е. без воздействия на ингибирующую или связывающую активность в отношении DP-IV. При наличии таких группировок, как, например, -CONHCH2CH2NHCO, они могут быть замещены приведенным ниже заместителем химически легко достижима, например, в виде NH-CO-NH, CO-NH-CO-, SO2-NMe-SO2; для каждого специалиста со средним уровнем знаний в данной области очевидно также, какие структуры недостижимы, например, типа -NH-NH-NH-. Конкретные примеры возможных соединений приведены в Таблице 7.
Во всех соединениях, описанных в Группе II и Группе III, определенные -CH2-группы, имеющиеся в длинных цепях, могут быть замещены с соблюдением биоизостерии, например, с помощью -О-, т.е. без воздействия на ингибирующую или связывающую активность в отношении DP-IV. При наличии таких группировок, как, например, -CONHCH2CH2NHCO, они могут быть замещены приведенным ниже заместителем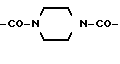 Кроме того, в соединениях Групп I, II и III любая амидная связь, связывающая A и B или любой амид в боковых цепях A (в Группах II и III), может быть замещена с помощью известных методов соблюдения биоизостерии амидов, например: 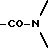 замещают на замещают на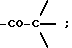 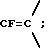 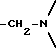 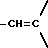 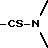 В Таблице 8 приведены примеры такого рода замещений. Биохимия Все соединения исследуют in vitro против чистой человеческой DP-IV (полученной от М & E, Копенгаген, Дания). Ингибирование DP-IV определяют с использованием флуоресцентного субстрата Ала-Про-AFC (Km 0,8 мкМ) при трех концентрациях для каждого ингибитора. Типичный тест (общий объем 0,4 мл) включает натрий-Гепес 83,3 мМ, ЭДТА 1.67 мМ. БСА 1.5 мг мл-1, pH 7,8, DP-IV 25 мкЕд.мл-1 ингибитор (в 10 мМ ацетате, pH 4,0). Начало протекания реакции осуществляют добавлением субстрата и каждые 30 сек в течение 7,5 мин отмечают значения возбуждения при 395 нм и эмиссию при 450 нм. Значения Ki определяют с помощью графика Диксона. Химия На Таблицах 1 – 8, вслед за которыми идут схемы и описание экспериментальной методики получения различных структурных типов, приведены 152 Примера синтезированных соединений. Все конечные продукты охарактеризованы методом FAB масс-спектрометрии с оценкой степени их чистоты исследованием с помощью ВЭЖХ с обращением фаз; все промежуточные продукты охарактеризованы при исследовании методом 1H ЯМР. На Таблице 9 приведены избранные значения Ki в отношении DP-IV при определении их с ингибиторами различных структурных типов. Схемы основных способов получения всех классов соединений представлены в табл. 1а – 11а. Экспериментальные процедуры для конкретных примеров Пример 1 2-(S)-циано-1-изолейцилпирролидин (11) 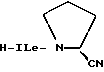 К раствору H-ProNH2  HCI (225 мг, 1.50 ммоля) в сухом CH2Cl2 (15 см3) добавляют диизопропилэтиламин до тех пор, пока значение pH станет равным 9. Добавляют в виде одной порции BoclleONSu и перемешивают смесь в течение 16 часов в атмосфере азота. Затем выпаривают растворитель, а остаток обрабатывают стандартным способом, т.е. распределяют остаток между этилацетатом (60 см3) и 0,3 N раствором KHSO4 (10 см3). Далее органический слой промывают насыщенным раствором NaHCO3 (10 см3), водой (10 см3) и солевым раствором (5 см3). Раствор высушивают (Na2SO4) и выпаривают при пониженном давлении. Неочищенный продукт пропускают через короткую пробку силикагеля, элюируют с помощью смеси гексан : этилацетат (от 10:90 до 0:100) с получением 301 мг (92%) BoclleProNH2, в виде бесцветной пены.
1H ЯМР (CDCl3) HCI (225 мг, 1.50 ммоля) в сухом CH2Cl2 (15 см3) добавляют диизопропилэтиламин до тех пор, пока значение pH станет равным 9. Добавляют в виде одной порции BoclleONSu и перемешивают смесь в течение 16 часов в атмосфере азота. Затем выпаривают растворитель, а остаток обрабатывают стандартным способом, т.е. распределяют остаток между этилацетатом (60 см3) и 0,3 N раствором KHSO4 (10 см3). Далее органический слой промывают насыщенным раствором NaHCO3 (10 см3), водой (10 см3) и солевым раствором (5 см3). Раствор высушивают (Na2SO4) и выпаривают при пониженном давлении. Неочищенный продукт пропускают через короткую пробку силикагеля, элюируют с помощью смеси гексан : этилацетат (от 10:90 до 0:100) с получением 301 мг (92%) BoclleProNH2, в виде бесцветной пены.
1H ЯМР (CDCl3)  (ppm); 6,90 (1H, шс); 5,51 (1H, шс); 5,18 (1H, д., J = 9,6 Гц): 4,62 (1H, дд. , J=2,6, 7,0 Гц); 4.29 (1H, дд., J=8,4, 9,2 Гц); 3,79-3,58 (2H, м.); 2.36 (1H, м): 2.09-1.57 (5H, м); 1,43 (9H, с): 1.17 (1H, м); 0,95 (3H, д., J = 6,6 Гц); 0,90 (3H, т. J = 7.3 Гц) (ppm); 6,90 (1H, шс); 5,51 (1H, шс); 5,18 (1H, д., J = 9,6 Гц): 4,62 (1H, дд. , J=2,6, 7,0 Гц); 4.29 (1H, дд., J=8,4, 9,2 Гц); 3,79-3,58 (2H, м.); 2.36 (1H, м): 2.09-1.57 (5H, м); 1,43 (9H, с): 1.17 (1H, м); 0,95 (3H, д., J = 6,6 Гц); 0,90 (3H, т. J = 7.3 Гц)К раствору BoclleProNH2 в сухом пиридине (10 см3) в атмосфере азота добавляют имидазол (84 мг, 1.24 ммоля). Раствор охлаждают до температуры -35oC, после чего добавляют по каплям POCl3 (0,25 см3, 2,48 ммоля). Реакционную смесь перемешивают при температуре от -30 до -20oC в течение 60 минут. Затем раствор выпаривают, а грубый остаток подвергают колоночной хроматографии (на силикагеле) с получением 180 мг (94%) 2-(S)-циано-1-[N-(т-бутоксикарбонил) изолейцил]-пирролидина в виде бесцветного масла. 1H ЯМР (CDCl3)  (ppm); 5,14 (1H, д. J = 9,2 Гц); 4,80 (1H, дд., J = 2,6, 7,1 Гц); 4,22 (1H. дд., J=7,9, 9,1 Гц); 3,81 (1H, м); 3,71 (1H, м); 2,30-2,12 (4H, м); 1,75 (1H, м); 1,60 (1H, м); 1,42 (9H, с); 1,19 (1H, м); 0,97 (3H, д, J = 6,9 ГЦ); 0,91 (3H, т., J = 7,3 ГЦ).
13C ЯМР (CDCl3) (ppm); 5,14 (1H, д. J = 9,2 Гц); 4,80 (1H, дд., J = 2,6, 7,1 Гц); 4,22 (1H. дд., J=7,9, 9,1 Гц); 3,81 (1H, м); 3,71 (1H, м); 2,30-2,12 (4H, м); 1,75 (1H, м); 1,60 (1H, м); 1,42 (9H, с); 1,19 (1H, м); 0,97 (3H, д, J = 6,9 ГЦ); 0,91 (3H, т., J = 7,3 ГЦ).
13C ЯМР (CDCl3)  (ppm) 171,7; 155,6; 118,0; 79,6; 56,0; 46,5; 46,0; 37,8; 29,6; 28,1; 25,0; 24,2; 15,2; 10,9.
Снятие защиты осуществляют при перемешивании с трифторуксусной кислотой в течение 60 минут. Выпаривание и лиофилизация из воды дают 60 мг 2- (S)-циано-1-изолейцилпирролидина (11) в виде белого пушистого твердого вещества.
FAB Масс-спектр.: Расчет: 209,3, Найдено (М+H)+=210,2.
1H ЯМР (D2O) (ppm) 171,7; 155,6; 118,0; 79,6; 56,0; 46,5; 46,0; 37,8; 29,6; 28,1; 25,0; 24,2; 15,2; 10,9.
Снятие защиты осуществляют при перемешивании с трифторуксусной кислотой в течение 60 минут. Выпаривание и лиофилизация из воды дают 60 мг 2- (S)-циано-1-изолейцилпирролидина (11) в виде белого пушистого твердого вещества.
FAB Масс-спектр.: Расчет: 209,3, Найдено (М+H)+=210,2.
1H ЯМР (D2O)  (ppm); 4,3 (1H, м); 3,64 (1H. д., J = 5,6 Гц); 3.16 (2H, м); 1,86-1,48 (5H, м); 0,98 (1H, м); 0,68 (1H, м); 0,51 (3H, д., J= 6,9 Гц); 0,38 (3H, т., J = 7,3 Гц).
13ЯМР (D2O) (ppm); 4,3 (1H, м); 3,64 (1H. д., J = 5,6 Гц); 3.16 (2H, м); 1,86-1,48 (5H, м); 0,98 (1H, м); 0,68 (1H, м); 0,51 (3H, д., J= 6,9 Гц); 0,38 (3H, т., J = 7,3 Гц).
13ЯМР (D2O)  (ppm); 169,7: 119,7: 57,3; 48,6: 48,1; 36,9; 30,2; 25,8; 24,5; 15,4; 11,5.
Пример 2 (ppm); 169,7: 119,7: 57,3; 48,6: 48,1; 36,9; 30,2; 25,8; 24,5; 15,4; 11,5.
Пример 2H-Glu (NH(CH2)7CONH(CH2)3NHZ] пирролидин (64) 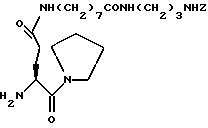 К раствору BocGlu (OH) пирролидида (193 мг, 0,64 ммоля) и PyBop (500 мг, 0,96 ммоля) в CH2Cl2 (6 см3) добавляют диизопропилэтиламин для доведения значения pH раствора до 9. После перемешивания в течение 5 минут добавляют раствор бензил 8-амино-октаноата (200 мг, 0,77 ммоля) в CH2Cl2 (5 см3). Смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь обрабатывают согласно процедуре, описанной в Примере 1. Грубый остаток подвергают колоночной хроматографии (от 1% до 3% метанола в этилацетате) с получением 344 мг (99%) BocGlu [NH(CH2)7 CO2Bn] пирролидида в виде бесцветного твердого вещества. 1H ЯМР (CDCl3)  (ppm); 7,35 (5H, с), 6,63 (1H, шт, J = 6.7 Гц); 5,65 (1H, д., J = 8,3 Гц); 5,11 (2H, с); 4,36 (1H, дт., J=2,6, 8,9 Гц); 3,55-3,20 (6H, м); 2,34 (2H, т. J=7,3 Гц); 2,26 (2H, дд., J=5,6. 7,3 Гц); 2.11-1,48 (10H, м): 1,43 (9H, с); 1,32-1,27 (6H, м).
Раствор BocGlu [NH(CH2)7CO2Bn] пирролидида (230 мг, 0,43 ммоля) в этилацетате (10 см3), содержащем 10% палладия на угле (50 мг), барботируют водородом. Через 90 минут в реакционный сосуд продувают азот, раствор фильтруют через целит, а растворитель выпаривают с получением 187 мг (98%) BocGlu NH(CH2)7CO2H] пирролидида в виде бесцветного масла.
К раствору BocGlu [NH(CH2)7CO2H] пирролидида (125 мг, 0,28 ммоля) и PyBop (221 мг, 0,43 ммоля) в CH2Cl2 (10 см3) добавляют диизопропилэтиламин до pH 9. После перемешивания в течение 5 минут добавляют одной порцией раствор ZNH(CH2)3NH2 (ppm); 7,35 (5H, с), 6,63 (1H, шт, J = 6.7 Гц); 5,65 (1H, д., J = 8,3 Гц); 5,11 (2H, с); 4,36 (1H, дт., J=2,6, 8,9 Гц); 3,55-3,20 (6H, м); 2,34 (2H, т. J=7,3 Гц); 2,26 (2H, дд., J=5,6. 7,3 Гц); 2.11-1,48 (10H, м): 1,43 (9H, с); 1,32-1,27 (6H, м).
Раствор BocGlu [NH(CH2)7CO2Bn] пирролидида (230 мг, 0,43 ммоля) в этилацетате (10 см3), содержащем 10% палладия на угле (50 мг), барботируют водородом. Через 90 минут в реакционный сосуд продувают азот, раствор фильтруют через целит, а растворитель выпаривают с получением 187 мг (98%) BocGlu NH(CH2)7CO2H] пирролидида в виде бесцветного масла.
К раствору BocGlu [NH(CH2)7CO2H] пирролидида (125 мг, 0,28 ммоля) и PyBop (221 мг, 0,43 ммоля) в CH2Cl2 (10 см3) добавляют диизопропилэтиламин до pH 9. После перемешивания в течение 5 минут добавляют одной порцией раствор ZNH(CH2)3NH2  HCl (90 мг, 0,37 ммоля) и диизопропилэтиламина (38 мг, 0,37 ммоля). Раствор перемешивают в течение 18 часов и затем обрабатывают в соответствии со стандартной процедурой, описанной в примере 1. Грубый остаток подвергают колоночной хроматографии (от 2% до 15% метанола в этилацетате) с получением 151 мг (85%) BocGlu [NH(CH2)7 CONH(CH2)3NHZ] пирролидида в виде бесцветного масла.
1H ЯМР (CDCl3) HCl (90 мг, 0,37 ммоля) и диизопропилэтиламина (38 мг, 0,37 ммоля). Раствор перемешивают в течение 18 часов и затем обрабатывают в соответствии со стандартной процедурой, описанной в примере 1. Грубый остаток подвергают колоночной хроматографии (от 2% до 15% метанола в этилацетате) с получением 151 мг (85%) BocGlu [NH(CH2)7 CONH(CH2)3NHZ] пирролидида в виде бесцветного масла.
1H ЯМР (CDCl3)  (ppm); 7,35 (5H, с.); 6,60 (1H, шт., J = 7,2 Гц); 6,14 (1H, шт. , J = 7,2 Гц); 5,63 (1H, д., J = 8,3 Гц); 5.39 (1H, шт., J = 5,6 Гц); 5,10 (2H, с); 4,38 (1H, дт., J=2,3, 9,2 Гц); 3,52-3,13 (10H. м); 2,26 (2H, т. , J = 6,9 Гц); 2.17 (2H, т., J = 7,6 Гц): 1,98-1,48 (12H, м); 1,44 (9H, с); 1,38-1,23 (6H, м).
Раствор BocGlu [NH(CH2)7CONH(CH2)3NHZ]пирролидида (14 мг, 0,022 ммоля) в 4N HCl/диоксане перемешивают в течение 45 минут. Растворитель выпаривают, а остаток растворяют в воде, фильтруют и лиофилизируют с получением 13 мг H-Glu [NH(CH2)7CONH (CH2)3NHZ]-пирролидида (64) в виде бесцветного масла.
FAB Масс-спектр.: Вычислено: 531,3, Найдено (М+H)+= 532,3 (ppm); 7,35 (5H, с.); 6,60 (1H, шт., J = 7,2 Гц); 6,14 (1H, шт. , J = 7,2 Гц); 5,63 (1H, д., J = 8,3 Гц); 5.39 (1H, шт., J = 5,6 Гц); 5,10 (2H, с); 4,38 (1H, дт., J=2,3, 9,2 Гц); 3,52-3,13 (10H. м); 2,26 (2H, т. , J = 6,9 Гц); 2.17 (2H, т., J = 7,6 Гц): 1,98-1,48 (12H, м); 1,44 (9H, с); 1,38-1,23 (6H, м).
Раствор BocGlu [NH(CH2)7CONH(CH2)3NHZ]пирролидида (14 мг, 0,022 ммоля) в 4N HCl/диоксане перемешивают в течение 45 минут. Растворитель выпаривают, а остаток растворяют в воде, фильтруют и лиофилизируют с получением 13 мг H-Glu [NH(CH2)7CONH (CH2)3NHZ]-пирролидида (64) в виде бесцветного масла.
FAB Масс-спектр.: Вычислено: 531,3, Найдено (М+H)+= 532,3Пример 3 H-Lys[CO(CH2)3NHSO2Pfp)пирролидид (110) 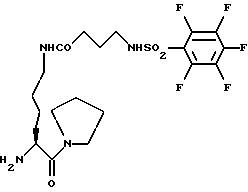 ZNH(CH2)3CO2NSu (570 мг, 1,7 ммоля) добавляют в виде одной порции к раствору 1-[N-(т-бутоксикарбонил) лизил] пирролидина (745 мг, 2.2 ммоля) в сухом CH2Cl2. Значение pH доводят до 9 с помощью диизопропилэтиламина, а смесь перемешивают в течение 60 минут. Растворитель выпаривают, а остаток обрабатывают по стандартной процедуре, описанной в примере 1. Колоночная хроматография (от 100% этилацетата до 15% метанола в этилацетате) дает 620 мг (68%) BocLys-[CO(CH2)3NHZ] пирролидида. 1H ЯМР (CDCl3)  (ppm); 7,42 (5H, с); 6,31 (1H, шт., J = 6,5 Гц); 5,58 (1H, д. , J = 8,9 Гц); 5.39 (1H. шт., J = 6.9 Гц); 5.17 (2H, с); 4,44 (1H, м); 3,72-3,20 (8H, м); 2,29 (2H, т., J = 7,3 Гц); 2,14-1,83 (8H, м); 1,78-1,41 (4H, м); 1.43 (9H, с).
Водородом барботируют смесь BocLys[Co(CH2)3NHZ] пирролидида (620 мг, 1,16 ммоля) и 10% палладия на угле в метаноле (10 см3), содержащую один молекулярный эквивалент 2N HCl. По прошествии 60 минут через реакционную смесь пропускают азот и фильтруют ее через целит. Выпаривание растворителя дает 282 мг (49%) BocLys [Co(CH2)3NH2 (ppm); 7,42 (5H, с); 6,31 (1H, шт., J = 6,5 Гц); 5,58 (1H, д. , J = 8,9 Гц); 5.39 (1H. шт., J = 6.9 Гц); 5.17 (2H, с); 4,44 (1H, м); 3,72-3,20 (8H, м); 2,29 (2H, т., J = 7,3 Гц); 2,14-1,83 (8H, м); 1,78-1,41 (4H, м); 1.43 (9H, с).
Водородом барботируют смесь BocLys[Co(CH2)3NHZ] пирролидида (620 мг, 1,16 ммоля) и 10% палладия на угле в метаноле (10 см3), содержащую один молекулярный эквивалент 2N HCl. По прошествии 60 минут через реакционную смесь пропускают азот и фильтруют ее через целит. Выпаривание растворителя дает 282 мг (49%) BocLys [Co(CH2)3NH2  HCl]пирролидида. Полученный продукт растворяют в CH2Cl2 (10 см3) и перемешивают в атмосфере азота. Перед внесением пентафторбензолсульфонил хлорида (45 мг, 0,17 ммоля) добавляют диизопропилэтиламин до pH 9. Смесь перемешивают в течение 16 часов. Растворитель выпаривают, а грубый материал обрабатывают по стандартной методике, описанной в примере 1. Колоночная хроматография (от 100% этилацетата до 10% метанола в этилацетате) дает 33 мг (31%) BocLys [CO(CH2)3NHSO2Pfp]пирролидида в виде бесцветного масла.
1H ЯМР (CDCl3) HCl]пирролидида. Полученный продукт растворяют в CH2Cl2 (10 см3) и перемешивают в атмосфере азота. Перед внесением пентафторбензолсульфонил хлорида (45 мг, 0,17 ммоля) добавляют диизопропилэтиламин до pH 9. Смесь перемешивают в течение 16 часов. Растворитель выпаривают, а грубый материал обрабатывают по стандартной методике, описанной в примере 1. Колоночная хроматография (от 100% этилацетата до 10% метанола в этилацетате) дает 33 мг (31%) BocLys [CO(CH2)3NHSO2Pfp]пирролидида в виде бесцветного масла.
1H ЯМР (CDCl3)  (ppm); 7,19 (1H, шт., J = 6,3 Гц); 6,18 (1H, шт., J= 6,6 Гц), 5,50 (1H, д., J = 8,4 Гц), 4,38 (1H, м); 3,65-3,16 (8H, м); 2,36 (2H, т., J = 6,8 Гц); 2,01-1,82 (8H, м), 1,69-1,41 (4H, м); 1,43 (9H, с).
Описываемый продукт перемешивают в трифторуксусной кислоте (10 см3) в течение 30 минут. Растворитель выпаривают, а остаток растворяют в воде, фильтруют и лиофилизируют с получением 30 мг H-Lys[CO(CH2)3-NHSO2Pfp]Prl (110) в виде бесцветного масла.
FAB Масс-спектр.: Вычислено 514,2; Найдено (М+H)+= 515,2.
Пример: (ppm); 7,19 (1H, шт., J = 6,3 Гц); 6,18 (1H, шт., J= 6,6 Гц), 5,50 (1H, д., J = 8,4 Гц), 4,38 (1H, м); 3,65-3,16 (8H, м); 2,36 (2H, т., J = 6,8 Гц); 2,01-1,82 (8H, м), 1,69-1,41 (4H, м); 1,43 (9H, с).
Описываемый продукт перемешивают в трифторуксусной кислоте (10 см3) в течение 30 минут. Растворитель выпаривают, а остаток растворяют в воде, фильтруют и лиофилизируют с получением 30 мг H-Lys[CO(CH2)3-NHSO2Pfp]Prl (110) в виде бесцветного масла.
FAB Масс-спектр.: Вычислено 514,2; Найдено (М+H)+= 515,2.
Пример:H-Thr[(CH2)5CH3)пирролидид (143) 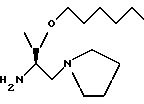 Пирролидин (0,88r, 12,4 ммоля) добавляют в раствор BocThrONSu (3,0 г, 9,5 ммоля) в сухом CH2Cl2 (30 см3) в атмосфере азота. Реакционную смесь перемешивают в течение 60 минут при комнатной температуре. Растворитель выпаривают, а остаток обрабатывают по стандартной методике, описанной в примере 1. Остаток подвергают колоночной хроматографии (гексан : этилацетат, 30:70) с получением 2,50 г (96%) 1-[N-(т-бутоксикарбонил)треонил]пирролидина в виде бесцветного масла. 1H ЯМР (CDCl3)  (ppm): 5,52 (1H, д, J= 6,5 Гц). 4,30 (1H, д, J= 7,4 Гц); 4,16 (2H, м), 3,72 (1H, м); 3,46 (3H, м); 1,98-1,82 (4H, м); 1,43 (9H, с), 1,19 (3H, д. J= 7,1 Гц).
К раствору 1-[N-(т-бутоксикарбонил)треонил]пирролидина в сухом ТГФ при температуре 0oC в атмосфере азота добавляют гидрид натрия (17 мг, 0,70 ммоль). Перед внесением н-гексил йодида (200 мг, 0,94 ммоля) смесь перемешивают в течение 16 минут. Затем реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Растворитель выпаривают, а остаток обрабатывают по стандартной методике, описанной в примере 1. Грубый продукт подвергают колоночной хроматографии (гексан : этилацетат, 40: 60) с получением 25 мг (10%) BocThr [(CH2)5CH3]пирролидида (143).
1H ЯМР (CDCl3)) (ppm): 5,52 (1H, д, J= 6,5 Гц). 4,30 (1H, д, J= 7,4 Гц); 4,16 (2H, м), 3,72 (1H, м); 3,46 (3H, м); 1,98-1,82 (4H, м); 1,43 (9H, с), 1,19 (3H, д. J= 7,1 Гц).
К раствору 1-[N-(т-бутоксикарбонил)треонил]пирролидина в сухом ТГФ при температуре 0oC в атмосфере азота добавляют гидрид натрия (17 мг, 0,70 ммоль). Перед внесением н-гексил йодида (200 мг, 0,94 ммоля) смесь перемешивают в течение 16 минут. Затем реакционную смесь перемешивают при комнатной температуре в течение 16 часов. Растворитель выпаривают, а остаток обрабатывают по стандартной методике, описанной в примере 1. Грубый продукт подвергают колоночной хроматографии (гексан : этилацетат, 40: 60) с получением 25 мг (10%) BocThr [(CH2)5CH3]пирролидида (143).
1H ЯМР (CDCl3))  (ppm), 5,50 (1H, д., J = 6,9 Гц); 4,48 (1H, м); 3,70- 3,32 (7H, м); 1,92-1,80 (6H, м); 1,52 (2H, м), 1,42 (9H, с); 1,30 (6H, м), 1,22 (8H, д., J= 6,9 Гц); 0,83 (3H, т., J = 7.9 Гц).
BocThr [(CH2)5CH3] пирролидид (20 мг, 0,06 ммоля) перемешивают в 4N HCl/диоксане (5 см3) в течение 60 минут. Растворитель выпаривают, а остаток переносят в воду, фильтруют и лиофилизируют с получением H-Thr-[(CH2)5CH3] пирролидида (20 мг) в виде оранжевого масла. Продукт чистят с помощью ВЭЖХ с обращением фаз, получая 15 мг (143) в виде бесцветного масла.
FAB Масс-спектр.: Вычислено: 256,2, Найдено (М+H)+ = 257,3.
Пример 5 (ppm), 5,50 (1H, д., J = 6,9 Гц); 4,48 (1H, м); 3,70- 3,32 (7H, м); 1,92-1,80 (6H, м); 1,52 (2H, м), 1,42 (9H, с); 1,30 (6H, м), 1,22 (8H, д., J= 6,9 Гц); 0,83 (3H, т., J = 7.9 Гц).
BocThr [(CH2)5CH3] пирролидид (20 мг, 0,06 ммоля) перемешивают в 4N HCl/диоксане (5 см3) в течение 60 минут. Растворитель выпаривают, а остаток переносят в воду, фильтруют и лиофилизируют с получением H-Thr-[(CH2)5CH3] пирролидида (20 мг) в виде оранжевого масла. Продукт чистят с помощью ВЭЖХ с обращением фаз, получая 15 мг (143) в виде бесцветного масла.
FAB Масс-спектр.: Вычислено: 256,2, Найдено (М+H)+ = 257,3.
Пример 5H-lle-  -[CH=CH)Пирролидид (149) -[CH=CH)Пирролидид (149)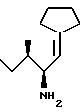 К раствору циклопентил трифенилфосфония бромида (287 мг, 0,69 ммоля) в сухом ТГФ (6 см3) в атмосфере азота при температуре -30oC добавляют при перемешивании 1,6 N nбутил лития (0,50 см3, 0,76 ммоля). Смесь перемешивают в течение 60 минут, после чего раствор охлаждают до температуры -50oC с последующим добавлением по каплям раствора N-(т-бутоксикарбонил)-L-изолейцинала (125 мг, 0,58 ммоля, получен по методу Fehrentz and Castro, Synthesis, 1983, 676) в сухом ТГФ (4 см3). По окончании добавления температуру реакционной смеси медленно, в течение 3,5 часа доводят до комнатной. Реакцию останавливают добавлением насыщенного раствора хлорида аммония (2 см3). Полученную смесь разбавляют водой (10 см3) и экстрагируют диэтиловым эфиром (3х20 см3). Объединенные эфирные слои промывают водой (10 см3), высушивают (Na2SO4) и выпаривают с получением 187 мг (> 100%) грубого продукта. Колоночная хроматография (90:10, гексан : Et2O) дает 53 мг (34%) Boc-lle-  [CH=CH]пирролидида в виде бесцветного масла [CH=CH]пирролидида в виде бесцветного масла1H ЯМР (CDCl3)  (ppm): 0,84 (3H, т., J = 6.9 Гц); 0,91 (3H, д., J = 7,3 Гц), 1,08 (1H, М); 1,44 (9H, с); 1,48 (1H, м): 1,64 (5H, м), 2,24-2,45 (4H, м): 4,08 (1H, шс); 4,41 (1H, шс), 5,12 (1H, дт., J = 2,3, 8,9 Гц).
13C ЯМР (CDCl3) (ppm): 0,84 (3H, т., J = 6.9 Гц); 0,91 (3H, д., J = 7,3 Гц), 1,08 (1H, М); 1,44 (9H, с); 1,48 (1H, м): 1,64 (5H, м), 2,24-2,45 (4H, м): 4,08 (1H, шс); 4,41 (1H, шс), 5,12 (1H, дт., J = 2,3, 8,9 Гц).
13C ЯМР (CDCl3)  (ppm) 155,8; 147,4: 119.1; 79,2; 54,8; 40,1; 34,2; 29,6; 28,9; 26,8; 26,6; 26,1; 15,0; 12,1.
Обработка данного продукта с применением 4N HCl/диоксана в течение 35 минут удаляет Вос-защитные группы. Реакционную смесь выпаривают, остаток растворяют в воде, фильтруют и лиофилизируют с получением 24 мг (63%) H-lle- (ppm) 155,8; 147,4: 119.1; 79,2; 54,8; 40,1; 34,2; 29,6; 28,9; 26,8; 26,6; 26,1; 15,0; 12,1.
Обработка данного продукта с применением 4N HCl/диоксана в течение 35 минут удаляет Вос-защитные группы. Реакционную смесь выпаривают, остаток растворяют в воде, фильтруют и лиофилизируют с получением 24 мг (63%) H-lle- [CH=CH]пирролидида (149) в виде пенистого твердого вещества.
FAB Масс-спектр.: Вычислено 167,2, Найдено (М+H)+= 168,2.
Примеры 6 и 7 [CH=CH]пирролидида (149) в виде пенистого твердого вещества.
FAB Масс-спектр.: Вычислено 167,2, Найдено (М+H)+= 168,2.
Примеры 6 и 7H-lle[(2R)-циано-  (CH=CH)пирролидид] (150) (CH=CH)пирролидид] (150)H-lle [(2S)-циано-  (CH=CH)пирролидид] (151) (CH=CH)пирролидид] (151)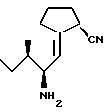 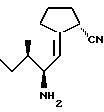 N-(т-бутоксикарбонил)-L-изолейцинал (2,40 г, 11,2 ммоля) и 2- окси-1-трифенилфосфоранциклопентан (4,61 г, 13,4 ммоля, приготовлен по методу H.O. House и H.Babed, J. Org. Chem. 1963, 28, 90) нагревают при температуре кипячения с обратным холодильником в толуоле в атмосфере азота. Через 15 часов смесь охлаждают, а растворитель выпаривают. Колоночная хроматография (80:20, гексан : этилацетат) грубого остатка дает 2,33 г (74%) Boclle –  [CH=CH] пирролидин-2-оне в виде бесцветного масла [CH=CH] пирролидин-2-оне в виде бесцветного масла1H ЯМР (CDCl3)  (ppm); 6,29 (1H, дт., J=2,6, 9,2 Гц), 4,59 (1H, шд), 4,17 (1H, м); 2,82 (1H, м), 2,66-2,50 (2H, м); 2,34 (2H, т., J = 7,8 Гц), 1,96 (2H, к. , J = 7,6 Гц); 1,44 (1H, м); 1,43 (9H, с); 1,12 (1H, м); 0,89 (3H, д., J = 5,3 Гц); 0,88 (3H, т., J = 6,9 Гц).
К раствору Boclle- (ppm); 6,29 (1H, дт., J=2,6, 9,2 Гц), 4,59 (1H, шд), 4,17 (1H, м); 2,82 (1H, м), 2,66-2,50 (2H, м); 2,34 (2H, т., J = 7,8 Гц), 1,96 (2H, к. , J = 7,6 Гц); 1,44 (1H, м); 1,43 (9H, с); 1,12 (1H, м); 0,89 (3H, д., J = 5,3 Гц); 0,88 (3H, т., J = 6,9 Гц).
К раствору Boclle- [CH= CH]пирролидин-2-она (180 мг, 0,64 ммол) и LiCN (0,5 М в ДМФ, 3,84 см3, 1,92 ммоля) в сухом ДМФ (2 см3) в атмосфере азота добавляют диэтилцианофосфоноацетат (0,30 см3, 1,92 ммоля). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут. Смесь разбавляют водой (20 см3) и затем экстрагируют этилацетатом (2 [CH= CH]пирролидин-2-она (180 мг, 0,64 ммол) и LiCN (0,5 М в ДМФ, 3,84 см3, 1,92 ммоля) в сухом ДМФ (2 см3) в атмосфере азота добавляют диэтилцианофосфоноацетат (0,30 см3, 1,92 ммоля). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут. Смесь разбавляют водой (20 см3) и затем экстрагируют этилацетатом (2 30 см3). Объединенные органические слои промывают водой (5 30 см3). Объединенные органические слои промывают водой (5 10 см3), высушивают (Na2SO4) и выпаривают с получением 360 мг (> 100%) грубого продукта. Порцию такого грубого цианофосфоната (284 мг, 0,64 ммоля) растворяют в сухом ТГФ и перемешивают в атмосфере азота. Вносят трет-бутанол (47 мг, 0,64 ммоля), затем добавляют по каплям раствор йодида самария (II) (0,1 М в ТГФ, 19,2 см3, 1,92 ммоля). После окончания добавления реакционную смесь перемешивают еще в течение 30 минут и затем добавляют 2N HCl (20 см3). Смесь экстрагируют диэтиловым эфиром (3 10 см3), высушивают (Na2SO4) и выпаривают с получением 360 мг (> 100%) грубого продукта. Порцию такого грубого цианофосфоната (284 мг, 0,64 ммоля) растворяют в сухом ТГФ и перемешивают в атмосфере азота. Вносят трет-бутанол (47 мг, 0,64 ммоля), затем добавляют по каплям раствор йодида самария (II) (0,1 М в ТГФ, 19,2 см3, 1,92 ммоля). После окончания добавления реакционную смесь перемешивают еще в течение 30 минут и затем добавляют 2N HCl (20 см3). Смесь экстрагируют диэтиловым эфиром (3 30 см3). Объединенные эфирные слои промывают 10% раствором Na2S2O3 (10 см3), водой (2 30 см3). Объединенные эфирные слои промывают 10% раствором Na2S2O3 (10 см3), водой (2 10 см3) и солевым раствором (2 10 см3) и солевым раствором (2 10 см3). Раствор высушивают (Na2SO4), выпаривают, а полученный грубый остаток подвергают колоночной хроматографии (90: 10, гексан: этилацетат) с получением 122 мг (66%) смеси диастереомеров Boclle [2-(RS)- циано- 10 см3). Раствор высушивают (Na2SO4), выпаривают, а полученный грубый остаток подвергают колоночной хроматографии (90: 10, гексан: этилацетат) с получением 122 мг (66%) смеси диастереомеров Boclle [2-(RS)- циано- (CH=CH)пирролидина] в виде бесцветного масла.
1H ЯМР (CDCl3) (CH=CH)пирролидина] в виде бесцветного масла.
1H ЯМР (CDCl3)  (ppm): 5,52 (1H, д., J = 9,6 Гц); 4,5 (1H, шс), 4,12 (1H, м): 3,35 (1H, м): 2,57 (1H, м); 2,38 (1H, м); 2,17 (1H, м): 1,91 (2H, м); 1,69 (2H, м), 1,53 (1H, м); 1,43 (9H, с); 1,12 (1H, м); 0,92 (1,5H, д., J=7,3 Гц); 0,91 (1,5H, д., J=7,3 Гц); 0,89 (1,5H, д., J = 6,6 Гц); 0,86 (1,5 H, т., J= 6,9 Гц).
Обработка полученной смеси диастереомеров 4N HCl/диоксаном в течение 60 минут удаляет защитные группы. Выпаривание растворителя и последующая ВЭЖХ с обращением фаз полученного остатка дает два чистых диастереомера.
(150), (47 мг, 60%) FAB Масс-спектр.: Вычислено 192,2, Найдено (М+H)+ = 193,2.
(151), (28 мг, 36%) FAB Масс-спектр.: Вычислено 192,2. Найдено (М+H)+ = 193,2 (ppm): 5,52 (1H, д., J = 9,6 Гц); 4,5 (1H, шс), 4,12 (1H, м): 3,35 (1H, м): 2,57 (1H, м); 2,38 (1H, м); 2,17 (1H, м): 1,91 (2H, м); 1,69 (2H, м), 1,53 (1H, м); 1,43 (9H, с); 1,12 (1H, м); 0,92 (1,5H, д., J=7,3 Гц); 0,91 (1,5H, д., J=7,3 Гц); 0,89 (1,5H, д., J = 6,6 Гц); 0,86 (1,5 H, т., J= 6,9 Гц).
Обработка полученной смеси диастереомеров 4N HCl/диоксаном в течение 60 минут удаляет защитные группы. Выпаривание растворителя и последующая ВЭЖХ с обращением фаз полученного остатка дает два чистых диастереомера.
(150), (47 мг, 60%) FAB Масс-спектр.: Вычислено 192,2, Найдено (М+H)+ = 193,2.
(151), (28 мг, 36%) FAB Масс-спектр.: Вычислено 192,2. Найдено (М+H)+ = 193,2Препаративные методы, описанные применительно к таблицам 1-8 и к примерам от первого до седьмого, составляют часть настоящего изобретения. Сокращения Boc трет-бутилоксикарбонил Bn бензил BSA бычий сывороточный альбумин nBu н-бутил Ch циклогексил DMF, ДМФ диметилформамид DMP десс-мартин периодан EDTA, ЭДТА этилендиаминтетрауксусная кислота FAB бомбардировка быстрыми атомами Gua гуанидил HPLC, ВЭЖХ высокоэффективная жидкостная хроматография nHx н-гексил Масс-спектр. Масс-спектрометрия mCPBA, мХПБК мета-хлорпербензойная кислота Mol Wt, М.в. молекулярный вес ONSu N-O-сукцинимид Pfp. пентафторфенил Ph фенил Pip пиперидил Prl пирролидид Py пиридин PyBop бензотриазол-1-ил-окси-трис-пирролидино-фосфония гексафторфосфат WSCD, ВРКД водорастворимый карбодиимид Z бензилоксикарбонил Аналитическая высокоэффективная жидкостная хроматография (ВЭЖХ) была предпринята на колонке Novapak C18 с обращенной фазой (размер частиц 4 мк, 8х100 мм) с линейными градиентами возрастающих концентраций ацетонитрила в воде, с постоянной 0,1% концентрацией трифторуксусной кислоты; скорость тока 1,5 мл/мин. Были использованы индивидуальные градиенты, представленные в табл. 9а и 10а. Изучение токсичности у крыс см. в табл. 11а. Формула изобретения
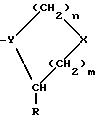 n равно 1 или 2; m равно 0, 1 или 2; X означает CH2, S, SO, SO2, O; Y означает N, R означает H, CN, CHO, B(OH)2, A прикрепляется к Y, и а) когда R означает H, A является альфа-аминоацильной группой, полученной из альфа-аминокислоты, несущей циклоалифатическую боковую цепь, или представляет собой бета-аминоацильную группу общей формулы 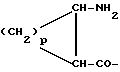 где p принимает значения от 1 до 6, при этом кольцо в любом случае может содержать ненасыщенные связи и/или замещение гетероатомом; б) когда R означает CN, A соответствует определению, данному в (а), и, кроме того, может быть получен из любой L-альфа-аминокислоты, несущей липофильную боковую цепь, и в) когда R означает CHO или B(OH)2, A означает бета-аминоацильную группу, определяемую в (а); (группа II): B, n, m, X – как указано выше; R означает H, CN; A прикрепляется к Y, при этом A представляет собой 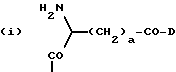 где a = 1 – 5; D означает G-(CH2)b-(R4)q-R3; G означает NH или NMe; b = 1 – 12; q = 0 или 1; R4 означает Z-NH-(CH2)c или NH-Z-(CH2)c-, где c = 1 – 12; Z означает CO, CH2; R3 = CO2H или его эфир, CONH2, CONR5R6, SO2NH2, SO2NR5R6, OH, OR5, замещенный или незамещенный арил, NH2, NR5R6, NHCOR5, NHSO2R5, NH-CH(: NR5)NR5R6; R5 и R6 выбирают, независимо друг от друга, из H, низших алкильных, фторалкильных групп, или R5 и R6, вместе с атомом азота, к которому они присоединены, составляют цепь C3-C8; или A представляет собой (ii) 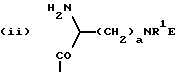 где R1 = H, Me; E = J-(CH2)b-(R4)q-R3; J = CO; a, b, q, R3 и R4 соответствуют определению, данному в (i); или представляет собой (iii) 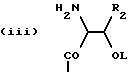 где R2 = H, Me; L означает (CH2)d-(CO)r-(CH2)b-(R4)q-R3, где r = 1, d = 1 – 4; b, q, R3 и R4 соответствуют определению, данному в (i). 2. Ингибиторы процессов, связанных с DP-IV по п.1, представляющие собой соединения с общей формулой: A-B (группа I), где B означает 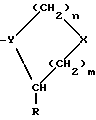 n равно 1 или 2; m равно 0, 1 или 2; X означает CH2, S, SO, SO2; R означает H, CN, CHO или B(OH)2; а) когда R означает H, A является альфа-аминоацильной группой, полученной из альфа-аминокислоты, несущей циклоалифатическую боковую цепь, или представляет собой бета-аминоацильную группу общей формулы 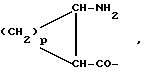 где p принимает значения от 1 до 6, при этом кольцо в любом случае может содержать ненасыщенные связи и/или замещение гетероатомом; б) когда R означает CN, A соответствует определению, данному в (а), и, кроме того, может быть получен из любой L-альфа-аминокислоты, несущей липофильную боковую цепь, и в) когда R означает CHO или B(OH)2, A означает бета-аминоацильную группу, определяемую в (а). 3. Ингибиторы по п.2, в которых B представляет собой 5-тичленное кольцо; n принимает значение 1; X означает CH2 или S; Y означает N; R означает CN. 4. Ингибиторы по п.1, представляющие собой соединение с общей формулой A-B (группа II), где B означает 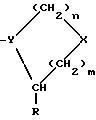 n равно 1 или 2; m равно 0, 1 или 2; X означает CH2, O, S, SO, SO2; R означает H или CN, A прикрепляется к Y, при этом A представляет собой 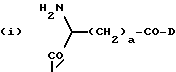 где a означает 1 – 5; D означает G-(CH2)b-(R4)q-R3; G означает NH или NMe; b = 1 – 12; q = 0 или 1; R4 означает Z-NH-(CH2)c или NH-Z-(CH2)c-, где c = 1 – 12, а Z означает CO, CH2; R3 означает CO2H или его эфир, CONH2, CONR5R6, SO2NH2, SO2NR5R6, OH, OR5, замещенный или незамещенный арил, NH2, NR5R6, NHCOR5, NHSO2R5, NH-CH(: NR5)NR5R6; R5 и R6 выбирают, независимо друг от друга, из H, низших алкильных, фторалкильных групп или R5 и R6, вместе с атомом азота, к которому они присоединены, составляют цепь C3-C8; или A представляет собой (ii) 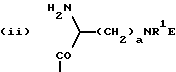 где R1 означает H, Me; E означает J-(CH2)b-(R4)q-R3; J означает CO; a, b, q, R3 и R4 соответствуют определению, данному в (i); или A представляет собой (iii) 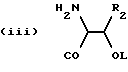 где R2 означает H или Me; L означает (CH2)d-(CO)r-(CH2)b-(R4)q-R3, где r = 1, d = 1 – 4; b, q, R3 и R4 соответствуют определению, данному в (i). РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 01.12.2008
Извещение опубликовано: 27.11.2010 БИ: 33/2010
|
||||||||||||||||||||||||||
