Патент на изобретение №2280032
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ АДАМАНТ-1-ИЛСОДЕРЖАЩИХ АЗОЛОВ
(57) Реферат:
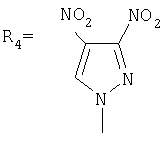
Изобретение относиться к химии производных адамантана, а именно к новому способу получения адамант-1-илсодержащих азолов общей формулы Указанные производные адамантана являются полупродуктами для синтеза биологически активных веществ. Техническим результатом является упрощение способа получения, а также возможность получения целевых соединений широкого ряда азолов с адамантильным радикалом. Данный технический результат достигается новым способом получения адамант-1-илсодержащих азолов, который заключается в присоединении к 1,3-дегидроадамантану азолов: 2-метилимидазола, 3(5)-метилпиразола и 4-метилпиразола, 3,4-динитропиразола, 1,2,4-триазола, 3-метилтриазола, 3-нитро-1,2,4-триазола и 5-метилтетразола при мольном соотношении 1,3-дегидроадамантана и азола, равном 1:1, в среде диэтилового эфира при температуре 100°С в течение 4-5 часов.
(56) (продолжение): CLASS=”b560m”с.1078-1087, РЖ хим., реферат 8 Ж 205. CABILIDO PILAR, ЕТ AL. “Regioselective adamantylation of N-unsubstituted pyrazole derivatives”, Tetrahedron Letters, 1994, 35 (1), p.183-4, Chem. Abstr., 120:270221, ACS on STN. SASAKI TADASHI, ЕТ AL. “Synthesis of adamantine derivatives. LVIII. Reaction of 1-adamantyl chloride with some heterocyclic unsaturated silanes”, Chemical and Pharmaceutical Bulletin, 1982, 30 (6), p.2051-60, Chem. Abstr., 97:198173, ACS on STN. CONZALES MARIA EUGENIA, ЕТ AL. “Synthesis and in vitro antiviral activity of some N-adamantylazoles and benzazoles”, European Journal of Medical Chemistry, 1985, 20 (4), p.359-62, Chem. Abstr., 105:60566, ACS on STN.
Изобретение относиться к химии производных адамантана, а именно к новому способу получения адамант-1-илсодержащих азолов общей формулы которые являются полупродуктами для синтеза биологически активных веществ. Известен способ получения адамант-1-илсодержащих азолов: имидазолов, пиразолов, триазолов и тетразолов, заключающийся в использовании в качестве исходных реагентов галогенадамантанов, 1-гидроксиадамантана или 1-нитроксиадамантана. При нагревании (190-200°С) 1-бромадамантана с азолами в присутствии кислот Льюиса (AlCl3 Недостатком данного метода является, прежде всего, использование повышенных температур (190-200°С) и присутствие катализаторов (AlCl3, TiCl3). Выход при этом адамантилсодержащих азолов составил 45-75%. Недостатками данного метода являются: использование концентрированной серной кислоты в качестве катализатора, достаточно продолжительное время синтеза, невысокий выход продукта. Также в этих условиях в реакцию адамантилирования не вступают имидазолы. Для успешного проведения синтеза необходимо подобрать систему, в которой сочетались бы образование адамантильного карбкатиона и неполное протонирование имидазола. Недостатками данного метода является невысокий выход продукта, а также исследования показали, что возможность кислотно-катализируемого адамантилирования имидазолов в смеси фосфорной и уксусной кислот весьма ограничена, так как соединения этого ряда обладают высокой основностью и практически полностью протонируются в этой системе. Общими недостатками всех вышеперечисленных способов является то, что они не являются универсальными в синтезе адамант-1-илсодержащих азолов: имидазолов, пиразолов, триазолов, тетразолов, невысокие выходы целевых продуктов, наличие катализатора. Задачей предлагаемого изобретения является разработка универсального технологичного, малостадийиого метода синтеза адамантилсодержащих азолов, протекающего с высоким выходом целевого продукта. Техническим результатом является упрощение способа получения, а также возможность получения целевых соединений широкого ряда азолов с адамантильным радикалом с достаточно большим выходом. Поставленный технический результат достигается в новом способе получения адамант-1-илсодержаших азолов общей формулы заключающимся в присоединении к производному адамантана соответствующего азола, причем в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве азола – 2-метилимидазол, 3(5)-метилпиразол и 4-метилпиразол, 3,4-динитропиразол, 1,2,4-триазол, 3-метилтриазол и 3-нитро-1,2,4-триазолы, 5-метилтетразол, и процесс проводят при мольном соотношении 1,3-дегидроадамантана и азола, равном 1:1, в среде диэтилового эфира при температуре 100°С в течение 4-5 часов. Сущность метода показана на примере присоединения к 1,3-дегидроадамантану 2-метилимидазола: Реакция 1,3-дегидроадамантана с N-незамещенными азолами протекает преимущественно по -NH связи азолов. Наличие дополнительных атомов азота оказывает большое влияние на свойства циклической системы. Они обогащают систему свободными электронными парами и обуславливают предпочтительное направление атаки для протонов и других электрофилов. Дополнительные атомы азота также способствуют понижению энергетических уровней На выход оказывает влияние также природа азола. При адамантилировании имидазолов, тетразолов выход составляет 90%, если в реакцию вступают нитропроизводные азолов, выход 70%. Преимуществами данного метода является высокий выход продукта (70-90%), а также возможность получения практически любых гомологов данного ряда, которые также являются полупродуктами для синтеза биологически активных веществ. Как показали проведенные исследования, селективность реакции чувствительна к температуре. Обнаружено, что максимальный выход достигается при температуре 100°С. Дальнейшее повышение температуры, а также снижение температуры ведет к снижению выхода целевых продуктов. Применение диэтилового эфира в качестве среды позволяет также использовать его как растворитель для 1,3-дегидроадамантана. Изменение молярного соотношения реагентов 1,3-ДГА:азол до 1:1 позволяет сократить получение побочных продуктов. Увеличение продолжительности реакции в интервале времени 4-5 часов, при прочих равных условиях, также ведет к некоторому увеличению выхода. Дальнейшее увеличение продолжительности реакции не приводит к существенному изменению выхода целевого продукта. При уменьшение продолжительности реакции менее 4 часов не достигается полной конверсии реагентов. Способ осуществляется следующим образом. К 1,3-дегидроадамантану приливают раствор азола в диэтиловом эфире в соотношении 1:1. Смесь нагревают до полного выпаривания эфира, затем температуру доводят до 100°С и выдерживают при этой температуре 4-5 часов. Изобретение иллюстрируется следующими примерами: Пример 1. Синтез N-(адамантил)-2-метилимидазола. К 5 г (0,037 моль) 1,3-дегидроадамантана в 30 мл диэтилового эфира приливают раствор 3,034 г (0,037 моль) 2-метилимидазола в 20 мл диэтилового эфира. Смесь нагревают до полного выпаривания эфира и температуру доводят до 100°С. При этой температуре выдерживают 5 часов. Остаток кристаллизуют из этанола. Выход 7,15 г (89,3%). Масс-спектр, m/z: 216 (М+, 100%). 201 ([М-СН3]+, 10%), 175 ([М-(СН3-HCN)]+, 7%), 159 ([М-С4H9]+, 50%), 135 (Ad+, 88%). Пример 2. Синтез N-(адамантил)-3(5)-метилпиразола. К 5 г (0,037 моль) 1,3-дегидроадамантана в 30 мл диэтилового эфира приливают раствор 3,03 г (0,037 моль) 3(5)-метилпиразола в 20 мл диэтилового эфира. Смесь нагревают до полного выпаривания эфира и температуру доводят до 100°С. При этой температуре выдерживают 4,5 часов. Остаток кристаллизуют из изопропанола. Выход 7,26 г (90,2%). Масс-спектр, m/z: 216(М+, 53,4%), 135(Ad+, 100%), 81(PYR+, 9,9%). Пример 3. Синтез N-(адамантил)-4-метилпиразола. К 5 г (0,037 моль) 1,3-дегидроадамантана в 30 мл диэтилового эфира приливают раствор 3,03 г (0,037 моль) 4-метилпиразола в 20 мл диэтилового эфира. Смесь нагревают до полного выпаривания эфира и температуру доводят до 100°С. При этой температуре выдерживают 5 часов. Остаток кристаллизуют из изопропанола. Выход 7,2 г (89,5%). ЯМР 1Н спектр (200 мГц, ДМСО-Д6): 1,75 с (12H,Ad), 2,05 d (3H, CH3), 2,15 с (3Н, Ad), 7,2 с (1H, PYR), 7,5 с (1Н, PYR). Масс-спектр, m/z: 216 (M+, 100%), 135 (Ad+, 98%), 81 ([M-Ad]+, 43,6%). Пример 4. Синтез N-(адамантил}-3,4-динитропиразола К 3,375 г (0,025 моль) 1,3-дегидроадамантана в 20 мл диэтилового эфира приливают раствор 4 г (0,025 моль) 3,4-динитропиразола в 30 мл диэтилового эфира. Смесь нагревают до полного выпаривания эфира и температуру доводят до 100°С. При этой температуре выдерживают 5 часов. Остаток кристаллизуют из изопропанола. Выход 5,13 г (70,3%). Полученный продукт представляет собой белое кристаллическое вещество с tпл=141-143°С. Масс-спектр, m/z: 292 (М+, 18,8%), 275 ([М-О]+, 15,2%), 245 ([М-С4H9]+ 12%), 158 ([M-Ad]+, 2,8%), 135 (Ad+, 100%). Пример 5. Синтез N-(адамантил)-1,2,4-триазола. К 2,7 г (0,02 моль) 1,3-дегидроадамантана в 20 мл диэтилового эфира приливают раствор 1,38 г (0,02 моль) 1,2,4-триазола в 30 мл диэтилового эфира. Смесь нагревают до полного выпаривания эфира и температуру доводят до 100°С. При этой температуре выдерживают 4,5 часов. Остаток кристаллизуют из гептана. Выход 3,65 г (89,8%). Спектр ПМР (СДCl3), Пример 6. Синтез N-(адамантил)-3-метил-1,2,4-триазола. К 4,73 г (0,035 моль) 1,3-дегидроадамантана в 30 мл диэтилового эфира приливают раствор 3,96 г (0,035 моль) 3-метил-1,2,4-триазола в 20 мл диэтилового эфира. Смесь нагревают до полного выпаривания эфира и температуру доводят до 100°С. При этой температуре выдерживают 5 часов. Остаток кристаллизуют из изопропанола. Выход 6,74 г (88,7%). ЯМР 1Н спектр: 1,68 с (12Н, Ad), 2,18 d (3Н, Ad), 2,9 т (3Н, СН3), 7,7 с (1H, TRY). Пример 7. Синтез N-(адамантил)-3-нитро-1,2,4-1триазола. К 4,73 г (0,035 моль) 1,3-дегидроадамантана в 30 мл диэтилового эфира приливают раствор 3,96 г (0,035 моль) 3-нитро-1,2,4-триазола в 20 мл диэтилового эфира. Смесь нагревают до полного выпаривания эфира и температуру доводят до 100°С. При этой температуре выдерживают 5 часов. Остаток кристаллизуют из изопропанола. Выход 6,2 г (71,5%). ЯМР 1Н спектр (200 мГц, СДCl3), Масс-спектр, m/z: 248 (М+, 29%), 191 ([M-C4H9]+ 2,4%), 149 ([AdN+], 4,9%), 135 (Ad+, 100%). Пример 8. Синтез 1-адамантил-5-метилтетразола. К 6,75 г (0,05 моль) 1,3-дегидроадамантана в 30 мл диэтилового эфира приливают раствор 4,2 г (0,05 моль) 5-метилтетразола в 30 мл диэтилового эфира. Смесь нагревают до полного выпаривания эфира и температуру доводят до 100°С. При этой температуре выдерживают 4,5 часов. Остаток кристаллизуют из гептана. Выход 9,74 г (89,8%). Полученный продукт представляет собой белое кристаллическое вещество с tпл=115-116°С. Спектр ПМР (СДCl3), Выводы. Разработан технологически универсальный, малостадийный метод синтеза адамантилсодержащих азолов, протекающий с высоким выходом целевого продукта. Структура описанных соединений подтверждена ПМР, ЯМР1Н и масс-спектрами.
Формула изобретения
Способ получения адамант-1-илсодержащих азолов общей формулы заключающийся в присоединении к производному адамантана соответствующего азола, отличающийся тем, что в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве азола 2-метилимидазол, 3(5)-метилпиразол и 4-метилпиразол, 3,4-динитропиразол, 1,2,4-триазол, 3-метилтриазол и 3-нитро-1,2,4-триазол, 5-метилтетразол, и процесс проводят при мольном соотношении 1,3-дегидроадамантана и азола, равном 1:1, в среде диэтилового эфира, при температуре 100°С, в течение 4-5 ч.
|
||||||||||||||||||||||||||









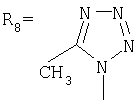

















 – орбиталей, в результате электрофильная атака по атомам углерода в этих молекулах затруднена. Влияние дополнительных атомов азота также может сказываться на кислотных и основных свойствах гетероциклов. С одной стороны, свободные пары электронов атомов азота определяют направление протонирования, и большинство азолов проявляет себя как более сильные основания, чем пиррол. С другой стороны, азолил-анионы более устойчивы, чем пирролил-анион, поэтому азолы, содержащие группы NH, более сильные кислоты, чем пиррол. Так, для 2-метилимидазола величина рКа=14, для 3-метилпиразола рКа=3,27, для 3,4-динитропиразола рКа=-2. Имидазол представляет собой основание средней силы, другие азолы – слабые основания; сила основания обычно уменьшается с увеличением числа атомов азота в молекуле из-за индуктивного электроноакцепторного влияния дополнительных атомов азота. Одним из следствий повышенной подвижности протонов N-незамещенных азолов можно назвать легкость образования водородных связей в жидких и твердых фазах, а также гораздо большую растворимость в воде. Другое важное следствие NH-кислотности заключается в том, что таутомерные формы N-незамещенных диазолов, триазолов и тетразолов существуют в виде ассоциатов за счет межмолекулярного переноса протона. Высокая нуклеофильность 1,3-дегидроадамантана позволяет получать продукты присоединения данных азолов с высокими выходами в достаточно мягких условиях в одну стадию.
– орбиталей, в результате электрофильная атака по атомам углерода в этих молекулах затруднена. Влияние дополнительных атомов азота также может сказываться на кислотных и основных свойствах гетероциклов. С одной стороны, свободные пары электронов атомов азота определяют направление протонирования, и большинство азолов проявляет себя как более сильные основания, чем пиррол. С другой стороны, азолил-анионы более устойчивы, чем пирролил-анион, поэтому азолы, содержащие группы NH, более сильные кислоты, чем пиррол. Так, для 2-метилимидазола величина рКа=14, для 3-метилпиразола рКа=3,27, для 3,4-динитропиразола рКа=-2. Имидазол представляет собой основание средней силы, другие азолы – слабые основания; сила основания обычно уменьшается с увеличением числа атомов азота в молекуле из-за индуктивного электроноакцепторного влияния дополнительных атомов азота. Одним из следствий повышенной подвижности протонов N-незамещенных азолов можно назвать легкость образования водородных связей в жидких и твердых фазах, а также гораздо большую растворимость в воде. Другое важное следствие NH-кислотности заключается в том, что таутомерные формы N-незамещенных диазолов, триазолов и тетразолов существуют в виде ассоциатов за счет межмолекулярного переноса протона. Высокая нуклеофильность 1,3-дегидроадамантана позволяет получать продукты присоединения данных азолов с высокими выходами в достаточно мягких условиях в одну стадию.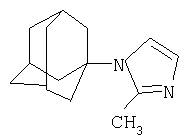




 , м.д: 1,67 с (12Н, Ad), 2,29 с (3Н, Ad), 7,60 с (1Н, TRY), 8,1 c (1H, TRY).
, м.д: 1,67 с (12Н, Ad), 2,29 с (3Н, Ad), 7,60 с (1Н, TRY), 8,1 c (1H, TRY).