|
|
(21), (22) Заявка: 2005113212/04, 03.05.2005
(24) Дата начала отсчета срока действия патента:
03.05.2005
(46) Опубликовано: 27.06.2006
(56) Список документов, цитированных в отчете о
поиске:
US 3215719, 02.11.1965. КОБРАКОВ К.И. и др., Оценка эффективности биозащитных свойств азокрасителей, содержащих 3,5-дихлорпиридильный фрагмент, Текстильная химия, 2004, №4, стр.10-16. RU 2182614 C1, 20.05.2002. RU 2100499 C1, 27.12.1997.
Адрес для переписки:
119991, Москва, ГСП-1, М. Калужская, 1, Московский государственный текстильный университет им. А.Н. Косыгина
|
(72) Автор(ы):
Измайлов Борис Александрович (RU),
Кобраков Константин Иванович (RU),
Журавлева Нина Васильевна (RU),
Станкевич Галина Сергеевна (RU),
Скрипникова Виктория Сергеевна (RU)
(73) Патентообладатель(и):
Московский государственный текстильный университет им. А.Н. Косыгина (RU)
|
(54) АЛКОКСИСИЛОКСАНОВЫЕ ПРОИЗВОДНЫЕ 3,5-ДИХЛОР-2-(4-ОКСИФЕНОКСИ)ПИРИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Реферат:
Описываются алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина общей формулы 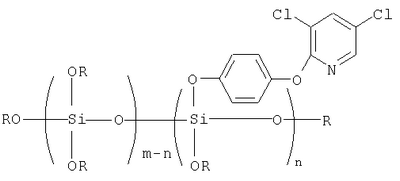 где R=СН3, С2Н5, С3Н7, С4Н9; m=2-6; n=1-5, и способ получения. Техническим результатом является использование алкоксисилоксановых производных 3,5-дихлор-2-(4-оксифенокси)пиридина в качестве биологически активных неокрашенных (бесцветных) соединений и применение их как биоцидных препаратов для пропитки и отделки текстильных материалов из различных волокон (природных, искусственных, синтетических) с целью защиты их от биоповреждений. 2 н.п. ф-лы, 3 табл. где R=СН3, С2Н5, С3Н7, С4Н9; m=2-6; n=1-5, и способ получения. Техническим результатом является использование алкоксисилоксановых производных 3,5-дихлор-2-(4-оксифенокси)пиридина в качестве биологически активных неокрашенных (бесцветных) соединений и применение их как биоцидных препаратов для пропитки и отделки текстильных материалов из различных волокон (природных, искусственных, синтетических) с целью защиты их от биоповреждений. 2 н.п. ф-лы, 3 табл.
Изобретение относится к химии элементоорганических соединений, конкретно к химии кремнийорганических соединений – алкоксисилоксановым производным 3,5-дихлор-2-(4-оксифенокси)пиридина, которые могут быть использованы в качестве биоцидных препаратов.
Известны азокрасители, содержащие 3,5-дихлорпиридильный радикал, которые используются для защиты текстильных материалов из волокон различных типов от биоповреждений [Кобраков К.И., Шарипова Э.А., Станкевич Г.С., Дмитриева М.Б., Балабанова Л.В. Оценка эффективности биозащитных свойств азокрасителей, содержащих 3,5-дихлорпиридильный фрагмент. Текстильная химия, 2004, №4, с.10-16]. Перспективность использования таких азокрасителей для колорирования текстильных материалов и их защиты от биоповреждений очевидна. Однако такие азокрасители совершенно не пригодны для защиты от биоповреждений текстильных материалов, которые ранее уже были подвергнуты крашению в другие цвета, а также текстильных материалов, представляющих собой музейные экспонаты, которые подлежат длительному хранению или реставрации и требуют защиты от биоповреждений.
Целью настоящего изобретения является синтез алкоксисилоксановых производных 3,5-дихлор-2-(4-оксифенокси)пиридина, которые могли бы быть использованы в качестве биоцидных препаратов.
Указанный технический результат достигается тем, что предложены алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина общей формулы
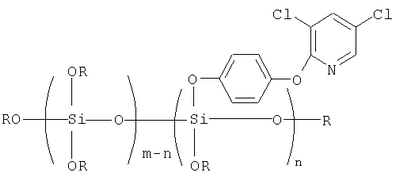
где R=СН3, С2Н5, С3Н7, С4Н9;
m=2-6; n=1-5.
3,5-Дихлор-2-(4-оксифенокси)пиридин конденсируют с алкоксисилоксанами при нагревании с одновременной отгонкой алифатического спирта.
Алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина являются биологически активными соединениями. Они могут быть использованы как биоцидные препараты для защиты текстильных материалов от биоповреждений микроорганизмами, бактериями и грибами.
Алкоксисилоксановые производные получают конденсацией 3,5-дихлор-2-(4-оксифенокси)пиридина с алкоксисилоксанами при нагревании с одновременной отгонкой от реакционной смеси алифатического спирта.
Указанные соединения, их свойства и способ получения в литературе не указаны.
В предложенном способе используют следующие алкоксисилоксаны: гексаметоксидисилоксан, октаэтокситрисилоксан, декапропокситетрасилоксан, тетрадекабутоксигексасилоксан, этилсиликат-40.
Указанные алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина являются биологически активными неокрашенными (бесцветными) соединениями и могут применяться как биоцидные препараты в виде растворов в органических растворителях, водных эмульсий и других форм для пропитки и отделки текстильных материалов из различных волокон (природных, искусственных, синтетических) с целью защиты их от биоповреждений.
Для лучшего понимания данного изобретения приводятся следующие примеры получения указанных соединений.
Пример 1. Пентаметокси[3,5-дихлор-2-(4-оксифенокси)пиридил]дисилоксан (I).
Смесь 25,8 г (0,1 моль) гексаметоксидисилоксана с 25,6 г (0,1 моль) 3,5-дихлор-2-(4-оксифенокси)пиридина в 100 мл толуола нагревают в течение 15-20 мин до начала выделения метанола и кипятят при 67-70°С, отгоняя одновременно от реакционной смеси 3,2 г (0,1 моль) метанола. Остаток охлаждают, фильтруют через керамический фильтр, отгоняют на роторном испарителе толуол и получают 45,8 г (95%) соединения (I) в виде смолообразного продукта, d4 20 1,040 г/см3.
Найдено, %: С 39,78; Н 4,35; Si 11,72; N 2,80; Cl 14,58; ОСН3 32,0; М 480.
C16H21Si2N1Cl2O8
Вычислено, %: С 39,83; Н 4,38; Si 11,63; N 2,90; Cl 14,71; ОСН3 32,15; М 482.
Данные ИК-спектров, см-1:  C-Cl 740-800; C-Cl 740-800;  SiOC 810; SiOC 810;  SiOSi 1050-1080; SiOSi 1050-1080;  Pyridyl 1040, 1520-1660. Pyridyl 1040, 1520-1660.
Пример 2. Гексаэтоксиди[3,5-дихлор-2-(4-оксифенокси)пиридил]трисилоксан (II).
Смесь 47,7 г (0,1 моль) октаэтокситрисилоксана с 51,2 г (0,2 моль) 3,5-дихлор-2-(4-оксифенокси)пиридина в 200 мл толуола нагревают в течение 25-30 мин до начала выделения этанола и кипятят при 80-83°С, отгоняя одновременно от реационной смеси 9,2 г (0,2 моль) этанола. Остаток охлаждают, фильтруют через керамический фильтр, отгоняют на роторном испарителе толуол и получают 86,1 г (96%) соединения (II) в виде смолообразного продукта, d4 20 1,050 г/см3.
Найдено, %: С 45,63; Н 4,83; Si 9,47; N 3,0; Cl 15,68; OC2H5 28,7; М 890.
C34H42Si3N2Cl4O12
Вычислено, %: С 45,52; Н 4,72; Si 9,39; N 3,12; Cl 15,83; OC2H5 30,10; М 897.
Данные ИК-спектров, см-1:  C-Cl 740-800; C-Cl 740-800;  SiOC 810; SiOC 810;  SiOSi 1050-1080; SiOSi 1050-1080;  Pyridyl 1040, 1520-1660. Pyridyl 1040, 1520-1660.
Пример 3. Гептапропокси-три-[3,5-дихлор-2-(4-оксифенокси)пиридил]тетрасилоксан (III).
Смесь 7,51 г (0,01 моль) декапропокситетрасилоксана с 7,68 (0,03 моль) 3.5-дихлор-2-(4-оксифенокси)пиридина в 30 мл толуола нагревают в течение 30 мин до начала выделения пропанола и кипятят при 98-100°С, одновременно отгоняя от реакционной смеси 1,8 г (0,03 моль) пропанола. Остаток охлаждают, фильтруют через керамический фильтр, отгоняют на роторном испарителе толуол и получают 12,8 г (96%) соединения (III) в виде смолообразного продукта, d4 20 1,070 г/см3.
Найдено, %: С 48,57; Н 5,12; Si 8,58; N 3,0; Cl 15,73; ОС3Н7 30,12; М 1330.
C54H67Si4N3Cl6O16
Вычислено, %: С 48,42; Н 5,04; Si 8,38; N 3,13; Cl 15,90; OC3H7 30,84; М 1339.
Пример 4. Нонабутокси-пента-[3,5-дихлор-2-(4-оксифенокси)пиридил]гексасилоксан (IV).
Смесь 12,72 г (0,01 моль) тетрадекабутоксигексасилоксана с 12,8 г (0,05 моль) 3,5-дихлор-2-(4-оксифенокси)пиридина в 60 мл дибутилового эфира нагревают в течение 30 мин до начала выделения бутанола и кипятят при 118-122°С, одновременно отгоняя от реакционной смеси 3,5 г (0,05 моль) бутанола. Остаток охлаждают, фильтруют через керамический фильтр, отгоняют на роторном испарителе дибутиловый эфир и получают 18,1 г (96%) соединения (ГУ) в виде смолообразного продукта, d4 20 1,090 г/см3.
Найдено, %: С 42,0; Н 5,81; Si 8,73; N 3,63; Cl 18,73; OC4H9 34,3; М 1880.
C66H111Si6N5Cl10O24
Вычислено, %: С 42,11; Н 5,94; Si 8,95; N 3,72; Cl 18,86; ОС4Н9 34,90; М 1882.
Пример 5. Гексаэтокси-тетра[3,5-дихлор-2-(4-оксифенокси)пиридил]тетрасилоксан (V).
Аналогично примеру 2 из 6,11 г (0,01 моль) декаэтокситетрасилоксана и 10,24 г (0,04 моль) 3,5-дихлор-2-(4-оксифенокси)пиридина в 40 мл толуола получают 14,0 г (96%) соединения (V) в виде смолообразного продукта, d4 20 1,055 г/см3.
Найдено, %: С 46,53; Н 3,68; Si 7,63; N 3,47; Cl 19,31; ОС2Н5 18,20; М 1450.
C56H54Si4N4Cl8O17
Вычислено, %: С 46,34; Н 3,75; Si 7,74; N 3,86; Cl 19,56; OC2H5 18,60; М 1451.
Данные ИК-спектров, см-1:  C-Cl 740-800; C-Cl 740-800;  SiOC 810; SiOC 810;  SiOSi 1050-1080; SiOSi 1050-1080;  Pyridyl 1040, 1520-1660. Pyridyl 1040, 1520-1660.
Синтезированные соединения (I-V) хорошо растворимы в алифатических и ароматических углеводородах, спиртах, эфире, ТГФ, диоксане, ацетоне, алкоксисилоксанах и не растворимы в воде. Они являются биологически активными соединениями.
В табл.1 приведены результаты испытаний добавок соединений (I-V) на рост тест-культур на жидкой среде Чапека, проведенных по ГОСТ 9048-15.
В пробирки с жидкой питательной средой Чапека (2 мл) добавляют растворы соединений (I-V) (0,5 мл) с таким расчетом, чтобы их конечная концентрация была 0,1 и 0,01% от всего объема жидкости в пробирках. (При приготовлении среды Чапека учитывают последующие разведения соединениями (I-V) и суспензией тест-культур). Затем в пробирки вносят 0,5 мл суспензии спор тест-культур двухнедельного возраста. В качестве тест-культур используют следующие плесневые грибы:
Aspergillus niger v.Teigh,
Aspergillus flavus Wink Fr.,
Penicillium chrysogenum Westling,
Ulocladium ilicis Thom (бывшее название Stemphylium).
Пробирки инкубируют при 24°С в течение пяти суток. Контролем служат тест-культуры, выращенные в таких же условиях, но без добавления соединений (I-V). На пятые сутки оценивают характер роста грибов по шестибальной шкале:
5 – воздушный и субстратный мицелий;
4 – спороношение и воздушный мицелий подавлены;
3 – субстратный мицелий хорошо развит, воздушный отсутствует;
2 – субстратный мицелий подавлен;
1 – вместо мицелия взвесь клеток и фрагментов гиф (муть);
0 – рост полностью отсутствует.
Из данных табл.1 видно, что соединения (I-V) являются биоцидными, т.к. уже в количестве 0,01-0,1% масс. полностью подавляют рост указанных плесневых грибов.
Соединения (I-V) могут применяться в качестве биоцидных препаратов в виде растворов в органических растворителях, водных эмульсий и других форм для пропитки и отделки текстильных материалов из различных волокон с целью их защиты от биоповреждений.
Пропитку текстильного материала, в том числе и музейного экспоната из текстиля, проводят методом смачивания материала раствором в органическом растворителе или водной эмульсией соединения (I-V) заданной концентрации – 0,01, 0,1, 1, 5, 10, 15%-ной, сушкой при комнатной температуре, после чего проводят закрепление биоцидного соединения термообработкой при 140°С в течение 5 мин, либо выдерживанием на стеллажах при комнатной температуре в течение 24 суток. Введение в пропиточную ванну препарата АГМ9 ( -аминопропилтриэтоксисилана) в количестве 0,2-2% от массы силикона позволяет заменить термообработку при 140-150°С сушкой при 100°С. -аминопропилтриэтоксисилана) в количестве 0,2-2% от массы силикона позволяет заменить термообработку при 140-150°С сушкой при 100°С.
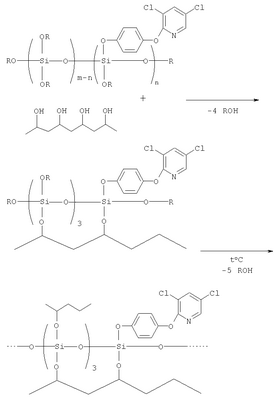
В результате указанной обработки соединения (I-V) ковалентно закрепляются на поверхности волокон текстильного материала вследствие конденсации алкоксигрупп соединения с функциональными группами полимера волокон (схема 1).
Сравнение характера роста на опытных образцах и в контроле – на питательной среде позволяет количественно оценить степень биостойкости материалов
К=Т0/Tк,
где К – коэффициент замедления роста;
Тк – длительность (час) развития спор до момента появления стадии ветвления в контроле (для бактерий Aspergillus niger и Ulocladium ilicis равно 10 и 34 час. соответственно);
Т0 – то же, на опытных образцах.
Коэффициент К показывает во сколько раз замедляется рост бактерий на испытуемых образцах по сравнению с контролем. Чем выше К, тем сильнее выражены биоцидные свойства образцов.
В табл.2 приведены результаты определения биостойкости опытных образцов шерстяной ткани.
Из данных табл.2 видно, что соединения I-V уже в количестве 0,01-0,1% масс. на шерстяной ткани полностью обеспечивают 100%-ное подавление роста испытуемых тест-культур и предохраняют ткани от биоповреждений.
Устойчивость к микробиологическому разрушению с применением почвенного метода (ГОСТ 9.060-75) определяется по показателю коэффициента устойчивости к микробиологическому разрушению П, %.
В табл.3 представлены данные по устойчивости хлопчатобумажной ткани к микробиологическому разрушению, обработанной соединениями I-V.
Из приведенных результатов видно, что хлопчатобумажная ткань не подвергается микробиологическому разрушению. Антимикробные свойства сохраняются после 3-5 стирок.
Таблица 1
Биоцидная активность соединений I-V на тест-культурах по шестибалльной шкале, определенная по ГОСТ 9048-75 |
| Соединение |
Тест-культуры |
| № |
Концентрация,% |
Aspergillus niger |
Aspergillus flavus |
Penicillium chrysogenum |
Ulocladium ilicis |
| I |
0.1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| |
0.01 |
1 |
1 |
0 |
0 |
1 |
1 |
2 |
2 |
| II |
0.1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| |
0.01 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
1 |
| III |
0.1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| |
0.01 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| IV |
0.1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| |
0.01 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| V |
0.1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| |
0.01 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| Контроль |
0 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
| |
0 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
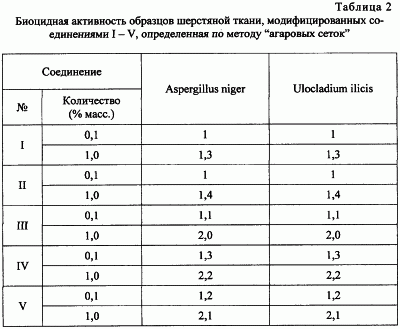
Таблица 3
Устойчивость хлопчатобумажной ткани к микробиологическому разрушению, определенная по ГОСТ 9.060-75 |
| Соединение |
Коэффициент устойчивости к микробиологическому разрушению, % |
| № |
Количество (% масс.) |
До стирки |
После 1-й стирки |
После 3-х стирок |
| I |
0,1 |
89,2 |
88,9 |
87,8 |
| |
0,2 |
97,9 |
97,3 |
96,7 |
| II |
0,1 |
88,5 |
88,0 |
87,3 |
| |
0,2 |
98,3 |
98,0 |
97,6 |
| III |
0,1 |
89,4 |
88,5 |
87,7 |
| |
0,2 |
99,6 |
99,0 |
98,6 |
| IV |
0,1 |
87,4 |
87,0 |
86,6 |
| |
0,2 |
94,5 |
93,8 |
93,0 |
| V |
0,1 |
88,7 |
87,6 |
86,3 |
| |
0,2 |
95,1 |
94,8 |
94,3 |
| Контроль |
0 |
50 |
– |
– |
| |
0 |
49 |
– |
– |
Схема 1
Формула изобретения
1. Алкоксисилоксановые производные 3,5-дихлор-2-(4-оксифенокси)пиридина общей формулы
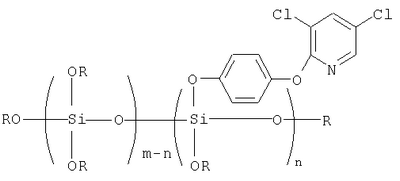
где R – СН3, С2Н5, С3Н7, С4Н10;
m=2-6; n=1-5.
2. Способ получения соединения по п.1, отличающийся тем, что 3,5-дихлор-2-(4-оксифенокси)пиридин конденсирует с алкоксисилоксанами при надевании с одновременной отгонкой алифатического спирта.
|
|