|
|
(21), (22) Заявка: 2004135497/04, 06.12.2004
(24) Дата начала отсчета срока действия патента:
06.12.2004
(46) Опубликовано: 20.06.2006
(56) Список документов, цитированных в отчете о
поиске:
RU 2188200, С2, 27.08.2002. RU 2223963, C1, 20.02.2004. US 5190966, А, 02.03.1993. US 5451599 А, 19.09.1995.
Адрес для переписки:
123995, Москва, ГСП-5, ул. Б. Садовая, 1, корп.4, ФГУП “ГНЦ “НИОПИК”
|
(72) Автор(ы):
Барканова Светлана Васильевна (RU),
Быстрицкий Георгий Иосифович (RU),
Ворожцов Георгий Николаевич (RU),
Кармакова Татьяна Анатольевна (RU),
Лужков Юрий Михайлович (RU),
Лукьянец Евгений Антонович (RU),
Макарова Елена Александровна (RU),
Морозова Наталья Борисовна (RU),
Умнова Любовь Васильевна (RU),
Якубовская Раиса Ивановна (RU)
(73) Патентообладатель(и):
Федеральное Государственное унитарное предприятие “Государственный научный центр “Научно-исследовательский институт органических полупродуктов и красителей” (RU)
|
(54) ТЕТРААЗАХЛОРИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ
(57) Реферат:
Изобретение относится к медицине, а более конкретно – к фотосенсибилизаторам для фотодинамической терапии (ФДТ) новообразований и ряда других заболеваний. Изобретение описывает тетраазахлорины общей формулы
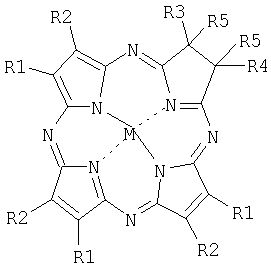
где R1R2=С6H4, R3=R4=R5=CH3, М=НН (Н2ТВТАС);
R1R2=1,2-С10Н6; R3=R4=R5=СН3, M=Zn(Zn-1,2-TNTAC);
R1=R2=C6H5; R3=R4=R5=СН3, М=НН (H2TACPh6);
R1=R3=H, R2=R4=C6H5, R5R5=СН2N(СН3)СН2, М=НН (H2PyrTACPh4);
R1R2=4-C(CH3)3C6H3, R3=R4-Н, R5R5=CH2N(CH3)CH2, М=НН (H2TBtTACPyrN-Me).
в качестве фотосенсибилизаторов ближней ИК области спектра для фотодинамической терапии. Описываемые фотосенсибилизаторы обладают интенсивным поглощением в спектральной области 710-750 нм и могут быть использованы для лечения методом ФДТ глубоких опухолевых тканей. 1 ил., 5 табл.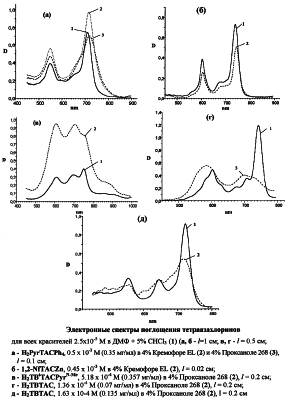
Настоящее изобретение относится к медицине, а более конкретно – к фотосенсибилизаторам для фотодинамической терапии (ФДТ) новообразований и ряда других заболеваний.
Метод ФДТ основан на использовании препаратов – фотосенсибилизаторов, которые обладают способностью при введении в организм накапливаться преимущественно в опухоли. При последующем световом, например лазерном, облучении патологического участка молекулы фотосенсибилизатора катализируют образование цитотоксических агентов, в частности синглетного кислорода, разрушающих опухолевые клетки.
Недостатком применяющихся в клинической практике фотосенсибилизаторов на основе производных гематопорфиринов, например HPD (hematoporphyrin derivative), фотофрин-2, является невысокая интенсивность поглощения в полосе фотовозбуждения (625-640 нм). Значительное собственное поглощение биологической ткани в этой спектральной области обусловливает малую глубину проникновения излучения и затрудняет лечение опухолей больших размеров (R. Bonnett. Photosensitizers of the porphyrin and phthalocyanine series for photodynamic therapy. Chem. Soc. Rev., 24(1), 19-33, 1995). В этом отношении преимущество имеют фотосенсибилизаторы на основе хлоринов (дигидропорфиринов), более интенсивная длинноволновая полоса поглощения которых смещена в красную область по сравнению с порфиринами. Среди них следует отметить водорастворимые моно-L-аспартилхлорин e6u (препараты NPe6, MACE) и другие различные формы хлорина e6, в частности отечественные препараты “Фотодитазин”, “Радахлорин”, а также синтетические хлорины – 5,10,15,20-тетракис(м-гидроксифенил)хлорин (темопорфин, m-THPC, фоскан) и производные бензопорфирина (бензопорфирин монокислота, кольцо А) с максимумом поглощения при 690 нм. Однако эти соединения весьма труднодоступны, к тому же их коэффициент экстинкции, как правило, невысок.
Весьма перспективными фотосенсибилизаторами являются производные фталоцианина, тетрабензотетраза – аналога порфиринов. Так, фотосенсибилизатор “Фотосенс” на основе сульфированного фталоцианина гидроксиалюминия, поглощающий при 675 нм с коэффициентом экстинкции, превышающим 105 л×моль-1·см-1 (E.A.Лукьянец. Новые сенсибилизаторы для фотодинамической терапии. Росс. хим. журнал, 42(5), 9-16, 1998), разрешен к клиническому применению в России для лечения ряда онкозаболеваний различных локализаций. Однако и в области поглощения “Фотосенса” собственное поглощение несенсибилизированных тканей остается значительным. Известно, что оно является минимальным только при длинах волн, превышающих 700 нм, в области так называемого “терапевтического окна”. Кроме того, недостатком “Фотосенса” является длительное удерживание в коже, что требует тщательного соблюдения пациентами светового режима. “Фотосенс” является наиболее близким аналогом предлагаемых в настоящей заявке фотосенсибилизаторов.
В предлагаемом изобретении ставится задача создания фотосенсибилизаторов для ФДТ с интенсивным поглощением в спектральной области 710-750 нм. Указанная задача решается тем, что в качестве фотосенсибилизатора для ФДТ предлагаются новые соединения – производные тетраазахлорина – общей формулы
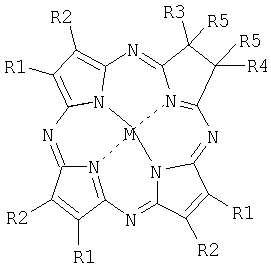
где R1R2=С6Н4, R3=R4=R5=СН3, М=НН(H2TBTAC);
R1R2=1,2-С10Н6; R3=R4=R5=СН3, М=Zn(Zn-1,2-TNTAC);
R1=R2=С6Н5; R3=R4=R5=СН3, М=НН (H2TACPh6);
R1=R3=Н, R2=R4=С6Н5, R5R5=СН2N(СН3)СН2, М=НН (H2PyrTACPh4);
R1R2=4-С(СН3)3С6Н3, R3=R4=Н, R5R5=СН2N(СН3)СН2, М=НН (H2TBtTACPyrBN-Me).
например, тетраметилтрибензотетраазахлорин (Н2ТВТАС), тетраметилтри-1,2-нафто-тетраазахлорин цинка (Zn-1,2-TNTAC), тетраметилгексафенилтетраазахлорин (Н2TACPh6), N-метилпирролидино-[3,4-b]тетрафенилтетраазахлорин (H2PyrTACPh4), N-метилпирролидино-[3,4-b]три-(4′-трет.-бутил)бензотетраазахлорин (H2TBtTACPyrN-Ме).
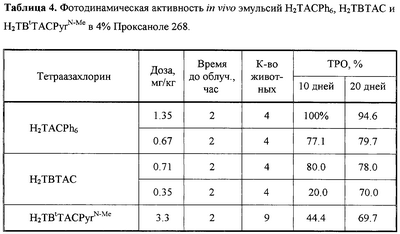
Предлагаемые производные тетраазахлорина синтезированы по разработанным нами методам. Тетраметилтрибензотетраазахлорин (Н2ТВТАС) и гексафенилтетраазахлорин (Н2TACPh6) получены конденсацией смеси тетраметилсукцинонитрила с соответствующими 1,2-динитрилами в диметиламиноэтаноле в присутствии диметиламиноэтилата лития, а три-1,2-нафтотетраазахлорин цинка (Zn-1,2-TNTAC) – аналогичной конденсацией в высококипящих органических растворителях в присутствии хлорида цинка [Патент РФ №2188200, кл. C 07 D 487/22 (2002). БИ №24 (2002)]. N-Метилпирролидино[3,4-b]тетрафенилтетраазахлорин (H2PyrTACPh4) и -три-(4′-трет.-бутил)бензотетраазахлорин (Н2ТВtACPyrN-Me) получены по аналогии с тетраарилпорфиринами (Silva A.M.G, Tome AC., Neves G.P.M.S., Silva A.M.S, Cavaleiro J.A.S., II J.Chem. Soc. Chem. Commun., 1999, р.1767) реакцией 1,3-циклоприсоединения соответствующих тетраазапорфинов с азометинилидом, генерируемым in situ из N-метилглицина и параформа. Все синтезированные тетраазахлорины нерастворимы в воде и использовались в виде их эмульсий в водных 4% растворах Кремофора EL и Проксанола 268 (таблица 1, чертеж).
Настоящее изобретение иллюстрируется следующими примерами.
ПРИМЕР 1. Синтез N-метилпирролидино[3,4-b]тетрафенилтетраазахлорина (H2PyrTACPh4). Нагревают при перемешивании раствор 50 мг (0.08 ммоль) тетрафенилтетраазапорфина в 5 мл о-дихлорбензола до 100°С в атмосфере аргона и добавляют 14 мг (0.16 ммоль) саркозина и 12 мг (0.4 ммоль) параформа. Далее реакционную смесь нагревают до 150°С и выдерживают при этой температуре в течение 1.5 ч. Затем охлажденную реакционную массу хроматографируют на силикагеле хлороформом. Вторую фракцию (смесь хлорина и изобактериохлорина) повторно хроматографируют на окиси алюминия толуолом. Собирают малиновую фракцию и после удаления растворителя получают 15 мг (27.5%) H2PyrTACPh4. Масс-спектр, m/z: 675 (М+). ЭСП,  макс.(соотношение интенсивностей), хлороформ: 711 (1.0), 656 пл. (0.39), 547 (0.49), 358 (1.02), 333 (0.99). макс.(соотношение интенсивностей), хлороформ: 711 (1.0), 656 пл. (0.39), 547 (0.49), 358 (1.02), 333 (0.99).
Аналогично из три-(4′-трет.-бутил)бензотетраазапорфина получен N-метилпирролидино-[3,4-b]три-(4′-трет.-бутил)бензотетраазахлорин (H2TBtTACPyrN-Me).
ПРИМЕР 2. Синтез тетраметилгексафенилтетраазахлорина (H2TACPh6). Растворяют 0.01 г (14 ммоль) лития при нагревании в 20 мл диметиламиноэтанола, охлаждают до комнатной температуры. Добавляют смесь 0.82 г (3.6 ммоль) дифенилмалеонитрила и 0.49 г (3.6 ммоль) тетраметилсукцинонитрила, медленно нагревают при перемешивании до кипения и продолжают кипячение в течение 4 часов. Затем реакционную смесь охлаждают, разбавляют 100 мл воды, выпавший осадок отфильтровывают, промывают последовательно горячей водой, 50% водным этанолом, сушат на воздухе. Остаток растирают, экстрагируют этанолом для удаления примесей, затем хлорбензолом. Хлорбензольный экстракт упаривают в вакууме и хроматографируют на силикагеле хлороформом, собирают малиновую фракцию. Получают 0.025 г (3.8%) H2TACPh6. Найдено, %: С 78.45; Н 5.66; N 12.76. C56H44N8H2O. Вычислено, %: С 79.41; Н 5.47; N 13.23. Масс-спектр, m/z: 829.2 (М+). Электронный спектр поглощения.  макс., нм (lg макс., нм (lg  ), хлороформ: 727 (4.63), 691пл. (3.85), 662пл. (3.69), 557 (4.10), 488 (3.57), 371 (4.32), 336 (4.33). ), хлороформ: 727 (4.63), 691пл. (3.85), 662пл. (3.69), 557 (4.10), 488 (3.57), 371 (4.32), 336 (4.33).
ПРИМЕР 3. Определение фототоксичности N-метилпирролидино[3,4-b]тетрафенилтетраазахлорина безметального (H2PyrTACPh4) in vitro.
Тестирование проводили на культуре клеток эпидермоидной карциномы гортаноглотки человека НЕр2. Клетки рассевали в концентрации 40×103 кл/мл в лунки 96-луночного планшета (“Costar”, США) в среде ИГЛА-МЕМ, содержащей 7% эмбриональную телячью сыворотку. Через 24 часа (начало логарифмической фазы роста культуры) вносили вещество в последовательных разведениях, инкубировали клетки в течение 2-5 часов и проводили облучение галогеновой лампой мощностью 500 Вт с использованием фильтра КС-13 (  640 нм). Плотность мощности составляла 13.6-15.0 мВт/см2. Расчетная световая доза во всех экспериментах составляла 10 Дж/см2. Контролем служили: 1) клетки, не подвергавшиеся обработке красителем, растворителем и облучению, 2) клетки, подвергавшиеся облучению без предварительной инкубации с красителем, 3) клетки, инкубированные с красителем без последующего облучения, 4) клетки, обработанные 4% Кремофором с последующим облучением. 640 нм). Плотность мощности составляла 13.6-15.0 мВт/см2. Расчетная световая доза во всех экспериментах составляла 10 Дж/см2. Контролем служили: 1) клетки, не подвергавшиеся обработке красителем, растворителем и облучению, 2) клетки, подвергавшиеся облучению без предварительной инкубации с красителем, 3) клетки, инкубированные с красителем без последующего облучения, 4) клетки, обработанные 4% Кремофором с последующим облучением.
Результаты определения фототоксичности приведены в таблице 2.
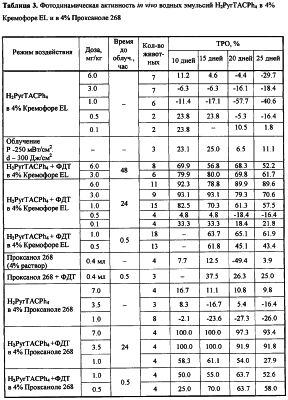
ПРИМЕР 4. Определение фотодинамической активности водных эмульсий тетраазахлоринов in vivo.
Солидную форму асцитной карциномы Эрлиха (ОЭ) прививали подкожно на наружную поверхность нижней конечности мышей-самок линии СВА. Для имплантации использовали разведенную асцитическую жидкость (2.2×106 опухолевых клеток), взятую от мыши-донора на 7 день роста опухоли.
Образцы тетраазахлоринов в 4% Кремофоре EL или Проксаноле 268 фильтровали через мембранный фильтр 0.22 мкм и вводили животным внутривенно (в хвостовую вену) однократно на 6 день роста опухоли за 48, 24 или 0.5 часа до проведения ФДТ.
Сенсибилизированную опухоль облучали с помощью аппарата терапевтического онкологического для фотодинамической терапии АТО-1 и фильтрами КС-18 с максимумом пропускания на длине волн 700 нм и СЗС для фильтрации ультрафиолетовой части спектра. Плотность мощности излучения – 250 мВт/см2, плотность дозы – 300 Дж/см2. Перед облучением шерсть над опухолью удаляли. Продолжительность наблюдения за животными составляла 25 дней после лечения.
Эффективность воздействия оценивали по изменению объема опухоли (Vоп) и значениям торможения роста опухоли (ТРО), рассчитанным по формулам (2) и (3):
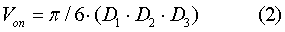
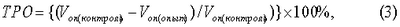
где D1, D2 и D3 – три взаимно перпендикулярных диаметра опухоли.
При исследовании фотодинамической активности in vivo водных эмульсий Н2PyrTACPh4 в 4% Кремофоре на мышах с опухолью Р-388 облучение проводили через 30 минут после введения с использованием аппарата АТО-1 с фильтрами КС-10 и СЗС. Плотность мощности излучения – 300 мВт/см2, световая доза – 270 Дж/см2.
Результаты определения фотодинамической активности приведены в таблицах 3-5.
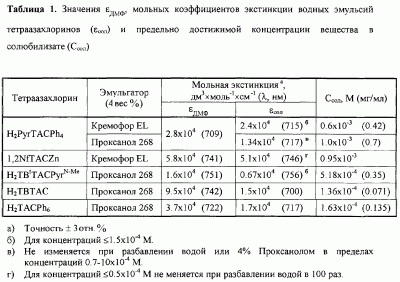 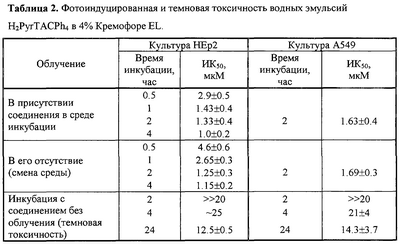   
Эмульсия Н2PyrTACPh4 в 4% Кремофоре (Н2PyrTACPh4-CrEL) обладает фотоиндуцированной активностью на культуре опухолевых клеток человека (таблица 2). В стандартных условиях скрининга ИК50 при облучении составляет в среднем 1-33 мкМ (культура НЕР2) и 1.63 мкМ (культура А549), “темновая” токсичность в этом диапазоне концентраций отсутствует. Варьирование времени инкубации и условий облучения позволяет заключить, что близкая к максимуму эффективная концентрация H2PyrTACPh4 в клетках достигается к 2 часам и фототоксичность на этот срок обусловлена преимущественно внутриклеточным фотосенсибилизатором. Аналогичная эмульсия Zn-1,2-TNTAC обладает сравнительно низкой фотоиндуцированной активностью: величина ИК50 для него оказалась равной 31.0 мкМ (культура НЕР2).
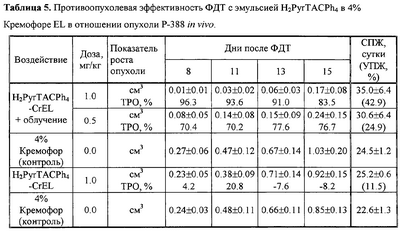
Фотодинамическая активность in vivo водных эмульсий H2PyrTACPh4 изучена на мышах с солидной формой асцитной карциномы Эрлиха (ОЭ). H2PyrTACPh4 в водном растворе 4% Кремофора EL (в дозах 0.1-6.0 мг/кг) и 4% Проксанола 268 (в дозах 1.0-7.0 мг/кг) не подавлял роста опухоли в отсутствие светового воздействия, т.е. не обладал “темновой” цитотоксичностью (таблица 3). При проведении ФДТ через 48 и 24 часа после внутривенного введения Н2PyrTACPh4 в дозах 1.0, 3.0 и 6.0 мг/кг отмечен выраженный противоопухолевый эффект на всем протяжении наблюдения (ТРО=52.2-92.3%). При проведении сеанса облучения через 0.5 часа после введения фотосенсибилизатора в дозе 1.0 мг/кг терапевтический эффект регистрировался на протяжении 25 дней наблюдения (ТРО=61.9-65.1), а в дозе 0.5 мг/кг – только на 15-ый день после ФДТ (61.8%).
Раствор H2PyrTACPh4 в 4% Проксаноле 268 проявлял высокую фотодинамическую активность в отношении экспериментальной ОЭ при введении в дозах 3.5 и 7.0 мг/кг за 24 часа до сеанса ФДТ – торможение роста опухоли достигало 91.8-100% (таблица 3). При более низких дозах (1.0 и 0.5 мг/кг) биологически значимое подавление роста опухоли отмечалось при облучении через 0.5 часа после введения и составляло 52.6-70.0% на 15-25 день наблюдения. Сравнение фотодинамической активности H2PyrTACPh4 в Кремофоре EL и Проксаноле 268 не выявило существенных различий (таблица 3).
Водные эмульсии H2TACPh6, H2TBTAC и H2TBtTACPyrN-Me в 4% Проксаноле 268 в аналогичных условиях также не обладали “темновой” токсичностью и проявляли выраженную активность при проведении сеанса ФДТ через 2 часа после введения (таблица 4). Следует отметить высокую активность Н2ТВТАС, обеспечивающего высокие значения ТРО при низких дозах (до 0.35 мг/кг).
Изучена также фотодинамическая активность in vivo водных эмульсий H2PyrTACPh4 в 4% Кремофоре на мышах с опухолью Р-388. ФДТ с H2PyrTACPh4-CrEL приводило к развитию характерных тканевых реакций – отека с последующим формированием некротического струпа у всех животных через 8-9 дней после облучения. ФДТ с H2PyrTACPh4-CrEL приводила к выраженному подавлению роста опухоли Р-388 на все сроки наблюдения и увеличению продолжительности жизни животных (таблица 4). Лечебный эффект ФДТ выше при дозе фотосенсибилизатора 1.0 мг/кг, чем при дозе 0,5 мг/кг: ТРО превышало 80% при дозе 1.0 мг/кг и 70% при дозе 0.5 мг/кг; УПЖ при дозе 1.0 мг/кг составило 42.9%, при дозе 0.5 мг/кг – 24.9%.
Таким образом, предлагаемые в настоящем изобретении производные тетраазахлорина с интенсивным поглощением в спектральной области 710-750 нм представляют собой новый класс эффективных фотосенсибилизаторов ближней ИК области спектра, которые могут быть использованы для лечения методом ФДТ глубоких опухолевых тканей.
Формула изобретения
Тетраазахлорины общей формулы
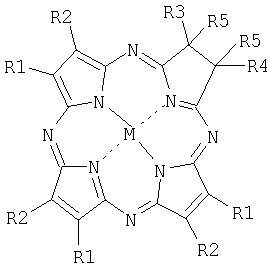
где R1R2=С6H4, R3=R4=R5=CH3, М=НН (Н2ТВТАС);
R1R2=1,2-С10Н6; R3=R4=R5=СН3, M=Zn(Zn-1,2-TNTAC);
R1=R2=C6H5; R3=R4=R5=СН3, М=НН (H2TACPh6);
R1=R3=H, R2=R4=C6H5, R5R5=СН2N(СН3)СН2, М=НН (H2PyrTACPh4);
R1R2=4-C(CH3)3C6H3, R3=R4=Н, R5R5=CH2N(CH3)CH2, М=НН (H2TBtTACPyrN-Me).
как фотосенсибилизаторы для фотодинамической терапии.
РИСУНКИ
|
|