|
|
(21), (22) Заявка: 2002121640/15, 18.01.2001
(24) Дата начала отсчета срока действия патента:
18.01.2001
(30) Конвенционный приоритет:
18.01.2000 AU PQ 5146
(43) Дата публикации заявки: 27.03.2004
(45) Опубликовано: 27.05.2006
(56) Список документов, цитированных в отчете о
поиске:
US 5716979 A, 10.02.1998. US 5610165 A, 11.03.1997. WO 99/64009 A1, 16.12.1999. ЕР 721778 А2, 17.07.1996. Руководство по медицине. THE MERCK MANUAL. – M.: Мир, 1997, т.1, c.991. Реферат из АБД Medline: Heald D.L. Vink R. Magnesium sulphate improves neurologic outcome following severe closed head injury in rats.Neurosci. Lett. 1997, Jun. 13;
(85) Дата перевода заявки PCT на национальную фазу:
19.08.2002
(86) Заявка PCT:
AU 01/00046 (18.01.2001)
(87) Публикация PCT:
WO 01/52844 (26.07.2001)
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, ЕВРОМАРКПАТ, пат.пов. М.В.Колесниковой, рег.№ 527
|
(72) Автор(ы):
ВИНК Роберт (AU),
НИММОУ Алан Джон (AU)
(73) Патентообладатель(и):
Ф.ХОФФМАНН-ЛЯ РОШ АГ (CH)
|
(54) ЛЕЧЕНИЕ ПОВРЕЖДЕНИЙ ГОЛОВНОГО МОЗГА, СПИННОГО МОЗГА И НЕРВОВ
(57) Реферат:
Предложено: композиция для инъекций на основе антагониста рецептора вещества Р и соли магния для лечения повреждений головного мозга, спинного мозга и нервов и соответствующий способ лечения, а также способы использования данной композиции: для снижения проницаемости гематоэнцефалического барьера, для уменьшения образования вазогенного отека, для предупреждения накопления высокого уровня воды в головном мозге, для облегчения последствия, связанного с нарушением познавательной способности после повреждения головного мозга, или последствия, связанного с нарушением моторной и познавательной способности после повреждения головного мозга, способ предупреждения вызванной дефицитом вещества Р способности к обучению и памяти. Показано, что совместное введение антагониста рецептора вещества Р и соли магния приводило к более выраженной защите нервов от повреждения, чем при их использовании по отдельности, при условии, что количество соли магния обеспечивает повышение концентрации свободного магния в крови до примерно 1 мМ. 8 н. и 15 з.п. ф-лы, 3 табл., 2 ил.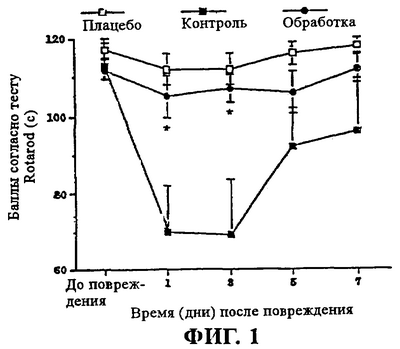
(56) (продолжение):
CLASS=”b560m”228(3):175-8. Реферат из АБД Medline: Heald D.L., Vink R. Optimization of magnesium therapy after severe diffuse axonal brain injury in rats. J. Pharmacol. Exp. Ther. 1999, Mar; 288(3):1311-6. RU 2055078 C1, 27.02.1996.
Область техники изобретения
Настоящее изобретение относится к способу лечения повреждений головного мозга, спинного мозга и нервов. Оно относится также к композиции, особенно предпочтительной для воплощения способа.
Повреждения головного мозга приводят к развитию моторного дефицита и дефицита познавательной способности, что обусловливает серьезные заболевания людей, выживших после травмы головного мозга. Кроме того, они наиболее часто встречаются у более молодых представителей общества. Вследствие этого повреждение головного мозга приводит к наиболее значительному снижению качества жизни по сравнению с любым другим болезненным процессом. Несмотря на это в настоящее время отсутствует эффективное лечение, обеспечивающее облегчение последствий повреждения головного мозга. В настоящем изобретении предложено применение способа лечения повреждения головного мозга, который представляет собой способ эффективного фармакологического вмешательства. С помощью экспериментального повреждения головного мозга от средней до сильной степени тяжести установлено, что применение такого лечения существенно улучшает последствия, связанные с нарушениями как моторных, так и познавательных процессов, а также оказывает положительное воздействие при лечении повреждений спинного мозга и нервов.
Предпосылки создания изобретения
Хорошо известно, что повреждение головного мозга приводит к развитию неврологических дефицитов посредством двух механизмов. Первый из них связан с первичными процессами. Они характерны для момента поражения и включают механические процессы, такие как ранение, разрыв, растяжение и сдавливание нервных волокон. Мало что можно сделать при этом типе повреждения после того, как оно произошло. Второй механизм представляет собой вторичное повреждение, и он включает биохимические и физиологические процессы, которые инициируются первичным повреждением, но проявляются с течением времени после повреждения. Было установлено, что большая часть заболеваний после повреждения головного мозга связана с развитием этого вторичного повреждения. Поскольку вторичное повреждение развивается в течение периода времени от нескольких минут до нескольких дней с момента первичного повреждения, то существует промежуток времени, благоприятный для предупреждения этого типа повреждения и существенного облегчения его последствий с помощью фармакологических средств. Однако сначала необходимо определить факторы, обусловливающие вторичное повреждение, а затем разработать “антифакторы”, ингибирующие процесс повреждения.
Исследование, проведенное при создании настоящего изобретения, касается выявления вторичных факторов повреждения после травмы головного мозга и развития путей терапевтического вмешательства. Один из ранее выявленных факторов [1-4], который имеет решающее значение для преодоления последствий повреждения головного мозга, является концентрация ионов магния в головном мозге. Этот ион является регуляторным фактором в целом ряде биохимических и физиологических процессов, которые активируются после повреждения головного мозга. Так, установлено, что снижение концентрации ионов магния приводит к обострению процесса повреждения, в то время как повышение концентрации ионов магния ослабляет процесс повреждения и приводит к облегчению последствий [5]. Установлено, что лечение повреждения головного мозга с помощью магния является эффективным [1, 6-10] даже при введении вплоть до 24 ч после момента повреждения и является успешным методом лечения, что доказано с помощью исследований на экспериментальных животных и позволило начать проведение клинических испытаний на людях с повреждением головного мозга.
Несмотря на облегчение симптомов дефицитов после повреждения головного мозга путем введения магния ясно, что существуют моторный дефицит и дефицит познавательной способности, сохраняющиеся после такого лечения. При создании изобретения, прежде всего, учитывался тот факт, что у более молодых животных накопление воды в головном мозге (т.е. церебральный отек или набухание головного мозга) сохраняется после такого лечения, и это может являться важным фактором риска. Так, согласно современным клиническим исследованиям [11] замедленное набухание головного мозга является причиной гибели 50% молодых людей из числа всех погибших в результате повреждения головного мозга.
Изложение сущности изобретения
Таким образом, объектом изобретения является способ лечения состояния, связанного с повреждением головного мозга, и композиция, предназначенная для применения согласно указанному способу.
Композиция, которая является одним из объектов изобретения, содержит антагонист рецептора вещества Р и магнийсодержащее соединение, причем совместное применение магнийсодержащего соединения и антагониста рецептора вещества Р приводит к более выраженной защите от повреждения, чем применение по отдельности либо магнийсодержащего соединения, либо антагониста рецептора вещества Р.
Способ по изобретению предусматривает стадию введения композиции пациенту, страдающему от повреждения головного мозга. В альтернативном варианте каждый из компонентов композиции вводят по отдельности или через такой промежуток времени после повреждения, который как указано выше, не влияет на эффективность лечения, например через 1-30 мин и вплоть до 24 ч.
Вещество Р является нейромедиатором возбуждения и играет роль в передаче боли, оно представляет собой пептид, имеющий строение RPKPEEFFGLM-NH2. Оно вырабатывается гипоталамусом, ЦНС и кишечником и повышает сокращение гладких мышц желудочно-кишечного тракта.
Известно, что вещество Р связывается с различными рецепторами, включая рецептор NK1 (т.е. рецептор нейрокинина 1), рецептор NK2 и рецептор NK3. Эти рецепторы, вероятно, принимают участие в движении крови в головном мозге.
Таким образом, антагонист вещества Р представляет собой субстанцию, которая ингибирует связывание вещества Р с любым из указанных выше рецепторов. Список приемлемых антагонистов вещества Р приведен ниже в таблицах 1, 2 и 3.
В качестве примеров антагонистов рецептора NK1 можно привести антагонисты, описанные в патенте US 5990125, который включен в настоящее описание в качестве ссылки, поскольку указанные в нем антагонисты вещества Р можно применять в композиции, предназначенной для использования согласно способу по изобретению. В качестве конкретных примеров можно упомянуть соединения, имеющие строение, представленное формулами Ia, Ib, Ic, Id, Ie, X, XVI, XVII, XVIII, XIX, XX и XXI, а также другие антагонисты, которые представляют собой производные хинуклидина, пиперидинэтилендиамина, пирролидина и азаборнана и родственные соединения, обладающие активностью антагонистов вещества Р, которые описаны в столбце 33 патента US 5990125.
Такие антагонисты рецептора можно применять в дозах, указанных в колонке 34 патента US 5990125, и в виде различных форм введения, т.е. индивидуально или в сочетании с различными фармацевтически приемлемыми носителями или разбавителями, путем перорального введения или парентерального введения, как указано в колонке 34 патента US 5990125.
Активность различных субстанций в качестве антагонистов рецептора вещества Р, предназначенных для применения согласно изобретению, можно также определять с помощью анализов, приведенных в колонках 35-36 патента US 5990125.
В качестве примеров можно упомянуть также антагонисты рецептора вещества Р, описанные в патенте US 5977104, включая различные дозируемые формы и дозы, указанные в этом патенте, который также полностью включен в настоящее описание в качестве ссылки.
Можно упомянуть также патент US 4481139, в котором описаны различные пептидные антагонисты, который также полностью включен в настоящее описание в качестве ссылки.
Следует понимать также, что понятие “вещество Р” в контексте настоящего описания также включает его различные укороченные формы или аналоги, описанные в патенте US 4481139, который полностью включен в настоящее описание в качестве ссылки.
В качестве антагонистов рецептора вещества Р, которые можно применять согласно настоящему изобретению, следует упомянуть различные пиперидиновые и морфолиновые производные, описанные в патенте US 4985896, или пиперазиновые производные, описанные в патенте US 5981520. Обе эти публикации полностью включены в настоящее описание в качестве ссылки.
В качестве антагонистов рецепторов NK1 и NK2, которые можно применять согласно изобретению, следует отметить антагонисты, описанные в патенте US 5998444, который также полостью включен в настоящее описание в качестве ссылки.
Также следует упомянуть, что антагонисты тахикинина, описанные в патенте US 4981744, можно также применять в качестве антагонистов рецептора вещества Р, и этот патент также полостью включен в настоящее описание в качестве ссылки.
Следует упомянуть также ЕР-А-1035115, полностью включенную в настоящее описание в качестве ссылки, в которой описаны N-бензил-4-толилникотинамиды и родственные соединения в качестве антагонистов рецептора NK1, которые можно применять согласно настоящему изобретению.
Следует упомянуть также международную заявку на патент WO 00/50398, полностью включенную в настоящее описание в качестве ссылки, в которой описаны различные фенильные и пиридинильные производные в качестве антагонистов рецептора NK1, которые можно применять согласно настоящему изобретению.
Следует упомянуть также международные заявки на патенты WO 00/50401, WO 00/53572, WO 00/73278 и WO 00/73279, полностью включенные в настоящее описание в качестве ссылки, в которых описаны 3-фенилпиридины, бифенильные производные, 5-фенилпиримидиновые производные и 4-фенилпиримидиновые производные соответственно. Указанные описания относятся к антагонистам рецептора NK1, которые можно применять согласно настоящему изобретению.
Следует упомянуть также каталог фирмы Sigma 1998 г. и более конкретно стр. 1194-1997, где описаны модификации вещества Р или фрагментов вещества Р, которые можно применять в качестве антагонистов вещества Р согласно настоящему изобретению. Эта публикация также полностью включена в настоящее описание в качестве ссылки.
Что касается магнийсодержащего соединения, то оно может представлять собой любой источник ионов магний, такой как хлорид магния, сульфат магния, оксалат магния, глюконат магния или другую нетоксичную соль магния.
Фармацевтически композиции по изобретению могут содержать также консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подслащивающие вещества, красители, корригенты, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать и другие терапевтически приемлемые субстанции. Так, понятие “содержащий” должно интерпретироваться в контексте настоящего описания. Доза может варьироваться в широких пределах и ее, естественно, можно приспосабливать к индивидуальным требованиям в каждом конкретном случае. В целом, доза составляет от 1 до 20000 мг на пациента, предпочтительно от 10 до 5000 мг и наиболее предпочтительно она должна включать от 50 до 2000 мг антагониста рецептора вещества Р.
При создании настоящего изобретения было установлено, что одной из причин высокого уровня накопления воды в головном мозге после повреждения является образование вазогенного отека. Это происходит в результате повышенной проницаемости гематоэнцефалического барьера, что позволяет сосудистым протеинам и воде проникать во внеклеточное пространство и вызывать набухание. Известно лишь несколько исследований, в которых оценивали связь между повышенной проницаемостью гематоэнцефалического барьера и развитием неврологических дефицитов после повреждения, однако отсутствуют данные о том, может ли ингибирование набухания головного мозга преодолеть последствия повреждения. Изучение мигрени [12, 13] позволило предположить, что сосудистая сеть твердой мозговой оболочки (внешний менингеальный слой) становится более проницаемой для сосудистых компонентов в результате выделения вещества Р. Отсюда авторы настоящего изобретения выдвинули гипотезу о том, что вещество Р может оказывать аналогичное действие на церебральную сосудистую сеть, причем это воздействие может привести к повышенной проницаемости гематоэнцефалического барьера и вазогенному церебральному отеку. Также была высказана гипотеза о том, что введение антагониста рецептора вещества Р может предупредить набухание головного мозга и развитие замедленных неврологических дефицитов после повреждения. Эта гипотеза привела к указанному выше открытию того факта, что вода, накопленная в головном мозге, является результатом образования вазогенного отека.
Таким образом, еще одним объектом изобретения является применение антагониста рецептора вещества Р для уменьшения проницаемости гематоэнцефалического барьера и/или вазогенного церебрального отека.
Экспериментальная часть
Большое количество синтезируемых с коммерческой целью антагонистов рецептора вещества Р, приведенных в таблицах 1, 2 и 3, в настоящее время можно получить от известных поставщиков научной химической продукции. Для применения было выбрано такое соединение, как N-ацетил-L-триптофан, на основе его низкой растворимости в жирах и способности в естественных условиях проникать через гематоэнцефалический барьер, а также с учетом его относительно невысокой стоимости. Введение N-ацетил-L-триптофана внутривенно в дозе 246 мг/кг (носитель – физиологический раствор) через 30 мин после повреждения головного мозга приводило к значительному облегчению последствия, связанного с дефицитом познавательной способности, у животных с повреждением головного мозга при оценке с помощью кольцевого лабиринта Barnes. Аналогично этому обнаружено значительное облегчение последствий, связанных с моторным дефицитом, которое было установлено с помощью Rotarod-теста. Эти облегчения последствий были выявлены через 24 ч после повреждения головного мозга, и они сохранялись в течение 14 дневного периода проведения наблюдений. У контрольных (обработанных носителем) животных обнаружены существенно более серьезные неврологические последствия по сравнению с обработанными животными во все изученные моменты времени.
У животных, обработанных N-ацетил-L-триптофаном, существенно снижалось накопление воды в головном мозге (т.е. церебральный отек) через 24 ч после повреждения по сравнению с обработанными носителем контрольными животными. Это согласуется с данными о том, что N-ацетил-L-триптофан снижал проникновение в головной мозг красителя голубого Эванса через 5 ч после повреждения, т.е. в период времени, для которого характерна максимальная проницаемость гематоэнцефалического барьера после повреждения головного мозга. Так, введение N-ацетил-L-триптофана через 30 мин после повреждения головного мозга приводило к снижению проницаемости гематоэнцефалического барьера и снижению образования вазогенного отека. Тот факт, что эти явления наблюдали при использовании композиции антагониста NK1, не обладающей способностью к проникновению, позволяет предположить, что эти явления в основном опосредуются сосудистыми рецепторами и не зависят от центральных рецепторов.
Введение N-ацетил-L-триптофана в дозе 24,6 мг/кг также заметно улучшало последствие, связанное с нарушением познавательной способности, у животных с повреждением головного мозга. Однако лекарство оказывало менее выраженное положительное воздействие на преодоление нарушения моторной функции. Кроме того, поскольку всегда у всех обработанных животных сохранялся остаточный моторный дефицит и дефицит познавательной способности, было сделано заключение о том, что положительные воздействия лечения с использованием антагониста NK1 проявлялись в меньшей степени при повреждении средней тяжести, чем при более серьезном повреждении. Это является основным ограничивающим фактором, поскольку повреждение головы средней тяжести наиболее часто встречаются у пациентов с повреждением головного мозга.
Комбинация магния и N-ацетил-L-триптофана
Наиболее часто встречающейся формой повреждения головного мозга является повреждение головы средней тяжести. Согласно руководствам, которые должны быть введены в следующем (2000 г.) Всемирной Федерацией нейрохирургов, рекомендовано во всех случаях небольшого повреждения головы, сопровождающегося любыми осложнениями, такими как рвота, тошнота, потеря сознания или амнезия, обязательно направлять пациентов в больницу. Это требует от системы здравоохранения разработки соответствующего лечения этих пациентов, которое препятствовало бы дальнейшему развитию вторичного повреждения. В настоящее время такая терапия отсутствует.
Полученные результаты с использованием N-ацетил-L-триптофана позволяют предположить, что это соединение закрывает гематоэнцефалический барьер после повреждения головы и снижает набухание головного мозга или церебральный отек. Это особенно важно для молодых жертв, получивших повреждения головы, которые особенно уязвимы к замедленному набуханию головного мозга. Кроме того, результаты, полученные с помощью терапии с использованием магния, позволяют предположить, что лечение магнием эффективно в отношении снижения неврологических дефицитов, не обязательно связанных с повышенной проницаемостью гематоэнцефалического барьера. Таким образом, в настоящем изобретении предложена комбинация, содержащая антагонист рецептора вещества Р и магнийсодержащее соединение или его соль, которая может представлять собой эффективное средство лечения повреждения головного мозга, независимо от его серьезности.
Введение комбинации, содержащей 246 мг/кг N-ацетил-L-триптофана плюс 30 мг/кг сульфата магния (внутривенно), приводило к выраженному смягчению как моторного дефицита, так и дефицита познавательной способности, существенно превышающему действие любого из указанных лекарственных средств по отдельности (фиг.1 и фиг.2).
Каждое соединение в объединенной композиции обладает рядом свойств, делающих его особенно ценным агентом для применения при повреждении головного мозга.
Установлено, что антагонисты вещества Р (SP) быстро улучшают настроение, оказывая антагонистическое воздействие на вызываемое веществом Р тревожное состояние. В результате этого они обладают эффективностью для лечения депрессии после повреждения. Из вышесказанного ясно, что антагонисты SP снижают проницаемость гематоэнцефалического барьера и ингибируют образование вазогенного отека и набухания головного мозга или церебрального отека после повреждения. Установлено, что антагонисты могут также ингибировать боль. Большое количество рецепторов вещества Р присутствует в гиппокампе и полосатом теле, т.е. в тех частях головного мозга, которые, как известно, связаны со способностью к обучению и памятью. Таким образом, путем ингибирования связывания антагонистов SP можно предупреждать вызываемую веществом Р индукцию дефицита способности к обучению и памяти. Представленные выше данные позволяют предположить, что это может происходить в данном случае. Этот факт никогда ранее не был установлен. Фактически литература о роли вещества Р или любых других нейропептидов в повреждении головного мозга отсутствует.
Магний оказывает воздействие более чем на 300 клеточных ферментов. Поэтому не является неожиданным тот факт, что магний имеет многочисленные мишени, посредством которых он может улучшать последствия повреждения. Они включают среди прочего блокаду индуцируемой глутаматом эксцитотоксичности, улучшение стабильности мембран и снижение производства реакционноспособных видов кислорода, улучшение энергетического статуса, ингибирование кальциевых каналов, снижение уровня высвобождения нейромедиаторов, ингибирование митохондриального переходного открытия пор и ингибирование апоптоза. Кроме того, магний также блокирует индуцируемое глутаматом высвобождение вещества Р. С помощью физиологических экспериментов установлено [14-17], что магний улучшает церебральный кровоток, снижает церебральный вазоспазм и снижает производство в сосудах керамида и простагландина.
Совместное применение магния и антагониста вещества Р приводит к более выраженной защите нервов от повреждения, чем при использовании любого лекарственного средства по отдельности.
Ранее заявители установили, что магний оказывает благоприятное воздействие при травме при введении внутривенно в дозах от 16 до 60 мг/кг. При введении с помощью внутримышечной инъекции эффективная доза составляет от 45 до 90 мг/кг. Цель заключается в повышении концентрации свободного магния в крови до примерно 1,0 мМ, что в два раза превышает нормальную концентрацию в крови свободного магния. Положительные результаты были получены независимо от применяемой соли магния.
Проведенные исследования с использованием антагониста вещества Р продемонстрировали, что эффективная внутривенная доза варьируется от 24,6 до 240,6 мг/кг или выше, при этом более высокие дозы оказывают более выраженное благоприятное воздействие на последствие, связанное с моторным дефицитом. Кроме того, эти дозы подходят для антагонистов, которые обладают низкой растворимостью в липидах и вследствие этого ограниченным проникновением через гематоэнцефалический барьер. Композиция, обладающая высокой растворимостью в липидах, может оказывать абсолютно такие благоприятные воздействия, но она может также опосредовать побочное действие, которое может быть нежелательным.
При применении в виде комбинации в композиции может варьироваться указанный диапазон отдельных компонентов. При создании изобретения самые хорошие результаты были получены при использовании максимальных внутривенных доз, указанных для отдельных компонентов.
Ожидается, что комбинация магния/антагонистов SP может найти применение при следующих состояниях:
– в качестве профилактического лечения в виде “первой помощи” после травматического повреждения головного мозга,
– в качестве профилактического лечения в виде “первой помощи” после слабых повреждений головы, включая сотрясение,
– в качестве лечения последствий нетравматических повреждений головного мозга, включая удар, гипоксию и любую форму повреждения головного мозга, сопровождающуюся отеком,
– в качестве поддерживающей терапии после повреждения головного мозга.
ССЫЛКИ
1. Vink R., Mclntosh Т.К., Demediuk P., Weiner M.W., Faden A.I.: Decline in intracellular free magnesium concentration is associated with irreversible tissue injury following brain trauma. J. Biol. Chem., 263: 757-761, 1988.
2. Vink R., Heath D.L., Mclntosh Т.К.: Acute and prolonged alteration in brain free magnesium following fluid percussion induced brain trauma in rats. J. Nurochem. 66:2477-2483, 1996.
3. Heath D.L., Vink R.: Brain intracellular free magnesium concentration declines following impact-acceleration induced brain injury in rats. Neurosci. Res. Commun., 18: 163-168, 1996.
4. Heath D.L., Vink R.: Traumatic brain axonal injury produces sustained decline in intracellular free magnesium concentration. Brain Research, 738: 150-153, 1996.
5. Mclntosh Т.К., Faden A.I., Yamakami I., Vink R.: Magnesium deficiency exacerbates and pretreatment improves outcome following traumatic brain injury in rats: 31P magnetic resonance spectroscopy and behavioural studies. J. Neurotrauma 5:17-31, 1988.
6. Vink R., Mclntosh Т.К.: Pharmacological and physiological effects of magnesium on experimental traumatic brain injury. Magnesium Res. 3: 163-169, 1990.
7. Heath D.L., Vink R.: Magnesium sulphate improves neurologic outcome following severe closed head injury in rats. Neuroscience Letters 228: 175-178, 1997.
8. Heath D.L., Vink R.: Neuroprotective effects of MgSO4 and MgCl2 in closed head injury: a comparative phosphorus NMR study. J. Neurotrauma 15: 183-189, 1998.
9. Heath D.L., Vink R.: Delayed therapy with magnesium up to 24 hours following traumatic brain injury improves motor outcome. J. Neurosurg. 90: 504-509, 1999.
10. Heath D.L., Vink R.: Optimisation of magnesium therapy following sever diffuse axonal brain injury in rats. J. Pharmacol. Exp. Ther. 288: 1311-1316, 1999.
11. Feickert H.G., Drommer S., Heyer R.: Severe head injury in children: impact of risk factors. J. Trauma 47: 33-38, 1999.
12. Moskowitz M.A.: The neurobiology of vascular head pain. Ann. Neurol. 16: 157-168, 1984.
13. Ferrari M.D.: Migraine. Lancet 351: 1043-1052, 1998.
14. Altura B.T., Altura B.M.: The role of magnesium in etiology of strokes and cerebrovasoxpasm. Magnesium 1: 277-291, 1982.
15. Farado M., Szabo С., Dora E., Horvath I., Kovach A.G.B.: Contractile and endothelium-dependent dilatory responses of cerebral arteries at various extracellular magnesium concentration. J. Cereb. Blood Flow Metab. 11: 161-164, 1991.
16. Kemp P.A., Gardiner S.M., March J.E., Rubin P.C., Bennett Т.: Assessment of the effects of endothelin-1 and magnesium sulphate on regional blood flows in conscious rats. Br. J. Parmacol. 126: 621-626, 1999.
17. Morril M.A., Gupta R.K., Kostellow A.B., Gy M., Zhang A., Altura B.T., Altura B.M.: Mg2+ modulates membrane sphingolipid and lipid second messenger levels in vascular smooth muscle cells. FEBS Lett., 167-171, 1998.
| Таблица 2 |
| Антагонисты рецептора NK2 |
| Химический код |
Химическое название |
| SR-48,968 |
(S)-N-метил-N-[4-(4-ацетиламино-4-(фенилпиперидино)-2-(3,4-дихлорфенил)бутил]бензамид |
| L-659877 |
Цикло[Gln, Trp, Phe, Gly, Leu, Met] |
| MEN 10627 |
Цикло(Met-Asp-Trp-Phe-Dap-Leu)цикло(2бета-5бета) |
| SR 144190 |
(R)-3-(1-[2-(4-бензоил-2-(3,4-дифторфенил)морфолин-2-ил)этил]-4-фенилпиперидин-4-ил)-1-диметилмочевина |
| GR 94800 |
PhCO-Ala-Ala-D-Trp-Phe-D-Pro-Pro-Nle-NH2 |
| Таблица 3 |
| Антагонисты рецептора NK3 |
| Химический код |
Химическое название |
| SR-142,801 |
(S)-N-(1-(3-(1-бензоил-3-(3,4-дихлорфенил)пиперидин-3-ил)пропил)-4-фенилпиперидин-4-ил)-N-метилацетамид |
| R 820 |
3-индолилкарбонил-Hup-Phg-N(Me)-Bzl |
| R 486 |
H-Asp-Ser-Phe-Trp-бета-Ala-Leu-Met-NH2 |
| SB 222200 |
(S)-(-)-N(а-эталбензил)-3-метил-2-фенилхинолин-4-карбоксимид |
| L 758, 298 |
фосфоновая кислота, [3-[[2-[1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)-4-морфолинил]метил]-2,5-дигидро-5-оксо-1Н-1,2,4-триазол-1-ил]-, [2R-[2 (R*), 3 (R*), 3 ]]- ]]- |
| NK-608 |
(2R,4S)-N-[1-{3,5-бис(трифторметил)бензоил}-2-(4-хлорбензил)-4-пиперидинил]хинолин-4-карбоксамид |
Формула изобретения
1. Инъецируемая композиция для лечения повреждения головного мозга, спинного мозга и нервов, содержащая терапевтически эффективное количество антагониста рецептора вещества Р и соль магния в количестве, достаточном для повышения концентрации свободного магния в крови примерно до 1,0 мМ.
2. Инъецируемая композиция по п.1, где совместное применение антагониста рецептора вещества Р и соли магния приводит к более выраженной защите от повреждения, чем индивидуальное применение антагониста рецептора вещества Р и соли магния.
3. Композиция по п.1 или 2, где антагонист рецептора вещества Р представляет собой антагонист рецептора NK1.
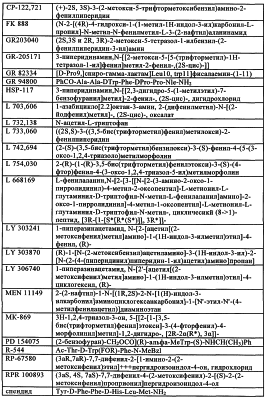
4. Композиция по п.3, где антагонист рецептора NK1 выбирают из группы, включающей CGP49823, СР-96,345, СР99,994, СР-122,721, FK88, GR203040, GR205171, GR82334, GR94800, HSP-117, L-703,606 оксалат, L-732,138, L-733060, L-742,694, L-745,030, L-668,169, LY-303241, LY-303870, LY306740, MEN-11149, MK-869, PD-154075, R-544, RP-67580, RPR100893, Сендид, Спантид II, Спантид III, SR140333, WIN-41,7098, WIN-62,577.
5. Композиция по любому из пп.1-4, где антагонист рецептора вещества Р представляет собой антагонист рецептора NK2.
6. Композиция по п.5, где антагонист рецептора Р выбирают из группы, включающей SR-48968, L-659877, GR103637, MGN-10627, SR144190 и GR94800.
7. Композиция по п.1 или 2, где антагонист рецептора вещества Р представляет собой антагонист рецептора NK3.
8. Композиция по п.7, где антагонист рецептора Р выбирают из группы, включающей SR-143,801, R820, R486, SB222200, L758,298 и NKP608.
9. Композиция по любому из пп.1-8, где соль магния выбирают из группы, включающей хлорид магния, сульфат магния, оксалат магния, глюконат магния или другую нетоксичную соль магния.
10. Композиция по любому из пп.1-9, где терапевтически эффективное количество антагониста рецептора вещества Р составляет 1-20000 мг.
11. Композиция по любому из пп.1-9, где терапевтически эффективное количество антагониста рецептора вещества Р составляет 10-5000 мг.
12. Композиция по любому из пп.1-9, где терапевтически эффективное количество антагониста рецептора вещества Р составляет 50-2000 мг.
13. Способ лечения повреждения головного мозга, спинного мозга и нервов путем введения пациенту, страдающему таким повреждением, терапевтически эффективного количества антагониста рецептора вещества Р и соли магния в количестве, достаточном для повышения концентрации свободного магния в крови примерно до 1,0 мМ, раздельно или в виде композиции по пп.1-12.
14. Способ по п.13, где повреждение обусловлено ранением, разрывом, растяжением и сдавливанием нервных волокон.
15. Способ снижения проницаемости гематоэнцефалического барьера путем введения пациенту, нуждающемуся в таком снижении, композиции по пп.1-12.
16. Способ уменьшения образования вазогенного отека путем введения пациенту, страдающему таким отеком, композиции по пп.1-12.
17. Способ по п.16. где вазогенный отек представляет собой вазогенный церебральный отек.
18. Способ предупреждения высокого уровня накопления воды в головном мозге после повреждения путем введения пациенту, нуждающемуся в таком предупреждении, композиции по пп.1-12.
19. Способ облегчения последствия, связанного с нарушением познавательной способности после повреждения головного мозга, путем введения пациенту, страдающему таким нарушением, композиции по пп.1-12.
20. Способ предупреждения вызванных веществом Р дефицитов способности к обучению и памяти после повреждения головного мозга путем введения пациенту, нуждающемуся в таком предупреждении, композиции по пп.1-12.
21. Способ облегчения последствия, связанного с нарушением моторной и познавательной способности после повреждения головного мозга от средней до серьезной тяжести путем введения пациенту, страдающему таким нарушением, композиции по пп.1-12.
22. Способ по любому из пп.13-21, где антагонист рецептора вещества Р обладает низкой растворимостью в липидах.
23. Способ по любому из пп.13-21, где антагонист рецептора вещества Р указан в пп.3-8.
РИСУНКИ
|
|