|
|
(21), (22) Заявка: 2004124218/15, 10.08.2004
(24) Дата начала отсчета срока действия патента:
10.08.2004
(43) Дата публикации заявки: 10.02.2006
(45) Опубликовано: 27.05.2006
(56) Список документов, цитированных в отчете о
поиске:
RU 21839563 C1, 27.06.2002. RU 2152790 C1, 20.07.2000. RU 2220722 С1, 10.01.2004. RU 2144538 C1, 20.01.2000. RU 2054476 C1, 20.02. 1996. NZ 508600 А1, 28.03.2003.
Адрес для переписки:
123557, Москва, ул. М. Грузинская, 38, стр.1, ОАО “Группа компаний “ГРАНД”, Л.Д. Тавровскому
|
(72) Автор(ы):
Пономарев Гелий Васильевич (RU),
Тавровский Леонид Даниилович (RU),
Зарецкий Александр Михайлович (RU),
Ашмаров Вячеслав Владимирович (RU),
Баум Рудольф Филиппович (RU)
(73) Патентообладатель(и):
Открытое акционерное общество “Группа компаний “ГРАНД” (RU)
|
(54) ФОТОСЕНСИБИЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ
(57) Реферат:
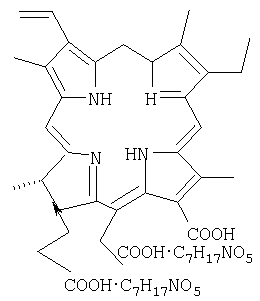
Изобретение относится к фармакологии, а именно к получению биологически активных соединений, и может быть использовано для получения водорастворимой формы высокоочищенного хлорина е6, который может найти применение в качестве фотосенсибилизатора для фотодинамической терапии рака и других новообразований различного генезиса. Способ получения фотосенсибилизатора заключается в обработке суспензии лиофильно высушенной спирулины в метаноле до получения осадка, содержащего хлорин е6, который затем промывают, суспендируют, рецентрифугируют, растворяют полученный осадок в водном растворе N-метил-D-глюкамина, доводят рН до 7.75-8.20, затем добавляют 510-520 мл апирогенной воды так, чтобы оптическая плотность раствора при 654 нм и рН9.0 составляла 200-210 ед., фильтруют раствор через фильтр с величиной пор 0.22 мкм и добавляют поливинилпирролидон с молекулярным весом от 9600 до 11500. Получаемый согласно изобретению фотосенсибилизатор для фотодинамической терапии содержит хлорин е6 в количестве не менее 98%, N-метил-D-глюкамин в мольном соотношении 1:2 и поливинилпирролидон с молекулярным весом от 9600 до 11500, при этом хлорин е6 имеет структурную формулу:
Технический результат: создание новой лекарственной формы, обладающей более высокими терапевтическими свойствами для лечения различных онкологических заболеваний методами фотодинамической терапии за счет более высокого содержания хлорина е6. 2 н.п. ф-лы, 3 табл., 8 ил.
Изобретение относится к фармакологии, а именно к получению биологически активных соединений, и может быть использовано для получения водорастворимой формы высокоочищенного хлорина е6, который может найти применение в качестве фотосенси-билизатора для фотодинамической терапии рака и других новообразований различного генезиса. Способ позволяет получить водорастворимую и стабильную при хранении соль высокоочищенного хлорина е6 (C34H36N4O6) с N-метилD-глюкамином (C7H17NO5), названную “фотодитазином” (С48Н70N6O16) (см. свидетельство Роспатента на товарный знак № 249188 от 18.06.03.)
Известны несколько способов получения водорастворимых солей хлорина е, однако все эти способы не позволяют получать конечный продукт высокой степени чистоты и, соответственно, получать стандартный с фиксированными биологическими свойствами и стабильный при хранении лекарственный препарат, что затрудняет создание на основе хлорина е6 лекарственной формы.
Известен способ получения тринатриевых и трикалиевых солей хлорина е6 (см. заявка № 93-036361/13 (036894) от 07/1993. Альбицкая О.Н., Ашмаров В.В., Мещерякова А.Л.).Способ получения 18-карбокси-20-(карбоксиметил)-8-этенил-13-этил2б3-дигидро-3,7,12,17-тетраметил-21Н,23Н-порфин-2-пропионовой кислоты или ее солей), который заключается в обработке биомассы спирулины водно-спиртовым раствором щелочи, выделения из экстракта многочисленных хлориновых производных, их совместного щелочного гидролиза в вакууме, нейтрализации, выделения выпавшего осадка, содержащего наряду с многочисленными хлориновыми производными также и некоторое количество хлорина e6, из которого при добавлении NaOH или КОН получают водорастворимый продукт. В данном способе состав и взаимное содержание водорастворимых хлоринов не определено, что затрудняет получение из него лекарственного препарата для медицинского использования. Основным и принципиальным недостатком данного способа получения водорастворимых солей хлорина е является тот факт, что из-за использования биомассы спирулины в качестве исходного сырья путем неконтролируемой переработки в процессе выделения производных хлорофилла (например, феофитина а, феофорбида а, затем щелочного размыкания циклопентанонового кольца в феофорбиде а без соответствующего физико-химического анализа каждого из полупродуктов, образующийся продукт не может иметь стабильный состав и, соответственно, одинаковые спектральные характеристики (спектры поглощения, спектры флюоресценции).
Известен способ получения водорастворимых хлоринов (RU 2144538 от 20.01.1998. Пономарев Г.В., Решетников А.В., Гусева-Донская Т.Н., Швец В.И., Баум Р.Ф., Ашмаров В.В. Способ получения водорастворимых хлоринов), согласно которому хлорины, содержащие три карбоксильных остатка – оксикарбонилэтильную, оксикарбонилметильную и ядерную карбоксильную группы, образуют водорастворимые соли с линейным или циклическим первичным или вторичным амином или же с основной аминокислотой. В качестве примера был использован комплекс хлоринов, выделяемый путем специальной переработки спирулины с выходом около 50%. К недостаткам этого метода следует отнести тот факт, что для получения водных растворов хлоринов был использован продукт, который содержал смесь различных хлоринов – хлорина е6, хлорина р6 и других, в которой содержание хлорина е6 варьировало в широких пределах и составляло 80-90%. Относительно невысокое содержание хлорина е6 обусловлено принципиальными трудностями при выделении этого хлорина из биомассы спирулины.
Другим, наиболее близким, способом получения водорастворимых солей хлорина е6 является гидролиз соответствующего триметилового эфира в ТГФ под азотом в присутствии NaOH в течение 2-х суток при комнатной температуре. Химическая структурная формула триметилового эфира хлорина е6 приведена на фиг.1.
Основным недостатком этого метода является предварительное получение соответствующего триметилового эфира хлорина e6, синтез которого представляет собой достаточно сложную синтетическую задачу. В процессе щелочного омыления трех сложноэфирных остатков имеется возможность присутствия в реакционной смеси многочисленных продуктов недоомыления, т.е. моно- и диметиловых эфиров, а для исчерпывающего гидролиза сложноэфирных остатков необходимо продолжительное время, которое отрицательно влияет на устойчивость хлорина е в щелочных средах.
В качестве ближайшего аналога выбран способ (RU 2183956 от 30.03.2001, Решетников А.В., Залевский И.Д., Кемов Ю.В., Иванов А.В., Градюшко A.T., Лаптев В.П., Неугодова Н.П., Абакумова О.Ю., Привалов В.А., Лаппа А.В., Романов В.А. Фотосенсибилизатор и способ его получения) получения смеси щелочных солей (натрия или калия) хлоринов переменного состава, состоящей из хлорина e6, пурпурина 5 и хлорина р6, образующейся в результате последовательной обработки биомассы спирулины ацетоном для извлечения хлорофилла а, затем обработки ацетонового экстракта соляной кислотой для превращения хлорофилла а в феофитин а, его выделения после нейтрализации раствора центрифугированием, затем гидролиза сложноэфирного остатка в системе соляная кислота-ацетон-гексан, выделения “сырого” феофорбида а фильтрацией, его частичной очистки путем переосаждения из смеси ацетон-вода, высушивания на воздухе, проведения щелочного гидролиза вначале в системе ацетон – разбавленная водная щелочь (0.05-1%), затем при нагревании до 40-60°С при добавлении большого количества щелочи в течение неопределенного интервала времени от 20 до 90 минут, нейтрализации продукта реакции соляной кислотой, его выделении центрифугированием, переосаждения из ацетона для отделения от продуктов деструкции, высушивания в широком интервале температур (40-100°С) и в течение 1 часа – 30 суток. В результате такой сложной и неоднозначной переработки микроводорослей спирулины получается продукт неопределенного состава, физико-химические и фото-физические характеристики которого, а также, соответственно, и биологические свойства будут зависеть от многих факторов и его использование в качестве медицинского препарата может иметь непредсказуемые последствия.
Таким образом, в данном патенте-аналоге заявляется в качестве объекта изобретения фотосенсибилизатор (ФС), состоящий по крайней мере из трех химических соединений хлоринового ряда, в том числе хлорина е6, хлорина р6 (пурпурина 18), пурпурина 5 – переменного состава в виде водорастворимых солей калия или натрия.
Нами предложен к патентованию фотосенсибилизатор как объект изобретения, содержащий соль хлорина-е6 с N-метил-D-глюкамином с содержанием хлорина е не менее 98%. Техническим результатом указанного изобретения является создание новой лекарственной формы, обладающей более высокими терапевтическими свойствами по отношению к объекту противопоставления для лечения различных онкологических заболеваний методами фотодинамической терапии (ФДТ) за счет более высокого содержания действующей субстанции, т.е. хлорина е6.
Важными и принципиальными отличительными свойствами препарата являются следующие:
1) возможность создания для типовых паталогий, подлежащих лечению методами ФДТ стандартизованных медицинских приемов и методов, включающих оптимальные величины вводимых доз лекарственного препарата,
2) регламентация энергии и времени светового облучения, поскольку предлагаемый нами ФС имеет достаточно однородную структуру и фиксируемые фотофизические характеристики, что принципиально невозможно при использовании ФС переменного состава (“Радохлорина”), каждый из компонентов которого обладает различной тропностью (т.е. способностью накапливаться в очаге заболевания), растворимостью в водных растворах, используемых для внутривенного введения, а также различными фото-физическими характеристиками – спектрами поглощения и флюоресценции и способностью генерировать синглетный кислород.
Поставленные цели достигаются следующим образом.
Для получения стабильного при хранении и постоянного по составу с высоким содержанием основного вещества – хлорина e6 предлагается способ получения фотосенсибилизатора исходя из стандартизованного исходного продукта – метилфеофорбида а или же этилфеофорбида а высокой степени чистоты не менее 99% по данным ЖХВР (жидкостная хромотография высокого разрешения) и ТСХ, а также спектральным характеристикам (УФ и ПМР спектры).
Ниже приведены химические структурные формулы метилфеофорбида а и этил-феофорбида а (см. фиг.2 и фиг.3).
Метилфеофорбид а или этилфеофорбид а получается по специально разработанной нами технологии, приведенной в материалах предлагаемого способа. Использование этих соединений в качестве исходных полупродуктов для синтеза хлорина е принципиально упрощает контроль за процессом раскрытия циклопентанонового кольца в процессе синтеза хлорина е6 методом ЖХВД и позволяет проводить данную реакцию практически с количественным выходом.
Водорастворимую форму хлорина е6 в виде соли с N-метил-D-глюкамином (названную “фотодитазином”) мы предлагаем в качестве фотосенсибилизатора (ФС), который может быть использован для медицинского применения.
Выбор N-метил-D-глюкамина в качестве основания обусловлен не только его более высокой химической устойчивостью и стабильностью по отношению к другим первичным и вторичным аминам, но также и немаловажным обстоятельством применения его в фармакопее для приготовления ряда лекарственных препаратов. Кроме того, высокая химическая устойчивость водных растворов хлорина е6 с N-метил-D-глюкамином объясняется еще и способностью указанного органического основания взаимодействовать с растворенным в водных растворах кислородом, что способствует защите хлорина e6 от деструкции и сохранению неизменной его химической структуры продолжительное время.
Известно также успешное использование N-метил-D-глюкамина для получения водорастворимых биологически активных порфиринов, содержащих два остатка пропионовых кислот (А.с. 1160710 СССР, от 28 апреля 1984 г., кл C 07 D 487/22, А 61 К 3140. Жамкочан Г.А. Кириллова Г.В., Пономарев Г.В., Сухин Г.М., Романычев Ю.А., Черненко О.В., Ярцев Е.И., Яшунский В.Г. Водорастворимые соли 2,4-ди(альфа-метоксиэтил)дейтеропорфирина-1Х, обладающие способностью локализоваться в раковых тканях.
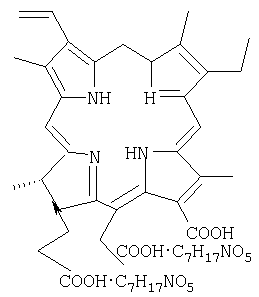
Согласно предлагаемому изобретению заявителям предлагается фотосенсибилизатор для фотодинамической терапии и способ его получения. Предлагаемый фотосенсибилизатор, состоящий их хлоринов, отличается тем, что в его составе хлорин е6 составляет не менее 98%, при этом в него дополнительно введен N-метил-D-глюкамин в мольном соотношении 1:2, а в качестве стабилизатора применен поливинилпирролидол с молекулярным весом от 9600 до 11500; фотосенсибилизатор имеет следующую химическую структурную формулу (см. фиг.4).
Предлагаемый способ получения фотосенсибилизатора, заключающийся в том, что раствор солей хлорина в ацетоне обрабатывают щелочным раствором, отличается тем, что к метилфеофорбиду а в ацетоне при 35-40°С добавляют 10 г NaOH в 100 мл воды, выдерживают в течение 5 минут при интенсивном барботировании аргона, затем при 40-50°С добавляют 45 г NaOH в 450 мл воды, выдерживают 15 мин, затем при 60°С выдерживают 45 минут, после завершения процесса охлаждают раствор до 15-20°С, нейтрализуют до рН4.5-5, отделяют осадок центрифугированием, промывают дважды дистиллированной водой, суспендируют осадок в стерильных условиях в апирогенной воде, рецентрифугируют 2-3 раза, растворяют полученный осадок в водном растворе N-метил-D-глюкамина, доводят рН до 7,75-8,20 путем добавления N-метил-D-глюкамина, затем добавляют 510-520 мл алирогенной воды так, чтобы оптическая плотность раствора при 654 нм и рН9,0 составляла 200-210 единиц, фильтруют раствор через фильтр с величиной пор 0,22 мкм, добавляют поливинилпирролидон с молекулярным весом от 9600 до 11500; а также тем, что к суспензии 20 г лиофильно высушенной спирулины в 60 мл метанола добавляют 3 мл концентрированной серной кислоты, перемешивают 24 часа, отфильтровывают, упаривают метанол до середины объема, к маслянистому остатку добавляют 10 мл гексана и повторяют операцию два раза, затем к нижнему слою добавляют 50 мл хлористого метилена, разбавляют смесь 100 мл холодной воды, органический слой отделяют, промывают водой, упаривают до минимального объема, остаток хроматографируют на колонке с силикагелем в системе хлороформ-эфир 95:5, основную фракцию упаривают, полученное вещество метилфеофорбид а кристаллизуют из хлороформа-метанола.
В результате предложенной обработки в растворе образуется практически чистый хлорин e6, о чем свидетельствует хромотограмма реакционной смеси (см. фиг.5. Прямое исследование реакции щелочного размыкания метилфеофорбида а). После завершения реакции проба из реакционной смеси обработана элюентом (смесь МеОН, CF3СООН, Н2O) до образования кислого раствора, что определяется по изменению окраски от бурой до синей, т.е. возникновению дикатиона хлорина е6). Содержание основного вещества в реакционном растворе составляет 100%. Условия проведения ЖХВД: Хроматограф фирмы LKB (Швеция); Насос – 2150 LKB, Детектор – 2158 UVCORD SD LKB, Интегратор – 2220 LKB Колонка фирмы Элсико, Носитель – Silasorb С-18, 4×250 mm, Элюент: MeOH-H2O-CF3COOH (90:10:0.01 v/v). Скорость – 0.85 мл/мин. Детекция при 405 нм.
После добавления N-метил-D-глюкамина и фильтрации через фильтры раствор полученного фотосенсибилизатора (“фотодитазина”) имеет содержание хлорина е6 не менее 98% (см. фиг.6. Образец лиофильновысушенного фотодитазина (стандарт)).
Хроматограф фирмы LKB (Швеция).
Насос – 2150 LKB, Детектор – 2158 UVCORD SD LKB.
Интегратор – 2220 LKB.
Колонка фирмы Элсико.
Носитель – Silasorb C-18,4×250 mm.
Элюент: МеОН-Н2O-CF3СООН (90:10:0.01 v/v).
Скорость – 0.85 мл/мин.
Детекция при 405 нм.
Содержание основного вещества – хлорина е6 – 98.13%.
Электронные спектры полученного фотосенсибилизатора в воде и в этаноле представлены на фиг.7 (УФ-спектры фотодитазина в воде (рН 9.0) и этаноле), а его спектры флюоресценции – на фиг.8. Спектры флуоресценции записаны на флуориметре Shimadzu RF-5301. Возбуждение в полосу Соре 404 нм для обоих растворов, ширина щели возбуждения 1,5 нм, ширина щели детектирования тоже 1,5 нм. Поглощение этих образцов в максимуме около 650 нм – в этаноле менее 0,1, в воде – менее 0,2.
Выбранные условия проведения реакции размыкания метилфеофорбида а в хлорин е6, приведенный в формуле изобретения, являются оптимальными с точки зрения раскрытия экзоцикла в молекуле хлорина. Применение мембранных фильтров с величиной пор 0,22 мкм позволяет получать стерильные растворы без разрушения структуры фотосенсибилизатора. Добавление поливинилпирролидона повышает устойчивость фотосенсибилизатора в водных растворах при хранении.
Пример 1. К раствору 4 г метилфеофорбида а в 750 мл ацетона при 35-40°С добавляют раствор 10 г NaOH в 100 мл воды, выдерживают в течение 5 минут при интенсивном барботировании аргона в при температуре 40-50°С, 45 г NaOH в 450 мл воды выдерживают 15 минут, затем 45 минут при 60°С, контролируя процесс превращения метилфеофорбида а в хлорин е6 методом ЖХВД и после завершения процесса раствор охлаждают до 15-20°С и при охлаждении нейтрализуют соляной кислотой (126 мл конц. 35%-ной HCl+250 мл воды) до рН 4.5-5, выпавший осадок отделяют центрифугированием, промывают дважды дистиллированной водой, затем в стерильных условиях суспендируют осадок в апирогенной воде и рецентрифугируют 2-3 раза. Полученный осадок растворяют в растворе 2.5 г N-метилглюкамина в 500 мл апирогенной воды, доводят рН раствора до 7.75-8.20, добавляя необходимое количество N-метилглюкамина, добавляют 510-520 мл апирогенной воды таким образом, чтобы оптическая плотность раствора в кювете 1 см при 654 нм и рН 9.0 составляла 200-210 единиц, раствор фильтруют через систему миллипор 0.22 ммк, добавляют поливинилпирролидон с молекулярным весом от 9600 до 11500, получая в результате раствор хлорина е6, который по данным ЖХВД содержит не менее 96-98% основного вещества.
Для получения предлагаемого фотосенсибилизатора в качестве основы предлагается использование метилфеофорбида a, который может быть также заменен этилфеофорбидом а, согласно предлагаемому способу метилфеофорбид а получают следующим образом.
Пример 2. К суспензии 20 г лиофильновысушенной спирулины в 60 мл МеОН приливают при интенсивном перемешивании 3 мл конц. серной кислоты, перемешивают 24 часа, сине-зеленый продукт, состоящий из спирулины, отфильтровывают через стеклянный фильтр № 2, метанол упаривают до половины объема в вакууме, к маслянистому остатку добавляют 10 мл гексана или легкого петролейного эфира, встряхивают, гексановый слой отделяют, к остатку добавляют 10 мл гексана и операцию повторяют 2 раза. К нижнему слою добавляют 50 мл хлористого метилена и смесь разбавляют 100 мл холодной воды, органический слой отделяют, промывают водой, упаривают до минимального объема, остаток хроматографируют на колонке с силикагелем в системе хлороформ-эфир (95:5), основную фракцию упаривают, вещество кристаллизуют из хлороформа-метанола и получают 0.155 г метилфеофорбида а.
УФ спектр в хлороформе,  макс нм ( макс нм ( 10-3): UV-VIS 10-3): UV-VIS  max (CHCl3) 668 nm (45.3), 610 (13.1), 536 (14.0), 506 (15,8), 412 (104.8). max (CHCl3) 668 nm (45.3), 610 (13.1), 536 (14.0), 506 (15,8), 412 (104.8).
Этилфеофорбид а можно получить аналогичным образом.
Пример 3. Аналогично, из 20 г спирулины, 60 мл абс. этанола и 4 мл конц. серной кислоты получают после обработки по п.1. 0.115 г этилфеофорбида а.
Изучение эффективности фотодинамической терапии (ФДТ) с новым фотосенсибилизатором хлоринового ряда – “фотодитазином” проводилось Государственным научным центром лазерной медицины МЗ РФ, утвержден Директором ГНЦ лазерной медицины проф. А.В.Гейницом. “Фотодитазин” – это глюкаминовая соль хлорина е6, хорошо растворимое в воде соединение, длина волны поглощения – 662 нм. Обладает высокой фотодинамической активностью, большим коэффициентом контрастности (отношение концентрации в опухоли и нормальной ткани составляет 10:1), быстрым клиренсом (через сутки в организме остается 6% от введенного количества, через 2 суток – 2%).
Изучение эффективности фотодинамической терапии с новым фотосенсибилизатором фотодитазином – производным хлорина е6 проведено по 2 протоколам: 1. При первичном и рецидивном раке кожи. С паллиативной целью для реканализации при обтурирующем раке пищевода, кардиального отдела желудка, трахеи, бронхов. В качестве фотосенсибилизатора применяли фотодитазин в дозах от 0,3 до 1,5 мг/кг. Средняя доза составила 0,8 мг/кг. Минимальная эффективная доза – 0,3 мг/кг.
Использовали диодные лазеры “Милон” с выходной мощностью 2,5 Вт, с длинной волны 662 нм (производство OOO “Сигма Плюс & Милон”, Россия) и “Ceralas” (производство фирмы CeramOptek, Германия) с выходной мощностью 1,0 Вт, длиной волны 662 нм, а также твердотельный лазер на алюминате иттрия Полюс-2 с выходной мощностью до 2 Вт, длиной волны 670 нм (производство НИИ “Полюс”, Россия).
Плотность мощности при наружном облучении составляла 0,2-0,3 Вт/см2, плотность энергии 180-240 Дж/см2. При ФДТ внутренних органов плотность энергии колебалась от 75 до 275 Дж/см.
С целью реканализации ФДТ повторяли через 7-14 дней, добиваясь поэтапного восстановления просвета трубчатого органа.
Из 72 больных 54 проведено по одному курсу ФДТ, 2 курса ФДТ проведено 11, а 3-5 курсов ФДТ – 7 больным. Всего 72 больным проведено 104 курса ФДТ: 101 с внутривенным введением фотодитазина, 3-е внутритканевым (таблица 1).
Таблица 1.
Количество курсов ФДТ с фотодитазином |
| |
Количество больных |
Количество курсов |
| 1 курс |
54 |
54 |
| 2 курса |
11 |
22 |
| 3-5 курсов |
7 |
28 |
| Всего |
72 |
104 |
Оценка непосредственных результатов проводилась через 2 месяца после окончания лечения по критериям ВОЗ:
1. Заключение о полной резорбции (ПР) делалось при отсутствии визуальных и пальпаторных признаков опухолевого роста, что подтверждалось негативными результатами морфологических исследований.
2. Заключение о частичной резорбции (ЧР) делалось в случае уменьшения максимального размера опухолевого узла на 50%, а также когда при клинически полном отсутствии опухоли морфологические исследования выявляли опухолевые клетки.
3. Уменьшение опухоли меньше чем наполовину или отсутствие изменения размеров опухоли расценивалось как отсутствие эффекта (БЭ).
Результаты применения ФДТ представлены в таблицах 2 и 3. Полная резорбция достигнута у 44 больных, частичная – у 28, включая 15 пациентов, получавших ФДТ с паллиативной целью: 12 с целью реканализации пищевода, кардии, трахеи и бронхов и у 3 с распространенным раком рото- и носоглотки.
Таблица 2.
Эффективность ФДТ с фотодитазином (Количество пролеченных больных) |
Локализация
опухоли |
Количество
больных |
Эффект ФДТ |
| ПР |
ЧР |
| Рак кожи |
41 |
34 |
7 |
| Меланома кожи |
2 |
1 |
1 |
| Рак слизистой оболочки полости рта, языка, губы |
6 |
3 |
3 |
| Рак гортани |
5 |
4 |
1 |
| Рак легкого |
3 |
|
3 |
| Рак пищевода |
8 |
|
8 |
| Рак желудка |
2 |
1 |
1 |
| Прочие |
5 |
1 |
4 |
| Всего |
72 |
44 |
28 |
Таблица 3.
ФДТ с фотодитазином (Количество опухолевых очагов) |
Локализация
опухоли |
Количество
опухолей |
Эффект ФДТ |
| ПР |
ЧР |
| Рак кожи |
140 |
91 |
49 |
| Меланома кожи |
5 |
1 |
4 |
| Рак слизистой оболочки полости рта, языка, губы |
6 |
3 |
3 |
| Рак гортани |
5 |
4 |
1 |
| Рак легкого |
3 |
0 |
3 |
| Рак пищевода |
8 |
0 |
8 |
| Рак желудка |
2 |
1 |
1 |
| Прочие |
4 |
1 |
3 |
| Всего |
173 |
101 |
72 |
| ПР – полная резорбция опухоли, ЧР – частичная резорбция опухоли |
Как видно из таблиц, ФДТ с фотодитазином во всех случаях приводила к развитию терапевтического эффекта. Отсутствия эффекта отмечено не было. При проведении ФДТ по радикальной программе у больных первичным и рецидивным раком кожи полная резорбция достигнута в 82,9% случаев. При лечении злокачественных опухолей гортани полная резорбция констатирована в 80% случаев.
При проведении паллиативной ФДТ при обтурирующих опухолях внутренних органов эффект ФДТ выражался в значительном улучшении состояния больных. В результате ФДТ у 8 больных раком пищевода получен выраженный эффект реканализации с восстановлением питания через рот. Трое из них в течение первого месяца прибавили в весе 15-20%. Эффект реканализации сохранялся 3-7 месяцев.
У всех больных раком легкого получен выраженный эффект реканализации с ликвидацией одышки и стридорозного дыхания с 3-4 суток после ФДТ. При контрольной бронхоскопии после первого курса ФДТ отмечалось частичное (50%) восстановление просвета бронхов, после 2-3 курса – полное восстановление просвета с рентгенологически определяемой ликвидацией явлений гиповентиляции и ателектаза и восстановлением прозрачности (воздушности) легочной ткани.
Среди больных с рецидивом плоскоклеточного рака языка и слизистой полости рта и рецидивом плоскоклеточного рака носоглотки после лучевой терапии, которым было проведено по 2 курса ФДТ с интервалом 2-2,5 месяца, у одного больного удалось добиться полной резорбции опухоли и у двух – частичной резорбции.
Быстрое выведение фотодитазина из организма разрешает проблему кожной фототоксичности, свойственную большинству применяемых в клинике фотосенсибилизаторов.
Благодаря быстрому накоплению в опухоли с высоким градиентом контрастности между опухолевой и нормальной тканью фотодитазин позволяет сократить всю лечебную процедуру с нескольких суток до 2-3 часов. Это свойство фотодитазина, наряду с высоким коэффициентом контрастности и имеющимися недорогими портативными надежными диодными лазерами с соответствующей длиной волны света, делает его весьма привлекательным фотосенсибилизатором для ФДТ.
Применение ФДТ с фотодитазином для лечения рака кожи приводит к наступлению полной резорбции опухоли у 83% больных.
ФДТ с фотодитазином можно с успехом применять с паллиативной целью у пациентов с распространенным опухолевым процессом в пищеводе, проксимальном отделе желудка, трахее, крупных бронхах, рото- и носоглотке.
Таким образом предлагаемые авторами фотосенсибилизатор и способ его изготовления удовлетворяют условиям патентоспособности, предусмотренным Патентным законом РФ “новизна”, “промышленная применимость”, “изобретательский уровень”.
Формула изобретения
1. Способ получения фотосенсибилизатора для фотодинамической терапии, заключающийся в обработке спирулины неорганической кислотой, перемешивании, фильтрации, с последующим получением производных феофорбида а, растворением их в ацетоне, добавлением неорганического основания в виде водного раствора при нагревании, охлаждением, нейтрализацией соляной кислотой, центрифугированием, отделением осадка, содержащего целевой продукт и, промывки его дистиллированной водой, отличающийся тем, что обрабатывают суспензию лиофильно высушенной спирулины в метаноле концентрированной серной кислотой, перемешивают 24 часа, после фильтрации упаривают метанол до половины объема в вакууме, к маслянистому остатку добавляют гексан, встряхивают, гексановый слой отделяют, к остатку снова добавляют гексан, повторяют операцию два раза, к нижнему слою добавляют хлористый метилен, разбавляют смесь холодной водой, органический слой отделяют, промывают водой, упаривают до минимального объема, остаток хроматографируют на колонке с силикагелем в системе хлороформ-эфир в соотношении 95:5, фракцию, содержащую метилфеофорбид а упаривают, кристаллизуют метилфеофорбид а из хлороформа-метанола, затем при добавлении неорганического основания в виде водного раствора NaOH к раствору метилфеофорбида а в ацетоне в течение 5 мин интенсивно барботируют аргоном, затем при 40-50°С вновь добавляют NaOH в воде и выдерживают 15 мин, затем 45 мин при 60°С, охлаждают раствор до 15-20°С, нейтрализуют до рН=4,5-5, а полученный центрифугированием осадок, содержащий хлорин е6, после промывки дистиллированной водой суспендируют в стерильных условиях в апирогенной воде, рецентрифугируют 2-3 раза, растворяют полученный осадок в водном растворе N-метил-D-глюкамина, доводят рН до 7,75-8,20, затем добавляют 510-520 мл апирогенной воды так, чтобы оптическая плотность раствора при 654 нм и рН=9,0 составляла 200-210 ед., фильтруют раствор через фильтр с величиной пор 0,22 ммк и добавляют поливинилпирролидон с молекулярным весом от 9600 до 11500.
2. Фотосенсибилизатор для фотодинамической терапии, содержащий соли хлорина, отличающийся тем, что он получен способом по п.1 и содержит хлорин е6 в количестве не менее 98%, N-метил-D-глюкамин в мольном соотношении 1:2 и поливинилпирролидон с молекулярным весом от 9600 до 11500, при этом хлорин е6 имеет структурную формулу:
РИСУНКИ
|
|