|
|
(21), (22) Заявка: 2002135617/04, 01.06.2001
(24) Дата начала отсчета срока действия патента:
01.06.2001
(30) Конвенционный приоритет:
06.06.2000 (пп.6, 7, 11) EP 00401581.4
07.02.2001 (пп.1-3, 8, 12-20) EP 01400297.6
05.03.2001 (пп.4, 5, 9, 10) EP 01400565.6
(43) Дата публикации заявки: 10.08.2004
(45) Опубликовано: 10.05.2006
(56) Список документов, цитированных в отчете о
поиске:
RU 2127263 C1, 10.03.1999. US 5962458 А, 05.10.1999. WO 99/61428 A1, 02.12.1999. US 5955464 A, 21.12.1999.
(85) Дата перевода заявки PCT на национальную фазу:
08.01.2003
(86) Заявка PCT:
GB 01/02424 (01.06.2001)
(87) Публикация PCT:
WO 01/94341 (13.12.2001)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ЭННЕКЕН Лоран Франсуа Андре (FR),
ПЛЕ Патрик (FR)
(73) Патентообладатель(и):
АСТРАЗЕНЕКА АБ (SE)
|
(54) ХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ
(57) Реферат:
Настоящее изобретение относится к хиназолиновым производным формулы I или их фармацевтически приемлемым солям
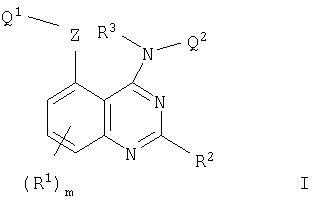
где m равно 0 или 1; каждая группа R1, которая может быть одинаковой или различной, представляет собой галоген, гидрокси и (1-6С)алкокси или группу формулы Q3-Х1, где X1 представляет О и Q3 представляет собой фенил-(1-6С)алкил, гетероарил(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, и где гетероарильная группа представляет собой ароматические 5- или 6-членные моноциклические кольца с одним или двумя гетероатомами азота и любая гетероциклильная группа, определенная как группа R1, представляет собой неароматическое насыщенное или частично насыщенное 3-6-членное моноциклическое кольцо с одним или двумя гетероатомами, выбранными из кислорода и азота, и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем внедрения в цепь О, и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой из указанных групп СН2 или СН3 один или несколько галогеновых заместителей или заместитель, выбранный из гидрокси, (1-6С)алкокси, (1-6С)алкилсульфонила или пиридилокси, и где любая гетероарильная или гетероциклильная группа в заместителе R1 необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, выбранными из гидрокси, карбамоила, 1-6С)алкила, (1-6С)алкоксикарбонила, N-(1-6С)алкилкарбамоила, N,N-ди-[(1-6С)алкил] карбамоила, (1-6С)алкокси-(1-6С)алкила и циано-(1-6С)алкила или из группы формулы -Х5-Q6, где X5 представляет собой прямую связь или СО и Q6 представляет собой гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит (1-6С)алкил в качестве заместителя, где гетероциклильная группа представляет собой неароматическое, полностью или частично насыщенное 5- или 6-членное моноциклическое кольцо с одним или двумя гетероатомами, выбранными из азота и кислорода; R2 представляет собой водород; R3 представляет собой водород; Z прямая связь или кислород; Q1 представляет собой фенил, (3-7С)циклоалкил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, где гетероарильная группа представляет собой 5- или 6-членное ароматическое моноциклическое кольцо с одним, двумя или тремя гетероатомами азота и любая гетероциклильная группа представляет собой неароматическое насыщенное полностью или частично 5- или 6-членное моноциклическое кольцо с одним или двумя гетероатомами, выбранными из кислорода, азота или серы, или когда Z представляет собой О, Q1 может быть (1-6С)алкилом или (1-6С)алкокси-(1-6С)алкилом и где любая из гетероциклильных групп в группе Q1-Z- необязательно заместители, выбранные из (1-6С)алкила, (1-6С)алкоксикарбонила и пиридилметила, и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителей, и Q2 представляет собой арильную группу формулы Ia
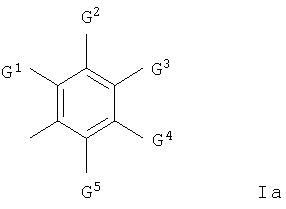
где G1 представляет собой галоген, трифторметил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (1-6С)алкилтио, (2-6С)алканоил, пирролил, пирролидинил, пиперидинил и морфолинометил и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, галоген, циано, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил и (1-6С)алкокси, или G1 и G2 вместе образуют группу формул -СН=СН-СН=СН-, -СН=СН-O- или -O-СН=СН-, каждая из которых необязательно имеет в качестве заместителя галоген, или G1 и G2 вместе образуют группу формул -O-СН2-O- или -O-СН2-СН2-O- или -O-СН2-СН2-O- и каждый из G3 и G4 представляет собой водород, и G5 выбирают из водорода и галогена. Соединения изобретения обладают противоопухолевой активностью и предназначены для получения лекарственного препарата для использования в качестве противоопухолевого средства для сдерживания и/или лечения солидных опухолей. Объектом изобретения также является фармацевтическая композиция на основе вышеописанных соединений. 2 н. и 18 з.п. ф-лы, 7 табл.
Настоящее изобретение относится к некоторым новым хиназолиновым производным или их фармацевтически приемлемым солям, которые обладают противоопухолевой активностью и соответственно могут использоваться в способах лечения организма человека или животного. Настоящее изобретение также относится к способам получения указанных хиназолиновых производных, к содержащим их фармацевтическим композициям и к их применению в способах лечения солидных опухолей у теплокровного животного, такого как человек.
Во многих из современных схем лечения клеточно-пролиферативных заболеваний, таких как псориаз и злокачественные опухоли, применяются соединения, ингибирующие синтез ДНК. Такие соединения вообще токсичны по отношению к клеткам, но их токсическое действие на быстроделящиеся клетки, такие как опухолевые клетки, может быть выгодным. Альтернативные подходы к противоопухолевым средствам, которые действуют по механизмам, отличным от ингибирования синтеза ДНК, обладают потенциалом оказания действия повышенной селективности.
В последние годы было доказано, что клетка может малигнизироваться в результате трансформации части ее ДНК в онкоген, т.е. ген, который при активации приводит к образованию злокачественных опухолевых клеток (Bradshaw, Mutagenesis, 1986, 1, 91). Некоторые такие онкогены вызывают продукцию пептидов, которые являются рецепторами для факторов роста. Активация комплекса рецептора фактора роста впоследствии приводит к усилению клеточной пролиферации. Известно, например, что некоторые онкогены кодируют тирозинкиназные ферменты, а также что определенные рецепторы факторов роста также являются тирозинкиназными ферментами (Yarden et al., Ann. Rev. Biochem., 1988, 57, 443; Larsen et al., Ann. Reports in Med. Chem., 1989, Chpt. 13). Первая идентифицированная группа тирозинкиназ состояла из таких вирусных онкогенов, как, например, тирозинкиназа pp60V Src (иначе называемая v-Src), и соответствующих тирозинкиназ нормальных клеток, например тирозинкиназы рр60С-Src (иначе называемой c-Src).
Рецепторные тирозинкиназы важны для передачи биохимических сигналов, запускающих клеточное деление. Они представляют собой крупные ферменты, которые пронизывают клеточную мембрану и обладают внеклеточным доменом, связывающим факторы роста, такие как эпидермальный фактор роста (EGF), и внутриклеточной частью, которая функционирует как киназа, фосфорилируя тирозиновые аминокислотные остатки в белках и таким образом влияя на клеточную пролиферацию. Известны разные классы рецепторных тирозинкиназ (Wilks, Advances in Cancer Research, 1993, 60, 43-73), основанные на семействах факторов роста, связывающихся с различными рецепторными тирозинкиназами. Классификация включает рецепторные тирозинкиназы класса I, включающие EGF-семейство рецепторных тирозинкиназ, такие как рецепторы EGF, TGF , Neu и erbB, рецепторные тирозинкиназы класса II, включающие инсулиновое семейство рецепторных тирозинкиназ, такие как рецепторы инсулина и IGFI и инсулин-ассоциированный рецептор (IRR), и рецепторные тирозинкиназы класса III, включающие рецепторные тирозинкиназы семейства тромбоцитарного фактора роста (PDGF), такие как рецепторы PDGF , Neu и erbB, рецепторные тирозинкиназы класса II, включающие инсулиновое семейство рецепторных тирозинкиназ, такие как рецепторы инсулина и IGFI и инсулин-ассоциированный рецептор (IRR), и рецепторные тирозинкиназы класса III, включающие рецепторные тирозинкиназы семейства тромбоцитарного фактора роста (PDGF), такие как рецепторы PDGF , PDGF , PDGF и колониестимулирующего фактора 1 (CSF1). и колониестимулирующего фактора 1 (CSF1).
Также известно, что некоторые тирозинкиназы принадлежат к классу нерецепторных тирозинкиназ, которые локализуются внутриклеточно и вовлечены в передачу биохимических сигналов, таких как сигналы, влияющие на подвижность, диссеминацию и инвазивность опухолевых клеток и, следовательно, рост опухолевых метастазов (Ullrich et al., Cell, 1990, 61, 203-212, Bolen et al., FASEB J., 1992, 6, 3403-3409, Brickell et al., Critical Reviews in Oncogenesis, 1992, 3, 401-406, Bohlen et al., Oncogene, 1993, 8, 2025-2031, Courtneidge et al., Semin. Cancer Biol., 1994, 5, 239-246, Lauffenburger et al., Cell, 1996, 84, 359-369, Hanks et al., BioEssays, 1996, 19, 137-145, Parsons et al., Current Opinion in Cell Biology, 1997, 9, 187-192, Brown et al., Biochimica et Biophysica Acta, 1996, 1287, 121-149, и Schlaepfer et al., Progress in Biophysics и Molecular Biology, 1999, 71, 435-478). Известны различные классы нерецепторных тирозинкиназ, включая семейство Src, такие как тирозинкиназы Src, Lyn, Fyn и Yes, семейство Abl, такие как Abl и Arg, и семейство Jak, такие как Jak 1 и Tyk 2.
Известно, что нерецепторные тирозинкиназы семейства Src чрезвычайно регулируемы в нормальных клетках и в отсутствие внеклеточных стимулов находятся в неактивной конформации. Однако некоторые члены семейства Src, например тирозинкиназа c-Src, зачастую значительно активирована (по сравнению с уровнями в нормальной клетке) при распространенных злокачественных опухолях у человека, таких как злокачественные опухоли желудочно-кишечного тракта, например толстой кишки, злокачественные опухоли прямой кишки и желудка (Cartwright et al., Proc. Natl. Acad. Sci. USA, 1990, 87, 558-562, и Мао et al., Oncogene, 1997, 15, 3083-3090) и рака молочной железы (Muthuswamy et al., Oncogene, 1995, 11, 1801-1810). Нерецепторные тирозинкиназы семейства Src также обнаруживаются при иных распространенных злокачественных опухолях у человека, таких как немелкоклеточный рак легкого (НМКРЛ), включая аденокарциномы и плоскоклеточный рак легкого (Mazurenko et al., European Journal of Cancer, 1992, 28, 372-7), рак мочевого пузыря (Fanning et al., Cancer Research, 1992, 52, 1457-62), рак пищевода (Jankowski et al., Gut, 1992, 33, 1033-8), рак предстательной железы, рак яичника (Wiener et al., Clin. Cancer Research, 1999, 5, 2164-70) и рак поджелудочной железы (Lutz et al., Biochem. и Biophys. Res. Comm., 1998, 243, 503-8). По мере того, как на предмет содержания нерецепторных тирозинкиназ семейства Src исследуются другие опухолевые ткани человека, ожидается, что будет установлена их широкая распространенность.
Также известно, что основная роль нерецепторной тирозинкиназы c-Src состоит в регуляции сборки комплексов фокальной адгезии путем взаимодействия с рядом цитоплазматических белков, включая, например, киназу фокальной адгезии и паксиллин. Кроме того, c-Src связывается с сигнальными путями, регулирующими актиновый цитоскелет, который способствует клеточной подвижности. Также нерецепторные тирозинкиназы c-Src, c-Yes и c-Fyn играют важную роль в интегрин-опосредованной передаче сигнала и в разрушении кадгерин-зависимых межклеточных контактов (Owens et al., Molecular Biology of the Cell, 2000, 11, 51-64, и Klinghoffer et al., EMBO Journal, 1999, 18, 2459-2471). Клеточная подвижность обязательно необходима для прогрессирования локализованной опухоли в стадии диссеминации через кровоток, прорастания других клеток и начала роста опухолевых метастазов. Например, прогрессирование опухоли толстого кишечника от локализованного до диссеминированного инвазивного метастатического заболевания коррелировало с активностью нерецепторной тирозинкиназы c-Src (Brunton et al., Oncogene, 1997, 14, 283-293, Fincham et al., EMBO J., 1998, 17, 81-92, и Verbeek et al., Exp. Cell Research, 1999, 248, 531-537).
Соответственно, стало понятно, что ингибитор таких нерецепторных тирозинкиназ будет применим в качестве селективного ингибитора подвижности опухолевых клеток и в качестве селективного ингибитора диссеминации и инвазивности злокачественных клеток у млекопитающих, что приведет к ингибированию роста метастазов опухоли. В частности, ингибитор таких нерецепторных тирозинкиназ будет применим в качестве антиинвазионного средства для применения для сдерживания и/или лечения солидной опухоли.
Авторы настоящего изобретения неожиданно обнаружили, что определенные хиназолиновые производные обладают мощной противоопухолевой активностью. Не подразумевая, что соединения, описанные в настоящем изобретении, обладают фармакологической активностью только посредством влияния на единственный биологический процесс, считается, что соединения обеспечивают противоопухолевый эффект путем ингибирования одной или нескольких нерецепторных тирозин-специфичных протеинкиназ, которые вовлечены в процесс передачи сигнала, который приводит к инвазивности и миграционной способности метастазирующих опухолевых клеток. В частности, считается, что соединения по настоящему изобретению оказывают противоопухолевый эффект путем ингибирования семейства нерецепторных тирозинкиназ Src, например, путем ингибирования одной или нескольких из c-Src, c-Yes и c-Fyn.
Также известно, что нерецепторный тирозинкиназный фермент c-Src участвует в подавлении осуществляемой остеокластами резорбции кости (Soriano et al., Cell, 1991, 64, 693-702; Boyce et al., J. Clin. Invest., 1992, 90, 1622-1627; Yoneda et al., J. Clin. Invest., 1993, 91, 2791-2795, и Missbach et al., Bone, 1999, 24, 437-49). Ингибитор нерецепторной тирозинкиназы c-Src, таким образом, применим для профилактики и лечения заболеваний кости, таких как остеопороз, болезнь Педжета, метастазы в кость и опухоль-индуцированная гиперкальциемия.
Соединения по настоящему изобретению также применимы в ингибировании неконтролируемой клеточной пролиферации, которая имеет место при различных незлокачественных заболеваниях, таких как воспалительные заболевания (например, ревматоидный артрит и воспалительные заболевания кишечника), фибротические заболевания (например, цирроз печени и фиброз легкого), гломерулонефрит, рассеянный склероз, псориаз, реакции гиперчувствительности кожи, заболевания кровеносных сосудов (например, атеросклероз и рестеноз), аллергическая бронхиальная астма, инсулин-зависимый сахарный диабет, диабетическая ретинопатия и диабетическая нефропатия.
Как правило, соединения по настоящему изобретению обладают мощной ингибирующей активностью по отношению к семейству нерецепторных тирозинкиназ Src, например, за счет ингибирования c-Src и/или c-Yes, при том что они обладают менее сильной ингибирующей активностью по отношению к другим тирозинкиназным ферментам, таким как рецепторные тирозинкиназы, например тирозинкиназа рецептора EGF и/или тирозинкиназа рецептора VEGF. Кроме того, определенные соединения по настоящему изобретению обладают существенно лучшей активностью против семейства нерецепторных тирозинкиназ Src, например c-Src и/или c-Yes, чем против тирозинкиназы рецептора EGF или тирозинкиназы рецептора VEGF. Такие соединения обладают достаточной активностью против семейства нерецепторных тирозинкиназ Src, например c-Src и/или c-Yes, для того чтобы быть применимыми в количестве, достаточном для ингибирования, например c-Src и/или c-Yes, демонстрируя при этом слабую активность против тирозинкиназы рецептора EGF или тирозинкиназы рецептора VEGF.
В соответствии с одним аспектом настоящее изобретение относится к хиназолиновым производным формулы I
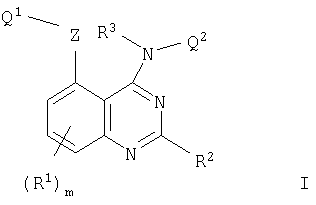
где m равно 0, 1, 2 или 3;
каждая группа R1, которая может быть одинаковой или различной, представляет собой галоген, трифторметил, циано, изоциано, нитро, гидрокси, меркапто, амино, формил, карбокси, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6C)алкокси, (2-6С)алкенилокси, (2-6C)алкинилокси, (1-6С)алкилтио, (1-6C)алкилсульфинил, (1-6С)алкилсульфонил, (1-6C)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, (3-6С)алкеноиламино, N-(1-6C)алкил(3-6С)алкеноиламино, (3-6С)алкиноиламино, N-(1-6С)алкил-(3-6С)алкиноиламино, N-(1-6С)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6С)алкансульфониламино или N-(1-6C)алкил-(1-6С)алкансульфониламино или группу формулы
Q3-X1,
где X1 представляет собой прямую связь или выбран из О, S, SO, SO2, N(R4), CO, CH(OR4), CON(R4), N(R4)CO, SO2N(R4), N(R4)SO2, OC(R4)2, SC(R4)2 или N(R4)C(R4)2, где R4 представляет собой водород или (1-6C)алкил, a Q3 представляет собой арил, арил-(1-6C)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6C)алкил, или (R1)m представляет собой (1-3С)алкилендиокси,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем внедрения в цепь группы, выбранной из О, S, SO, SO2, N(R5), CO, CH(OR5), CON(R5), N(R5)CO, SO2N(R5), N(R5)SO2, CH=CH и С С, где R5 представляет собой водород или (1-6C)алкил и где любая из групп СН2=СН- и НС С, где R5 представляет собой водород или (1-6C)алкил и где любая из групп СН2=СН- и НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой галоген, карбокси, карбамоил, (1-6C)алкоксикарбонил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6C)алкил или группу формулы заместитель, представляющий собой галоген, карбокси, карбамоил, (1-6C)алкоксикарбонил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6C)алкил или группу формулы
Q4-X2,
где X2 представляет собой прямую связь или СО, или N(R6)СО, где R6 представляет собой водород или (1-6C)алкил, a Q4 представляет собой арил, арил-(1-6C)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой из указанных групп СН2 или СН3 один или несколько галогеновых или (1-6С)алкильных заместителей или заместитель, представляющий собой гидрокси, циано, амино, карбокси, карбамоил, (1-6C)алкокси, (1-6С)алкилтио, (1-6C)алкилсульфинил, (1-6C)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6C)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил(2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6С)алкил-(1-6C)алкансульфониламино, или группу формулы
-Х3-Q5,
где X3 представляет собой прямую связь или О, S, SO, SO2, N(R7), CO, CH(OR7), CON(R7), N(R7)CO, SO2N(R7), N(R7)SO2, C(R7)2O, C(R7)2S или N(R7)C(R7)2, где R7 представляет собой водород или (1-6C)алкил, а Q5 представляет собой арил, арил-(1-6C)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил(1-6C)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6C)алкил, гетероарил, гетероарил(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил, и где любая арильная, гетероарильная или гетероциклильная группа в заместителе В1 необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6C)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6C)алкилтио, (1-6C)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С) алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, N-(1-6С)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6С)алкансульфониламино или N-(1-6C)алкил(1-6С)алкансульфониламино, или группу формулы
-Х4-R8,
где X4 представляет собой прямую связь или О или N(R9), где R9 представляет собой водород или (1-6C)алкил, a R8 представляет собой галоген-(1-6C)алкил, гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6C)алкил, циано-(1-6C)алкил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил, ди-[(1-6С)алкил]амино(1-6C) алкил, (2-6С)алканоиламино-(1-6C)алкил или (1-6C)алкоксикарбониламино-(1-6C)алкил, или группу формулы
-X5-Q6,
где X5 представляет собой прямую связь или О, СО и N(R10), где R10 представляет собой водород или (1-6C)алкил, и Q6 представляет собой арил, арил-(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, выбранные из галогена, (1-6С)алкила и (1-6С)алкокси, и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксо- или тиоксозаместителя;
R2 представляет собой водород или (1-6С)алкил;
R3 представляет собой водород или (1-6С)алкил;
Z представляет собой прямую связь или О, S, SO, SO2, N(R11), CO, CH(OR11), CON(R11), N(R11)CO, SO2N(R11), N(R11)SO2, OC(R11)2, SC (R11)2 или N(R11)С(R11)2, где R11 представляет собой водород или (1-6С)алкил;
Q1 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, или, когда Z представляет собой прямую связь или О, Q1 может представлять собой (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, галоген-(1-6С)алкил, гидрокси-(1-6С)алкил, (1-6С)алкокси-(1-6С)алкил, циано-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино(1-6С)алкил, ди-[(1-6С)алкил]амино-(1-6С)алкил, (1-6С)алкилтио-(1-6С)алкил, (1-6С)алкилсульфинил-(1-6С)алкил или (1-6С)алкилсульфонил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z-необязательно разделены путем встраивания в цепь группы, выбранной из О, S, SO, SO2, N(R12), CO, CH(OR12), CON(R12), N(R12)CO, SO2N(R12), N(R12)SO2, CH=CH и С С, где R12 представляет собой водород или (1-6C)алкил, С, где R12 представляет собой водород или (1-6C)алкил,
и где любая из групп СН2=СН- или HC C- в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС C- в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой галоген, карбокси, карбамоил, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, амино-(1-6C)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6C)алкил]амино-(1-6С)алкил или группу формулы заместитель, представляющий собой галоген, карбокси, карбамоил, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, амино-(1-6C)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6C)алкил]амино-(1-6С)алкил или группу формулы
Q7-X6-,
где X6 представляет собой прямую связь или СО или N(R13)CO, где R13 представляет собой водород или (1-6C) алкил, а Q7 представляет собой арил, арил-(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая из групп CH2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе CH2 или СН3 один или несколько галогеновых или (1-6C)алкильных заместителей или заместитель, представляющий собой гидрокси, циано, амино, карбокси, карбамоил, (1-6C)алкокси, (1-6С)алкилтио, (1-6C)алкилсульфинил, (1-6C)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6C)алкил]амино, (1-6C)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил(2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6C)алкил] сульфамоил, (1-6C)алкансульфониламино или N-(1-6С)алкил-(1-6С)алкансульфониламино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, S, SO, SO2, N(R14), CO, CH(OR14), CON(R14), N(R14)CO, SO2N(R14), N(R14)SO2, C(R14)2O, C(R14)2S или N(R14)C(R14)2, где R14 представляет собой водород или (1-6C)алкил, a Q8 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая из арильной, гетероарильной или гетероциклильной группы в группе Q1-Z- необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, N-(1-6С)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6С)алкансульфониламино или N-(1-6C)алкил(1-6С)алкансульфониламино, или группу формулы
-X8-R15,
где X8 представляет собой прямую связь или О или N(R16), где R16 представляет собой водород или (1-6C)алкил, и R15 представляет собой галоген-(1-6С)алкил, гидрокси-(1-6С)алкил, (1-6С)алкокси-(1-6С)алкил, циано-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил или ди-[(1-6С)алкил]амино-(1-6С)алкил, или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О, СО или N(R17), где R17 представляет собой водород или (1-6С) алкил, a Q9 представляет собой арил, арил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, выбранные из галогена, (1-6С)алкила и (1-6С)алкокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксо- или тиоксозаместителя и Q2 представляет собой арильную группу формулы Ia
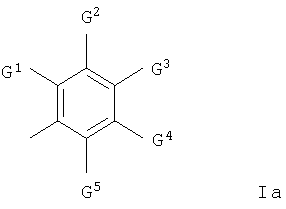
где G1 представляет собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, (3-6С)алкеноиламино, N-(1-6C)алкил(3-6С)алкеноиламино, (3-6С)алкиноиламино, N-(1-6C)алкил-(3-6С)алкиноиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6C)алкил-(1-6C)алкансульфониламино, или группу формулы
-Х10-R18,
где X10 представляет собой прямую связь или О или N(R19), где R19 представляет собой водород или (1-6C)алкил, a R18 представляет собой галоген-(1-6C)алкил, гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6C)алкил, циано-(1-6C)алкил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6C)алкил, или группу формулы
-Х11-Q10.
где X11 представляет собой прямую связь или О, S, SO, SO2, N(R20), CO, CH(OR20), CON(R20), N(R20)CO, SO2N(R20), N(R20)SO2, C(R20)2O, C(R20)2S или N(R20)C(R20)2, где R20 представляет собой водород или (1-6C)алкил, a Q10 представляет собой арил, арил-(1-6С)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6C)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, выбранные из галогена, (1-6C)алкила и (1-6С)алкокси, и любая гетероциклильная группа в Q10 необязательно содержит 1 или 2 оксо- или тиоксозаместителя,
и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, галоген, трифторметил, циано, нитро, гидрокси, амино, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (1-6С)алкиламино или ди-[(1-6С)алкил]амино,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -N=CH-CH=CH-, -CH=N-CH=CH-, -CH=CH-N=CH-, -CH=CH-CH=N-, -N=CH-N=CH-, -CH=N-CH-N-, -N=CH-CH=N-, -N=N-CH=CH-, -CH=CH-N=N-, -CH=CH-O-, -O-CH=CH-, -CH=CH-S-, -S-CH=CH-, -CH2-CH2-O-, -О-СН2-СН2-, -CH2-CH2-S-, -S-CH2-CH2-, -O-CH2-O-, -O-CH2-CH2-O-, -S-CH2-S-, -S-CH2-CH2-S-, -CH=CH-NH-, -NH-CH=CH-, -CH2-CH2-NH-, -NH-CH2-CH2-, -N=CH-NH-, -NH-CH=N-, -NH-CH2-NH-, -O-CH=N-, -N=CH-O-, -S-CH=N-, -N=CH-S-, -O-CH2-NH-, -NH-CH2-O-, -S-CH2-NH-, -NH-CH2-S-, -O-N=CH-, -CH=N-O-, -S-N=CH-, -CH=N-S-, -O-NH-CH2-, -CH2-NH-O-, -S-NH-CH2-, -CH2-NH-S-, -NH-N=CH-, -CH=N-NH-, -NH-NH-CH2-, -CH2-NH-NH-, -N=N-NH- или -NH-N=N-,
или G1 принимает одно из значений, определенных ранее, а G2 и G3 вместе или G3 и G4 вместе образуют группу формулы -СН=СН-СН=СН-, -N=CH-CH=CH-, -CH=N-CH=CH-, -CH=CH-N=CH-, -CH=CH-CH=N-, -N=CH-N=CH-, -CH=N-CH=N-, -N=CH-CH=N-, -N=N-CH=CH-, -CH=CH-N=N-, -CH=CH-O-, -O-CH=CH-, -CH=CH-S-, -S-CH=CH-, -CH2-CH2-O-, -O-CH2-CH2-, -CH2-CH2-S-, -S-CH2-CH2-, -O-CH2-O-, -O-CH2-CH2-O-, -S-CH2-S-, -S-CH2-CH2-S-, -CH=CH-NH-, -NH-CH=CH-, -CH2-CH2-NH-, -NH-CH2-CH2-, -N=CH-NH-, -NH-CH=N-, -NH-CH2-NH-, -O-CH=N-, -N=CH-O-, -S-CH=N-, -N=CH-S-, -O-CH2-NH-, -NH-CH2-O-, -S-CH2-NH-, -NH-CH2-S-, -O-N=CH-, -CH=N-O-, -S-N=CH-, -CH=N-S-, -O-NH-CH2-, -CH2-NH-O-, -S-NH-CH2-, -CH2-NH-S-, -NH-N=CH-, -CH=N-NH-, -NH-NH-CH2-, -CH2-NH-NH-, -N=N-NH- или -NH-N=N-,
и 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо, образуемое при связывании G1 и G2 вместе, G2 и G3 вместе или G3 и G4 вместе, необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (1-6С)алкиламино или ди-[(1-6С)алкил]амино, и любое образованное таким образом бициклическое гетероциклическое кольцо необязательно содержит 1 или 2 оксо- или тиоксогруппы,
или его фармацевтически приемлемой соли.
В соответствии со следующим аспектом настоящее изобретение относится к хиназолиновому производному формулы I, где каждый из m, R1, R2, R3 и Q2 принимает значения, определенные выше, и
Z представляет собой прямую связь или О, S, SO, SO2, N(R11), CO, CH(OR11), CON(R11), N(R11)CO, SO2N(R11), N(R11)SO2, OC(R11)2, SC(R11)2 или N(R11)C(R11)2, где R11 представляет собой водород или (1-6С)алкил и
Q1 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6С)алкил, гетероарил, гетероарил-(1-6С) алкил, гетероциклил или гетероциклил-(1-6С) алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z-необязательно разделены путем встраивания в цепь группы, выбранной из О, S, SO, SO2, N(R12), CO, CH (OR12), CON(R12), N(R12)CO, SO2N(R12), N(Rl2)SO2, CH=CH и C C, где R12 представляет собой водород или (1-6С)алкил, C, где R12 представляет собой водород или (1-6С)алкил,
и где любая из групп СН2 или СН2 в группе Q1-Z- необязательно содержит в каждой из указанных групп СН2 или СН3 один или несколько галогеновых или (1-6С)алкильных заместителей или заместитель, представляющий собой гидрокси, циано, амино, карбокси, карбамоил, (1-6С)алкокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил(2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6С)алкил-(1-6C)алкансульфониламино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, S, SO, SO2, N(R14), CO, CH(OR14), CON(R14), N(R14)CO, SO2N(R14), N(R14)SO2, С(R14)2O, C(R14)2S или N(Rl4)C(R14)2, где R14 представляет собой водород или (1-6C)алкил, a Q8 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6C)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6 С)алкил,
и где любая арильная, гетероарильная или гетероциклильная группа в группе Q1-Z-необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6C)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, N-(1-6С)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6С)алкил(1-6С)алкансульфониламино, или группу формулы
-Х8-R15,
где X8 представляет собой прямую связь или О или N(R16), где R16 представляет собой водород или (1-6C)алкил, a R15 представляет собой галоген-(1-6C)алкил, гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6C)алкил, циано-(1-6C)алкил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6C)алкил, или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О, СО или N(R17), где R17 представляет собой водород или (1-6C) алкил, a Q9 представляет собой арил, арил-(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, выбранные из галогена, (1-6С)алкила и (1-6С)алкокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксо- или тиоксозаместителя.
В соответствии со следующим аспектом настоящее изобретение относится к хиназолиновому производному формулы I, где каждый из m, R1, R2, R3 и Q2 принимает любое из значений, определенных выше, и
Z представляет собой О, S, SO, SO2, N(R11), CO, CH(OR11), CON(R11), N(R11)СО, SO2N(R11), N(R11)SO2, OC(R11)2, SC(R11)2 или N(R11)С(R11)2, где R11 представляет собой водород или (1-6С)алкил, и
Q1 представляет собой (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z-необязательно разделены путем встраивания в цепь группы, выбранной из О, S, SO, SO2, N(R12), CO, CH(OR12), CON(R12), N(R12)CO, SO2N(R12), N(R12)SO2, CH=CH и С С, где R12 представляет собой водород или (1-6С)алкил, С, где R12 представляет собой водород или (1-6С)алкил,
и где любая группа СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 один или несколько галогеновых или (1-6С)алкильных заместителей и заместитель, представляющий собой гидрокси, циано, амино, карбокси, карбамоил, (1-6С)алкокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6C)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил(2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6С)алкил-(1-6C)алкансульфониламино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, S, SO, SO2, N(R14), CO, CH(OR14), CON(R14), N(R14)CO, SO2N(R14), N(R14)SO2, C(R14)2O, C(R14)2S или N(R14)C(R14)2, где R14 представляет собой водород или (1-6C)алкил, a Q8 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6C)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая гетероциклильная группа в группе Q1-Z-необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6C)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6С)алкилтио, (1-6C)алкилсульфинил, (1-6C)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6C)алкил]амино, (1-6C)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил-(2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6С)алкил]сульфамоил, (1-6С)алкансульфониламино или N-(1-6С)алкил-(1-6С)алкансульфониламино, или группу формулы
-Х8-R15,
где X8 представляет собой прямую связь или О или N (R16), где R16 представляет собой водород или (1-6С)алкил, а R15 представляет собой галоген-(1-6С)алкил, гидрокси-(1-6С)алкил, (1-6С)алкокси-(1-6С)алкил, циано-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил или ди-[(1-6С)алкил]амино-(1-6С)алкил, или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О, СО или N(R17), где R17 представляет собой водород или (1-6С)алкил, a Q9 представляет собой арил, арил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, выбранные из галогена, (1-6С)алкила и (1-6С)алкокси, и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксо- или тиоксозаместителя.
В соответствии со следующим аспектом настоящее изобретение относится к хиназолиновому производному формулы I

где m представляет собой 0, 1, 2 или 3;
каждая группа R1, которая может быть одинаковой или различной, представляет собой галоген, трифторметил, циано, изоциано, нитро, гидрокси, меркапто, амино, формил, карбокси, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6C)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил-(2-6С)алканоиламино, (3-6С)алкеноиламино, N-(1-6С)алкил(3-6С)алкеноиламино, (3-6С)алкиноиламино, N-(1-6С)алкил-(3-6С)алкиноиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6С)алкил-(1-6C)алкансульфониламино, или группу формулы
Q3-X1-,
где X1 представляет собой прямую связь или О, S, SO, SO2, N(R4), CO, CH(OR4), CON(R4), N(R4)CO, SO2N(R4), N(R4)SO2, OC(R4)2, SC(R4)2 или N(R4)C(R4)2, где R4 представляет собой водород или (1-6C)алкил, a Q3 представляет собой арил, арил-(1-6C)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил(1-6C)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6C)алкил, гетероарил, гетероарил(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил, или (R1)m представляет собой (1-3С)алкилендиокси,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем встраивания в цепь группы, выбранной из О, S, SO, SO2, N(R5), CO, CH(OR5), CON(R5), N(R5)СО, SON(R5), N(R5)SO2, СН=СН и С С, где R5 представляет собой водород или (1-6С)алкил, С, где R5 представляет собой водород или (1-6С)алкил,
и где любая из групп СН2=СН- или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой галоген, карбокси, карбамоил, (1-6С)алкоксикарбонил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил и ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы заместитель, представляющий собой галоген, карбокси, карбамоил, (1-6С)алкоксикарбонил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил и ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы
Q4-X2-,
где X2 представляет собой прямую связь или СО или N(R6)СО, где R6 представляет собой водород или (1-6С)алкил, a Q4 представляет собой арил, арил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 один или несколько галогеновых или (1-6С)алкильных заместителей или заместитель, представляющий собой гидрокси, циано, амино, карбокси, карбамоил, (1-6С)алкокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил(2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6С)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6С)алкил-(1-6С)алкансульфониламино, или группу формулы
-Х3-Q5,
где X3 представляет собой прямую связь или О, S, SO, SO2, N(R7), CO, CH(OR7), CON(R7), N(R7)CO, SO2N(R7), N(R7)SO2, C(R7)2O, C(R7)2S и N(R7)С(R7)2, где R7 представляет собой водород или (1-6С)алкил, a Q5 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6С)алкил, гетероарил, гетероарил(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая арильная, гетероарильная или гетероциклильная группа в заместителе R1 необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, N-(1-6С)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6С)алкансульфониламино и N-(1-6C)алкил(1-6С)алкансульфониламино, или группу формулы
-Х4-R8,
где X4 представляет собой прямую связь или О или N(R9), где R9 представляет собой водород или (1-6С)алкил, a R8 представляет собой галоген-(1-6С)алкил, гидрокси-(1-6С)алкил, (1-6С)алкокси-(1-6С)алкил, циано-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил, ди-[(1-6С)алкил]амино-(1-6С)алкил, (2-6С)алканоиламино-(1-6С)алкил или (1-6С)алкоксикарбониламино-(1-6С)алкил, или группу формулы
-X5-Q6,
где X5 представляет собой прямую связь или О или N(R10), где R10 представляет собой водород или (1-6С)алкил, a Q6 представляет собой арил, арил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, (1-6С)алкил и (1-6С)алкокси,
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксо- или тиоксозаместителя;
R2 представляет собой водород или (1-6С)алкил;
R3 представляет собой водород или (1-6С)алкил;
Z представляет собой прямую связь или О, S, SO, SO2, N(R11), CO, CH(OR11), CON(R11), N(R11)CO, SO2N(R11), N(R11)SO2, OC(R11)2, SC(R11)2 или N(R11)C(R11)2, где R11 представляет собой водород или (1-6С)алкил;
Q1 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, или, когда Z представляет собой прямую связь или О, Q1 может представлять собой (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, галоген-(1-6С)алкил, гидрокси-(1-6С)алкил, (1-6C)алкокси-(1-6С)алкил, циано-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил, ди-[(1-6С)алкил]амино-(1-6С)алкил, (1-6С)алкилтио-(1-6С)алкил, (1-6С)алкилсульфинил-(1-6С)алкил или (1-6С)алкилсульфонил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z-необязательно разделены путем встраивания в цепь группы, выбранной из О, S, SO, SO2, N(R12), CO, CH(OR12), CON(R12), N(R12)CO, SO2N(R12), N(R12)SO2, CH=CH и С С, где R12 представляет собой водород или (1-6С)алкил, С, где R12 представляет собой водород или (1-6С)алкил,
и где любая из групп СН2=СН- или НС С- в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС С- в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой галоген, карбокси, карбамоил, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, амино-(1-6C)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6C)алкил]амино-(1-6С)алкил, или группу формулы заместитель, представляющий собой галоген, карбокси, карбамоил, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, амино-(1-6C)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6C)алкил]амино-(1-6С)алкил, или группу формулы
Q7-X6-,
где X6 представляет собой прямую связь или СО или N(R13)CO, где R13 представляет собой водород или (1-6C) алкил, а Q7 представляет собой арил, арил-(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СНз один или несколько галогеновых или (1-6С)алкильных заместителей или заместитель, представляющий собой гидрокси, циано, амино, карбокси, карбамоил, (1-6C)алкокси, (1-6С)алкилтио, (1-6C)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил (2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6C)алкансульфониламино и N-(1-6С)алкил-(1-6C)алкансульфониламино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, S, SO, SO2, N(R14), CO, CH(OR14), CON(R14), N(R14)CO, SO2N(R14), N(R14)SO2, C(R14)2O, C(R14)2S или N(R14)C(R14)2, где R14 представляет собой водород или (1-6C)алкил, a Q8 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6C)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая арильная, гетероарильная или гетероциклильная группа в группе Q1-Z-необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6C)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6C)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6C)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил-(2-6С)алканоиламино, N-(1-6С)алкилсульфамоил, N,N-ди-[(1-6С)алкил]сульфамоил, (1-6С)алкансульфониламино или N-(1-6C)алкил(1-6С)алкансульфониламино, или группу формулы
-X8-R15,
где X8 представляет собой прямую связь или О или N(R16), где R16 представляет собой водород или (1-6C)алкил, a R15 представляет собой галоген-(1-6C)алкил, гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6C)алкил, циано-(1-6C)алкил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6C)алкил, или группу формулы
-Х9-Q9,
где Х9 представляет собой прямую связь или О или N(R17), где R17 представляет собой водород или (1-6C)алкил, a Q9 представляет собой арил, арил-(1-6C)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, выбранные из галогена, (1-6С)алкила и (1-6C)алкокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксо- или тиоксозаместителя и Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6C)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, (3-6С)алкеноиламино, N-(1-6C)алкил(3-6С)алкеноиламино, (3-6С)алкиноиламино, N-(1-6C)алкил-(3-6С)алкиноиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6C)алкил-(1-6С)алкансульфониламино, или группу формулы
-X10-R18,
где X10 представляет собой прямую связь или О или N(R19), где R19 представляет собой водород или (1-6C)алкил, a R18 представляет собой галоген-(1-6C)алкил, гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6C)алкил, циано-(1-6C)алкил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6C)алкил, или группу формулы
-X11-Q10,
где X11 представляет собой прямую связь или О, S, SO, SO2, N(R20), CO, CH(OR20), CON(R20), N(R20)CO, SO2N(R20), N(R20)SO2, C(R20)2O, C(R20)2S и N(R20)C(R20)2, где R20 представляет собой водород или (1-6С)алкил, a Q10 представляет собой арил, арил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, выбранные из галогена, (1-6С)алкила и (1-6С)алкокси, и любая гетероциклильная группа в Q10 необязательно содержит 1 или 2 оксо- или тиоксозаместителя,
и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, галоген, трифторметил, циано, нитро, гидрокси, амино, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (1-6С)алкиламино и ди-[(1-6С)алкил]амино, или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -N=CH-CH=CH-, -CH=N-CH=CH-, -CH=CH-N=CH-, -CH=CH-CH=N-, -N=CH-N=CH-, -CH=N-CH=N-, -N=CH-CH=N-, -N=N-CH=CH-, -CH=CH-N=N-, -CH=CH-O-, -O-CH=CH-, -CH=CH-S-, -S-CH=CH-, CH2-CH2-O-, -O-CH2-CH2-, -CH2-CH2-S-, -S-CH2-CH2-, -O-CH2-O-, -O-CH2-CH2-O-, -S-CH2-S-S, -S-CH2-CH2-S-, -CH=CH-NH, -NH-CH=CH-, -CH2-CH2-NH-, -NH-CH2-CH2-, -N=CH-NH-, -NH-CH=N-, -NH-CH2-NH-, -O-CH=N-, -N=CH-O-, -S-CH=N-, -N=CH-S-, -O-CH2-NH-, -NH-CH2-O-, -S-CH2-NH-, -NH-CH2-S-, -O-N=CH-, -CH=N-O-, -S-N=CH-, -CH=N-S-, -O-NH-CH2-, -CH2-NH-O-, -S-NH-СН2-, -CH2-NH-S-, -NH-N=CH-, -CH=N-NH-, -NH-NH-CH2-, -CH2-NH-NH-, -N=N-NH- или -NH-N=N-,
или G1 принимает одно из значений, определенных выше, a G2 и G3 вместе или G3 и G4 вместе образуют группу формулы -СН=СН-СН=СН-, -N=CH-CH=CH-, -CH=N-CH=CH-, -CH=CH-N=CH-, -CH=CH-CH=N-, -N=CH-N=CH-, -CH=N-CH=N-, -N=CH-CH=N-, -N=N-CH=CH-, -CH=CH-N=N-, -CH=CH-O-, -O-CH=CH, -CH=CH-S, -S-CH=CH-, -CH2-CH2-O-, -O-CH2-CH2-, -CH2-CH2-S-, -S-CH2-CH2-, -O-CH2-O-, -O-CH2-CH2-O-, -S-CH2-S-, -S-CH2-CH2-S-, -CH=CH-NH-, NH-CH=CH-, -CH2-CH2-NH-, -NH-CH2-CH2-, -N=CH-NH-, -NH-CH=N-, -NH-CH2-NH-, -O-CH=N-, -N=CH-O-, -S-CH=N-, -N=CH-S-, -O-CH2-NH-, -NH-CH2-O-, -S-CH2-NH-, -NH-CH2-S-, -O-N=CH-, -CH=N-O-, -S-N=CH-, -CH=N-S-, -O-NH-CH2-, -CH2-NH-O-, -S-NH-CH2-, -CH2-NH-S-, -NH-N=CH-, -CH=N-NH-, -NH-NH-CH2-, -CH2-NH-NH-, -N=N-NH- или -NH-N=N-,
и 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо, образованное путем соединения вместе G1 и G2, вместе G2 и G3 или вместе G3 и G4, необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (1-6С)алкиламино и ди-[(1-6С)алкил]амино, и любое образованное таким образом бициклическое гетероциклическое кольцо необязательно содержит 1 или 2 оксо- или тиоксогруппы,
или к его фармацевтически приемлемой соли.
В соответствии со следующим аспектом настоящее изобретение относится к хиназолиновому производному формулы I, где каждый из m, R1, R2, R3 и Q2 принимает любое из значений, определенных выше, и
Z представляет собой прямую связь или О, S, SO, SO2, N(R11), CO, CH(OR11), CON(R11), N(R11)CO, SO2N(R11), N(R11)SO2, OC(R11)2, SC(R11)2 или N(R11)C(R11)2, где R11 представляет собой водород или (1-6С)алкил; и
Q1 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z-необязательно разделены путем встраивания в цепь группы, выбранной из О, S, SO, SO2, N(R12), CO, CH(OR12), CON(R12), N(R12)CO, SO2N(R12), N(R12)SO2, CH=CH и С С, где R12 представляет собой водород или (1-6С)алкил, С, где R12 представляет собой водород или (1-6С)алкил,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 один или несколько галогеновых или (1-6С)алкильных заместителей или заместитель, представляющий собой гидрокси, циано, амино, карбокси, карбамоил, (1-6С)алкокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С) алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил(2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6С)алкил]сульфамоил, (1-6С)алкансульфониламино или N-(1-6C)алкил-(1-6C)алкансульфониламино, или группу формулы
-X7-Q8,
где Х7 представляет собой прямую связь или О, S, SO, SO2, N(R14), CO, CH(OR14), CON(R14), N(R14)CO, SO2N(R14), N(R14)SO2, C(R14)2O, C(R14)2S или N(R14)C(R14), где R14 представляет собой водород или (1-6С)алкил, a Q8 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая арильная, гетероарильная или гетероциклильная группа в группе Q1-Z- необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, N-(1-6С)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6С)алкансульфониламино или N-(1-6C)алкил(1-6С)алкансульфониламино, или группу формулы
-Х8-R15,
где X8 представляет собой прямую связь или О или N(R16), где R16 представляет собой водород или (1-6С)алкил, a R15 представляет собой галоген-(1-6С)алкил, гидрокси-(1-6С)алкил, (1-6С)алкокси-(1-6С)алкил, циано-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил или ди-[(1-6С)алкил]амино-(1-6С)алкил, или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О или N(R17), где R17 представляет собой водород или (1-6С)алкил, a Q9 представляет собой арил, арил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, выбранных из галогена, (1-6С)алкила и (1-6С)алкокси, и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксо- или тиоксозаместителя.
В соответствии со следующим аспектом настоящее изобретение относится к хиназолиновому производному формулы I, где каждый из m, R1, R2, R3 и Q2 принимает любое из значений, определенных выше, и
Z представляет собой О, S, SO, SO2, N(R11), CO, CH(OR11), CON(R11), N(R11)CO, SO2N(R11), N(R11)SO2, OC(R11)2, SC(R11)2 или N(R11)C(R11)2, где R11 представляет собой водород или (1-6С)алкил, и
Q1 представляет собой (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6С)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z- необязательно разделены путем встраивания в цепь группы, выбранной из О, S, SO, SO2, N(R12), CO, CH(OR12), CON(R12), N(R12)СО, SO2N(R12), N(R12)SO2, CH=CH и C C, где R12 представляет собой водород или (1-6С)алкил, C, где R12 представляет собой водород или (1-6С)алкил,
и где любая из групп CH2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 один или несколько галогеновых или (1-6С)алкильных заместителей или заместитель, представляющий собой гидрокси, циано, амино, карбокси, карбамоил, (1-6С)алкокси, (1-6C) алкилтио, (1-6C)алкилсульфинил, (1-6С)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил(2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6С)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6C)алкил-(1-6C)алкансульфониламино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, S, SO, SO2, N(R14), CO, CH(OR14), CON(R14), N(R14)СО, SO2N(R14), N(R14)SO2, C(R14)2O, C(R14)2S или N(R14)C(R14)2, где R14 представляет собой водород или (1-6C)алкил, a Q8 представляет собой арил, арил-(1-6C)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6C)алкил, (3-7С)циклоалкенил, (3-7С)циклоалкенил-(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6 С)алкил,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, нитро, гидрокси, амино, карбокси, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-6С)алкенилокси, (2-6С)алкинилокси, (1-6С)алкилтио, (1-6С)алкилсульфинил, (1-6C)алкилсульфонил, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, (1-6С)алкоксикарбонил, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоил, (2-6С)алканоилокси, (2-6С)алканоиламино, N-(1-6С)алкил-(2-6С)алканоиламино, N-(1-6C)алкилсульфамоил, N,N-ди-[(1-6C)алкил]сульфамоил, (1-6C)алкансульфониламино или N-(1-6С)алкил-(1-6C)алкансульфониламино, или группу формулы
-Х8-R15,
где X8 представляет собой прямую связь или О или N(R16), где R16 представляет собой водород или (1-6C)алкил, a R15 представляет собой галоген-(1-6C)алкил, гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6C)алкил, циано-(1-6C)алкил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6C)алкил, или группу формулы
-X9-Q9,
где X9 представляет собой прямую связь или О или N(R17), где R17 представляет собой водород или (1-6C)алкил, a Q9 представляет собой арил, арил-(1-6C)алкил, гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, (1-6С)алкил и (1-6С) алкокси,
и где любая гетероциклильная группа в группе Q1-Z-необязательно содержит 1 или 2 оксо- или тиоксозаместителя.
Для целей данного описания родовой термин “алкил” включает в себя как неразветвленные, так и разветвленные алкильные группы, такие как пропил, изопропил и трет-бутил, и (3-7С)циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Однако ссылки на отдельные алкильные группы, такие как “пропил”, относятся конкретно к неразветвленной разновидности, ссылки на отдельные разветвленные алкильные группы, такие как “изопропил”, относятся конкретно только к разветвленной разновидности, а ссылки на отдельные циклоалкильные группы, такие как “циклопентил”, конкретно относятся только к 5-членному кольцу. Аналогичные условные обозначения применимы и к другим родовым терминам, например, (1-6С)алкокси включает в себя метокси, этокси, циклопропилокси и циклопентилокси, (1-6С)алкиламино включает в себя метиламино, этиламино, циклобутиламино и циклогексиламино, и ди-[(1-6Салкил]амино включает в себя диметиламино, диэтиламино, N-циклобутил-N-метиламино и N-циклогексил-N-этиламино.
Следует учесть, что поскольку определенные соединения формулы I, определенные выше, могут существовать в оптически активной или рацемической формах благодаря присутствию одного или нескольких асимметрических атомов углерода, настоящее изобретение включает в свой объем любую такую оптически активную или рацемическую форму, которая обладает обсуждавшейся выше активностью. Синтез оптически активных форм может быть осуществлен в соответствии со стандартными методиками из области органической химии, хорошо известными в данной области, например путем синтеза из оптически активных исходных веществ или путем разделения рацемической формы. Аналогично обсуждавшаяся выше активность может быть оценена в соответствии со стандартными лабораторными методиками, описанными ниже.
Подходящие значения для родовых радикалов, упомянутых выше, включают в себя приведенные ниже.
Подходящее значение для любой из групп ‘Q’ (Q1, Q3-Q10), когда она представляет собой арил, или арильная группа в группе ‘Q’ представляет собой, например, фенил или нафтил, предпочтительно фенил.
Подходящее значение для любой из групп ‘Q’ (Q1, Q3-Q10), когда она представляет собой (3-7С)циклоалкил, или (3-7С)циклоалкильная группа в группе ‘Q’ представляет собой, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или бицикло[2.2.1]гептил, а подходящее значение для любой из групп ‘Q’ (Q1, Q3-Q8), когда она представляет собой (3-7С)циклоалкенил, или (3-7С)циклоалкенильная группа в группе ‘Q’ представляет собой, например, циклобутенил, циклопентенил, циклогексенил или циклогептенил.
Подходящее значение для любой из групп ‘Q’ (Q1, Q3-Q10), когда она представляет собой гетероарил, или гетероарильная группа в группе ‘Q’ представляет собой, например, ароматическое 5- или 6-членное моноциклическое кольцо или 9- или 10-членное бициклическое кольцо, содержащее до пяти гетероатомов в цикле, выбранных из кислорода, азота и серы, например фурил, пирролил, тиенил, оксазолил, изоксазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, 1,3,5-триазенил, бензофуранил, индолил, бензотиенил, бензоксазолил, бензимидазолил, бензотиазолил, индазолил, бензофуразанил, хинолил, изохинолил, хиназолинил, хиноксалинил, циннолинил или нафтиридинил.
Подходящее значение для любой из групп ‘Q’ (Q1, Q3-О10), когда она представляет собой гетероциклил, или гетероциклильная группа в группе ‘Q’ представляет собой, например, неароматическое насыщенное или частично насыщенное 3-10-членное моноциклическое или бициклическое кольцо, содержащее до пяти гетероатомов в цикле, выбранных из кислорода, азота и серы, например, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, оксепанил, пирролинил, пирролидинил, морфолинил, тетрагидро-1,4-тиазинил, 1,1-диоксотетрагидро-1,4-тиазинил, пиперидинил, гомопиперидинил, пиперазинил, гомопиперазинил, дигидропиридинил, тетрагидропиридинил, дигидропиримидинил или тетрагидропиримидинил, предпочтительно тетрагидрофуранил, тетрагидропиранил, пирролидинил, морфолинил, 1,1-диоксотетрагидро-4Н-1,4-тиазинил, пиперидинил или пиперазинил, более предпочтительно тетрагидрофуран-3-ил, тетрагидропиран-4-ил, пирролидин-3-ил, морфолино, 1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил, пиперидино, пиперидин-4-ил или пиперазин-1-ил. Походящее значение для такой группы, которая содержит 1 или 2 оксо- или тиоксозаместителя, представляет собой, например, 2-оксопирролидинил, 2-тиоксопирролидинил, 2-оксоимидазолидинил, 2-тиоксоимидазолидинил, 2-оксопиперидинил, 2,5-диоксопирролидинил, 2,5-диоксоимидазолидинил или 2,6-диоксопиперидинил.
Подходящее значение для группы ‘Q’, когда она представляет собой гетероарил-(1-6С)алкил, например, представляет собой гетероарилметил, 2-гетероарилэтил и 3-гетероарилпропил. Настоящее изобретение охватывает соответствующие подходящие значения для групп ‘Q’, когда, например, вместо гетероарил-(1-6С)алкильной группы, присутствует арил-(1-6С)алкильная, (3-7С)циклоалкил-(1-6С)алкильная, (3-7С)циклоалкенил-(1-6С)алкильная или гетероциклил-(1-6С)алкильная группа.
Подходящие значения для любых групп ‘R’ (R1-R20) или для различных групп в заместителе R1 или для G1 или для различных групп в G1 или для любых групп ‘G’ (G2-G5) в Q2 или для различных групп в Q2 или для Q1 или для различных групп в Q1 или для различных групп в группе Q1-Z-включают в себя следующие:
для галогена: фтор, хлор, бром и иод;
для (1-6С)алкила: метил, этил, пропил, изопропил и трет-бутил;
для (2-8С)алкенила: винил, изопропенил, аллил и бут-2-енил;
для (2-8С)алкинила: этинил, 2-пропинил и бут-2-инил;
для (1-6С)алкокси: метокси, этокси, пропокси, изопропокси и бутокси;
для (2-6С)алкенилокси: винилокси и аллилокси;
для (2-6С)алкинилокси: этинилокси и 2-пропинилокси;
для (1-6С)алкилтио: метилтио, этилтио и пропилтио;
для (1-6С)алкилсульфинила: метилсульфинил и этилсульфинил;
для (1-6С)алкилсульфонила: метилсульфонил и этилсульфонил;
для (1-6С)алкиламино: метиламино, этиламино, пропиламино, изопропиламино и бутиламино;
для ди-[(1-6С)алкил]амино: диметиламино, диэтиламино, N-этил-N-метиламино и диизопропиламино;
для (1-6С)алкоксикарбонила: метоксикарбонил, этоксикарбонил, пропоксикарбонил и трет-бутоксикарбонил;
для N-(1-6C)алкилкарбамоила: N-метилкарбамоил, N-этилкарбамоил и N-пропилкарбамоил;
для N,N-ди-[(1-6C)алкил]карбамоила: N,N-диметилкарбамоил, N-этил-N-метилкарбамоил и N,N-диэтилкарбамоил;
для (2-6С)алканоила: ацетил и пропионил;
для (2-6С)алканоилокси: ацетокси и пропионилокси;
для (2-6С)алканоиламино: ацетамидо и пропионамидо;
для N-(1-6C)алкил-(2-6С)алканоиламино: N-метилацетамидо и N-метилпропионамидо;
для N-(1-6C)алкилсульфамоил: N-метилсульфамоил и N-этилсульфамоил;
для N,N-ди-[(1-6C)алкил]сульфамоила: N,N-диметилсульфамоил;
для (1-6C)алкансульфониламино: метансульфониламино и этансульфониламино;
для N-(1-6C)алкил-(1-6C)алкансульфониламино: N-метилметансульфониламино и N-метилэтансульфониламино;
для (3-6С)алкеноиламино: акриламидо, метакриламидо и кротонамидо;
для N-(1-6C)алкил-(3-6С)алкеноиламино: N-метилакриламидо и N-метилкротонамидо;
для (3-6С)алкиноиламино: пропиоламидо;
для N-(1-6C)алкил-(3-6С)алкиноиламино: N-метилпропиоламидо;
для амино-(1-6C)алкила: аминометил, 2-аминоэтил, 1-аминоэтил и 3-аминопропил;
для (1-6C)алкиламино-(1-6C)алкила: метиламинометил, этиламинометил, 1-метиламиноэтил, 2-метиламиноэтил, 2-этиламиноэтил и 3-метиламинопропил;
для ди-[(1-6C)алкил]амино-(1-6C)алкила: диметиламинометил, диэтиламинометил, 1-диметиламиноэтил, 2-диметиламиноэтил и 3-диметиламинопропил;
для галоген-(1-6С)алкила: хлорметил, 2-хлорэтил, 1-хлорэтил и 3-хлорпропил;
для гидрокси-(1-6С)алкила: гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил и 3-гидроксипропил;
для (1-6С)алкокси-(1-6С)алкила: метоксиметил, этоксиметил, 1-метоксиэтил, 2-метоксиэтил, 2-этоксиэтил и 3-метоксипропил;
для циано-(1-6С)алкила: цианометил,-2-цианоэтил, 1-цианоэтил и 3-цианопропил;
для (1-6С)алкилтио-(1-6С)алкила: метилтиометил, этилтиометил, 2-метилтиоэтил, 1-метилтиоэтил и 3-метилтиопропил;
для (1-6С)алкилсульфинил-(1-6С)алкила: метилсульфинилметил, этилсульфинилметил, 2-метилсульфинилэтил, 1-метилсульфинилэтил и 3-метилсульфинилпропил;
для (1-6С)алкилсульфонил-(1-6С)алкила: метилсульфонилметил, этилсульфонилметил, 2-метилсульфонилэтил, 1-метилсульфонилэтил и 3-метилсульфонилпропил;
для (2-6С)алканоиламино-(1-6С)алкила: ацетамидометил, пропионамидометил и 2-ацетамидоэтил и
для (1-6С)алкоксикарбониламино-(1-6С)алкила: метоксикарбониламинометил, этоксикарбониламинометил, трет-бутоксикарбониламинометил и 2-метоксикарбониламиноэтил.
Подходящим значением (R1)m, когда он представляет собой (1-3С)алкилендиоксигруппу, является, например, метилендиокси или этилендиокси, а их атомы кислорода занимают два соседних положения в цикле.
Когда, как определено выше, группа R1 образует группу формулы Q3-Х1-, и, например, X1 представляет собой связующую группу ОС(R4)2, атом углерода, а не атом кислорода связующей группы OC(R4)2 присоединен к хиназолиновому кольцу, а атом кислорода присоединен к группе Q3. Аналогично, когда, например, группа СН3 в заместителе R1 содержит группу формулы -Х3-Q5 и, например, X3 представляет собой связующую группу C(R7)2O, она представляет собой атом углерода, а не атом кислорода связующей группы C(R7)2O, которая присоединена к группе СН3, а атом кислорода присоединен к группе Q5. Такое же правило применимо к присоединению групп формул Q4-X2– и -Х7-Q7.
Как определено выше, соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 могут быть необязательно разделены путем встраивания в цепь группы, такой как О, CON(R5) или С С. Например, встраивание группы С С. Например, встраивание группы С С в этиленовую цепь в 2-морфолиноэтоксигруппе дает 4-морфолинобут-2-инилоксигруппу, а, например, встраивание группы CONH в этиленовую цепь в 3-метоксипропоксигруппе дает, например, 2-(2-метоксиацетамидо)этоксигруппу. С в этиленовую цепь в 2-морфолиноэтоксигруппе дает 4-морфолинобут-2-инилоксигруппу, а, например, встраивание группы CONH в этиленовую цепь в 3-метоксипропоксигруппе дает, например, 2-(2-метоксиацетамидо)этоксигруппу.
Когда, как определено выше, любая из групп СН2=СН- или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС заместитель, такой как группа формулы Q4-Х2-, где X2 представляет собой, например, NHCO, а Q4 представляет собой гетероциклил-(1-6С)алкильную группу, подходящие образовавшиеся таким образом заместители R1 включают в себя, например, N-[гетероциклил(1-6С)алкил]карбамоилвинильные группы, такие как N-(2-пирролидин-1-илэтил)карбамоилвинил, или N-[гетероциклил-(1-6С)алкил]карбамоилэтинильные группы, такие как N-(2-пирролидин-1-илэтил)карбамоилэтинил. заместитель, такой как группа формулы Q4-Х2-, где X2 представляет собой, например, NHCO, а Q4 представляет собой гетероциклил-(1-6С)алкильную группу, подходящие образовавшиеся таким образом заместители R1 включают в себя, например, N-[гетероциклил(1-6С)алкил]карбамоилвинильные группы, такие как N-(2-пирролидин-1-илэтил)карбамоилвинил, или N-[гетероциклил-(1-6С)алкил]карбамоилэтинильные группы, такие как N-(2-пирролидин-1-илэтил)карбамоилэтинил.
Когда, как определено выше, любая из групп CH2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 один или несколько галогеновых или (1-6С)алкильных заместителей, на каждой указанной группе СН2 надлежаще присутствуют 1 или 2 галогеновых или (1-6С)алкильных заместителей, а на каждой указанной группе СН3 надлежаще присутствуют 1, 2 или 3 таких заместителя.
Когда, как определено выше, любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, определенный выше, подходящие полученные таким образом заместители R1 включают в себя, например, гидроксизамещенные гетероциклил(1-6С)алкоксигруппы, такие как 2-гидрокси-3-пиперидинопропокси и 2-гидрокси-3-морфолинопропокси, гидроксизамещенные амино-(2-6С)алкоксигруппы, такие как 3-амино-2-гидроксипропокси, гидроксизамещенные (1-6С)алкиламино-(2-6С)алкоксигруппы, такие как 2-гидрокси-3-метиламинопропокси, гидроксизамещенные ди-[(1-6С)алкил]амино-(2-6С)алкоксигруппы, такие как 3-диметиламино-2-гидроксипропокси, гидроксизамещенные гетероциклил(1-6С)алкиламиногруппы, такие как 2-гидрокси-3-пиперидинопропиламино и 2-гидрокси-3-морфолинопропиламино, гидроксизамещенные амино-(2-6С)алкиламиногруппы, такие как 3-амино-2-гидроксипропиламино, гидроксизамещенные (1-6С)алкиламино-(2-6С)алкиламиногруппы, такие как 2-гидрокси-3-метиламинопропиламино, гидроксизамещенные ди-[(1-6С)алкил]амино-(2-6С)алкиламиногруппы, такие как 3-диметиламино-2-гидроксипропиламино, гидроксизамещенные (1-6С)алкоксигруппы, такие как 2-гидроксиэтокси, (1-6С)алкоксизамещенные (1-6С)алкоксигруппы, такие как 2-метоксиэтокси и 3-этоксипропокси, (1-6С)алкилсульфонилзамещенные (1-6С)алкокси-группы, такие как 2-метилсульфонилэтокси и гетероциклилзамещенные (1-6С)алкиламино-(1-6С)алкильные группы, такие как 2-морфолиноэтиламинометил, 2-пиперазин-1-илэтиламинометил и 3-морфолинопропиламинометил.
Аналогичные соображения применимы к присоединениям и замещениям в группе -Z-Q1.
Когда, как определено выше, G1 и G2 вместе образуют, например, группу формулы -O-СН=СН-, атом кислорода, а не атом углерода присоединен к орто-положению фенильного кольца формулы Ia, а атом углерода присоединен к соседнему мета-положению фенильного кольца формулы Ia. Аналогично, когда, например, G2 и G3 вместе образуют, например, группу формулы -CH=CH-CH=N-, атом углерода, а не атом азота присоединен к мета-положению G2 фенильного кольца формулы Ia, а атом азота присоединен к соседнему пара-положению G3 фенильного кольца формулы Ia. Аналогичное правило применимо к присоединению групп, когда, например, объединены G3 и G4.
Подходящая фармацевтически приемлемая соль соединения формулы I, например, представляет собой кислотно-аддитивную соль соединения формулы I, например кислотно-аддитивную соль неорганической или органической кислоты, такой как хлористоводородная, бромистоводородная, серная, трифторуксусная, лимонная или малеиновая кислота; или, например, соль соединения формулы I, которая является достаточно кислой, например соль щелочного или щелочноземельного металла, такую как соль кальция или магния, или соль аммония, или соль органического основания, такого как метиламин, диметиламин, триметиламин, пиперидин, морфолин или трис-(2-гидроксиэтил)амин.
Конкретные новые соединения по настоящему изобретению включают в себя, например, хиназолиновые производные формулы I или их фармацевтически приемлемые соли, где, если не оговорено особо, каждый из m, R1, R2, R3, Z, Q1 и Q2 принимает любое из значений, определенных выше или в абзацах (а)-(ее) далее:
(а) m представляет собой 1 или 2, и каждая группа R1, которая может быть одинаковой или различной, представляет собой галоген, трифторметил, гидрокси, амино, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (1-6С)алкиламино, ди-[(1-6С)алкил]амино, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, (3-6С)алкеноиламино, N-(1-6С)алкил(3-6С)алкеноиламино, (3-6С)алкиноиламино или N-(1-6С)алкил-(3-6С)алкиноиламино, или группу формулы
Q3-X1-,
где X1 представляет собой прямую связь или О, N(R4), CON(R4), N(R4)CO или OC(R4)2, где R4 представляет собой водород или (1-6С)алкил, a Q3 представляет собой арил, арил-(1-6С)алкил, циклоалкил(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем встраивания в цепь группы, выбранной из О, N(R5), CON(R5), N(R5)CO, CH=CH и С С, где R5 представляет собой водород или (1-6С)алкил, С, где R5 представляет собой водород или (1-6С)алкил,
и где любая из групп СН2=СН- или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил или ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы: заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил или ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы:
Q4-X2-,
где X2 представляет собой прямую связь или представляет собой СО или N(R6)CO, где R6 представляет собой водород или (1-6С)алкил, а Q4 представляет собой гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СНз заместитель, представляющий собой гидрокси, амино, (1-6С)алкокси, (1-6С)алкилсульфонил, (1-6С)алкиламино или ди-[(1-6С)алкил]амино, или группу формулы
-Х3-Q5,
где X3 представляет собой прямую связь или О, N(R7), CON(R7), N(R7)CO или C(R7)2O, где R7 представляет собой водород или (1-6C)алкил, a Q5 представляет собой гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая арильная, гетероарильная или гетероциклильная группа в заместителе R1 необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, предсталяющих собой галоген, трифторметил, гидрокси, амино, карбамоил, (1-6С)алкил, (1-6С)алкокси, N-(1-6C)алкилкарбамоил и N,N-ди-[(1-6C)алкил]карбамоил, или необязательно содержит 1 заместитель, выбранный из группы формулы
-X4-R8,
где X4 представляет собой прямую связь или О или N(R9), где R9 представляет собой водород или (1-6C)алкил, а R8 представляет собой гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6С)алкил, амино-(1-6C)алкил, (1-6C)алкиламино-(1-6C)алкил, ди-[(1-6C)алкил]амино-(1-6C)алкил, (2 -6С)алканоиламино(1-6C)алкил или (1-6C)алкоксикарбониламино-(1-6C)алкил, или группу формулы
-X5-Q6,
где X5 представляет собой прямую связь или О или N(R10), где R10 представляет собой водород или (1-6C)алкил, а Q6 представляет собой гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, (1-6С)алкил или (1-6С)алкокси,
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксозаместителя;
(b) m представляет собой 1 или 2, и каждая группа R1, которая может быть одинаковой или различной, представляет собой фтор, хлор, трифторметил, гидрокси, амино, карбамоил, метил, этил, пропил, винил, этинил, метокси, этокси, пропокси, метиламино, этиламино, пропиламино, диметиламино, диэтиламино, дипропиламино, N-метилкарбамоил, N,N-диметилкарбамоил, ацетамидо, пропионамидо, акриламидо и пропиоламидо, или группу формулы
Q3-X1,
где X1 представляет собой прямую связь или О, NH, CONH, NHCO или ОСН2, a Q3 представляет собой фенил, бензил, циклопропилметил, 2-тиенил, 1-имидазолил, 1,2,3-триазол-1-ил, 2-, 3- или 4-пиридил, 2-имидазол-1-илэтил, 3-имидазол-1-илпропил, 2-(1,2,3-триазолил)этил, 3-(1,2,3-триазолил)пропил, 2-, 3- или 4-пиридилметил, 2-(2-, 3- или 4-пиридил)этил, 3-(2-, 3- или 4-пиридил)пропил, 1-, 2-или 3-пирролидинил, морфолино, 1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил, пиперидино, пиперидин-3-ил, пиперидин-4-ил, 1-, 3- или 4-гомопиперидинил, пиперазин-1-ил, гомопиперазин-1-ил, 1-, 2- или 3-пирролидинилметил, морфолинометил, пиперидинометил, 3- или 4-пиперидинилметил, 1-, 3- или 4-гомопиперидинилметил, 2-пирролидин-1-илэтил, 3-пирролидин-2-илпропил, пирролидин-2-илметил, 2-пирролидин-2-илэтил, 3-пирролидин-1-илпропил, 2-морфолиноэтил, 3-морфолинопропил, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этил, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропил, 2-пиперидиноэтил, 3-пиперидинопропил, 2-пиперидин-3-илэтил, 2-пиперидин-4-илэтил, 2-гомопиперидин-1-илэтил, 3-гомопиперидин-1-илпропил, 2-пиперазин-1-илэтил, 3-пиперазин-1-илпропил, 2-гомопиперазин-1-илэтил или 3-гомопиперазин-1-илпропил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, CONH, NHCO, СН=СН и С С, С,
и где любая из групп CH2=CH- или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой карбамоил, N-метилкарбамоил, N-этилкарбамоил, N-пропилкарбамоил, N,N-диметилкарбамоил, аминометил, 2-аминоэтил, 3-аминопропил, 4-аминобутил, метиламинометил, 2-метиламиноэтил, 3-метиламинопропил, 4-метиламинобутил, диметиламинометил, 2-диметиламиноэтил, 3-диметиламинопропил или 4-диметиламинобутил, или группу формулы заместитель, представляющий собой карбамоил, N-метилкарбамоил, N-этилкарбамоил, N-пропилкарбамоил, N,N-диметилкарбамоил, аминометил, 2-аминоэтил, 3-аминопропил, 4-аминобутил, метиламинометил, 2-метиламиноэтил, 3-метиламинопропил, 4-метиламинобутил, диметиламинометил, 2-диметиламиноэтил, 3-диметиламинопропил или 4-диметиламинобутил, или группу формулы
Q4-X2,
где X2 представляет собой прямую связь или СО, NHCO или N(Me)CO, a Q4 представляет собой пиридил, пиридилметил, 2-пиридилэтил, пирролидин-1-ил, пирролидин-2-ил, морфолино, пиперидино, пиперидин-3-ил, пиперидин-4-ил, пиперазин-1-ил, пирролидин-1-илметил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, 4-пирролидин-1-илбутил, пирролидин-2-илметил, 2-пирролидин-2-илэтил, 3-пирролидин-2-илпропил, морфолинометил, 2-морфолиноэтил, 3-морфолинопропил, 4-морфолинобутил, пиперидинометил, 2-пиперидиноэтил, 3-пиперидинопропил, 4-пиперидинобутил, пиперидин-3-илметил, 2-пиперидин-3-илэтил, пиперидин-4-илметил, 2-пиперидин-4-илэтил, пиперазин-1-илметил, 2-пиперазин-1-илэтил, 3-пиперазин-1-илпропил или 4-пиперазин-1-илбутил,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, представляющий собой гидрокси, амино, метокси, метилсульфонил, метиламино и диметиламино, или группу формулы
-Х3-Q5,
где X3 представляет собой прямую связь или О, NH, CONH, NHCO и СН2О, a Q5 представляет собой пиридил, пиридилметил, пирролидин-1-ил, пирролидин-2-ил, морфолино, пиперидино, пиперидин-3-ил, пиперидин-4-ил, пиперазин-1-ил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, пирролидин-2-илметил, 2-пирролидин-2-илэтил, 3-пирролидин-2-илпропил, 2-морфолиноэтил, 3-морфолинопропил, 2-пиперидиноэтил, 3-пиперидинопропил, пиперидин-3-илметил, 2-пиперидин-3-илэтил, пиперидин-4-илметил, 2-пиперидин-4-илэтил, 2-пиперазин-1-илэтил или 3-пиперазин-1-илпропил,
и где любая арильная, гетероарильная или гетероциклильная группа в заместителе R1 необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, карбамоил, метил, этил и метокси, или необязательно содержит 1 заместитель, выбранный из группы формулы
-X4-R8,
где X4 представляет собой прямую связь или О или NH, a R8 представляет собой 2-гидроксиэтил, 3-гидроксипропил, 2-метоксиэтил, 3-метоксипропил, аминометил, 2-аминоэтил, 3-аминопропил, метиламинометил, 2-метиламиноэтил, 3-метиламинопропил, 2-этиламиноэтил, 3-этиламинопропил, диметиламинометил, 2-диметиламиноэтил, 3-диметиламинопропил, ацетамидометил, метоксикарбониламинометил, этоксикарбониламинометил или трет-бутоксикарбониламинометил, и группу формулы
-X5-Q6,
где X5 представляет собой прямую связь или О или NH, a Q6 представляет собой пирролидин-1-илметил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, морфолинометил, 2-морфолиноэтил, 3-морфолинопропил, пиперидинометил, 2-пиперидиноэтил, 3-пиперидинопропил, пиперазин-1-илметил, 2-пиперазин-1-илэтил или 3-пиперазин-1-илпропил, каждый из которых необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, метил и метокси,
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксозаместителя;
(с) m представляет собой 1 или 2, а группы R1, которые могут быть одинаковыми или различными, расположены в 6- и/или 7-положениях и выбраны из гидрокси, амино, метил, этил, пропил, винил, этинил, метокси, этокси, пропокси, метиламино, этиламино, диметиламино, диэтиламино, ацетамидо, пропионамидо, бензилокси, циклопропилметокси, 2-имидазол-1-илэтокси, 3-имидазол-1-илпропокси, 2-(1,2,3-триазол-1-ил)этокси, 3-(1,2,3-триазол-1-ил)пропокси, пирид-2-илметокси, пирид-3-илметокси, пирид-4-илметокси, 2-пирид-2-илэтокси, 2-пирид-3-илэтокси, 2-пирид-4-илэтокси, 3-пирид-2-илпропокси, 3-пирид-3-илпропокси, 3-пирид-4-илпропокси, пирролидин-1-ил, морфолино, пиперидино, пиперазин-1-ил, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси, 3-гомопиперазин-1-илпропокси, 2-пирролидин-1-илэтиламино, 3-пирролидин-1-илпропиламино, пирролидин-3-иламино, пирролидин-2-илметиламино, 2-пирролидин-2-илэтиламино, 3-пирролидин-2-илпропиламино, 2-морфолиноэтиламино, 3-морфолинопропиламино, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этиламино, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропиламино, 2-пиперидиноэтиламино, 3-пиперидинопропиламино, пиперидин-3-иламино, пиперидин-4-иламино, пиперидин-3-илметиламино, 2-пиперидин-3-илэтиламино, пиперидин-4-илметиламино, 2-пиперидин-4-илэтиламино, 2-гомопиперидин-1-илэтиламино, 3-гомопиперидин-1-илпропиламино, 2-пиперазин-1-илэтиламино, 3-пиперазин-1-илпропиламино, 2-гомопиперазин-1-илэтиламино или 3-гомопиперазин-1-илпропиламино,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в R1 заместителе необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, СН=СН и С С, С,
и когда R1 представляет собой винильную или этинильную группу, заместитель R1 необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой N-(2-диметиламиноэтил)карбамоил, N-(3-диметиламинопропил)карбамоил, метиламинометил, 2-метиламиноэтил, 3-метиламинопропил, 4-метиламинобутил, диметиламинометил, 2-диметиламиноэтил, 3-диметиламинопропил и 4-диметиламинобутил, или группу формулы заместитель, представляющий собой N-(2-диметиламиноэтил)карбамоил, N-(3-диметиламинопропил)карбамоил, метиламинометил, 2-метиламиноэтил, 3-метиламинопропил, 4-метиламинобутил, диметиламинометил, 2-диметиламиноэтил, 3-диметиламинопропил и 4-диметиламинобутил, или группу формулы
Q4-X2-,
где X2 представляет собой прямую связь или NHCO или N(Me)CO, a Q4 представляет собой имидазолилметил, 2-имидазолилэтил, 3-имидазолилпропил, пиридилметил, 2-пиридилэтил, 3-пиридилпропил, пирролидин-1-илметил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, 4-пирролидин-1-илбутил, пирролидин-2-илметил, 2-пирролидин-2-илэтил, 3-пирролидин-2-илпропил, морфолинометил, 2-морфолиноэтил, 3-морфолинопропил, 4-морфолинобутил, пиперидинометил, 2-пиперидиноэтил, 3-пиперидинопропил, 4-пиперидинобутил, пиперидин-3-илметил, 2-пиперидин-3-илэтил, пиперидин-4-илметил, 2-пиперидин-4-илэтил, пиперазин-1-илметил, 2-пиперазин-1-илэтил, 3-пиперазин-1-илпропил или 4-пиперазин-1-илбутил,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где любая фенильная, пиридильная или гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, карбамоил, метил, этил и метокси, и пиперидин-3-илметильная или пиперидин-4-илметильная группа в заместителе R1 необязательно N-замещена 2-метоксиэтилом, 3-метоксипропилом, 2-аминоэтилом, 3-аминопропилом, 2-метиламиноэтилом, 3-метиламинопропилом, 2-диметиламиноэтилом, 3-диметиламинопропилом, 2-пирролидин-1-илэтилом, 3-пирролидин-1-илпропилом, 2-морфолиноэтилом, 3-морфолинопропилом, 2-пиперидиноэтилом, 3-пиперидинопропилом, 2-пиперазин-1-илэтилом или 3-пиперазин-1-илпропилом, причем каждый из последних 8 заместителей необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, метил и метокси,
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксозаместителя;
(d) m представляет собой 1, а группа R1 расположена в 6- или 7-положении и представляет собой гидрокси, амино, метил, этил, пропил, метокси, этокси, пропокси, метиламино, этиламино, диметиламино, диэтиламино, ацетамидо, пропионамидо, бензилокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в R1 заместителе необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил и метокси,
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксозаместителя;
(e) m представляет собой 0;
(f) R2 представляет собой водород;
(g) R3 представляет собой водород;
(h) Z представляет собой прямую связь или О, S, SO, SO2, N(R11) или СО;
(i) Z представляет собой CON(R11), N(R11)CO, SO2N(R11), N(R11)SO2, OC(R11)2, SC(R11)2 и N(R11)С(R11)2, где R11 представляет собой водород или (1-6С)алкил;
(j) группа Q1-Z-представляет собой (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-8С)алкенилокси, (2-8С)алкинилокси, галоген-(1-6С)алкил, гидрокси-(1-6С)алкил, (1-6С)алкокси-(1-6С)алкил, циано-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил, ди-[(1-6С)алкил]амино-(1-6С)алкил, галоген-(1-6С)алкокси, гидрокси-(1-6С)алкокси, (1-6С)алкокси-(1-6С)алкокси, циано-(1-6С)алкокси, амино-(1-6С)алкокси, (1-6С)алкиламино-(1-6С)алкокси и ди-[(1-6С)алкил]амино(1-6С)алкокси,
или Z представляет собой прямую связь или О, S, SO, SO2, N(R11) и СО, где R11 представляет собой водород или (1-6С) алкил, a Q1 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в Q1-Z-группе необязательно разделены путем встраивания в цепь группы, выбранной из О, N(R12), CON(R12), N(R12)СО, СН=СН и С С, где R12 представляет собой водород или (1-6С)алкил, С, где R12 представляет собой водород или (1-6С)алкил,
и где любая из групп СН2=СН- или НС С- в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС С- в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы
Q7-X6-,
где X6 представляет собой прямую связь или СО или N(R13)CO, где R13 представляет собой водород или (1-6С) алкил, а Q7 представляет собой гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе CH2 или СН3 заместитель, выбранный из гидрокси, амино, (1-6С)алкокси, (1-6С)алкилсульфонил, (1-6С)алкиламино и ди-[(1-6С)алкил]амино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, N(R14), CON(R14), N(R14)CO или С(R14)2O, где R14 представляет собой водород или (1-6С)алкил, а Q8 представляет собой гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая арильная, гетероарильная или гетероциклильная группа в группе Q1-Z-необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, гидрокси, амино, карбамоил, (1-6С)алкил, (1-6С)алкокси, N-(1-6C)алкилкарбамоил и N,N-ди-[(1-6C)алкил]карбамоил, или необязательно содержит 1 заместитель, выбранный из группы формулы
-Х8-R15,
где X4 представляет собой прямую связь или О или N(R16), где R16 представляет собой водород или (1-6C)алкил, a R15 представляет собой гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6C)алкил, амино-(1-6C)алкил, (1-6C)алкиламино-(1-6C)алкил, ди-[(1-6C)алкил]амино-(1-6C)алкил, (2-6С)алканоиламино(1-6C)алкил или (1-6C)алкоксикарбониламино-(1-6C)алкил или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О или N(R17), где R17 представляет собой водород или (1-6C)алкил, a Q9 представляет собой гетероциклил или гетероциклил-(1-6C)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, (1-6C)алкил или (1-6C)алкокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(k) группа Q1-Z- представляет собой метокси, этокси, пропокси, изопропокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, 2-аминоэтокси, 3-аминопропокси, 2-метиламиноэтокси, 3-метиламинопропокси, 2-этиламиноэтокси, 3-этиламинопропокси, 2-диметиламиноэтокси, 3-диметиламинопропокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси, циклопропилметокси, циклобутилметокси, циклопентилметокси, циклогексилметокси и циклогептилметокси,
или Z представляет собой прямую связь или О, S, SO, SO2 или NH, и Q1 представляет собой фенил, бензил, 2-тиенил, 1-имидазолил, 1,2,3-триазол-1-ил, 1,2,4-триазол-1-ил, 2-, 3- или 4-пиридил, 2-имидазол-1-илэтил, 3-имидазол-1-илпропил, 2-(1,2,3-триазол-1-ил)этил, 2-(1,2,4-триазол-1-ил)этил, 3-(1,2,3-триазол-1-ил)пропил, 3-(1,2,4-триазол-1-ил)пропил, 2-, 3- или 4-пиридилметил, 2-(2-, 3- или 4-пиридил)этил, 3-(2-, 3- или 4-пиридил)пропил, оксетан-3-ил, тетрагидрофуран-3-ил, 3- или 4-тетрагидропиранил, 3- или 4-оксепанил, 1-, 2- или 3-пирролидинил, морфолино, 1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил, пиперидино, пиперидин-3-ил, пиперидин-4-ил, 1-, 3- или 4-гомопиперидинил, пиперазин-1-ил, гомопиперазин-1-ил, 1-, 2- или 3-пирролидинилметил, морфолинометил, пиперидинометил, 3- или 4-пиперидинилметил, 1-, 3- или 4-гомопиперидинилметил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, 2-пирролидин-2-илэтил, 3-пирролидин-2-илпропил, 2-морфолиноэтил, 3-морфолинопропил, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этил, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропил, 2-пиперидиноэтил, 3-пиперидинопропил, 2-пиперидин-3-илэтил, 2-пиперидин-4-илэтил, 2-гомопиперидин-1-илэтил, 3-гомопиперидин-1-илпропил, 2-пиперазин-1-илэтил, 3-пиперазин-1-илпропил, 2-гомопиперазин-1-илэтил или 3-гомопиперазин-1-илпропил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z-необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, CONH, NHCO, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, NH, CONH, NHCO и СН2О, a Q8 представляет собой пиридил, пиридилметил, пирролидин-1-ил, пирролидин-2-ил, морфолино, пиперидино, пиперидин-3-ил, пиперидин-4-ил, пиперазин-1-ил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, пирролидин-2-илметил, 2-пирролидин-2-илэтил, 3-пирролидин-2-илпропил, 2-морфолиноэтил, 3-морфолинопропил, 2-пиперидиноэтил, 3-пиперидинопропил, пиперидин-3-илметил, 2-пиперидин-3-илэтил, пиперидин-4-илметил, 2-пиперидин-4-илэтил, 2-пиперазин-1-илэтил или 3-пиперазин-1-илпропил,
и где любая арильная, гетероарильная или гетероциклильная группа в группе Q1-Z-необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, карбамоил, метил, этил и метокси, или необязательно содержит 1 заместитель, выбранный из группы формулы
-Х8-R15,
где X8 представляет собой прямую связь или О или NH, a R15 представляет собой 2-гидроксиэтил, 3-гидроксипропил, 2-метоксиэтил, 3-метоксипропил, аминометил, 2-аминоэтил, 3-аминопропил, метиламинометил, 2-метиламиноэтил, 3-метиламинопропил, 2-этиламиноэтил, 3-этиламинопропил, диметиламинометил, 2-диметиламиноэтил, 3-диметиламинопропил, ацетамидометил, метоксикарбониламинометил, этоксикарбониламинометил или трет-бутоксикарбониламинометил, или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О или NH, a Q9 представляет собой пирролидин-1-илметил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, морфолинометил, 2-морфолиноэтил, 3-морфолинопропил, пиперидинометил, 2-пиперидиноэтил, 3-пиперидинопропил, пиперазин-1-илметил, 2-пиперазин-1-илэтил или 3-пиперазин-1-илпропил, каждый из которых необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, метил и метокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(1) группа Q1-Z- представляет собой метокси, этокси, пропокси, изопропокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси, фенокси, фенилтио, анилино, бензилокси, циклопропилметокси, тетрагидрофуран-3-илокси, 3- или 4-тетрагидропиранилокси, 2-имидазол-1-илэтокси, 3-имидазол-1-илпропокси, 2-(1,2,3-триазол-1-ил)этокси, 2-(1,2,4-триазол-1-ил)этокси, 3-(1,2,3-триазол-1-ил)пропокси, 3-(1,2,4-триазол-1-ил)пропокси, пирролидин-1-ил, морфолино, пиперидино, пиперазин-1-ил, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, гомопиперидин-3-илокси, гомопиперидин-4-илокси, гомопиперидин-3-илметокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси, 3-гомопиперазин-1-илпропокси, 2-пирролидин-1-илэтиламино, 3-пирролидин-1-илпропиламино, пирролидин-3-иламино, пирролидин-2-илметиламино, 2-пирролидин-2-илэтиламино, 3-пирролидин-2-илпропиламино, 2-морфолиноэтиламино, 3-морфолинопропиламино, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этиламино, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропиламино, 2-пиперидиноэтиламино, 3-пиперидинопропиламино, пиперидин-3-иламино, пиперидин-4-иламино, пиперидин-3-илметиламино, 2-пиперидин-3-илэтиламино, пиперидин-4-илме тиламино, 2-пиперидин-4-илэтиламино, гомопиперидин-3-иламино, гомопиперидин-4-иламино, гомопиперидин-3-илметиламино, 2-гомопиперидин-1-илэтиламино, 3-гомопиперидин-1-илпропиламино, 2-пиперазин-1-илэтиламино, 3-пиперазин-1-илпропиламино, 2-гомопиперазин-1-илэтиламино или 3-гомопиперазин-1-илпропиламино,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z- необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонил, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, карбамоил, метил, этил и метокси, а пиперидин-3-илметильная или пиперидин-4-илметильная группа в группе Q1-Z- необязательно N-замещена 2-метоксиэтилом, 3-метоксипропилом, 2-аминоэтилом, 3-аминопропилом, 2-метиламиноэтилом, 3-метиламинопропилом, 2-диметиламиноэтилом, 3-диметиламинопропилом, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропилом, 2-морфолиноэтилом, 3-морфолинопропилом, 2-пиперидиноэтилом, 3-пиперидинопропилом, 2-пиперазин-1-илэтилом или 3-пиперазин-1-илпропилом, причем каждый из последних 8 заместителей необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, метил и метокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(m) Q1-Z- представляет собой пропокси, изопропокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, циклопентилокси, циклогексилокси, фенокси, бензилокси, тетрагидрофуран-3-илокси, тетрагидропиран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, гомопиперидин-3-илокси, гомопиперидин-4-илокси, гомопиперидин-3-илметокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил и метокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(n) Z представляет собой прямую связь или О, S, SO, SO2, N(R11) или СО, где R11 представляет собой водород или (1-6С)алкил, a Q1 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил-(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в Q1-Z- группе необязательно разделены путем встраивания в цепь группы, выбранной из О, N(R12), CON(R12), N(R12)СО, СН=СН и С С, где R12 представляет собой водород или (1-6С)алкил, С, где R12 представляет собой водород или (1-6С)алкил,
и где любая из групп СН2=СН- или НС С- в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС С- в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил и ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил и ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы
Q7-X6-,
где X6 представляет собой прямую связь или СО или N(R13)CO, где R13 представляет собой водород или (1-6С) алкил, а Q7 представляет собой гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, (1-6С)алкокси, (1-6С)алкилсульфонила, (1-6С)алкиламино и ди-[(1-6С)алкил]амино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, N(R14), CON(R14), N(R14)CO и C(R14)2O, где R14 представляет собой водород или (1-6С)алкил, а Q8 представляет собой гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая арильная, гетероарильная или гетероциклильная группа в группе Q1-Z-необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, гидрокси, амино, карбамоил, (1-6С)алкил, (1-6С)алкокси, N-(1-6C)алкилкарбамоил или N,N-ди-[(1-6C)алкил]карбамоил, или необязательно содержит 1 заместитель, выбранный из группы формулы
-X8-R15,
где X8 представляет собой прямую связь или О или N(R16), где R16 представляет собой водород или (1-6С)алкил, и R15 представляет собой гидрокси-(1-6С)алкил, (1-6С)алкокси-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил, ди-[(1-6С)алкил]амино-(1-6С)алкил, (2-6С)алканоиламино(1-6С)алкил или (1-6С)алкоксикарбониламино-(1-6С)алкил, или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О или N(R17), где R17 представляет собой водород или (1-6С)алкил, a Q9 представляет собой гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, (1-6С)алкил и (1-6С)алкокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(о) Z представляет собой прямую связь или О, S, SO, SO2 или NH, а Q1 представляет собой фенил, бензил, 2-тиенил, 1-имидазолил, 1,2,3-триазол-1-ил, 1,2,4-триазол-1-ил, 2-, 3- или 4-пиридил, 2-имидазол-1-илэтил, 3-имидазол-1-илпропил, 2-(1,2,3-триазол-1-ил)этил, 2-(1,2,4-триазол-1-ил)этил, 3-(1,2,3-триазол-1-ил)пропил, 3-(1,2,4-триазол-1-ил)пропил, 2-, 3- или 4-пиридилметил, 2-(2-, 3- или 4-пиридил)этил, 3-(2-, 3- или 4-пиридил)пропил, оксетан-3-ил, тетрагидрофуран-3-ил, 3- или 4-тетрагидропиранил, 3- или 4-оксепанил, 1-, 2- или 3-пирролидинил, морфолино, 1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил, пиперидино, пиперидин-3-ил, пиперидин-4-ил, 1-, 3- или 4-гомопиперидинил, пиперазин-1-ил, гомопиперазин-1-ил, 1-, 2-или 3-пирролидинилметил, морфолинометил, пиперидинометил, 3- или 4-пиперидинилметил, 1-, 3- или 4-гомопиперидинилметил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, 2-пирролидин-2-илэтил, 3-пирролидин-2-илпропил, 2-морфолиноэтил, 3-морфолинопропил, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этил, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропил, 2-пиперидиноэтил, 3-пиперидинопропил, 2-пиперидин-3-илэтил, 2-пиперидин-4-илэтил, 2-гомопиперидин-1-илэтил, 3-гомопиперидин-1-илпропил, 2-пиперазин-1-илэтил, 3-пиперазин-1-илпропил, 2-гомопиперазин-1-илэтил или 3-гомопиперазин-1-илпропил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в Q1-Z- группе необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, CONH, NHCO, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, NH, CONH, NHCO или СН2О, a Q8 представляет собой пиридил, пиридилметил, пирролидин-1-ил, пирролидин-2-ил, морфолино, пиперидино, пиперидин-3-ил, пиперидин-4-ил, пиперазин-1-ил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, пирролидин-2-илметил, 2-пирролидин-2-илэтил, 3-пирролидин-2-илпропил, 2-морфолиноэтил, 3-морфолинопропил, 2-пиперидиноэтил, 3-пиперидинопропил, пиперидин-3-илметил, 2-пиперидин-3-илэтил, пиперидин-4-илметил, 2-пиперидин-4-илэтил, 2-пиперазин-1-илэтил или 3-пиперазин-1-илпропил,
и где любая арильная, гетероарильная или гетероциклильная группа в группе Q1-Z-необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, карбамоил, метил, этил и метокси, или необязательно содержит 1 заместитель, выбранный из группы формулы
-Х8-R15,
где X8 представляет собой прямую связь или О или NH, a R15 представляет собой 2-гидроксиэтил, 3-гидроксипропил, 2-метоксиэтил, 3-метоксипропил, аминометил, 2-аминоэтил, 3-аминопропил, метиламинометил, 2-метиламиноэтил, 3-метиламинопропил, 2-этиламиноэтил, 3-этиламинопропил, диметиламинометил, 2-диметиламиноэтил, 3-диметиламинопропил, ацетамидометил, метоксикарбониламинометил, этоксикарбониламинометил или трет-бутоксикарбониламинометил, или группу формулы
-X9-Q9,
где X9 представляет собой прямую связь или О или NH, a Q9 представляет собой пирролидин-1-илметил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, морфолинометил, 2-морфолиноэтил, 3-морфолинопропил, пиперидинометил, 2-пиперидиноэтил, 3-пиперидинопропил, пиперазин-1-илметил, 2-пиперазин-1-илэтил или 3-пиперазин-1-илпропил, каждый из которых необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, метил и метокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(р) группа Q1-Z- представляет собой фенокси, фенилтио, анилино, бензилокси, циклопропилметокси, тетрагидрофуран-3-илокси, 3- или 4-тетрагидропиранилокси, 2-имидазол-1-илэтокси, 3-имидазол-1-илпропокси, 2-(1,2,3-триазол-1-ил)этокси, 2-(1,2,4-триазол-1-ил)этокси, 3-(1,2,3-триазол-1-ил)пропокси, 3-(1,2,4-триазол-1-ил)пропокси, пирролидин-1-ил, морфолино, пиперидино, пиперазин-1-ил, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, гомопиперидин-3-илокси, гомопиперидин-4-илокси, гомопиперидин-3-илметокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси, 3-гомопиперазин-1-илпропокси, 2-пирролидин-1-илэтиламино, 3-пирролидин-1-илпропиламино, пирролидин-3-иламино, пирролидин-2-илметиламино, 2-пирролидин-2-илэтиламино, 3-пирролидин-2-илпропиламино, 2-морфолиноэтиламино, 3-морфолинопропиламино, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этиламино, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропиламино, 2-пиперидиноэтиламино, 3-пиперидинопропиламино, пиперидин-3-иламино, пиперидин-4-иламино, пиперидин-3-илметиламино, 2-пиперидин-3-илэтиламино, пиперидин-4-илметиламино, 2-пиперидин-4-илэтиламино, гомопиперидин-3-иламино, гомопиперидин-4-иламино, гомопиперидин-3-илметиламино, 2-гомопиперидин-1-илэтиламино, 3-гомопиперидин-1-илпропиламино, 2-пиперазин-1-илэтиламино, 3-пиперазин-1-илпропиламино, 2-гомопиперазин-1-илэтиламино или 3-гомопиперазин-1-илпропиламино,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z- необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе CH2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, карбамоил, метил, этил и метокси, а пиперидин-3-илметильная или пиперидин-4-илметильная группа в группе Q1-Z необязательно N-замещена 2-метоксиэтилом, 3-метоксипропилом, 2-аминоэтилом, 3-аминопропилом, 2-метиламиноэтилом, 3-метиламинопропилом, 2-диметиламиноэтилом, 3-диметиламинопропилом, 2-пирролидин-1-илэтилом, 3-пирролидин-1-илпропилом, 2-морфолиноэтилом, 3-морфолинопропилом, 2-пиперидиноэтилом, 3-пиперидинопропилом, 2-пиперазин-1-илэтилом или 3-пиперазин-1-илпропилом, причем каждый из последних 8 заместителей необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, метил и метокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(q) группа Q1-Z- представляет собой фенокси, бензилокси, тетрагидрофуран-3-илокси, тетрагидропиран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4H-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, гомопиперидин-3-илокси, гомопиперидин-4-илокси, гомопиперидин-3-илметокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонил, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил и метокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(r) Z представляет собой О, S, SO, SO2, N(R11) или СО, где R11 представляет собой водород или (1-6С)алкил, a Q1 представляет собой (3-7С) циклоалкил, (3-7С) циклоалкил-(1-6С) алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z-необязательно разделены путем встраивания в цепь группы, выбранной из О, N(R12), CON(R12), N(R12)CO, CH=CH и С С, где R12 представляет собой водород или (1-6С)алкил, С, где R12 представляет собой водород или (1-6С)алкил,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, (1-6С)алкокси, (1-6С)алкилсульфонила, (1-6С)алкиламино и ди-[(1-6С)алкил]амино, или группы формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, N(R14), CON(R14), N(R14)CO или C(R14)2O, где R14 представляет собой водород или (1-6C)алкил, a Q8 представляет собой гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1, 2 или -3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, гидрокси, амино, карбамоил, (1-6С)алкил, (1-6С)алкокси, N-(1-6C)алкилкарбамоил или N,N-ди-[(1-6С)алкил]карбамоил, или необязательно содержит 1 заместитель, выбранный из группы формулы
-Х8-R15,
где X4 представляет собой прямую связь или О или N(R16), где R16 представляет собой водород или (1-6С)алкил, а R15 представляет собой гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6С)алкил, амино-(1-6C)алкил, (1-6C)алкиламино-(1-6C)алкил, ди-[(1-6C)алкил]амино-(1-6C)алкил, (2-6С)алканоиламино(1-6C)алкил или (1-6C)алкоксикарбамоиламино-(1-6C)алкил, или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О или N(R17), где R17 представляет собой водород или (1-6C)алкил, а Q9 представляет собой гетероциклил или гетероциклил-(1-6C)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, (1-6С)алкил и (1-6С)алкокси,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(s) Z представляет собой О, S, SO, SO2 или NH, a Q1 представляет собой оксетан-3-ил, тетрагидрофуран-3-ил, 3- или 4-тетрагидропиранил, 3- или 4-оксепанил, 1-, 2- или 3-пирролидинил, морфолино, 1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил, пиперидино, пиперидин-3-ил, пиперидин-4-ил, 1-, 3- или 4-гомопиперидинил, пиперазин-1-ил, гомопиперазин-1-ил, 1-, 2- или 3-пирролидинилметил, морфолинометил, пиперидинометил, 3- или 4-пиперидинилметил, 1-, 3- или 4-гомопиперидинилметил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, 2-пирролидин-2-илэтил, 3-пирролидин-2-илпропил, 2-морфолиноэтил, 3-морфолинопропил, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этил, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропил, 2-пиперидиноэтил, 3-пиперидинопропил, 2-пиперидин-3-илэтил, 2-пиперидин-4-илэтил, 2-гомопиперидин-1-илэтил, 3-гомопиперидин-1-илпропил, 2-пиперазин-1-илэтил, 3-пиперазин-1-илпропил, 2-гомопиперазин-1-илэтил или 3-гомопиперазин-1-илпропил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z-необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, CONH, NHCO, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, NH, CONH, NHCO и СН2O, a Q8 представляет собой пиридил, пиридилметил, пирролидин-1-ил, пирролидин-2-ил, морфолино, пиперидино, пиперидин-3-ил, пиперидин-4-ил, пиперазин-1-ил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, пирролидин-2-илметил, 2-пирролидин-2-илэтил, 3-пирролидин-2-илпропил, 2-морфолиноэтил, 3-морфолинопропил, 2-пиперидиноэтил, 3-пиперидинопропил, пиперидин-3-илметил, 2-пиперидин-3-илэтил, пиперидин-4-илметил, 2-пиперидин-4-илэтил, 2-пиперазин-1-илэтил или 3-пиперазин-1-илпропил,
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, карбамоил, метил, этил и метокси, или необязательно содержит 1 заместитель, выбранный из группы формулы
-Х8-R15,
где X8 представляет собой прямую связь или О или NH, a R15 представляет собой 2-гидроксиэтил, 3-гидроксипропил, 2-метоксиэтил, 3-метоксипропил, аминометил, 2-аминоэтил, 3-аминопропил, метиламинометил, 2-метиламиноэтил, 3-метиламинопропил, 2-этиламиноэтил, 3-этиламинопропил, диметиламинометил, 2-диметиламиноэтил, 3-диметиламинопропил, ацетамидометил, метоксикарбониламинометил, этоксикарбониламинометил или трет-бутоксикарбониламинометил, или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О или NH, a Q9 представляет собой пирролидин-1-илметил, 2-пирролидин-1-илэтил, 3-пирролидин-1-илпропил, морфолинометил, 2-морфолиноэтил, 3-морфолинопропил, пиперидинометил, 2-пиперидиноэтил, 3-пиперидинопропил, пиперазин-1-илметил, 2-пиперазин-1-илэтил или 3-пиперазин-1-илпропил, каждый из которых необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, метил и метокси,
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(t) группа Q1-Z- представляет собой циклопропилметокси, тетрагидрофуран-3-илокси, 3-или 4-тетрагидропиранилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, гомопиперидин-3-илокси, гомопиперидин-4-илокси, гомопиперидин-3-илметокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси, 3-гомопиперазин-1-илпропокси, 2-пирролидин-1-илэтиламино, 3-пирролидин-1-илпропиламино, пирролидин-3-иламино, пирролидин-2-илметиламино, 2-пирролидин-2-илэтиламино, 3-пирролидин-2-илпропиламино, 2-морфолиноэтиламино, 3-морфолинопропиламино, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этиламино, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропиламино, 2-пиперидиноэтиламино, 3-пиперидинопропиламино, пиперидин-3-иламино, пиперидин-4-иламино, пиперидин-3-илметиламино, 2-пиперидин-3-илэтиламино, пиперидин-4-илметиламино, 2-пиперидин-4-илэтиламино, гомопиперидин-3-иламино, гомопиперидин-4-иламино, гомопиперидин-3-илметиламино, 2-гомопиперидин-1-илэтиламино, 3-гомопиперидин-1-илпропиламино, 2-пиперазин-1-илэтиламино, 3-пиперазин-1-илпропиламино, 2-гомопиперазин-1-илэтиламино или 3-гомопиперазин-1-илпропиламино,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в группе Q1-Z-необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где каждая гетероциклильная группа в группе Q1-Z необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, карбамоил, метил, этил и метокси, а пиперидин-3-илметильная или пиперидин-4-илметильная группа в группе Q1-Z необязательно N-замещена 2-метоксиэтилом, 3-метоксипропилом, 2-аминоэтилом, 3-аминопропилом, 2-метиламиноэтилом, 3-метиламинопропилом, 2-диметиламиноэтилом, 3-диметиламинопропилом, 2-пирролидин-1-илэтилом, 3-пирролидин-1-илпропилом, 2-морфолиноэтилом, 3-морфолинопропилом, 2-пиперидиноэтилом, 3-пиперидинопропилом, 2-пиперазин-1-илэтилом или 3-пиперазин-1-илпропилом, причем каждый из последних 8 заместителей необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, метил и метокси,
и где каждая гетероциклильная группа в группе Q1-Z необязательно содержит 1 или 2 оксозаместителя;
(u) группа Q1-Z- представляет собой тетрагидрофуран-3-илокси, тетрагидропиран-3-илокси, тетрагидропиран-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин4-ил)пропокси, 2-пиперидино-этокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, гомопиперидин-3-илокси, гомопиперидин-4-илокси, гомопиперидин-3-илметокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил и метокси,
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
(v) Q2 представляет собой арильную группу формулы Ia
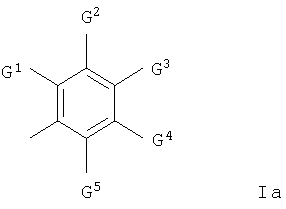
где G1 представляет собой галоген, трифторметил, циано, гидрокси, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил и (1-6С)алкокси,
и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, галоген, трифторметил, циано, гидрокси, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил и (1-6С)алкокси;
(w) Q2 представляет собой арильную группу формулы Ia, где G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -N=CH-СН=СН-, -CH=N-CH=CH-, -CH=CH-N=CH-, -CH=CH-CH=N-, -CH=CH-O-, -O-СН=СН-, -CH=CH-S-, -S-CH=CH-, -О-СН2-О- или -O-СН2-СН2-O-,
и 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо, образующееся, когда G1 и G2 связываются вместе, необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, гидрокси, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил и (1-6С)алкокси, и любая из групп образующегося таким образом бициклического гетероциклического кольца необязательно содержит 1 или 2 оксо- или тиоксогрупп,
а каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, галоген, трифторметил, циано, гидрокси, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил или (1-6С)алкокси;
(х) Q2 представляет собой арильную группу формулы Ia, где G1 представляет собой галоген, трифторметил, циано, гидрокси, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил и (1-6С)алкокси,
а G2 и G3 вместе или G3 и G4 вместе образуют группу формулы -СН=СН-СН=СН-, -N=CH-CH=CH-, -CH=N-CH=CH-, -CH=CH- N=CH-, -CH=CH-CH=N-, -CH=CH-O-, -O-CH=CH-, -CH=CH-S-, -S-CH=CH-, -O-CH2-O- или -O-CH2-CH2-O-,
и 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо, образующееся, когда связываются G2 и G3 вместе или G3 и G4 вместе, необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, циано, гидрокси, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил и (1-6С)алкокси, и любое образующееся таким образом бициклическое гетероциклическое кольцо необязательно содержит 1 или 2 оксо- или тиоксогруппы,
а каждый из G4 и G5 или G2 и G5, как необходимо, которые могут быть одинаковыми или различными, представляет собой водород, галоген, трифторметил, циано, гидрокси, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил или (1-6С)алкокси;
(у) Q2 представляет собой арильную группу формулы Ia, где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, 1-пропинил, 2-пропинил, метокси или этокси,
а каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, 1-пропинил, 2-пропинил, метокси или этокси;
(z) Q2 представляет собой арильную группу формулы Ia, где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси,
а каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси;
(аа) Q2 представляет собой арильную группу формулы Ia, где G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -O-СН2-O-,
а образующееся таким образом 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси и этокси, и любое образующееся таким образом бициклическое гетероциклическое кольцо необязательно содержит 1 или 2 оксо- или тиоксогрупп,
и каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси и этокси;
(bb) Q2 представляет собой арильную группу формулы Ia, где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, метокси и этокси,
а G2 и G3 вместе или G3 и G4 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -O-СН2-O-,
и образующееся таким образом 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси и этокси, и любое образующееся таким образом бициклическое гетероциклическое кольцо необязательно содержит 1 или 2 оксо- или тиоксогрупп,
и каждый из G4 и G5 или G2 и G5, как необходимо, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси и этокси;
(cc) Q2 представляет собой арильную группу формулы Ia, где G1 и G2 вместе образуют группу формулы -О-СН2-О-,
и образующееся таким образом 9-членное бициклическое гетероциклическое кольцо необязательно содержит в гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси и этокси, и образующееся таким образом бициклическое гетероциклическое кольцо необязательно содержит 1 оксо- или тиоксогруппу,
каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси и этокси и
G5 представляет собой водород, фтор, хлор или бром;
(dd) m представляет собой 1 или 2, и каждая из групп R1, которые могут быть одинаковыми или различными, представляет собой галоген, трифторметил, гидрокси, амино, карбамоил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (1-6С)алкиламино, ди-[(1-6C)алкиламино, N-(1-6C)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, (2-6С)алканоиламино, N-(1-6C)алкил-(2-6С)алканоиламино, (3-6С)алкеноиламино, N-(1-6C)алкил(3-6С)алкеноиламино, (3-6С)алкиноиламино или N-(1-6С)алкил-(3-6С)алкиноиламино, или группу формулы
Q3-X1-,
где X1 представляет собой прямую связь или О, N(R4), CON(R4), N(R4)СО или OC(R4)2, где R4 представляет собой водород или (1-6C)алкил, a Q3 представляет собой арил, арил-(1-6С)алкил, циклоалкил(1-6C)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6C)алкил,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем встраивания в цепь группы, выбранной из О, N(R5), CON(R5), N(R5)CO, CH=CH и С С, где R5 представляет собой водород или (1-6C)алкил, С, где R5 представляет собой водород или (1-6C)алкил,
и где любая из групп СН2=СН- или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС С- в заместителе R1 необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6C)алкил или группу формулы заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6C)алкил]карбамоил, амино-(1-6С)алкил, (1-6C)алкиламино-(1-6C)алкил или ди-[(1-6С)алкил]амино-(1-6C)алкил или группу формулы
Q4-X2-,
где X2 представляет собой прямую связь или СО или N(R6)CO, где R6 представляет собой водород или (1-6С)алкил, a Q4 представляет собой гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, (1-6С)алкокси, (1-6С)алкилсульфонила, (1-6С)алкиламино и ди-[(1-6С)алкил]амино, или группу формулы
-Х3-Q5,
где X3 представляет собой прямую связь или О, N(R7), CON(R7), N(R7)CO и C(R7)2O, где R7 представляет собой водород или (1-6С)алкил, а Q5 представляет собой гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая арильная, гетероарильная или гетероциклильная группа в заместителе R1 необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, гидрокси, амино, карбамоил, (1-6С)алкил, (1-6С)алкокси, N-(1-6C)алкилкарбамоил и N,N-ди-[(1-6C) алкил] карбамоил, или необязательно содержит 1 заместитель, выбранный из группы формулы
-X4-R8,
где X4 представляет собой прямую связь или О или N(R9), где R9 представляет собой водород или (1-6С)алкил, a R8 представляет собой гидрокси-(1-6С)алкил, (1-6С)алкокси-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил, ди-[(1-6С)алкил]амино-(1-6С)алкил, (2-6С)алканоиламино-(1-6С)алкил или (1-6С)алкоксикарбониламино-(1-6С)алкил, или группу формулы
-X5-Q6,
где X5 представляет собой прямую связь или О, СО или N(R10), где R1 представляет собой водород или (1-6С)алкил, a Q6 представляет собой гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, (1-6С)алкил и (1-6С)алкокси,
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксозаместителя; и
(ее) группа Q1-Z- представляет собой (1-6С) алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (2-8С)алкенилокси, (2-8С)алкинилокси, галоген-(1-6С)алкил, гидрокси-(1-6С)алкил, (1-6С)алкокси-(1-6С)алкил, циано-(1-6С)алкил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил, ди-[(1-6С)алкил]амино-(1-6С)алкил, галоген-(1-6С)алкокси, гидрокси-(1-6С)алкокси, (1-6С)алкокси-(1-6С)алкокси, циано-(1-6С)алкокси, амино-(1-6С) алкокси, (1-6С)алкиламино-(1-6С)алкокси или ди-[(1-6С)алкил]амино(1-6С)алкокси,
или Z представляет собой прямую связь или О, S, SO, SO2, N(R11) или СО, где R11 представляет собой водород или (1-6С)алкил, a Q1 представляет собой арил, арил-(1-6С)алкил, (3-7С)циклоалкил, (3-7С)циклоалкил(1-6С)алкил, гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где соседние атомы углерода в любой (2-6С) алкиленовой цепи в Q1-Z-группе необязательно разделены путем встраивания в цепь группы, выбранной из О, N(R12), CON(R12), N(R12)CO, CH=CH и С С, где R12 представляет собой водород или (1-6С)алкил, С, где R12 представляет собой водород или (1-6С)алкил,
и где любая из групп СН2=СН- или НС С- группа в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС С- группа в группе Q1-Z- необязательно содержит в концевом положении СН2= или НС заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил или ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы заместитель, представляющий собой карбамоил, N-(1-6С)алкилкарбамоил, N,N-ди-[(1-6С)алкил]карбамоил, амино-(1-6С)алкил, (1-6С)алкиламино-(1-6С)алкил или ди-[(1-6С)алкил]амино-(1-6С)алкил или группу формулы
Q7-X6-,
где Х6 представляет собой прямую связь или представляет собой СО или N(R13)СО, где R13 представляет собой водород или (1-6С)алкил, а Q7 представляет собой гетероарил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая из групп СН2 или СН3 группа в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, (1-6С)алкокси, (1-6С)алкилсульфонила, (1-6С)алкиламино и ди-[(1-6С)алкил]амино, или группу формулы
-X7-Q8,
где X7 представляет собой прямую связь или О, N(R14), CON(R14), N(R14)CO или С(R14)2O, где R14 представляет собой водород или (1-6C)алкил, a Q8 представляет собой гетероарил, гетероарил-(1-6C)алкил, гетероциклил или гетероциклил-(1-6С)алкил,
и где любая арильная, гетероарильная или гетероциклильная группа в группе Q1-Z-необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, трифторметил, гидрокси, амино, карбамоил, (1-6С)алкил, (1-6С)алкокси, N-(1-6C)алкилкарбамоил или N,N-ди-[(1-6C)алкил]карбамоил, или необязательно содержит 1 заместитель, выбранный из группы формулы
-X8-R15,
где X4 представляет собой прямую связь или О или N(R16), где R16 представляет собой водород или (1-6С)алкил, и R15 представляет собой гидрокси-(1-6C)алкил, (1-6C)алкокси-(1-6С)алкил, амино-(1-6C)алкил, (1-6C)алкиламино-(1-6C)алкил, ди-[(1-6C)алкил]амино-(1-6C)алкил, (2-6С)алканоиламино(1-6C)алкил или (1-6C)алкоксикарбониламино-(1-6C)алкил, или группу формулы
-Х9-Q9,
где X9 представляет собой прямую связь или О, СО или N(R17), где R17 представляет собой водород или (1-6С)алкил, а Q9 представляет собой гетероциклил или гетероциклил-(1-6C)алкил, который необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой галоген, (1-6C)алкил и (1-6C)алкокси,
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя.
Как указано выше, определенные соединения по настоящему изобретению обладают существенно лучшей активностью против семейства нерецепторных тирозинкиназ Src, например c-Src и/или c-Yes, нежели против рецепторной тирозинкиназы EGF или рецепторной тирозинкиназы VEGF. Конкретные группы новых соединений по настоящему изобретению, обладающих подобной селективностью, включают, например, хиназолиновые производные формулы I или их фармацевтически приемлемые соли, где каждый из m, R1, R2, R3, Z и Q1 принимает любое из значений, определенных выше, и
(а) Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой галоген или трифторметил,
каждый из G2 и G5 представляет собой водород,
G3 представляет собой водород, галоген, трифторметил, циано, гидрокси, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил или (1-6С)алкокси,
а G4 представляет собой галоген или (1-6С)алкокси;
(b) Q2 представляет собой арильную группу формулы Ia, где G1 представляет собой фтор, хлор, бром, иод или трифторметил,
каждый из G2 и G5 представляет собой водород,
G3 представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси,
а G4 представляет собой фтор, хлор, бром, метокси или этокси;
(c) Q2 представляет собой арильную группу формулы Ia, где G1 и G2 вместе образуют группу формулы -O-СН2-O-,
каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, галоген, трифторметил, циано, гидрокси, (1-6С)алкил или (1-6С)алкокси,
а G5 представляет собой галоген; или
(d) Q2 представляет собой арильную группу формулы Ia, где G1 и G2 вместе образуют группу формулы -О-СН2-О-,
каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси или этокси,
а G5 представляет собой фтор, хлор или бром.
Предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 0 или m представляет собой 1, и группа R1 расположена в 6- или 7-положении и представляет собой гидрокси, амино, метил, этил, пропил, метокси, этокси, пропокси, метиламино, этиламино, диметиламино, диэтиламино, ацетамидо, пропионамидо, бензилокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в R1 заместителе необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонил, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил и метокси,
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксозаместителя;
группа Q1-Z- представляет собой пропокси, изопропокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, циклопентилокси, циклогексилокси, фенокси, бензилокси, тетрагидрофуран-3-илокси, тетрагидропиран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, гомопиперидин-3-илокси, гомопиперидин-4-илокси, гомопиперидин-3-илметокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе CH2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонил, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил или метокси,
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia,

где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -О-СН2-О-, и образующееся таким образом 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси или этокси, и любое образующееся таким образом бициклическое гетероциклическое кольцо необязательно содержит 1 или 2 оксо- или тиоксогруппы, и каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси или этокси,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой гидрокси, метокси, этокси, пропокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, 2-метилсульфонилэтокси, 3-метилсульфонилпропокси или 2-(2-метоксиэтокси)этокси;
и где любая группа СН2 в заместителе R1, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
группа Q1-Z- представляет собой пропокси, изопропокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, циклопентилокси, циклогексилокси, тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, N-метилпирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, N-метилпиперидин-3-илокси, пиперидин-4-илокси, N-метилпиперидин-4-илокси, пиперидин-3-илметокси, N-метилпиперидин-3-илметокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-метилпиперазин-1-ил)этокси или 3-(4-метилпиперазин-1-ил)пропокси,
и где любая группа СН2 в группе Q1-Z-, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia,

где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, винил, изопропенил или этинил, каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и каждый из G2 и G5 представляет собой водород, или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -О-СН2-О-, и образующееся таким образом 9-или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси, и каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой гидрокси, метокси, бензилокси, 3-морфолинопропокси, 2-гидрокси-3-морфолинопропокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-гидрокси-3-(4-метилпиперазин-1-ил)пропокси, 2-метоксиэтокси и 2-(2-метоксиэтокси)этокси;
группа Q1-Z- представляет собой изопропокси, 2-метоксиэтокси, циклогексилокси, тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 3-пирролидин-1-илпропокси, N-метилпирролидин-3-илокси, 3-морфолинопропокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, N-метилпиперидин-4-илокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси или 3-(4-метилпиперазин-1-ил)пропокси,
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром или иод, каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, хлор или метокси и каждый из G2 и G5 представляет собой водород,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=С(Cl)-, -O-СН=С(Cl)- или -O-СН2-O-, и каждый из G3, G4 и G5 представляет собой водород,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 0 или m представляет собой 1, и группа R1 расположена в 6- или 7-положении и представляет собой гидрокси, амино, метил, этил, пропил, метокси, этокси, пропокси, метиламино, этиламино, диметиламино, диэтиламино, ацетамидо, пропионамидо, бензилокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомоперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил или метокси,
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксозаместителя;
группа Q1-Z- представляет собой фенокси, бензилокси, тетрагидрофуран-3-илокси, тетрагидропиран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, гомопиперидин-3-илокси, гомопиперидин-4-илокси, гомопиперидин-3-илметокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил или метокси,
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -O-СН2-O-, и образующееся таким образом 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси или этокси, и любое образующееся таким образом бициклическое гетероциклическое кольцо необязательно содержит 1 или 2 оксо- или тиоксогруппы, и каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси или этокси,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой гидрокси, метокси, этокси, пропокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, 2-метилсульфонилэтокси, 3-метилсульфонилпропокси или 2-(2-метоксиэтокси)этокси;
и где любая группа СН2 в заместителе R1, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
группа Q1-Z- представляет собой тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, N-метилпирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, N-метилпиперидин-3-илокси, пиперидин-4-илокси, N-метилпиперидин-4-илокси, пиперидин-3-илметокси, N-метилпиперидин-3-илметокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-метилпиперазин-1-ил) этокси и 3-(4-метилпиперазин-1-ил)пропокси,
и где любая группа СН2 в группе Q1-Z-, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, винил, изопропенил или этинил, каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и каждый из G2 и G5 представляет собой водород, или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -O-СН2-O-, и образующееся таким образом 9-или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси, и каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой гидрокси, метокси, бензилокси, 3-морфолинопропокси, 2-гидрокси-3-морфолинопропокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-гидрокси-3-(4-метилпиперазин-1-ил)пропокси, 2-метоксиэтокси и 2-(2-метоксиэтокси)этокси;
группа Q1-Z- представляет собой тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 3-пирролидин-1-илпропокси, N-метилпирролидин-3-илокси, 3-морфолинопропокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, N-метилпиперидин-4-илокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси или 3-(4-метилпиперазин-1-ил)пропокси,
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром и иод, каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, хлор или метокси, и каждый из G2 и G5 представляет собой водород,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=С(Cl)-, -O-СН=С(Cl)- или -O-СН2-O-, и каждый из G3, G4 и G5 представляет собой водород,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 0 или m представляет собой 1, и группа R1 расположена в 6- или 7-положении и представляет собой гидрокси, амино, метил, этил, пропил, метокси, этокси, пропокси, метиламино, этиламино, диметиламино, диэтиламино, ацетамидо, пропионамидо, бензилокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем встраивания в цепь группы, выбранной из О, NH, СН=СН и С С, С,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где любая фенильная или гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил или метокси,
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 оксозаместителя;
группа Q1-Z- представляет собой тетрагидрофуран-3-илокси, тетрагидропиран-3-илокси, тетрагидропиран-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, гомопиперидин-3-илокси, гомопиперидин-4-илокси, гомопиперидин-3-илметокси, 2пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-гомопиперазин-1-илэтокси или 3-гомопиперазин-1-илпропокси,
и где любая из групп СН2 или СН3 в группе Q1-Z- необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, амино, метокси, метилсульфонила, метиламино и диметиламино,
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, трифторметил, гидрокси, амино, метил, этил или метокси,
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -O-СН2-O-, и образующееся таким образом 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси или этокси,
и любое образующееся таким образом бициклическое гетероциклическое кольцо необязательно содержит 1 или 2 оксо- или тиоксогруппы, и каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, метокси или этокси;
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой гидрокси, метокси, этокси, пропокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, 2-метилсульфонилэтокси, 3-метилсульфонилпропокси или 2-(2-метоксиэтокси)этокси;
и где любая группа СН2 в заместителе R1, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
группа Q1-Z- представляет собой тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, N-метилпирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, N-метилпиперидин-3-илокси, пиперидин-4-илокси, N-метилпиперидин-4-илокси, пиперидин-3-илметокси, N-метилпиперидин-3-илметокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-метилпиперазин-1-ил)этокси или 3-(4-метилпиперазин-1-ил)пропокси,
и где любая группа СН2 в группе Q1-Z-, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, винил, изопропенил или этинил, каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и каждый из G2 и G5 представляет собой водород, или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -O-СН2-O-, и образующееся таким образом 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси, и каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой гидрокси, метокси, этокси, пропокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-[(2S)-2-(N-метилкарбамоил)пирролидин-1-ил]этокси, 2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, 2-метилсульфонилэтокси, 3-метилсульфонилпропокси, 2-(2-метоксиэтокси)этокси, 2-(4-пиридилокси)этокси, 2-пиридилметокси, 3-пиридилметокси или 4-пиридилметокси;
и где любая группа СН2 в заместителе R1, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
группа Q1-Z- представляет собой тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, N-метилпирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 3-пиперидинилокси, N-метилпиперидин-3-илокси, 4-пиперидинилокси, N-метилпиперидин-4-илокси, пиперидин-3-илметокси, N-метилпиперидин-3-илметокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, циклобутилокси, циклопентилокси и циклогексилокси,
и где любая группа СН2 в группе Q1-Z-, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, винил, изопропенил, этинил, метокси или пирролидин-1-ил, G2 представляет собой водород, каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и G5 представляет собой водород или метокси,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -О-СН2-О-, и образующееся таким образом 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси, и каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой гидрокси, метокси, этокси, пропокси, изопропокси, изобутокси, 2-фторэтокси, 2,2,2-трифторэтокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-пиперидин-4-илэтокси, 2-(N-метилпиперидин-4-ил)этокси, 2 -гомопиперидин-1-илэтокси, 3 -гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 3-(4-цианометилпиперазин-1-ил)пропокси, 2-[(2S)-2-карбамоилпирролидин-1-ил]этокси, 2-[(2S)-2-(N-метилкарбамоил)пирролидин-1-ил]этокси, 2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси, 2-тетрагидропиран-4-илэтокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, 2-метилсульфонилэтокси, 3-метилсульфонилпропокси, 2-(2-метоксиэтокси)этокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-пиридилокси)этокси, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси и 3-цианопирид-4-илметокси;
и где любая группа СН2 в заместителе R1, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
группа Q1-Z- представляет собой тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, N-метилпирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 3-пиперидинилокси, N-метилпиперидин-3-илокси, 4-пиперидинилокси, N-метилпиперидин-4-илокси, пиперидин-3-илметокси, N-метилпиперидин-3-илметокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, циклобутилокси, циклопентилокси и циклогексилокси,
и где любая группа СН2 в группе Q1-Z-, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
и где каждая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром, иод, трифторметил, циано, метил, этил, винил, изопропенил, этинил, метокси или пирролидин-1-ил, G2 представляет собой водород, каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил, этил, винил, аллил, изопропенил, этинил, метокси и этокси, и G5 представляет собой водород или метокси,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН-, -O-СН=СН- или -O-СН2-O-, и образующееся таким образом 9- или 10-членное бициклическое гетероарильное или гетероциклическое кольцо необязательно содержит в гетероарильной или гетероциклической части бициклического кольца 1 или 2 заместителя, которые могут быть одинаковыми или различными, представляющие собой фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси, и каждый из G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, трифторметил, циано, гидрокси, метил или метокси,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой гидрокси, метокси, бензилокси, 3-морфолинопропокси, 2-гидрокси-3-морфолинопропокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-гидрокси-3-(4-метилпиперазин-1-ил)пропокси, 2-метоксиэтокси и 2-(2-метоксиэтокси)этокси;
группа Q1-Z- представляет собой тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси, 3-пирролидин-1-илпропокси, N-метилпирролидин-3-илокси, 3-морфолинопропокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, N-метилпиперидин-4-илокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси и 3-(4-метилпиперазин-1-ил)пропокси,
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром или иод, каждый из G3 и G4, которые могут быть одинаковыми или различными, представляет собой водород, хлор или метокси, и каждый из G2 и G5 представляет собой водород,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=С(Cl)-, -O-СН=С(Cl)- или -O-СН2-O-, и каждый из G3, G4 и G5 представляет собой водород,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой метокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-[(2S)-2-(N-метилкарбамоил)пирролидин-1-ил]этокси, 2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси, 3-метилсульфонилпропокси, 2-(4-пиридилокси)этокси, 2-пиридилметокси, 3-пиридилметокси и 4-пиридилметокси;
группа Q1-Z- представляет собой тетрагидропиран-4-илокси, 3-пирролидин-1-илпропокси, N-метилпирролидин-3-илокси, 3-морфолинопропокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 4-пиперидинилокси, N-метилпиперидин-4-илокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 3-(4-метилпиперазин-1-ил)пропокси, циклопентилокси и циклогексилокси;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой хлор, бром, трифторметил, метил, метокси или пирролидин-1-ил, G2 представляет собой водород, G3 представляет собой водород или хлор, G4 представляет собой метокси и G5 представляет собой водород,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=С(Cl)-, -O-СН=С(Cl)- или -О-СН2-О-, каждый из G3 и G4 представляет собой водород и G5 представляет собой водород или хлор,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой метокси, этокси, пропокси, изопропокси, изобутокси, 2-фторэтокси, 2,2,2-трифторэтокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-пиперидин-4-илэтокси, 2-(N-метилпиперидин-4-ил)этокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-гомопиперидин-1-илэтокси, 3-гомопиперидин-1-илпропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 3-(4-цианометилпиперазин-1-ил)пропокси, 2-[(2S)-2-карбамоилпирролидин-1-ил]этокси, 2-[(2S)-2-(N-метилкарбамоил)пирролидин-1-ил]этокси, 2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси, 3-метилсульфонилпропокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-пиридилокси)этокси, 2-пиридилметокси, 3-пиридилметокси, 4-пиридилметокси или 2-цианопирид-4-илметокси,
и где любая группа СН2 в заместителе R1, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
группа Q1-Z- представляет собой тетрагидропиран-4-илокси, 3-пирролидин-1-илпропокси, N-метилпирролидин-3-илокси, 3-морфолинопропокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 4-пиперидинилокси, N-метилпиперидин-4-илокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 3-(4-метилпиперазин-1-ил)пропокси, циклопентилокси и циклогексилокси;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой хлор, бром, трифторметил, метил, метокси или пирролидин-1-ил, G2 представляет собой водород, G3 представляет собой водород и хлор, G4 представляет собой метокси и G5 представляет собой водород,
или G1 и G2 вместе образуют группу формулы -O-СН=СН-, -O-СН=С(Cl)- или -О-СН2-О-, каждый из G3 и G4 представляет собой водород и G5 представляет собой водород или хлор,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой метокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-[(2S)-2-(N-метилкарбамоил)пирролидин1-ил]этокси, 2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси, 3-метилсульфонилпропокси, 2-(4-пиридилокси)этокси, 2-пиридилметокси, 3-пиридилметокси и 4-пиридилметокси;
группа Q1-Z- представляет собой тетрагидропиран-4-илокси, 4-пиперидинилокси, N-метилпиперидин-4-илокси, циклопентилокси и циклогексилокси;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 и G2 вместе образуют группу формулы -O-СН2-O-, каждый из G3 и G4 представляет собой водород и G5 представляет собой хлор,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Следующее предпочтительное соединение по настоящему изобретению представляет собой хиназолиновое производное формулы I, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой метокси, этокси, пропокси, изопропокси, изобутокси, 2-фторэтокси, 2,2, 2-трифторэтокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 3-(4-гидроксипиперидин-1-ил)пропокси, 2-пиперидин-4-илэтокси, 2-(N-метилпиперидин-4-ил)этокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 3-(4-цианометилпиперазин-1-ил)пропокси, 2-[(2S)-2-карбамоилпирролидин-1-ил]этокси, 2-[(2S)-2-(N-метилкарбамоил)пирролидин-1-ил]этокси, 2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси, 3-метилсульфонилпропокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-пиридилокси)этокси, 2-пиридилметокси, 3-пиридилметокси и 4-пиридилметокси;
группа Q1-Z- представляет собой тетрагидропиран-4-илокси, 4-пиперидинилокси, N-метилпиперидин-4-илокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, циклопентилокси и циклогексилокси;
каждый из R2 и R3 представляет собой водород и
Q2 представляет собой арильную группу формулы Ia

где G1 и G2 вместе образуют группу формулы -О-СН2-О-, каждый из G3 и G4 представляет собой водород, и G5 представляет собой хлор,
или его фармацевтически приемлемую кислотно-аддитивную соль.
Особенно предпочтительное соединение по настоящему изобретению представляет собой, например, хиназолиновое производное формулы I, представляющее собой
4-(2-хлор-5-метоксианилино)-5,7-ди-(3-морфолинопропокси)хиназолин,
4-(2-бром-5-метоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(2-хлор-5-метоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(2-хлор-5-метоксианилино)-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-(3-морфолинопропокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-[2-гидрокси-3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-(2-гидрокси-3-морфолинопропокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидрофуран-3-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-(3-морфолинопропокси)-5-тетрагидрофуран-3-илоксихиназолин,
4-(5-хлорнафт-1-иламино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин и
4-(3-хлорбензофуран-7-иламино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
или их фармацевтически приемлемые кислотно-аддитивные соли.
Следующее особенно предпочтительное соединение по настоящему изобретению представляет собой, например, хиназолиновое производное формулы I, представляющее собой
4-(2-хлор-5-метоксианилино)-5-изопропокси-7-(3-морфолинопропокси)хиназолин и
4-(2-хлор-5-метоксианилино)-5-изопропокси-7-[3-(4-метилпиперазин-1-ил)пропокси]хиназолин,
или их фармацевтически приемлемые кислотно-аддитивные соли.
Особенно предпочтительное соединение по настоящему изобретению представляет собой, например, хиназолиновое производное формулы I, представляющее собой
7-бензилокси-4-(2-бром-5-метоксианилино)-5-пиперидин-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(3-метилсульфонилпропокси)-5-пиперидин-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-метокси-5-пиперидин-4-илметоксихиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(2,5-диметоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-(2-пиперидиноэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-(2-морфолиноэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-[2-(4-метилпиперазин-1-ил)этокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(2-пиперидиноэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-[2-(4-метилпиперазин-1-ил) этокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(4-пиридилоксиэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-{2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси}-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-{2-[(2S)-2-(N-метилкарбамоил)пирролидин-1-ил]этокси}-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(4-пиридилметокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(5-метокси-2-пирролидин-1-иланилино)-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин и
4-(2-бром-5-метоксианилино)-5-циклопентилокси-7-(2-пирролидин-1-илэтокси)хиназолин,
или их фармацевтически приемлемые кислотно-аддитивные соли.
Следующее особенно предпочтительное соединение по настоящему изобретению представляет собой, например, хиназолиновое производное формулы I, представляющее собой
4-(6-хлор-2,3-метилендиоксианилино)-5-циклопентилокси-7-(2-пирролидин-1-илэтокси)хиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-5-пиперидин-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-метокси-5-пиперидин-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-метокси-5-пиперидин-4-илметоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-(3-пирролидин-1-илпропокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-[2-(4-метилпиперазин-1-ил)этокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-(2-пиперидиноэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-[2-(4-пиридилокси)этокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-пиперидин-4-илметокси-5-тетрагидропиран-4-илоксихиназолин и
4-(6-хлор-2,3-метилендиоксианилино)-7-(N-метилпиперидин-4-илметокси)-5-тетрагидропиран-4-илоксихиназолин,
или их фармацевтически приемлемые кислотно-аддитивные соли.
Хиназолиновое производное формулы I или его фармацевтически приемлемая соль могут быть получены в соответствии с любой известной методикой, применимой для получения химически близких соединений. Такие методики, применяемые для получения хиназолинового производного формулы I, являются следующим аспектом настоящего изобретения и проиллюстрированы следующими показательными примерами вариантов методик, в которых, если не оговорено особо, Q1, Z, m, R1, R2, R3 и Q2 принимают любое из значений, определенных выше. Необходимые исходные вещества могут быть получены в соответствии со стандарными методиками из области органической химии. Получение таких исходных веществ описано в совокупности со следующими показательными вариантами методик и в прилагаемых примерах. Альтернативно необходимые исходные вещества могут быть получены в соответствии с методиками, аналогичными проиллюстрированным, которые входят в объем знаний химика-органика.
(а) Реакция предпочтительно в присутствии подходящего основания, хиназолина формулы II
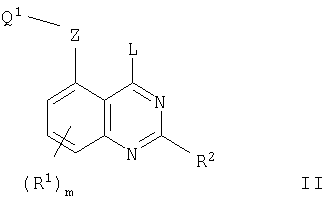
где L представляет собой удаляемую группу, a Q1, Z, m, R1 и R2 принимают любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, с анилином формулы
Q2NHR3,
где Q2 и R3 принимают любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, после чего любую присутствующую защитную группу удаляют традиционными средствами.
Подходящее основание представляет собой, например, органическое аминовое основание, такое как, например, пиридин, 2,6-лутидин, коллидин, 4-диметиламинопиридин, триэтиламин, морфолин, N-метилморфолин или диазабицикло[5.4.0]ундец-7-ен, или, например, карбонат или гидроксид щелочного или щелочноземельного металла, например, карбонат натрия, карбонат калия, карбонат кальция, гидроксид натрия или гидроксид калия, или, например гидрид щелочного металла, например гидрид натрия.
Подходящая удаляемая группа L представляет собой, например, галоген, алкокси, арилокси или сульфонилоксигруппу, например, хлор, бром, метокси, фенокси, пентафторфенокси, метансульфонилокси или толуол-4-сульфонилоксигруппу. Реакцию предпочтительно проводят в присутствии подходящего инертного растворителя или разбавителя, например спирта или сложного эфира, такого как метанол, этанол, изопропанол или этилацетат, галогенированного растворителя, такого как метиленхлорид, хлороформ или четыреххлористый углерод, простого эфира, такого как тетрагидрофуран или 1,4-диоксан, ароматического растворителя, такого как толуол, или диполярного апротонного растворителя, такого как N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидин-2-он или диметилсульфоксид. Реакцию предпочтительно проводят при температуре в пределах, например, от 10 до 250°С, предпочтительно в интервале от 40 до 80°С.
Обычно хиназолин формулы II может взаимодействовать с анилином формулы Q2NHR3 в присутствии протонного растворителя, такого как изопропанол, предпочтительно в присутствии кислоты, такой как газообразный хлороводород в диэтиловом эфире или соляная кислота, и при температуре в интервале, например, от 0 до 150°С, предпочтительно при температуре возгонки растворителя реакции или около того.
Хиназолиновое производное формулы I может быть получено в результате данного процесса в виде свободного основания или альтернативно оно может быть получено в виде соли кислоты формулы H-L, где L принимает значение, определенное выше. Когда желательным является получение из соли свободного основания, соль может быть обработана подходящим основанием, например органическим аминовым основанием, таким как, например, пиридин, 2,6-лутидин, коллидин, 4-диметиламинопиридин, триэтиламин, морфолин, N-метилморфолин или диазабицикло[5.4.0]ундец-7-ен, или, например, карбонат или гидроксид щелочного или щелочноземельного металла, например карбонат натрия, карбонат калия, карбонат кальция, гидроксид натрия или гидроксид калия.
Защитные группы, как правило, могут быть выбраны из любых групп, описанных в литературе или известных квалифицированному химику как подходящие для защиты конкретной группы, и могут быть введены традиционными способами. Защитные группы могут быть сняты традиционным способом, описанным в литературе или известным квалифицированному химику как подходящий для снятия конкретной защитной группы, причем такие способы выбирают таким образом, чтобы осуществить удаление защитной группы с минимальным влиянием на группы, находящиеся где-либо еще в молекуле.
Конкретные примеры защитных групп приведены ниже для удобства, где термин «низший», как, например, в термине «низший алкил», означает, что группа, к которой он применен, предпочтительно содержит 1-4 атома углерода. Следует понимать, что данные примеры не являются исчерпывающими. Конкретные примеры методов удаления защитных групп, приведенные ниже, также не являются исчерпывающими. Применение защитных групп и методов снятия защиты, конкретно не упомянутых здесь, разумеется подпадает под объем настоящего изобретения.
Карбоксизащитная группа может представлять собой остаток эфиробразующего алифатического или арилалифатического спирта или эфиробразующего силанола (причем указанный спирт или силанол предпочтительно содержат 1-20 атомов углерода). Примеры карбоксизащитных групп включают в себя алкильные группы с неразветвленной или разветвленной цепью (1-12С) (например, изопропил и трет-бутил); группы низший алкокси-низший алкил (например, метоксиметил, этоксиметил и изобутоксиметил); группы низший ацилокси-низший алкил (например, ацетоксиметил, пропионилоксиметил, бутирилоксиметил и пивалоилоксиметил); группы низший алкоксикарбонилокси-низший алкил (например, 1-метоксикарбонилоксиэтил и 1-этоксикарбонилоксиэтил); группы арил-низший алкил (например, бензил, 4-метоксибензил, 2-нитробензил, 4-нитробензил, бензгидрил и фталидил); три(низший алкил)силильные группы (например, триметилсилил и трет-бутилдиметилсилил); группы три(низший алкил)силил-низший алкил (например, триметилсилилэтил); и (2-6С)алкенильные группы (например, аллил). Способы, особенно предпочтительные для удаления карбоксизащитных групп, включают в себя, например, расщепление, катализируемое кислотой, основанием, металлом или ферментом.
Примеры гидроксизащитных групп включают в себя низшие алкильные группы (например, трет-бутил), низшие алкенильные группы (например, аллил); низшие алканоильные группы (например, ацетил); низшие алкоксикарбонильные группы (например, трет-бутоксикарбонил); низшие алкенилоксикарбонильные группы (например, аллилоксикарбонил); группы арил-низший алкоксикарбонил (например, бензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитробензилоксикарбонил и 4-нитробензилоксикарбонил); три(низший алкил)силильные (например, триметилсилил и трет-бутилдиметилсилил) группы и группы арил-низший алкил (например, бензил).
Примеры аминозащитных групп включают в себя формил, группы арил-низший алкил (например, бензил и замещенный бензил, 4-метоксибензил, 2-нитробензил и 2,4-диметоксибензил, и трифенилметил); ди-4-анизилметильную и фурилметильную группы; низший алкоксикарбонил (например, трет-бутоксикарбонил); низший алкенилоксикарбонил (например, аллилоксикарбонил); группы арил-низший алкоксикарбонил (например, бензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитробензилоксикарбонил и 4-нитробензилоксикарбонил); триалкилсилил (например, триметилсилил и трет-бутилдиметилсилил); алкилиденовые (например, метилиден) и бензилиденовые и замещенные бензилиденовые группы.
Способы, подходящие для удаления гидрокси- и аминозащитных групп, включают в себя, например, катализируемый кислотой, основанием, металлом или ферментом гидролиз для таких групп, как 2-нитробензилоксикарбонил, гидрирование для таких групп, как бензил, и фотолитическое расщепление для таких групп, как 2-нитробензилоксикарбонил.
Авторы отсылают читателя к Advanced Organic Chemistry, 4th Edition, by J. March, published by John Wiley & Sons, 1992, за общим руководством по условиям реакции и реагентам и к Protective Groups in Organic Synthesis, 2nd Edition, by T. Green et al., также опубликованной John Wiley & Sons, за общим руководством по защитным группам.
Хиназолиновые исходные вещества формулы II могут быть получены в соответствии со стандартными методиками. Например, 3,4-дигидрохиназолин-4-он формулы III
где m, R1, Q1, Z и R2 принимают любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, может взаимодействовать с галогенирующим агентом, таким как тионилхлорид, фосфорилхлорид или смесь четыреххлористого углерода и трифенилфосфина, после чего любую присутствующую защитную группу удаляют традиционными средствами.
Полученный таким образом 4-хлорхиназолин может быть преобразован при необходимости в 4-пентафторфеноксихиназолин путем реакции с пентафторфенолом в присутствии подходящего основания, такого как карбонат калия, и в присутствии подходящего растворителя, такого как N,N-диметилформамид.
(b) Для получения таких соединений формулы I, где Z представляет собой атом кислорода, присоединение предпочтительно в присутствии подходящего осушителя, спирта формулы
Q1-OH,
где Q1 принимает любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, к хиназолину формулы IV
где m, R1, R2, R3 и Q2 принимают любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, после чего любую присутствующую защитную группу удаляют традиционными средствами.
Подходящий осушитель представляет собой, например, карбодиимидный реагент, такой как дициклогексилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид, или смесь азосоединения, такого как диэтил- или ди-трет-бутилазодикарбоксилат, и фосфина, такого как трифенилфосфин. Реакцию предпочтительно проводят в присутствии подходящего инертного растворителя или разбавителя, например галогенированного растворителя, такого как метиленхлорид, хлороформ или четыреххлористый углерод, и при температуре в интервале, например, от 10 до 150°С, предпочтительно при температуре окружающей среды или около того.
Хиназолин формулы IV может быть получен в соответствии со стандартными методиками. Например, хиназолин формулы V
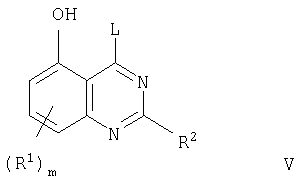
где L представляет собой удаляемую группу, определенную выше, a m, R1 и R2 принимают любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, может взаимодействовать с анилином формулы
Q2NHR3,
где Q2 и R3 принимают любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, после чего любую присутствующую защитную группу удаляют традиционными средствами.
(с) Для получения таких соединений формулы I, где m представляет собой 1, а R1 представляет собой группу формулы
Q3-X1-,
где Q3 представляет собой арил-(1-6С)алкил, (3-7С)циклоалкил-(1-6С)алкил, (3-7С)циклоалкенил(1-6С)алкил, гетероарил-(1-6С)алкил или гетероциклил-(1-6С)алкил и X1 представляет собой атом кислорода, присоединение, предпочтительно, в присутствии подходящего осушителя, определенного выше, хиназолина формулы VI
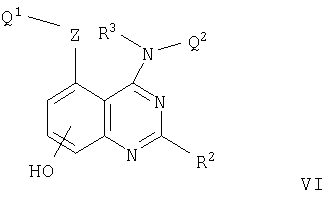
где Q1, Z, R2, R3 и Q2 принимают любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, с подходящим спиртом, где любая функциональная группа при необходимости защищена, после чего любую присутствующую защитную группу удаляют традиционными средствами.
Реакцию предпочтительно проводят в присутствии подходящего инертного растворителя или разбавителя, например галогенированного растворителя, такого как метиленхлорид, хлороформ или четыреххлористый углерод, и при температуре в интервале, например, от 10 до 150°С, предпочтительно при температуре окружающей среды или около того.
(d) Для получения таких соединений формулы 1, где R1 представляет собой гидроксигруппу, расщепление хиназолинового производного формулы I, где R1 представляет собой (1-6С)алкокси- или арилметоксигруппу.
Реакция расщепления может быть предпочтительно проведена в соответствии с любой из множества методик, известных для такого преобразования. Реакция расщепления соединения формулы 1, где R1 представляет собой (1-6С)алкоксигруппу может быть проведена, например, путем обработки хиназолинового производного (1-6С)алкилсульфидом щелочного металла, таким как этантиолат натрия, или, например, путем обработки диарилфосфидом щелочного металла, таким как дифенилфосфид лития. Альтернативно реакция расщепления может быть предпочтительно проведена, например, путем обработки хиназолинового производного тригалогенидом бора или алюминия, таким как трибромид бора. Реакция расщепления соединения формулы I, где R1 представляет собой арилметоксигруппу, может быть проведена, например, путем гидрирования хиназолинового производного в присутствии подходящего металлического катализатора, такого как палладий, или путем взаимодействия с органической или неорганической кислотой, например с трифторуксусной кислотой. Такие реакции предпочтительно проводят в присутствии подходящего инертного растворителя или разбавителя, определенного выше, и при температуре в интервале, например, от 10 до 150°С, предпочтительно при температуре окружающей среды или около того.
(е) Для получения таких соединений формулы I, где Q1, R1 или Q2 содержит первичную или вторичную аминогруппу, расщепление соответствующего соединения формулы I, где Q1, R1 или Q2 содержит защищенную первичную или вторичную аминогруппу.
Подходящие защитные группы для аминогруппы представляют собой, например, любую из защитных групп, описанных выше применительно к аминогруппе. Подходящие способы расщепления таких аминозащитных групп также описаны выше. В частности, подоходящая защитная группа представляет собой низшую алкоксикарбонильную группу, такую как трет-бутоксикарбонильная группа, которая может быть расщеплена в стандартных реакционных условиях, как, например, путем кислотно-катализируемого гидролиза, например, в присутствии трифторуксусной кислоты.
(f) Для получения таких соединений формулы I, где Q1, R1 или Q2 содержит (1-6С)алкокси- или замещенную (1-6С)алкоксигруппу или (1-6С)алкиламино- или замещенную (1-6С)алкиламиногруппу, алкилирование предпочтительно в присутствии подходящего основания, определенного выше, хиназолинового производного формулы I, где Q1, R1 или Q2 содержит по необходимости гидроксигруппу или первичную или вторичную аминогруппу.
Подходящий алкилирующий агент представляет собой, например, любой известный в данной области агент для алкилирования гидрокси до алкокси или замещенного алкокси, или для алкилирования амино до алкиламино или замещенного алкиламино, например галогенид алкила или замещенного алкила, например (1-6С)алкилхлорид, -бромид или -иодид или замещенный (1-6С) алкилхлорид, -бромид или -иодид, предпочтительно в присутствии подходящего основания, определенного выше, в подходящем инертном растворителе или разбавителе, определеннном выше, и при температуре в интервале, например, от 10 до 140°С, предпочтительно при температуре окружающей среды или около того.
Предпочтительно для получения таких соединений формулы I, где Q1, R1 или Q2 содержит (1-6С)алкиламино- или замещенную (1-6С)алкиламиногруппу, может быть применена реакция восстановительного аминирования. Например, для получения таких соединений формулы I, где Q1, R1 или Q2 содержит N-метильную группу, соответствующее соединение, содержащее группу N-H, может быть подвергнуто реакции с формальдегидом в присутствии подходящего восстановителя. Подходящий восстановитель представляет собой, например, гидридный восстановитель, например гидрид щелочного металла и алюминия, такой как литийалюминийгидрид или предпочтительно боргидрид щелочного металла, такой как боргидрид натрия, цианоборгидрид натрия, триэтилборгидрид натрия, триметоксиборгидрид натрия и триацетоксиборгидрид натрия. Реакцию предпочтительно проводят в подходящем инертном растворителе или разбавителе, например в тетрагидрофуране и диэтиловом эфире, для более сильных восстановителей, таких как литийалюминийгидрид, и, например, в метиленхлориде или протонном растворителе, таком как метанол и этанол, для менее сильных восстановителей, таких как триацетоксиборгидрид натрия и цианоборгидрид натрия. Реакцию проводят при температуре в интервале, например, от 10 до 80°С, предпочтительно при температуре окружающей среды или около того.
(g) Для получения таких соединений формулы I, где Q1, R1 или Q2 содержит амино-гидрокси-двузамещенную (1-6С)алкоксигруппу (такую как 2-гидрокси-3-пиперидинопропокси, 2-гидрокси-3-метиламинопропокси, 3-диметиламино-2-гидроксипропокси или 3-[N-(3-диметиламинопропил)-N-метиламино]-2-гидроксипропокси), реакция соединения формулы I, где Q1, R1 или Q2 содержит эпоксизамещенную (1-6С)алкоксигруппу, с гетероциклильным соединением или подходящим амином.
Реакцию предпочтительно проводят в присутствии подходящего инертного растворителя или разбавителя, определеннного выше, и при температуре в интервале, например, от 10 до 150°С, предпочтительно при температуре окружающей среды или около того.
(h) Реакция предпочтительно в присутствии подходящего основания, определенного выше, хиназолина формулы VII
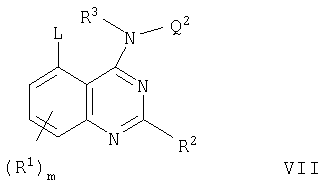
где L представляет собой удаляемую группу, определенную выше, a m, R1, R2, R3 и Q2 принимают любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, с соединением формулы
Q1ZH,
где Q1 и Z принимают любое из значений, определенных выше, за исключением того, что любая функциональная группа при необходимости защищена, после чего любую присутствующую защитную группу удаляют традиционными средствами.
Реакцию предпочтительно проводят в присутствии подходящего инертного растворителя или разбавителя, определенного выше, и при температуре в интервале, например, от 10 до 150°С, предпочтительно при 50°С или около того.
(i) Для получения таких соединений формулы I, где Q1, R1 или Q2 содержит аминозамещенную (1-6С)алкоксигруппу (такую как 3-пиперидинопропокси, 3-метиламинопропокси или 3-диметиламинопропокси), реакция соединения формулы I, где Q1, R1 или Q2 содержит галогензамещенную (1-6С)алкоксигруппу, с гетероциклильным соединением или подходящим амином.
Реакцию предпочтительно проводят в присутствии подходящего инертного растворителя или разбавителя, определенного выше, и при температуре в интервале, например, от 10 до 150°С, предпочтительно при температуре окружающей среды или около того.
Когда необходима фармацевтически приемлемая соль хиназолинового производного формулы I, например кислотно-аддитивная соль, она может быть получена путем, например, реакции указанного хиназолинового производного с подходящей кислотой в соответствии с традиционной методикой.
Биологические анализы
Следующие анализы могут использоваться для измерения эффектов соединений по настоящему изобретению в качестве ингибиторов тирозинкиназы c-Src, в качестве ингибиторов in vitro пролиферации трансфицированных c-Src фибробластов, в качестве ингибиторов in vitro миграции опухолевых клеток легкого человека А549 и в качестве ингибиторов in vivo роста у мышей nude трансплантатов ткани А549.
(a) In vitro ферментный анализ
Способность тестируемых соединений ингибировать фосфорилирование тирозинсодержащего полипептидного субстрата ферментом киназой c-Src оценивали с применением традиционного анализа ИФА.
Раствор субстрата [100 мкл 20 нг/мл раствора полиаминокислоты Poly(Glu, Туг) 4:1 (каталожный № Sigma P0275) в фосфатно-буферном растворе (ФБР), содержащем 0,2 мг/мл азида натрия] добавляли в каждую лунку ряда 96-луночных планшетов для иммуноанализов Nunc (каталожный № 439454) и планшеты укупоривали и выдерживали при 4°С в течение 16 часов. Избыток раствора субстрата декантировали и аликвоты бычьего сывороточного альбумина (BSA; 150 мкл 5%-ного раствора в ФБР) переносили в каждую покрытую субстратом аналитическую лунку и инкубировали в течение 1 часа при температуре окружающей среды для блокирования неспецифического связывания. Лунки аналитического планшета промывали по очереди ФБР, содержащим 0,05% (по объему) Tween 20, (PBST) и буфером Hepes, pH=7,4, (50 мМ, 300 мкл/лунка) перед тем, как промокнуть насухо.
Каждое тестируемое соединение растворяли в диметилсульфоксиде и разбавляли дистиллированной водой с получением серии разведений (от 100 мкМ до 0,001 мкМ). Порции (25 мкл) каждого разведения тестируемого соединения переносили в лунки промытых аналитических планшетов. «Полностью» контрольные лунки содержали разведенный ДМСО вместо соединения. Аликвоты (25 мкл) водного раствора хлорида магния (80 мМ), содержащего аденозин-5′-трифосфат (АТФ; 40 мкМ), добавляли во все тестируемые лунки за исключением контрольных лунок-пустышек, которые содержали хлорид магния без АТФ.
Активную человеческую киназу c-Src (рекомбинантный фермент, экспрессируемый в клетках насекомых Sf9; полученную от Upstate Biotechnology Inc. продукт 14-117) разбавляли непосредственно перед применением в 10000 раз разбавителем фермента, который содержал 100 мМ буфер Hepes, рН=7,4, 0,2 мМ ортованадат натрия, 2 мМ дитиотреитол и 0,02%-ный BSA. Для запуска реакции аликвоты (50 мкл) свежеразбавленного фермента добавляли в каждую лунку и планшеты инкубировали при температуре окружающей среды в течение 20 минут. Надосадочную жидкость из каждой лунки декантировали и лунки дважды промывали PBST. Мышиный IgG-антитело против фосфотирозина (Upstate Biotechnology Inc. продукт 05-321; 100 мкл) разбавляли в 6000 раз PBST, содержащим 0,5% (м/о) BSA, и добавляли в каждую лунку. Планшеты инкубировали в течение 1 часа при температуре окружающей среды. Надосадочную жидкость декантировали и каждую лунку промывали PBST (×4). Овечье антитело против мышиного Ig, конъюгированное с пероксидазой хрена (HRP) (каталожный № Amersham NXA 931; 100 мкл) разбавляли в 500 раз PBST, содержащим 0,5% (м/о) BSA, и добавляли в каждую лунку. Планшеты инкубировали в течение 1 часа при температуре окружающей среды. Надосадочную жидкость декантировали и каждую лунку промывали PBST (×4).
Капсулу PCSB (каталожный № Sigma P4922) растворяли в дистиллированной воде (100 мл) с получением фосфатно-цитратного буфера, рН=5, (50 мМ), содержащего 0,03%-ный перборат натрия. Аликвоту (50 мл) данного буфера смешивали с 50 мг таблеткой 2,2′-азино-бис-(3-этилбензотиазолин-6-сульфоновой кислоты) (ABTS; каталожный № Boehringer 1204 521). Аликвоты (100 мкл) полученного раствора добавляли в каждую лунку. Планшеты инкубировали в течение 20-60 минут при температуре окружающей среды до тех пор, пока значение оптической плотности «полностью» контрольных лунок, измеряемое при 405 нм с использованием считывающего планшеты спектрофотометра, не составляло приблизительно 1,0. «Пустые» (без АТФ) и «полностью» (без соединения) контрольные значения использовали для определения интервала разведения тестируемого соединения, которое оказывало 50%-ное ингибирование активности фермента.
(b) In vitro анализ пролиферации трансфицированных c-Src фибробластов NIH 3Т3 (c-src 3T3)
Данный анализ позволял определить способность тестируемого соединения ингибировать пролиферацию фибробластов мыши 3Т3, полученной в National Institute of Health (NIH), которые стабильно трансфицированы активирующим мутантом (Y530F) человеческой c-Src.
Клетки NIH 3Т3 трансфицировали активирующим мутантом (Y530F) человеческой c-Src, используя методику, сходную с таковой, описанной Shalloway et al., Cell, 1987, 49, 65-73. Полученные клетки c-Src 3Т3 обычно высевали при 1,5×104 клеток на лунку на 96-луночные обработанные тканевой культурой прозрачные аналитические планшеты (Costar), причем каждый из них содержал аналитическую среду, содержащую модифицированную Дульбекко среду Игла (DMEM; Sigma) и 0,5%-ную околоплодную сыворотку теленка (FCS), 2 мМ глутамин, 100 Ед/мл пенициллин и 0,1 мг/мл стрептомицин в 0,9%-ном водном растворе хлорида натрия. Планшеты инкубировали в течение ночи при 37°С во влажном (7,5%-ный CO2: 95%-ная влажность) инкубаторе.
Тестируемые соединения растворяли в ДМСО с получением 10 мМ маточного раствора. Аликвоты маточного раствора разбавляли средой DMEM, описанной выше, и добавляли в подходящие лунки. Готовили серийные разведения с получением ряда тестируемых концентраций. Контрольные лунки, в которые не добавляли тестируемое соединение, присутствовали на каждом планшете. Планшеты инкубировали в течение ночи при 37°С во влажном (7,5%-ный CO2: 95%-ная влажность) инкубаторе.
Метящий реагент BrdU (каталожный № Boehringer Mannheim 647 229) разбавляли в 100 раз средой DMEM, содержащей 0,5%-ный PCS, и аликвоты (20 мкл) добавляли в каждую лунку с получением конечной концентрации 10 мкМ. Планшеты инкубировали при 37°С в течение 2 часов. Среду декантировали. Денатурирующий раствор (FixDenat solution, каталожный № Boehringer Mannheim 647 229; 50 мкл) добавляли в каждую лунку и планшеты выдерживали на шейкере при температуре окружающей среды в течение 45 минут. Супернатант декантировали и лунки промывали ФБР (200 мкл на лунку). Раствор Anti-BrdU-Peroxidase (каталожный № Boehringer Mannheim 647 229) разбавляли в 100 раз ФБР, содержащим 1%-ный BSA и 0,025%-ное сухое обезжиренное молоко (Marvel (зарегистрированный товарный знак), Premier Beverages, Stafford, GB), и аликвоту (100 мкл) полученного раствора добавляли в каждую лунку. Планшеты выдерживали на шейкере при температуре окружающей среды в течение 90 минут. Лунки промывали ФБР (×5) для гарантии удаления несвязавшегося конъюгата антитела. Планшеты промокали насухо и в каждую лунку добавляли раствор тетраметилбензидинового субстрата (каталожный № Boehringer Mannheim 647 229; 100 мкл). Планшеты мягко встряхивали на шейкере до тех пор, пока не развивалась окраска в течение 10-20-минутного периода. Поглощение лунок измеряли при 690 нм. Определяли степень ингибирования клеточной пролиферации для ряда концентраций каждого тестируемого соединения и вычисляли значение антипролиферативной IC50.
(с) In vitro микрокапельный анализ миграции
Данный анализ позволяет определить способность тестируемого соединения ингибировать миграцию адгезивных клеточных линий млекопитающих, например человеческой опухолевой клеточной линии А549.
Среду RPMI (Sigma), содержащую 10%-ную FCS, 1%-ный L-глутамин и 0,3%-ную агарозу (каталожный № Difco 0142-01) нагревали до 37°С на водяной бане. Маточный 2%-ный водный раствор агара автоклавировали и выдерживали при 42°С. Аликвоту (1,5 мл) раствора агара добавляли в среду RPMI (10 мл) непосредственно перед применением. Клетки А549 (№ доступа АТСС CCL185) суспендировали в концентрации 2×107 клеток/мл в среде и выдерживали при температуре 37°С. Каплю (2 мкл) смеси клеток/агарозы переносили пипеткой в центр каждой лунки ряда 96-луночных плоскодонных не обработанных тканевой культурой планшетов для микротитрования (каталожный № Bibby Sterilin 642000). Планшеты на короткий период времени помещали на лед для ускорения желирования агарозосодержащих капель. Аликвоты (90 мкл) среды, охлажденной до 4°С, переносили в каждую лунку, стараясь не повреждать микрокапли. Тестируемые соединения разбавляли из 10 мМ маточного раствора в ДМСО, используя среду RPMI, описанную выше. Аликвоты (10 мкл) разбавленных тестируемых соединений переносили в лунки, опять же, не повреждать микрокапли. Планшеты инкубировали при 37°С в увлажненном (7,5%-ный СО2: 95%-ная влажность) инкубаторе в течение приблизительно 48 часов.
Миграцию оценивали визуально и измеряли расстояние миграции к поверхности агаровой капли. Ингибирующую миграцию IC50 получали, откладывая на графике среднее расстояние миграции против концентрации тестируемого соединения.
(d) In vivo анализ роста трансплантата А549
Данный тест позволяет измерить способность соединений ингибировать рост человеческой карциномы А549, выращенной в виде опухоли у бестимусных мышей nude (линия Alderley Park nu/nu). Всего приблизительно 5×106 клеток А549 в матригеле (каталожный № Beckton Dickinson 40234) вводили подкожно в левый бок каждой подопытной мыши и давали полученным опухолям расти в течение приблизительно 14 суток. Размер опухоли измеряли дважды в неделю с помощью кронциркуля и расчитывали теоретический объем. Животных разделяли с получением контрольной и получающей лечение групп с приблизительно одинаковым средним объемом опухоли. Тестируемые соединения готовили в виде размолотой в шаровой мельнице суспензии в 1%-ном полисорбатном носителе и вводили перорально один раз в сутки в течение периода приблизительно 28 суток. Оценивали эффект на опухолевый рост.
Хотя, как и ожидалось, фармакологические свойства соединений формулы I варьируют с изменением структуры, в общем, активность соединений формулы I может быть продемонстрирована в следующих концентрациях или дозах в одном или нескольких указанных выше тестах (а), (b), (с) и (d):
Тест (a): IC50 в интервале, например, 0,001-10 мкМ;
Тест (b): IC50 в интервале, например, 0,01-20 мкМ;
Тест (с): активность в интервале, например, 0,01-25 мкМ;
Тест (d): активность в интервале, например, 1-200 мг/кг/ сутки.
В тесте (d) для протестированных соединений по настоящему изобретению не наблюдалось физиологически неприемлемой токсичности. Соответственно, не ожидается каких-либо побочных токсикологических эффектов при введении соединения формулы I или его фармацевтически приемлемой соли, определенных выше, в интервалах дозировок, определенных выше.
В соответствии со следующим аспектом настоящее изобретение относится к фармацевтической композиции, которая содержит хиназолиновое производное формулы I или его фармацевтически приемлемую соль, определенные выше, вместе с фармацевтически приемлемым разбавителем или носителем.
Композиции по настоящему изобретению могут находиться в форме, подходящей для перорального применения (например, в форме таблеток, лепешек, твердых или мягких капсул, водных или масляных суспензий, эмульсий, измельчаемых порошков или гранул, сиропов или эликсиров), для местного применения (например, в форме кремов, мазей, гелей или водных или масляных растворов или суспензий), для введения путем ингаляции (например, в форме мелкодисперсного порошка или жидкого аэрозоля), для введения путем инсуффляции (например, в форме мелкодисперсного порошка) или для парентерального введения (например, в форме стерильного водного или масляного раствора для внутривенного, подкожного или внутримышечного введения) или в форме суппозитория для ректального введения.
Композиции по настоящему изобретению могут быть получены в соответствии с традиционными методиками с использованием традиционных фармацевтических наполнителей, хорошо известных в данной области. Так, композиции, предназначенные для перорального введения, могут содержать, например, один или несколько красителей, подсластителей, корригентов и/или консервантов.
Количество активного ингредиента, которое смешивают с одним или несколькими наполнителями с получением разовой дозированной формы, будет по необходимости варьировать в зависимости от получающего лечение организма и конкретного пути введения. Например, композиция, предназначенная для перорального введения людям, как правило, будет содержать, например, от 0,5 мг до 0,5 г активного агента (более предпочтительно, от 0,5 до 100 мг, например от 1 до 30 мг), смешанного с подходящим и удобным количеством наполнителей, масса которых может варьировать приблизительно от 5 приблизительно до 98% от массы всей композиции.
Размер дозы соединения формулы I для терапевтических или профилактических целей естественно будет варьировать в зависимости от природы и тяжести состояний, возраста и пола животного или пациента и пути введения в соответствии с хорошо известными медицинскими принципами.
При использовании соединения формулы I для терапевтических или профилактических целей оно, как правило, будет назначаться таким образом, что будет вводиться суточная доза в интервале, например, от 0,1 до 75 мг/кг массы тела, и при необходимости раздельными дозами. Как правило, минимальные дозы будут вводиться при использовании парентерального пути. Так, например, для внутривенного введения обычно будет использоваться доза в интервале, например, от 0,1 до 30 мг/кг массы тела. Аналогично для введения путем ингаляции обычно будет использоваться доза в интервале, например, от 0,05 до 25 мг/кг массы тела. Однако предпочтительно пероральное введение, особенно в форме таблеток. Как правило, разовые дозированные формы будут содержать приблизительно от 0,5 мг до 0,5 г соединения по настоящему изобретению.
В соответствии со следующим аспектом настоящее изобретение относится к хиназолиновому производному формулы I или его фармацевтически приемлемой соли, определенным выше, для использования в способе терапевтического лечения организма человека или животного.
Как указано выше, известно, что преобладающей ролью нерецепторной тирозинкиназы c-Src является регуляция клеточной подвижности, которая необходима локализованной опухоли для прогрессирования в стадии диссеминации в кровоток, инвазии в другие ткани и начала метастатического опухолевого роста. Авторы настоящего изобретения обнаружили, что хиназолиновые производные по настоящему изобретению обладают мощной противоопухолевой активностью, которая, как считается, достигается путем ингибирования одной или нескольких нерецепторных тирозин-специфичных протеинкиназ, таких как киназа c-Src, которые вовлечены в процесс передачи сигнала, который приводит к инвазивности и миграционной способности метастазирующих опухолевых клеток.
Соответственно, хиназолиновые производные по настоящему изобретению представляют ценность в качестве противоопухолевых средств, в частности в качестве селективных ингибиторов подвижности, диссеминации и инвазивности злокачественных клеток млекопитающего, что приводит к ингибированию метастатического опухолевого роста. В частности, хиназолиновые производные по настоящему изобретению представляют ценность в качестве антиинвазивных средств для сдерживания и/или лечения солидных опухолей. В частности, ожидается, что соединения по настоящему изобретению будут применимы для профилактики или лечения тех опухолей, которые чувствительны к ингибированию одной или нескольких из множества нерецепторных тирозинкиназ, таких как киназа c-Src, которые вовлечены в процесс передачи сигнала, который приводит к инвазивности и миграционной способности метастазирующих опухолевых клеток. Кроме того, ожидается, что соединения по настоящему изобретению окажутся применимыми для профилактики или лечения тех опухолей, которые опосредуются исключительно или частично ингибированием фермента c-Src, т.е. соединения могут использоваться для оказания ингибирующего эффекта на фермент c-Src у теплокровного животного, нуждающегося в таком лечении. Конкретно, ожидается, что соединения по настоящему изобретению окажутся применимыми для профилактики или лечения солидных опухолей.
Таким образом, в соответствии с данным аспектом настоящее изобретение относится к применению хиназолинового производного формулы I или его фармацевтически приемлемой соли, определенных выше, для производства лекарственного препарата для использования в качестве противоопухолевого средства для сдерживания и/или лечения солидных опухолей.
В соответствии со следующим признаком данного аспекта настоящее изобретение относится к способу оказания антиинвазивного эффекта путем сдерживания и/или лечения солидной опухоли у теплокровного животного, такого как человек, нуждающегося в таком лечении, который предусматривает введение указанному животному эффективного количества хиназолинового производного формулы I или его фармацевтически приемлемой соли, определенных выше.
В соответствии со следующим аспектом настоящее изобретение относится к применению хиназолинового производного формулы I или его фармацевтически приемлемой соли, определенных выше, в производстве лекарственного препарата для использования в профилактике или лечении солидной опухоли у теплокровного животного, такого как человек.
В соответствии со следующим признаком данного аспекта настоящее изобретение относится к способу профилактики или лечения солидной опухоли у теплокровного животного, такого как человек, нуждающегося в таком лечении, который предусматривает введение указанному животному эффективного количества хиназолинового производного формулы I или его фармацевтически приемлемой соли, определенных выше.
В соответствии со следующим аспектом настоящее изобретение относится к применению хиназолинового производного формулы I или его фармацевтически приемлемой соли, определенных выше, в производстве лекарственного препарата для использования в профилактике или лечении тех опухолей, которые чувствительны к ингибированию нерецепторных тирозинкиназ, таких как киназа c-Src, которые вовлечены в процесс передачи сигнала, который приводит к инвазивности и миграционной способности метастазирующих опухолевых клеток.
В соответствии со следующим признаком данного аспекта настоящее изобретение относится к способу профилактики или лечения тех опухолей, которые чувствительны к ингибированию нерецепторных тирозинкиназ, таких как киназа c-Src, которые вовлечены в процесс передачи сигнала, который приводит к инвазивности и миграционной способности метастазирующих опухолевых клеток, который предусматривает введение указанному животному эффективного количества хиназолинового производного формулы I или его фармацевтически приемлемой соли, определенных выше.
В соответствии со следующим аспектом настоящее изобретение относится к применению хиназолинового производного формулы I или его фармацевтически приемлемой соли, определенных выше, в производстве лекарственного препарата для использования в оказании ингибирующего эффекта на киназу с-Src.
В соответствии со следующим признаком данного аспекта настоящее изобретение относится к способу оказания ингибирующего эффекта на киназу c-Src, который предусматривает введение указанному животному эффективного количества хиназолинового производного формулы I или его фармацевтически приемлемой соли, определенных выше.
Антиинвазивное лечение, описанное выше, может применяться в виде единственной терапии или может включать в себя, помимо хиназолинового производного по настоящему изобретению, еще и традиционные хирургическое вмешательство, лучевую терапию или химиотерапию. Такая химиотерапия может включать в себя одну или несколько из указанных категорий противоопухолевых средств:
(i) иные антиинвазивные средства (например, ингибиторы металлопротеиназ, такие как маримастат, и ингибиторы функции урокиназного рецептора активатора плазминогена);
(ii) антипролиферативные/антинеопластические средства и их сочетания, применяемые в медицинской онкологии, такие как алкилирующие агенты (например, цис-платин, карбоплатин, циклофосфамид, азотистый иприт, мелфалан, хлорамбуцил, бусульфан и нитрозомочевины); антиметаболиты (например, антифолаты, такие как фторпиримидины, такие как 5-фторурацил, и тегафур, ралтитрексед, метотрексат, цитозинарабинозид и гидроксимочевина, или, например, один из предпочтительных антиметаболитов, описанных в заявке на выдачу Европейского патента №562734, такой как (2S)-2-{о-фтор-п-[N-(2,7-диметил-4-оксо-3,4-дигидрохиназолин-6-илметил)-N-(проп-2-инил)амино]бензамидо}-4-(тетразол-5-ил)масляная кислота); противоопухолевые антибиотики (например, антрациклины, такие как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин, идарубицин, митомицин-С, дактиномицин и митрамицин); антимитотические средства (например, алкалоиды винка, такие как винкристин, винбластин, виндезин и виорелбин, и таксоиды, такие как таксол и таксотер); и ингибиторы топоизомеразы (например, эпиподофиллотоксины, такие как этопозид и тенипозид, амсакрин, топотекан и камптотецин);
(iii) цитостатические средства, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и иодоксифен), антиандрогены (например, бикалутамид, флутамид, нилутамид и ципротерона ацетат), антагонисты LHRH или агонисты LHRH (например, гозерелин, лейпрорелин и бузерелин), прогестогены (например, мегестрола ацетат), ингибиторы ароматазы (например, анастрозол, летразол, воразол и экземестан) и ингибиторы 5 -редуктазы, такие как финастерид; -редуктазы, такие как финастерид;
(iv) ингибиторы функции факторов роста, например, такие ингибиторы включают в себя антитела против факторов роста, антитела против рецепторов факторов роста, ингибиторы тирозинкиназ и ингибиторы сериновых/треониновых киназ, например ингибиторы семейства эпидермального фактора роста (например, ингибиторы тирозинкиназы EGFR N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (ZD1839), N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (СР 358774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4-амин (CI 1033)), например, ингибиторы семейства тромбоцитарного фактора роста и, например, ингибиторы семейства гепатоцитарного фактора роста, и
(v) антиангиогенные средства, такие как средства, ингибирующие фактор роста сосудистого эндотелия, такие как соединения, описанные в международных патентных заявках WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354, и средства, действующие по иным механизмам (например, линомид, ингибиторы функции интегрина  v v и ангиостатин). и ангиостатин).
Такое сочетанное лечение может быть достигнуто путем одновременного, последовательного или раздельного введения отдельных компонентов лечения. Такие комбинированные продукты включают в себя соединения по настоящему изобретению в интервале дозировок, описанных выше, и иные фармацевтически активные средства в одобренных для них интервалах дозировок.
В соответствии с данным аспектом настоящее изобретение относится к фармацевтическому продукту, содержащему хиназолиновое производное формулы I, определенное выше, и дополнительное противоопухолевое средство, определенное выше, для сочетанного лечения злокачественной опухоли.
Хотя соединения формулы I представляют основную ценность в качестве лекарственных средств для использования у теплокровных животных (включая человека), они также применимы в случаях, когда необходимо ингибировать эффекты c-Src. Так, они применимы в качестве фармакологических стандартов для использования в разработке новых биологических тестов и в поиске новых фармакологических средств.
Ниже настоящее изобретение будет проиллюстрировано следующими примерами, в которых, как правило,
(i) операции проводили при температуре окружающей среды, т.е. в интервале от 17 до 25°C, и в атмосфере инертного газа, такого как аргон, если не оговорено особо;
(ii) упаривание проводили путем роторного испарения в вакууме, а процедуры обработки проводили после удаления оставшихся твердых веществ путем фильтрования;
(iii) колоночную хроматографию (по флэш-процедуре) и жидкостную хроматографию среднего давления (ЖХСД) проводили на силикагеле Merck Kieselgel (Art. 9385) или обращенно-фазовом силикагеле Merck Lichroprep RP-18 (Art. 9303), полученном от E. Merck, Darmstadt, Germany, или жидкостную хроматографию высокого давления (ЖХВД) проводили на обращенно-фазовом силикагеле CIS, например, на препаративной обращенно-фазовой колонке Dynamax C-18 60A;
(iv) выходы, при наличии, не обязательно максимально достижимые;
(v) как правило, для конечных продуктов формулы I получены удовлетворительные данные микроанализов, и их структура подтверждена данными ядерно-магнитного резонанса (ЯМР) и/или масс-спектральных методов; масс-спектральные данные, полученные с помощью бомбардировки быстрыми атомами (FAB), получали, используя спектрометр Platform и, где возможно, собирали данные либо по положительно заряженным ионам, либо по отрицательно заряженным ионам; значения химического сдвига ЯМР измеряли по дельта-шкале [данные протонно-магнитного резонанса получали, используя спектрометр Jeol JNM EX 400, работающий при силе поля 400 МГц, спектрометр Varian Gemini 2000, работающий при силе поля 300 МГц, или спектрометр Brulcer AM300, работающий при силе поля 300 МГц]; использовали следующие сокращения: с – синглет; д – дублет; т – триплет; кв – квартет; м – мультиплет; уш.- уширенный;
(vi) промежуточные продукты, как правило, не охарактеризовывали полностью, а чистоту оценивали по методам тонкослойной хроматографии, ЖХВД, инфракрасного (ИК) и/или ЯМР анализов;
(vii) точки плавления не корректировали и определяли, используя автоматическое устройство для определения точек плавления Mettler SP62 или устройство на основе масляной бани; точки плавления конечных продуктов формулы I определяли после кристаллизации из традиционного органического растворителя, такого как этанол, метанол, ацетон, эфир или гексан, отдельно или в смеси;
(viii) использовали следующие сокращения:
ДМФ – N,N-диметилформамид
ДМСО – диметилсульфоксид
ТГФ – тетрагидрофуран
ДМА – N,N-диметилацетамид.
Пример 1
4-(2-Хлор-5-метоксианилино)-1-метокси-5-(3-морфолинопропокси)хиназолин
Ди-трет-бутилазодикарбоксилат (0,208 г) добавляли по каплям к перемешиваемой смеси 4-(2-хлор-5-метоксианилино)-5-гидрокси-7-метоксихиназолина (0,2 г), 4-(3-гидроксипропил)морфолина (Bull. Soc. Chim. Fr., 1962, 1117; 0,131 г), трифенилфосфина (0,237 г) и метиленхлорида (3 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (99:1). Полученное таким образом вещество растирали в присутствии диэтилового эфира. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением указанного в заголовке соединения (0,12 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 2,35 (м, 2Н), 3,1 (т, 2Н), 3,3 (т, 2Н), 3,5 (д, 2Н), 3,68 (т, 2Н), 3,8 (с, 3Н), 4,0 (д, 2Н), 4,02 (с, 3Н), 4,6 (т, 2Н), 6,93 (с, 1Н), 7,05-7,15 (м, 2Н), 7,5 (с, 1Н), 7,57 (д, 1Н), 8,87 (с, 1Н). Масс-спектр: М+Н+ 459 и 461. Элементарный анализ: обнаружено С 60,0; Н 6,0; N 12,1; С23Н27ClN4O4 ; вычислено С 60,19; Н 5,93; N 12,2%.
Применяемый в качестве исходного вещества 4-(2-хлор-5-метоксианилино)-5-гидрокси-7-метоксихиназолин получали следующим образом.
Смесь 3,5-диметоксианилингидрохлорида (54,7 г), оксалилхлорида (54 мл) и метанола (500 мл) перемешивали и нагревали с обратным холодильником в течение 1,5 часов. Смесь охлаждали до температуры окружающей среды. Осадок выделяли, поочередно промывали метанолом и диэтиловым эфиром и сушили в вакууме с получением 4,6-диметокси-2,3-диоксоиндолина (55 г). ЯМР-спектр: (ДМСОd6) 3,85 (с, 3Н), 3,9 (с, 3Н), 6,0 (с, 1Н), 6,2 (с, 1Н), 10,9 (с, 1Н). Масс-спектр: М+Na+ 230.
Пероксид водорода (30% водный раствор, 30 мл) добавляли по каплям к перемешиваемому раствору 4,6-диметокси-2,3-диоксоиндолина (27 г) в концентрированном водном растворе гидроксида натрия (33%, 220 мл). Полученную смесь перемешивали при температуре окружающей среды в течение 10 минут. Добавляли лед и приводили основность смеси к значению рН=9 путем добавления концентрированной водной соляной кислоты, а затем подкисляли смесь до значения рН=3,5 путем добавления ледяной уксусной кислоты. Полученный осадок выделяли, промывали водой и сушили в течение ночи в вакууме с получением 2-амино-4,6-диметоксибензойной кислоты (15,9 г). ЯМР-спектр: (ДМСОd6) 3,7 (с, 3Н), 3,78 (с, 3Н), 5,79 (с, 1Н), 5,92 (с, 1Н).
Диазометан получали с применением методики, аналогичной описанной Lombardi et al., Chemistry & Industry, 1990, 708, из смеси N-метил-N-нитрозо-4-толуолсульфонамида (31 г), этанола (200 мл) и насыщенного водного раствора гидроксида натрия (35 мл) и барботировали через раствор 2-амино-4,6-диметоксибензойной кислоты (15,9 г) в метиленхлориде (280 мл), охлажденном до 0°С. Полученную реакционную смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента метиленхлорид. Таким образом получали метил-2-амино-4,6-диметоксибензоат (16,2 г). ЯМР-спектр: (ДМСОd6) 3,65 (с, 3Н), 3,7 (с, 6Н), 5,75 (с, 1Н), 5,9 (с, 1Н), 6,2 (уш.с, 2Н).
Смесь метил-2-амино-4,6-диметоксибензоата (16 г), ацетата формамидина (24 г) и 2-метоксиэтанола (330 мл) перемешивали и нагревали с обратным холодильником до тех пор, пока не прореагирует все исходное вещество. Смесь упаривали и растирали остаток в присутствии воды (100 мл). Полученное твердое вещество выделяли, промывали водой и сушили в вакууме с получением 5,7-диметокси-3,4-дигидроксихиназолин-4-она (14,5 г). ЯМР-спектр: (ДМСОd6) 3,82 (с, 3Н), 3,86 (с, 3Н), 6,5 (с, 1Н), 6,7 (с, 1Н), 7,9 (с, 1Н), 11,7 (уш.с, 1Н).
Смесь части (0,35 г) полученного таким образом вещества, фосфорилхлорида (0,95 мл) и ацетонитрила (8 мл) перемешивали и нагревали с обратным холодильником в течение 2 часов. Смесь охлаждали до 0°С и поочередно добавляли изопропанол (8 мл) и 2-хлор-5-метоксианилин (0,321 г). Полученную смесь нагревали с обратным холодильником в течение 1,5 часов. Смесь охлаждали до температуры окружающей среды, полученный осадок фильтровали, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали 4-(2-хлор-5-метоксианилино)-5,7-диметоксихиназолингидрохлорид (0,365 г). ЯМР-спектр: (ДМСОd6) 3,8 (с, 3Н), 4,0 (с, 3Н), 4,2 (с, 3Н), 7,0 (м, 3Н), 7,6 (д, 1Н), 7,62 (с, 1Н), 8,8 (с, 1Н), 10,9 (с, 1Н). Масс-спектр: М+Н+ 346 и 348.
Смесь 4-(2-хлор-5-метоксианилино)-5,7-диметоксихиназолингидрохлорида (2,5 г), гидрохлорида пиридина (0,76 г) и пиридина (50 мл) перемешивали и нагревали с обратным холодильником в течение 9 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Остаток суспендировали в воде и подщелачивали смесь до значения рН=10 путем добавления водного раствора бикарбоната натрия. Полученный твердый осадок выделяли, поочередно промывали водой, метиленхлоридом и диэтиловым эфиром и сушили в течение ночи в вакууме при 50°С. Таким образом получали 4-(2-хлор-5-метоксианилино)-5-гидрокси-7-метоксихиназолин (2,1 г). ЯМР-спектр: (ДМСОd6) 3,8 (с, 3Н), 3,85 (с, 3Н), 6,3-6,5 (м, 2Н), 6,8 (д, 1Н), 7,4 (д, 1Н), 8,1 (уш.с, 1Н), 8,42 (уш.с, 1Н).
Пример 2
С применением методики, аналогичной описанной в Примере 1, проводили взаимодействие подходящего 5-гидроксихиназолина с подходящим спиртом с получением соединений, описанных в Таблице I.
Таблица I
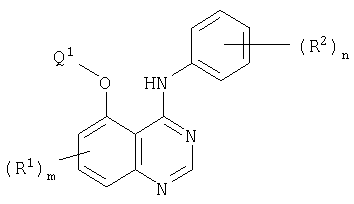 |
| № и примечание |
(R1)m |
Q1 |
(R2)n |
| [1] |
7-метокси |
3-(4-метилпиперазин-1-ил)пропил |
2-хлор-5-метокси |
| [2] |
7-метокси |
2-пиперидиноэтил |
2-хлор-5-метокси |
| [3] |
7-метокси |
3-пирролидин-1-илпропил |
2-хлор-5-метокси |
| [4] |
7-метокси |
2-(1,2,4-триазол-1-ил)этил |
2-хлор-5-метокси |
| [5] |
7-бензилокси |
3-морфолинопропил |
2-хлор-5-метокси |
| [6] |
7-бензилокси |
3-пирролидин-1-илпропил |
2-хлор-5-метокси |
| [7] |
водород |
3-морфолинопропил |
2-бром-5-метокси |
| [8] |
водород |
3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропил |
2-бром-5-метокси |
| [9] |
водород |
2-(4-метилпиперазин-1-ил)этил |
2-бром-5-метокси |
| [10] |
водород |
3-(4-метилпиперазин-1-ил)пропил |
2-хлор-5-метокси |
| [11] |
водород |
2-имидазол-1-илэтил |
2-хлор-5-метокси |
| [12] |
7-метокси |
N-метилпиперидин-4-ил |
2-хлор-5-метокси |
| [13] |
водород |
N-метилпиперидин-4-ил |
2-хлор-5-метокси |
| [14] |
водород |
N-метилпиперидин-4-ил |
2-бром-5-метокси |
| [15] |
водород |
N-метилпиперидин-4-ил |
2,5-дихлор |
| [16] |
водород |
N-(трет-бутоксикарбонил)пиперидин-4-илметил |
2-хлор-5-метокси |
| [17] |
водород |
N-(трет-бутоксикарбонил)пиперидин-4-илметил |
2-бром-5-метокси |
| [18] |
7-метокси |
2-метоксиэтил |
2-хлор-5-метокси |
| [19] |
7-метокси |
N-метилпирролидин-3-ил |
2-бром-5-метокси |
| [20] |
7-бензилокси |
4-тетрагидропиранил |
2-хлор-5-метокси |
| [21] |
водород |
4-тетрагидропиранил |
2-хлор-5-метокси |
| [22] |
7-бензилокси |
3-тетрагидрофуранил |
2-хлор-5-метокси |
| [23] |
7-(3-морфолинопропокси) |
3-тетрагидрофуранил |
2-хлор-5-метокси |
| [24] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
3-тетрагидрофуранил |
2-хлор-5-метокси |
| [25] |
7-бензилокси |
изопропил |
2-хлор-5-метокси |
| [26] |
7-метокси |
4-тетрагидропиранил |
2-бром-5-метокси |
| [27] |
7-метокси |
3-пирролидин-1-илпропил |
6-хлор-2,3-метилендиокси |
| [28] |
7-метокси |
3-(4-метилпиперазин-1-илпропил) |
6-хлор-2,3-метилендиокси |
ПРИМЕЧАНИЯ
[1] Продукт реакции растирали в присутствии смеси изопропанола и диэтилового эфира и добавляли 6М раствор хлороводорода в изопропаноле. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6) 2,2-2,4 (м, 2Н), 2,8 (уш.с, 3Н), 3,2-3,7 (м, 10Н), 3,8 (с, 3Н), 4,0 (с, 3Н), 4,6 (м, 2Н), 6,95-7,0 (м, 2Н), 7,08 (с, 1Н), 7,55 (д, 1Н), 7,6 (с, 1Н), 8,8 (с, 1Н), 10,6 (с, 1Н). Масс-спектр: M+H+ 472 и 474.
Применяемый в качестве исходного вещества 1-(3-гидроксипропил)-4-метилпиперазин получали следующим образом.
Смесь 3-бромпропанола (20 мл), N-метилпиперазина (29 мл), карбоната калия (83 г) и этанола (200 мл) перемешивали и нагревали с обратным холодильником в течение 20 часов. Смесь охлаждали до температуры окружающей среды и фильтровали. Фильтрат упаривали и растирали остаток в присутствии диэтилового эфира. Полученную смесь фильтровали и упаривали фильтрат. Остаток очищали путем перегонки с получением требуемого исходного вещества в виде масла. ЯМР-спектр: (CDCl3) 1,72 (м, 2Н), 2,3 (с, 3Н), 2,2-2,8 (м, 8Н), 2,6 (т, 2Н), 3,8 (т, 2Н), 5,3 (уш.с, 1Н).
[2] Продукт реакции растворяли в смеси изопропанола и диэтилового эфира и добавляли 6М раствор хлороводорода в изопропаноле. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида. ЯМР-спектр:(ДМСОd6 и CF3COOD) 1,3-1,5 (м, 2Н), 1,65-1,9 (м, 4Н), 3,02 (т, 2Н), 3,6 (д, 2Н), 3,7 (уш.с, 2Н), 3,8 (с, 3H), 4,02 (с, 3H), 4,9 (уш.с, 2Н), 7,0 (с, 1Н), 7,05 (м, 1Н), 7,1 (с, 1Н), 7,3 (с, 1Н), 7,58 (д, 1Н), 8,8 (с, 1Н). Масс-спектр: M+H+ 443 и 445.
[3] Продукт реакции растворяли в смеси изопропанола и диэтилового эфира и добавляли 6М раствор хлороводорода в изопропаноле. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,9 (м, 2Н), 2,05 (м, 2Н), 2,35 (м, 2Н), 3,02 (м, 2Н), 3,35 (т, 2Н), 3,6 (м, 2Н), 3,8 (с, 3Н), 4,02 (с, 3Н), 4,6 (т, 2Н), 6,95 (д, 1Н), 7,05 (м, 1Н), 7,1 (с, 1Н), 7,5 (д, 1Н), 7,6 (д, 1Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 443 и 445.
Применяемый в качестве исходного вещества N-(3-гидроксипропил)пирролидин получали следующим образом.
Смесь 3-хлорпропанола (66 г), пирролидина (50 г), карбоната калия (145 г) и ацетонитрила (1 л) перемешивали и нагревали с обратным холодильником в течение 20 часов. Смесь охлаждали до температуры окружающей среды и фильтровали. Фильтрат упаривали и очищали остаток путем перегонки с получением требуемого исходного вещества в виде масла (62 г). ЯМР-спектр: (CDCl3) 1,6-1,8 (м, 6Н), 2,55 (уш.с, 4Н), 2,75 (т, 2Н), 3,85 (т, 2Н), 5,5 (уш.с, 1Н).
[4] Продукт осаждали из реакционной смеси путем добавления дополнительного количества метиленхлорида. Продукт выделяли, промывали диэтиловым эфиром и сушили в вакууме. Для полученного таким образом продукта получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 3,82 (с, 3Н), 4,0 (с, 3Н), 4,8 (м, 2Н), 4,85 (м, 2Н), 6,9 (с, 1Н), 7,05 (с, 1Н), 7,1 (м, 1Н), 7,3 (д, 1Н), 7,58 (д, 1Н), 7,65 (с, 1Н), 8,67 (с, 1Н), 8,79 (с, 1Н). Масс-спектр: M+H+ 427 и 429.
Применяемый в качестве исходного вещества N1-(2-гидроксиэтил)-1,2,4-триазол получали в соответствие с методикой, раскрытой в Ann. Pharm. Fr., 1977, 35, 503.
[5] Для продукта получены следующие данные. ЯМР-спектр: (ДМСОd6) 2,1 (м, 2Н), 2,32 (уш.с, 4Н), 2,45 (т, 2Н), 3,52 (м, 4Н), 3,8 (с, 3Н), 4,5 (т, 2Н), 5,3 (с, 2Н), 6,8 (м, 1Н), 6,95 (с, 1Н), 6,92 (с, 1Н), 7,3-7,6 (м, 6Н), 8,35 (с, 1Н), 8,55 (с, 1Н), 10,12 (с, 1Н). Масс-спектр: M+H+ 535 и 537.
Применяемый в качестве исходного вещества 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-гидроксихиназолин получали следующим образом.
Смесь 3,5-дибензилоксианилингидрохлорида (J. Org. Chem., 1975, 40, 1556; 10 г) и оксалилхлорида (15 мл) нагревали до 170°С в течение 3 часов. Смесь охлаждали до температуры окружающей среды, добавляли метанол (45 мл) и нагревали смесь с обратным холодильником в течение 1 часа. Смесь охлаждали до температуры окружающей среды, осадок выделяли, промывали метанолом и сушили в вакууме с получением 4,6-дибензилокси-2,3-диоксоиндолина (8,8 г). ЯМР-спектр: (ДМСОd6) 5,22 (с, 2Н), 5,28 (с, 2Н), 6,12 (с, 1Н), 6,42 (с, 1Н), 7,3-7,55 (м, 10Н), 10,97 (с, 1Н).
Пероксид водорода (30% водный раствор, 13 мл) добавляли по каплям к перемешиваемому раствору 4,6-дибензилокси-2,3-диоксоиндолина (14,3 г) в концентрированном водном растворе гидроксида натрия (22,3 г в 90 мл воды), нагретом до 70°С. Полученную смесь перемешивали при 70°С в течение 30 минут и затем охлаждали до температуры окружающей среды. Добавляли лед и доводили основность смеси до значения рН=9 путем добавления 2н. водной соляной кислоты, а затем подкисляли смесь до значения рН=3,7 путем добавления ледяной уксусной кислоты. Полученный осадок очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (99:1). Таким образом получали 2-амино-4,6-дибензилоксибензойную кислоту (8 г). ЯМР-спектр: (ДМСОd6) 5,05 (с, 2Н), 5,15 (с, 2Н), 6,01 (с, 1Н), 6,05 (с, 1Н), 7,3-7, 6 (м, 10Н).
Диазометан получали с применением методики, аналогичной описанной Lombardi et al., Chemistry & Industry, 1990, 708, из смеси N-метил-N-нитрозо-4-толуолсульфонамида (11,5 г), этанола (60 мл) и насыщенного водного раствора гидроксида натрия (30 мл), и барботировали через раствор 2-амино-4,6-диметоксибензойной кислоты (8 г) в метиленхлориде (170 мл), охлажденном до 0°С. Полученную реакционную смесь упаривали и растирали остаток в присутствии диэтилового эфира. Таким образом получали метил-2-амино-4,6-дибензилоксибензоат (7,7 г). ЯМР-спектр: (ДМСОd6) 3,74 (с, 3Н), 5,07 (с, 2Н), 5,11 (с, 2Н), 6,0 (с, 1Н), 6,04 (с, 1Н), 6,25 (уш.с, 2Н), 7,28-7,5 (м, 10Н).
Смесь метил-2-амино-4,6-дибензилоксибензоата (7,7 г), ацетата формамидина (7,2 г) и 2-метоксиэтанола (100 мл) перемешивали и нагревали с обратным холодильником до тех пор, пока не прореагирует все исходное вещество. Смесь упаривали и растирали остаток в присутствии воды (60 мл). Полученное твердое вещество выделяли, промывали водой и сушили в вакууме с получением 5,7-дибензилокси-З,4-дигидрохиназолин-4-она (6,8 г). ЯМР-спектр: (ДМСОd6) 5,24 (с, 4Н), 6,75 (с, 1Н), 6,8 (с, 1Н), 7,3-7,7 (м, 10Н), 7,95 (с, 1Н), 11,75 (уш.с, 1Н).
Смесь части (6 г) полученного таким образом вещества, фосфорилхлорида (1,72 мл), диизопропилэтиламина (7,3 мл) и 1,2-дихлорэтана (60 мл) перемешивали и нагревали с обратным холодильником в течение 2 часов. Реакционную смесь упаривали, смесь остатка и изопропанола (80 мл) охлаждали до 10°С и поочередно добавляли 2-хлор-5-метоксианилин (3,4 г) и диизопропилэтиламин (1,45 мл). Полученную смесь нагревали с обратным холодильником в течение 1,5 часов. Смесь охлаждали до температуры окружающей среды, полученный осадок выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали 4-(2-хлор-5-метоксианилино)-5,7-дибензилоксихиназолингидрохлорид (6,35 г). ЯМР-спектр: (ДМСОd6) 3,8 (с, 3Н), 5,31 (с, 2Н), 5,65 (с, 2Н), 6,95 (м, 1Н), 7,02 (с, 1Н), 7,15 (с, 1Н), 7,3-7,5 (м, 9Н), 7,6 (д, 2Н), 7,7 (с, 1Н), 8,8 (с, 1Н). Масс-спектр: M+H+ 498 и 500.
Смесь 4-(2-хлор-5-метоксианилино)-5,7-дибензилоксихиназолингидрохлорида (4,3 г), пиридингидрохлорида (0,94 г) и пиридина (90 мл) перемешивали и нагревали с обратным холодильником в течение 9 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Остаток растирали в присутствии воды. Полученный твердый осадок выделяли, промывали водой и сушили в течение ночи в вакууме. Затем вещество растирали в присутствии метанола. Полученное твердое вещество выделяли и сушили в вакууме. Таким образом получали 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-гидроксихиназолин (3,1 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 3,85 (с, 3Н), 5,3 (с, 2Н), 6,85 (с, 2Н), 7,0 (м, 1Н), 7,3-7,6 (м, 6Н), 7,8 (д, 1Н), 8,85 (с, 1Н).
[6] Для продукта получены следующие данные. ЯМР-спектр: (CDCl3) 1,75 (уш.с, 4Н), 2,2 (м, 2Н), 2,5 (уш.с, 4Н), 2,65 (т, 2Н), 3,85 (с, 3Н), 4,4 (т, 2Н), 5,2 (с, 2Н), 6,62 (д, 1Н), 6,7 (с, 1Н), 6,95 (с, 1Н), 7,2-7,5 (м, 6Н), 8,4 (с, 1Н), 8,6 (с, 1Н), 10,1 (с, 1Н). Масс-спектр: М+Н+ 519.
[7] Продукт реакции растирали в присутствии диэтилового эфира, добавляли 6,3 М раствор хлороводорода в изопропаноле и перемешивали смесь при температуре окружающей среды в течение 1 часа. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида, для которого получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 2,3-2,45 (м, 2Н), 3,1 (т, 2Н), 3,3 (т, 2Н), 3,45 (д, 2Н), 3,75 (т, 2Н), 3,81 (с, 3Н), 4,0 (д, 2Н), 4,68 (т, 2Н), 7,08 (м, 1Н), 7,5-7,7 (м, 4Н), 8,1 (м, 1Н), 8,95 (с, 1Н). Масс-спектр: M+H+ 473 и 475.
Применяемый в качестве исходного вещества 4-(2-бром-5-метоксианилино)-5-гидроксихиназолин получали следующим образом.
Смесь 5-метокси-3,4-дигидрохиназолин-4-она (заявка на выдачу международного патента WO 96/09294, страницы 28 и 29; 2,1 г), фосфорилхлорида (1,23 мл), диизопропилэтиламина (5,2 мл) и 1,2-дихлорэтана (20 мл) перемешивали и нагревали до 80°С в течение 3 часов. Смесь упаривали. Остаток растворяли в изопропаноле (20 мл) и поочередно добавляли 2-бром-5-метоксианилин (J.Amer. Chem. Soc., 1994, 116, 11797; 2,45 г) и 6М раствор хлороводорода в изопропаноле (0,33 мл). Полученную смесь нагревали до 80°С в течение 1,5 часов. Смесь охлаждали до температуры окружающей среды, полученный осадок выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали 4-(2-бром-5-метоксианилино)-5-метоксихиназолингидрохлорид (3,8 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 3,82 (с, 3Н), 4,2 (с, 3Н), 7,0 (м, 1Н), 7,48 (д, 1Н), 7,5 (д, 1Н), 7,55 (д, 1Н), 7,75 (д, 1Н), 8,1 (м, 1Н), 7,92 (с, 1Н). Масс-спектр: М+Н+ 360 и 362.
Смесь 4-(2-бром-5-метоксианилино)-5-метоксихиназолингидрохлорида (3,5 г), пиридингидрохлорида (2 г) и пиридина (30 мл) перемешивали и нагревали с обратным холодильником в течение 18 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Остаток суспендировали в воде. Смесь подщелачивали до значения рН=11 путем добавления раствора концентрированного гидроксида аммония и перемешивали в течение 1 часа. Полученный осадок выделяли, промывали водой и диэтиловым эфиром и сушили в вакууме. Таким образом получали 4-(2-бром-5-метоксианилино)-5-гидроксихиназолин (2,15 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 3,8 (с, 3Н), 6,95 (м, 1Н), 7,25 (д, 1Н), 7,3 (д, 1Н), 7,7 (с, 1Н), 7,75 (д, 1Н), 7,9 (м, 1Н), 8,9 (с, 1Н). Масс-спектр: M+H+ 346 и 348.
[8] С применением обработки, сходной с описанной выше в Примечании [7], получали продукт в виде дигидрохлорида, для которого получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 2,4-2,5 (м, 2Н), 3,5 (м, 2Н), 3,7 (уш.с, 4Н), 3,72-3,9 (уш.с, 4Н), 3,8 (с, 3Н), 4,7 (т, 2Н), 7,0 (м, 1Н), 7,4-7,6 (м, 3Н), 7,75 (д, 1Н), 8,1 (м, 1Н), 9,02 (с, 1Н). Масс-спектр: М+Н+ 521 и 523.
Применяемый в качестве исходного вещества 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропан-1-ол получали следующим образом.
Смесь 3-аминопропан-1-ола (0,650 мл) и дивинилсульфона (1 г) нагревали до 110°С в течение 45 минут. Смесь охлаждали до температуры окружающей среды и очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (19:1). Таким образом получали 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропан-1-ол (0,8 г). ЯМР-спектр: (CDCl3) 1,7-1,8 (м, 2Н), 2,73 (т, 2Н), 3,06 (уш.с, 8Н), 3,25 (с, 1Н), 3,78 (т, 2Н). Масс-спектр: M+H+ 194.
[9] С применением обработки, сходной с описанной выше в Примечании [7], получали продукт в виде дигидрохлорида, для которого получены следующие данные. Масс-спектр: М+Н+ 472 и 474.
Применяемый в качестве исходного вещества 1-(2-гидроксиэтил)-4-метилпиперазин получали следующим образом.
Смесь 2-бромэтанола (2,36 г), N-метилпиперазина (1,26 г), карбоната калия (5,0 г) и этанола (150 мл) перемешивали и нагревали с обратным холодильником в течение 18 часов. Смесь охлаждали до температуры окружающей среды и фильтровали. Фильтрат упаривали и растирали остаток в присутствии смеси метиленхлорида и ацетона. Полученную смесь фильтровали и фильтрат упаривали с получением требуемого исходного вещества в виде масла (0,87 г). ЯМР-спектр: (CDCl3) 2,18 (с, 3Н), 2,3-2,7 (brm, 8Н), 2,56 (т, 2Н), 3,61 (т, 2Н).
[10] С применением обработки, сходной с описанной выше в Примечании [7], получали продукт в виде дигидрохлорида, для которого получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 2,35-2,45 (м, 2Н), 2,9 (с, 33H), 3,2-3,9 (м, 10Н), 3,85 (с, 3Н), 4,7 (т, 2Н), 7,05 (м, 1Н), 7,45-7,6 (м, 4Н), 8,1 (м, 1Н), 8,95 (с, 1Н). Масс-спектр: М+Н+ 442 и 444.
[11] С применением обработки, сходной с описанной выше в Примечании [7], получали продукт в виде дигидрохлорида, для которого получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 3,82 (с, 3Н), 4,85 (т, 2Н), 5,05 (т, 2Н), 7,05 (м, 1Н), 7,35 (д, 1Н), 7,5-7,65 (м, 3Н), 7,7 (с, 1Н), 7,8 (с, 1Н), 8,1 (м, 1Н), 8,95 (с, 1Н), 9,15 (с, 1Н). Масс-спектр: М+Н+ 396 и 398.
Применяемый в качестве исходного вещества N-(2-гидроксиэтил)имидазол получали в соответствие с методикой, раскрытой в J. Med. Chem., 1993, 25, 4052.
[12] 4-Гидрокси-1-метилпиперидин добавляли после перемешивания остальных реагентов при 0°С в течение 1 часа. Полученную реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Реакционную смесь фильтровали и промывали фильтрат 1н. водным раствором гидроксида натрия. Органический раствор упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (98:2). Полученное таким образом вещество растирали в присутствии 6М раствора хлороводорода в диэтиловом эфире. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида, для которого получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 2,0-2,15 (м, 2Н), 2,15-2,3 (м, 4Н), 2,35 (с, 3Н), 2,8-2,9 (м, 2Н), 3,85 (с, 3Н), 3,95 (с, 3Н), 4,55 (м, 1Н), 6,55 (с, 1Н), 6,65 (м, 1Н), 6,85 (с, 1Н), 7,3 (д, 1Н), 8,15 (д, 1Н), 8,55 (с, 1Н), 9,85 (уш.с, 1Н). Масс-спектр: M+H+ 429 и 431.
[13] С применением обработки, сходной с описанной выше в Примечании [7], получали продукт в виде дигидрохлорида, для которого получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) (были обнаружены два конформера в соотношении приблизительно 3:2) 2,2-2,4 (м, 2Н), 2,5 (д, 2Н), 2,85 (с, 3Н), 3,1-3,3 (м, 2Н), 3,4-3,5 (м, 0,5Н минорный конформер), 3,55-3,7 (д, 1Н основной конформер и 0,5Н минорный конформер), 2,8 (с, 3Н), 5,1-5,2 (м, 1Н основной конформер), 5,2-5,3 (м, 1Н минорный конформер), 7,05 (м, 1Н основной конформер), 7,1 (м, 1Н минорный конформер), 7,4-7,8 (м, 4Н), 8,05-8,15 (м, 1Н), 8,95 (с, 1Н минорный конформер), 9,0 (с, 1Н основной конформер). Масс-спектр: М+Н+ 399 и 401.
[14] С применением обработки, сходной с описанной выше в Примечании [7], получали продукт в виде дигидрохлорида, для которого получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) (были обнаружены два конформера в соотношении приблизительно 3:2) 2,2-2,4 (м, 2Н), 2,4-2,65 (м, 2Н), 2,8 (с, 3Н основной конформер), 2,82 (с, 3Н минорный конформер), 3,1-3,3 (м, 2Н), 3,45 (м, 0,5Н минорный конформер), 3,5-3,7 (м, 0,5Н минорный конформер), 3,8 (с, 3Н), 5,1-5,2 (м, 1Н основной конформер), 5,25 (уш.с, 1Н минорный конформер), 7,0 (м, 1Н основной конформер), 7,05 (м, 1Н минорный конформер), 7,4-7,8 (м, 4Н), 8,12 (м, 1Н), 8,9 (с, 1Н минорный конформер), 9,0 (с, 1Н). Масс-спектр: M+H+ 443 и 445.
[15] С применением обработки, сходной с описанной выше в Примечании [7], получали продукт в виде дигидрохлорида, для которого получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) (были обнаружены два конформера в соотношении приблизительно 3:2) 2,15-2,3 (м, 2Н), 2,4-2,52 (м, 2Н), 2,85 (с, 3Н), 3,1-3,3 (м, 2Н), 3,4-3,5 (м, 0,5Н минорный конформер), 3,6-3,7 (м, 1Н минорный конформер, 0,5Н минорный конформер), 5,1-5,2 (м, 1Н), 5,2-5,3 (м, 1Н минорный конформер), 7,5-7,6 (м, 2Н), 7,6-7,8 (м, 2Н), 8,0-8,25 (м, 2Н), 9,0 (с, 1Н минорный конформер), 9,1 (с, 1Н основной конформер). Масс-спектр: М+Н+ 402 и 404.
Применяемый в качестве исходного вещества 4-(2,5-дихлоранилино)-5-гидроксихиназолин получали следующим образом.
Смесь 5-метокси-3,4-дигидрохиназолин-4-она (1,8 г), фосфорилхлорида (1,03 мл), диизопропилэтиламина (4,4 мл) и 1,2-дихлорэтана (20 мл) перемешивали и нагревали до 80°С в течение 3 часов. Смесь упаривали. Остаток растворяли в изопропаноле (20 мл) и поочередно добавляли 2,5-дихлоранилин (1,95 г) и 6М раствор хлороводорода в изопропаноле (0,33 мл). Полученную смесь нагревали до 80°С в течение 1,5 часов. Смесь охлаждали до температуры окружающей среды, полученный осадок выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали 4-(2, 5-дихлоранилино)-5-метоксихиназолингидрохлорид (3,2 г). ЯМР-спектр: (ДМСОd6) 4,19 (с, 3Н), 7,45 (д, 1Н), 7,5-7,6 (м, 2Н), 7,75 (д, 1Н), 8,05-8,15 (м, 2Н), 8,95 (с, 1Н).
Смесь 4-(2,5-дихлоранилино)-5-метоксихиназолингидрохлорида (3,2 г), пиридингидрохлорида (2,1 г) и пиридина (30 мл) перемешивали и нагревали с обратным холодильником в течение 18 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Остаток суспендировали в воде. Смесь подщелачивали до значения рН=11 путем добавления концентрированного раствора гидроксида аммония и перемешивали в течение 1 часа. Полученный осадок выделяли, промывали водой и диэтиловым эфиром и сушили в вакууме. Таким образом получали 4-(2,5-дихлоранилино)-5-гидроксихиназолин (1,3 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 7,25 (д, 1Н), 7,3 (д, 1Н), 7,5 (т, 1Н), 7,7 (д, 1Н), 7,95 (т, 1Н), 8,3 (с, 1Н), 9,0 (с, 1Н). Масс-спектр: M+H+ 306 и 308.
[16] Для продукта получены следующие данные. ЯМР-спектр: (CDCl3) 1,2-1,4 (м, 2Н), 1,5 (с, 9Н), 1,9 (д, 2Н), 2,3 (м, 1Н), 2,8 (т, 2Н), 3,9 (с, 3Н), 4,1-4,2 (м, 2Н), 4,2 (д, 2Н), 6,66 (м, 1Н), 6,93 (д, 1Н), 7,7 (м, 1Н), 8,45 (д, 1Н), 8,7 (с, 1Н). Масс-спектр: М+Н+ 499 и 501.
Применяемый в качестве исходного вещества 4-(2-хлор-5-метоксианилино)-5-гидроксихиназолин получали следующим образом.
Смесь 5-метокси-3,4-дигидрохиназолин-4-она (2,1 г), фосфорилхлорида (1,23 мл), диизопропилэтиламина (5,2 мл) и 1,2-дихлорэтана (20 мл) перемешивали и нагревали до 80°С в течение 3 часов. Смесь упаривали. Остаток растворяли в изопропаноле (20 мл) и поочередно добавляли 2-хлор-5-метоксианилин (1,9 г) и 6М раствор хлороводорода в изопропаноле (0,33 мл). Полученную смесь нагревали до 80°С в течение 1,5 часов. Смесь охлаждали до температуры окружающей среды, полученный осадок выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали 4-(2-хлор-5-метоксианилино)-5-метоксихиназолингидрохлорид (3,4 г). ЯМР-спектр: (ДМСОd6) 3,8 (с, 3Н), 4,17 (с, 3Н), 7,02 (м, 1Н), 7,43 (д, 1Н), 7,6 (м, 3Н), 8,07 (м, 1Н), 8,9 (с, 1Н).
Смесь полученного таким образом вещества, пиридингидрохлорида (1,1 г) и пиридина (30 мл) перемешивали и нагревали с обратным холодильником в течение 18 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Остаток суспендировали в воде. Смесь подщелачивали до значения рН=11 путем добавления концентрированного раствора гидроксида аммония и перемешивали в течение 1 часа. Полученный осадок выделяли, промывали водой и диэтиловым эфиром и сушили в вакууме. Таким образом получали 4-(2-хлор-5-метоксианилино)-5-гидроксихиназолин (1,4 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 3,83 (с, 3Н), 7,01 (м, 1Н), 7,25 (д, 1Н), 7,3 (д, 1Н), 7,6 (д, 1Н), 7,82 (д, 1Н), 7,92 (м, 1Н), 8,95 (с, 1Н). Масс-спектр: М+Н+ 302 и 304.
Применяемый в качестве исходного вещества N-трет-бутоксикарбонил)пиперидин-4-илметанол получали следующим образом.
Раствор ди-трет-бутилдикарбоната (41,7 г) в этилацетате (75 мл) добавляли по каплям к перемешиваемому раствору этилпиперидин-4-карбоксилата (30 г) в этилацетате (150 мл), охлажденном до 0-5°С в ледяной бане. Полученную смесь перемешивали при температуре окружающей среды в течение 48 часов. Смесь вливали в воду (300 мл). Органический слой выделяли, поочередно промывали водой (200 мл), 0,1н. водным раствором соляной кислоты (200 мл), насыщенным водным раствором бикарбоната натрия (200 мл) и насыщенным соляным раствором (200 мл), сушили над сульфатом магния и упаривали. Таким образом получали этил-N-(трет-бутоксикарбонил)пиперидин -4-карбоксилат (48 г). ЯМР-спектр: (CDCl3) 1,25 (т, 3Н), 1,45 (с, 9Н), 1,55-1,7 (м, 2Н), 1,8-2,0 (д, 2Н), 2,35-2,5 (м, 1Н), 2,7-2,95 (т, 2Н), 3,9-4,1 (уш.с, 2Н), 4,15 (кв, 2Н).
Раствор полученного таким образом вещества в ТГФ (180 мл) охлаждали до 0°С и по каплям добавляли литийалюминийгидрид (1М раствор в ТГФ; 133 мл). Смесь перемешивали при 0°С в течение 2 часов. Поочередно добавляли воду (30 мл) и 2н. водный раствор гидроксида натрия (10 мл) и перемешивали смесь в течение 15 минут. Полученную смесь фильтровали через диатомовую землю и промывали твердые вещества этилацетатом. Фильтрат поочередно промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Таким образом получали N-(трет-бутоксикарбонил)пиперидин-4-илметанол (36,3 г). ЯМР-спектр: (CDCl3) 1,05-1,2 (м, 2Н), 1,35-1,55 (м, 10Н), 1,6-1,8 (м, 2Н), 2,6-2,8 (т, 2Н), 3,4-3,6 (т, 2Н), 4,0-4,2 (уш.с, 2Н).
[17] Для продукта получены следующие данные. ЯМР-спектр: (CDCl3) 1,2-1,35 (м, 2Н), 1,5 (с, 9Н), 1,9 (д, 2Н), 2,35 (м, 1Н), 2,75 (т, 2Н), 3,85 (с, 3Н), 4,05-4,2 (м, 2Н), 4,2 (д, 2Н), 6,62 (м, 1Н), 6,95 (д, 1Н), 7,7 (м, 1Н), 8,25 (д, 1Н), 8,7 (с, 1Н). Масс-спектр: M+H+ 543 и 545.
Применяемый в качестве исходного вещества 4-(2-бром-5-метоксианилино)-5-гидроксихиназолин получали из 5-метокси-3,4-дигидрохиназолин-4-она в соответствие с методиками, описанными непосредственно выше в части Примечания [16], используя 2-бром-5-метоксианилин вместо 2-хлор-5-метоксианилина.
[18] Для продукта получены следующие данные. ЯМР-спектр: (ДМСОd6) 3,25 (с, 3Н), 3,79 (с, 3Н), 3,83 (м, 2Н), 3,98 (с, 3H), 4,58 (м, 2Н), 6,95 (с, 1Н), 7,0 (м, 1Н), 7,07 (с, 1Н), 7,55 (м, 2Н), 8,8 (с, 1Н), 10,64 (с, 1Н). Масс-спектр: М+Н+ 390 и 392.
[19] Продукт реакции растирали в присутствии смеси изопропанола и диэтилового эфира и добавляли 6М раствор хлороводорода в изопропаноле. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида. ЯМР-спектр: (CDCl3) 2,2-2,3 (м, 1Н), 2,4 (с, 3Н), 2,4-2,5 (м, 1Н), 2,5-2,6 (м, 1Н), 2,8-2,9 (м, 1Н), 2,95-3,1 (м, 2Н), 3,85 (с, 3Н), 3,95 (с, 3Н), 5,05 (м, 1Н), 6,42 (с, 1Н), 6,65 (м, 1Н), 6,88 (с, 1Н), 7,5 (д, 1Н), 7,9 (д, 1Н), 8,55 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: M+H+ 459 и 461.
Применяемый в качестве исходного вещества 4-(2-бром-5-метоксианилино)-5-гидрокси-7-метоксихиназолин получали следующим образом.
С применением методик, аналогичных описанным в последнем параграфе Примера 1 в той его части, которая касается получения исходных продуктов, проводили взаимодействие 5,7-диметокси-3,4-дигидрохиназолин-4-она (3 г) с фосфорилхлоридом (1,5 мл) и проводили взаимодействие полученного продукта с 2-бром-5-метоксианилином (3,53 г). Таким образом получали 4-(2-бром-5-метоксианилино)-5,7-диметоксихиназолингидрохлорид (5 г). ЯМР-спектр: (ДМСОd6) 3,8 (с, 3Н), 4,0 (с, 3Н), 4,18 (с, 3Н), 6,95 (м, 3H), 7,6 (уш.с, 1Н), 7,7 (д, 1Н), 7,8 (с, 1Н), 10,85 (с, 1Н). Масс-спектр: M+H+ 391 и 393.
Смесь полученного таким образом вещества, пиридингидрохлорида (1,4 г) и пиридина (100 мл) перемешивали и нагревали с обратным холодильником в течение 6 часов. По частям добавляли вторую часть (2,8 г) пиридингидрохлорида и дополнительно нагревали смесь с обратным холодильником в течение 18 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Полученное таким образом вещество растирали в присутствии воды. Осадок выделяли и промывали метиленхлоридом (100 мл) в течение 1 часа. Твердое вещество выделяли и сушили в вакууме. Таким образом получали 4-(2-бром-5-метоксианилино)-5-гидрокси-7-метоксихиназолин (39 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 3,75 (с, 3Н), 3,9 (с, 3Н), 6,75 (с, 2Н), 6,92 (м, 1Н), 7,58-7,7 (м, 2Н), 8,8 (с, 1Н).
[20] В качестве подходящего спирта применяли 4-гидрокситетрагидропиран. Для продукта получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,75-1,9 (м, 2Н), 2,15 (д, 2Н), 3,5 (т, 2Н), 3,8 (с, 3Н), 3,9 (м, 2Н), 5,05 (м, 1Н), 5,3 (с, 2Н), 5,8 (м, 1Н), 6,95 (д, 1Н), 7,05 (д, 1Н), 7,3-7,6 (м, 6Н), 8,1 (д, 1Н), 8,5 (с, 1Н), 9,85 (с, 1Н). Масс-спектр: М+Н+ 492 и 494.
[21] Продукт реакции растворяли в диэтиловом эфире и добавляли 6М раствор хлороводорода в диэтиловом эфире (0,1 мл). Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде гидрохлорида, для которого получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,9-2,05 (м, 2Н), 2,18 (д, 2Н), 3,55 (т, 2Н), 3,82 (с, 3H), 3,95 (м, 2Н), 5,15 (м, 1Н), 7,05 (м, 1Н), 7,5 (д, 1Н), 7,58 (д, 2Н), 7,65 (д, 1Н), 8,05 (м, 1Н), 8,95 (с, 1Н). Масс-спектр: М+Н+ 386 и 388.
[22] Для продукта получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 2,2-2,3 (м, 1Н), 2,35-2,5 (м, 1Н), 3,8 (с, 3Н), 3,8-3,9 (м, 1Н), 3,9-4,0 (м, 2Н), 4,2 (д, 1Н), 5,4 (с, 2Н), 5,6 (уш.с, 1Н), 7,01 (д, 1Н), 7,05 (с, 1Н), 7,18 (с, 1Н), 7,42 (д, 1Н), 7,45 (м, 2Н), 7,52 (с, 1Н), 7,55 (д, 2Н), 7,6 (д, 1Н), 8,9 (с, 1Н). Масс-спектр: M+H+ 477 и 479.
[23] Для продукта получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,9-2,0 (м, 2Н), 2,15-2,25 (м, 1Н), 2,3-2,5 (м, 5Н), 2.5 (т, 2Н), 3,6 (т, 4Н), 3,8 (с, 3Н), 3,9-4,0 (м, 3Н), 4,1 (д, 1Н), 4,2 (т, 2Н), 5,45 (т, 1Н), 6,75-6,8 (м, 2Н), 6,85 (с, 1Н), 7,45 (д, 1Н), 8,1 (с, 1Н), 8,5 (с, 1Н), 9,72 (с, 1Н). Масс-спектр: М+Н+ 515 и 517.
[24] Для продукта получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,9-2,0 (м, 2Н), 2,14 (с, 3Н), 2,15-2,35 (м, 2Н), 2,2-2,6 (м, 10Н), 3,8 (с, 3Н), 3,85-4,0 (м, 3Н), 4,12 (д, Ш), 4,2 (т, 2Н), 5,45 (т, 1Н), 7,75-7,8 (м, 2Н), 7,85 (с, 1Н), 7,45 (д, 1Н), 8,1 (с, 1Н), 8,5 (с, 1Н), 9,72 (с, 1Н). Масс-спектр: M+H+ 528 и 530.
[25] Для продукта получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,5 (д, 6Н), 3,82 (с, 3Н), 5,2 (м, 1Н), 5,4 (с, 2Н), 6,98 (с, 1Н), 7,0 (м, 1Н), 7,18 (с, 1Н), 7,4 (д, 1Н), 7,45 (м, 2Н), 7,5-7,6 (м, 2Н), 7,65 (д, 1Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 449 и 451.
[26] Продукт реакции растворяли в метиленхлориде (2 мл), содержащем несколько капель метанола, и добавляли 6М раствор хлороводорода в диэтиловом эфире (2 эквивалента). Добавляли диэтиловый эфир (50 мл), полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде гидрохлорида (0,135 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,9-2,1,(м, 2Н), 2,1-2,2 (м, 2Н), 3,55 (м, 2Н), 3,79 (с, 3Н), 3,92 (м, 2Н), 4,0 (с, 3Н), 5,15 (м, 1Н), 6,9 (с, 1Н), 6,95 (м, 1Н), 7,15 (д, 1Н), 7,45 (д, 1Н), 7,7 (д, 1Н), 8,85 (с, 1Н). Масс-спектр: М+Н+ 460 и 462.
[27] Продукт реакции растирали в присутствии 5М раствора хлороводорода в изопропаноле. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3СО2D) 1,9 (м, 2Н), 2,05 (м, 2Н), 2,35 (м, 2Н), 3,05 (м, 2Н), 3,3 (м, 2Н), 3,6 (м, 2Н), 4,05 (с, 3H), 4,65 (т, 2Н), 6,15 (с, 2Н), 6,95 (д, 1Н), 7,1 (м, 2Н), 7,15 (д, 1Н), 8,85 (с, 1Н). Масс-спектр: М+H+ 457 и 459.
Применяемый в качестве исходного вещества 4-(6-хлор-2,3-метилендиоксианилино)-5-гидрокси-7-метоксихиназолин получали следующим образом.
Фосфорилхлорид (2,7 мл) добавляли по каплям к смеси 5,7-диметокси-3,4-дигидрохиназолин-4-она (1 г), диизопропилэтиламина (2,27 мл) и 1,2-дихлорэтана (20 мл) и полученную смесь перемешивали и нагревали до 80°С в течение 3 часов. Смесь упаривали. Таким образом получали 4-хлор-5,7-диметоксихиназолин, который использовали без дополнительной очистки. Полученное таким образом вещество суспендировали в изопропаноле (14 мл) и поочередно добавляли 6-хлор-2,3-метилендиоксианилин (Пример 17, Примечание [30]; 0,915 г) и 5н. раствор хлороводорода в изопропаноле (0,97 мл). Реакционную смесь перемешивали и нагревали до 90°С в течение 1,5 часов. Смесь охлаждали до температуры окружающей среды, осадок выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Полученное таким образом вещество растворяли в смеси метиленхлорида и метанола и добавляли насыщенный метанольный раствор аммиака. Полученную смесь фильтровали и упаривали фильтрат. Таким образом получали 4-(6-хлор-2,3-метилендиоксианилино)-5,7-диметоксихиназолин (1,36 г). ЯМР-спектр: (ДМСОd6) 3,95 (с, 3Н), 4,1 (с, 3Н), 6,1 (с, 2Н), 6,85 (д, 1Н), 6,9 (д, 1Н), 7,05 (д, 1Н), 7,1 (д, 1Н), 8,65 (с, 1Н).
Пиридин (0,54 мл) растворяли в метиленхлориде (5 мл) и добавляли 5н. раствор хлороводорода в изопропаноле (1,34 мл). Спустя несколько минут смесь упаривали. Добавляли пиридин (24 мл), затем 4-(6-хлор-2,3-метилендиоксианилино)-5,7-диметоксихиназолин (1,2 г) и нагревали реакционную смесь до 125°С в течение 6 часов. Полученную смесь упаривали и растирали остаток в присутствии воды. Полученное твердое вещество выделяли, промывали водой и сушили в вакууме. Полученное таким образом вещество очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и ацетонитрила (7:3). Таким образом получали 4-(6-хлор-2,3-метилендиоксианилино)-5-гидрокси-7-метоксихиназолин (0,72 г). ЯМР-спектр: (ДМСОd6 и CF3СО2D) 3,9 (с, 3Н), 6,15 (с, 2Н), 6,75 (м, 2Н), 7,05 (д, 1Н), 7,1 (д, 1Н), 8,75 (с, 1Н).
[28] Продукт реакции растирали в присутствии 5М раствора хлороводорода в изопропаноле. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3СО2D) 2,35 (м, 2Н), 2,9 (с, 3Н), 3,2-4,0 (м, 10Н), 4,05 (с, 3Н), 4,65 (т, 2Н), 6,15 (с, 2Н), 6,95 (д, 1Н), 7,1 (м, 3Н), 8,85, (с, 1Н). Масс-спектр: М+Н+ 486 и 488.
Пример 3
4-(2-Бром-5-метоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин
Смесь 4-хлор-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолина (0,11 г), 2-бром-5-метоксианилингидрохлорида (0,099 г) и изопропанола (8 мл) перемешивали и нагревали до 80°С в течение 30 минут. Смесь упаривали и растирали остаток в присутствии минимального объема изопропанола. Полученное твердое вещество выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали указанное в заголовке соединение в виде дигидрохлорида (0,06 г). Образец продукта обрабатывали насыщенным метанольным раствором аммиака. Смесь фильтровали и упаривали фильтрат с получением указанного в заголовке соединения в форме свободного основания. ЯМР-спектр: (CDCl3) 2,15-2,25 (м, 6Н), 2,35 (с, 3Н), 2,9 (м, 2Н), 3,84 (с, 3Н), 3,93 (с, 3Н), 4,6 (уш.с, 1Н), 6,62 (с, 1Н), 6,6 (м, 1Н), 6,85 (с, 1Н), 7,5 (д, 1Н), 7,9 (с, 1Н), 8,55 (с, 1Н), 9,64 (уш.с, 1Н). Масс-спектр: М+Н+ 473 и 475.
Применяемый в качестве исходного вещества 4-хлор-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин получали следующим образом.
Пиридин (40 мл) добавляли по каплям к бромиду магния (3,6 г), охлажденному до 0°С. Добавляли 5,7-диметокси-З,4-дигидрохиназолин-4-он (4 г) и нагревали смесь с обратным холодильником в течение 15 минут. Смесь упаривали и перемешивали остаток со смесью ледяной уксусной кислоты (12 мл) и воды (80 мл) в течение 10 минут. Полученное твердое вещество выделяли, промывали водой и сушили в вакууме при 50°С. Таким образом получали 5-гидрокси-7-метокси-3,4-дигидрохиназолин-4-он (3,75 г). ЯМР-спектр: (ДМСОd6) 3,95 (с, 3H), 6,45 (с, 1Н), 6,62 (с, 1Н), 8,1 (с, 1Н).
Часть (1,8 г) полученного таким образом вещества добавляли к перемешиваемой суспензии гидрида натрия (0,79 г 60% дисперсии в минеральном масле, промытом ТГФ) в ДМФ (18 мл). Смесь перемешивали при температуре окружающей среды в течение 1 часа. Смесь охлаждали до 0°С и по каплям добавляли хлорметилпивалат (1,62 мл). Смесь перемешивали при температуре окружающей среды в течение 1 часа, добавляли к смеси ледяной уксусной кислоты (50 мл) и воды (200 мл) и перемешивали при температуре окружающей среды в течение 5 минут. Полученный осадок выделяли, промывали водой и сушили в течение ночи в вакууме. Твердое вещество растирали в присутствии пентана, выделяли и сушили в вакууме. Таким образом получали 5-гидрокси-7-метокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-он (2,5 г). ЯМР-спектр: (CDCl3) 1,2 (с, 9Н), 3,9 (с, 3Н), 5,88 (с, 2Н), 6,5 (с, 1Н), 6,68 (с, 1Н), 8,15 (с, 1Н), 11,36 (с, 1Н).
Раствор ди-трет-бутилазодикарбоксилата (1,7 г) в метиленхлориде (5 мл) добавляли к перемешиваемой смеси 5-гидрокси-7-метокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-она (1,5 г), трифенилфосфина (1,9 г), 4-гидроксилметилпиперидина (0,675 г) и метиленхлорида (20 мл), охлажденного до 5°С. Смесь перемешивали при температуре окружающей среды в течение 1 часа. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида, этилацетата и насыщенного метанольного раствора аммиака (9:10:1). Полученное таким образом вещество растирали в присутствии диэтилового эфира. Полученное твердое вещество промывали диэтиловым эфиром и сушили в вакууме с получением 7-метокси-5-(N-метилпиперидин-4-илокси)-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-она (1,75 г). ЯМР-спектр: (CDCl3) 1,2 (с, 9Н), 2,05 (уш.с, 4Н), 2,3 (с, 3Н), 2,3-2,42 (м, 2Н), 2,7-2,8 (м, 2Н), 3,9 (с, 3Н), 4,48 (м, 1Н), 5,9 (с, 2Н), 6,5 (д, 1Н), 6,71 (д, 1Н), 8,18 (с, 1Н).
Смесь полученного таким образом вещества и насыщенного метанольного раствора аммиака (100 мл) перемешивали при температуре окружающей среды в течение 15 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали 7-метокси-5-(N-метилпиперидин-4-илокси)-3,4-дигидрохиназолин-4-он (0,855 г). ЯМР-спектр: (ДМСОd6) 1,7 (м, 2Н), 1,9 (м, 2H), 2,15 (с, 3Н), 1,15-1,25 (м, 2Н), 2,55-2,7 (м, 2Н), 3,85 (с, 3Н), 4,5 (м, 1Н), 6,55 (д, 1Н), 6,65 (д, 1Н), 7,89 (с, 1Н), 11,62 (уш.с, 1Н).
Смесь 7-метокси-5-(N-метилпиперидин-4-илокси)-3,4-дигидрохиназолин-4-она (0,65 г), трифенилфосфина (1,18 г), тетрахлорида углерода (0,45 мл) и метиленхлорида (25 мл) перемешивали и нагревали с обратным холодильником в течение 2 часов. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь этилацетата, метиленхлорида и насыщенного метанольного раствора аммиака (10:9:1). Полученное таким образом вещество растирали в присутствии пентана, полученное твердое вещество выделяли и сушили в вакууме. Таким образом получали 4-хлор-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин (0,5 г). ЯМР-спектр: (CDCl3) 1,95-2,15 (м, 4Н), 2,3 (с, 3Н), 2,3-2,45 (м, 2Н), 2,6-2,8 (м, 2Н), 3,92 (с, 3Н), 4,55 (уш.с, 1Н), 6,56 (с, 1Н), 6,9 (с, 1Н), 8,77 (с, 1Н).
Пример 4
С применением методики, аналогичной описанной в Примере 3, проводили взаимодействие подходящего 4-хлорхиназолина с подходящим анилином с получением соединения, описанного в Таблице II.
| Таблица II |
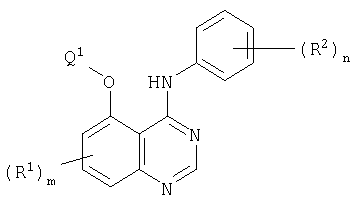 |
| № и примечание |
(R1)m |
Q1 |
(R2)n |
| [1] |
7-метокси |
N-метилпиперидин-4-ил |
2,4-дихлор-5-метокси |
| [2] |
7-метокси |
N-метилпиперидин-4-ил |
2-фтор-4-хлор-5-метокси |
| [3] |
7-(2-пирролидин-1-илэтокси) |
4-тетрагидропиранил |
2,5-диметокси |
| [4] |
7-метокси |
N-метилпиперидин-4-ил |
6-хлор-2,3-метилендиокси |
| [5] |
7-фтор |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [6] |
7-(2-пирролидин-1-илэтокси) |
4-тетрагидропиранил |
2,3-этилендиокси |
| [7] |
7-метокси |
N-метилпиперидин-4-ил |
2,3-этилендиокси |
| [8] |
7-метокси |
пиперидин-4-ил |
2,3-этилендиокси |
ПРИМЕЧАНИЯ
[1] Продукт реакции получали в виде дигидрохлорида, из которого с применением методики, аналогичной описанной в Примере 3, выделяли свободное основание. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,15 (м, 2Н), 2,15-2,3 (м, 4Н), 2,32 (м, 3Н), 2,85 (м, 2Н), 3,92 (с, 3Н), 3,95 (с, 3Н), 4,55 (м, 1Н), 6,56 (д, 1Н), 6,86 (д, 1Н), 7,42 (с, 1Н), 8,31 (с, 1Н), 8,56 (с, 1Н), 9,87 (с, 1Н). Масс-спектр: М+Н+ 463 и 465.
[2] Продукт реакции получали в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6 и NaOD) 1,9-2,1 (м, 2Н), 2,2-2,35 (м, 2Н), 2,6 (с, 3Н), 2,6 (м, 2Н), 3,1-3,2 (м, 2Н), 3,92 (с, 3Н), 3,95 (с, 3Н), 4,95 (м, 1Н), 6,92 (с, 1Н), 6,95 (с, 1Н), 7,6 (д, 1Н), 8,6 (с, 1Н), 8,7 (уш.с, 1Н). Масс-спектр: M+H+ 447 и 449.
Применяемый в качестве исходного вещества 4-хлор-2-фтор-5-метоксианилин получали следующим образом.
6н. водный раствор гидроксида натрия (17 мл) добавляли по каплям к перемешиваемому раствору 4-хлор-2-фтор-5-метоксикарбонилокси-1-нитробензола (J.Med. Chem., 1999, 42, 5369; 25 г) в метаноле (200 мл), охлажденном до 5°С. Реакционную смесь перемешивали при температуре окружающей среды в течение 30 минут. Добавляли 12н. водный раствор соляной кислоты (8,5 мл) и упаривали смесь. Остаток распределяли между метиленхлоридом и водой. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали с получением 4-хлор-2-фтор-5-гидрокси-1-нитробензола (18,5 г). ЯМР-спектр: (CDCl3) 5,8 (уш.с, 1Н), 7,35 (д, 1Н), 7,75 (д, 1Н).
Диметилсульфат (10,5 мл) добавляли к перемешиваемой смеси 4-хлор-2-фтор-5-гидрокси-1-нитробензола (14 г), карбоната калия (13 г) и ДМФ (70 мл) и перемешивали реакционную смесь при температуре окружающей среды в течение 16 часов. Смесь вливали в воду (500 мл), полученный осадок выделяли и сушили в вакууме. Полученное таким образом твердое вещество распределяли между метиленхлоридом и водой. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали с получением 4-хлор-2-фтор-5-метокси-1-нитробензола (14,1 г). ЯМР-спектр: (CDCl3) 3,94 (с, 3Н), 7,4 (д, 1Н), 7,6 (д, 1Н).
Смесь полученного таким образом вещества, оксида платины (0,5 г) и этанола (250 мл) перемешивали в течение 2 часов в атмосфере водорода под давлением 1,2 атм. Смесь фильтровали и упаривали фильтрат. Очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента метиленхлорид. Таким образом получали 4-хлор-2-фтор-5-метоксианилин (8,5 г). ЯМР-спектр: (CDCl3) 3,7 (уш.с, 2Н), 3,81 (с, 3Н), 6,38 (д, 1Н), 7,02 (д, 1Н), 7,28 (с, 1Н).
[3] Продукт реакции получали в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3CO2O) 1,85-2,0 (м, 4Н), 2,0-2,15 (м, 2Н), 2,2-2,3 (м, 2Н), 3,15-3,25 (м, 2Н), 3,58 (т, 2Н), 3,65-3,75 (м, 4Н), 3,78 (с, 3H), 3,95 (с, 3H), 4,02 (м, 2Н), 4,6 (м, 2Н), 5,2 (м, 1Н), 6,9 (м, 1Н), 7,02 (д, 1Н), 7,16 (д, 1Н), 7,23 (д, 1Н), 8,16 (д, 1Н), 8,98 (с, 1Н). Масс-спектр: М+Н+ 495.
Применяемый в качестве исходного вещества 4-хлор-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин описан в Примечании [6] Примера 19.
[4] Продукт реакции получали в виде дигидрохлорида, из которого с применением методики, аналогичной описанной в Примере 3, выделяли свободное основание. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,15 (м, 2Н), 2,15-2,3 (м, 2Н), 2,3 (с, 3Н), 2,3-2,5 (м, 2Н), 2,75 (м, 2Н), 3,92 (с, 3Н), 4,6 (м, 1Н), 6,05 (с, 2Н), 6,50 (д, 1Н), 6,72 (д, 1Н), 6,84 (д, 1Н), 6,97 (д, 1Н), 8,52 (с, 1Н), 9,26 (с, 1Н). Масс-спектр: М+Н+ 443 и 445.
[5] Продукт реакции получали в виде дигидрохлорида, из которого с применением методики, аналогичной описанной в Примере 3, выделяли свободное основание. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,92-2,1 (м, 2Н), 2,2-2,3 (м, 2Н), 3,6-3,7 (м, 2Н), 4,0-4,1 (м, 2Н), 4,8 (м, 1Н), 6,1 (с, 2Н), 6,7 (м, 1Н), 6,75 (д, 1Н), 6,98 (д, 1Н), 7,15 (м, 1Н), 8,6 (с, 1Н), 9,32 (с, 1Н). Масс-спектр: M+H+ 418 и 420.
Применяемый в качестве исходного вещества 4-хлор-7-фтор-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Раствор 3,5-дифторанилина (10,8 г) в смеси 12н. водного раствора соляной кислоты (7,5 мл) и воды (90 мл) добавляли к перемешиваемой смеси хлоральгидрата (9,2 мл), десятиводного сульфата натрия (240 г) и воды (210 мл). Затем добавляли раствор гидроксиламингидрохлорида (18,6 г) в воде (90 мл) и нагревали смесь до 120°С в течение 45 минут. Смесь охлаждали до температуры окружающей среды, осадок выделяли и сушили в вакууме. Полученное таким образом вещество добавляли к концентрированной серной кислоте (60 мл), смесь перемешивали и нагревали до 80-90°С в течение 10 минут. Смесь охлаждали до температуры окружающей среды и вливали в смесь льда и воды (1:1; 600 мл). Осадок выделяли, промывали водой и сушили в вакууме при 50°С с получением 4,6-дифтор-2,3-диоксоиндолина (14 г). ЯМР-спектр: (ДМСОd6) 6,61 (м, 1Н), 6,9 (м, 1Н).
Пероксид водорода (35% водный раствор, 23 мл) добавляли по каплям к перемешиваемому раствору 4,6-дифтор-2,3-диоксоиндолина (14 г) в концентрированном водном растворе гидроксида натрия (33%, 115 мл), нагретом до 70°С. Смесь нагревали до 70°С в течение 15 минут. Полученную смесь охлаждали до 0°С и подкисляли до значения рН=4 путем добавления концентрированного водного раствора соляной кислоты. Смесь экстрагировали этилацетатом. Органический слой выделяли, промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали с получением 2-амино-4,6-дифторбензойной кислоты (12 г). ЯМР-спектр: (ДМСОd6) 6,25 (м, 1Н), 6,38 (м, 1Н).
Диэтилазодикарбоксилат (26,7 мл) добавляли по каплям к перемешиваемой смеси 2-амино-4,6-дифторбензойной кислоты (26,6 г), трифенилфосфина (45 г), метанола (9 мл) и метиленхлорида (350 мл), охлажденного до 5°С. Смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 2 часов. Реакционную смесь наносили на наполненную силикагелем хроматографическую колонку и элюировали метиленхлоридом. Таким образом получали метил-2-амино-4,6-дифторбензоат (25,2 г). ЯМР-спектр: (ДМСОd6) 3,8 (с, 3Н), 6,3 (м, 1Н), 6,4 (м, 1Н), 7,0 (уш.с, 2Н). Масс-спектр: М+Н+ 188.
Смесь метил-2-амино-4,6-дифторбензоата (47 г), формамидинацетата (79 г) и 2-метоксиэтанола (750 мл) перемешивали и нагревали с обратным холодильником в течение 10 часов. Добавляли вторую порцию (26 г) формамидинацетата и дополнительно нагревали смесь с обратным холодильником в течение 2,5 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Остаток промывали диэтиловым эфиром и водой и сушили в вакууме над пентоксидом фосфора. Фильтрат упаривали досуха и растирали остаток в присутствии диэтилового эфира. Полученное твердое вещество выделяли и сушили в вакууме. Объединяли две загрузки твердого вещества и очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (19:1). Таким образом получали 5,7-дифтор-3,4-дигидрохиназолин-4-он (33,7 г). ЯМР-спектр: (ДМСОd6) 7,3-7,4 (м, 2Н), 8,12 (с, 1Н). Масс-спектр: М+Н+ 183.
Гидрид натрия (60% дисперсия в минеральном масле; 0,6 г) добавляли порциями к раствору 4-гидрокситетрагидропирана (0,78 г) в ДМФ (10 мл), охлажденном до 5°С.
Смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 15 минут. Добавляли 5,7-дифтор-3,4-дигидрохиназолин-4-он (0.9 г) и перемешивали смесь при температуре окружающей среды в течение 30 минут. Смесь вливали в воду (100 мл) и для подкисления смеси до значения рН=5 при интенсивном перемешивании добавляли ледяную уксусную кислоту. Полученное твердое вещество выделяли, промывали водой и диэтиловым эфиром и сушили в вакууме. Таким образом получали 7-фтор-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-он (1,1 г). ЯМР-спектр: (ДМСОd6) 1,6-1,75 (м, 2Н), 1,9-2,0 (м, 2Н), 3,5-3,6 (м, 2Н), 3,85-3,95 (м, 2Н), 4,8 (м, 1Н), 6,9 (м, 1Н), 7,05 (м, 1Н), 8,0 (с, 1Н). Масс-спектр: М+Н+ 265.
Смесь 7-фтор-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (1 г), фосфорилхлорида (4 мл), диизопропилэтиламина (1,5 мл) и 1,2-дихлорэтана (15 мл) перемешивали и нагревали до 80°С в течение 3 часов. Смесь упаривали с получением 4-хлор-7-фтор-5-тетрагидропиран-4-илоксихиназолина, который использовали без дополнительной очистки.
[6] В качестве исходного вещества использовали 2,3-этилендиоксианилин (J.Med. Chem., 1995, 38, 4044). Продукт реакции получали в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3CO2D) 1,8-2,0 (м, 4Н), 2,0-2,1 (м, 2Н), 2,15-2,25 (м, 2Н), 3,1-3,25 (м, 2Н), 3,55 (м, 2Н), 3,6-3,75 (м, 4Н), 4,0 (м, 2Н), 4,32 (м, 2Н), 4,42 (м, 2Н), 4,58 (т, 2Н), 5,2 (м, 1Н), 6,85 (д, 1Н), 6,95 (м, 1Н), 6,99 (д, 1Н), 7,2 (д, 1Н), 8,0 (д, 1Н), 8,94 (с, 1Н). Масс-спектр: М+Н+ 493.
[7] Продукт реакции получали в виде дигидрохлорида, из которого с применением методики, аналогичной описанной в Примере 3, выделяли свободное основание. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,15-2,3 (м, 4Н), 2,3 (с, 3Н), 2,9 (м, 2Н), 3,9 (с, 3Н), 4,32 (м, 2Н), 4,4 (м, 2Н), 4,52 (м, 1Н), 6,5 (д, 1Н), 6,65 (м, 1Н), 6,8 (д, 1Н), 6,92 (м, 1Н), 8,3 (д, 1Н), 8,6 (с, 1Н), 10,05 (с, 1Н). Масс-спектр: М+Н+ 423.
[8] Реагенты представляли собой 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-хлор-7-метоксихиназолин и 2,3-этилендиоксианилин. Из реакционной смеси выделяли осадок, поочередно промывали изопропанолом, этилацетатом и диэтиловым эфиром и сушили в вакууме. Полученное таким образом вещество растворяли в 2М растворе хлороводорода в диэтиловом эфире и перемешивали смесь при температуре окружающей среды в течение 2 часов. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали продукт реакции в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3CO2D) 2,0-2,15 (м, 2Н), 2,35-2,55 (м, 2Н), 3,2 (м, 2Н), 3,45 (м, 2Н), 4,02 (с, 3Н), 4,4 (м, 2Н), 4,52 (м, 2Н), 5,2 (м, 1Н), 6,85 (д, 1Н), 6,98 (м, 2Н), 7,2 (д, 1Н), 8,05 (д, 1Н), 8,98 (с, 1Н). Масс-спектр: М+Н+ 409.
Применяемый в качестве исходного вещества 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-хлор-7-метоксихиназолин описан в Примере 33.
Пример 5
Дигидрохлорид 4-(5-хлорнафт-1-иламино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолина
Смесь 4-хлор-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолина (0,08 г), 5-хлор-1-нафтиламина (0,055 г), 6,2М раствора хлороводорода в изопропаноле (0,044 мл) и изопропанола (3 мл) перемешивали и нагревали с обратным холодильником в течение 2 часов. Смесь охлаждали до температуры окружающей среды, осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали указаное в заголовке соединение (0,129 г), часть которого обрабатывали насыщенным метанольным раствором аммиака. Смесь фильтровали и упаривали фильтрат с получением свободного основания. ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 4Н), 2,22 (с, 3Н), 2,25-2,4 (м, 2Н), 2,6-2,7 (м, 2Н), 3,94 (с, 3Н), 4,7 (уш.с, 1Н), 6,6 (с, 1Н), 6,9 (с, 1Н), 7,4 (м, 1Н), 7,62 (д, 1Н), 7,7 (м, 1Н), 8,0 (м, 2Н), 8,25 (д, 1Н), 8,46 (с, 1Н), 9,9 (уш.с, 1Н). Масс-спектр: М+Н+ 449 и 451.
Пример 6
4-(3-Хлорбензофуран-7-иламино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолиндигидрохлорид
С применением методики, аналогичной описанной в Примере 5, проводили взаимодействие 4-хлор-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолина с 7-амино-3-хлорбензофураном с получением указанного в заголовке соединения, часть которого обрабатывали насыщенным метанольным раствором аммиака. Смесь фильтровали и упаривали фильтрат с получением свободного основания. ЯМР-спектр: (CDCl3) 2,0-2,4 (м, 6Н), 2,33 (с, 3Н), 2,9 (м, 2Н), 3,93 (с, 3Н), 4,6 (м, 1Н), 6,56 (с, 1Н), 6,9 (с, 1Н), 7,3-7,4 (м, 2Н), 7,7 (уш.с, 1Н), 8,64 (с, 1Н), 8,7 (д, 1Н), 10,3 (уш.с, 1Н). Масс-спектр: М+Н+ 439 и 441.
Применяемый в качестве исходного вещества 7-амино-3-хлорбензофуран получали следующим образом.
В течение 30 минут газообразный хлор барботировали через раствор 7-нитробензофурана (1,2 г) в ледяной уксусной кислоте (12 мл), охлажденной до 18°С. Полученную смесь упаривали и остаток распределяли между диэтиловым эфиром и водой. Органический слой поочередно промывали насыщенным водным раствором бикарбоната натрия, водой и насыщенным водным раствором хлорида натрия, сушили над MgSO4 и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле с получением смеси цис- и транс- 2,3-дихлор-7-нитро-2,3-дигидробензофурана. Полученное таким образом вещество растворяли в этаноле (2 мл) и добавляли 0,8М раствор гидроксида калия в этаноле (2,7 мл). Смесь перемешивали при температуре окружающей среды в течение 75 минут. Смесь упаривали для удаления этанола. Остаток разбавляли водой и подкисляли смесь до значения рН=2 путем добавления концентрированной соляной кислоты. Смесь экстрагировали диэтиловым эфиром. Органический экстракт промывали водой и насыщенным водным раствором хлорида натрия, сушили над MgSO4 и упаривали. Таким образом получали 3-хлор-7-нитробензофуран (0,7 г). ЯМР-спектр: (ДМСОd6) 7,63 (м, 1Н), 8,12 (д, 1Н), 8,3 (д, 1Н), 8,65 (с, 1Н). Масс-спектр: М+Н+ 197 и 199.
Суспензию гидразингидрата (0,049 мл) и никеля Ренея (0,01 г) в метаноле (2 мл) нагревали до 60°С и добавляли по каплям к смеси 3-хлор-7-нитробензофурана (0,04 г) и метанола (4 мл). Полученную смесь нагревали с обратным холодильником в течение 10 минут, фильтровали и упаривали. Остаток распределяли между метиленхлоридом и водой. Органический слой промывали водой, сушили над MgSO4 и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и петролейного эфира (1:1). Таким образом получали 3-хлор-7-аминобензофуран (0,021 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 6,65 (д, 1Н), 6,75 (д, 1Н), 7,05 (м, 1Н), 8,2 (с, 1Н). Масс-спектр: M+H+ 167.
Пример 7
4-(2,3-Метилендиоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолиндигидрохлорид
С применением методики, аналогичной описанной в Примере 5, проводили взаимодействие 4-хлор-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолина с 2,3-метилендиоксианилином (J.Med. Chem., 1979, 22, 1354) с получением указанного в заголовке соединения, часть которого обрабатывали насыщенным метанольным раствором аммиака. Смесь фильтровали и упаривали фильтрат с получением свободного основания. ЯМР-спектр: (CDCl3) 2,0-2,1 (м, 2Н), 2,15-2,3 (м, 4Н), 2,31 (с, 3Н), 2,85 (м, 2Н), 3,91 (с, 3Н), 6,01 (с, 2Н), 6,5 (д, 1Н), 6,68 (д, 1Н), 6,82 (д, 1Н), 6,91 (м, 1Н), 8,0 (д, 1Н), 8,6 (с, 1Н), 9,72 (с, 1Н). Масс-спектр: М+Н+ 409.
Пример 8
4-(2-Хлор-5-метоксианилино)-5-(N-метилпиперидин-4-илметокси)хинаэолин
Смесь 5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-(2-хлор-5-метоксианилино)хиназолина (0,2 г), концентрированного водного раствора формальдегида (37%, 0,4 мл) и муравьиной кислоты (4 мл) перемешивали и нагревали до 100°С в течение 2,5 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Остаток растирали в присутствии диэтилового эфира, полученное твердое вещество выделяли и сушили в вакууме. Таким образом получали 4-(2-хлор-5-метоксианилино)-5-(N-метилпиперидин-4-илметокси)хиназолин в виде формиата (0,09 г). ЯМР-спектр: (CDCl3) 1,8-2,0 (м, 2Н), 2,05-2,15 (м, 2Н), 2,35 (м, 1Н), 2,6 (т, 2Н), 3,55 (д, 2Н), 3,93 (с, 3Н), 4,21 (д, 2Н), 6,68 (м, 1Н), 6,95 (д, 1Н), 7,31 (д, 1Н), 7,54 (д, 1Н), 7,7 (м, 1Н), 8,35 (уш.с, 1Н), 8,39 (д, 1Н), 8,7 (с, 1Н). Масс-спектр: М+Н+ 413.
Пример 9
4-(2-Бром-5-метоксианилино)-5-(N-метилпиперидин-4-илметокси)хиназолин
С применением методики, аналогичной описанной в Примере 8, проводили взаимодействие 4-(2-бром-5-метоксианилино)-5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]хиназолина (0,22 г) с концентрированным водным раствором формальдегида (0,4 мл) с получением указанного в заголовке соединения в виде формиата (0,183 г). ЯМР-спектр: (CDCl3) 1,7-1,9 (м, 2Н), 2,06 (д, 2Н), 2,2 (м, 1Н), 2,58 (т, 2Н), 2,68 (с, 3Н), 3,51 (д, 2Н), 3,8 (с, 3Н), 4,24 (д, 2Н), 6,64 (м, 1Н), 6,94 (д, 1Н), 7,48 (д, 1Н), 7,54 (д, 1Н), 7,69 (м, 1Н), 8,2 (д, 1Н), 8,3 (уш.с, 1Н), 8,69 (с, 1Н), 9,94 (с, 1Н). Масс-спектр: М+Н+ 457 и 459.
Пример 10
4-(2-Бром-5-метоксианилино)-5-пиперидин-4-илметоксихиназолин
Смесь 4-(2-бром-5-метоксианилино)-5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси] хиназолина (0,108 г), трифторуксусной кислоты (1 мл) и метиленхлорида (1 мл) перемешивали при температуре окружающей среды в течение 1,5 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученное твердое вещество выделяли и сушили в вакууме. Твердое вещество растворяли в метиленхлориде и добавляли несколько капель насыщенного метанольного раствора аммиака. Раствор вливали в наполненную силикагелем хроматографическую колонку и элюировали смесью метиленхлорида и насыщенного метанольного раствора аммиака (97:3). Таким образом получали указанное в заголовке соединение (0,082 г). ЯМР-спектр: (CDCl3) 1,2-1,4 (м, 2Н), 1,9 (д, 2Н), 2,3 (м, 1Н), 2,65 (т, 2Н), 3,12 (д, 2Н), 3,84 (с, 3Н), 4,2 (д, 2Н), 6,61 (м, 1Н), 6,93 (д, 1Н), 7,5 (д, 2Н), 7,68 (м, 1Н), 8,22 (д, 1Н), 8,68 (с, 1Н). Масс-спектр: М+Н+ 443 и 445.
Пример 11
4-(2-Хлор-5-метоксианилино)-7-гидрокси-5-(3-морфолинопропокси)хиназолин
Смесь 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-(3-морфолинопропокси)хиназолина (0,185 г), катализатора 10% «палладия на угле» (0,018 г), этанола (2,5 мл), ТГФ (2,5 мл) и ДМФ (1 мл) перемешивали под атмосферным давлением водорода в течение 16 часов. Смесь фильтровали и упаривали фильтрат. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (9:1). Таким образом получали указанное в заголовке соединение (0,045 г). ЯМР-спектр: (ДМСОd6) 2,05 (м, 2Н), 2,35 (уш.с, 4Н), 2,45 (т, 2Н), 3,55 (т, 4Н), 3,8 (с, 3Н), 4,42 (т, 2Н), 6,7 (д, 2Н), 7,45 (д, 1Н), 8,3 (с, 1Н), 8,45 (с, 1Н), 10,05 (с, 1Н). Масс-спектр: М+Н+ 445.
Пример 12
4-(2-Хлор-5-метоксианилино)-5,7-ди-(3-морфолинопропокси)хиназолин
Ди-трет-бутилазодикарбоксилат (0,035 г) добавляли по каплям к перемешиваемой смеси 4-(2-хлор-5-метоксианилино)-7-гидрокси-5-(3-морфолинопропокси)хиназолина (0,045 г), 4-(3-гидроксипропил)морфолина (0,016 г), трифенилфосфина (0,04 г) и метиленхлорида (1 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 10 минут. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорда, этилацетата и насыщенного метанольного раствора аммиака (9:10:1). Полученное таким образом вещество растирали в присутствии диэтилового эфира. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением указанного в заголовке соединения (0,018 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 2,2-2,4 (м, 4Н), 3,15 (м, 4Н), 3,35 (м, 4Н), 3,5 (м, 4Н), 3,7 (м, 4Н), 3,8 (с, 3Н), 4,02 (т, 4Н), 4,35 (т, 2Н), 4,6 (т, 2Н), 6,95 (с, 1Н), 7,03 (с, 1Н), 7,05 (м, 1Н), 7,5 (с, 1Н), 7,6 (д, 1Н), 8,88 (с, 1Н). Масс-спектр: М+Н+ 572 и 574.
Пример 13
4-(2-Хлор-5-метоксианилино)-7-гидрокси-5-(3-пирролидин-1-илпропокси)хиназолин
Смесь 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-(3-пирролидин-1-илпропокси)хиназолина (0,68 г), катализатора 10% «палладия на угле» (0,16 г), этанола (13 мл) и ТГФ (13 мл) перемешивали в течение 16 часов в атмосфере водорода при давлении 5 атм. Смесь фильтровали и упаривали фильтрат. Растирали остаток в присутствии метанола. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали указанное в заголовке соединение (0,405 г). ЯМР-спектр: (ДМСОd6) 1,65 (уш.с, 4Н), 2,1 (м, 2Н), 2,4 (уш.с, 4Н), 2,55 (т, 2Н), 3,8 (с, 3H), 4,4 (т, 2Н), 6,7 (м, 2Н), 6,75 (м, 1Н), 7,48 (д, 1Н), 8,3 (д, 1Н), 8,4 (с, 1Н), 10,05 (с, 1Н).
Пример 14
С применением методики, аналогичной описанной в Примере 12, проводили взаимодействие подходящего 7-гидроксизамещенного хиназолина с подходящим спиртом с получением соединений, описанных в Таблице III.
| Таблица III |
 |
| № и прим. |
(R1)m |
Q1 |
(R2)n |
| [1] |
7-(3-морфолинопропокси) |
3-пирролидин-1-илпропил |
2-хлор-5-метокси |
| [2] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
3-пирролидин-1-илпропил |
2-хлор-5-метокси |
| [3] |
7-(2-метоксиэтокси) |
3-пирролидин-1-илпропил |
2-хлор-5-метокси |
| [4] |
7-[2-(2-метоксиэтокси)этокси] |
3-пирролидин-1-илпропил |
2-хлор-5-метокси |
| [5] |
7-изопропокси |
4-пиперидинил |
2-бром-5-метокси |
| [6] |
7-(3-метилсульфонил)пропокси |
4-пиперидинил |
2-бром-5-метокси |
| [7] |
7-(2-пиридилметокси) |
N-(2-пиридилметил)-пиперидин-4-ил |
2-бром-5-метокси |
| [8] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
2-хлор-5-метокси |
| [9] |
7-(3-морфолинопропокси) |
4-тетрагидропиранил |
2-хлор-5-метокси |
| [10] |
7-(N-метилпиперидин-4-илокси) |
4-тетрагидропиранил |
2-бром-5-метокси |
| [11] |
7-(2-пирролидин-1-илэтокси) |
4-тетрагидропиранил |
2-бром-5-метокси |
| [12] |
7-(3-пирролидин-1-илпропокси) |
4-тетрагидропиранил |
2-бром-5-метокси |
| [13] |
7-(2-пиперидиноэтокси) |
4-тетрагидропиранил |
2-бром-5-метокси |
| [14] |
7-[2-(4-метилпиперазин-1-ил)этокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [15] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [16] |
7-[2-(2-морфолинометил-5-метилимидазол-1-ил)этокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [17] |
7-{2-[2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси} |
4-тетрагидропиранил |
2-бром-5-метокси |
| [18] |
7-{3-[2-(N,N-диметилкарбамоил)пирролидин-1-ил]пропокси} |
4-тетрагидропиранил |
2-бром-5-метокси |
| [19] |
7-[2-(2,5-диметоксиметилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [20] |
7-[2-(4-пиридилокси)этокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [21] |
7-(3-морфолинопропокси) |
циклогексил |
2-хлор-5-метокси |
| [22] |
7-(2-пирролидин-1-илэтокси) |
циклопентил |
2,4-дихлор-5-метокси |
| [23] |
7-(3-морфолинопропокси) |
изопропил |
2-хлор-5-метокси |
| [24] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
изопропил |
2-хлор-5-метокси |
| [25] |
7-(2-пирролидин-1-илэтокси) |
4-тетрагидропиранил |
2,3-метилендиокси |
| [26] |
7-(3-пирролидин-1-илпропокси) |
4-тетрагидропиранил |
2,3-метилендиокси |
| [27] |
7-(3-пиридилметокси) |
4-пиперидинил |
2-бром-5-метокси |
| [28] |
7-(2-пирролидин-1-илэтокси) |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [29] |
7-(3-пирролидин-1-илпропокси) |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [30] |
7-(2-пиперидиноэтокси) |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [31] |
7-[2-(4-метилпиперазин-1-илэтокси] |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [32] |
7-(2-морфолиноэтокси) |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [33] |
7-{2-[2-(N-метилкарбамоил)пирролидин-1-ил]этокси} |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [34] |
7-[2-(2-карбамоилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [35] |
7-[2-(2-морфолинокарбонилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [36] |
7-{2-[2-(4-метилпиперазин-1-илкарбонил)пирролидин-1-ил]этокси} |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [37] |
7-{2-[2-(пирролидин-1-илкарбонил)пирролидин-1-ил]этокси} |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [38] |
7-[2-(2-пиперидинокарбонилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [39] |
7-[2-(2-метилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [40] |
7-[2-(2-метоксиметилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [41] |
7-[2-(4-пиридилокси)этокси] |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [42] |
7-(3-пиридилметокси) |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [43] |
7-(4-пиридилметокси) |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [44] |
7-(N-метилпиперидин-4-илокси) |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [45] |
7-{2-[2-(N-метилкарбамоил)пирролидин-1-ил]этокси} |
4-тетрагидропиранил |
2-бром-5-метокси |
| [46] |
7-[2-(2-морфолинокарбонилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [47] |
7-{2-[2-(4-метилпиперазин-1-илкарбонил)пирролидин-1-ил]этокси} |
4-тетрагидропиранил |
2-бром-5-метокси |
| [48] |
7-{2-[2-(пирролидин-1-илкарбонил)пирролидин-1-ил]этокси} |
4-тетрагидропиранил |
2-бром-5-метокси |
| [49] |
7-[2-(2-пиперидинокарбонилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [50] |
7-[2-(2-карбамоилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [51] |
7-[2-(2-метилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [52] |
7-[2-(2-метоксиметилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [53] |
7-(3-пиридилметокси) |
4-тетрагидропиранил |
2-бром-5-метокси |
| [54] |
7-(4-пиридилметокси) |
4-тетрагидропиранил |
2-бром-5-метокси |
| [55] |
7-изопропокси |
4-пиперидинил |
6-хлор-2,3-метилендиокси |
| [56] |
7-этокси |
4-пиперидинил |
6-хлор-2,3-метилендиокси |
| [57] |
7-изобутокси |
4-пиперидинил |
6-хлор-2,3-метилендиокси |
| [58] |
7-(2-фторэтокси) |
4-пиперидинил |
6-хлор-2,3-метилендиокси |
| [59] |
7-[2-(2,5-диметоксиметилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,3-метилендиокси |
| [60] |
7-[2-(4-пиридилокси)этокси] |
4-тетрагидропиранил |
2,3-метилендиокси |
| [61] |
7-(3-пиридилметокси) |
4-тетрагидропиранил |
2,3-метилендиокси |
| [62] |
7-(4-пиридилметокси) |
4-тетрагидропиранил |
2,3-метилендиокси |
| [63] |
7-{2-[2-(N-метилкарбамоил)пирролидин-1-ил]этокси} |
4-тетрагидропиранил |
2,3-метилендиокси |
| [64] |
7-[2-(2-морфолинокарбонилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,3-метилендиокси |
| [65] |
7-{2-[2-(4-метилпиперазин-1-илкарбонил)пирролидин -1-ил]этокси} |
4-тетрагидропиранил |
2,3-метилендиокси |
| [66] |
7-{2-[2-(пирролидин-1-илкарбонил)пирролидин-1-ил]этокси} |
4-тетрагидропиранил |
2,3-метилендиокси |
| [67] |
7-[2-(2-пиперидинокарбонилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,3-метилендиокси |
| [68] |
7-[2-(2-карбамоилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,3-метилендиокси |
| [69] |
7-[2-(2-метилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,3-метилендиокси |
| [70] |
7-[2-(2-метоксиметилпирролидин-1-ил)этокси] |
4-тетрагидропиранил |
2,3-метилендиокси |
| [71] |
7-(3-пиперазин-1-илпропокси) |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [72] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [73] |
7-[2-(4-метилпиперазин-1-ил)этокси] |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [74] |
7-(2-пиперидиноэтокси) |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [75] |
7-(2-пиперидин-4-илэтокси) |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [76] |
7-[2-(4-пиридилокси)этокси] |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [77] |
7-[N-трет-бутоксикарбонил)пиперидин-4-илметокси] |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [78] |
7-(3-пирролидин-1-илпропокси) |
циклопентил |
2,3-метилендиокси |
| [79] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
циклопентил |
2,3-метилендиокси |
| [80] |
7-[2-(4-метилпиперазин-1-ил)этокси] |
циклопентил |
2,3-метилендиокси |
| [81] |
7-(2-пиперидиноэтокси) |
циклопентил |
2,3-метилендиокси |
| [82] |
7-{2-[2-(4-метилпиперазин-1-илкарбонил)пирролидин-1-ил]этокси} |
циклопентил |
2,3-метилендиокси |
| [83] |
7-(пиперидин-4-илметокси) |
циклопентил |
2,3-метилендиокси |
| [84] |
7-(3-пиперазин-1-илпропокси) |
циклопентил |
2,3-метилендиокси |
ПРИМЕЧАНИЯ
[1] Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире (5 мл) при температуре окружающей среды в течение 30 минут. Полученное твердое вещество выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме с получением продукта в виде тригидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,8-2,1 (м, 4Н), 2,35 (м, 4Н), 3,05 (м, 2Н), 3,15 (т, 2Н), 3,35 (м, 4Н), 3,55 (м, 4Н), 3,8 (с, 3Н), 3,85 (т, 2Н), 4,05 (д, 2Н), 4,4 (т, 2Н), 4,7 (т, 2Н), 7,0-7,15 (м, 3Н), 7,52 (д, 1Н), 7,56 (д, 1Н), 8,86 (с, 1Н). Масс-спектр: M+H+ 556 и 558.
[2] Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире (5 мл) при температуре окружающей среды в течение 30 минут. Полученное твердое вещество выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме с получением продукта в виде тригидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,8-2,05 (м, 4Н), 2,4 (м, 4Н), 2,95 (с, 3H), 3,02 (м, 2Н), 3,2-3,65 (м, 12Н), 3,8 (т, 2Н), 3,85 (с, 3Н), 4,4 (т, 2Н), 4,7 (т, 2Н), 7,02 (с, 1Н), 7,05 (м, 1Н), 7,1 (с, 1Н), 7,5 (с, 1Н), 7,6 (д, 1Н), 7,95 (с, 1Н).
[3] Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире (5 мл) при температуре окружающей среды в течение 30 минут. Полученное твердое вещество выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,85-2,1 (м, 4Н), 2,38 (м, 2Н), 3,05 (м, 2Н), 3,35 (т, 2Н), 3,4 (с, 3Н), 3,6 (м, 2Н), 3,8 (с, 3H), 3,85 (м, 2Н), 4,4 (т, 2Н), 4,65 (т, 2Н), 7,0 (с, 1Н), 7,05 (м, 1Н), 7,12 (с, 1Н), 7,52 (д, 1Н), 7,6 (д, 1Н), 8,87 (с, 1Н). Масс-спектр: M+H+ 487 и 489.
[4] Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире (5 мл) при температуре окружающей среды в течение 30 минут. Полученное твердое вещество выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме с получением продукта в виде дигидрохлорида. ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,8-2,05 (м, 4Н), 2,35 (м, 2Н), 3,0 (м, 2Н), 3,25 (с, 3Н), 3,35 (т, 2Н), 3,5 (т, 2Н), 3,55 (м, 2Н), 3,65 (т, 2Н), 3,8 (с, 3Н), 3,85 (м, 2Н), 4,35 (м, 2Н), 4,65 (т, 2Н), 7,0 (с, 1Н), 7,05 (м, 1Н), 7,12 (с, 1Н), 7,45 (с, 1Н), 7,57 (д, 1Н), 8,85 (с, 1Н). Масс-спектр: М+Н+ 531 и 533.
[5] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в изопропаноле с получением дигидрохлорида 4-(2-бром-5-метоксианилино)-7-изопропокси-5-пиперидин-4-илоксихиназолина, часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,45 (д, 6Н), 1,8-2,0 (м, 2Н), 2,25 (д, 2Н), 2,75 (м, 2Н), 3,2 (м, 2Н), 3,82 (с, 3Н), 4,65 (м, 1Н), 4,75 (м, 1Н), 6,52 (д, 1Н), 6,65 (м, 1Н), 6,85 (д, 1Н), 7,5 (д, 1Н), 7,92 (д, 1Н), 8,52 (с, 1Н), 9,72 (с, 1Н). Масс-спектр: M+H+ 487 и 489.
Применяемый в качестве исходного вещества 4-(2-бром-5-метоксианилино)-7-гидрокси-5-пиперидин-4-илоксихиназолин описан в настоящем документе в Примере 20.
[6] Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа, после чего добавляли вторую порцию ди-трет-бутилазодикарбоксилата и трифенилфосфина и перемешивали реакционную смесь при температуре окружающей среды в течение 30 минут. Продукт реакции растворяли в содержащем карбонат калия метаноле и нагревали с обратным холодильником в течение 15 минут. Смесь фильтровали и упаривали фильтрат с получением требуемого продукта. ЯМР-спектр: (CDCl3) 1,85-2,0 (м, 2Н), 2,25 (д, 2Н), 2,42 (м, 2Н), 2,8 (м, 2Н), 3,0 (с, 3H), 3,21 (м, 2Н), 3,3 (м, 2Н), 3,82 (с, 3H), 4,25 (м, 2Н), 4,65 (м, 1Н), 6,55 (д, 1Н), 6,62 (м, 1Н), 6,82 (д, 1Н), 7,5 (д, 1Н), 7,9 (д, 1Н), 8,52 (с, 1Н), 9,75 (с, 1Н). Масс-спектр: M+H+ 565 и 567.
[7] Реагенты представляли собой 4-(2-бром-5-метоксианилино)-7-гидрокси-5-пиперидин-4-илоксихиназолин и 2-пиридилметанол. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа, после чего добавляли вторую порцию ди-трет-бутилазодикарбоксилата и трифенилфосфина и перемешивали реакционную смесь при температуре окружающей среды в течение 30 минут. Продукт реакции растворяли в содержащем карбонат калия метаноле и нагревали с обратным холодильником в течение 15 минут. Смесь фильтровали и упаривали фильтрат с получением требуемого продукта. ЯМР-спектр: (CDCl3) 2,05-2,2 (м, 2Н), 2,2-2,3 (м, 2Н), 2,35 (м, 2Н), 2,92 (д, 2Н), 3,68 (с, 3Н), 3,82 (с, 3Н), 4,6 (м, 1Н), 5,32 (с, 2Н), 6,62 (м, 1Н), 6,7 (д, 1Н), 6,92 (д, 1Н), 7,2 (м, 1Н), 7,4 (д, 1Н), 7,5 (м, 2Н), 7,65 (м, 1Н), 7,75 (м, 1Н), 7,88 (д, 1Н), 8,52 (с, 1Н), 8,55 (м, 2Н), 8,65 (д, 1Н), 9,72 (с, 1Н). Масс-спектр: M+H+ 627 и 629.
[8] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта реакции, полученного в виде свободного основания, получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,15 (м, 6Н), 2,3 (с, 3Н), 2,35-2,7 (м, 10Н), 3,6 (т, 2Н), 3,85 (с, 3Н), 4,0-4,2 (м, 4Н), 4,75 (м, 1Н), 6,6 (с, 1Н), 6,7 (м, 1Н), 6,9 (с, 1Н), 7,32 (д, 1Н), 8,2 (с, 1Н), 8,58 (с, 1Н), 9,85 (с, 1Н). Масс-спектр: M+H+ 542 и 544.
Применяемый в качестве исходного вещества 4-(2-хлор-5-метоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин описан в Примере 21.
[9] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта реакции, полученного в виде свободного основания, получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3СО2D) 1,85-2,0 (с, 2Н), 2,18 (д, 2Н), 2,2-2,3 (м, 2Н), 3,15 (м, 2Н), 3,3-3,4 (м, 2Н), 3,5 (д, 2Н), 3,7 (т, 2Н), 3,8 (с, 3Н), 3,95 (м, 2Н), 4,05 (д, 2Н), 4,3 (т, 2Н), 5,15 (м, 1Н), 6,9 (с, 1Н), 7,02 (м, 1Н), 7,1 (с, 1Н), 7,6 (м, 2Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 529 и 531.
[10] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,8-2,0 (м, 2Н), 2,0-2,2 (м, 4Н), 2,2-2,3 (м, 4Н), 2,33 (с, 3Н), 2,78 (м, 2Н), 3,6 (м, 2Н), 3,84 (с, 3Н), 4,08 (м, 2Н), 4,45 (м, 1Н), 4,75 (м, 1Н), 6,55 (с, 1Н), 6,65 (м, 1Н), 6,85 (д, 1Н), 7,5 (д, 1Н), 7,92 (д, 1Н), 8,52 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: M+H+ 543 и 545.
Применяемый в качестве исходного вещества 4-(2-бром-5-метоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин описан в Примере 24.
[11] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,85 (м, 4Н), 2,1 (м, 2Н), 2,22 (д, 2Н), 2,65 (м, 4Н), 2,98 (т, 2Н), 3,58 (т, 2Н), 3,85 (с, 3H), 4,05 (м, 2Н), 4,22 (т, 2Н), 4,75 (м, 1Н), 6,65 (м, 2Н), 6,87 (с, 1Н), 7,5 (д, 1Н), 7,95 (с, 1Н), 8,55 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: М+H+ 543 и 545.
[12] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,8 (м, 4Н), 2,0-2,2 (м, 4Н), 2,22 (д, 2Н), 2,45-2,6 (м, 4Н), 2,68 (м, 2Н), 3,6 (м, 2Н), 3,85 (с, 3Н), 4,05 (м, 2Н), 4,15 (м, 2Н), 4,78 (м, 1Н), 6,55 (д, 1Н), 6,65 (м, 1Н), 6,85 (д, 1Н), 7,5 (д, 1Н), 7,95 (д, 1Н), 8,55 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: М+Н+ 557 и 559.
[13] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,63 (уш.с, 6Н), 2,0-2,2 (м, 2Н), 2,25 (д, 2Н), 2,55 (уш.с, 4Н), 2,85 (т, 2Н), 3,6 (м, 2Н), 3,84 (с, 3Н), 4,05 (м, 2Н), 4,25 (м, 2Н), 4,75 (м, 1Н), 6,62 (м, 2Н), 6,85 (д, 1Н), 7,5 (д, 1Н), 7,95 (д, 1Н), 8,55 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: M+H+ 557 и 559.
[14] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,18 (м, 2Н), 2,25 (д, 2Н), 2,31 (с, 3Н), 2,5 (уш.с, 4Н), 2,65 (уш.с, 4Н), 2,9 (т, 2Н), 3,6 (м, 2Н), 3,84 (с, 3Н), 4,05 (м, 2Н), 4,25 (т, 2Н), 4,75 (м, 1Н), 6,62 (м, 2Н), 6,85 (д, 1Н), 7,5 (д, 1Н), 7,95 (д, 1Н), 8,55 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: M+H+ 572 и 574.
[15] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные: ЯМР-спектр: (CDCl3) 2,02-2,2 (м, 4Н), 2,25 (д, 2Н), 2,29 (с, 3H), 2,35-2,7 (м, 10 Н), 3,6 (м, 2Н), 3,84 (с, 3Н), 4,1 (м, 2Н), 4,15 (т, 2Н), 4,75 (м, 1Н), 6,55 (с, 1Н), 6,65 (м, 1Н), 6,85 (д, 1Н), 7,5 (д, 1Н), 7,95 (д, 1Н), 8,55 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: M+H+ 586 и 588.
[16] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,2 (м, 2Н), 2,22 (д, 2Н), 2,3 (с, 3Н), 2,45 (уш.с, 4Н), 3,6 (т, 2Н), 3,65 (уш.с, 6Н), 3,85 (с, 3Н), 4,05 (м, 2Н), 4,42 (м, 2Н), 4,45 (м, 2Н), 4,75 (м, 1Н), 6,48 (с, 1Н), 6,65 (м, 1Н), 6,7 (с, 1Н), 6,82 (д, 1Н), 7,5 (д, 1Н), 7,92 (д, 1Н), 8,55 (с, 1Н), 9,68 (с, 1Н). Масс-спектр: М+Н+ 653 и 655.
Применяемый в качестве исходного вещества 1-(2-гидроксиэтил)-5-метил-2-морфолинометилимидазол получали следующим образом.
Смесь 4-метил-1-тритилимидазола (J. Heterocyclic Chem., 1982, 19, 253; 32,5 г), метилбромацетата (11,4 мл) и ацетона (500 мл) нагревали с обратным холодильником в течение 2 часов. Растворитель выпаривали, растворяли остаток в метаноле (100 мл) и нагревали с обратным холодильником в течение 45 минут. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученный осадок выделяли и перемешивали при температуре окружающей среды в течение 1 часа в смеси с диэтиловым эфиром (200 мл) и насыщенным метанольным раствором аммиака (20 мл). Смесь фильтровали и упаривали фильтрат. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (49:1). Таким образом получали метил-2-(5-метилимидазол-1-ил)ацетат (6 г). ЯМР-спектр: (CDCl3) 2,16 (с, 3Н), 3,78 (с, 3Н), 4,61 (с, 3Н), 6,8 (с, 1Н), 7,42 (с, 1Н).
Раствор части (1,7 г) полученного таким образом вещества в диэтиловом эфире (20 мл) добавляли по каплям к перемешиваемой суспензии литийалюминийгидрида (0,76 г) в диэтиловом эфире (70 мл), охлажденном до 0°С. Полученную смесь перемешивали при температуре окружающей среды в течение 1 часа. Смесь охлаждали до 0°С и поочередно по каплям добавляли 6н. водный раствор гидроксида натрия (0,8 мл) и воду (2,4 мл). Смесь перемешивали при температуре окружающей среды в течение 30 минут и затем упаривали. Остаток растворяли в метиленхлориде, сушили над сульфатом магния и упаривали с получением 1-(2-гидроксиэтил)-5-метилимидазола (1,1 г). ЯМР-спектр: (CDCl3) 2,17 (с, 3Н), 3,81 (т, 2Н), 3,92 (т, 2Н), 6,6 (с, 1Н), 7,24 (с, 1Н).
трет-Бутилдиметилсилилхлорид (9,05 г) добавляли к перемешиваемой смеси 1-(2-гидроксиэтил)-5-метилимидазола (6,4 г), имидазола (7,5 г) и метиленхлорида (30 мл), охлажденного до 0°С. Реакционную смесь перемешивали при температуре окружающей среды в течение 4 часов. Смесь вливали в воду. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали с получением 1-(2-трет-бутилдиметилсилилоксиэтил)-5-метилимидазола (11,7 г). ЯМР-спектр: (CDCl3) -0,04 (с, 6Н), 0,85 (с, 6Н), 2,2 (с, 3Н), 3,8 (м, 2Н), 3,94 (м, 2Н), 6,75 (с, 1Н), 7,43 (с, 1Н).
Полученное таким образом вещество растворяли в ТГФ (400 мл) и охлаждали раствор до -60°С. По каплям добавляли н-бутиллитий (2,5М в гексане, 40 мл) и перемешивали смесь при -50°С в течение 1 часа. Смесь охлаждали до -60°С и по каплям добавляли ДМФ (12,5 мл). Полученную смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 2 часов. Добавляли диэтиловый эфир (500 мл) и вливали реакционную смесь в насыщенный водный раствор хлорида аммония. Органический слой выделяли, промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Полученное таким образом вещество очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смеси метиленхлорида и насыщенного метанольного раствора аммиака с увеличивающейся полярностью. Таким образом получали 1-(2-трет-бутилдиметилсилилоксиэтил)-2-формил-5-метилимидазол (11 г). ЯМР-спектр: (CDCl3) -0,1 (с, 6Н), 0,79 (с, 9Н), 2,32 (с, 3Н), 3,91 (т, 2Н), 4,4 (т, 2Н), 7,07 (с, 1Н), 9,71 (с, 1Н).
Часть (0,79 г) полученного таким образом вещества растворяли в метиленхлориде (24 мл) и добавляли морфолин (0,263 мл) и уксусную кислоту (0,175 мл). Порциями добавляли триацетат боргидрида натрия (0,8 г) и перемешивали смесь при температуре окружающей среды в течение 16 часов. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (49:1). Таким образом получали 1-(2-трет-бутилдиметилсилилоксиэтил)-5-метил-2-морфолинометилимидазол (0,5 г). ЯМР-спектр: (CDCl3) 0 (с, 6Н), 0,82 (с, 9Н), 2,25 (с, 3Н), 2,45 (м, 4Н), 3,6 (с, 2Н), 3,68 (м, 4Н), 3,85 (т, 2Н), 4,1 (т, 2Н), 6,7 (с, 1Н).
Смесь полученного таким образом вещества, 12н. водного раствора соляной кислоты (0,26 мл) и метанола (10 мл) перемешивали при температуре окружающей среды в течение 5 часов. Смесь упаривали и растирали остаток в присутствии пентана. Полученное твердое вещество выделяли и сушили в вакууме. Твердое вещество перемешивали при температуре окружающей среды в течение 1 часа в смеси с метиленхлоридом и насыщенным метанольным раствором аммиака. Смесь фильтровали и упаривали фильтрат. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (19:1). Таким образом получали 1-(2-гидроксиэтил)-5-метил-2-морфолинометилимидазол (0,25 г). ЯМР-спектр: (CDCl3) 2,2 (с, 3Н), 2,6 (уш.с, 4Н), 3,58 (с, 2Н), 3,7 (м, 4Н), 3,85 (т, 2Н), 4,1 (т, 2Н), 6,5-6,9 (уш.с, 1Н), 6,65 (с, 1Н).
[17] Реакционную смесь перемешивали при температуре окружающей среды в течение 2. часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,75-2,3 (м, 8Н), 2,5 (м, 1Н), 2,8-2,9 (м, 1Н), 2,9 (с, 3Н), 3,1 (с, 3Н), 3,18 (м, 1Н), 3,35 (м, 1Н), 3,48 (м, 1Н), 3,58 (м, 2Н), 3,82 (с, 3Н), 4,05 (м, 2Н), 4,2 (м, 2Н), 4,72 (м, 1Н), 6,6 (м, 2Н), 6,8 (с, 1Н), 7,5 (д, 1Н), 7,92 (д, 1Н), 8,5 (с, 1Н), 9,68 (с, 1Н). Масс-спектр: M+H+ 614 и 616.
Применяемый в качестве исходного вещества (2S)-1-(2-гидроксиэтил)-N,N-диметилпирролидин-2-карбоксамид получали следующим образом.
Смесь 1-трет-бутоксикарбонил)-L-пролина (10,75 г), гидрохлорида 1-(3-диметиламинопропил)3-этилкарбодиимида (10,6 г), диметиламингидрохлорида (5,33 г), 4-диметиламинопиридина (6,1 г) и метиленхлорида (200 мл) перемешивали при температуре окружающей среды в течение 4 часов. Смесь вливали в воду. Органический слой выделяли, поочередно промывали а 1н. водным раствором гидросульфата калия, 5% водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали с получением 1-(трет-бутоксикарбонил)-N,N-диметил-L-пролинамида (11,2 г). ЯМР-спектр: (CDCl3) 1,4 и 1,5 (2с, 9Н), 1,8-1,9 (м, 2Н), 1,95-2,2 (м, 2Н), 3,0 и 3,1 (2д, 6Н), 3,35-3,6 (м, 2Н), 4,55 и 4,7 (2м, 1Н).
Смесь части (0,24 г) полученного таким образом вещества и трифторуксусной кислоты (3 мл) перемешивали при температуре окружающей среды в течение 2 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. В небольшом избытке добавляли 2М раствор хлороводорода в диэтиловом эфире, осадок выделяли и сушили в вакууме с получением N,N-диметил-L-пролинамидгидрохлорида (0,25 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,7-2,0 (м, 3Н), 2,3-2,5 (м, 1Н), 2,95 (с, 3Н), 3,05 (с, 3Н), 3,1-3,4 (м, 2Н), 4,6 (м, 1Н).
Смесь N,N-диметил-L-пролинамидгидрохлорида (6,3 г), 2-бромэтанола (3,8 мл), карбоната калия (14 г) и ацетонитрила (70 мл) перемешивали и нагревали с обратным холодильником в течение 16 часов. Смесь фильтровали и упаривали фильтрат. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (24:1). Таким образом получали (2S)-1-(2-гидроксиэтил)-N,N-диметилпирролидин-2-карбоксамид (3,4 г). ЯМР-спектр: (CDCl3) 1,6 (м, 1Н), 1,6-2,0 (м, 4Н), 2,1-2,3 (м, 2Н), 2,4 (м, 1Н), 2,9 (м, 1Н), 3,0 (с, 3Н), 3,05 (с, 3Н), 3,25-3,4 (м, 2Н), 3,75 (м, 1Н), 3,9 (м, 1Н), 5,1 (уш.с, 1Н). Масс-спектр: М+Н+ 187.
[18] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,7-2,5 (м, 12Н), 2,95 (с, 3Н), 3,1 (с, 3Н), 2,8-3,0 (м, 1Н), 3,2-3,4 (м, 2Н), 3,58 (т, 2Н), 3,82 (с, 3Н), 4,05 (м, 2Н), 4,1 (т, 2Н), 4,75 (м, 1Н), 6,55 (д, 1Н), 6,6 (м, 1Н), 6,8 (д, 1Н), 7,48 (д, 1Н), 7,92 (д, 1Н), 8,5 (с, 1Н), 9,65 (с, 1Н). Масс-спектр: М+H+ 628 и 630.
Применяемый в качестве исходного вещества (2S)-1-(3-гидроксипропил)-N,N-диметилпирролидин-2-карбоксамид получали следующим образом с применением методики, аналогичной описанной в заявке на выдачу международного патента WO 98/13354 (Пример 76 данной зявки).
С применением методики, аналогичной описанной в последнем параграфе Примечания [17] в той его части, которая касается получения исходных продуктов, проводили взаимодействие 3-бромпропанола с N,N-диметил-1-пролиламидгидрохлоридом.
[19] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, фильтровали смесь и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,6-1,8 (м, 2Н), 1,9-2,0 (м, 2Н), 2,05-2,15 (м, 2Н), 2,25 (д, 2Н), 3,21 (м, 2Н), 3,25-3,5 (м, 6Н), 3,33 (с, 3Н), 3,34 (с, 3Н), 3,58 (м, 2Н), 3,84 (с, 3Н), 4,05 (м, 2Н), 4,25 (м, 2Н), 4,75 (м, 1Н), 6,6 (д, 1Н), 6,65 (м, 1Н), 6,9 (д, 1Н), 7,5 (д, 1Н), 7,95 (д, 1Н), 8,55 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: М+Н+ 631 и 633.
Применяемый в качестве исходного вещества (2R,5R)-1-(2-гидроксиэтил)-2,5-диметоксиметилпирролидин получали следующим образом.
Смесь (2R,5R)-2,5-диметоксиметилпирролидина (0,25 г), 2-бромэтанола (1,1 мл), карбоната калия (2,8 г) и ацетонитрила (10 мл) перемешивали и нагревали с обратным холодильником в течение 18 часов. Смесь фильтровали, вливали фильтрат в наполненную силикагелем колонку и элюировали смесью метиленхлорида и насыщенного метанольного раствора аммиака (49:1). Таким образом получали (2R,5R)-1-(2-гидроксиэтил)-2,5-диметоксиметилпирролидин (0,23 г). Масс-спектр: M+H+ 204.
[20] В качестве исходного вещества применяли 4-(2-гидроксиэтокси)пиридин (J.Chem. Soc. Perkin II, 1987, 1867). Для продукта получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,65-1,9 (м, 2Н), 2,25 (д, 2Н), 3,55 (м, 2Н), 3,78 (с, 3Н), 3,9 (м, 2Н), 4,4-4,55 (м, 4Н), 5,1 (м, 1Н), 6,78 (м, 1Н), 6,85 (д, 1Н), 7,0 (д, 1Н), 7,05 (д, 2Н), 7,6 (д, 1Н), 7,84 (д, 1Н), 8,4 (д, 2Н), 8,45 (с, 1Н), 9,69 (с, 1Н). Масс-спектр: М+Н+ 567 и 569.
[21] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта реакции, полученного в виде свободного основания, получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3СО2D) 1,2-1,35 (м, 1Н), 1,4-1,5 (м, 2Н), 1,6 (м, 1Н), 1,7-1,8 (м, 4Н), 2,1-2,15 (м, 2Н), 2,2-2,3 (м, 2Н), 3,1-3,2 (т, 2Н), 3,35 (т, 2Н), 3,55 (д, 2Н), 3,7 (т, 2Н), 3,8 (с, 3H), 4,05 (д, 2Н), 4,3 (т, 2Н), 4,92 (м, 1Н), 6,9 (с, 1Н), 7,02 (д, 1Н), 7,05 (с, 1Н), 7,58 (д, 1Н), 7,58 (с, 1Н), 7,9 (с, 1Н). Масс-спектр: М+H+ 527 и 529.
Применяемый в качестве исходного вещества 4-(2-хлор-5-метоксианилино)-5-циклогексилокси-7-гидроксихиназолин получали следующим образом.
С применением методики, аналогичной описанной в Примере 1, проводили взаимодействие 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-гидроксихиназолина (0,53 г) с циклогексанолом с получением 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-циклогексилоксихиназолина (0,25 г). ЯМР-спектр: (ДМСОd6 и CF3СО2D) 1,3-1,4 (м, 1Н), 1,4-1,55 (м, 2Н), 1,55-1,65 (м, 1Н), 1,7-1,85 (м, 4Н), 2,15 (м, 2Н), 3,82 (с, 3Н), 4,95 (м, 1Н), 5,4 (с, 2Н), 7,0 (д, 1Н), 7,05 (м, 1Н), 7,2 (с, 1Н), 7,4-7,65 (м, 7Н), 8,9 (с, 1Н). Масс-спектр: M+H+ 490 и 492.
С применением методики, аналогичной описанной в Примере 20, проводили взаимодействие 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-циклогексилоксихиназолина с трифторуксусной кислотой с получением 4-(2-хлор-5-метоксианилино)-5-циклогексилокси-7-гидроксихиназолина. ЯМР-спектр: (ДМСОd6 и CF3СО2D) 1,2-1,35 (м, 1Н), 1,4-1,55 (м, 2Н), 1,55-1,65 (м, 1Н), 1,7-1,85 (м, 4Н), 2,15 (м, 2Н), 3,82 (с, 3Н), 4,85 (м, 1Н), 6,8 (с, 1Н), 7,0 (с, 1Н), 7,05 (м, 1Н), 7,55 (д, 1Н), 7,6 (д, 1Н), 8,82 (с, 1Н). Масс-спектр: М+Н+ 400 и 402.
[22] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта реакции, полученного в виде свободного основания, получены следующие данные. ЯМР-спектр: (CDCl3) 1,65-1,75 (м, 2Н), 1,75-1,8 (м, 2Н), 1,8-1,9 (м, 4Н), 2,05-2,18 (м, 4Н), 2,65 (м, 4Н), 2,98 (м, 2Н), 3,95 (с, 3Н), 4,22 (м, 2Н), 5,02 (м, 1Н), 6,62 (д, 1Н), 6,85 (д, 1Н), 7,4 (с, 1Н), 8,38 (с, 1Н), 8,55 (с, 1Н), 9,8 (с, 1Н). Масс-спектр: М+Н+ 517 и 519.
Применяемый в качестве исходного вещества 5-циклопентилокси-4-(2,4-дихлор-5-метоксианилино)-7-гидроксихиназолин получали следующим образом.
Ди-трет-бутилазодикарбоксилат (1,1 г) добавляли порциями к перемешиваемой смеси 5-гидрокси-7-метокси-3,4-дигидрохиназолин-4-она (1 г), циклопентанола (0,385 мл), трифенилфосфина (1,28 г) и метиленхлорида (16 мл), окружающая температура которого поддерживалась с помощью водяной бани. Смесь перемешивали при температуре окружающей среды в течение 1 часа. Добавляли 6М раствор хлороводорода в диэтиловом эфире (4 мл) и перемешивали смесь при температуре окружающей среды в течение 10 минут. Полученный осадок выделяли, промывали метиленхлоридом и этилацетатом и сушили в вакууме. Полученный таким образом продукт перемешивали в метаноле (16 мл), содержащем гидроксид натрия (0,28 г), при температуре окружающей среды в течение 1 часа. Смесь упаривали и твердое вещество растирали в присутствии воды (20 мл), содержащей уксусную кислоту (1 мл). Полученный осадок выделяли, поочередно промывали водой, этилацетатом и диэтиловым эфиром. Таким образом получали 5-циклопентилокси-7-метокси-3,4-дигидрохиназолин-4-он (0,52 г). ЯМР-спектр: (CDCl3) 1,55 (уш.с, 2Н), 1,75 (м, 4Н), 1,9 (м, 2Н), 3,85 (с, 3Н), 4,9 (уш.с, 1Н), 6,5 (с, 1Н), 6,62 (с, 1Н), 7,9 (с, 1Н), 11,62 (уш.с, 1Н). Масс-спектр: М+Н+ 261,5.
Полученное таким образом вещество смешивали с карбонатом калия (0,414 г) и добавляли N-метилпирролидин-2-он (10 мл) и тиофенол (0,306 мл). Полученную смесь перемешивали и нагревали до 175°С в течение 30 минут. Смесь упаривали и остаток вливали в воду (20 мл), содержащую уксусную кислоту (1 мл). Полученный осадок выделяли, промывали этилацетатом и сушили в вакууме с получением 5-циклопентилокси-7-гидрокси-3,4-дигидрохиназолин-4-она (0,4 г). ЯМР-спектр: (ДМСОd6) 1,6 (м, 2Н), 1,8 (м, 4Н), 1,9 (м, 2Н), 4,8 (уш.с, 1Н), 6,38 (с, 1Н), 6,5 (с, 1Н), 7,8 (с, 1Н), 10,35 (с, 1Н), 11,5 (уш.с, 1Н). Масс-спектр: М+H+ 247,5.
Смесь 5-циклопентилокси-7-гидрокси-3,4-дигидрохиназолин-4-она (13 г), уксусного ангидрида (25 мл) и пиридина (21 мл) перемешивали и нагревали до 100°С в течение 1 часа. Смесь упаривали, растворяли остаток в смеси воды (70 мл) и метанола (70 мл) и перемешивали при 15°С в течение 30 минут. Метанол выпаривали, полученный осадок выделяли, промывали водой и сушили в вакууме с получением 7-ацетокси-5-циклопентилокси-3,4-дигидрохиназолин-4-она (12,2 г). ЯМР-спектр: (ДМСОd6) 1,6 (уш.с, 2Н), 1,8 (м, 4Н), 1,92 (м, 2Н), 2,3 (с, 3Н), 4,9 (м, 1Н), 6,8 (с, 1Н), 6,9 (с, 1Н), 7,95 (с, 1Н), 11,9 (уш.с, 1Н). Масс-спектр: М+Н+ 289,6.
С применением методики, аналогичной описанной в последнем параграфе Примечания [9] в Примере 15, проводили взаимодействие 7-ацетокси-5-циклопентилокси-3,4-дигидрохиназолин-4-она (5 г) с тетрахлоридом углерода и трифенилфосфином с получением 7-ацетокси-4-хлор-5-циклопентилоксихиназолина (5,3 г). ЯМР-спектр: (CDCl3) 1,65-1,8 (м, 2Н), 1,8-2,05 (м, 4Н), 2,1 (м, 2Н), 2,4 (с, 3Н), 4,95 (м, 1Н), 6,78 (д, 1Н), 7,35 (д, 1Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 307 и 309.
Смесь части (1 г) полученного таким образом вещества, 2,4-дихлор-5-метоксианилингидрохлорида (0,82 г), триэтиламина (0,408 мл) и изопропанола (6 мл) перемешивали и нагревали до 80°С в течение 1,5 часов. Осадок выделяли, поочередно промывали изопропанолом, этилацетатом и диэтиловым эфиром и сушили в вакууме с получением 7-ацетокси-5-циклопентилокси-4-(2,4-дихлор-5-метоксианилино)хиназолина (1,2 г). ЯМР-спектр: (ДМСОd6) 1,6-1,8 (м, 4Н), 1,95-2,2 (м, 4Н), 2,4 (с, 3Н), 3,9 (с, 3Н), 5,25 (уш.с, 1Н), 7,3 (с, 2Н), 7,82 (с, 1Н), 7,9 (с, 1Н), 8,82 (с, 1Н), 10,32 (с, 1Н). Масс-спектр: М+Н+ 462 и 464.
Смесь полученного таким образом вещества и насыщенного метанольного раствора аммиака (20 мл) перемешивали при температуре окружающей среды в течение 4 часов. Смесь упаривали и растирали остаток в присутствии воды. Полученное твердое вещество выделяли и сушили в вакууме с получением 5-циклопентилокси-4-(2,4-дихлор-5-метоксианилино)-7-гидроксихиназолина (1 г). ЯМР-спектр: (ДМСОd6) 1,6-1,8 (м, 4Н), 1,95 (м, 2Н), 2,0-2,15 (м, 2Н), 3,9 (с, 3H), 5,15 (м, 1Н), 6,7 (с, 2Н), 7,7 (с, 1Н), 8,3 (с, 1Н), 8,4 (с, 1Н), 9,7 (с, 1Н), 10,5-10,7 (уш.с, 1Н). Масс-спектр: М+Н+ 420 и 422.
[23] Для продукта в виде свободного основания получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3СО2D) 1,5 (д, 6Н), 2,2-2,3 (м, 2Н), 3,15 (т, 2Н), 3,3-3,4 (м, 2Н), 3,52 (д, 2Н), 3,7 (м, 2Н), 3,8 (с, 3Н), 4,02 (д, 2Н), 4,3 (т, 2Н), 5,1-5,2 (м, 1Н), 6,9 (с, 1Н), 7,0 (м, 2Н), 7,55 (д, 1Н), 7,65 (с, 1Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 487 и 489.
[24] Для продукта в виде свободного основания получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,5 (д, 6Н), 1,95 (м, 2Н), 2,18 (с, 3H), 2,2-2,6 (м, 10Н), 3,8 (с, 3Н), 4,2 (т, 2Н), 5,1 (м, 1Н), 6,75-6,85 (м, 3H), 7,48 (д, 1Н), 8,2 (с, 1Н), 8,5 (с, 1Н), 10,0 (с, 1Н). Масс-спектр: М+Н+ 500 и 502.
[25] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта в виде свободного основания получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,7 (уш.с, 4Н), 1,8-1,95 (м, 2Н), 2,15 (д, 2Н), 2,55 (уш.с, 4Н), 2,85 (м, 2Н), 3,55 (м, 2Н), 3,95 (м, 2Н), 4,22 (м, 2Н), 5,05 (м, 1Н), 6,15 (с, 2Н), 6,75 (д, 1Н), 6,85 (д, 1Н), 6,9-7,0 (м, 2Н), 8,1 (д, 1Н), 8,5 (с, 1Н), 9,85 (с, 1Н). Масс-спектр: М+Н+ 479.
Применяемый в качестве исходного вещества 4-(2,3-метилендиоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Смесь 7-ацетокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (3,04 г), диизопропилэтиламина (4,34 мл), фосфорилхлорида (1,02 мл) и 1,2-дихлорэтана (60 мл) перемешивали и нагревали до 80°С в течение 2 часов. Смесь упаривали с получением 7-ацетокси-4-хлор-5-тетрагидропиран-4-илоксихиназолина, который использовали без дополнительной очистки.
Смесь полученного таким образом вещества, 2,3-метилендиоксианилина (1,5 г) и изопропанола (20 мл) перемешивали и нагревали до 80°С в течение 1 часа. Смесь охлаждали до температуры окружающей среды, полученное твердое вещество выделяли, поочередно промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали 7-ацетокси-4-(2,3-метилендиоксианилино)-5-тетрагидропиран-4-илоксихиназолингидрохлорид (3,6 г). ЯМР-спектр: (ДМСОd6) 1,9-2,05 (м, 2Н), 2,1-2,25 (м, 2Н), 2,4 (с, 3Н), 3,55 (м, 2Н), 3,98 (м, 2Н), 5,1 (м, 1Н), 6,2 (с, 2Н), 6,95-7,05 (м, 2Н), 7,32 (с, 1Н), 7,5 (с, 1Н), 7,62 (м, 1Н), 9,0 (с, 1Н). Масс-спектр: М+Н+ 424.
С применением методики, аналогичной описанной выше в последнем параграфе Примечания [22], проводили взаимодействие 7-ацетокси-4-(2,3-метилендиоксианилино)-5-тетрагидропиран-4-илоксихиназолина с насыщенным метанольным раствором аммиака с получением 4-(2,3-метилендиоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолина. ЯМР-спектр: (ДМСОd6) 1,8-1,95 (м, 2Н), 2,1-2,2 (м, 2Н), 3,52 (м, 2Н), 3,8 (с, 3Н), 3,9 (м, 2Н), 4,95 (м, 1Н), 6,7 (с, 1Н), 6,75 (д, 1Н), 6,85 (с, 1Н), 7,6 (д, 1Н), 7,88 (с, 1Н), 8,4 (с, 1Н), 9,65 (с, 1Н), 10,6 (уш.с, 1Н). Масс-спектр: М+Н+ 382.
[26] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта в виде свободного основания получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,7 (уш.с, 4Н), 1,75-1,9 (м, 2Н), 1,9-2,0 (м, 2Н), 2,15 (д, 2Н), 2,5 (уш.с, 4Н), 2,6 (м, 2Н), 3,55 (м, 2Н), 3,9 (м, 2Н), 4,18 (м, 2Н), 5,0 (м, 1Н), 6,1 (с, 2Н), 6,72 (д, 1Н), 6,8 (с, 1Н), 6,9 (м, 2Н), 8,08 (д, 1Н), 8,5 (с, 1Н), 8,82 (с, 1Н). Масс-спектр: М+Н+ 493.
[27] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в изопропаноле с получением 4-(2-бром-5-метоксианилино)-5-пиперидин-4-илокси-7-(3-пиридилметокси)хиназолиндигидрохлорида, часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,85-2,0 (м, 2Н), 2,25 (д, 2Н), 2,78 (м, 2Н), 3,2 (м, 2Н), 3,85 (с, 3H), 4,65 (м, 1Н), 5,2 (с, 2Н), 6,62 (с, 1Н), 6,65 (м, 1Н), 6,92 (д, 1Н), 7,38 (м, 1Н), 7,5 (д, 1Н), 7,82 (д, 1Н), 7,92 (д, 1Н), 8,55 (с, 1Н), 8,65 (д, 1Н), 8,75 (с, 1Н), 9,72 (с, 1Н). Масс-спектр: М+Н+ 536 и 538.
[28] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,8-1,9 (м, 4Н), 1,95-2,1 (м, 2Н), 2,12 (д, 2Н), 2,68 (уш.с, 4Н), 3,0 (т, 2Н), 3,58 (т, 2Н), 3,98 (с, 3Н), 4,08 (м, 2Н), 4,25 (т, 2Н), 4,72 (м, 1Н), 6,8 (д, 1Н), 6,9 (д, 1Н), 7,42 (с, 1Н), 8,4 (с, 1Н), 8,6 (с, 1Н), 9,9 (с, 1Н). Масс-спектр: М+Н+ 533 и 535.
Применяемый в качестве исходного вещества 4-(2,4-дихлор-5-метоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Смесь 7-ацетокси-4-хлор-5-тетрагидропиран-4-илоксихиназолина (полученного из 7-ацетокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (3,04 г) и фосфорилхлорида), 2,4-дихлор-5-метоксианилина (2,1 г) и изопропанола (20 мл) перемешивали и нагревали до 80°С в течение 1 часа. Смесь охлаждали до температуры окружающей среды, полученное твердое вещество выделяли, поочередно промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали 7-ацетокси-4-(2,4-дихлор-5-метоксианилино)-5-тетрагидропиран-4-илоксихиназолингидрохлорид (3,5 г). ЯМР-спектр: (ДМСОd6 и CF3СО2D) 1,9-2,1 (м, 2Н), 2,15 (д, 2Н), 2,4 (с, 3H), 3,52 (т, 2Н), 3,9 (с, 3H), 3,95 (м, 2Н), 5,1 (м, 1Н), 7,4 (д, 1Н), 7,55 (д, 1Н), 7,78 (с, 1Н), 7,95 (с, 1Н), 8,95 (с, 1Н). Масс-спектр: М+Н+ 478 и 480.
С применением методики, аналогичной описанной выше в последнем параграфе Примечания [22], проводили взаимодействие 7-ацетокси-4-(2,4-дихлор-5-метоксианилино)-5-тетрагидропиран-4-илоксихиназолина с насыщенным метанольным раствором аммиака с получением 4-(2,4-дихлор-5-метоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолина. ЯМР-спектр: (ДМСОd6) 1,75-1,9 (м, 2Н), 2,18 (д, 2Н), 3,52 (т, 2Н), 3,9 (с, 3Н), 3,95 (м, 2Н), 4,95 (м, 1Н), 6,7 (д, 1Н), 6,82 (д, 1Н), 7,7 (с, 1Н), 8,35 (с, 1Н), 8,42 (с, 1Н), 9,85 (с, 1Н), 10,5-10,7 (уш.с, 1Н). Масс-спектр: М+Н+ 436 и 438.
[29] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,85 (уш.с, 4Н), 2,0-2,15 (м, 4Н), 2,25 (д, 2Н), 2,6 (уш.с, 4Н), 2,68 (т, 2Н), 3,6 (т, 2Н), 3,96 (с, 3H), 4,08 (м, 2Н), 4,18 (т, 2Н), 4,75 (м, 1Н), 6,6 (д, 1Н), 6,88 (д, 1Н), 7,45 (с, 1Н), 8,4 (с, 1Н), 8,6 (с, 1Н). Масс-спектр: М+Н+ 547 и 549.
[30] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,4-1,5 (м, 2Н), 1,5-1,75 (м, 6Н), 2,0-2,1 (м, 2Н), 2,25 (д, 2Н), 2,52 (уш.с, 4Н), 2,85 (т, 2Н), 3,58 (м, 2Н), 3,96 (с, 3H), 4,08 (м, 2Н), 4,25 (т, 2Н), 4,75 (м, 1Н), 6,65 (д, 1Н), 6,68 (д, 1Н), 7,25 (с, 1Н), 8,4 (с, 1Н), 8,58 (с, 1Н), 9,85 (с, 1Н). Масс-спектр: M+H+ 547 и 549.
[31] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,98-2,12 (м, 4Н), 2,22 (д, 2Н), 2,32 (с, 3Н), 2,5 (уш.с, 2Н), 2,65 (уш.с, 2Н), 2,9 (т, 2Н), 3,6 (м, 2Н), 3,96 (с, 3Н), 4,08 (м, 2Н), 4,25 (т, 2Н), 4,75 (м, 1Н), 6,61 (д, 1Н), 6,86 (д, 1Н), 7,42 (с, 1Н), 8,4 (с, 1Н), 8,6 (с, 1Н), 9,85 (д, 1Н). Масс-спектр: M+H+ 562 и 564.
[32] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,1 (м, 2Н), 2,22 (д, 2Н), 2,6 (м, 4Н), 2,9 (т, 2Н), 3,6 (м, 2Н), 3,8 (м, 4Н), 3,98 (с, 3Н), 4,08 (м, 2Н), 4,25 (т, 2Н), 4,75 (м, 1Н), 6,62 (д, 1Н), 6,88 (д, 1Н), 7,42 (с, 1Н), 8,4 (с, 1Н), 8,6 (с, 1Н), 9,9 (с, 1Н). Масс-спектр: M+H+ 549 и 551.
[33] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 590 и 592.
Применяемый в качестве исходного вещества (2S)-1-(2-гидроксиэтил)-N-метилпролинамид получали следующим образом.
Смесь 1-(трет-бутоксикарбонил)-L-пролина (5,4 г), 1-(3-диметиламинопропил)-3-этилкарбодиимида (5,3 г), метиламингидрохлорида (2,2 г), 4-диметиламинопиридина (3 г) и метиленхлорида (50 мл) перемешивали при температуре окружающей среды в течение 16 часов. Полученную смесь вливали в воду, органический слой выделяли, поочередно промывали 1М водным раствором гидросульфата калия, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Таким образом получали 1-(трет-бутоксикарбонил)-N-метил-L-пролинамид (5,6 г). Масс-спектр: М+Н+ 229.
Смесь части (4,4 г) полученного таким образом вещества и трифторуксусной кислоты (10 мл) перемешивали при температуре окружающей среды в течение 2 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали трифторацетат N-метил-L-пролинамида (3,7 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,85-2,05 (м, 3Н), 2,2-2,3 (м, 1Н), 2,73 (с, 3Н), 3,2-3,4 (м, 2Н), 4,2 (м, 1Н).
Смесь части (2,5 г) полученного таким образом вещества, 2-бромэтанола (2,15 мл), карбоната калия (5,5 г) и ацетонитрила (20 мл) перемешивали и нагревали с обратным холодильником в течение 18 часов. Смесь охлаждали до температуры окружающей среды, фильтровали, упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (49:1). Таким образом получали (2S)-1-(2-гидроксиэтил)-N-метилпролинамид (0,5 г). ЯМР-спектр: (CDCl3) 1,6-2,0 (м, 4Н), 2,1-2,3 (м, 1Н), 2,3-2,45 (м, 1Н), 2,6-2,7 (м, 1Н), 2,85 (д, 3Н), 2,8-2,9 (м, 1Н), 3,1-3,2 (м, 1Н), 3,2-3,3 (м, 1Н), 3,6-3,8 (м, 2Н). Масс-спектр: M+Н+ 173.
[34] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 576 и 578.
Применяемый в качестве исходного вещества (2S)-1-(2-гидроксиэтил)пролинамид получали путем взаимодействия L-пролинамида и 2-бромэтанола с применением методики, аналогичной описанной выше в Примечании [33]. Таким образом получали необходимое исходное вещество. ЯМР-спектр: (CDCl3) 1,6-2,0 (м, 4Н), 2,1-2,25 (м, 1Н), 2,35-2,45 (м, 1Н), 2,6-2,7 (м, 1Н), 2,8-3,0 (м, 1Н), 3,1 (м, 1Н), 3,2-3,3 (м, 1Н), 3,6-3,8 (м, 2Н), 5,6 (уш.с, 1Н), 7,4 (уш.с, 1Н). Масс-спектр: М+Н+ 159.
[35] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 646 и 648.
Применяемый в качестве исходного вещества (2S)-1-(2-гидроксиэтил)-2-морфолинокарбонилпирролидин получали следующим образом.
С применением методик, аналогичных описанным выше в Примечании [33], проводили взаимодействие 1-(трет-бутоксикарбонил)-L-пролина с морфолином с получением (2S)-1-трет-бутоксикарбонил)-2-морфолинокарбонилпирролидина, с которого снимали защиту и проводили взаимодействие с 2-бромэтанолом. Таким образом получали необходимое исходное вещество. ЯМР-спектр: (CDCl3) 1,7-2,0 (м, 4Н), 2,1-2,2 (м, 1Н), 2,4-2,5 (м, 1Н), 2,6-2,7 (м, 1Н), 2,8-2,9 (м, 1Н), 3,3-3,4 (м, 2Н), 3,4-3,8 (м, 10Н). Масс-спектр: M+H+ 229.
[36] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 659 и 661.
Применяемый в качестве исходного вещества (2S)-1-(2-гидроксиэтил)-2-(4-метилпиперазин-1-илкарбонил)пирролидин получали следующим образом.
С применением методик, аналогичных описанным выше в Примечании [33], проводили взаимодействие 1-трет-бутоксикарбонил)-L-пролина с 1-метилпиперазином с получением (2S)-1-трет-бутоксикарбонил)-2-(4-метилпиперазин-1-илкарбонил)пирролидина, с которого снимали защиту и проводили взаимодействие с 2-бромэтанолом. Таким образом получали необходимое исходное вещество. ЯМР-спектр: (CDCl3) 1,7-2,05 (м, 4Н), 2,1-2,25 (м, 1Н), 2,32 (с, 3H), 2,35-2,5 (м, 4Н), 2,6-2,7 (м, 1Н), 2,8-2,9 (м, 1Н), 3,3-3,7 (м, 8Н), 4,15 (уш.с, 1Н). Масс-спектр: М+Н+ 242.
[37] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 630 и 632.
Применяемый в качестве исходного вещества (2S)-1-(2-гидроксиэтил)-2-(пирролидин-1-илкарбонил)пирролидин получали следующим образом.
С применением методик, аналогичных описанным выше в Примечании [33], проводили взаимодействие 1-трет-бутоксикарбонил)-L-пролина с пирролидином с получением (2S)-1-(трет-бутоксикарбонил)-2-(пирролидин-1-илкарбонил)пирролидина, с которого снимали защиту и проводили взаимодействие с 2-бромэтанолом. Таким образом получали необходимое исходное вещество. ЯМР-спектр: (CDCl3) 1,7-2,05 (м, 8Н), 2,1-2,3 (м, 1Н), 2,4-2,5 (м, 1Н), 2,55-2,7 (м, 1Н), 2,8-2,9 (м, 1Н), 3,2-3,3 (м, 2Н), 3,4-3,7 (м, 5Н), 4,1 (уш.с, 1Н). Масс-спектр: М+Н+ 213.
[38] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 644 и 646.
Применяемый в качестве исходного вещества (2S)-1-(2-гидроксиэтил)-2-пиперидинокарбонилпирролидин получали следующим образом.
С применением методик, аналогичных описанным выше в Примечании [33], проводили взаимодействие 1-трет-бутоксикарбонил)-L-пролина с пиперидином с получением (2S)-1-трет-бутоксикарбонил)-2-пиперидинокарбонилпирролидина, с которого снимали защиту и проводили взаимодействие с 2-бромэтанолом. Таким образом получали необходимое исходное вещество. ЯМР-спектр: (CDCl3) 1,5-1,9 (м, 10Н), 1,9-2,0 (м, 1Н), 2,1-2,2 (м, 1Н), 2,4-2,5 (м, 1Н), 2,55-2,65 (м, 1Н), 2,8-2,9 (м, 1Н), 3,3-3,7 (м, 6Н), 4,3 (уш.с, 1Н). Масс-спектр: М+H+ 227.
[39] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 547 и 549.
Применяемый в качестве исходного вещества (2R)-1-(2-гидроксиэтил)-2-метилпирролидин получали следующим образом.
Смесь (2R)-2-метилпирролидина (0,853 г), 2-бромэтанола (1,1 мл), карбоната калия (2,8 г) и ацетонитрила (10 мл) перемешивали и нагревали с обратным холодильником в течение 18 часов. Смесь фильтровали и упаривали фильтрат. Полученный остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (49:1). Таким образом получали (2R)-1-(2-гидроксиэтил)-2-метилпирролидин (0,35 г). ЯМР-спектр: (CDCl3) 1,1 (д, 3Н), 1,3-1,5 (м, 1Н), 1,6-1,8 (м, 3Н), 1,95 (м, 1Н), 2,15 (м, 1Н), 2,28 (м, 1Н), 2,4-2,5 (м, 1Н), 2,95-3,05 (м, 1Н), 3,2 (м, 1Н), 3,5-3,8 (м, 2Н). Масс-спектр: М+Н+ 130.
[40] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 577 и 579.
Применяемый в качестве исходного вещества (2S)-1-(2-гидроксиэтил)-2-метоксиметилпирролидин получали следующим образом.
С применением методик, аналогичных описанным выше в Примечании [39], проводили взаимодействие (2S)-2-метоксиметилпирролидина с 2-бромэтанолом с получением (2S)-1-(2-гидроксиэтил)-2-метоксиметилпирролидина. ЯМР-спектр: (CDCl3) 1,5-1,65 (м, 1Н), 1,65-1,8 (м, 2Н), 1,8-2,0 (м, 2Н), 2,3 (м, 1Н), 2,6 (м, 1Н), 2,8 (м, 1Н), 2,95-3,05 (м, 1Н), 3,17 (м, 1Н), 3,3 (т, 1Н), 3,35 (т, 1Н), 3,37 (с, 3Н), 3,5-3,7 (м, 2Н).
[41] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 557 и 559.
[42] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 527 и 529.
[43] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 527 и 529.
[44] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 533 и 535.
[45] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-N-метилпролинамид, реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+H+ 600 и 602.
[46] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-морфолинокарбонилпирролидин, реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 658 и 660.
[47] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-(4-метилпиперазин-1-илкарбонил)пирролидин, реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 671 и 673.
[48] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-(пирролидин-1-илкарбонил)пирролидин, реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 642 и 644.
[49] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-пиперидинокарбонилпирролидин, реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 656 и 658.
[50] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)пролинамид, реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 588 и 590.
[51] В качестве исходного вещества применяли (2R)-1-(2-гидроксиэтил)-2-метилпирролидин, реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 557 и 559.
[52] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-метоксиметилпирролидин, реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 587 и 589.
[53] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 537 и 539.
[54] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 537 и 539.
[55] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-(6-хлор-2,3-метилендиоксианилино)-7-гидроксихиназолин и изопропанол. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. После этого добавляли 6М раствор хлороводорода в диэтиловом эфире и перемешивали реакционную смесь при температуре окружающей среды в течение 1 часа. Полученный осадок выделяли, промывали этилацетатом и диэтиловым эфиром и сушили. Таким образом получали требуемый продукт, 4-(6-хлор-2,3-метилендиоксианилино)-7-изопропокси-5-пиперидин-4-илоксихиназолин. ЯМР-спектр: (CDCl3) 1,4 (д, 6Н), 1,8-1,9 (м, 2Н), 2,25 (м, 2Н), 1,75-1,85 (м, 2Н), 3,1-3,2 (м, 2Н), 4,7 (м, 1Н), 4,72 (м, 1Н), 6,05 (с, 2Н), 6,5 (д, 1Н), 6,7 (д, 1Н), 6,82 (д, 1Н), 6,98 (д, 1Н), 8,5 (с, 1Н), 9,32 (с, 1Н). Масс-спектр: М+Н+ 457 и 459.
Применяемый в качестве исходного вещества 5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-(6-хлор-2,3-метилендиоксианилино)-7-гидроксихиназолин описан в настоящем документе в Примере 35.
[56] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-(6-хлор-2,3-метилендиоксианилино)-7-гидроксихиназолин и этанол. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. После этого добавляли 6М раствор хлороводорода в диэтиловом эфире и перемешивали реакционную смесь при температуре окружающей среды в течение 1 часа. Полученный осадок выделяли, промывали этилацетатом и диэтиловым эфиром и сушили. Таким образом получали требуемый продукт, 4-(6-хлор-2,3-метилендиоксианилино)-7-этокси-5-пиперидин-4-илоксихиназолин. ЯМР-спектр: (CDCl3) 1,45 (т, 3Н), 1,7-1,9 (м, 2Н), 2,1-2,25 (м, 2Н), 2,7-2,8 (м, 2Н), 3,05-3,2 (м, 2Н), 4,12 (кв, 2Н), 4,6 (м, 1Н), 6,02 (с, 2Н), 6,48 (д, 1Н), 6,7 (д, 1Н), 6,8 (д, 1Н), 6,92 (д, 1Н), 8,5 (с, 1Н), 9,3 (с, 1Н). Масс-спектр: М+Н+ 443 и 445.
[57] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-(6-хлор-2,3-метилендиоксианилино)-7-гидроксихиназолин и изобутанол. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. После этого добавляли 6М раствор хлороводорода в диэтиловом эфире и перемешивали реакционную смесь при температуре окружающей среды в течение 1 часа. Полученный осадок выделяли, промывали этилацетатом и диэтиловым эфиром и сушили. Таким образом получали требуемый продукт, 4-(6-хлор-2,3-метилендиоксианилино)-7-изобутокси-5-пиперидин-4-илоксихиназолин. ЯМР-спектр: (CDCl3) 1,05 (д, 6Н), 1,8-1,9 (м, 2Н), 2,12 (м, 1Н), 2,2-2,3 (м, 2Н), 2,75-2,9 (м, 2Н), 3,1-3,2 (м, 2Н), 4,85 (д, 2Н), 4,65 (м, 1Н), 6,05 (с, 2Н), 6,5 (д, 1Н), 6,7 (д, 1Н), 6,8 (д, 1Н), 6,95 (д, 1Н), 8,5 (с, 1Н), 9,32 (с, 1Н). Масс-спектр: М+Н+ 471 и 473.
[58] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-(6-хлор-2,3-метилендиоксианилино)-7-гидроксихиназолин и 2-фторэтанол. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. После этого добавляли 6М раствор хлороводорода в диэтиловом эфире и перемешивали реакционную смесь при температуре окружающей среды в течение 1 часа. Полученный осадок выделяли, промывали этилацетатом и диэтиловым эфиром и сушили. Таким образом получали требуемый продукт, 4-(6-хлор-2,3-метилендиоксианилино)-7-(2-фторэтокси)-5-пиперидин-4-илоксихиназолин. ЯМР-спектр: (CDCl3) 1,8-2,0 (м, 2Н), 2,2-2,3 (м, 2Н), 2,8-2,9 (м, 2Н), 3,1-3,3 (м, 2Н), 4,3 (м, 1Н), 4,4 (м, 1Н), 4,7 (м, 1Н), 4,8 (м, 1Н), 4,9 (м, 1Н), 6,08 (с, 2Н), 6,6 (д, 1Н), 6,75 (д, 1Н), 6,82 (д, 1Н), 7,0 (д, 1Н), 8,55 (с, 1Н), 9,35 (с, 1Н). Масс-спектр: М+Н+ 461 и 463.
[59] В качестве исходного вещества использовали (2R,5R)-1-(2-гидроксиэтил)-2,5-диметоксиметилпирролидин и перемешивали реакционную смесь при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида. Часть его обрабатывали насыщенным метанольным раствором аммиака, смесь фильтровали и упаривали фильтрат с получением свободного основания, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,6-1,7 (м, 4Н), 1,9-2,1 (м, 2Н), 2,22 (м, 2Н), 3,15-3,5 (м, 8Н), 3,33 (с, 6Н), 3,6 (м, 2Н), 4,08 (м, 2Н), 4,12 (м, 2Н), 4,75 (м, 1Н), 6,05 (с, 2Н) 6,58 (д, 1Н), 6,7 (д, 1Н), 6,9 (д, 1Н), 6,95 (м, 1Н), 8,1 (д, 1Н), 8,6 (с, 1Н), 9,75 (с, 1Н). Масс-спектр: М+Н+ 567.
[60] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Продукт реакции очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (24:1). Для полученного продукта получены следующие данные. Масс-спектр: М+Н+ 503.
[61] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Продукт реакции очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смеси метиленхлорида и насыщенного метанольного раствора аммиака с увеличивающейся полярностью. Для полученного продукта получены следующие данные. Масс-спектр: М+Н+ 473.
[62] Реакционную смесь перемешивали при температуре окружающей среды в течение 3 часов. Продукт реакции очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смеси метиленхлорида и насыщенного метанольного раствора аммиака с увеличивающейся полярностью. Для полученного продукта получены следующие данные. Масс-спектр: М+Н+ 473.
[63] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-N-метилпролинамид и перемешивали реакционную смесь при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 536.
[64] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-морфолинокарбонилпирролидин и перемешивали реакционную смесь при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: M+H+ 592.
[65] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-(4-метилпиперазин-1-илкарбонил)пирролидин и перемешивали реакционную смесь при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 605.
[66] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-(пирролидин-1-илкарбонил)пирролидин и перемешивали реакционную смесь при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 576.
[67] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-пиперидинокарбонилпирролидин и перемешивали реакционную смесь при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 590.
[68] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)пролинамид и перемешивали реакционную смесь при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 522.
[69] В качестве исходного вещества применяли (2R)-1-(2-гидроксиэтил)-2-метилпирролидин и перемешивали реакционную смесь при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 493.
[70] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-метоксиметилпирролидин и перемешивали реакционную смесь при температуре окружающей среды в течение 3 часов. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 523.
[71] Реагенты представляли собой 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин и 1-(трет-бутоксикарбонил)4-(3-гидроксипропил)пиперазин, и перемешивали реакционную смесь при температуре окружающей среды в течение 2 часов. После этого добавляли трифторуксусную кислоту (1 мл) и перемешивали смесь при температуре окружающей среды в течение 16 часов. Смесь упаривали и растирали остаток в присутствии насыщенного метанольного раствора аммиака (1 мл). Добавляли метиленхлорид и фильтровали смесь. Фильтрат упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (97:3). Полученное таким образом вещество обрабатывали 6М раствором хлороводорода в диэтиловом эфире. Осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением дигидрохлорида (0,11 г) требуемого продукта, часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 4Н), 2,2-2,3 (м, 2Н), 2,3-2,5 (м, 4Н), 2,55 (м, 2Н), 2,91 (м, 4Н), 3,65 (м, 2Н), 4,05 (м, 2Н), 4,15 (м, 2Н), 4,8 (м, 1Н), 6,06 (с, 2Н), 6,5 (д, 1Н), 6,72 (д, 1Н), 6,84 (д, 1Н), 6,97 (д, 1Н), 8,5 (с, 1Н), 9,26 (с, 1Н). Масс-спектр: М+Н+ 542 и 544.
Применяемый в качестве исходного вещества 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Смесь 7-бензилокси-4-(6-хлор-2,3-метилендиоксианилино)-5-тетрагидропиран-4-илоксихиназолина (Пример 17 [34], 0,2 г) и трифторуксусной кислоты (2 мл) перемешивали и нагревали до 80°С в течение 6 часов. Смесь упаривали и растирали остаток в присутствии 6М раствора хлороводорода в диэтиловом эфире. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Твердое вещество обрабатывали насыщенным метанольным раствором аммиака. Смесь фильтровали, фильтрат упаривали и растирали остаток в присутствии метиленхлорида. Полученное таким образом твердое вещество промывали метиленхлоридом и сушили в вакууме. Таким образом получали 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин (0,17 г). ЯМР-спектр: (ДМСОd6) 1,8-1,9 (м, 2Н), 2,05-2,2 (м, 2Н), 3,5-3,6 (м, 2Н), 3,8-3,9 (м, 2Н), 4,95 (м, 1Н), 6,08 (с, 2Н), 6,7 (д, 1Н), 6,8 (д, 1Н), 6,95 (д, 1Н), 7,05 (д, 1Н), 8,35 (с, 2Н), 9,32 (с, 1Н), 10,8 (уш.с, 1Н). Масс-спектр: М+Н+ 414 и 416.
Применяемый в качестве исходного вещества 1-трет-бутоксикарбонил)-4-(3-гидроксипропил)пиперазин получали с применением методики, аналогичной описанной в заявке на выдачу Европейского патента №0388309.
Смесь 3-бромпропанола (25 мл), 1-(трет-бутоксикарбонил)пиперазина (29 мл), карбоната калия (83 г) и этанола (200 мл) перемешивали и нагревали с обратным холодильником в течение 20 часов. Смесь охлаждали до температуры окружающей среды и фильтровали. Фильтрат упаривали и растирали остаток в присутствии диэтилового эфира. Полученную смесь фильтровали и упаривали фильтрат. Остаток очищали путем перегонки с получением требуемого исходного вещества в виде масла.
[72] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида продукта, часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 4Н), 2,15-2,3 (м, 2Н), 2,28 (с, 3Н), 2,4-2,7 (м, 10Н), 3,6-3,7 (м, 2Н), 4,0-4,1 (м, 2Н), 4,15 (м, 2Н), 4,75 (м, 1Н), 6,05 (с, 2Н), 6,5 (д, 1Н), 6,72 (д, 1Н), 6,83 (д, 1Н), 6,97 (д, 1Н), 8,52 (с, 1Н), 9,26 (с, 1Н). Масс-спектр: M+H+ 556 и 558.
[73] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида продукта, часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,05 (м, 2Н), 2,2-2,3 (м, 2Н), 2,31 (с, 3Н), 2,4-2,7 (м, 8Н), 2,87 (м, 2Н), 2,55-2,7 (м, 2Н), 3,95-4,05 (м, 2Н), 4,25 (м, 2Н), 4,75 (м, 1Н), 6,05 (с, 2Н), 6,55 (д, 1Н), 6,72 (д, 1Н), 6,83 (д, 1Н), 6,97 (д, 1Н), 8,52 (с, 1Н), 9,26 (с, 1Н). Масс-спектр: М+Н+ 542 и 544.
[74] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида продукта, часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,4-1,5 (м, 2Н), 1,6-1,7 (м, 4Н), 1,9-2,05 (м, 2Н), 2,2-2,3 (м, 2Н), 2,5 (уш.с, 4Н), 2,82 (м, 2Н), 3,62 (м, 2Н), 4,05 (м, 2Н), 4,22 (м, 2Н), 4,75 (м, 1Н), 6,05 (с, 2Н), 6,55 (д, 1Н), 6,71 (д, 1Н), 6,83 (д, 1Н), 6,97 (д, 1Н), 8,52 (с, 1Н), 9,27 (с, 1Н). Масс-спектр: М+Н+ 527 и 529.
[75] Реагенты представляли собой 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин и N-(трет-бутоксикарбонил)-4-(2-гидроксиэтил)пиперидин (J.Med. Chem., 1994, 37, 2721) и реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. После этого добавляли трифторуксусную кислоту (1 мл) и перемешивали смесь при температуре окружающей среды в течение 16 часов. Смесь упаривали и растирали остаток в присутствии насыщенного метанольного раствора аммиака (1 мл). Добавляли метиленхлорид и фильтровали смесь. Фильтрат упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (97:3). Полученное таким образом вещество обрабатывали 6М раствором хлороводорода в диэтиловом эфире. Осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением требуемого продукта. ЯМР-спектр: (ДМСОd6 и CF3СО2D) 1,35-1,5 (м, 2Н), 1,75-1,95 (м, 5Н), 2,0-2,15 (м, 4Н), 2,8-2,95 (м, 2Н), 3,3 (д, 2Н), 3,55 (м, 2Н), 3,92 (м, 2Н), 4,25 (м, 2Н), 5,15 (м, 1Н), 6,14 (с, 2Н), 6,94 (д, 1Н), 7,04 (д, 1Н), 7,13 (д, 1Н), 7,15 (с, 1Н), 8,84 (с, 1Н). Масс-спектр: М+Н+ 527 и 529.
[76] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Продукт реакции обрабатывали 6М раствором хлороводорода в диэтиловом эфире с получением дигидрохлорида продукта, часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 2Н), 2,2-2,3 (м, 2Н), 3,6-3,7 (м, 2Н), 4,0-4,1 (м, 2Н), 4,42 (м, 2Н), 4,5 (м, 2Н), 4,8 (м, 1Н), 6,06 (с, 2Н), 6,56 (д, 1Н), 6,73 (д, 1Н), 6,9 (м, 3Н), 7,0 (д, 1Н), 8,47 (д, 2Н), 8,54 (с, 1Н), 9,28 (с, 1Н). Масс-спектр: М+Н+ 537 и 539.
[77] Реакционную смесь перемешивали при температуре окружающей среды в течение 2 часов. Для продукта получены следующие данные. ЯМР-спектр: (CDCl3) 1,25-1,4 (м, 2Н), 1,5 (с, 9Н), 1,75-1,9 (м, 2Н), 1,9-2,1 (м, 3Н), 2,2-2,3 (м, 2Н), 2,7-2,8 (м, 2Н), 3,6-3,7 (м, 2Н), 3,95 (д, 2Н), 4,0-4,1 (м, 2Н), 4,1-4,3 (м, 2Н), 4,78 (м, 1Н), 6,08 (с, 2Н), 6,5 (д, 1Н), 6,75 (д, 1Н), 6,82 (д, 1Н), 6,97 (д, 1Н), 8,52 (с, 1Н), 9,28 (с, 1Н). Масс-спектр: М+Н+ 613 и 615.
[78] Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,6-1,75 (м, 4Н), 1,75-1,9 (м, 6Н), 2,0-2,2 (м, 4Н), 2,55 (м, 4Н), 2,65 (м, 2Н), 4,15 (м, 2Н), 5,0 (м, 1Н), 6,02 (с, 2Н), 6,5 (д, 1Н), 6,65 (д, 1Н), 6,8 (д, 1Н), 6,9 (м, 1Н), 8,12 (д, 1Н), 8,58 (с, 1Н), 8,8 (с, 1Н). Масс-спектр: M+H+ 477.
[79] Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,65-1,8 (м, 4Н), 1,9 (м, 2Н), 2,0-2,2 (м, 8Н), 2,3 (с, 3Н), 2,3-2,7 (м, 6Н), 4,15 (т, 2Н), 5,0 (м, 1Н), 6,02 (с, 2Н), 6,5 (с, 1Н), 6,65 (д, 1Н), 6,8 (д, 1Н), 6,92 (м, 1Н), 8,15 (д, 1Н), 8,6 (с, 1Н), 9,8 (с, 1Н). Масс-спектр: М+Н+ 506.
[80] Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,65-1,8 (м, 2Н), 1,8-1,95 (м, 2Н), 1,95-2,2 (м, 4Н), 2,3 (с, 3Н), 2,4-2,6 (м, 4Н), 2,6-2,8 (м, 4Н), 2,9 (м, 2Н), 4,2 (м, 2Н), 5,0 (м, 1Н), 6,0 (с, 2Н), 6,52 (д, 1Н), 6,65 (д, 1Н), 6,8 (д, 1Н), 6,9 (м, 1Н), 8,15 (д, 1Н), 8,6 (с, 1Н), 9,8 (с, 1Н). Масс-спектр: M+H+ 492.
[81] Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,6-1,7 (м, 6Н), 1,7-1,8 (м, 2Н), 1,8-1,95 (м, 2Н), 2,0-2,2 (м, 4Н), 2,55 (уш.с, 4Н), 2,82 (м, 2Н), 4,22 (м, 2Н), 5,0 (м, 1Н), 6,02 (с, 2Н), 6,52 (с, 1Н), 6,65 (д, 1Н), 6,8 (д, 1Н), 6,9 (м, 1Н), 8,15 (д, 1Н), 8,6 (с, 1Н), 9,8 (с, 1Н). Масс-спектр: M+H+ 477.
[82] В качестве исходного вещества применяли (2S)-1-(2-гидроксиэтил)-2-(4-метилпиперазин-1-илкарбонил)пирролидин и перемешивали реакционную смесь при температуре окружающей среды в течение 1 часа. Для продукта реакции получены следующие данные. Масс-спектр: М+Н+ 589.
[83] В качестве реагента применяли N-(трет-бутоксикарбонил)пиперидин-4-илметанол. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. После этого добавляли 6М раствор хлороводорода в диэтиловом эфире (2 мл) и перемешивали реакционную смесь при температуре окружающей среды в течение 16 часов. Смесь разбавляли метиленхлоридом (10 мл) и добавляли насыщенный метанольный раствор аммиака (3 мл). Смесь фильтровали и упаривали фильтрат досуха. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида, этилацетата и насыщенного метанольного раствора аммиака (50:47:3). Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,25-1,42 (м, 2Н), 1,6-1,7 (м, 4Н), 1,8-2,0 (м, 3Н), 2,0-2,2 (м, 4Н), 2,7 (м, 2Н), 3,15 (д, 2Н), 3,95 (д, 2Н), 5,05 (м, 1Н), 6,02 (с, 2Н), 6,5 (д, 1Н), 6,65 (д, 1Н), 6,8 (д, 1Н), 6,9 (м, 1Н), 8,15 (д, 1Н), 8,6 (с, 1Н), 8,8 (с, 1Н). Масс-спектр: М+Н+ 463.
[84] В качестве реагента применяли 1-(трет-бутоксикарбонил)-4-(3-гидроксипропил)пиперазин. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. После этого добавляли 6М раствор хлороводорода в диэтиловом эфире (2 мл) и перемешивали реакционную смесь при температуре окружающей среды в течение 16 часов. Смесь разбавляли метиленхлоридом (10 мл) и добавляли насыщенный метанольный раствор аммиака (3 мл). Смесь фильтровали и упаривали фильтрат досуха. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида, этилацетата и насыщенного метанольного раствора аммиака (50:47:3). Для продукта реакции получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 2Н), 1,8-1,95 (м, 2Н), 1,95-2,2 (м, 6Н), 1,9 (уш.с, 4Н), 1,95 (м, 2Н), 2,9 (м, 4Н), 4,15 (м, 2Н), 5,0 (м, 1Н), 6,02 (с, 2Н), 6,5 (д, 1Н), 6,65 (д, 1Н), 6,8 (д, 1Н), 6,9 (м, 1Н), 8,12 (д, 1Н), 8,6 (с, 1Н), 8,8 (с, 1Н). Масс-спектр: М+Н+ 492.
Пример 15
С применением методики, аналогичной описанной в Примере 5, проводили взаимодействие подходящего 4-хлорхиназолина с подходящим анилином в присутствии хлороводорода с получением дигидрохлоридов соединений, описанных в Таблице IV, часть которых преобразовывали в свободное основание.
| Таблица IV |
 |
| № и прим. |
(R1)m |
Q1 |
(R2)n |
| [1] |
7-метокси |
пиперидин-4-илметил |
2-бром-5-метокси |
| [2] |
7-метокси |
пиперидин-4-илметил |
2-хлор-5-метокси |
| [3] |
7-метокси |
пиперидин-4-илметил |
2,5-диметокси |
| [4] |
7-метокси |
пиперидин-4-илметил |
2,5-дихлор |
| [5] |
7-метокси |
пиперидин-4-илметил |
2,3-метилендиокси |
| [6] |
7-метокси |
N-метилпиперидин-4-ил |
2,5-дихлор |
| [7] |
7-метокси |
N-метилпиперидин-4-ил |
2-бром-5-хлор |
| [8] |
7-бензилокси |
пиперидин-4-ил |
2-бром-5-метокси |
| [9] |
6-метокси |
N-метилпиперидин-4-ил |
2-хлор-5-метокси |
| [10] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
2,4-дихлор-5-метокси |
| [11] |
6-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
2-хлор-5-метокси |
| [12] |
6-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
2,5-дихлор |
| [13] |
6-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
2-бром-5-метокси |
| [14] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
4-хлор-2-фтор-5-метокси |
| [15] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
4-бром-2-фтор |
| [16] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
2-пирролидин-1-ил-5-метокси |
| [17] |
7-[3-(4-метилпиперазин-1-ил)пропокси] |
4-тетрагидропиранил |
2,3-метилендиокси |
| [18] |
7-бензилокси |
N-трет-бутоксикарбонилпиперидин-4-ил |
6-хлор-2,3-метилендиокси |
| [19] |
7-гидрокси |
циклопентил |
2,3-метилендиокси |
ПРИМЕЧАНИЯ
[1] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-хлор-7-метоксихиназолин и 2-бром-5-метоксианилингидрохлорид, и реакционную смесь нагревали до 80°С в течение 2 часов. Добавляли вторую порцию 6М раствора хлороводорода в изопропаноле (0,06 мл) и дополнительно нагревали реакционную смесь до 80°С в течение 4 часов. Продукт реакции получали в виде дигидрохлорида, часть которого преобразовывали в свободное основание, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,3 (м, 2Н), 1,9 (д, 2Н), 2,3 (м, 1Н), 2,68 (м, 2Н), 3,12 (д, 2Н), 3,85 (с, 3Н), 3,95 (с, 3Н), 4,15 (д, 2Н), 6,52 (д, 1Н), 6,62 (м, 1Н), 6,88 (с, 1Н), 7,5 (д, 1Н), 8,22 (д, 1Н), 8,6 (с, 1Н), 8,9 (с, 1Н). Масс-спектр: M+H+ 473 и 475.
Применяемый в качестве исходного вещества 5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-хлор-7-метоксихиназолин получали следующим образом.
Диэтилазодикарбоксилат (3,85 мл) добавляли по каплям к перемешиваемой смеси 5-гидрокси-7-метокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-она (5 г), N-(трет-бутоксикарбонил)пиперидин-4-илметанола (4,2 г), трифенилфосфина (6,4 г) и метиленхлорида (50 мл), охлажденного до 10°С. Смесь перемешивали при температуре окружающей среды в течение 1 часа. Полученную смесь наносили на наполненную силикагелем колонку и элюировали смесями метиленхлорида и этилацтата с увеличивающейся полярностью. Полученный таким образом продукт растворяли в насыщенном метанольном растворе аммиака (250 мл) и добавляли твердый гидроксид натрия (0,65 г). Полученную смесь перемешивали при температуре окружающей среды в течение 30 минут. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, элюируя сначала смесями метиленхлорида и этилацтата с увеличивающейся полярностью, а затем метиленхлоридом, этилацетатом и метанолом. Полученный таким образом продукт растирали в присутствии диэтилового эфира. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали 5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-7-метокси-3,4-дигидрохиназолин-4-он (3,4 г). ЯМР-спектр: (CDCl3) 1,3-1,4 (м, 2Н), 1,46 (с, 9Н), 1,95 (д, 2Н), 2,15 (м, 1Н), 2,35 (т, 2Н), 3,9 (с, 3Н), 3,9 (м, 2Н), 4,15 (уш.с, 2Н), 6,45 (д, 1Н), 6,75 (д, 1Н), 7,93 (с, 1Н), 11,0 (уш.с, 1Н). Масс-спектр: М+Н+ 390.
Смесь части (2,9 г) полученного таким образом вещества, трифенилфосфина (5,3 г), тетрахлорида углерода (3 мл) и 1,2-дихлорэтана (50 мл) перемешивали и нагревали до 70°С в течение 2,5 часов. Смесь наносили на наполненную силикагелем колонку и элюировали смесями метиленхлорида и этилацетата с увеличивающейся полярностью. Полученное таким образом вещество растирали в присутствии диэтилового эфира. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили. Таким образом получали 5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-хлор-7-метоксихиназолин (1,9 г). ЯМР-спектр: (CDCl3) 1,35-1,5 (м, 2Н), 1,45 (с, 9Н), 1,92 (д, 2Н), 2,15 (м, 1Н), 2,8 (т, 2Н), 3,95 (д, 2Н), 3,97 (с, 3Н), 4,2 (уш.с, 2Н), 6,6 (д, 1Н), 6,98 (д, 1Н), 8,82 (с, 1Н).
[2] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-хлор-7-метоксихиназолин и 2-хлор-5-метоксианилин, и реакционную смесь нагревали до 80°С в течение 2 часов. Добавляли вторую порцию 6М раствора хлороводорода в изопропаноле (0,06 мл) и дополнительно нагревали реакционную смесь до 80°С в течение 4 часов. Продукт реакции получали в виде дигидрохлорида, часть которого преобразовывали в свободное основание, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,3-1,4 (м, 2Н), 1,92 (д, 2Н), 2,3 (м, 1Н), 2,7 (т, 2Н), 3,2 (д, 2Н), 3,85 (с, 3H), 3,95 (с, 3Н), 4,15 (д, 2Н), 6,52 (с, 1Н), 6,65 (м, 1Н), 6,9 (с, 1Н), 7,32 (д, 1Н), 8,4 (с, 1Н), 8,62 (с, 1Н), 10,2 (с, 1Н). Масс-спектр: М+Н+ 429 и 431.
[3] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-хлор-7-метоксихиназолин и 2,5-диметоксианилин, и реакционную смесь нагревали до 80°С в течение 2 часов. Реакционную смесь упаривали и растворяли остаток в метиленхлориде (1 мл). Добавляли трифторуксусную кислоту (1 мл) и перемешивали смесь при температуре окружающей среды в течение 15 минут. Полученную смесь упаривали и распределяли остаток между этилацетатом и 1н. водным раствором гидроксида натрия. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток растворяли в изопропаноле (1 мл) и добавляли 6М раствор хлороводорода в изопропаноле (0,1 мл). Полученный осадок выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали требуемый продукт в виде дигидрохлорида, часть которого преобразовывали в свободное основание, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,3-1,5 (м, 2Н), 1,95 (д, 2Н), 2,25 (м, 1Н), 2,7 (м, 2Н), 3,2 (д, 2Н), 3,84 (с, 3Н), 3,92 (с, 3Н), 3,93 (с, 3Н), 4,1 (д, 2Н), 6,5 (с, 1Н), 6,6 (м, 1Н), 6,9 (м, 2Н), 8,52 (д, 1Н), 8,6 (с, 1Н), 10,15 (с, 1Н). Масс-спектр: М+Н+ 425.
[4] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-хлор-7-метоксихиназолин и 2,5-дихлоранилин, и реакционную смесь нагревали до 80°С в течение 2 часов. Реакционную смесь упаривали и растворяли остаток в метиленхлориде (1 мл). Добавляли трифторуксусную кислоту (1 мл) и перемешивали смесь при температуре окружающей среды в течение 15 минут. Полученную смесь упаривали и распределяли остаток между этилацетатом и 1н. водным раствором гидроксида натрия. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида, этилацетата и метанола (9:10:1). Полученное таким образом вещество растворяли в изопропаноле (1 мл) и добавляли 6М раствор хлороводорода в изопропаноле (0,1 мл). Полученный осадок выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали требуемый продукт в виде дигидрохлорида, часть которого преобразовывали в свободное основание, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,25-1,4 (м, 2Н), 1,9 (д, 2Н), 2,25 (м, 1Н), 2,65 (м, 2Н), 3,15 (д, 2Н), 3,95 (с, 3Н), 4,12 (д, 2Н), 6,55 (д, 1Н), 6,9 (д, 1Н), 7,05 (м, 1Н), 7,35 (д, 1Н), 8,6 (с, 1Н), 8,87 (д, 1Н), 10,09 (уш.с, 1Н). Масс-спектр: М+Н+ 433 и 435.
[5] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-хлор-7-метоксихиназолин и 2,3-метилендиоксианилин и реакционную смесь нагревали до 80°С в течение 2 часов. Реакционную смесь упаривали и растворяли остаток в метиленхлориде (1 мл). Добавляли трифторуксусную кислоту (1 мл) и перемешивали смесь при температуре окружающей среды в течение 15 минут. Полученную смесь упаривали и распределяли остаток между между этилацетатом и 1н. водным раствором гидроксида натрия. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток растворяли в изопропаноле (1 мл) и добавляли 6М раствор хлороводорода в изопропаноле (0,1 мл). Полученный осадок выделяли, промывали изопропанолом и диэтиловым эфиром и сушили в вакууме. Таким образом получали требуемый продукт в виде дигидрохлорида, часть которого преобразовывали в свободное основание, для которого получены следующие данные. ЯМР-спектр: (CDCl2) 1,25-1,4 (м, 2Н), 1,85 (д, 2Н), 2,2 (м, 1Н), 2,65 (м, 2Н), 3,2 (д, 2Н), 3,9 (с, 3Н), 4,02 (д, 2Н), 6,0 (с, 2Н), 6,48 (д, 1Н), 6,62 (д, 1Н), 6,85 (д, 1Н), 6,9 (м, 1Н), 8,07 (д, 1Н), 8,58 (с, 1Н), 9,6 (с, 1Н). Масс-спектр: М+Н+ 409.
[6] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,15-2,35 (м, 4Н), 2,3 (с, 3Н), 2,85 (м, 2Н), 3,92 (с, 3Н), 4,5 (м, 1Н), 6,55 (д, 1Н), 6,85 (д, 1Н), 7,03 (м, 1Н), 7,3 (д, 1Н), 8,6 (с, 1Н), 8,85 (с, 1Н). Масс-спектр: М+H+ 433 и 435.
[7] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,15 (м, 2Н), 2,15-2,3 (м, 4Н), 2,28 (с, 3Н), 2,85 (м, 2Н), 3,92 (с, 3H), 4,5 (м, 1Н), 6,5 (с, 1Н), 6,85 (с, 1Н), 7,0 (м, 1Н), 7,5 (д, 1Н), 8,35 (с, 1Н), 8,55 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: М+Н+ 477, 479 и 481.
[8] Реагенты представляли собой 7-бензилокси-5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-хлорхиназолин и 2-бром-5-метоксианилингидрохлорид, и реакционную смесь нагревали до 80°С в течение 2 часов. Добавляли вторую порцию 6М раствора хлороводорода в изопропаноле (0,06 мл) и дополнительно нагревали реакционную смесь до 80°С в течение 4 часов. Продукт реакции получали в виде дигидрохлорида, часть которого преобразовывали в свободное основание, для которого получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,25 (д, 2Н), 2,8 (м, 2Н), 3,22 (м, 2Н), 3,78 (с, 3Н), 4,6 (м, 1Н), 5,2 (с, 3Н), 6,58 (м, 2Н), 6,9 (д, 1Н), 7,25-7,5 (м, 5Н), 7,89 (д, 1Н), 8,5 (с, 1Н), 9,6 (с, 1Н). Масс-спектр: M+H+ 535 и 537.
Применяемый в качестве исходного вещества 7-бензилокси-5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-хлорхиназолин получали следующим образом.
Смесь 5,7-дибензилокси-3,4-дигидрохиназолин-4-она (2 г), бромида магния (1 г) и пиридина (10 мл) перемешивали и нагревали до 120°С в течение 20 минут. Смесь упаривали, растворяли остаток в смеси воды (20 мл) и ледяной уксусной кислоты (4 мл) и перемешивали в течение 10 минут. Полученный осадок выделяли, промывали водой и сушили в вакууме над пентоксидом фосфора при 50°С. Таким образом получали 7-бензилокси-5-гидрокси-3,4-дигидрохиназолин-4-он (1,5 г). ЯМР-спектр: (ДМСОd6) 5,22 (с, 2Н), 6,5 (д, 1Н), 6,7 (д, 1Н), 7,3-7,5 (м, 5Н), 8,05 (с, 1Н). Масс-спектр: М+Н+ 269,5.
Полученное таким образом вещество добавляли порциями к перемешиваемой суспензии гидрида натрия (60% дисперсия в минеральном масле, промытом пентаном; 0,46 г) в ДМФ (15 мл), охлажденном до 0°С. Смесь перемешивали при температуре окружающей среды в течение 30 минут. Полученную смесь охлаждали до 0°С, добавляли хлорметилпивалат (1,2 мл) и перемешивали смесь при температуре окружающей среды в течение 1 часа. Смесь вливали в воду (70 мл), содержащую уксусную кислоту (4 мл), полученный осадок выделяли и сушили в вакууме. Полученное таким образом вещество растворяли в метиленхлориде, органический слой сушили над сульфатом магния и упаривали. Растирали остаток в присутствии пентана, полученное твердое вещество выделяли и сушили в вакууме. Таким образом получали 7-бензилокси-5-гидрокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-он (1,95 г). ЯМР-спектр: (CDCl3) 1,2 (с, 9Н), 5,12 (с, 2Н), 5,88 (с, 2Н), 6,58 (д, 1Н), 6,72 (д, 1Н), 7,3-7,5 (м, 5Н), 8,15 (с, 1Н), 11,32 (с, 1Н). Масс-спектр: M+H+ 383.
Проводили взаимодействие полученного таким образом вещества с N-(трет-бутоксикарбонил)-4-гидроксипиперидином с применением методики, аналогичной описанной выше в первом параграфе Примечания [1] в той его части, которая касается получения исходных веществ. Таким образом получали 7-бензилокси-5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-3,4-дигидрохиназолин-4-он (1,4 г). ЯМР-спектр: (CDCl3) 1,5 (с, 9Н), 1,82 (м, 4Н), 3,52 (м, 2Н), 3,7 (м, 2Н), 4,65 (м, 1Н), 5,2 (с, 2Н), 6,6 (д, 1Н), 6,9 (д, 1Н), 7,3-7,5 (м, 5Н), 7,92 (с, 1Н), 10,56 (уш.с, 1Н). Масс-спектр: М+Н+ 452,6.
Смесь полученного таким образом вещества, трифенилфосфина (1,66 г), тетрахлорида углерода (0,92 мл) и 1,2-дихлорэтана (40 мл) перемешивали и нагревали до 70°С в течение 1,5 часов. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и этилацетата (9:1). Таким образом получали 7-бензилокси-5-[N-трет-бутоксикарбонил)пиперидин-4-илокси]-4-хлорхиназолин (1,1 г). ЯМР-спектр: (CDCl3) 1,5 (с, 9Н), 1,98 (м, 4Н), 3,5-3,7 (м, 4Н), 4,75 (м, 1Н), 5,2 (с, 2Н), 6,7 (д, 1Н), 7,08 (д, 1Н), 7,32-7,52 (м, 5Н), 8,82 (с, 1Н). Масс-спектр: М+Н+ 470.
[9] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,15 (м, 6Н), 2,25 (с, 3Н), 2,85 (уш.с, 2Н), 3,87 (с, 3Н), 4,02 (с, 3Н), 4,45 (м, 1Н), 6,65 (м, 1Н), 7,35 (д, 1Н), 7,55 (д, 1Н), 7,7 (д, 1Н), 8,5 (д, 1Н), 8,6 (с, 1Н), 10,45 (уш.с, 1Н). Масс-спектр: М+Н+ 429 и 431.
Применяемый в качестве исходного вещества 4-хлор-6-метокси-5-(N-метилпиперидин-4-илокси)хиназолин получали следующим образом.
Раствор семиводного сульфата железа (II) (99 г) в натретой до 70°С воде (410 мл) добавляли к смеси 2-бензилокси-3-метокси-6-нитробензойной кислоты (Bull. Soc. Chim. Fr., 1965, 1417; 15,5 г) и концентрированного водного раствора гидроксида аммония (370 мл), нагретого до 70°С. Полученную смесь нагревали с обратным холодильником в течение 30 минут. Смесь фильтровали, приводили основность фильтрата до значения рН=8 путем добавления 2н. водного раствора соляной кислоты и затем подкисляли фильтрат до значения рН=4 путем добавления 1М водного раствора лимонной кислоты. Смесь распределяли между этилацетатом и водой. Органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали с получением 6-амино-2-бензилокси-3-метоксибензойной кислоты (12,15 г). ЯМР-спектр: (CDCl3) 3,9 (с, 3Н), 5,22 (с, 2Н), 6,5 (д, 1Н), 7,05 (д, 1Н), 7,35-7,55 (м, 5Н). Масс-спектр: M+H+ 274.
Смесь полученного таким образом вещества, триазина (3,6 г), пиперидина (3 мл) и этанола (275 мл) перемешивали и нагревали с обратным холодильником в течение 16 часов. Смесь охлаждали до температуры окружающей среды. Осадок выделяли, промывали этанолом и диэтиловым эфиром и сушили в вакууме с получением 5-бензилокси-6-метокси-3,4-дигидрохиназолин-4-она (10,3 г). ЯМР-спектр: (CDCl3) 3,9 (с, 3Н), 5,15 (с, 2Н), 7,2-7,45 (м, 4Н), 7,5 (д, 1Н), 7,62 (д, 2Н), 7,8 (с, 1Н), 11,1 (уш.с, 1Н). Масс-спектр: М+Н+ 283.
Раствор части (5 г) полученного таким образом вещества в трифторуксусной кислоте (50 мл) перемешивали при температуре окружающей среды в течение 30 минут. Смесь упаривали и растворяли остаток в воде. Раствор подщелачивали до значения рН=8,5 путем порционного добавления бикарбоната натрия. Полученный осадок выделяли, промывали водой и сушили в вакууме при 50°С над пентоксидом фосфора. Таким образом получали 5-гидрокси-6-метокси-3,4-дигидрохиназолин-4-он (3,4 г). ЯМР-спектр: (ДМСОd6) 3,85 (с, 3Н), 7,12 (д, 1Н), 7,52 (д, 1Н), 7,98 (с, 1Н), 11,89 (с, 1Н). Масс-спектр: M+H+ 193.
Полученное таким образом вещество добавляли к перемешиваемой суспензии гидрида натрия (1,59 г 60% дисперсии в минеральном масле, промытом пентаном) в ДМФ (18 мл), охлажденном до 0°С. Смесь перемешивали при температуре окружающей среды в течение 30 минут. Смесь охлаждали до 0°С и по каплям добавляли хлорметилпивалат (4,1 мл). Смесь перемешивали при температуре окружающей среды в течение 1,5 часов. Полученный осадок выделяли, промывали водой и сушили в течение ночи в вакууме. Твердое вещество растворяли в метиленхлориде и сушили раствор над сульфатом магния. Раствор упаривали и растирали остаток в присутствии пентана. Полученное твердое вещество выделяли и сушили в вакууме. Таким образом получали 5-гидрокси-6-метокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-он (4,6 г). ЯМР-спектр: (CDCl3) 1,25 (с, 9Н), 4,0 (с, 3H), 5,9 (с, 2Н), 7,2 (д, 1Н), 7,38 (д, 1Н), 8,08 (с, 1Н), 11,5 (с, 1Н). Масс-спектр: M+H+ 307.
Раствор ди-трет-бутилазодикарбоксилата (1,75 г) в метиленхлориде (3 мл) добавляли к перемешиваемой смеси 5-гидрокси-6-метокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-она (1,55 г), трифенилфосфина (1,99 г), 4-гидрокси-1-метилпиперидина (0,75 г) и метиленхлорида (12 мл), охлажденного до 5°С. Смесь перемешивали при температуре окружающей среды в течение 1 часа. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида, этилацетата и насыщенного метанольного раствора аммиака (9:10:1). Полученное таким образом вещество перемешивали в насыщенном метанольном растворе аммиака в течение 48 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученное твердое вещество промывали диэтиловым эфиром и сушили в вакууме с получением 6-метокси-5-(N-метилпиперидин-4-илокси)-3,4-дигидрохиназолин-4-она (0,92 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,7-1,9 (м, 4Н), 1,95 (т, 2Н), 2,15 (с, 3Н), 2,7 (м, 2Н), 3,85 (с, 3Н), 4,08 (м, 1Н), 7,4 (д, 1Н), 7,6 (д, 1Н), 7,85 (с, 1Н), 11,8 (уш.с, 1Н). Масс-спектр: M+H+ 290.
Смесь части (0,3 г) полученного таким образом вещества, трифенилфосфина (0,54 г), тетрахлорида углерода (0,3 мл) и 1,2-дихлорэтана (13 мл) перемешивали и нагревали до 70°С в течение 2,5 часов. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь этилацетата, метиленхлорида и насыщенного метанольного раствора аммиака (10:9:1). Таким образом получали 4-хлор-6-метокси-5-(N-метилпиперидин-4-илокси)хиназолин (0,22 г). ЯМР-спектр: (CDCl3) 1,82-2,1 (м, 6Н), 2,25 (с, 3Н), 2,85 (м, 2Н), 4,0 (с, 3Н), 4,4 (м, 1Н), 7,7 (д, 1Н), 7,8 (д, 1Н), 8,82 (с, 1Н).
[10] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,02 (м, 4Н), 2,2 (д, 2Н), 2,4 (с, 3Н), 2,5-2,8 (м, 10Н), 3,55 (т, 2Н), 3,95 (с, 3Н), 4,05 (м, 2Н), 4,1 (т, 2Н), 4,7 (м, 1Н), 6,55 (д, 1Н), 6,82 (д, 1Н), 7,4 (с, 1Н), 8,35 (с, 1Н), 8,55 (с, 1Н), 9,82 (с, 1Н); Масс-спектр: M+H+ 576 и 578.
Применяемый в качестве исходного вещества 4-хлор-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Проводили взаимодействие 5-гидрокси-7-метокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-она (0,61 г) с 4-гидрокситетрагидропираном (0,23 мл) с применением методики, аналогичной описанной выше в первом параграфе Примечания [1] в той его части, которая касается получения исходных веществ. Таким образом получали 7-метокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-он (0,3 г). ЯМР-спектр: (ДМСОd6) 1,6-1,75 (м, 2Н), 1,9-2,0 (м, 2Н), 3,52 (м, 2Н), 3,85 (с, 3Н), 3,95 (м, 2Н), 4,75 (м, 1Н), 6,65 (д, 1Н), 6,7 (м, 1Н), 7,92 (с, 1Н).
Смесь 7-метокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (4 г), тиофенола (2,2 мл), карбоната калия (3 г) и N-метилпирролидин-2-она (40 мл) перемешивали и нагревали до 200°С в течение 25 минут. Смесь упаривали и подкисляли остаток путем добавления 12н. водного раствора соляной кислоты (2 мл). Добавляли метиленхлорид (5 мл). Полученный осадок выделяли, поочередно промывали водой и диэтиловым эфиром и сушили в вакууме с получением 7-гидрокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (3,4 г). ЯМР-спектр: (ДМСОd6) 1,6-1,75 (м, 2Н), 1,9-2,0 (м, 2Н), 3,45-3,6 (м, 2Н), 3,8 (м, 3Н), 4,65 (м, 1Н), 6,5 (д, 1Н), 6,65 (м, 1Н), 7,92 (с, 1Н), 10,4 (с, 1Н), 11,5 (с, 1Н). Масс-спектр: M+H+ 263.
Смесь 7-гидрокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (3,2 г), пиридина (3,2 мл) и уксусного ангидрида (20 мл) перемешивали и нагревали до 100°С в течение 2 часов. Смесь упаривали. Остаток растворяли в смеси метанола и воды и перемешивали при температуре окружающей среды в течение 2 часов. Смесь упаривали для удаления метанола и сушили водный слой остатка вымораживанием. Очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (19:1). Таким образом получали 7-ацетокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-он (3,1 г). ЯМР-спектр: (ДМСОd6) 1,7 (м, 2Н), 1,92 (м, 2Н), 2,3 (с, 3H), 3,5 (м, 2Н), 3,9 (м, 2Н), 4,72 (м, 1Н), 6,95 (д, 2Н), 7,98 (с, 1Н), 10,9 (уш.с, 1Н). Масс-спектр: М+Н+ 305.
Смесь части (1,2 г) полученного таким образом вещества, фосфорилхлорида (0,41 мл), диизопропилэтиламина (1,74 мл) и 1,2-дихлорэтана (30 мл) перемешивали и нагревали до 80°С в течение 2,5 часов. Смесь упаривали. Полученное таким образом вещество растворяли в насыщенном метанольном растворе аммиака и перемешивали в течение 2,5 часов. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (97:3). Таким образом получали 4-хлор-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин (0,5 г). ЯМР-спектр: (ДМСОd6) 1,8 (м, 2Н), 2,08 (м, 2Н), 3,6 (м, 2Н), 3,9 (м, 2Н), 4,9 (м, 1Н), 6,9 (д, 2Н), 8,76 (с, 1Н). Масс-спектр: M+H+ 281 и 283.
Ди-трет-бутилазодикарбоксилат (0,65 г) добавляли к перемешиваемой смеси 4-хлор-7-гидрокси-5-тетрагидропиран-4-илоксихиназолина (0,5 г), трифенилфосфина (0,75 г), 1-(3-гидроксипропил)-4-метилпиперазина (0,34 г) и метиленхлорида (20 мл) и перемешивали смесь при температуре окружающей среды в течение 1,5 часов. Смесь наносили на наполненную силикагелем колонку и элюировали сначала смесью метиленхлорида и метанола (49:1), а затем смесью метиленхлорида и насыщенного метанольного раствора аммиака (97:3). Таким образом получали 4-хлор-7-[3-(4-метилпиперазин-4-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин (0,54 г). ЯМР-спектр: (CDCl3) 1,9-2,2 (м, 6Н), 2,25 (с, 3Н), 2,32-2,68 (м, 10Н), 3,68 (м, 2Н), 4,05 (м, 2Н), 4,15 (т, 2Н), 4,72 (м, 1Н), 6,58 (д, 1Н), 6,92 (д, 1Н), 8,8 (с, 1Н). Масс-спектр: М+Н+ 421 и 423.
[11] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,2 (м, 6Н), 2,5 (с, 3Н), 2,6-2,9 (м, 10Н), 3,35 (м, 2Н), 3,9 (с, 3Н), 4,02 (м, 2Н), 4,25 (т, 2Н), 4,6 (м, 1Н), 6,65 (м, 1Н), 7,35 (д, 1Н), 7,55 (д, 1Н), 7,68 (д, 1Н), 8,55 (с, 1Н), 8,65 (с, 1Н), 10,45 (с, 1Н). Масс-спектр: М+Н+ 542 и 544.
Применяемый в качестве исходного вещества 4-хлор-6-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Ди-трет-бутилазодикарбоксилат (3,6 г) добавляли порциями к перемешиваемой смеси 5-гидрокси-6-метокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-она (3 г), трифенилфосфина (4,1 г), 4-гидрокситетрагидропирана (1,2 мл) и метиленхлорида (50 мл) и перемешивали смесь при температуре окружающей среды в течение 30 минут. Смесь упаривали и перемешивали остаток в насыщенном метанольном растворе аммиака в течение 7 часов. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида, этилацетата и насыщенного метанольного раствора аммиака (9:10:1). Таким образом получали 6-метокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-он (2,3 г). ЯМР-спектр: (ДМСОd6) 1,65-1,8 (м, 2Н), 1,8-1,9 (м, 2Н), 3,35 (м, 2Н), 3,9 (с, 3Н), 3,92 (м, 2Н), 4,3 (м, 1Н), 7,42 (д, 1Н), 7,6 (д, 1Н), 7,9 (с, 1Н), 11,8 (уш.с, 1Н). Масс-спектр: М+Н+ 277.
Смесь части (1,9 г) полученного таким образом вещества, тиофенола (1 мл), карбоната калия (1,4 г) и N-метилпирролид-2-она (20 мл) перемешивали и нагревали до 200°С в течение 30 минут. Смесь упаривали. Остаток растворяли в смеси метиленхлорида (25 мл), метанола (1 мл) и уксусной кислоты (2 мл), раствор наносили на наполненную силикагелем колонку и элюировали смесью метиленхлорида, этилацетата и метанола (9:10:1). Полученное таким образом вещество растирали в присутствии диэтилового эфира, полученное твердое вещество промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали 6-гидрокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-он (1,65 г). ЯМР-спектр: (ДМСОd6) 1,7-1,9 (м, 4Н), 3,2-3,4 (м, 2Н), 3,92 (м, 2Н), 4,3 (м, 1Н), 7,3 (д, 1Н), 7,35 (д, 1Н), 7,85 (с, 1Н), 9,55 (уш.с, 1Н), 11,75 (уш.с, 1Н). Масс-спектр: М+Н+ 263.
Смесь части (0,7 г) полученного таким образом вещества, пиперидина (0,7 мл) и уксусного ангидрида (10 мл) нагревали с обратным холодильником в течение 1 часа. Смесь упаривали. Остаток растворяли в смеси метанола и воды (1:1; 18 мл) и перемешивали при температуре окружающей среды в течение 1 часа. Полученный осадок выделяли, промывали водой и сушили в вакууме с получением 6-ацетокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (0,54 г). ЯМР-спектр: (CDCl3) 1,8-2,0 (м, 2Н), 2,0-2,1 (м, 2Н), 2,4 (с, 3H), 3,45 (м, 2Н), 4,02 (м, 2Н), 4,4 (м, 1Н), 7,5-7,6 (м, 2Н), 8,0 (с, 1Н), 10,5 (уш.с, 1Н). Масс-спектр: М+Н+ 305.
Смесь полученного таким образом вещества, трифенилфосфина (0,93 г), тетрахлорида углерода (0,515 мл) и 1,2-дихлорэтана (24 мл) перемешивали и нагревали до 70°С в течение 2,5 часов. Смесь упаривали, растворяли остаток в насыщенном метанольном растворе аммиака (20 мл) и перемешивали при температуре окружающей среды в течение 1 часа. Смесь фильтровали, фильтрат наносили на наполненную силикагелем колонку и элюировали поочередно метиленхлоридом, смесью метиленхлорида и этилацетата (1:1), и затем смесью метиленхлорида, этилацетата и метанола (24:25:1). Таким образом получали 4-хлор-6-гидрокси-5-тетрагидропиран-4-илоксихиназолин.
С применением методики, аналогичной описанной выше в последнем параграфе Примечания [10] в той его части, которая касается получения исходных веществ, проводили взаимодействие 4-хлор-6-гидрокси-5-тетрагидропиран-4-илоксихиназолина (1,12 г) с 1-(3-гидроксипропил)-4-метилпиперазином с получением 4-хлор-6-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолина (0,56 г). ЯМР-спектр: (CDCl3) 1,85-2,2 (м, 6Н), 2,32 (с, 3Н), 2,35-2,7 (м, 10Н), 3,42 (м, 2Н), 4,05 (м, 2Н), 4,25 (м, 2Н), 4,65 (м, 1Н), 7,75 (д, 1Н), 7,85 (д, 1Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 421 и 423.
[12] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,82-2,18 (м, 6Н), 2,35 (с, 3Н), 2,4-2,7 (м, 10Н), 3,35 (м, 2Н), 4,02 (д, 2Н), 4,25 (т, 2Н), 4,65 (м, 1Н), 7,08 (м, 1Н), 7,4 (д, 1Н), 7,6 (д, 1Н), 7,7 (д, 1Н), 8,68 (с, 1Н), 9,0 (с, 1Н), 10,5 (с, 1Н). Масс-спектр: М+Н+ 546 и 548.
[13] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,15 (м, 6Н), 2,35 (с, 3H), 2,4-2,75 (м, 10 Н), 3,35 (м, 2Н), 3,89 (с, 3Н), 4,02 (м, 2Н), 4,25 (т, 2Н), 4,65 (м, 1Н), 6,65 (м, 1Н), 7,5 (д, 1Н), 7,55 (д, 1Н), 7,65 (д, 1Н), 8,35 (д, 1Н), 8,6 (с, 1Н), 10,28 (с, 1Н). Масс-спектр: М+Н+ 586 и 588.
[14] 4-Хлор-2-фтор-5-метоксианилин раскрыт в заявке на выдачу международного патента WO 86/02642. Для свободного основания продукта получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 4Н), 2,22 (д, 2Н), 2,27 (с, 3Н), 2,32-2,62 (м, 10Н), 3,55 (м, 2Н), 3,94 (с, 3Н), 4,08 (м, 2Н), 4,15 (т, 2Н), 4,7 (м, 1Н), 6,52 (с, 1Н), 6,82 (с, 1Н), 7,15 (д, 1Н), 8,6 (с, 1Н), 8,8 (д, 1Н), 10,1 (с, 1Н). Масс-спектр: М+Н+ 560 и 562.
[15] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 4Н), 2,22 (д, 2Н), 2,28 (с, 3Н), 2,35-2,7 (м, 10Н), 3,6 (м, 2Н), 4,08 (м, 2Н), 4,12 (т, 2Н), 4,7 (м, 1Н), 6,5 (д, 1Н), 6,82 (д, 1Н), 7,25-7,35 (м, 2Н), 8,57 (с, 1Н), 8,77 (м, 1Н), 10,02 (с, 1Н). Масс-спектр: M+H+ 574 и 576.
[16] 2-Пирролидин-1-ил-5-метоксианилин раскрыт в заявке на выдачу международного патента WO 85/01939. Для свободного основания продукта получены следующие данные. ЯМР-спектр: (CDCl3) 1,8-2,0 (м, 8Н), 2,2 (д, 2Н), 2,29 (с, 3Н), 2,4-2,7 (м, 12Н), 3,1 (т, 2Н), 3,6 (м, 2Н), 3,82 (с, 3H), 4,02 (м, 2Н), 4,15 (т, 2Н), 4,7 (м, 1Н), 6,5 (д, 1Н), 6,65 (м, 1Н), 6,85 (д, 1Н), 7,05 (д, 1Н),’7,9 (д, 1Н), 8,55 (с, 1Н), 9,82 (с, 1Н). Масс-спектр: М+Н+ 577.
[17] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95 (м, 4Н), 2,18 (д, 2Н), 2,25 (с, 3H), 2,3-2,6 (м, 10Н), 3,55 (т, 2Н), 4,02 (м, 2Н), 4,1 (т, 2Н), 4,68 (м, 1Н), 5,95 (с, 2Н), 6,45 (с, 1Н), 6,6 (д, 1Н), 6,78 (с, 1Н), 6,85 (м, 1Н), 8,02 (д, 1Н), 8,5 (с, 1Н), 9,68 (с, 1Н). Масс-спектр: M+H+ 522.
[18] Реагенты представляли собой 7-бензилокси-5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-хлорхиназолин (1,92 г) и 6-хлор-2,3-метилендиоксианилин (0,771 г), и нагревали реакционную смесь с обратным холодильником в течение 1,5 часов. Реакционную смесь охлаждали до температуры окружающей среды, осадок выделяли поочередно промывали изопропанолом, этилацетатом и диэтиловым эфиром и сушили в вакууме. Полученное таким образом вещество растворяли в 2М растворе хлороводорода в диэтиловом эфире и перемешивали при температуре окружающей среды в течение 2 часов. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали требуемое соединение в виде дигидрохлорида (2,4 г), для которого получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,4 (с, 9Н), 1,8-1,95 (м, 2Н), 2,0-2,1 (м, 2Н), 2,9-3,1 (м, 2Н), 3,4 (м, 2Н), 5,08 (м, 1Н), 5,35 (с, 2Н), 6,12 (с, 2Н), 7,0-7,05 (м, 2Н), 7,12 (д, 1Н), 7,22 (д, 1Н), 7,3-7,6 (м, 5Н), 8,75 (с, 1Н), 10,1 (с, 1Н). Масс-спектр: М+Н+ 605 и 607.
[19] Реагенты представляли собой 7-ацетокси-4-хлор-5-циклопентилоксихиназолин и 2,3-метилендиоксианилин. Осадок выделяли из реакционной смеси, растворяли в насыщенном метанольном растворе аммиака (20 мл) и перемешивали при температуре окружающей среды в течение 2 часов. Смесь упаривали и растирали остаток в присутствии воды. Полученное таким образом твердое вещество промывали водой и сушили в течение ночи в вакууме. Для продукта получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,6-1,7 (м, 2Н), 1,7-1,9 (м, 2Н), 1,9-2,15 (м, 4Н), 5,1 (уш.с, 1Н), 6,12 (с, 2Н), 6,63 (с, 1Н), 6,65 (с, 1Н), 6,72 (д, 1Н), 6,9 (м, 1Н), 8,15 (д, 1Н), 8,42 (с, 1Н), 9,8 (с, 1Н), 10,58 (с, 1Н). Масс-спектр: М+Н+ 366.
Пример 16
4-(2-Иоданилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолиндигидрохлорид
Смесь 4-хлор-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолина (0,08 г), 2-иоданилина (0,068 г), 6М раствора хлороводорода в изопропаноле (0,05 мл) и изопропанола (3 мл) перемешивали и нагревали до 80°С в течение 2 часов. Смесь охлаждали до 0°С и добавляли диэтиловый эфир. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме. Полученное таким образом твердое вещество растворяли в метиленхлориде и промывали раствор насыщенным водным раствором бикарбоната натрия. Органический раствор наносили на наполненную силикагелем колонку и элюировали сначала смесью метиленхлорида, этилацетата и метанола (9:10:1), а затем смесью метиленхлорида, этилацетата и насыщенного метанольного раствора аммиака (9:10:1). Полученное таким образом вещество растворяли в диэтиловом эфире и добавляли 6М раствор хлороводорода в диэтиловом эфире (0,1 мл). Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали указанное в заголовке соединение (0,081 г) в виде дигидрохлорида, часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,1-2,4 (м, 6Н), 2,3 (с, 3Н), 2,8 (м, 2Н), 3,92 (с, 3Н), 4,6 (м, 1Н), 6,55 (с, 1Н), 6,85 (с, 1Н), 6,95 (т, 1Н), 7,42 (т, 1Н), 7,9 (д, 2Н), 8,5 (с, 1Н), 9,5 (с, 1Н). Масс-спектр: M+H+ 491.
Пример 17
С применением методики, аналогичной описанной в Примере 16, проводили взаимодействие подходящего 4-хлорхиназолина с подходящим анилином в присутствии хлороводорода с получением дигидрохлорида каждого из соединений, описанных в Таблице V, часть из которых преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3.
| Таблица V |
 |
| № и прим. |
(R1)m |
Q1 |
(R2)n |
| [1] |
7-метокси |
N-метилпиперидин-4-ил |
2,4-дихлор |
| [2] |
7-метокси |
N-метилпиперидин-4-ил |
4-бром-2-хлор |
| [3] |
7-метокси |
N-метилпиперидин-4-ил |
2-хлор-4-циано |
| [4] |
7-метокси |
N-метилпиперидин-4-ил |
2-бром-4-фтор |
| [5] |
7-метокси |
N-метилпиперидин-4-ил |
2-бром-4-хлор |
| [6] |
7-метокси |
N-метилпиперидин-4-ил |
2,4-дибром |
| [7] |
7-метокси |
N-метилпиперидин-4-ил |
2-бром |
| [8] |
7-метокси |
N-метилпиперидин-4-ил |
2-бром-4-метил |
| [9] |
7-метокси |
N-метилпиперидин-4-ил |
2-фтор-4-хлор |
| [10] |
7-метокси |
N-метилпиперидин-4-ил |
2-фтор-4-бром |
| [11] |
7-метокси |
N-метилпиперидин-4-ил |
2-фтор-3-хлор |
| [12] |
7-метокси |
N-метилпиперидин-4-ил |
2,4-диметокси |
| [13] |
7-метокси |
N-метилпиперидин-4-ил |
2,3-диметокси |
| [14] |
7-метокси |
N-метилпиперидин-4-ил |
2-метокси-5-метил |
| [15] |
7-метокси |
N-метилпиперидин-4-ил |
2-метокси-5-хлор |
| [16] |
7-метокси |
N-метилпиперидин-4-ил |
2-метокси |
| [17] |
7-метокси |
N-метилпиперидин-4-ил |
2-этокси |
| [18] |
7-метокси |
N-метилпиперидин-4-ил |
2-метилтио |
| [19] |
7-метокси |
N-метилпиперидин-4-ил |
2-ацетил-4-хлор |
| [20] |
7-метокси |
N-метилпиперидин-4-ил |
2-метил-5-хлор |
| [21] |
7-метокси |
N-метилпиперидин-4-ил |
2-метил-3-хлор |
| [22] |
7-метокси |
N-метилпиперидин-4-ил |
2-метил-4-хлор |
| [23] |
7-метокси |
N-метилпиперидин-4-ил |
2-метил-5-метокси |
| [24] |
7-метокси |
N-метилпиперидин-4-ил |
2-изопропенил |
| [25] |
7-метокси |
N-метилпиперидин-4-ил |
2-(1-пирролил) |
| [26] |
7-метокси |
N-метилпиперидин-4-ил |
2-пиперидино |
| [27] |
7-(2-пирролидин-1-илэтокси) |
циклопентил |
2-бром-5-метокси |
| [28] |
7-(2-пирролидин-1-илэтокси) |
циклопентил |
5-метокси-2-пирролидин-1-ил |
| [29] |
7-(2-пирролидин-1-илэтокси) |
циклопентил |
5-метокси-2-морфолинометил |
| [30] |
7-(2-пирролидин-1-илэтокси) |
циклопентил |
6-хлор-2,3-метилендиокси |
| [31] |
7-метокси |
пиперидин-4-илметил |
6-хлор-2,3-метилендиокси |
| [32] |
7-(2-пирролидин-1-илэтокси) |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [33] |
7-(3-пирролидин-1-илпропокси) |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
| [34] |
7-бензилокси |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
ПРИМЕЧАНИЯ
[1] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,1 (м, 2Н), 2,15-2,4 (м, 4Н), 2,3 (с, 3H), 2,75-2,9 (м, 2Н), 3,89 (с, 3Н), 4,55 (м, 1Н), 6,5 (с, 1Н), 6,82 (с, 1Н), 7,28 (м, 1Н), 7,42 (д, 1Н), 8,35 (д, 1Н), 8,5 (с, 1Н), 9,8 (с, 1Н). Масс-спектр: M+H+ 433 и 435.
[2] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,15-2,35 (м, 4Н), 2,3 (с, 3H), 2,7-2,9 (м, 2Н), 3,9 (с, 3Н), 4,42-4,6 (м, 1Н), 6,55 (д, 1Н), 6,82 (д, 1Н), 7,4 (м, 1Н), 7,55 (д, 1Н), 8,3 (д, 1Н), 8,51 (с, 1Н), 9,8 (с, 1Н). Масс-спектр: М+Н+ 477 и 479.
[3] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,1-2,25 (м, 4Н), 2,28 (с, 3H), 2,85 (br d, 2Н), 3,9 (с, 3H), 4,5 (м, 1Н), 6,55 (д, 1Н), 6,85 (д, 1Н), 7,58 (м, 1Н), 7,7 (с, 1Н), 8,6 (с, 1Н), 8,82 (д, 1Н). Масс-спектр: M+H+ 424 и 426.
[4] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,1 (м, 2Н), 2,15-2,4 (м, 4Н), 2,28 (с, 3H), 2,8 (м, 2Н), 3,9 (с, 3H), 4,55 (м, 1Н), 6,5 (с, 1Н), 6,8 (с, 1Н), 7,1 (м, 1Н), 7,35 (м, 1Н), 8,05 (м, 1Н), 8,48 (с, 1Н), 9,55 (уш.с, 1Н). Масс-спектр: М+Н+ 461 и 463.
[5] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,15 (м, 2Н), 2,2-2,4 (м, 4Н), 2,3 (с, 3Н), 2,8 (м, 2Н), 3,9 (с, 3Н), 4,5-4,6 (м, 1Н), 6,5 (д, 1Н), 6,8 (д, 1Н), 7,3 (м, 1Н), 7,6 (д, 1Н), 8,15 (д, 1Н), 8,5 (с, 1Н), 9,6 (уш.с, 1Н). Масс-спектр: М+Н+ 477 и 479.
[6] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,2 (м, 2Н), 2,2-2,35 (м, 4Н), 2,25 (с, 3Н), 2,7-2,9 (м, 2Н), 3,9 (с, 3Н), 4,5-4,6 (м, 2Н), 6,55 (с, 1Н), 6,85 (с, 1Н), 7,15 (м, 1Н), 7,45 (д, 1Н), 8,45 (с, 1Н), 8,55 (с, 1Н), 9,68 (уш.с, 1Н). Масс-спектр: М+Н+ 521, 523 и 525.
[7] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,15 (м, 2Н), 2,15-2,38 (м, 4Н), 2,3 (с, 3H), 2,8 (м, 2Н), 3,9 (с, 3H), 4,55 (м, 1Н), 6,5 (д, 1Н), 6,82 (д, 1Н), 7,02 (м, 1Н), 7,35 (м, 1Н), 7,36 (д, 1Н), 8,15 (д, 1Н), 8,5 (с, 1Н), 9,65 (с, 1Н). Масс-спектр: М+Н+ 443 и 445.
[8] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,15 (м, 2Н), 2,2-2,4 (м, 4Н), 2,28 (с, 3Н), 2,31 (с, 3Н), 2,8 (м, 2Н), 3,89 (с, 3Н), 4,55 (м, 1Н), 6,5 (с, 1Н), 6,8 (с, 1Н), 7,15 (м, 1Н), 7,42 (с, 1Н), 7,95 (д, 1Н), 8,48 (с, 1Н), 9,55 (с, 1Н). Масс-спектр: М+Н+ 457 и 449.
[9] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,15-2,3 (м, 4Н), 2,3 (с, 3Н), 2,85 (д, 1Н), 3,9 (с, 3Н), 4,5 (м, 1Н), 6,5 (д, 1Н), 6,82 (д, 1Н), 7,1-7,2 (м, 2Н), 8,58 (с, 1Н), 8,75 (м, 1Н). Масс-спектр: М+Н+ 417 и 419.
[10] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,15-2,35 (м, 4Н), 2,32 (с, 3Н), 2,9 (м, 2Н), 3,89 (с, 3Н), 4,55 (м, 1Н), 6,5 (д, 1Н), 6,85 (д, 1Н), 7,25-7,35 (м, 2Н), 8,58 (с, 1Н), 8,75 (м, 1Н). Масс-спектр: М+Н+ 461 и 463.
[11] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,12-2,28 (м, 4Н), 2,28 (с, 3Н), 2,85 (м, 2Н), 3,86 (с, 3Н), 4,5 (м, 1Н), 6,5 (с, 1Н), 6,8 (с, 1Н), 7,0-7,1 (м, 2Н), 8,55 (с, 1Н), 8,68 (м, 1Н). Масс-спектр: М+Н+ 417 и 419.
[12] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,1-2,22 (м, 4Н), 2,25 (с, 3Н), 2,82 (м, 2Н), 3,77 (с, 3Н), 3,83 (с, 3Н), 3,85 (с, 3Н), 4,48 (м, 1Н), 6,45 (д, 1Н), 6,52 (м, 1Н), 6,8 (м, 2Н), 8,45 (д, 1Н), 8,52 (с, 1Н). Масс-спектр: М+Н+ 425.
[13] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 2Н), 2,1-2,25 (м, 4Н), 2,28 (с, 3Н), 2,7-2,9 (м, 2Н), 3,8 (с, 3Н), 3,85 (с, ЗН), 3,9 (с, 3Н), 4,5 (м, 1Н), 6,45 (д, 1Н), 6,5-6,6 (м, 2Н), 6,8 (д, 1Н), 8,4 (д, 1Н), 8,5 (с, 1Н), 9,85 (с, 1Н). Масс-спектр: М+Н+ 425.
[14] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,15-2,3 (м, 4Н), 2,27 (с, 3Н), 2,3 (с, 3Н), 2,85 (м, 2Н), 3,87 (с, 3Н), 3,89 (с, 3Н), 4,5 (м, 1Н), 6,5 (с, 1Н), 6,8-6,9 (м, 3Н), 8,45 (с, 1Н), 8,55 (с, 1Н). Масс-спектр: М+Н+ 409.
[15] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,15-2,3 (м, 4Н), 2,3 (с, 3Н), 2,85 (д, 2Н), 3,89 (с, 3Н), 3,9 (с, 3Н), 4,5 (м, 1Н), 6,5 (д, 1Н), 6,8 (м, 2Н), 7,0 (м, 1Н), 8,6 (с, 1Н), 8,85 (д, 1Н). Масс-спектр: М+Н+ 429 и 431.
[16] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,0-2,1 (м, 2Н), 2,15-2,3 (м, 4Н), 2,29 (с, 3H), 2,85 (м, 2Н), 3,88 (с, 3Н), 3,9 (с, 3Н), 4,52 (м, 1Н), 6,5 (с, 1Н), 6,8 (с, 1Н), 6,95 (м, 1Н), 7,02 (м, 2Н), 8,55 (с, 1Н), 8,65 (м, 1Н). Масс-спектр: M+H+ 395.
[17] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,4 (т, 3Н), 1,9-2,1 (м, 2Н), 2,1-2,3 (м, 4Н), 2,24 (с, 3Н), 2,7-2,9 (м, 2Н), 3,9 (с, 3Н), 4,2 (кв, 2Н), 4,4-4,55 (м, 1Н), 6,5 (д, 1Н), 6,8 (д, 1Н), 6,9 (м, 1Н), 6,95-7,1 (м, 2Н), 8,38 (м, 1Н), 8,5 (с, 1Н), 9,85 (уш.с, 1Н). Масс-спектр: М+Н+ 409.
[18] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,05-2,35 (м, 6Н), 2,27 (с, 3H), 2,38 (с, 3Н), 2,7-2,9 (м, 2Н), 3,9 (с, 3Н), 4,5-4,6 (м, 1Н), 6,5 (д, 1Н), 6,8 (д, 1Н), 7,15 (м, 1Н), 7,26 (м, 1Н), 7,38 (м, 1Н), 7,98 (д, 1Н), 8,5 (с, 1Н), 9,7 (уш.с, 1Н). Масс-спектр: М+H+ 411.
[19] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,15-2,35 (м, 6Н), 2,27 (с, 3Н), 2,57 (с, 3Н), 2,82 (м, 2Н), 3,89 (с, 3Н), 4,55 (м, 1Н), 6,52 (с, 1Н), 6,8 (с, 1Н), 7,48 (м, 1Н), 7,75 (д, 1Н), 8,3 (д, 1Н), 8,5 (с, 1Н). Масс-спектр: М+Н+ 441 и 443.
[20] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,0 (м, 2Н), 2,15-2,4 (м, 4Н), 2,26 (с, 3Н), 2,28 (с, 3Н), 2,75 (уш.с, 2Н), 3,9 (с, 3Н), 4,55 (уш.с, 1Н), 6,5 (д, 1Н), 6,82 (с, 1Н), 7,1 (м, 1Н), 7,18 (д, 1Н), 7,8 (с, 1Н), 8,48 (с, 1Н), 9,1 (с, 1Н). Масс-спектр: М+Н+ 413 и 415.
[21] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,0 (м, 2Н), 2,15-2,25 (м, 2Н), 2,28 (с, 3Н), 2,25-2,38 (м, 2Н), 2,35 (с, 3Н), 2,7 (уш.с, 2Н), 3,9 (с, 3Н), 4,6 (м, 1Н), 6,5 (д, 1Н), 6,8 (д, 1Н), 7,18 (м, 1Н), 7,28 (м, 1Н), 7,5 (д, 1Н), 8,45 (с, 1Н), 9,35 (с, 1Н). Масс-спектр: М+Н+ 413 и 415.
[22] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,0 (м, 2Н), 2,2-2,4 (м, 4Н), 2,27 (с, 3Н), 2,65-2,8 (м, 2Н), 3,89 (с, 3Н), 4,55 (м, 1Н), 6,5 (д, 1Н), 6,8 (д, 1Н), 7,15-7,25 (м, 2Н), 7,6 (д, 1Н), 8,45 (с, 1Н), 9,25 (с, 1Н). Масс-спектр: М+Н+ 413 и 415.
[23] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,0 (м, 2Н), 2,15-2,22 (м, 4Н), 2,17 (с, 3Н), 2,22 (с, 3Н), 2,72 (м, 2Н), 3,78 (с, 3Н), 3,89 (с, 3H), 4,55 (м, 1Н), 6,5 (д, 1Н), 6,7 (м, 1Н), 6,8 (д, 1Н), 7,15 (д, 1Н), 7,3 (д, 1Н), 8,45 (с, 1Н), 9,3 (с, 1Н). Масс-спектр: М+Н+ 409.
[24] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,85-2,0 (м, 2Н), 2,05 (с, 3Н), 2,1-2,3 (м, 4Н), 2,28 (с, 3Н), 2,72 (м, 2Н), 3,92 (с, 3Н), 4,5 (м, 1Н), 5,1 (с, 1Н), 5,25 (с, 1Н), 6,5 (с, 1Н), 6,82 (с, 1Н), 7,2 (т, 1Н), 7,3 (д, 1Н), 7,35 (т, 1Н), 7,85 (д, 1Н), 8,5 (с, 1Н), 9,35 (с, 1Н).
[25] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,45-1,6 (м, 2Н), 1,8-1,95 (м, 2Н), 2,05-2,2 (м, 2Н), 2,2 (с, 3Н), 2,4-2,55 (уш.с, 2Н), 3,95 (с, 3H), 4,25-4,35 (м, 2Н), 6,25 (д, 2Н), 6,4 (с, 1Н), 6,8 (с, 1Н), 6,85 (д, 2Н), 7,2 (м, 1Н), 7,3 (м, 1Н), 7,35 (м, 1Н), 8,05 (д, 1Н), 8,5 (с, 1Н), 9,25 (уш.с, 1Н). Масс-спектр: М+Н+ 430.
[26] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,6 (м, 2Н), 1,7 (м, 4Н), 2,1 (м, 2Н), 2,2 (с, 3Н), 2,2 (м, 2Н), 2,3 (м, 2Н), 2,7 (м, 2Н), 2,9 (м, 4Н), 3,95 (с, 3Н), 4,6 (м, 1Н), 6,1 (д, 1Н), 6,9 (д, 1Н), 7,1-7,2 (м, 3Н), 8,02 (м, 1Н), 8,52 (с, 1Н), 9,72 (с, 1Н). Масс-спектр: М+Н+ 448.
[27] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,6-1,78 (м, 4Н), 1,85 (м, 4Н), 2,1 (м, 4Н), 2,65 (м, 4Н), 2,98 (м, 2Н), 3,82 (с, 3Н), 4,25 (м, 2Н), 5,02 (м, 1Н), 6,4 (д, 1Н), 6,45 (м, 1Н), 6,82 (д, 1Н), 7,5 (д, 1Н), 7,85 (д, 1Н), 8,52 (с, 1Н), 9,62 (с, 1Н). Масс-спектр: М+Н+ 527 и 529.
Применяемый в качестве исходного вещества 4-хлор-5-циклопентилокси-7-(2-пирролидин-1-илэтокси)хиназолин получали следующим образом.
Смесь 7-ацетокси-4-хлор-5-циклопентилоксихиназолина (1 г), насыщенного метанольного раствора аммиака (10 мл) и метанола (10 мл) перемешивали при температуре окружающей среды в течение 30 минут. Смесь упаривали и растирали остаток в присутствии воды. Полученное твердое вещество выделяли, промывали водой и сушили в вакууме с получением 4-хлор-5-циклопентилокси-7-гидроксихиназолина (0,67 г). ЯМР-спектр: (ДМСОd6) 1,6-1,75 (м, 2Н), 1,75-1,85 (м, 2Н), 1,85-2,05 (м, 4Н), 5,0 (м, 1Н), 6,72 (д, 1Н), 6,8 (д, 1Н), 8,7 (с, 1Н). Масс-спектр: М+Н+ 265.
С применением методики, аналогичной описанной в Примере 1, проводили взаимодействие 4-хлор-5-циклопентилокси-7-гидрохиназолина (0,84 г) с 2-пирролидин-1-илэтанолом (0,448 мл). Таким образом получали 4-хлор-5-циклопентилокси-7-(2-пирролидин-1-илэтокси)хиназолин (0,82 г). ЯМР-спектр: (CDCl3) 1,65-2,12 (м, 12Н), 2,65 (м, 4Н), 2,97 (м, 2Н), 4,25 (м, 2Н), 4,9 (м, 1Н), 6,65 (д, 1Н), 6,92 (д, 1Н), 8,8 (с, 1Н). Масс-спектр: М+Н+ 362 и 364.
[28] Продукт реакции очищали методом колоночной хроматографии с обращенной фазой на силикагеле с применением смесей воды, ацетонитрила и насыщенного метанольного раствора аммиака со снижающейся полярностью. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,6-1,75 (м, 2Н), 1,8 (м, 2Н), 1,8-1,95 (м, 8Н), 2,05 (м, 4Н), 2,65 (уш.с, 1Н), 2,95 (м, 2Н), 3,05 (уш.с, 4Н), 3,8 (с, 3Н), 4,25 (м, 2Н), 4,95 (м, 1Н), 6,55 (с, 1Н), 6,65 (м, 1Н), 6,8 (с, 1Н), 7,1 (д, 1Н), 7,75 (д, 1Н), 8,5 (с, 1Н), 9,7 (с, 1Н). Масс-спектр: М+Н+ 518.
[29] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,65-1,9 (м, 8Н), 1,9-2,15 (м, 4Н), 2,35 (м, 4Н), 2,65 (м, 4Н), 2,98 (м, 2Н), 3,42 (с, 2Н), 3,55 (м, 4Н), 3,82 (с, 3Н), 4,25 (м, 2Н), 5,0 (м, 1Н), 6,6 (с, 1Н), 6,8 (м, 2Н), 7,1 (с, 1Н), 7,38 (д, 1Н), 8,42 (с, 1Н), 9,3 (с, 1Н). Масс-спектр: М+Н+ 548.
Применяемый в качестве исходного вещества 2-морфолинометил-5-метоксианилин получали следующим образом.
Смесь 4-метокси-2-нитротолуола (20 г), N-бромсукцинимида (23 г), каталитического количества бензоилпероксида и тетрахлорида углерода (100 мл) нагревали с обратным холодильником в течение 8 часов. Смесь разбавляли метиленхлоридом (200 мл) и поочередно промывали 2н. водным раствором гидроксида натрия и насыщенным солевым раствором. Органический слой сушили над сульфатом магния и упаривали. Таким образом получали 4-метокси-2-нитробензилбромид (29 г), который использовали без дополнительной очистки.
Морфолин (2,8 мл) добавляли к перемешиваемому раствору 4-метокси-2-нитробензилбромида (4 г) в диэтиловом эфире (150 мл), охлажденном до 0°С. Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь фильтровали и упаривали фильтрат. Таким образом получали 2-морфолинометил-5-метокси-1-нитробензол (4 г). ЯМР-спектр: (CDCl3) 2,4 (м, 4Н), 3,68 (м, 4Н), 3,7 (с, 2Н), 3,88 (с, 3Н), 7,1 (м, 1Н), 7,35 (д, 1Н), 7,45 (д, 1Н).
Смесь полученного таким образом вещества, катализатора 10% «палладия на угле» (0,2 г) и метанола (100 мл) перемешивали под атмосферным давлением водорода в течение 1 часа. Смесь фильтровали и упаривали фильтрат. Очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (49:1). Таким образом получали 2-морфолинометил-5-метоксианилин (1,9 г). ЯМР-спектр: (CDCl3) 2,4 (уш.с, 4Н), 3,48 (с, 2Н), 3,7 (м, 4Н), 3,78 (с, 3Н), 4,75 (уш.с, 2Н), 6,2 (с, 1Н), 6,25 (д, 1Н), 6,9 (д, 1Н).
[30] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,7-1,8 (м, 2Н), 1,9 (уш.с, 4Н), 2,1 (м, 2Н), 2,65 (уш.с, 4Н), 3,0 (уш.с, 2Н), 4,25 (м, 2Н), 5,0 (м, 1Н), 6,05 (с, 1Н), 6,55 (д, 1Н), 6,7 (д, 1Н), 6,8 (д, 1Н), 6,98 (д, 1Н), 8,5 (с, 1Н), 9,3 (с, 1Н). Масс-спектр: M+H+ 497 и 499.
Применяемый в качестве исходного вещества 6-хлор-2,3-метилендиоксианилин получали следующим образом.
Сульфурилхлорид (72,5 мл) добавляли по каплям в течение 1,7 часов к перемешиваемой смеси бензодиоксола (100 г), трихлорида алюминия (0,43 г) и дифенилсульфида (0,55 мл). Когда начиналась реакция с выделением диоксида серы, реакционную смесь охлаждали в водяной бане до температуры приблизительно 22°С. После завершения процесса добавления реакционную смесь перемешивали при температуре окружающей среды в течение 45 минут. Реакционную смесь дегазировали в вакууме, фильтровали и перегоняли фильтрат при атмосферном давлении с применением дистилляционной колонки Вигре. Таким образом получали 5-хлор-1,3-бензодиоксол; т. кипения 185-187°С. ЯМР-спектр: (CDCl3) 6,0 (с, 2Н), 6,7 (д, 1Н), 6,75-6,9 (м, 2Н).
Смесь диизопропиламина (4,92 мл) и ТГФ (100 мл) охлаждали до -78°С и добавляли по каплям н-бутиллитий (2,5 М в гексане, 14 мл). Смесь перемешивали при -78°С в течение 15 минут. По каплям добавляли 5-хлор-1,3-бензодиоксол (3,73 мл) и перемешивали реакционную смесь при -78°С в течение 30 минут. Через реакционную смесь в течение 30 минут барботировали сухой диоксид углерода. Полученную реакционную смесь оставляли нагреваться до температуры окружающей среды и дополнительно перемешивали в течение 1 часа. Добавляли воду и выпаривали органический растворитель. Остаток подкисляли до значения рН=2 путем добавления 2н. водного раствора соляной кислоты. Полученное твердое вещество выделяли и поочередно промывали водой и диэтиловым эфиром. Таким образом получали 5-хлор-1,3-бензодиоксол-4-карбоновую кислоту (5,4 г). ЯМР-спектр: (ДМСОd6) 6,15 (с, 2Н), 7,0 (м, 2Н), 13,7 (уш.с, 1Н).
Часть (1 г) полученного таким образом вещества растворяли в 1,4-диоксане (15 мл) и поочередно добавляли безводный трет-бутанол (4 мл), азид дифенилфосфорила (1,12 мл) и триэтиламин (0,73 мл). Полученную смесь перемешивали и нагревали до 100°С в течение 4 часов. Смесь упаривали и распределяли остаток между этилацетатом и 5% водным раствором лимонной кислоты. Органическую фазу поочередно промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь петролейного эфира (т. кипения 40-60°С) и этилацетата (9:1). Таким образом получали трет-бутил-5-хлор-1,3-бензодиоксол-4-илкарбамат (1,1 г). ЯМР-спектр: (ДМСОd6) 1,45 (с, 9Н), 6,1 (с, 2Н), 6,85 (д, 1Н), 6,95 (д, 1Н), 8,75 (с, 1Н).
Смесь полученного таким образом вещества (1,1 г), трифторуксусной кислоты (6 мл) и метиленхлорида (20 мл) перемешивали при температуре окружающей среды в течение 3 часов. Растворитель выпаривали и распределяли остаток между этилацетатом и насыщенным водным раствором бикарбоната натрия. Органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Таким образом получали 6-хлор-2,3-метилендиоксианилин (0,642 г). ЯМР-спектр: (ДМСОd6) 5,15 (с, 2Н), 6,0 (с, 2Н), 6,25 (д, 1Н), 6,75 (д, 1Н).
[31] Реагенты представляли собой 5-[N-(трет-бутоксикарбонил)пиперидин-1-илметокси]-4-хлор-7-метоксихиназолин (0,4 г) и 6-хлор-(2,3-метилендиокси)анилин (0,089 г). После подщелачивания и очистки методом колоночной хроматографии продукт реакции суспендировали в 2М растворе хлороводорода в диэтиловом эфире (15 мл) и перемешивали при температуре окружающей среды в течение 3 часов. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Для полученного таким образом дигидрохлорида получены следующие данные. ЯМР-спектр: (ДМСОd6) 1,4-1,6 (м, 2Н), 1,95 (д, 2Н), 2,3-2,4 (м, 1Н), 2,8-2,9 (м, 2Н), 3,3 (м, 2Н), 3,97 (с, 3Н), 4,4 (д, 2Н), 6,12 (с, 2Н), 6,95 (д, 1Н), 7,03 (д, 1Н), 7,07 (д, 1Н), 7,11 (д, 1Н), 8,74 (с, 1Н), 8,8-9,0 (м, 2Н), 10,25 (уш.с, 1Н). Масс-спектр: M+H+ 443 и 445.
[32] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,8-1,9 (м, 4Н), 1,9-2,05 (м, 2Н), 2,2-2,3 (м, 2Н), 2,6-2,7 (м, 4Н), 2,95 (м, 2Н), 3,6-3,7 (м, 2Н), 4,05 (м, 2Н), 4,25 (м, 2Н), 4,75 (м, 1Н), 6,05 (с, 2Н), 6,6 (д, 1Н), 6,71 (д, 1Н), 6,84 (д, 1Н), 6,97 (д, 1Н), 8,5 (с, 1Н), 9,3 (с, 1Н). Масс-спектр: M+H+ 513 и 515.
Применяемый в качестве исходного вещества 4-хлор-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин описан в Примечании [6] Примера 19.
[33] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,75-1,9 (м, 4Н), 1,9-2,15 (м, 4Н), 2,2-2,3 (м, 2Н), 2,55 (уш.с, 4Н), 2,65 (м, 2Н), 3,65 (м, 2Н), 4,02 (м, 2Н), 4,15 (м, 2Н), 4,8 (м, 1Н), 6,05 (с, 2Н), 6,52 (д, 1Н), 6,72 (д, 1Н), 6,82 (д, 1Н), 6,97 (д, 1Н), 8,5 (с, 1Н), 9,26 (с, 1Н). Масс-спектр: М+Н+ 527 и 529.
Применяемый в качестве исходного вещества 4-хлор-7-(3-пирролидин-1-илпропокси)-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
С применением методики, аналогичной описанной ниже в Примечании [6] Примера 19, проводили взаимодействие 4-хлор-7-гидрокси-5-тетрагидропиран-4-илоксихиназолина (0,112 г) с 1-(3-гидроксипропил)пирролидином (0,062 г) с получением 4-хлор-7-(3-пирролидин-1-илпропокси)-5-тетрагидропиран-4-илоксихиназолина (0,125 г). ЯМР-спектр: (CDCl3) 1,7-1,9 (м, 4Н), 1,95-2,2 (м, 6Н), 2,55 (уш.с, 4Н), 2,65 (м, 2Н), 3,65-3,75 (м, 2Н), 4,0-4,1 (м, 2Н), 4,2 (м, 2Н), 4,75 (м, 1Н), 6,6 (д, 1Н), 6,95 (д, 1Н), 8,8 (с, 1Н). Масс-спектр: M+H+ 392 и 394.
[34] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 2,1-2,2 (м, 2Н), 2,15-2,3 (м, 2Н), 3,52-3,65 (м, 2Н), 3,95-4,08 (м, 2Н), 4,75 (м, 1Н), 5,18 (с, 2Н), 6,05 (с, 2Н), 6,6 (д, 1Н), 6,75 (д, 1Н), 6,9-7,0 (м, 2Н), 7,3-7,5 (м, 5Н), 8,55 (с, 1Н), 9,34 (с, 1Н). Масс-спектр: M+H+ 506 и 508.
Применяемый в качестве исходного вещества 7-бензилокси-4-хлор-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Ди-трет-бутилазодикарбоксилат (16,3 г) добавляли порциями к перемешиваемой смеси 7-бензилокси-5-гидрокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-она (17 г), 4-гидрокситетрагидропирана (5,4 г) и метиленхлорида (200 мл), охлажденного до 5°С. Смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 2 часов. Смесь упаривали и растворяли остаток в насыщенном метанольном растворе аммиака. Полученную смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученное таким образом твердое вещество сушили в вакууме с получением 7-бензилокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (12,5 г). ЯМР-спектр: (ДМСОd6) 1,6-1,7 (м, 2Н), 1,85-1,95 (м, 2Н), 3,5 (м, 2Н), 3,9 (м, 2Н), 4,75 (м, 1Н), 5,22 (с, 2Н), 6,7 (д, 1Н), 6,8 (д, 1Н), 7,3-7,5 (м, 5Н), 7,9 (с, 1Н). Масс-спектр: М+Н+ 353.
Смесь 7-бензилокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (9 г), фосфорилхлорида (2,8 мл), диизопропилэтиламина (11,4 мл) и 1,2-дихлорэтана (130 мл) перемешивали и нагревали до 80°С в течение 3 часов. Смесь упаривали с получением 7-бензилокси-4-хлор-5-тетрагидропиран-4-илоксихиназолина, который использовали без дополнительной очистки.
Пример 18
4-(2,6-Дихлоранилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолиндигидрохлорид
Гексаметилдисилазан натрия (1М раствор в ТГФ; 0,65 мл) добавляли к раствору 2,6-дихлоранилина (0,105 г) в ДМФ (3 мл) и перемешивали смесь при температуре окружающей среды в течение 5 минут. Добавляли раствор 4-хлор-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолина (0,1 г) в ДМФ (8 мл) и перемешивали смесь при температуре окружающей среды в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и экстрагировали смесь этилацетатом. Органический слой упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента сначала смесь метиленхлорида, этилацетата и метанола (9:10:1), а затем смесь метиленхлорида, этилацетата и насыщенного метанольного раствора аммиака (9:10:1). Полученное таким образом вещество растирали в присутствии диэтилового эфира. Твердое вещество выделяли и сушили в вакууме. Полученное таким образом вещество растворяли в смеси изопропанола (2 мл) и диэтилового эфира (2 мл) и добавляли 6М раствор хлороводорода в изопропаноле (0,11 мл). Смесь упаривали и сушили твердый остаток в вакууме. Таким образом получали указанное в заголовке соединение в виде дигидрохлорида (0,06 г), часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие характеристические данные. ЯМР-спектр: (CDCl3) 2,0-2,1 (м, 2Н), 2,15-2,25 (м, 2Н), 2,3 (с, 3Н), 2,4 (м, 2Н), 2,68 (м, 2Н), 3,95 (с, 3Н), 4,65 (м, 1Н), 6,55 (д, 1Н), 6,85 (д, 1Н), 7,22 (м, 1Н), 7,45 (д, 2Н), 8,5 (с, 1Н), 9,3 (с, 1Н). Масс-спектр: М+Н+ 433 и 435.
Пример 19
С применением методики, аналогичной описанной в Примере 18, проводили взаимодействие подходящего 4-хлорхиназолина с подходящим анилином в присутствии гексаметилдисилазана натрия с получением соединений, описанных в Таблице VI. Каждый продукт очищали в виде его дигидрохлорида и, если не определено иначе, часть каждого соединения преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3.
| Таблица VI |
 |
| № и прим. |
(R1)m |
Q1 |
(R2)n |
| [1] |
7-метокси |
N-метилпиперидин-4-ил |
2-бром-4-хлор-6-фтор |
| [2] |
7-метокси |
N-метилпиперидин-4-ил |
4-хлор-2-трифторметил |
| [3] |
7-метокси |
N-метилпиперидин-4-ил |
4-циано-2-трифторметил |
| [4] |
7-(2-пирролидин-1-илэтокси) |
циклопентил |
2-бром-4-хлор-6-фтор |
| [5] |
7-(2-пирролидин-1-илэтокси) |
циклопентил |
4-хлор-2-трифторметил |
| [6] |
7-(2-пирролидин-1-илэтокси) |
4-тетрагидропиранил |
4-хлор-2-трифторметил |
| [7] |
7-(2-пирролидин-1-илэтокси) |
4-тетрагидропиранил |
2-бром-4-хлор-6-фтор |
ПРИМЕЧАНИЯ
[1] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,98-2,1 (м, 2Н), 2,22 (м, 2Н), 2,31 (с, 3Н), 2,4 (м, 2Н), 2,7 (уш.с, 2Н), 3,95 (с, 3Н), 4,65 (м, 1Н), 6,55 (д, 1Н), 6,85 (д, 1Н), 7,25 (м, 1Н), 7,52 (д, 1Н), 8,48 (с, 1Н), 9,15 (с, 1Н). Масс-спектр: М+Н+ 495, 497 и 499.
[2] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,82-2,05 (м, 2Н), 2,1-2,3 (м, 4Н), 2,25 (с, 3Н), 2,75 (м, 2Н), 3,9 (с, 3Н), 4,5 (м, 1Н), 6,5 (д, 1Н), 6,8 (д, 1Н), 7,55 (м, 1Н), 7,65 (д, 1Н), 7,82 (д, 1Н), 8,4 (с, 1Н), 9,5 (с, 1Н). Масс-спектр: M+H+ 467 и 469.
[3] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,9-2,0 (м, 2Н), 2,15-2,25 (м, 4Н), 2,3 (с, 3Н), 2,85 (уш.с, 2Н), 3,85 (с, 3Н), 4,55 (м, 1Н), 6,6 (д, 1Н), 6,9 (д, 1Н), 7,88 (м, 1Н), 8,0 (с, 1Н), 8,3 (д, 1Н), 8,52 (с, 1Н), 9,78 (с, 1Н). Масс-спектр: M+H+ 458.
[4] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,7-1,95 (м, 8Н), 2,05 (уш.с, 4Н), 2,65 (уш.с, 4Н), 2,95 (м, 2Н), 4,25 (м, 2Н), 5,02 (м, 1Н), 6,6 (с, 1Н), 6,85 (с, 1Н), 7,2 (м, 1Н), 7,5 (с, 1Н), 8,45 (с, 1Н), 9,1 (с, 1Н). Масс-спектр: М+Н+ 549 и 551.
[5] Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,5-1,75 (м, 2Н), 1,75-1,9 (м, 6Н), 1,9-2,05 (м, 2Н), 2,05-2,15 (м, 2Н), 2,62 (уш.с, 4Н), 2,98 (м, 2Н), 4,25 (м, 2Н), 4,98 (м, 1Н), 6,6 (с, 1Н), 6,85 (с, 1Н), 7,55 (м, 1Н), 7,65 (д, 1Н), 7,85 (д, 1Н), 8,45 (с, 1Н), 9,45 (с, 1Н). Масс-спектр: M+H+ 521 и 523.
[6] Для дигидрохлорида получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,8-2,2 (м, 8Н), 3,1-3,3 (м, 2Н), 3,5 (т, 2Н), 3,6-3,75 (м, 4Н), 3,95 (д, 2Н), 4,6 (т, 2Н), 5,1 (м, 1Н), 7,0 (д, 1Н), 7,2 (д, 1Н), 7,75 (д, 1Н), 7,95 (м, 1Н), 8,0 (д, 1Н), 8,8 (с, 1Н). Масс-спектр: М+Н+ 537 и 539.
Применяемый в качестве исходного вещества 4-хлор-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Ди-трет-бутилазодикарбоксилат (0,99 г) добавляли к перемешиваемой смеси 4-хлор-7-гидрокси-5-тетрагидропиран-4-илоксихиназолина (0,75 г), трифенилфосфина (1,14 г), 1-(2-гидроксиэтил)пирролидина (0,372 г) и метиленхлорида (20 мл) и перемешивали смесь при температуре окружающей среды в течение 0,5 часа. Смесь наносили на наполненную силикагелем колонку и элюировали сначала смесью метиленхлорида и метанола (49:1), а затем смесью метиленхлорида и насыщенного метанольного раствора аммиака (97:3). Таким образом получали 4-хлор-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин (0,9 г). ЯМР-спектр: (CDCl3) 1,8-1,9 (м, 4Н), 1,9-2,05 (м, 2Н), 2,1-2,2 (м, 2Н), 2,6-2,7 (м, 4Н), 2,97 (м, 2Н), 3,65-3,75 (м, 2Н), 4,0-4,1 (м, 2Н), 4,25 (м, 2Н), 4,75 (м, 1Н), 6,7 (д, 1Н), 6,96 (д, 1Н), 9,81 (с, 1Н). Масс-спектр: М+Н+ 378 и 380.
[7] Для дигидрохлорида получены следующие данные. ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,85-2,2 (м, 8Н), 3,15-3,25 (м, 2Н), 3,5-3,65 (м, 2Н), 3,65-3,75 (м, 4Н), 4,0 (м, 2Н), 4,6 (т, 2Н), 5,15 (м, 1Н), 7,0 (д, 1Н), 7,22 (д, 1Н), 7,73 (м, 1Н), 7,87 (д, 1Н), 8,88 (с, 1Н). Масс-спектр: M+H+ 565 и 567.
Пример 20
4-(2-Бром-5-метоксианилино)-7-гидрокси-5-пиперидин-4-илоксихиназолин
Смесь 7-бензилокси-4-(2-бром-5-метоксианилино)-5-пиперидин-4-илоксихиназолина (0,35 г) и трифторуксусной кислоты (6 мл) перемешивали и нагревали до 80°С в течение 5 часов. Смесь упаривали и растворяли остаток в воде (12 мл). Раствор подщелачивали до значения рН=8 путем добавления бикарбоната натрия. Полученный осадок выделяли, промывали водой и этилацетатом и сушили в вакууме. Таким образом получали указанное в заголовке соединение (0,26 г). ЯМР-спектр: (ДМСОd6) 1,95-2,15 (м, 2H), 2,32 (д, 2Н), 3,05 (т, 2Н), 3,3-3,4 (м, 2Н), 3,8 (с, 3Н), 5,0 (м, 1Н), 6,75 (м, 2Н), 6,85 (с, 1Н), 7,6 (д, 1Н), 7,98 (с, 1Н), 8,4 (с, 1Н), 9,58 (с, 1Н). Масс-спектр: M+H+ 445 и 447.
Пример 21
4-(2-Хлор-5-метоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин
С применением методики, аналогичной описанной в Примере 20, проводили взаимодействие 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-тетрагидропиран-4-илоксихиназолина (0,78 г) с трифторуксусной кислотой (5 мл). Реакционную смесь упаривали и растирали остаток в присутствии диэтилового эфира. Осадок выделяли и растворяли твердое вещество в смеси метиленхлорида и насыщенного метанольного раствора аммиака. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (97:3). Таким образом получали указанное в заголовке соединение (0,47 г). ЯМР-спектр: (ДМСОd6) 1,8-1,9 (м, 2Н), 2,2 (д, 2Н), 3,52 (т, 2Н), 3,8 (с, 3Н), 3,92 (м, 2Н), 4,95 (м, 1Н), 6,7 (с, 1Н), 6,75-6,85 (м, 2Н), 7,5 (д, 1Н), 8,12 (д, 1Н), 8,4 (с, 1Н), 9,85 (с, 1Н). Масс-спектр: M+H+ 402 и 404.
Пример 22
4-(2-Хлор-5-метоксианилино)-7-[(2R)-2-гидрокси-3-морфолинопропокси]- 5-тетрагидропиран-4-илоксихиназолин
Смесь 4-(2-хлор-5-метоксианилино)-7-[(2R)-2,3-эпоксипропокси]-5-тетрагидропиран-4-илоксихиназолина (0,08 г), морфолина (0,044 мл), этанола (1 мл) и хлороформа (1 мл) перемешивали и нагревали до 45°С в течение 16 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Растирали остаток в присутствии пентана. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением указанного в заголовке соединения (0,08 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,9-2,05 (м, 2Н), 2,15 (д, 2Н), 3,1-3,45 (м, 5Н), 3,45-3,6 (м, 3Н), 3,7-3,9 (м, 2Н), 3,8 (с, 3H), 3,9-4,1 (м, 2Н), 4,22 (м, 1Н), 4,45 (м, 1Н), 5,15 (м, 1Н), 6,95 (с, 1Н), 7,02 (м, 1Н), 7,15 (с, 1Н), 7,5-7,6 (м, 2Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 545 и 547.
Применяемый в качестве исходного вещества 4-(2-хлор-5-метоксианилино)-7-[(2R)-2,3-эпоксипропокси]-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Фторид цезия (0,213 г) и (2R)-(-)-глицидилтозилат (0,119 г) поочередно добавляли к раствору 4-(2-хлор-5-метоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолина (0,19 г) в ДМА (2 мл), реакционную смесь перемешивали и нагревали до 50°С в течение 4,5 часов. Смесь упаривали и распределяли остаток между этилацетатом и насыщенным водным раствором бикарбоната натрия. Органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (49:1). Таким образом получали 4-(2-хлор-5-метоксианилино)-7-[(2R)-2,3-эпоксипропокси]-5-тетрагидропиран-4-илоксихиназолин (0,155 г). ЯМР-спектр: (CDCl3) 2,0-2,1 (м, 2Н), 2,25 (д, 2Н), 2,8 (м, 1Н), 2,98 (м, 1Н), 3,45 (уш.с, 1Н), 3,6 (т, 2Н), 3,85 (с, 3Н), 3,95-4,1 (м, 3Н), 4,45 (м, 1Н), 4,75 (м, 1Н), 6,6-6,7 (м, 2Н), 6,85 (с, 1Н), 7,32 (д, 1Н), 8,2 (д, 1Н), 8,6 (с, 1Н), 9,85 (с, 1Н). Масс-спектр: М+Н+ 458 и 460.
Пример 23
4-(2-Хлор-5-метоксианилино)-7-[(2R)-2-гидрокси-3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин
С применением методики, аналогичной описанной в Примере 22, проводили взаимодействие 4-(2-хлор-5-метоксианилино)-7-[(2R)-2,3-эпоксипропокси]-5-тетрагидропиран-4-илоксихиназолина (0,07 г) с 1-метилпиперазином (0,05 мл) с получением указанного в заголовке соединения (0,04 г). ЯМР-спектр: (ДМСОd6) 1,8-1,9 (м, 2Н), 2,2 (с, 3Н), 2,2 (д, 2Н), 2,25-2,6 (м, 10Н), 3,55 (т, 2Н), 3,8 (с, 3Н), 3,92 (м, 2Н), 4,05 (м, 2Н), 4,2 (м, 1Н), 4,9 (д, 1Н), 5,1 (м, 1Н), 6,8 (м, 1Н), 6,85 (д, 1Н), 6,95 (д, 1Н), 7,5 (д, 1Н), 8,12 (д, 1Н), 8,5 (с, 1Н), 9,9 (с, 1Н). Масс-спектр: М+Н+ 558 и 560.
Пример 24
4-(2-Бром-5-метоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолин
Смесь 7-ацетокси-4-хлор-5-тетрагидропиран-4-илоксихиназолина (1,7 г), 2-бром-5-метоксианилина (1,1 г) и изопропанола (10 мл) перемешивали и нагревали до 80°С в течение 1 часа. Полученный осадок выделяли, промывали изопропанолом и сушили в вакууме с получением 7-ацетокси-4-(2-бром-5-метоксианилино)-5-тетрагидропиран-4-илоксихиназолингидрохлорида (2 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 1,9-2,1 (м, 2Н), 2,17 (д, 2Н), 2,38 (с, 3Н), 3,5 (т, 2Н), 3,8 (с, 3Н), 3,95 (м, 2Н), 5,1 (м, 1Н), 7,0 (м, 1Н), 7,32 (с, 1Н), 7,42 (д, 1Н), 7,5 (с, 1Н), 7,7 (д, 1Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 488 и 490.
Смесь части (0,15 г) полученного таким образом вещества и насыщенного метанольного раствора аммиака (5 мл) перемешивали при температуре окружающей среды в течение 16 часов. Смесь упаривали и растирали остаток в присутствии воды. Полученное твердое вещество выделяли и сушили в вакууме с получением указанного в заголовке соединения (0,091 г). ЯМР-спектр: (ДМСОd6) 1,8-2,0 (м, 2Н), 2,15 (д, 2Н), 3,52 (т, 2Н), 3,8 (с, 3H), 3,9 (м, 2Н), 4,95 (м, 1Н), 6,7 (с, 1Н), 6,75 (м, 1Н), 6,8 (д, 1Н), 7,6 (д, 1Н), 7,85 (д, 1Н), 8,35 (с, 1Н), 9,65 (с, 1Н), 10,58 (с, 1Н). Масс-спектр: М+Н+ 446 и 448.
Применяемый в качестве исходного вещества 7-ацетокси-4-хлор-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Раствор 7-ацетокси-5-тетрагидропиран-4-илокси-3,4-дигидрохиназолин-4-она (1,52 г) в 1,2-дихлорэтане (30 мл), содержащий оксихлорид фосфора (0,51 мл) и диизопропилэтиламин (2,17 мл), перемешивали и нагревали до 80°С в течение 2 часов. Смесь упаривали с получением требуемого вещества, которое использовали без дополнительной очистки.
Пример 25
4-(2-Хлор-5-метоксианилино)-7-гидрокси-5-тетрагидрофуран-3-илоксихиназолин
С применением методики, аналогичной описанной в Примере 20, проводили взаимодействие 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-тетрагидрофуран-3-илоксихиназолина (0,39 г) с трифторуксусной кислотой (2,5 мл). Реакционную смесь упаривали и растирали остаток в присутствии диэтилового эфира. Осадок выделяли и растворяли твердое вещество в смеси метиленхлорида и насыщенного метанольного раствора аммиака. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (97:3). Таким образом получали указанное в заголовке соединение (0,47 г). ЯМР-спектр: (ДМСОd6 и CF3CO2D) 2,2-2,3 (м, 1Н), 2,3-2,5 (м, 1Н), 3,8 (с, 3Н), 3,75-3,9 (м, 1Н), 3,9-4,0 (м, 2Н), 4,2 (д, 1Н), 5,5 (м, 1Н), 6,8 (с, 1Н), 6,92 (с, 1Н), 7,02 (м, 1Н), 7,55 (д, 1Н), 7,6 (д, 1Н), 8,85 (с, 1Н). Масс-спектр: М+Н+ 388 и 390.
Пример 26
4-(2-Хлор-5-метоксианилино)-7-гидрокси-5-изопропоксихиназолин
С применением методики, аналогичной описанной в Примере 20, проводили взаимодействие 7-бензилокси-4-(2-хлор-5-метоксианилино)-5-изопропоксихиназолина (0,33 г) с трифторуксусной кислотой. Таким образом получали указанное в заголовке соединение (0,17 г). ЯМР-спектр: (ДМСОd6 и CF3CO2D) 1,55 (д, 6Н), 3,85 (с, 3Н), 5,1 (м, 1Н), 6,8 (с, 1Н), 6,92 (с, 1Н), 7,0 (м, 1Н), 7,58 (д, 1Н), 7,65 (д, 1Н), 8,85 (с, 1Н). Масс-спектр: М+Н+ 360 и 362.
Пример 27
4-(Бензофуран-7-иламино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолиндигидрохлорид
С применением методики, аналогичной описанной в Примере 5, проводили взаимодействие 4-хлор-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолина с 7-аминобензофураном с получением указанного в заголовке соединения, часть которого обрабатывали насыщенным раствором аммиака в метаноле. Смесь фильтровали и упаривали фильтрат с получением свободного основания. ЯМР-спектр: (CDCl3) 2,15-2,35 (м, 6Н), 2,32 (с, 3H), 2,92 (м, 2Н), 3,9 (с, 3H), 4,6 (м, 1Н), 6,5 (д, 1Н), 6,8 (д, 1Н), 6,85 (д, 1Н), 7,25-7,4 (м, 2Н), 7,68 (д, 1Н), 8,58 (д, 1Н), 8,6 (с, 1Н), 10,25 (уш.с, 1Н). Масс-спектр: М+Н+ 405.
Применяемый в качестве исходного вещества 7-аминобензофуран получали следующим образом.
Гидразингидрат (0,45 мл) добавляли по каплям к перемешиваемой смеси 7-нитробензофурана (J.Med. Chem., 1988, 31, 1934; 0,5 г), никеля Ренея (0,02 г) и метанола (9 мл), натретого до 55°С. Полученную смесь нагревали с обратным холодильником в течение 30 минут. Катализатор удаляли путем фильтрации и упаривали фильтрат. Остаток распределяли между метиленхлоридом и водой. Органическую фазу сушили над сульфатом магния и упаривали с получением 7-аминобензофурана (0,4 г) в виде масла. ЯМР-спектр: (ДМСОd6) 5,25 (уш.с, 2Н), 6,55 (д, 1Н), 6,8 (м, 2Н), 6,9 (т, 1Н), 7,85 (д, 1Н).
Пример 28
4-(3-Хлорбензофуран-7-иламино)-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолиндигидрохлорид
С применением методики, аналогичной описанной в Примере 5, проводили взаимодействие 4-хлор-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолина с 7-амино-3-хлорбензофураном с получением указанного в заголовке соединения, часть которого обрабатывали насыщенным раствором аммиака в метаноле. Смесь фильтровали и упаривали фильтрат с получением свободного основания. ЯМР-спектр: (CDCl3) 2,07 (м, 2Н), 2,1 (м, 2Н), 2,25 (м, 2Н), 2,27 (с, 3Н), 2,35-2,68 (м, 10Н), 3,6 (т, 2Н), 4,0-4,2 (м, 4Н), 4,75 (м, 1Н), 6,52 (с, 1Н), 6,85 (с, 1Н), 7,35 (м, 2Н), 7,65 (с, 1Н), 8,6 (с, 1Н), 8,7 (д, 1Н), 10,3 (с, 1Н). Масс-спектр: M+H+ 522 и 524.
Пример 29
4-(2,4-Дихлор-5-метоксианилино)-7-(3-пипераэин-1-илпропокси)-5-тетрагидропиран-4-илоксихиназолиндигидрохлорид
Смесь 4-(2,4-дихлор-5-метоксианилино)-7-[3-(4-трет-бутоксикарбонилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолина (0,12 г) и трифторуксусной кислоты (2 мл) перемешивали при температуре окружающей среды в течение 2 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученное твердое вещество выделяли и сушили в вакууме. Твердое вещество растворяли в диэтиловом эфире и добавляли 6М раствор хлороводорода в диэтиловом эфире (0,5 мл). Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали указанное в заголовке соединение (0,112 г). ЯМР-спектр: (ДМСОd6 и CF3CO2D) 1,9-2,1 (м, 2Н), 2,15 (д, 2Н), 2,28-2,4 (м, 2Н), 3,4 (м, 2Н), 3,4-3,9 (м, 10Н), 3,92 (с, 3Н), 3,95 (м, 2Н), 4,39 (т, 2Н), 5,2 (м, 1Н), 7,0 (д, 1Н), 7,2 (д, 1Н), 7,78 (с, 1Н), 7,82 (с, 1Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 562 и 564.
Применяемый в качестве исходного вещества 4-(2,4-дихлор-5-метоксианилино) -7-[3-(4-трет-бутоксикарбонилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
С применением методики, аналогичной описанной в Примере 12, проводили взаимодействие 4-(2,4-дихлор-5-метоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолина (0,109 г) с 1-трет-бутоксикарбонил-4-(3-гидроксипропил)пиперазином (0,074 г) с получением 4-(2,4-дихлор-5-метоксианилино)-7-[3-(4-трет-бутоксикарбонилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолина (0,12 г).
Пример 30
4-(2,4-Дихлор-5-метоксианилино)-7-пиперидин-4-илметокси-5-тетрагидропиран-4-илоксихиназолин
Смесь 4-(2,4-дихлор-5-метоксианилино)-7-(1-трет-бутоксикарбонилпиперидин-4-илметокси)-5-тетрагидропиран-4-илоксихиназолина (0,11 г) и трифторуксусной кислоты (2 мл) перемешивали при температуре окружающей среды в течение 2 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученное твердое вещество выделяли и сушили в вакууме. Твердое вещество растворяли в диэтиловом эфире и добавляли 6М раствор хлороводорода в диэтиловом эфире (0,5 мл). Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали дигидрохлорид указанного в заголовке соединения. Твердое вещество растворяли в метиленхлориде и добавляли несколько капель насыщенного метанольного раствора аммиака. Раствор наносили на наполненную силикагелем хроматографическую колонку и элюировали смесью метиленхлорида и насыщенного метанольного раствора аммиака (24:1). Таким образом получали указанное в заголовке соединение (0,08 г). ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 2Н), 1,95 (д, 2Н), 1,9-2,15 (м, 3Н), 2,52 (д, 2Н), 2,7 (м, 2Н), 3,2 (д, 2Н), 3,6 (м, 2Н), 3,9-4,0 (м, 2Н), 4,05 (с, 3Н), 4,1 (тд, 2Н), 4,75 (м, 1Н), 6,6 (д, 1Н), 6,85 (м, 1Н), 7,45 (с, 1Н), 8,4 (с, 1Н), 8,6 (с, 1Н). Масс-спектр: М+Н+ 533 и 535.
Применяемый в качестве исходного вещества 4-(2,4-дихлор-5-метоксианилино)-7-(1-трет-бутоксикарбонилпиперидин-4-илметокси)-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
С применением методики, аналогичной описанной в Примере 12, проводили взаимодействие 4-(2,4-дихлор-5-метоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолина (0,109 г) с 1-трет-бутоксикарбонилпиперидин-4-илметанолом (0,065 г) с получением 4-(2,4-дихлор-5-метоксианилино)-7-(1-трет-бутоксикарбонилпиперидин-4-илметокси)-5-тетрагидропиран-4-илоксихиназолина (0,11 г).
Пример 31
4-(6-Хлор-2,3-метилендиоксианилино)-7-фтор-5-пиперидин-4-илоксихиназолиндигидрохлорид
Смесь 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-(6-хлор-2,3-метилендиоксианилино)-7-фторхиназолиндигидрохлорида (0,12 г) и 2М раствора хлороводорода в диэтиловом эфире (5 мл) перемешивали при температуре окружающей среды в течение 1 часа. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали указанное в заголовке соединение (0,086 г). ЯМР-спектр: (ДМСОd6) 2,1-2,3 (м, 4Н), 3,0-3,15 (м, 2Н), 3,3 (м, 2Н), 5,1 (м, 1Н), 6,12 (с, 2Н), 7,01 (д, 1Н), 7,1 (д, 1Н), 7,3 (д, 1Н), 7,53 (д, 1Н), 8,75 (с, 1Н), 9,05 (уш.с, 1Н), 9,3 (уш.с, 1Н), 9,95 (уш.с, 1Н). Масс-спектр: M+H+ 417 и 419.
Применяемый в качестве исходного вещества 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-(6-хлор-2,3-метилендиоксианилино)-7-фторхиназолиндигидрохлорид получали следующим образом.
Гидрид натрия (60% дисперсия в минеральном масле; 0,55 г) добавляли порциями к раствору трет-бутил-4-гидроксипиперидин-1-карбоксилата (1,65 г) в ДМФ (10 мл) и перемешивали полученную смесь при температуре окружающей среды в течение 15 минут. Добавляли 5,7-дифтор-3,4-дигидрохиназолин-4-он (1 г) и перемешивали смесь при температуре окружающей среды в течение 30 минут. Смесь вливали в воду (100 мл) и для подкисления смеси до значения рН=5 при интенсивном перемешивании добавляли ледяную уксусную кислоту. Полученное твердое вещество выделяли, промывали водой и диэтиловым эфиром и сушили в вакууме. Таким образом получали 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-7-фтор-3,4-дигидрохиназолин-4-он (1,4 г). ЯМР-спектр: (CDCl3) 1,47 (с, 9Н), 1,94 (м, 4Н), 3,5-3,8 (м, 4Н), 4,7 (м, 1Н), 6,68 (м, 1Н), 7,0 (м, 1Н), 7,9 (с, 1Н), 10,55 (уш.с, 1Н). Масс-спектр: М+Н+ 364.
Смесь 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-7-фтор-3,4-дигидрохиназолин-4-она (0,15 г), трифенилфосфина (0,216 г), тетрахлорида углерода (0,12 мл) и 1,2-дихлорэтана (5 мл) перемешивали и нагревали до 70°С в течение 1 часа. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и этилацетата (9:1). Таким образом получали 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-хлор-7-фторхиназолин (0,1 г). ЯМР-спектр: (CDCl3) 1,48 (с, 9Н), 2,0 (м, 4Н), 3,5-3,7 (м, 4Н), 4,8 (м, 1Н), 6,8 (м, 1Н), 7,3 (м, 1Н), 8,9 (с, 1Н). Масс-спектр: М+Н+ 382 и 384.
Смесь полученного таким образом вещества, 6-хлор-2,3-метилендиоксианилина (0,049 г), 5М раствора хлороводорода в изопропаноле (1 капля) и изопропанола (1 мл) перемешивали и нагревали до 50°С в течение 15 минут и затем до 80°С в течение 45 минут. Осадок выделяли, поочередно промывали изопропанолом, этилацетатом и диэтиловым эфиром и сушили в вакууме. Таким образом получали 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-(6-хлор-2,3-метилендиоксианилино)-7-фторхиназолиндигидрохлорид (0,065 г). ЯМР-спектр: (ДМСОd6) 1,4 (с, 9Н), 1,8-2,0 (ш, 2Н), 2,0-2,15 (м, 2Н), 3,05 (уш.с, 2Н), 3,9 (д, 2Н), 5,05 (м, 1Н), 6,11 (с, 2Н), 7,1 (д, 1Н), 7,16 (д, 1Н), 7,2 (м, 1Н), 7,52 (д, 1Н), 8,7 (с, 1Н), 9,92 (уш.с, 1Н). Масс-спектр: M+H+ 517 и 519.
Пример 32
4-(6-Хлор-2,3-метилендиоксианилино)-5-пиперидин-4-илоксихиназолиндигидрохлорид
С применением методики, аналогичной описанной в Примере 31, проводили взаимодействие 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-(6-хлор-2,3-метилендиоксианилино)хиназолиндигидрохлорида (0,14 г) с хлороводородом с получением указанного в заголовке соединения (0,113 г). ЯМР-спектр: (ДМСОd6) 2,15-2,34 (м, 4Н), 3,15 (м, 2Н), 3,3 (м, 2Н), 5,17 (м, 1Н), 6,17 (с, 2Н), 7,07 (д, 1Н), 7,16 (д, 1Н), 7,58 (м, 1Н), 8,06 (м, 1Н), 8,88 (с, 1Н), 9,14 (уш.с, 1Н), 9,32 (уш.с, 1Н), 10,28 (с, 1Н). Масс-спектр: М+Н+ 399 и 401.
Применяемый в качестве исходного вещества 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-(6-хлор-2,3-метилендиоксианилино)хиназолиндигидрохлорид получали с применением методик, аналогичных описанным в Примере 31 в той его части, которая касается получения исходных веществ, следующим образом.
Так, проводили взаимодействие трет-бутил-4-гидроксипиперидин-1-карбоксилата (0,33 г) с 5-фтор-3,4-дигидрохиназолин-4-оном (0,18 г) с получением 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-3,4-дигидрохиназолин-4-она (0,39 г). ЯМР-спектр: (CDCl3) 1,5 (с, 9Н), 1,9-2,0 (м, 4Н), 3,52 (м, 2Н), 3,7 (м, 2Н), 4,72 (м, 1Н), 6,95 (д, 1Н), 7,32 (д, 1Н), 7,65 (м, 1Н), 7,95 (с, 1Н), 10,22 (уш.с, 1Н). Масс-спектр: М+Н+ 346.
Проводили взаимодействие 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-3,4-дигидрохиназолин-4-она (0,31 г) с трифенилфосфином и тетрахлоридом углерода с получением 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-хлорхиназолина (0,156 г). ЯМР-спектр: (CDCl3) 1,5 (с, 9Н), 1,9-2,1 (м, 4Н), 3,5-3,8 (м, 4Н), 4,8 (м, 1Н), 7,05 (д, 1Н), 7,65 (д, 1Н), 7,82 (м, 1Н), 8,95 (с, 1Н). Масс-спектр: М+Н+ 364 и 366. И проводили взаимодействие части (0,124 г) полученного таким образом вещества и 6-хлор-2,3-метилендиоксианилина (0,064 г) с получением 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-(6-хлор-2,3-метилендиоксианилино)-хиназолиндигидрохлорида (0,14 г). ЯМР-спектр: (ДМСОd6) 1,4 (с, 9Н), 1,85-2,0 (м, 2Н), 2,1 (м, 2Н), 2,95-3,2 (м, 2Н), 3,92 (д, 2Н), 5,1 (м, 1Н), 6,15 (с, 2Н,), 7,08 (д, 1Н), 7,15 (д, 1Н), 7,55 (д, 1Н), 7,6 (д, 1Н), 8,05 (м, 1Н), 8,86 (с, 1Н), 10,35 (с, 1Н). Масс-спектр: M+H+ 499 и 501.
Пример 33
4-(6-Хлор-2,3-метилендиоксианилино)-7-метокси-5-пиперидин-4-илоксихиназолин
Смесь 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-(6-хлор-2,3-метилендиоксианилино)-7-метоксихиназолиндигидрохлорида (2,39 г), трифторуксусной кислоты (10 мл) и метиленхлорида (35 мл) перемешивали при температуре окружающей среды в течение 1,5 часов. Смесь упаривали и распределяли остаток между этилацетатом и 1н. водным раствором гидроксида натрия. Органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (19:1). Таким образом получали указанное в заголовке соединение (1,44 г). ЯМР-спектр: (CDCl3) 1,8-2,0 (м, 2Н), 2,15-2,3 (м, 2Н), 2,75-2,9 (м, 2Н), 3,1-3,2 (м, 2Н), 3,9 (с, 3Н), 4,65 (м, 1Н), 6,0 (с, 2Н), 6,46 (д, 1Н), 6,72 (д, 1Н), 6,8 (д, 1Н), 6,91 (д, 1Н), 8,5 (с, 1Н), 9,21 (с, 1Н). Масс-спектр: M+H+ 429 и 431.
Применяемый в качестве исходного вещества 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-(6-хлор-2,3-метилендиоксианилино)-7-метоксихиназолиндигидрохлорид получали следующим образом.
Ди-трет-бутилазодикарбоксилат (1,13 г) добавляли порциями к перемешиваемой смеси 5-гидрокси-7-метокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-она (1 г), трет-бутил-4-гидроксипиперидин-1-карбоксилата (0,788 г), трифенилфосфина (1,28 г) и метиленхлорида (15 мл), охлажденного до 10°С. Смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 1 часа. Смесь упаривали и растворяли остаток в метаноле (25 мл). Добавляли гидроксид натрия (0,2 г) и перемешивали смесь при температуре окружающей среды в течение 1 часа. Полученную смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида, этилацетата и метанола (47:50:3). Таким образом получали 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-7-метокси-3,4-дигидрохиназолин-4-он (1,09 г). ЯМР-спектр: (CDCl3) 1,5 (с, 9Н), 1,87-2,0 (м, 4Н), 3,48-3,6 (м, 2Н), 3,6-3,75 (м, 2Н), 3,9 (с, 3Н), 4,65 (м, 1Н), 6,5 (д, 1Н), 6,77 (д, 1Н), 7,91 (с, 1Н), 10,7 (уш.с, 1Н). Масс-спектр: М+Н+ 376.
С применением методики, аналогичной описанной в Примере 31 в той его части, которая касается получения исходных веществ, проводили взаимодействие 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-7-метокси-3,4-дигидрохиназолин-4-она (1 г) с трифенилфосфином и тетрахлоридом углерода с получением 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-хлор-7-метоксихиназолина (0,8 г). ЯМР-спектр: (CDCl3) 1,5 (с, 9Н), 1,9-2,1 (м, 4Н), 3,5-3,7 (м, 4Н), 3,96 (с, 3Н), 4,72 (м, 2Н), 6,6 (д, 1Н), 6,98 (д, 1Н), 8,82 (с, 1Н). Масс-спектр: М+Н+ 394 и 396.
С применением методики, аналогичной также описанной в Примере 31 в той его части, которая касается получения исходных веществ, проводили взаимодействие 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-хлор-7-метоксихиназолина (0,14 г) и 6-хлор-2,3-метилендиоксианилина (0,064 г) с получением 5-(1-трет-бутоксикарбонилпиперидин-4-илокси)-4-(6-хлор-2,3-метилендиоксианилино)-7-метоксихиназолиндигидрохлорида (0,17 г). ЯМР-спектр: (ДМСОd6) 1,42 (с, 9Н), 1,8-2,0 (м, 2Н), 2,0-2,15 (м, 2Н), 3,0-3,2 (м, 2Н), 3,85-3,95 (м, 2Н), 3,99 (с, 3Н), 5,1 (м, 1Н), 6,96 (д, 1Н), 7,05 (д, 1Н), 7,12 (с, 1Н), 7,15 (д, 1Н), 8,78 (с, 1Н), 10,1 (с, 1Н). Масс-спектр: М+Н+ 529 и 531.
Пример 34
4-(6-Хлор-2,3-метилендиоксианилино)-7-гидрокси-5-пиперидин-4-илоксихиназолин
Смесь 7-бензилокси-5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-(6-хлор-2,3-метилендиоксианилино)хиназолиндигидрохлорида (2,3 г) и трифторуксусной кислоты (28 мл) перемешивали и нагревали до 80°С в течение 6 часов. Смесь упаривали, растворяли остаток в воде и подщелачивали раствор до значения рН=10 путем добавления 1н. водного раствора гидроксида натрия. Смесь перемешивали при температуре окружающей среды в течение 1 часа. Твердое вещество выделяли, промывали водой и сушили в вакууме. Таким образом получали указанное в заголовке соединение (1,1 г). ЯМР-спектр: (ДМСОd6) 1,6-1,8 (м, 2Н), 2,0-2,15 (м, 2Н), 2,65-2,75 (м, 2Н), 2,9-3,05 (м, 2Н), 4,8 (м, 1Н), 6,1 (с, 2Н), 6,62 (с, 1Н), 6,7 (с, 1Н), 6,92 (д, 1Н), 7,05 (д, 1Н), 8,25 (с, 1Н), 9,2 (с, 1Н). Масс-спектр: М+Н+ 415 и 417.
Пример 35
5-[N-(трет-Бутоксикарбонил)пиперидин-4-илокси]-4-(6-хлор-2,3-метилендиоксианилино)-7-гидроксихиназолин
Смесь 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-пиперидин-4-илоксихиназолина (1,4 г), ди-трет-бутилдикарбоната (0,737 г) и ДМФ (14 мл) перемешивали при температуре окружающей среды в течение 2 часов. Смесь упаривали и распределяли остаток между этилацетатом и водой. Органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (24:1). Таким образом получали указанное в заголовке соединение(1,2 г). ЯМР-спектр: (CDCl3) 1,5 (с, 9Н), 1,7-1,9 (м, 2Н), 2,0-2,15 (м, 2Н), 3,0-3,15 (м, 2Н), 3,8-3,95 (м, 2Н), 4,6 (м, 1Н), 6,02 (с, 2Н), 6,55 (с, 1Н), 6,72 (д, 1Н), 6,98 (м, 2Н), 8,4 (с, 1Н), 9,4 (с, 1Н). Масс-спектр: М+Н+ 515 и 517.
Пример 36
4-(6-Хлор-2,3-метилендиоксианилино)-5-пиперидин-4-илокси-7-(2,2,2-трифторэтокси)хиназолин
Смесь 5-[N-(трет-бутоксикарбонил)пиперидин-4-илокси]-4-(6-хлор-2,3-метилендиоксианилино)-7-гидроксихиназолина (0,15 г), 2,2,2-трифторэтил-4-толуолсульфоната (0,089 г), карбоната калия (0,1 г) и ДМФ (3 мл) перемешивали и нагревали до 95°С в течение 24 часов. Смесь охлаждали до температуры окружающей среды и распределяли между этилацетатом и водой. Органический слой промывали 1н. водным раствором гидроксида натрия и насыщенным солевым раствором и сушили над сульфатом магния. Органический раствор фильтровали и добавляли 6н. раствор хлороводорода в диэтиловом эфире (2 мл). Смесь перемешивали при температуре окружающей среды в течение 16 часов. Смесь упаривали. Остаток растворяли в метиленхлориде (3 мл) и добавляли насыщенный метанольный раствор аммиака (1 мл). Смесь фильтровали и упаривали фильтрат. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (19:1). Таким образом получали указанное в заголовке соединение (0,061 г). ЯМР-спектр: (CDCl3) 1,85-2,0 (м, 2Н), 2,3 (м, 2Н), 2,8-2,95 (м, 2Н), 3,1-3,3 (м, 2Н), 4,5 (м, 2Н), 4,72 (м, 1Н), 6,08 (с, 2Н), 6,6 (д, 1Н), 6,75 (д, 1Н), 6,82 (д, 1Н), 7,0 (д, 1Н), 8,58 (с, 1Н), 9,32 (с, 1Н). Масс-спектр: М+Н+ 497 и 499.
Пример 37
4-(6-Хлор-2,3-метилендиоксианилино)-5-(N-метилпиперидин-4-илокси)хиназолин
4-Гидрокси-1-метилпиперидин (0,049 г) добавляли к перемешиваемой суспензии гидрида натрия (60% дисперсия в минеральном масле, 0,043 г) в ДМФ (2 мл) и перемешивали смесь при температуре окружающей среды в течение 5 минут. Дигидрохлорид 4-(6-хлор-2,3-метилендиоксианилино)-5-фторхиназолина обрабатывали насыщенным метанольным раствором аммиака с получением свободного основания (0,1 г), которое добавляли к вышеупомянутому раствору натриевой соли 4-гидрокси-1-метилпиперидина. Полученную смесь перемешивали и нагревали до 50°С в течение 30 минут. Смесь охлаждали до температуры окружающей среды и распределяли между этилацетатом и водой. Органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь этилацетата, метиленхлорида и насыщенного метанольного раствора аммиака (25:24:1). Таким образом получали 4-(6-хлор-2,3-метилендиоксианилино)-5-(N-метилпиперидин-4-илокси)хиназолин (0,054 г). ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,1-2,25 (м, 2Н), 2,3 (с, 3H), 2,3-2,4 (м, 2Н), 2,7 (уш.с, 2Н), 4,65 (м, 1Н), 6,01 (с, 2Н), 6,7 (д, 1Н), 6,8 (д, 1Н), 6,85 (д, 1Н), 7,45 (д, 1Н), 7,6 (м, 1Н), 8,56 (с, 1Н), 9,5 (уш.с, 1Н). Масс-спектр: М+Н+ 413 и 415.
Применяемый в качестве исходного вещества 4-(6-хлор-2,3-метилендиоксианилино)-5-фторхиназолиндигидрохлорид получали следующим образом с применением методик, аналогичных описанным в Примере 31 в той его части, которая касается получения исходных веществ.
Так, проводили взаимодействие 5-фтор-3,4-дигидрохиназолин-4-она (2 г) с трифенилфосфином и тетрахлоридом углерода с получением 5-фтор-4-хлорхиназолина (1,34 г). ЯМР-спектр: (CDCl3) 7,4-7,5 (м, 1Н), 7,9-8,0 (м, 2Н), 9,1 (с, 1Н). И проводили взаимодействие части (0,4 г) полученного таким образом вещества с 6-хлор-2,3-метилендиоксианилином (0,413 г) с получением 4-(6-хлор-2,3-метилендиоксианилино)-5-фторхиназолиндигидрохлорида (0,73 г). ЯМР-спектр: (ДМСОd6) 6,18 (с, 2Н), 7,05 (д, 1Н), 7,12 (д, 1Н), 7,7 (м, 1Н), 7,85 (д, 1Н), 8,12 (м, 1Н), 8,87 (с, 1Н). Масс-спектр: М+Н+ 318 и 320.
Пример 38
4-(6-Хлор-2,3-метилендиоксианилино)-7-изопропокси-5-(N-метилпиперидин-4-илокси)хиназолин
Триацетоксиборгидрат натрия (0,087 г) добавляли порциями к перемешиваемой смеси 4-(6-хлор-2,3-метилендиоксианилино)-7-изопропокси-5-пиперидин-4-илоксихиназолина (0,125 г), водного раствора формальдегида (13н., 0,042 мл), уксусной кислоты (0,019 мл), метиленхлорида (5 мл) и метанола (2 мл) и нагревали полученную смесь с обратным холодильником в течение 3 минут. Смесь упаривали и распределяли остаток между этиацетатом и 1н. водным раствором гидроксида натрия. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали с получением указанного в заголовке соединения (0,11 г). ЯМР-спектр: (CDCl3) 1,42 (д, 6Н), 1,95-2,1 (м, 2Н), 2,15-2,25 (м, 2Н), 2,3 (с, 3Н), 2,3-2,4 (м, 2Н), 2,7-2,8 (м, 2Н), 4,6 (ш, 1Н), 4,72 (м, 1Н), 6,05 (с, 2Н), 6,5 (д, 1Н), 6,75 (д, 1Н), 6,82 (д, 1Н), 6,99 (д, 1Н), 8,52 (с, 1Н), 9,3 (с, 1Н). Масс-спектр: М+Н+ 471 и 473.
Пример 39
4-(6-Хлор-2,3-метилендиоксианилино)-5-пиперидин-4-илметоксихиназолиндигидрохлорид
С применением методики, аналогичной описанной в Примере 37, проводили взаимодействие N-(трет-бутоксикарбонил)пиперидин-4-илметанола с 4-(6-хлор-2,3-метилендиоксианилино)-5-фторхиназолином (0,1 г). Полученный таким образом продукт растворяли в 2М растворе хлороводорода в диэтиловом эфире (20 мл) и перемешивали при температуре окружающей среды в течение 3 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученное таким образом твердое вещество промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали указанное в заголовке соединение (0,121 г). ЯМР-спектр: (ДМСОd6) 1,5-1,6 (м, 2Н), 1,9-2,0 (м, 2Н), 2,3-2,4 (м, 1Н), 2,8-2,9 (м, 2Н), 3,3 (д, 2Н), 4,42 (д, 2Н), 6,15 (с, 2Н), 7,07 (д, 1Н), 7,15 (д, 1Н), 7,53 (м, 2Н), 8,06 (м, 1Н), 8,87 (с, 1Н), 10,57 (уш.с, 1Н). Масс-спектр: М+Н+ 413 и 415.
Пример 40
4-(6-Хлор-2,3-метилендиоксианилино)-5-(N-метилпиперидин-4-илметокси)хиназолиндигидрохлорид
С применением методики, аналогичной описанной в Примере 38, проводили взаимодействие 4-(6-хлор-2,3-метилендиоксианилино)-5-пиперидин-4-илметоксихиназолина (полученного из дигидрохлорида путем растирания в присутствии насыщенного метанольного раствора аммиака) с водным раствором формальдегида и триацетоксиборгидрида натрия. Полученный в виде свободного основания продукт реакции растирали в присутствии 2М раствора хлороводорода в диэтиловом эфире. Полученный осадок выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали указанное в заголовке соединение, часть которого преобразовывали в свободное основание путем растирания в присутствии насыщенного метанольного раствора аммиака. Для свободного основания получены следующие данные. ЯМР-спектр: (CDCl3) 1,35-1,55 (м, 2Н), 1,9-2,1 (м, 5Н), 2,3 (с, 3Н), 2,9 (д, 2Н), 4,12 (д, 2Н), 6,04 (с, 2Н), 6,75 (д, 1Н), 6,9 (д, 1Н), 6,98 (д, 1Н), 7,48 (д, 1Н), 7,64 (м, 1Н), 8,62 (с, 1Н), 9,38 (с, 1Н). Масс-спектр: М+Н+ 427 и 429.
Пример 41
4-(6-Хлор-2,3-метилендиоксианилино)-7-(3-пиперидинопропокси)-5-тетрагидропиран-4-илоксихиназолин
Смесь 7-(3-бромпропокси)-4-(6-хлор-2,3-метилендиоксианилино)-5-тетрагидропиран-4-илоксихиназолина (0,536 г), пиперидина (0,12 мл), карбоната калия (0,4 г) и ДМФ (2 мл) перемешивали при температуре окружающей среды в течение 16 часов. Смесь упаривали и растирали остаток в присутствии метиленхлорида. Смесь фильтровали и очищали фильтрат методом колоночной хроматографии на силикагеле, применяя в качестве элюента сначала смесь этилацетата и метиленхлорида (1:1), а затем смесь этилацетата, метиленхлорида и насыщенного метанольного раствора аммиака (10:9:1). Таким образом получали указанное в заголовке соединение (0,53 г). ЯМР-спектр: (CDCl3) 1,4-1,5 (м, 2Н), 1,55-1,7 (м, 4Н), 1,9-2,1 (м, 4Н), 2,2-2,3 (м, 2Н), 2,4 (м, 4Н), 2,5 (м, 2Н), 3,6-3,7 (м, 2Н), 4,0-4,1 (м, 2Н), 4,15 (м, 2Н), 4,8 (м, 1Н), 6,08 (с, 2Н), 6,52 (д, 1Н), 6,75 (д, 1Н), 6,85 (д, 1Н), 7,0 (д, 1Н), 8,55 (с, 1Н), 9,35 (с, 1Н). Масс-спектр: М+Н+ 541 и 543.
Применяемый в качестве исходного вещества 7-(3-бромпропокси)-4-(6-хлор-2,3-метилендиоксианилино)-5-тетрагидропиран-4-илоксихиназолин получали следующим образом.
Ди-трет-бутилазодикарбоксилат (1,66 г) добавляли к перемешиваемой смеси 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-тетрагидропиран-4-илоксихиназолина (1,5 г), 3-бромпропан-1-ола (0,49 мл), трифенилфосфина (1,9 г) и метиленхлорида (20 мл) и перемешивали смесь при температуре окружающей среды в течение 1 часа. Добавляли вторую порцию (1,66 г) ди-трет-бутилазодикарбоксилата и перемешивали смесь при температуре окружающей среды в течение 16 часов. Смесь фильтровали и очищали фильтрат методом колоночной хроматографии на силикагеле, применяя в качестве элюента сначала смесь этилацетата и метиленхлорида (1:1), а затем смесь этилацетата, метиленхлорида и метанола (25:24:1). Полученное таким образом вещество растирали в присутствии диэтилового эфира. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме с получением требуемого исходного вещества (0,536 г).
Пример 42
С применением методики, аналогичной описанной в Примере 41, проводили взаимодействие подходящего галогеналкоксизамещенного хиназолина с подходящим амином с получением соединения, описанного в Таблице VII.
| Таблица VII |
 |
| № иприм. |
(R1)m |
Q1 |
(R2)n |
| [1] |
7-[3-(4-гидроксипиперидин-1-ил)пропокси] |
4-тетрагидропиранил |
6-хлор-2,3-метилендиокси |
ПРИМЕЧАНИЕ
[1] В качестве амина применяли 4-гидроксипиперидин. Для продукта получены следующие данные. ЯМР-спектр: (CDCl3) 1,5-1,7 (м, 2Н), 1,85-2,05 (м, 6Н), 2,05-2,25 (м, 4Н), 2,5 (м, 2Н), 2,8 (м, 2Н), 3,55-3,65 (м, 2Н), 3,6 (м, 1Н), 3,95-4,05 (м, 2Н), 4,12 (м, 2Н), 4,75 (м, 1Н), 6,05 (с, 2Н), 6,5 (с, 1Н), 6,7 (д, 1Н), 6,8 (д, 1Н), 6,95 (д, 1Н), 8,5 (с, 1Н), 9,25 (с, 1Н). Масс-спектр: М+Н+ 557 и 559.
Пример 43
4-(6-Хлор-2,3-метилендиоксианилино)- 7-пиперидин-4-илметокси-5-тетрагидропиран-4-илоксихиназолин
Смесь 7-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-(6-хлор-2,3-метилендиоксианилино)-5-тетрагидропиран-4-илоксихиназолина (0,25 г), трифторуксусной кислоты (1 мл) и метиленхлорида (1 мл) перемешивали при температуре окружающей среды в течение 1,5 часов. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (93:7). Полученное таким образом вещество распределяли между этилацетатом и водным раствором гидроксида натрия. Органический слой сушили над сульфатом магния и упаривали. Таким образом получали указанное в заголовке соединение (0,07 г). ЯМР-спектр: (CDCl3 и D2O) 1,5-1,7 (м, 2Н), 1,9-2,1 (м, 4Н), 2,2-2,3 (м, 2Н), 2,8 (м, 2Н), 3,32 (д, 2Н), 3,65 (м, 2Н), 3,9-4,1 (м, 3Н), 4,8 (м, 1Н), 6,08 (с, 2Н), 6,52 (уш.с, 1Н), 6,72 (д, 1Н), 6,8 (с, 1Н), 6,98 (д, 1Н), 8,5 (с, 1Н). Масс-спектр: М+Н+ 513 и 515.
Пример 44
4-(6-Хлор-2,3-метилендиоксианилино)-7-(N-метилпиперидин-4-илметокси)-5-тетрагидропиран-4-илоксихиназолин
Смесь 7-[N-(трет-бутоксикарбонил)пиперидин-4-илметокси]-4-(6-хлор-2,3-метилендиоксианилино)-5-тетрагидропиран-4-илоксихиназолина (0,25 г), концентрированного водного раствора формальдегида (37%, 0,5 мл) и муравьиной кислоты (5 мл) перемешивали и нагревали до 100°С в течение 2 часов. Смесь охлаждали до температуры окружающей среды и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (24:1). Полученное таким образом вещество распределяли между этилацетатом и водным раствором гидроксида натрия. Органический слой сушили над сульфатом магния и упаривали. Таким образом получали указанное в заголовке соединение (0,1 г). ЯМР-спектр: (CDCl3) 1,4-1,6 (м, 2Н), 1,75-1,9 (м, 3Н), 1,9-2,1 (м, 4Н), 2,2-2,3 (м, 2Н), 2,29 (с, 3Н), 2,9 (д, 2Н), 3,6-3,7 (м, 2Н), 3,95 (д, 2Н), 4,0-4,1 (м, 2Н), 4,75 (м, 1Н), 6,05 (с, 2Н), 6,5 (д, 1Н), 6,72 (д, 1Н), 6,81 (д, 1Н), 6,97 (д, 1Н), 8,5 (с, 1Н), 9,26 (с, 1Н). Масс-спектр: М+Н+ 527 и 529.
Пример 45
4-(6-Хлор-2,3-метилендиоксианилино)-7-[(2R)-2,3-эпоксипропокси]-5-тетрагидропиран-4-илоксихиназолин
Фторид цезия (0,46 г) и (2R)-(-)-глицидилтозилат (0,275 г) поочередно добавляли к раствору 4-(6-хлор-2,3-метилендиоксианилино)-7-фтор-5-тетрагидропиран-4-илоксихиназолина (0,416 г) в ДМФ (5 мл), реакционную смесь перемешивали и нагревали до 60°С в течение 2 часов и до 70°С в течение дополнительных 1,5 часов. Смесь упаривали и распределяли остаток между этилацетатом и насыщенным водным раствором бикарбоната натрия. Органический слой промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (49:1). Таким образом получали указанное в заголовке соединение (0,36 г). ЯМР-спектр: (CDCl3) 1,9-2,1 (м, 2Н), 2,2-2,3 (м, 2Н), 2,8 (м, 1Н), 2,98 (м, 1Н), 3,42 (м, 1Н), 3,6-3,7 (м, 2Н), 3,95-4,1 (м, 3Н), 4,45 (м, 1Н), 4,8 (м, 1Н), 6,02 (с, 2Н), 6,59 (м, 12Н), 6,72 (д, 1Н), 6,81 (д, 1Н), 6,97 (д, 1Н), 8,5 (с, 1Н), 9,27 (с, 1Н). Масс-спектр: M+H+ 472 и 474.
Пример 46
4-(6-Хлор-2,3-метилендиоксианилино)-7-[3-(4-цианометилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин
Смесь 4-(6-хлор-2,3-метилендиоксианилино)-7-(3-пиперазин-1-илпропокси)-5-тетрагидропиран-4-илоксихиназолина (1,3 г), 2-хлорацетонитрила (0,167 мл), иодида натрия (0,036 г), карбоната калия (0,331 г) и ДМФ (15 мл) перемешивали при температуре окружающей среды в течение 5 часов. Смесь упаривали и распределяли остаток между этилацетатом и водой. Органическую фазу промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь этилацетата, метиленхлорида и метанола (10:9:1). Таким образом получали указанное в заголовке соединение (0,69 г). ЯМР-спектр: (CDCl3) 1,85-2,0 (м, 4Н), 2,1 (м, 2Н), 2,4-2,5 (м, 6Н), 2,5-2,6 (м, 4Н), 3,42 (с, 2Н), 3,5-3,6 (м, 2Н), 3,9-4,0 (м, 2Н), 4,0-4,1 (м, 2Н), 4,7 (м, 1Н), 6,0 (с, 2Н), 6,42 (с, 1Н), 6,65 (д, 1Н), 6,78 (д, 1Н), 6,9 (д, 1Н), 8,42 (с, 1Н), 9,2 (с, 1Н). Масс-спектр: M+H+ 581 и 583.
Пример 47
4-(6-Хлорбензофуран-7-иламино)-7-(2-пирролидин-1-илэтокси)-5-циклопентилоксихиназолиндигидрохлорид
Гексаметилдисилазан натрия (1М раствор в ТГФ; 0,55 мл) добавляли к раствору 7-амино-6-хлорбензофурана (0,093 г) в ДМФ (3 мл), охлажденном до 10°С, и перемешивали смесь при 10°С в течение 5 минут. Добавляли раствор 4-хлор-5-циклопентилокси-7-(2-пирролидин-1-илэтокси)хиназолина (0,1 г) в ДМФ (8 мл) и перемешивали смесь при температуре окружающей среды в течение 1 часа. Смесь распределяли между этилацетатом и водой. Органический слой упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (49:1). Полученное таким образом вещество растворяли в диэтиловом эфире и добавляли 6М раствор хлороводорода в изопропаноле (0,1 мл). Смесь перемешивали в течение 5 минут и затем упаривали. Таким образом получали указанное в заголовке соединение в виде дигидрохлорида (0,095 г), часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие характеристические данные. ЯМР-спектр: (CDCl3) 1,55-1,75 (м, 4Н), 1,75-1,95 (м, 4Н), 2,08 (м, 2Н), 2,6-2,75 (м, 4Н), 3,0 (м, 2Н), 4,25 (м, 2Н), 5,05 (м, 1Н), 6,6 (д, 1Н), 6,8 (д, 1Н), 6,85 (д, 1Н), 7,38 (д, 1Н), 7,45 (д, 1Н), 7,6 (д, 1Н), 8,42 (с, 1Н), 9,5 (с, 1Н). Масс-спектр: М+Н+ 493 и 495.
Применяемый в качестве исходного вещества 7-амино-6-хлорбензофуран получали следующим образом.
Гидрид натрия (60% дисперсия в минеральном масле; 4,6 г) добавляли к перемешиваемому раствору 6-хлорантраниловой кислоты (18 г) в ДМФ (100 мл) и перемешивали смесь при температуре окружающей среды в течение 30 минут. Добавляли этилиодид (10 мл) и перемешивали реакционную смесь при температуре окружающей среды в течение 2 суток. Растворитель выпаривали и распределяли остаток между этилацетатом и водой. Органическую фазу поочередно промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь петролейного эфира (т. кипения 60-80°С) и этилацета (4:1). Таким образом получали этил-6-хлорантранилат (15,8 г) в виде масла. ЯМР-спектр: (ДМСОd6) 1,3 (т, 3Н), 4,3 (кв, 2Н), 5,7 (уш.с, 2Н), 6,6 (д, 1Н), 6,7 (д, 1Н), 7,1 (т, 1Н).
Раствор нитрита натрия (4,5 г) в воде (100 мл) добавляли по каплям в течение 5 минут к перемешиваемой суспензии этил-6-хлорантранилата (12,7 г) в смеси концентрированной серной кислоты (27,9 мл), воды (38 мл) и льда (76 г). Реакционную смесь дополнительно перемешивали при 0°С в течение 20 минут и затем нагревали до 120°С в течение 1 часа. Полученную смесь вливали в смесь льда и воды и экстрагировали продукт диэтиловым эфиром. Органическую фазу поочередно промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь петролейного эфира (т. кипения 60-80°С) и метиленхлорида (4:1). Таким образом получали этил-6-хлор-2-гидроксибензоат (9,8 г). ЯМР-спектр: (ДМСОd6) 1,3 (т, 3Н), 4,3 (кв, 2Н), 6,9 (д, 1Н), 6,95 (д, 1Н), 7,25 (д, 1Н), 10,45 (уш.с, 1Н).
Аллилбромид (5,5 мл) добавляли к перемешиваемой смеси этил-6-хлор-2-гидроксибензоата (9,8 г), 1,5,7-триазабицикло[4,4,0]дец-5-ена (10,4 г) и ацетонитрила (250 мл) и перемешивали реакционную смесь при температуре окружающей среды в течение 20 часов. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь петролейного эфира (т. кипения 60-80°С) и диэтилового эфира (17:3). Таким образом получали этил-2-аллилокси-6-хлорбензоат (10,3 г). ЯМР-спектр: (ДМСОd6) 1,3,(т, 3Н), 4,35 (кв, 2Н), 4,65 (д, 2Н), 5,25 (д, 1Н), 5,4 (д, 1Н), 6,0 (м, 1Н), 7,15 (м, 2Н), 7,45 (т, 1Н).
Полученное таким образом вещество нагревали до 230°С в течение 1 часа. Продукт реакции охлаждали до температуры окружающей среды и очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь петролейного эфира (т. кипения 60-80°С) и метиленхлорида (4:1). Таким образом получали этил-3-аллил-6-хлор-2-гидроксибензоат (7,3 г). ЯМР-спектр: (ДМСОd6) 1,3 (т, 3H), 3,3 (м, 2Н), 4,35 (кв, 2Н), 5,05 (м, 2Н), 5,95 (м, 1Н), 6,95 (д, 1Н), 7,15 (д, 1Н), 9,7 (уш.с, 1Н).
Полученное таким образом вещество растворяли в метаноле и охлаждали до -78°С. Озон барбатировали через раствор в течение 30 минут. Добавляли диметилсульфид (5,4 мл) и оставляли реакционную смесь нагреваться до температуры окружающей среды. Смесь упаривали и распределяли остаток между диэтиловым эфиром и водой. Органическую фазу поочередно промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента сначала смесь петролейного эфира (т. кипения 60-80°С) и метиленхлорида (1:1), а затем смесь метиленхлорида и диэтилового эфира (9:1). Таким образом получали 2-(4-хлор-3-этоксикарбонил-2-гидроксифенил)ацетальдегид, который немедленно суспендировали в 85% фосфорной кислоте (18 мл) и нагревали смесь до 100°С в течение 1 часа. Смесь охлаждали до температуры окружающей среды и распределяли между диэтиловым эфиром и водой. Органическую фазу поочередно промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь петролейного эфира (т. кипения 60-80°С) и метиленхлорида (1:1). Таким образом получали этил-6-хлорбензофуран-7-карбоксилат (5,9 г). ЯМР-спектр: (ДМСОd6) 1,35 (т, 3Н), 4,45 (кв, 2Н), 7,10 (д, 1Н), 7,45 (д, 1Н), 7,85 (д, 1Н), 8,15 (д, 1Н).
Смесь полученного таким образом вещества, 35% водного раствора гидроксида калия (12,7 мл) и метанола (20 мл) перемешивали и нагревали с обратным холодильником в течение 1 часа. Метанол выпаривали, остаток разбавляли водой и подкисляли до значения рН=1 путем добавления 6н. водного раствора соляной кислоты. Полученный осадок выделяли, промывали водой и сушили в вакууме над пентоксидом фосфора с получением 6-хлорбензофуран-7-карбоновой кислоты (4,6 г). ЯМР-спектр: (ДМСОd6) 7,05 (д, 1Н), 7,4 (д, 1Н), 7,75 (д, 1Н), 8,1 (д, 1Н).
Смесь части (1 г) полученного таким образом вещества, дифенилфосфорилазида (2,2 мл), триэтиламина (1,4 мл) и трет-бутанола (2,7 мл) перемешивали и нагревали с обратным холодильником в течение 18 часов. Смесь оставляли охлаждаться до температуры окружающей среды, вливали в воду и экстрагировали этилацетатом. Органическую фазу поочередно промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на оксиде алюминия, применяя в качестве элюента смеси растворителей с увеличивающейся полярностью, начиная со смесей петролейного эфира и метиленхлорида и заканчивая смесью метиленхлорида и этилацетата (4:1). Таким образом получали смесь 7-амино-6-хлорбензофурана и трет-бутил-6-хлорбензофуран-7-карбамата. Раствор полученной таким образом смеси в метиленхлориде (15 мл) охлаждали до 0°С и добавляли трифторуксусную кислоту (1,2 мл). Полученную смесь перемешивали в течение 1 часа. Смесь упаривали и распределяли остаток между этилацетатом и насыщенным водным раствором бикарбоната натрия. Органическую фазу сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь петролейного эфира (т. кипения 60-80°С) и метиленхлорида (3:1). Таким образом получали 7-амино-6-хлорбензофуран (0,376 г). ЯМР-спектр: (ДМСОd6) 5,5 (уш.с, 2Н), 6,85 (м, 2Н), 7,1 (д, 1Н), 7,95 (д, 1Н). Масс-спектр: M+H+ 167.
Пример 48
4-(3-Хлорбензофуран-7-иламино)-7-(2-пирролидин-1-илэтокси)-5-циклопентилоксихиназолиндигидрохлорид
С применением методики, аналогичной описанной в Примере 47, проводили взаимодействие 4-хлор-5-циклопентилокси-7-(2-пирролидин-1-илэтокси)хиназолина (0,1 г) с 7-амино-3-хлорбензофураном (0,051 г) с получением указанного в заголовке соединения в виде дигидрохлорида (0,074 г), часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие характеристические данные. ЯМР-спектр: (CDCl3) 1,7-1,8 (м, 2Н), 1,8-2,0 (м, 6Н), 2,1-2,3 (м, 4Н), 2,7 (br s, 4Н), 3,02 (м, 2Н), 4,3 (т, 2Н), 5,08 (м, 1Н), 6,61 (д, 1Н), 6,84 (д, 1Н), 7,3-7,45 (м, 2Н), 7,65 (с, 1Н), 8,64 (с, 1Н), 8,76 (д, 1Н), 10,3 (с, 1Н). Масс-спектр: M+H+ 493 и 495.
Пример 49
4-(2-Хлор-5-метоксианилино)-5-(4-метилпиперазин-1-ил)-7-(2-пирролидин-1-илэтокси)хиназолинтригидрохлорид
С применением методики, аналогичной описанной в Примере 5, проводили взаимодействие 4-хлор-5-(4-метилпиперазин-1-ил)-7-(2-пирролидин-1-илэтокси)хиназолина (0,11 г) с 2-хлор-5-метоксианилингидрохлоридом (0,064 г) в присутствии 6М раствора хлороводорода в изопропаноле (0,05 мл) с получением указанного в заголовке соединения в виде тригидрохлорида (0,092 г), часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие характеристические данные. ЯМР-спектр: (CDCl3) 1,8-1,9 (м, 4Н), 2,32 (с, 3Н), 2,48 (м, 2Н), 2,65 (уш.с, 4Н), 2,82 (д, 2Н), 2,98 (м, 4Н), 3,2 (д, 2Н), 3,82 (с, 3Н), 4,25 (м, 2Н), 6,65 (ш, 1Н), 6,95 (м, 1Н), 7,3 (д, 1Н), 8,02 (д, 1Н), 8,52 (с, 1Н). Масс-спектр: М+Н+ 497 и 499.
Применяемый в качестве исходного вещества 4-хлор-5-(4-метилпиперазин-1-ил)-7-(2-пирролидин-1-илэтокси)хиназолин получали следующим образом.
Смесь 5,7-дифтор-3,4-дигидрохиназолин-4-она (0,091 г), 1-метилпиперазина (0,1 г) и ДМФ (2 мл) перемешивали и нагревали до 100°С в течение 1 часа. Смесь упаривали и очищали остаток методом колоночной хроматографии, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (97:3). Таким образом получали 7-фтор-5-(4-метилпиперазин-1-ил)-3,4-дигидрохиназолин-4-он (0,09 г). ЯМР-спектр: (CDCl3) 2,42 (с, 3Н), 2,72 (уш.с, 4Н), 3,2 (уш.с, 4Н), 6,72 (м, 1Н), 7,0 (м, 1Н), 8,0 (с, 1Н). Масс-спектр: М+Н+ 263.
Гидрид натрия (60% дисперсия в минеральном масле; 0,96 г) добавляли к перемешиваемому раствору 1-(2-гидроксиэтил)пирролидина (1,4 мл) в ДМФ (20 мл) и перемешивали смесь при температуре окружающей среды в течение 10 минут. Добавляли 7-фтор-5-(4-метилпиперазин-1-ил)-3,4-дигидрохиназолин-4-он (0,09 г), смесь перемешивали и нагревали до 100°С в течение 3 часов. Полученную смесь упаривали и к остатку поочередно добавляли уксусную кислоту (1,4 мл) и метиленхлорид. Смесь фильтровали, вливали фильтрат в наполненную силикагелем колонку и элюировали смесью метиленхлорида и насыщенного метанольного раствора аммиака (19:1). Полученное таким образом вещество растирали в присутствии пентана, выделяли, промывали пентаном и сушили в вакууме. Таким образом получали 5-(4-метилпиперазин-1-ил)-7-(2-пирролидин-1-илэтокси)-3,4-дигидрохиназолин-4-он (0,74 г). ЯМР-спектр: (CDCl3) 1,7-1,9 (м, 4Н), 2,4 (с, 3Н), 2,6-2,8 (м, 8Н), 2,92 (т, 2Н), 3,15 (уш.с, 4Н), 4,2 (т, 2Н), 6,6 (д, 1Н), 6,8 (д, 1Н), 7,92 (с, 1Н). Масс-спектр: M+H+ 358.
Смесь части (0,65 г) полученного таким образом вещества, фосфорилхлорида (0,252 мл), диизопропилэтиламина (0,94 мл) и 1,2-дихлорэтана (30 мл) перемешивали и нагревали до 80°С в течение 2 часов. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и насыщенного метанольного раствора аммиака (24:1). Таким образом получали 4-хлор-5-(4-метилпиперазин-1-ил)-7-(2-пирролидин-1-илэтокси)хиназолин (0,23 г). ЯМР-спектр: (CDCl3) 1,9-2,1 (уш.с, 4Н), 2,5 (с, 3H), 2,65 (м, 2Н), 2,85-3,1 (м, 10Н), 3,32 (д, 2Н), 4,4 (уш.с, 2Н), 6,85 (д, 1Н), 7,05 (д, 1Н), 8,8 (с, 1Н). Масс-спектр: M+H+ 376.
Пример 50
4-(6-Хлор-2,3-метилендиоксианилино)-5-(N-метилпиперидин-4-илокси)-7-(2,2,2-трифторэтокси)хиназолин
Смесь 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-(N-метилпиперидин-4-илокси)хиназолина (0,1 г), 2,2,2-трифторэтил-4-толуолсульфоната (0,071 г), карбоната калия (0,08 г) и ДМФ (2 мл) перемешивали и нагревали до 95°С в течение 24 часов. Смесь охлаждали до температуры окружающей среды и распределяли между этилацетатом и водой. Органический раствор промывали водой и насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида, этилацетата и метанола (45:46:4). Таким образом получали указанное в заголовке соединение (0,058 г). ЯМР-спектр: (CDCl3) 1,95-2,1 (м, 2Н), 2,1-2,3 (м, 2Н), 2,32 (с, 3Н), 2,3-2,45 (м, 2Н), 2,75 (м, 2Н), 4,48 (м, 2Н), 4,64 (м, 1Н), 6,05 (с, 2Н), 6,6 (д, 1Н), 6,74 (д, 1Н), 6,78 (д, 1Н), 6,97 (д, 1Н), 8,5 (с, 1Н), 9,28 (с, 1Н). Масс-спектр: М+Н+ 511 и 513.
Применяемый в качестве исходного вещества 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-(N-метилпиперидин-4-илокси)хиназолин получали следующим образом.
Раствор ди-трет-бутилазодикарбоксилата (5,44 г) в метиленхлориде (20 мл) добавляли по каплям к перемешиваемой смеси 7-бензилокси-5-гидрокси-3-пивалоилоксиметил-3,4-дигидрохиназолин-4-она (6 г), 4-гидрокси-N-метилпиперидина (2,17 г), трифенилфосфина (6,17 г) и метиленхлорида (100 мл), охлажденного до 0°С. Полученную смесь перемешивали при температуре окружающей среды в течение 1 часа. Смесь упаривали и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида, этилацетата и насыщенного метанольного раствора аммиака (10:9:1). Полученное таким образом вещество растворяли в насыщенном метанольном растворе аммиака (240 мл) и перемешивали при температуре окружающей среды в течение 16 часов. Смесь упаривали и растирали остаток в присутствии диэтилового эфира. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали 7-бензилокси-5-(N-метилпиперидин-4-илокси)-3,4-дигидрохиназолин-4-он (3,68 г). ЯМР-спектр: (CDCl3) 2,0 (м, 4Н), 2,3 (с, 3Н), 2,35 (м, 2Н), 2,75 (м, 2Н), 4,5 (м, 1Н), 5,15 (с, 2Н), 6,6 (д, 1Н), 6,82 (д, 1Н), 7,3-7,5 (м, 5Н), 7,92 (с, 1Н). Масс-спектр: М+Н+ 366.
Смесь полученного таким образом вещества, трифенилфосфина (8,65 г), тетрахлорида углерода (10 мл) и 1,2-дихлорэтана (100 мл) перемешивали и нагревали до 70°С в течение 2 часов. Смесь упаривали, растворяли полученный таким образом 7-бензилокси-4-хлор-5-(N-метилпиперидин-4-илокси)хиназолин в изопропаноле (2 мл) и поочередно добавляли 6-хлор-2,3-метилендиоксианилин (1,9 г) и 5М раствор HCl в изопропаноле (2,1 мл). Полученную смесь перемешивали при 50°С в течение 20 минут и при 80°С в течение 30 минут. Смесь упаривали, остаток суспендировали в этилацетате и перемешивали в течение 1 часа при комнатной температуре. Полученное твердое вещество выделяли, промывали этилацетатом и диэтиловым эфиром. Твердое вещество растворяли в смеси метиленхлорида и насыщенного метанольного раствора аммиака (19:1) и перемешивали при температуре окружающей среды в течение 15 минут. Смесь фильтровали, упаривали фильтрат и очищали остаток методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь этилацетата, метиленхлорида и метанола (50:47:3). Таким образом получали 7-бензилокси-4-(6-хлор-2,3-метилендиоксианилин)-5-(N-метилпиперидин-4-илокси)хиназолин (4,2 г). ЯМР-спектр: (CDCl3) 2,0-2,1 (м, 2Н), 2,2 (м, 2Н), 2,3 (с, 3Н), 2,25-2,35 (м, 2Н), 2,75 (м, 2Н), 4,6 (м, 1Н), 5,2 (с, 2Н), 6,1 (с, 2Н), 6,6 (с, 1Н), 6,75 (д, 1Н), 6,95 (с, 1Н), 7,0 (д, 1Н), 7,32-7,52 (м, 5Н), 8,52 (с, 1Н), 9,3 (с, 1Н). Масс-спектр: M+H+ 519 и 521.
Смесь части (1,5 г) полученного таким образом вещества и трифторуксусной кислоты (15 мл) перемешивали и нагревали с обратным холодильником в течение 6 часов. Смесь упаривали, растворяли остаток в воде и подщелачивали до значения рН=9 путем добавления твердого бикарбоната натрия. Смесь экстрагировали этилацетатом и промывали органический слой насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь этилацетата, метиленхлорида и метанола (10:9:2). Таким образом получали 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-(N-метилпиперидин-4-илокси)хиназолин (0,8 г). ЯМР-спектр: (CDCl3) 1,9-2,05 (м, 2Н), 2,05-2,15 (м, 2Н), 2,2-2,3 (м, 2Н), 2,28 (с, 3Н), 2,7 (м, 2Н), 4,5 (уш.с, 1Н), 6,05 (с, 2Н), 6,5 (д, 1Н), 6,7 (д, 1Н), 6,85 (д, 1Н), 6,95 (д, 1Н), 8,4 (с, 1Н), 9,35 (с, 1Н). Масс-спектр: М+Н+ 429 и 431.
Пример 51
4-(6-Хлор-2,3-метилендиоксианилино)-7-этокси-5-(N-метилпиперидин-4-илокси)хиназолин
Раствор ди-трет-бутилазодикарбоксилата (0,26 г) в метиленхлориде (1 мл) добавляли по каплям к перемешиваемой смеси 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-(N-метилпиперидин-4-илокси)хиназолина (0,12 г), этанола (0,019 г), трифенилфосфина (0,15 г) и метиленхлорида (2 мл) и перемешивали полученную смесь при температуре окружающей среды в течение 1 часа. Добавляли 2М раствор хлороводорода в диэтиловом эфире (3 мл) и перемешивали смесь при температуре окружающей среды в течение 1,5 часов. Добавляли диэтиловый эфир (1 мл), осадок выделяли и сушили в вакууме. Полученное таким образом твердое вещество растворяли в смеси метиленхлорида и насыщенного метанольного раствора аммиака (9:1). Смесь фильтровали и упаривали фильтрат. Остаток растирали в присутствии пентана, полученное твердое вещество выделяли и сушили в вакууме. Таким образом получали указанное в заголовке соединение (0,092 г). ЯМР-спектр: (CDCl3) 1,5 (т, 3Н), 1,95-2,1 (м, 2Н), 2,15-2,5 (м, 2Н), 2,3 (с, 3Н), 2,3-2,4 (м, 2Н), 2,7 (уш.с, 2Н), 4,15 (м, 2Н), 4,6 (м, 1Н), 6,05 (с, 2Н), 6,5 (д, 1Н), 6,7 (д, 1Н), 6,8 (д, 1Н), 6,95 (д, 1Н), 8,5 (с, 1Н), 9,25 (уш.с, 1Н). Масс-спектр: M+H+ 457 и 459.
Пример 52
4-(6-Хлор-2,3-метилендиоксианилино)-7-(2-фторэтокси)-5-(N-метилпиперидин-4-илокси)хиназолин
С применением методики, аналогичной описанной в Примере 51, проводили взаимодействие 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-(N-метилпиперидин-4-илокси)хиназолина с 2-фторэтанолом с получением указанного в заголовке соединения. ЯМР-спектр: (CDCl3) 2,0-2,1 (м, 2Н), 2,15-2,3 (м, 2Н), 2,35 (с, 3H), 2,3-2,4 (м, 2Н), 2,8 (уш.с, 2Н), 4,32 (м, 1Н), 4,4 (м, 1Н), 4,65 (м, 1Н), 4,8 (м, 1Н), 4,9 (м, 1Н), 6,05 (с, 2Н), 6,6 (с, 1Н), 6,75 (д, 1Н), 6,85 (с, 1Н), 7,0 (д, 1Н), 8,55 (с, 1Н), 9,3 (с, 1Н). Масс-спектр: М+Н+ 475 и 477.
Пример 53
4-(6-Хлор-2,3-метилендиоксианилино)-7-изобутокси-5-(N-метилпиперидин-4-илокси)хиназолин
С применением методики, аналогичной описанной в Примере 51, проводили взаимодействие 4-(6-хлор-2,3-метилендиоксианилино)-7-гидрокси-5-(N-метилпиперидин-4-илокси)хиназолина с изобутанолом с получением указанного в заголовке соединения. ЯМР-спектр: (CDCl3) 1,05 (д, 6Н), 1,95-2,05 (м, 2Н), 2,08-2,28 (м, 3Н), 2,3 (с, 3Н), 2,3-2,4 (м, 2Н), 2,7 (уш.с, 2Н), 3,82 (д, 2Н), 4,6 (м, 1Н), 6,03 (с, 2Н), 6,5 (с, 1Н), 6,7 (д, 1Н), 6,8 (с, 1Н), 6,95 (д, 1Н), 8,5 (с, 1Н), 9,25 (с, 1Н). Масс-спектр: М+Н+ 485 и 487.
Пример 54
4-(2,3-Метилендиоксианилино)-5-(4-метилпиперазин-1-ил)-7-(2-пирролидин-1-илэтокси)хиназолинтригидрохлорид
С применением методики, аналогичной описанной в Примере 5, проводили взаимодействие 4-хлор-5-(4-метилпиперазин-1-ил)-7-(2-пирролидин-1-илэтокси)хиназолина (0,11 г) с 2,3-метилендиоксианилином (0,045 г) в присутствии 6М раствора хлороводорода в изопропаноле с получением указанного в заголовке соединения в виде тригидрохлорида (0,105 г), часть которого преобразовывали в свободное основание с применением методики, аналогичной описанной в Примере 3. Для свободного основания получены следующие характеристические данные. ЯМР-спектр: (CDCl3) 1,78 (уш.с, 4Н), 2,3 (с, 3Н), 2,5 (м, 2Н), 2,6 (уш.с, 4Н), 2,8 (д, 2Н), 2,95 (м, 4Н), 3,08 (д, 2Н), 4,18 (м, 2Н), 5,98 (с, 2Н), 6,6 (д, 1Н), 6,86 (м, 1Н), 6,94 (с, 1Н), 8,06 (д, 1Н), 8,5 (с, 1Н), 11,8 (с, 1Н). Масс-спектр: M+H+ 477.
Пример 55
4-(6-Хлор-2,3-метилендиоксианилино)-5-морфолино-7-(2-пирролидин-1-илэтокси)хиназолин
Смесь 4-хлор-5-морфолино-7-(2-пирролидин-1-илэтокси)хиназолина (0,27 г), 6-хлор-2,3-метилендиоксианилина (0,14 г) и изопропанола (4 мл) перемешивали и нагревали до 80°С в течение 1 часа. Смесь упаривали и растворяли остаток в смеси метиленхлорида и насыщенного метанольного раствора аммиака (49:1). Смесь фильтровали, фильтрат наносили на наполненную силикагелем колонку и элюировали смесью метиленхлорида и насыщенного метанольного раствора аммиака (97:3). Полученное таким образом вещество растирали в присутствии диэтилового эфира. Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали указанное в заголовке соединение (0,035 г). ЯМР-спектр: (CDCl3) 1,85 (уш.с, 4Н), 2,65 (уш.с, 4Н), 3,0 (м, 2Н), 3,08 (м, 2Н), 3,18 (д, 2Н), 3,82 (м, 2Н), 4,05 (м, 2Н), 4,25 (м, 2Н), 6,05 (с, 2Н), 6,75 (д, 1Н), 6,95-7,1 (м, 3Н), 8,52 (с, 1Н). Масс-спектр: М+Н+ 498 и 500.
Применяемый в качестве исходного вещества 4-хлор-5-морфолино-7-(2-пирролидин-1-илэтокси)хиназолин получали следующим образом.
Смесь 5,7-дифтор-3,4-дигидрохиназолин-4-она (0,91 г), морфолина (0,9 мл) и ДМФ (20 мл) перемешивали и нагревали до 100°С в течение 1 часа. Смесь упаривали. Добавляли к остатку насыщенный метанольный раствор аммиака (1 мл) и перемешивали смесь при температуре окружающей среды в течение 5 минут. Смесь упаривали и растирали остаток в присутствии воды. Полученное твердое вещество выделяли, промывали водой и диэтиловым эфиром и сушили в вакууме. Таким образом получали 7-фтор-5-морфолино-3,4-дигидрохиназолин-4-он (0,85 г). ЯМР-спектр: (ДМСОd6) 3,05 (уш.с, 4Н), 3,8 (т, 4Н), 6,8 (м, 1Н), 6,92 (м, 1Н), 8,02 (с, 1Н). Масс-спектр: М+Н+ 250.
Гидрид натрия (60% дисперсия в минеральном масле, 0,5 г) добавляли к перемешиваемому раствору 1-(2-гидроксиэтил)пирролидина (0,7 мл) в ДМФ (15 мл), охлажденном до 5°С. Смесь перемешивали в течение 10 минут. Добавляли 7-фтор-5-морфолино-3,4-дигидрохиназолин-4-он (0,75 г) и нагревали смесь до 80°С в течение 1 часа, а затем до 90°С в течение 3 часов. Смесь упаривали, растворяли остаток в уксусной кислоте (0,9 мл) и разбавляли смесью метиленхлорида и метанола. Полученный раствор наносили на наполненную силикагелем колонку и элюировали смесью метиленхлорида и метанола (47:3). Полученное таким образом вещество растирали в присутствии диэтилового эфира, полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали 5-морфолино-7-(2-пирролидин-1-илэтокси-)-3,4-дигидрохиназолин-4-он (0,5 г). ЯМР-спектр: (ДМСОd6) 1,7 (уш.с, 4Н), 2,8 (м, 2Н), 3,02 (уш.с, 4Н), 3,8 (м, 4Н), 4,2 (м, 2Н), 6,45 (д, 1Н), 6,7 (д, 1Н), 7,92 (с, 1Н), 11,7 (уш.с, 1Н). Масс-спектр: M+H+ 345.
Смесь части (0,26 г) полученного таким образом вещества, фосфорилхлорида (0,084 мл), диизопропилэтиламина (0,34 мл) и 1,2-дихлорэтана (5 мл) перемешивали и нагревали до 80°С в течение 3 часов. Смесь упаривали с получением 4-хлор-5-морфолино-7-(2-пирролидин-1-илэтокси)хиназолина, который использовали без дополнительной очистки.
Пример 56
4-(6-Хлор-2,3-метилендиоксианилино)-5-феноксихиназолинмоногидрохлорид
Смесь 4-(6-хлор-2,3-метилендиоксианилино)-5-фторхиназолина (0,213 г), фенола (0,45 г), карбоната калия (0,828 г) и ДМФ (3 мл) перемешивали и нагревали до 90°С в течение 30 часов. Смесь упаривали и распределяли остаток между этилацетатом и 2н водным раствором гидроксида натрия. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом магния и упаривали. Остаток очищали методом колоночной хроматографии на силикагеле, применяя в качестве элюента смесь метиленхлорида и метанола (99:1). Полученное таким образом вещество растворяли в диэтиловом эфире и добавляли 6М раствор хлороводорода в диэтиловом эфире (1 эквивалент). Полученное твердое вещество выделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким образом получали указанное в заголовке соединение (0,05 г). ЯМР-спектр: (ДМСОd6 и CF3COOD) 6,18 (с, 2Н), 6,95 (д, 1Н), 7,05 (д, 1Н), 7,1 (д, 1Н), 7,35 (д, 1Н), 7,42 (м, 1Н), 7,52-7,62 (м, 3Н), 8,0 (м, 1Н), 9,0 (с, 1Н).
Масс-спектр: М+Н+ 392 и 394.
Пример 57
Фармацевтические композиции
Нижеследующее отображает образцы определенных здесь дозированных форм по настоящему изобретению (активный ингредиент обозначен как «соединение X») для терапевтического и профилактического применения людьми:
| (а) Таблетированная форма I |
мг/таблетка |
| соединение Х |
100 |
| лактоза Ph.Eur. |
182,75 |
| кросскармелоза натрия |
12,0 |
| паста из кукурузного крахмала |
2,25 |
| (5% мас/об) |
|
| стеарат магния |
3,0 |
| (b) Таблетированная форма II |
мг/таблетка |
| соединение Х |
50 |
| лактоза Ph.Eur. |
223,75 |
| кросскармелоза натрия; |
6,0 |
| кукурузный крахмал |
15,0 |
| поливинилпирролидон (5% мас/об, паста) |
2,25 |
| стеарат магния |
3,0 |
| (с) Таблетированная форма III |
мг/таблетка |
| соединение Х |
1,0 |
| лактоза Ph.Eur. |
93,25 |
| кросскармелоза натрия |
4,0 |
| кукурузный крахмал (5% мас/об, |
0,75 |
| паста) |
|
| стеарат магния |
1,0 |
| (d) Капсулированная форма |
мг/капсула |
| соединение Х |
10 |
| лактоза Ph.Eur. |
488,5 |
| магнезия |
1,5 |
| (е) Форма для инъекций I |
(50 мг/мл) |
| соединение Х |
5,0% мас/об |
| 1М раствор гидроксида натрия |
15,0% об/об |
| 0,1 М соляная кислота (для |
|
| доведения значения рН до 7,6) |
|
| полиэтиленгликоль 400 |
4,5% мас/об |
| доведение водой для инъекций до 100% |
|
| (f) Форма для инъекций II |
(10 мг/мл) |
| соединение Х |
1,0% мас/об |
| фосфат натрия ВР |
3,6% мас/об |
| 0,1 М раствор гидрохлорида натрия |
15,0% об/об |
| доведение водой для инъекций до 100% |
|
| (д) Форма для инъекций III |
(1 мг/мл, забуференный до значения рН=6) |
| соединение Х |
0,1% мас/об |
| фосфат натрия ВР |
2,26% мас/об |
| лимонная кислота |
0,38% мас/об |
| полиэтиленгликоль 400 |
3,5% мас/об |
| доведение водой для инъекций до100% |
|
| (h) Форма в виде аэрозоля I |
мг/мл |
| соединение Х |
10,0 |
| триолеат сорбитана |
13,5 |
| трихлорфторметан |
910,0 |
| дихлордифторметан |
490,0 |
| (i) Форма в виде аэрозоля II |
мг/мл |
| соединение Х |
0,2 |
| триолеат сорбитана |
0,27 |
| трихлорфторметан |
70,0 |
| дихлордифторметан |
280,0 |
| дихлортетрафторэтан |
1094,0 |
| (j) Форма в виде аэрозоля III |
мг/мл |
| соединение Х |
2,5 |
| триолеат сорбитана |
3,38 |
| трихлорфторметан |
67,5 |
| дихлордифторметан |
1086,0 |
| дихлортетрафторэтан |
191,6 |
| (k) Форма в виде аэрозоля IV |
мг/мл |
| соединение Х |
2,5 |
| соевый лецитин |
2,7 |
| трихлорфторметан |
67,5 |
| дихлордифторметан |
1086,0 |
| дихлортетрафторэтан |
191,6 |
| (1) Мазевая форма |
мл |
| соединение X |
40 мг |
| этанол |
300 мкл |
| вода |
300 мкл |
| 1-додецилазациклогептан-2-он |
50 мкл |
| пропиленгликоль |
до 1 мл |
ПРИМЕЧАНИЕ
Приведенные выше композиции могут быть приготовлены с применением традиционных методик, хорошо известных в области фармацевтики. Таблетированные формы (а)-(с) могут быть покрыты энтеросолюбильным покрытием, например ацетатфталатом целлюлозы, в соответствие с традиционными методиками. Формы в виде аэрозолей (h)-(k) могут применяться вместе со стандартным аэрозольным диспенсером, расчитанным на определенную дозу, а суспендирующие агенты – триолеат сорбитана и лицетин сои – могут быть заменены любым альтернативным суспендирующим агентом, таким как моноолеат сорбитана, сесквиолеат сорбитана, полисорбат 80, полиглицерололеат или олеиновая кислота.
Формула изобретения
1. Хиназолиновое производное формулы I
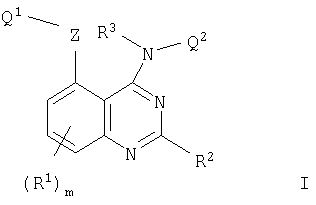
где m равно 0 или 1;
каждая группа R1, которая может быть одинаковой или различной, представляет собой галоген, гидрокси и (1-6С)алкокси или группу из формулы
Q3-X1,
где X1 представляет О, и Q3 представляет собой фенил-(1-6С)алкил, гетероарил(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, и где гетероарильная группа представляют собой ароматические 5- или 6-членные моноциклические кольца с одним или двумя гетероатомами азота и любая гетероциклильная группа определенная как группа R1 представляет собой неароматическое насыщенное или частично насыщенное 3-6-членное моноциклическое кольцо с одним или двумя гетероатомами, выбранными из кислорода и азота,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем внедрения в цепь О,
и где любая из групп CH2 или СН3 в заместителе R1 необязательно содержит в каждой из указанных групп CH2 или СН3 один или несколько галогеновых заместителей или заместитель, выбранный из гидрокси, (1-6С)алкокси, (1-6С)алкилсульфонила или пиридилокси,
и где любая гетероарильная или гетероциклильная группа в заместителе R1 необязательно содержит 1, 2 или 3 заместителя, которые могут быть одинаковыми или различными, выбранными из гидрокси, карбамоила, (1-6С)алкила, (1-6С)алкоксикарбонила, N-(1-6С)алкилкарбамоила, N,N-ди-[(1-6С)алкил]карбамоила, (1-6С)алкокси-(1-6С)алкила и циано-(1-6С)алкила или из группы формулы
-X5-Q6,
где X5 представляет собой прямую связь или СО и Q6 представляет собой гетероциклил или гетероциклил-(1-6С)алкил, который необязательно содержит (1-6С)алкил в качестве заместителя, где гетероциклильная группа представляет собой неароматическое, полностью или частично насыщенное 5- или 6-членное моноциклическое кольцо с одним или двумя гетероатомами, выбранными из азота и кислорода;
R2 представляет собой водород;
R3 представляет собой водород;
Z прямая связь или кислород;
Q1 представляет собой фенил, (3-7С)циклоалкил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, где гетероарильная группа представляет собой 5- или 6-членное ароматическое моноциклическое кольцо с одним, двумя или тремя гетероатомами азота и любая гетероциклильная группа представляет собой неароматическое насыщенное полностью или частично 5- или 6-членное моноциклическое кольцо с одним или двумя гетероатомами выбранными из кислорода, азота или серы или когда Z представляет собой О, Q1 может быть (1-6С)алкилом или (1-6С)алкокси-(1-6С)алкилом и где любая из гетероциклильных групп в группе Q1-Z-необязательно заместители, выбранные из (1-6С)алкила, (1-6С)алкоксикарбонила и пиридилметила,
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителей;
Q2 представляет собой арильную группу формулы Ia
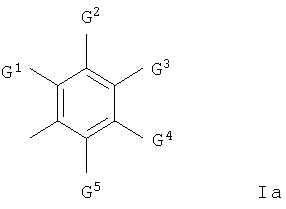
где G1 представляет собой галоген, трифторметил, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, (1-6С)алкокси, (1-6С)алкилтио, (2-6С)алканоил, пирролил, пирролидинил, пиперидинил и морфолинометил и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, галоген, циано, (1-6С)алкил, (2-8С)алкенил, (2-8С)алкинил, и (1-6С)алкокси,
или G1 и G2 вместе образуют группу формул -СН=СН-СН=СН-, -СН=СН-O- или -O-СН=СН-, каждая из которых необязательно имеет в качестве заместителя галоген,
или G1 и G2 вместе образуют группу формул -O-СН2-O- или -O-СН2-СН2-O- или -O-СН2-СН2-O-и каждый из G3 и G4 представляет собой водород, и G5 выбирают из водорода и галогена;
или его фармацевтически приемлемая соль.
2. Хиназолиновое производное формулы I по п.1 или его фармацевтически приемлемая соль, где каждый из m, R1, R2, R3 и Q2 принимает значения, определенные в п.1, и
Z представляет собой прямую связь или О и
Q1 представляет собой фенил, (3-7С)циклоалкил, гетероарил-(1-6С)алкил, гетероциклил или гетероциклил-(1-6С)алкил, где гетероарильная группа представляет собой 5- или -6 членное ароматическое моноциклическое кольцо с одним, двумя или тремя гетероатомами азота и любая гетероциклильная группа представляет собой неароматическое насыщенное полностью или частично 5- или 6-членное моноциклическое кольцо с одним или двумя гетероатомами выбранными из кислорода, азота или серы
и где любая гетероциклильная группа в группе Q1-Z необязательно содержит заместители, выбранные из (1-6С)алкила, (1-6С)алкоксикарбонила и пиридилметила
и где любая гетероциклильная группа в группе Q1-Z необязательно содержит 1 или 2 оксозаместителя.
3. Хиназолиновое производное формулы I по п.1 или его фармацевтически приемлемая соль, где каждый из m, R1, R2, R3 и Q2 принимает любое из значений, определенных в п.1, и
Z представляет собой О, и
Q1 представляет собой (3-7С)циклоалкил, гетероциклил или гетероциклил-(1-6С)алкил, где гетероарильная группа представляет собой 5- или -6 членное ароматическое моноциклическое кольцо с одним, двумя или тремя гетероатомами азота и любая гетероциклильная группа представляет собой неароматическое насыщенное полнстью или частично 5- или 6-членное моноциклическое кольцо с одним или двумя гетероатомами выбранными из кислорода, азота или серы
и где любая гетероциклильная группа в группе Q1-Z необязательно содержит заместители, представляющие собой (1-6С)алкил, (1-6С)алкокси, (1-6С)алкоксикарбонил и пиридилметил,
и где любая гетероциклильная группа в группе Q1-Z необязательно содержит 1 или 2 оксозаместителя.
4. Хиназолиновое производное формулы I по п.1 или его фармацевтически приемлемая соль, где каждый из m, R1, R2, R3, Z и Q1 принимает любое из значений, определенных в п.1, и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой галоген или трифторметил,
каждый из G2 и G5 представляют собой водород,
G3 выбирают из водорода, галогена, циано, (1-6С)алкила, (2-8С)алкенила, (2-8С)алкинила или (1-6С)алкокси,
и G4 представляет собой галоген или (1-6С)алкокси.
5. Хиназолиновое производное формулы I по п.1 или его фармацевтически приемлемая соль, где каждый из m, R1, R2, R3, Z и Q1 принимает любое из значений, определенных в п.1, и
Q2 представляет собой арильную группу формулы Ia, где G1 и G2 вместе образуют группу формулы -О-СН2-О-,
каждый из G3 и G4, представляет собой водород, а G5 представляет собой галоген.
6. Хиназолиновое производное формулы I по п.1, где
m представляет собой 0, или m представляет собой 1, и группа R1 расположена в 6- или 7-положении и представляет собой гидрокси, метокси, этокси, пропокси, бензилокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-пиперазин-1-илэтокси и 3-пиперазин-1-илпропокси,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в R1 заместителе необязательно разделены путем встраивания в цепь О,
и где любая из групп СН2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, метокси, метилсульфонила, и где любая гетероциклильная группа, определенная как R1 необязательно имеет 1 или 2 различных или одинаковых заместителя, выбранными из гидрокси, метила и этила,
группа Q1-Z представляет собой пропокси, изопропокси, 2-метоксиэтокси, 3-метоксипропокси, циклопентилокси, циклогексилокси, фенокси, тетрагидрофуран-3-илокси, тетрагидропиран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-пиперазин-1-илэтокси или 3-пиперазин-1-илпропокси
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит заместители, представляющие собой, метил и этил.
и где любая гетероциклильная группа в группе Q1-Z- необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород; и
Q2 представляет собой арильную группу формулы Ia,

где G1 представляет собой фтор, хлор, бром, йод, трифторметил, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, циано, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси,
или G1 и G2 вместе образуют группу формул: -СН=СН-СН=СН- или -O-СН=СН- каждая из которых необязательно имеет галоген в качестве заместителя или G1 и G2 вместе образуют группу формулы: -O-CH2-O-, и каждый G3 и G4 представляют собой водород и G5 выбирают из группы водорода, фтора, хлора и брома или его фармацевтически приемлемая кислотно-аддитивная соль.
7. Хиназолиновое производное формулы I по п.1, где:
m представляет собой 0, или m представляет собой 1, и группа R1 расположена в 6- или 7-положении и представляет собой гидрокси, метокси, этокси, пропокси, бензилокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, 2-пиперазин-1-илэтокси и 3-пиперазин-1-илпропокси,
и где соседние атомы углерода в любой (2-6С)алкиленовой цепи в заместителе R1 необязательно разделены путем встраивания в цепь О
и где любая из групп CH2 или СН3 в заместителе R1 необязательно содержит в каждой указанной группе СН2 или СН3 заместитель, выбранный из гидрокси, метокси и метилсульфонила.
и где любая гетероциклильная группа в заместителе R1 необязательно содержит 1 или 2 заместителя, которые могут быть одинаковыми или различными, выбранными из гидрокси, метила и этила;
группа Q1-Z представляет собой фенокси, бензилокси, тетрагидрофуран-3-илокси, тетрагидропиран-3-илокси, тетрагидропиран-4-илокси, 2-имидазол-1-илэтокси, 2-(1,2,4-триазол-1-ил)этокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, пиперидин-3-илокси, пиперидин-4-илокси, пиперидин-3-илметокси, 2-пиперидин-3-илэтокси, пиперидин-4-илметокси, 2-пиперидин-4-илэтокси, и 3-гомопиперазин-1-илпропокси,
и где любая гетероциклильная группа в составе, представленная как Q1-Z, необязательно содержит заместитель, выбранный из метила и этила,
и где каждая гетероциклильная группа в группе Q1-Z необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород; и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром, йод, трифторметил, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и каждый из G2, G3, G4 и G5, которые могут быть одинаковыми или различными, представляет собой водород, фтор, хлор, бром, циано, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси,
или G1 и G2 вместе образуют группу формулы -СН=СН-СН=СН- или -O-СН=СН-, каждый из которых необязательно имеет атом галогена в качестве заместителя, или G1 и G2 вместе образуют группу формулы -О-СН2-О- и каждый из G3 и G4 представляет собой водород и G5 представляет собой водород, фтор, хлор и бром
или его фармацевтически приемлемая кислотно-аддитивная соль.
8. Хиназолиновое производное формулы I по п.1, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой гидрокси, метокси, этокси, пропокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 2-[(2S)-2-(N-метилкарбамоил)пирролидин-1-ил]этокси, 2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси, 2-гидроксиэтокси, 3-гидроксипропокси, 2-метоксиэтокси, 3-метоксипропокси, 2-метилсульфонилэтокси, 3-метилсульфонилпропокси, 2-(2-метоксиэтокси)этокси, 2-(4-пиридилокси)этокси, 2-пиридилметокси, 3-пиридилметокси или 4-пиридилметокси;
и где любая группа СН2 в заместителе R1, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
группа Q1-Z представляет собой тетрагидрофуран-3-илокси, тетрагидропиран-4-илокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, пирролидин-3-илокси, N-метилпирролидин-3-илокси, пирролидин-2-илметокси, 2-пирролидин-2-илэтокси, 3-пирролидин-2-илпропокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)этокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 3-пиперидинилокси, N-метилпиперидин-3-илокси, 4-пиперидинилокси, N-метилпиперидин-4-илокси, пиперидин-3-илметокси, N-метилпиперидин-3-илметокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, циклобутилокси, циклопентилокси и циклогексилокси,
и где каждая гетероциклильная группа в группе Q1-Z необязательно содержит 1 или 2 оксозаместителя;
каждый из R2 и R3 представляет собой водород; и
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой фтор, хлор, бром, йод, трифторметил, метил, этил, винил, изопропенил, этинил, метокси или пирролидин-1-ил, G2 представляет собой водород, каждый из G3 и G4, которые могут быть одинаковыми или различными, представляют собой водород, фтор, хлор, бром, циано, метил, этил, винил, аллил, изопропенил, этинил, метокси или этокси, и G5 представляет собой водород или метокси,
или G1 и G2 вместе образуют группу формул: -СН=СН-СН=СН- или -O-СН=СН-, каждый из которых необязательно имеет галоген в качестве заместителя или G1 и G2 вместе образуют группу формулы -O-СН2-O- и каждый из G3 и G4 представляет собой водород и G5 представляет собой водород, фтор, хлор и бром.
или его фармацевтически приемлемая кислотно-аддитивная соль.
9. Хиназолиновое производное формулы I по п.1, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой метокси, этокси, пропокси, изопропокси, изобутокси, 2-фторэтокси, 2,2,2-трифторэтокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 2-пиперидин-4-илэтокси, 2-(N-метилпиперидин-4-ил)этокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 3-(4-цианометилпиперазин-1-ил)пропокси, 2-[(2S)-2-карбамоилпирролидин-1-ил]этокси, 2-[(2S)-2-(N-метилкарбамоил)-пирролидин-1-ил]этокси, 2-[(2S)-2-(N,N-диметилкарбамоил)-пирролидин-1-ил]этокси, 3-метилсульфонилпропокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-пиридилокси)этокси, 2-пиридилметокси, 3-пиридилметокси и 4-пиридилметокси,
и где любая группа СН2 в заместителе R1, которая соединена с двумя атомами углерода, необязательно содержит гидроксигруппу на указанной группе СН2;
группа Q1-Z представляет собой тетрагидропиран-4-илокси, 3-пирролидин-1-илпропокси, N-метилпирролидин-3-илокси, 3-морфолинопропокси, 3-(1,1-диоксотетрагидро-4Н-1,4-тиазин-4-ил)пропокси, 2-пиперидиноэтокси, 4-пиперидинилокси, N-метилпиперидин-4-илокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 3-(4-метилпиперазин-1-ил)пропокси, циклопентилокси и циклогексилокси;
каждый из R2 и R3 представляет собой водород;
Q2 представляет собой арильную группу формулы Ia

где G1 представляет собой хлор, бром, трифторметил, метил, метокси или пирролидин-1-ил,
G2 представляет собой водород, G3 представляет собой водород и хлор, G4 представляет собой метокси, G5 представляет собой водород,
или G1 и G2 вместе образуют группу формул: -O-СН=СН-, -O-СН=С(Cl)-или -O-СН2-O-, каждый из G3 и G4 представляет собой водород, G5 представляет собой водород или хлор;
или его фармацевтически приемлемая кислотно-аддитивная соль.
10. Хиназолиновое производное формулы I по п.1, где
m представляет собой 1, и группа R1 расположена в 7-положении и представляет собой метокси, этокси, пропокси, изопропокси, изобутокси, 2-фторэтокси, 2,2,2-трифторэтокси, бензилокси, 2-пирролидин-1-илэтокси, 3-пирролидин-1-илпропокси, 2-пиперидиноэтокси, 3-пиперидинопропокси, 3-(4-гидроксипиперидин-1-ил)пропокси, 2-пиперидин-4-илэтокси, 2-(N-метилпиперидин-4-ил)этокси, 2-морфолиноэтокси, 3-морфолинопропокси, 2-пиперазин-1-илэтокси, 3-пиперазин-1-илпропокси, 2-(4-метилпиперазин-1-ил)этокси, 3-(4-метилпиперазин-1-ил)пропокси, 3-(4-цианометилпиперазин-1-ил)пропокси, 2-[(2S)-2-карбамоилпирролидин-1-ил]этокси, 2-[(2S)-2-(N-метилкарбамоил)пирролидин-1-ил]этокси, 2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси, 3-метилсульфонилпропокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, 2-(4-пиридилокси)этокси, 2-пиридилметокси, 3-пиридилметокси или 4-пиридилметокси;
группа Q1-Z представляет собой тетрагидропиран-4-илокси, 4-пиперидинилокси, N-метилпиперидин-4-илокси, пиперидин-4-илметокси, N-метилпиперидин-4-илметокси, циклопентилокси и циклогексилокси;
каждый из R2 и R3 представляет собой водород; и
Q2 представляет собой арильную группу формулы Ia

где G1 и G2 вместе образуют группу формулы -O-CH2-O-, каждый из G3 и G4 представляет собой водород, G5 представляет собой хлор;
или его фармацевтически приемлемая кислотно-аддитивная соль.
11. Хиназолиновое производное формулы I по п.1, представляющее собой
4-(2-хлор-5-метоксианилино)-5,7-ди-(3-морфолинопропокси)-хиназолин,
4-(2-бром-5-метоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(2-хлор-5-метоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(2-хлор-5-метоксианилино)-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-(3-морфолинопропокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-[2-гидрокси-3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-(2-гидрокси-3-морфолинопропокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-[3-(4-метилпиперазин-1-ил)-пропокси]-5-тетрагидрофуран-3-илоксихиназолин,
4-(2-хлор-5-метоксианилино)-7-(3-морфолинопропокси)-5-тетрагидрофуран-3-илоксихиназолин,
4-(5-хлорнафт-1-иламино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(3-хлорбензофуран-7-иламино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
7-бензилокси-4-(2-бром-5-метоксианилино)-5-пиперидин-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(3-метилсульфонилпропокси)-5-пиперидин-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-метокси-5-пиперидин-4-илметоксихиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(2,5-диметоксианилино)-7-метокси-5-(N-метилпиперидин-4-илокси)хиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-(2-пиперидиноэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-(2-морфолиноэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2,4-дихлор-5-метоксианилино)-7-[2-(4-метилпиперазин-1-ил)этокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(2-пиперидиноэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-[2-(4-метилпиперазин-1-ил)-этокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(4-пиридилоксиэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-{2-[(2S)-2-(N,N-диметилкарбамоил)пирролидин-1-ил]этокси}-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-{2-[(2S)-2-(N-метилкарбамоил)пирролидин-1-ил]этокси}-5-тетрагидропиран-4-илоксихиназолин,
4-(2-бром-5-метоксианилино)-7-(4-пиридилметокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(5-метокси-2-пирролидин-1-иланилино)-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин или
4-(2-бром-5-метоксианилино)-5-циклопентилокси-7-(2-пирролидин-1-илэтокси)хиназолин;
или его фармацевтически приемлемая кислотно-аддитивная соль.
12. Хиназолиновое производное формулы I по п.1, представляющее собой:
4-(6-хлор-2,3-метилендиоксианилино)-5-циклопентилокси-7-(2-пирролидин-1-илэтокси)хиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-5-пиперидин-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-метокси-5-пиперидин-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-метокси-5-(N-метил-пиперидин-4-илокси)хиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-метокси-5-пиперидин-4-илметоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-(3-пирролидин-1-илпропокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-[3-(4-метилпиперазин-1-ил)пропокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-[2-(4-метилпиперазин-1-ил)этокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-(2-пиперидиноэтокси)-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-[2-(4-пиридилокси)этокси]-5-тетрагидропиран-4-илоксихиназолин,
4-(6-хлор-2,3-метилендиоксианилино)-7-пиперидин-4-илметокси-5-тетрагидропиран-4-илоксихиназолин или
4-(6-хлор-2,3-метилендиоксианилино)-7-(N-метилпиперидин-4-илметокси)-5-тетрагидропиран-4-илоксихиназолин;
или его фармацевтически приемлемая кислотно-аддитивная соль.
13. Фармацевтическая композиция, обладающая противоопухолевой активностью, содержащая хиназолиновое производное формулы I или его фармацевтически приемлемую соль по п.1 вместе с фармацевтически приемлемым разбавителем или носителем.
14. Хиназолиновое производное формулы I или его фармацевтически приемлемые соли по п.1, предназначенные для получения лекарственного препарата для использования в качестве противоопухолевого средства для сдерживания и/или лечения солидных опухолей.
15. Хиназолиновое производное формулы I по п.1, представляющее собой 4-(6-хлор-2,3-метилендиоксианилино)-7-фтор-5-тетрагидропиран-4-илоксихиназолин, или его фармацевтически приемлемая соль
16. Хиназолиновое производное формулы I по п.1, представляющее собой 4-(6-хлор-2,3-метилендиоксианилино)-7-(2-пирролидин-1-илэтокси)-5-тетрагидропиран-4-илоксихиназолин или его фармацевтически приемлемая соль.
17. Хиназолиновое производное формулы I по п.1, представляющее собой 4-(6-хлор-2,3-метилендиоксианилино)-7-(3-пирролидин-1-илпропокси)-5-тетрагидропиран-4-илоксихиназолин или его фармацевтически приемлемая соль.
18. Хиназолиновое производное формулы I по п.1, представляющее собой 4-(6-хлор-2,3-метилендиоксианилино)-7-(3-(4-метилпиперазин-1-илпропокси)-5-тетрагидропиран-4-илоксихиназолин или его фармацевтически приемлемая соль.
19. Хиназолиновое производное формулы I по п.1, представляющее собой 4-(6-хлор-2,3-метилендиоксианилино)-7-[2-(4-метилпиперазин-1-ил)этокси]-5-тетрагидропиран-4-илоксихиназолин или его фармацевтически приемлемая соль.
20. Хиназолиновое производное формулы I по п.1, представляющее собой 4-(6-хлор-2,3-метиленедиоксианилино)-7-(N-метилпиперидин-4-илметокси)-5-тетрагидропиран-4-илоксихиназолин или его фармацевтически приемлемая аддитивно-кислая соль.
|
|