|
|
(21), (22) Заявка: 2003104794/04, 20.07.2001
(24) Дата начала отсчета срока действия патента:
20.07.2001
(30) Конвенционный приоритет:
24.07.2000 EP 00115846.8
(43) Дата публикации заявки: 10.09.2004
(45) Опубликовано: 10.05.2006
(56) Список документов, цитированных в отчете о
поиске:
IKEURA Y. et al. Chemical and pharmaceutical bulletin. Vol.45, №10, 1997, 1642-1652, abstract. NATSUGARI H. et al. Journal of medicinal chemistry. Vol.38, №16, 1995, 3106-3120, abstract. HOSOKI R. et al. European journal of pharmacology. Vol. 341, №2/3, 1998, 235-241, abstract. WO 9947132 A2, 23.09.1999. RU 2236402 C2, 20.09.2004.
(85) Дата перевода заявки PCT на национальную фазу:
24.02.2003
(86) Заявка PCT:
EP 01/08432 (20.07.2001)
(87) Публикация PCT:
WO 02/08232 (31.01.2002)
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, ЕВРОМАРКПАТ, пат.пов. И.А.Веселицкой, рег. № 11
|
(72) Автор(ы):
ХОФФМАНН Торстен (DE),
ШНИДЕР Патрик (CH),
ШТАДЛЕР Хайнц (CH)
(73) Патентообладатель(и):
Ф.ХОФФМАНН-ЛЯ РОШ АГ (CH)
|
(54) ПРОИЗВОДНЫЕ 4-ФЕНИЛПИРИДИНА И ЛЕКАРСТВЕННОЕ СРЕДСТВО
(57) Реферат:
Описываются производные 4-фенилпиридина общих формул,
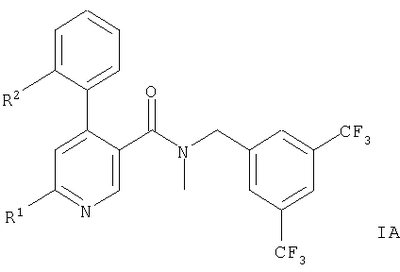 или или 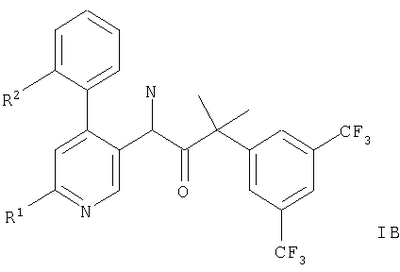
где R1 означает
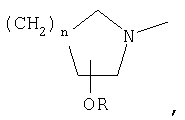 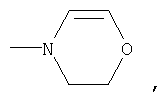 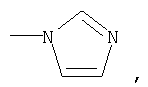 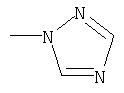 или означает или означает
-NH(CH2)2OH, -NR3C(O)CH3, или -NR3C(O)-циклопропил; R2 означает метил или хлор, R3 означает водород или метил, R означает водород или -(CH2)2OH и n означает 1 или 2, и их фармацевтически приемлемые кислотно-аддитивные соли. Описывается также лекарственное средство, обладающее действием антагониста рецептора NK-1, на основе этих соединений.
Технический результат: соединения характеризуются хорошим средством к рецептору NK-1 и поэтому могут быть использованы для лечения или предупреждения заболеваний, связанных с этим рецептором. 2 н. и 8 з.п. ф-лы, 1 табл.
Представленное изобретение относится к соединениям общих формул,
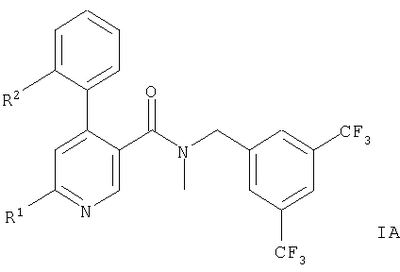 или или 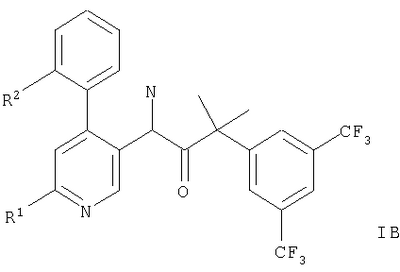
где R1 означает
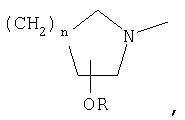 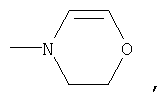 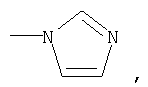 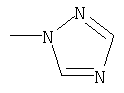 или означает или означает
-NH(CH2)2OH, -NR3C(O)CH3 или -NR3С(O)-циклопропил;
R2 означает метил или хлор;
R3 означает водород или метил;
R означает водород или -(CH2)2OH; и
n означает 1 или 2;
и к их фармацевтически приемлемым кислотно-аддитивным солям.
Соединения, подобные описанным в настоящей заявке, были описаны в европейском патенте ЕР 1035115.
Соединения формул IA и IB и их соли обладают ценными терапевтическими свойствами. Неожиданно было обнаружено, что соединения по настоящему изобретению являются антагонистами рецептора нейрокинина 1 (NK-1, вещество Р). Вещество Р является природным ундекапептидом, относящимся к тахикининовому семейству пептидов, последние так называются из-за их вызывающего быстрое сокращение воздействия на внесосудистую гладкую мышечную ткань. Рецептор вещества Р является членом сверхсемейства связанных с белком G рецепторов.
Нейропептидный рецептор вещества Р (NK-1) широко распространен повсюду в нервной системе млекопитающих (особенно в мозгу и спинномозговых ганглиях), в кровеносной системе и периферических тканях (в частности, в двенадцатиперстной кишке и тощей кишке) и вовлечен в регулирование ряда разнообразных биологических процессов.
Центральное и периферическое действие тахикининового вещества Р млекопитающих связано с многочисленными воспалительными состояниями, включающими мигрень, ревматоидный артрит, астму и воспалительное заболевание кишечника, а также посредничество рвотному рефлексу и модуляцию нарушений центральной нервной системы, как, например, болезнь Паркинсона (Neurosci. Res., 1996, 7, 187-214), тревога (Can. J. Phys., 1997, 75, 612-621) и депрессия (Science, 1998, 281, 1640-1645).
Свидетельства полезности антагонистов тахикининового рецептора при боли, головной боли, особенно мигрени, болезни Альцгеймера, множественном склерозе, ослаблении синдрома отмены морфина, при сердечно-сосудистых изменениях, отеках, как, например, отеки, вызванные термическим ожогом, при хронических воспалительных заболеваниях, как, например, ревматоидный артрит, астма/ повышенная бронхиальная реактивность и другие заболевания дыхательных путей, включающие аллергический ринит, при воспалительных заболеваниях кишок, включающих язвенный колит и болезнь Крона, при повреждениях глаз и воспалительных глазных заболеваниях представлены в обзоре “Тахикининовый рецептор и антагонисты тахикининового рецептора”, J. Auton. Pharmacol., 13, 23-29, 1993.
Кроме того, антагонисты рецептора нейрокинина 1 разработаны для лечения ряда физиологических нарушений, связанных с избытком или дисбалансом тахикинина, в частности вещества Р. Примеры состояний, в которые вовлечено вещество Р, включают нарушения центральной нервной системы, как, например, тревога, депрессия и психоз (международные заявки на патенты WO 95/16679, WO 95/18124 и WO 95/23798).
Антагонисты рецептора нейрокинина 1 также пригодны для лечения укачивания и для лечения индуцированной рвоты.
В дополнение к этому, в журнале The New England Journal of Medicine, том 340, №3, стр. 190-195, 1999, описано ослабление индуцированной цисплатином рвоты с помощью селективного антагониста рецептора нейрокинина 1.
Кроме того, в патенте США №5972938 описывается метод лечения психоиммунологического или психосоматического нарушения при введении антагониста тахикининового рецептора, как, например, антагониста рецептора NK-1.
Пригодность антагонистов рецептора нейрокинина 1 для лечения некоторых форм недержания мочи также описывается в “Neuropeptides, 32(1), 1-49, (1998)” и в “Eur. J. Pharmacol., 383(3), 297-303, (1999)”.
Соединения формул IA и IB могут быть также использованы в виде их пролекарств. Примерами являются сложные эфиры, N-окиси, фосфорные эфиры, сложные эфиры гликоамидов, сложные глицериды и им подобные. Пролекарства могут добавлять к ценности настоящих соединений преимущества в адсорбции, фармакокинетике, в распределении и транспорте к мозгу.
Объектами представленного изобретения являются соединения формул IA и IB и их фармацевтически приемлемые соли, получение вышеупомянутых соединений, лекарственные средства, содержащие их, и их приготовление, а также использование вышеупомянутых соединений для контроля и предупреждения заболеваний, особенно таких заболеваний и нарушений, которые упоминались ранее, или для изготовления соответствующих лекарственных средств.
Наиболее предпочтительными показаниями согласно настоящему изобретению являются те, которые включают нарушения центральной нервной системы, например, лечение или предупреждение некоторых депрессивных нарушений или рвоты при введении антагонистов рецептора NK-1. Обширным приступом депрессии определяется период, как минимум, в две недели, во время которого в большинство дней и почти каждый день наблюдается либо подавленное настроение, либо потеря интереса ко всему или удовольствия от всего, или почти от всякой деятельности.
Предпочтительными примерами являются соединения формулы IA, где R2 означает метил, например, следующие соединения:
N-(3,5-бис(трифторметил)бензил)-Н-метил-4-о-толил-6-[1,2,4]триазол-1-ил-никотинамид,
N-(3,5-бис(трифторметил)бензил)-6-(2-гидроксиэтиламино)-N-метил-4-о-толил-никотинамид,
(3,5-бис(трифторметил)бензил)метиламид 4-гидрокси-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты,
(3,5-бис(трифторметил)бензил)метиламид 4-(2-гидроксиэтокси)-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты или
(R)-N-(3,5-бис(трифторметил)бензил)-6-(3-гидроксипирролидин-1-ил)-N-метил-4-о-толилникотинамид.
Далее предпочтительны соединения формулы IA, где R означает хлор.
Примером такого соединения является:
(3,5-бис(трифторметил)бензил)метиламид 4′-(2-хлорфенил)-4-гидрокси-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты.
Предпочтительными примерами являются соединения формулы IB, где R2 означает метил, например, следующие соединения:
2-(3,5-бис(трифторметил)фенил)-N-[6-(2-гидроксиэтиламино)-4-о-толилпиридин-3-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[6-(2,3-дигидро-[1,4]оксазин-4-ил)-4-о-толил-пиридин-3-ил]-N-метилизобутирамид,
N-(6-ацетиламино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метил-изобутирамид,
N-[6-(ацетилметиламино)-4-о-толилпиридин-3-ил]-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамид,
(5-{[2-(3,5-бис(трифторметил)фенил)-2-метилпропионил]метиламино}-4-о-толил-пиридин-2-ил)амид циклопропанкарбоновой кислоты,
(5-{[2-(3,5-бис(трифторметил)фенил)-2-метилпропионил]метиламино}-4-о-толил-пиридин-2-ил)метиламид циклопропанкарбоновой кислоты или
2-(3,5-бис(трифторметил)фенил)-N-(6-имидазол-1-ил-4-о-толилпиридин-3-ил)-N-метилизобутирамид.
Далее предпочтительны соединения формулы IB, где R означает хлор, например, следующее соединение:
2-(3,5-бис(трифторметил)фенил)-N-[4-(2-хлорфенил)-6-(2-гидроксиэтиламино)-пиридин-3-ил]-N-метилизобутирамид.
Представленные соединения формул IA и IB и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например, способом, описанным ниже, который включает
а) взаимодействие соединения формулы
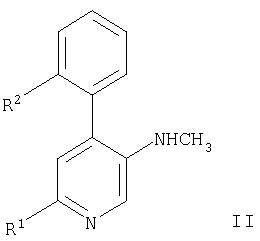
с соединением формулы
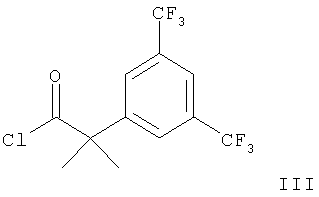
с образованием соединения формулы,

где R1 и R2 имеют приведенные выше значения,
или
б) взаимодействие соединения формулы
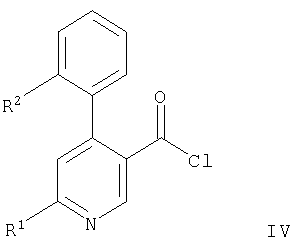
с соединением формулы
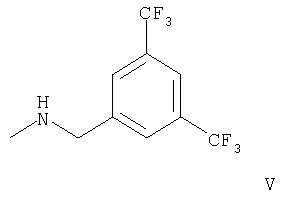
с образованием соединения формулы,

где R1 и R2 имеют приведенные выше значения, или
в) взаимодействие соединения формулы
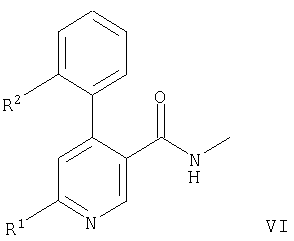
с соединением формулы
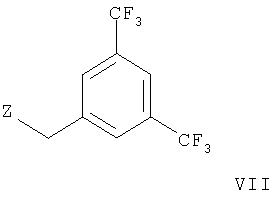
с образованием соединения формулы,

где Z означает хлор, бром, иод, -OS(O)2С6Н4СН3 или -OS(O)2СН3 и другие обозначения заместителей приводятся выше, или
г) взаимодействие соединения формулы
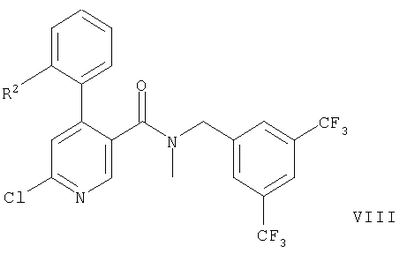 или или 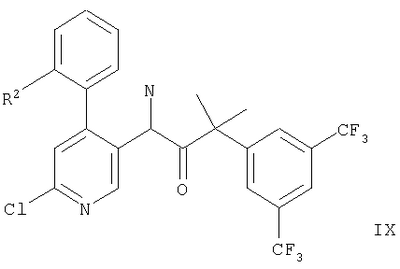
с соединением формулы

с образованием соединения формул,
 или или 
где обозначение заместителей приводится выше,
и,
если желательно, превращение полученного соединения в фармацевтически приемлемую кислотно-аддитивную соль.
В соответствии с вариантом а) способа прибавляют DIPEA (N-этилдиизопропил-амин) к смеси соединения формулы II и соединения формулы III в дихлорметане и смесь перемешивают при температуре 35-40°С. Желаемое соединение формулы IB выделяют после очистки с хорошими выходами.
Вариант б) способа описывает реакцию соединения формулы IV с соединением формулы V, приводящую к соединению формулы IA. Реакцию проводят обычным способом, например, в растворителе, таком, как смесь толуола и триэтиламина. Смесь кипятят с обратным холодильником около 1 часа.
В варианте в) способа описывается реакция соединения формулы VI с соединением формулы VII, приводящую к образованию соединения формулы IA. Эту реакцию осуществляют путем депротонирования соединения формулы VI с помощью KHMDS (гексаметилдисилазид калия) и последующего прибавления соединения формулы VII. Подходящим растворителем является тетрагидрофуран. Реакцию проводят при комнатной температуре.
Дополнительный способ получения соединения формулы IA или IB описывается в варианте г) способа. Соединение формулы VIII или IX обрабатывают соединением формулы XIV, которое является, например, 1,2,4-триазолом, этаноламином, 4-гидроксипиперидином, (R)-3-пирролидинолом или морфолином. Реакцию проводят в тетрагидрофуране обычно при 80-140°С.
Образование солей осуществляется при комнатной температуре согласно способам, которые известны сами по себе и которые знакомы любому специалисту в данной области. Рассматриваются не только соли с неорганическими кислотами, но также соли с органическими кислотами. Гидрохлориды, гидробромиды, сульфаты, нитраты, цитраты, ацетаты, малеаты, соли янтарной кислоты, соли метансульфокислоты, соли п-толуолсульфокислоты и им подобные являются примерами таких солей.
Следующие схемы 1-3 описывают способы получения соединений формул IA и IB более подробно. Исходными веществами являются известные соединения или они могут быть получены согласно известным в данной области способам.
На схемах использованы следующие сокращения:
PivCl – хлорангидрид триметилуксусной кислоты
THF – тетрагидрофуран
TMEDA – N,N,N’,N’-тетраметилэтилендиамин
DIPEA – N-этилдиизопропиламин
KHMDS – гексаметилдисилазид калия
Схема 1
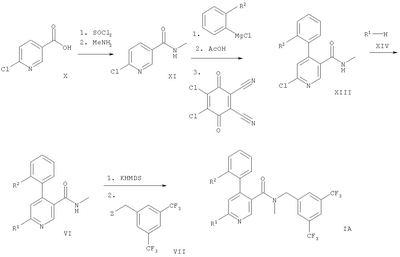
Обозначение заместителей приводится выше.
Схема 2
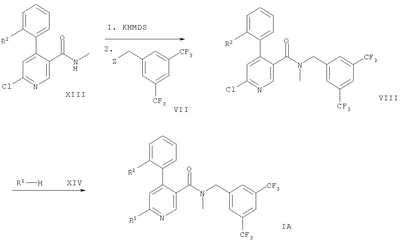
Обозначение заместителей приводится выше.
Схема 3
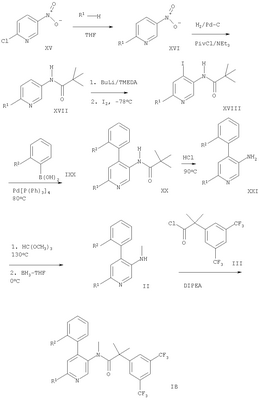
Обозначение заместителей приводится выше.
Как указано ранее, соединения формул IA и IB и их фармацевтически используемые аддитивные соли обладают ценными фармакологическими свойствами. Было найдено, что соединения по настоящему изобретению являются антагонистами рецептора нейрокинина 1 (NK-1, вещество Р). Соединения исследовались согласно приведенным ниже тестам. Сродство исследуемых соединений к рецептору NK-1 оценивали на рецепторах человеческого NK-1 в клетках яичника китайского хомячка, инфицированных рецептором человеческого NK-1 (при использовании системы вирусной экспрессии Semliki) и радиоактивно меченых [3H]веществом Р (конечная концентрация 0,6 нМ). Опыты по связыванию проводили в буфере HEPES (50 мМ, рН 7,4), содержащем бычий сывороточный альбумин (0,04%), лейпептин (8 мкг/мл), MnCl2 (3 мМ) и фосфорамидон (2 мкМ). Опыты по связыванию включали 250 мкл мембранной суспензии (1,25×105 клеток/ в пробирке для опыта), 0,125 мкл буфера из замещающего средства и 125 мкл [Н3]вещества Р. Кривые замещения определяли при, как минимум, семи концентрациях соединения. Пробирки с пробами инкубировали 60 мин при комнатной температуре, по истечении этого времени содержимое пробирок быстро фильтровали в вакууме через фильтры GF/C, предварительно вымоченные в течение 60 минут с применением полиэтиленимина (PEI) (0,3%), с промывками 2×2 мл буфером HEPES (50 мМ, рН 7,4). Удерживаемую на фильтрах радиоактивность измеряли с помощью сцинтилляционного отсчета. Все анализы повторяли трижды в, как минимум, двух отдельных экспериментах.
Сродство к рецептору NK-1, приведенное в таблице в виде pKi, для описанных соединений находится в диапазоне 8,40-9,24.
| Таблица |
| pKi |
R1 |
R2 |
Формула |
Примеры |
| 8.4 |
 |
СН3 |
IA |
1 |
| 8.87 |
-NH(CH2)2OH |
СН3 |
IA |
2 |
| 8.91 |
 |
СН3 |
IA |
3 |
| 9.03 |
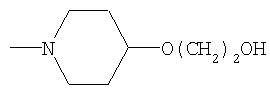 |
СН3 |
IA |
4 |
| 9.24 |
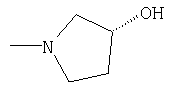 |
СН3 |
IA |
5 |
| 9.18 |
 |
Cl |
IA |
6 |
| 9.16 |
-NH(CH2)2OH |
СН3 |
IB |
7 |
| 9.14 |
-NH(CH2)2OH |
Cl |
IB |
8 |
| 8.83 |
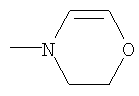 |
СН3 |
IB |
9 |
| 8.6 |
-NHC(O)CH3 |
СН3 |
IB |
10 |
| 8.71 |
-N(СН3)С(O)СН3 |
СН3 |
IB |
11 |
| 8.65 |
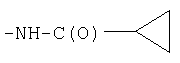 |
СН3 |
IB |
12 |
| 8.87 |
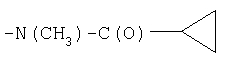 |
СН3 |
IB |
13 |
| 8.65 |
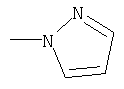 |
СН3 |
IB |
14 |
Соединения формул IA и IB, а также их фармацевтически используемые кислотно-аддитивные соли могут быть применены в качестве лекарственных средств, например, в виде фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например, в виде таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение препарата может быть осуществлено, однако, также через прямую кишку, например, в виде суппозиториев, или парентерально в виде инъекционных растворов.
Соединения формул IA и IB и их фармацевтически используемые кислотно-аддитивные соли могут быть подвергнуты обработке вместе с фармацевтически инертными, неорганическими или органическими наполнителями для получения таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли и т.д. могут быть использованы в качестве таких наполнителей, например, для таблеток, драже и твердых желатиновых капсул.
Подходящими наполнителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.д.
Подходящими наполнителями для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар, глюкоза и т.д.
Подходящими наполнителями для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими наполнителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие средства, эмульгаторы, подсластители, красители, придающие аромат вещества, соли для изменения осмотического давления, буферы, маскирующие средства или антиоксиданты. Они также могут содержать еще и другие терапевтически ценные вещества.
Доза может варьироваться в широких пределах и может, конечно, быть подобрана для удовлетворения характерных требований в каждом отдельном случае. Обычно эффективная доза для перорального или парентерального введения составляет от 0,01 до 20 мг/кг/в день, дозировка 0,1-10 мг/кг/в день является предпочтительной для всех описанных показаний. Дневная доза для взрослого человека, вес которого 70 кг, находится, соответственно, между 0,7-1400 мг в день, предпочтительно между 7 и 700 мг в день.
Следующие примеры иллюстрируют настоящее изобретение, не ограничивая его. Все температуры приведены в градусах по Цельсию.
Пример 1
N-(3,5-Бис(трифторметил)бензил)-N-метил-4-о-толил-6-[1,2,4]триазол-1-ил-никотинамид
а) 6-Хлор-N-метилникотинамид
К 50 г (317 ммолей) 2-хлорникотиновой кислоты прибавляли 230 мл (3,16 моля) хлористого тионила при 0°С. После кипячения смеси с обратным холодильником в течение 2 часов избыток хлористого тионила удаляли при перегонке. Маслянистый остаток коричневого цвета растворяли в 250 мл дихлорметана. Раствор обрабатывали метиламином-газом при 0°С до тех пор, пока больше не наблюдалась экзотермическая реакция. Полученную в результате суспензию разбавляли 1000 мл дихлорметана/воды. Слои разделяли и водный слой экстрагировали тремя порциями дихлорметана по 300 мл каждая. После высушивания органического слоя сульфатом натрия и концентрирования получали 53,2 г (98%) указанного в заглавии соединения в виде твердого вещества светло-желтого цвета.
Масс-спектр (МС) m/е (%): 171 (М+Н+ 15).
б) 6-Хлор-N-метил-4-о-толилникотинамид
К раствору 3,41 г (20,0 ммолей) 6-хлор-N-метилникотинамида в 80 мл тетрагидрофурана прибавляли по каплям при 0°С 50 мл (50 ммолей) 1М раствора о-толилмагнийхлорида в тетрагидрофуране. После завершения прибавления реакционной смеси давали нагреться до комнатной температуры и перемешивали 1,5 часа. Смесь снова охлаждали до 0°С, затем прибавляли по каплям 5,7 мл (100 ммолей) уксусной кислоты и раствор 5,1 г (22 ммоля) 2,3-дихлор-5,6-дициан-1,4-бензохинона в 18 мл тетрагидрофурана. После окончания прибавления реакционной смеси давали нагреться до комнатной температуры и перемешивали 15 минут. Прибавляли 30 мл 2н. водного раствора гидроокиси натрия и затем разбавляли 1 л этилацетата и 200 мл воды. Слои разделяли и органический слой промывали 2 н. водным раствором гидроокиси натрия четырьмя порциями по 250 мл каждая. Объединенные водные слои экстрагировали этилацетатом 3×500 мл. Объединенные органические экстракты промывали насыщенным водным раствором хлористого натрия и сушили сульфатом натрия. После концентрирования получали 5,44 г масла коричнево-красного цвета. Колоночная флэш-хроматография приводила к 2,15 г (41,3%) указанного в заглавии соединения в виде твердого вещества светло-желтого цвета.
МС m/е (%): 260 (М+, 11). Тпл 91-93°С.
в) N-(3,5-Бис(трифторметил)бензил)-6-хлор-N-метил-4-о-толилникотинамид
К раствору 10,0 г (38,4 ммолей) 6-хлор-N-метил-4-о-толилникотинамида в 190 мл тетрагидрофурана прибавляли 46 мл 1М раствора (46 ммолей) гексаметилдисилазида калия в тетрагидрофуране при 0°С. Через 30 минут к полученной в результате суспензии прибавляли по каплям 8,5 мл (46 ммолей) бромистого 3,5-бис-(трифторметил)бензила. После окончания прибавления баню для охлаждения со льдом и водой удаляли и реакционной смеси давали нагреться до комнатной температуры. Через 2 часа к реакционной смеси прибавляли воду. Устанавливали в смеси рН 3 с помощью 1М водного раствора соляной кислоты и перемешивали 10 минут. Подщелачивали с помощью 1М водного раствора гидроокиси натрия до рН 8, затем концентрировали для удаления тетрагидрофурана. Водный остаток экстрагировали четырьмя порциями дихлорметана. Объединенные органические экстракты сушили сульфатом натрия и концентрировали, получали 21,4 г технического продукта. Колоночная хроматография приводила к 18,4 г (98,5%) указанного в заглавии соединения в виде твердого вещества белого цвета.
МС m/е (%): 485 ([М-Н]+, 2).
г) N-(3,5-Бис(трифторметил)бензил)-N-метил-4-о-толил-6-[1,2,4]триазол-1-ил-никотинамид
Смесь 1,00 г (2,05 ммоля) N-(3,5-бис(трифторметил)бензил)-6-хлор-N-метил-4-о-толилникотинамида и 1,42 г (20,5 ммолей) 1,2,4-триазола перемешивали 36 часов при 130°С. После охлаждения до комнатной температуры техническую смесь очищали с помощью флэш-хроматографии, получали 0,93 г (87%) указанного в заглавии соединения в виде твердого вещества белого цвета.
МС m/е (%): 520 (М+Н+, 100).
Пример 2
N-(3,5-Бис(трифторметил)бензил)-6-(2-гидроксиэтиламино)-N-метил-4-о-толил-никотинамид
Смесь 0,837 г (1,72 ммоля) N-(3,5-бис(трифторметил)бензил)-6-хлор-N-метил-4-о-толилникотинамида и 5,0 мл (83 ммоля) этаноламина перемешивали 48 часов при 100°С. После охлаждения до комнатной температуры избыток этаноламина удаляли в вакууме. Остаток растворяли в смеси этилацетата и насыщенного водного раствора бикарбоната натрия. Слои разделяли и водный слой экстрагировали двумя порциями этилацетата. Объединенные органические экстракты промывали насыщенным водным раствором бикарбоната натрия и водой, сушили сульфатом натрия и концентрировали, получали 0,8 г технического продукта. Флэш-хроматография приводила к 0,650 г (73,9%) указанного в заглавии соединения в виде твердого вещества белого цвета.
МС m/е (%): 512 (М+Н+, 100).
Пример 3
(3,5-Бис(трифторметил)бензил)метиламид 4-гидрокси-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
Смесь 10,0 г (20,5 ммолей) N-(3,5-бис(трифторметил)бензил)-6-хлор-]-N-метил-4-о-толилникотинамида, 3,1 г (31 ммоль) 4-гидроксипиперидина, 10,6 мл (62 ммоля) N-этилдиизопропиламина и 0,13 г (1,0 ммоль) 4-(N,N-диметиламино)пиридина перемешивали 70 часов при 140°С. После охлаждения до комнатной температуры остаток растворяли в смеси дихлорметана и воды. Слои разделяли и водный слой экстрагировали четырьмя порциями дихлорметана. Объединенные органические экстракты сушили сульфатом натрия и концентрировали, получали 11,1 г технического продукта. Флэш-хроматография приводила к 9,0 г (80%) указанного в заглавии соединения в виде твердого вещества белого цвета.
МС m/е (%): 552 (М+Н+, 100), tпл 150-152°С.
Пример 4
(3,5-Бис(трифторметил)бензил)метиламид 4-(2-гидроксиэтокси)-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
а) (3,5-Бис(трифторметил)бензил)метиламид 4-[2-(трет-бутилдиметил-силанилокси)этокси]-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
К суспензии 48 мг (1,1 ммоля) гидрида натрия (55% в масле) и 17 мг (0,045 ммоля) йодистого тетрабутиламмония в 4,5 мл безводного тетрагидрофурана прибавляли по каплям при 0°С под аргоном раствор 0,50 г (0,91 ммоля) (3,5-бис(трифторметил)бензил)метиламида 4-гидрокси-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты в 4,5 мл безводного тетрагидрофурана. По окончании прибавления реакционной смеси давали нагреться до комнатной температуры. Через 1 час прибавляли по каплям 0,23 мл (1,1 ммоля) (2-бромэтокси)-трет-бутилдиметилсилана. Реакционную смесь нагревали до 50°С и перемешивали в течение ночи. После охлаждения до комнатной температуры реакцию прекращали путем прибавления 5 мл воды. Устанавливали рН 2 путем прибавления 1М водного раствора соляной кислоты. Через 5 мин смесь подщелачивали с помощью насыщенного водного раствора карбоната натрия и экстрагировали 3 порциями этилацетата. Объединенные органические экстракты промывали водой, сушили сульфатом натрия и концентрировали, получали 0,79 г масла желтого цвета. Флэш-хроматография приводила к 0,13 г (20%) указанного в заглавии соединения в виде твердого вещества белого цвета.
МС m/e (%): 710 (М+Н+, 100).
Выделяли исходное вещество (0,21 г, 42%).
б) (3,5-Бис(трифторметил)бензил)метиламид 4-(2-гидроксиэтокси)-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
К раствору 115 мг (0,162 ммоля) (3,5-бис(трифторметил)бензил)метиламида 4-[2-(трет-бутилдиметилсиланилокси)этокси]-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты в 3 мл безводного тетрагидрофурана прибавляли под аргоном при комнатной температуре 0,17 мл (0,17 ммоля) 1М раствора фтористого тетрабутиламмония в тетрагидрофуране. После перемешивания в течение ночи реакционную смесь разбавляли этилацетатом и промывали водой. Слои разделяли и водный слой экстрагировали двумя порциями этилацетата. Объединенные органические экстракты промывали двумя порциями воды, сушили сульфатом магния и концентрировали, получали 111 мг масла желтого цвета. Флэш-хроматография приводила к 59 мг (61%) указанного в заглавии соединения в виде твердого вещества белого цвета.
МС m/е (%): 596 (М+Н+, 100).
Пример 5
(R)-N-(3,5-Бис(трифторметил)бензил)-6-(3-гидроксипирролидин-1-ил)-N-метил-4-о-толилникотинамид
Указанное в заглавии соединение получали в виде бесцветной аморфной массы со сравнимыми выходами согласно методике, описанной выше для получения (3,5-бис-(трифторметил)бензил)метиламида 4-гидрокси-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты, используя (R)-3-пирролидинол вместо 4-гидроксипиперидина.
МС m/е (%): 538 (М+Н+, 100).
Пример 6
(3,5-Бис(трифторметил)бензил)метиламид 4′-(2-хлорфенил)-4-гидрокси-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
а) Метиламид 4-гидрокси-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
Смесь 8,51 г (49,9 ммолей) 6-хлор-N-метилникотинамида, 5,66 г (54,9 ммоля) 4-гидроксипиперидина, 26,1 мл (150 ммолей) N-этилдиизопропиламина и 0,31 г (2,5 ммоля) 4-(N,N-диметиламино)пиридина кипятили с обратным холодильником в течение ночи. После охлаждения до комнатной температуры техническую смесь переносили в колонку для флэш-хроматографии. После элюирования получали 10,1 г (86,1%) указанного в заглавии соединения в виде твердого вещества желтого цвета.
МС m/е (%): 236 (М+Н+, 100).
б) Метиламид 4-(трет-бутилдиметилсиланилокси)-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
Смесь 10,1 г (42,9 ммоля) метиламида 4-гидрокси-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты, 8,0 г (52 ммоля) трет-бутилдиметилхлорсилана и 6,5 г (94 ммоля) имидазола в 90 мл N,N-диметилформамида перемешивали при комнатной температуре в течение ночи. Реакцию останавливали при смешении с водой. Полученную в результате суспензию экстрагировали этилацетатом. Органический экстракт промывали тремя порциями воды. Объединенные водные слои экстрагировали тремя порциями дихлорметана. Объединенные органические экстракты сушили сульфатом натрия, концентрировали и сушили в вакууме (0,5 мбар) при 80°С. После колоночной флэш-хроматографии получали 14,6 г (97,3%) указанного в заглавии соединения в виде твердого вещества желтого цвета.
МС m/е (%): 349 (М+, 21).
в) Метиламид 4-(трет-бутилдиметилсиланилокси)-4′-иод-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
К раствору 500 мг (1,43 ммоля) метиламида 4-(трет-бутилдиметилсиланилокси)-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты, 1,7 мл (11 ммолей) N,N,N’,N’-тетраметилэтилендиамина и 1,0 мл (5,7 ммолей) 2,2,6,6-тетраметил-пиперидина в 9,5 мл безводного тетрагидрофурана прибавляли по каплям под аргоном при -78°С в течение 10 минут 7,2 мл (11 ммолей) 1,6 М раствора н-бутиллития в гексанах. Полученный в результате раствор перемешивали при -78°С в течение 30 минут, нагревали до -20°С и перемешивали при этой температуре 3 часа. После охлаждения реакционной смеси до -78°С прибавляли по каплям под аргоном раствор 2,92 г (11,5 ммолей) иода в 7 мл безводного тетрагидрофурана. Полученную в результате суспензию выдерживали при -78°С в течение 2 часов и затем в течение 1 ч суспензии давали нагреться до комнатной температуры. Суспензию выливали в раствор 12,4 г (50,0 ммолей) пентагидрата тиосульфата натрия в 50 мл охлажденной до температуры льда воды. Полученную в результате суспензию желтого цвета экстрагировали двумя порциями по 250 мл каждая (трет-бутил)метилового эфира. Объединенные органические экстракты промывали двумя порциями насыщенного водного раствора хлористого аммония, сушили сульфатом натрия и концентрировали. После флэш-хроматографии получали 495 мг (72,8%) указанного в заглавии соединения в виде аморфной массы не совсем белого цвета.
МС m/е (%): 476 (М+Н+, 100).
г) Метиламид 4-(трет-бутилдиметилсиланилокси)-4′-(2-хлорфенил)-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
Смесь 480 мг (1,01 ммоля) метиламида 4-(трет-бутилдиметилсиланилокси)-4′-иод-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты, 174 мг (1,11 ммоля) 2-хлорфенилборной кислоты, 6 мл диметоксиэтана и 1 мл 2 М водного раствора карбоната натрия подвергали дезоксигенированию с помощью трех циклов, включающих замораживание-оттаивание. После прибавления 60 мг (0,052 ммоля) тетракис(трифенилфосфин)палладия(0) реакционную смесь перемешивали 3 ч при 90°С. Охлаждали до комнатной температуры, затем разбавляли водой и экстрагировали этилацетатом. Органические экстракты промывали насыщенными водными растворами карбоната натрия и хлористого натрия, сушили сульфатом натрия и концентрировали. После колоночной хроматографии получали 425 мг (91,5%) указанного в заглавии соединения в виде твердого вещества не совсем белого цвета.
МС m/е (%): 460 (М+Н+, 100).
д) (3,5-Бис(трифторметил)бензил)метиламид 4-(трет-бутилдиметилсиланилокси)-4′-(2-хлорфенил)-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
Указанное в заглавии соединение получали в виде не совсем белой пены с выходом 49% согласно описанной выше методике получения N-(3,5-бис-(трифторметил)бензил)-6-хлор-N-метил-4-о-толилникотинамида, используя метиламид 4-(трет-бутилдиметилсиланилокси)-4′-(2-хлорфенил)-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты вместо 6-хлор-N-метил-4-о-толил-никотинамида.
МС m/е (%): 685 (М+, 40).
е) (3,5-Бис(трифторметил)бензил)метиламид 4′-(2-хлорфенил)-4-гидрокси-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты
Указанное в заглавии соединение получали в виде твердого вещества белого цвета с выходом 82% согласно методике, описанной выше для получения (3,5-бис-(трифторметил)бензил)метиламида 4-(2-гидроксиэтокси)-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты, используя (3,5-бис-(трифторметил)бензил)метиламид 4-(трет-бутилдиметилсиланилокси)-4′-(2-хлор-фенил)-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты вместо (3,5-бис(трифторметил)бензил)метиламида (4-[2-(трет-бутилдиметилсиланилокси)этокси]-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты.
МС m/е (%); 572 (М+Н+, 100).
Пример 7
2-(3,5-Бис(трифторметил)фенил)-N-[6-(2-гидроксиэтиламино)-4-о-толилпиридин-3-ил]-N-метилизобутирамид
а) 4-(5-Нитро-2-пиридил)морфолин
К раствору 20 г (126 ммолей) 2-хлор-5-нитропиридина в 150 мл тетрагидрофурана прибавляли по каплям 27 мл (315 ммолей) морфолина в течение 10 минут. Реакционную смесь кипятили с обратным холодильником еще 2 часа. После охлаждения до комнатной температуры растворитель удаляли в вакууме и остаток заново растворяли в 200 мл этилацетата. Органическую фазу промывали 200 мл 1 н. раствора бикарбоната натрия, сушили (сульфатом магния) и упаривали, получали 27,3 г (выход количественный) указанного в заглавии соединения в виде твердого вещества желтого цвета. Тпл 142-143°С.
б) 2,2-Диметил-N-(6-морфолин-4-илпиридин-3-ил)пропионамид
К раствору 27,3 г (126 ммолей) 4-(5-нитро-2-пиридил)морфолина в 600 мл метанола прибавляли 2,5 г 10% палладия на активированном угле. Реакционную смесь гидрировали (температура от комнатной до примерно 45°С, 1 бар) до поглощения теоретического количества водорода (около 3 часов). Катализатор отфильтровывали и дважды промывали метанолом порциями по 100 мл каждая. Фильтрат упаривали в вакууме, получали 22,6 г масла пурпурного цвета, состоящего по данным анализа с помощью тонкослойной хроматографии из примерно 95% желаемого производного анилина.
Технический продукт растворяли в смеси 240 мл тетрагидрофурана и 60 мл диэтилового эфира. После охлаждения до 0°С прибавляли в один прием 26 мл (189 ммолей) триэтиламина. Перемешивание продолжали, в это время прибавляли по каплям 23 г (189 ммолей) хлорангидрида триметилуксусной кислоты в течение 10 минут. Баню со льдом удаляли и реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Затем растворитель удаляли в вакууме и остаток суспендировали в 200 мл 1 н. раствора бикарбоната натрия. Продукт трижды экстрагировали дихлорметаном порциями по 200 мл каждая, сушили (сульфатом натрия) и упаривали. После перекристаллизации твердого остатка из этилацетата/ гексана 1:8 получали 28,6 г (86%) указанного в заглавии соединения в виде кристаллов белого цвета.
МС m/е (%): 264 (M+H+, 100).
в) N-(4-Иод-6-морфолин-4-илпиридин-3-ил)-2,2-диметилпропионамид
Раствор 28,4 г (108 ммолей) 2,2-диметил-N-(6-морфолин-4-илпиридин-3-ил)пропионамида и 49 мл (324 ммоля) N,N,N’,N’-тетраметилэтилендиамина в 600 мл тетрагидрофурана в атмосфере аргона охлаждали в бане с сухим льдом до -78°С. В течение часа прибавляли по каплям 202 мл (324 ммоля) 1,6 н. раствора н-бутиллития в гексане. Реакционной смеси давали нагреться до -35°С в течение ночи. После повторного охлаждения до -78°С прибавляли по каплям в течение 15 минут 37 г (146 ммолей) иода, растворенного в 60 мл тетрагидрофурана. Баню с сухим льдом заменяли на баню со льдом и прибавляли раствор 90 г (363 ммоля) пентагидрата тиосульфата натрия в 250 мл воды в течение 10 минут, когда температура реакционной смеси достигла 0°С. Затем прибавляли 1000 мл диэтилового эфира и органический слой отделяли. Водный слой дважды экстрагировали 500 мл дихлорметана и объединенные органические слои сушили (сульфатом магния) и упаривали. После флэш-хроматографии получали 15,6 г (37%) указанного в заглавии соединения в виде масла светло-коричневого цвета, которое кристаллизовалось при стоянии при комнатной температуре.
МС m/е (%): 389 (М+, 71), 358 (25), 304 (43), 57 (100).
г) 2,2-Диметил-N-(‘6-морфолин-4-ил-4-о-толилпиридин-3-ил)пропионамид
Смесь 3,50 г (9,0 ммолей) N-(4-иод-6-морфолин-4-илпиридин-3-ил)-2,2-диметил-пропионамида, 35 мл толуола, 18 мл 2 н. раствора карбоната натрия, 312 мг (0,27 ммоля) тетракис(трифенилфосфин)палладия(0) и 1,34 г (9,9 ммолей) о-толилборной кислоты нагревали в атмосфере аргона 12 часов при 80°С. После охлаждения до комнатной температуры водную фазу отделяли и дважды промывали этилацетатом. Объединенные органические слои промывали 50 мл соляного раствора, сушили (сульфатом натрия) и упаривали. После очистки с помощью флэш-хроматографии получали 3,23 г (количественный выход) указанного в заглавии соединения в виде пены белого цвета. МС m/е (%): 354 (М+Н+, 100).
д) 6-Морфолин-4-ил-4-о-толилпиридин-3-иламин
Суспензию 2,93 г (8,28 ммолей) 2,2-диметил-N-(6-морфолин-4-ил-4-о-толил-пиридин-3-ил)пропионамида в 80 мл 3 н. раствора соляной кислоты и 5 мл 1-пропанола нагревали при 90-95°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры, промывали тремя порциями по 20 мл диэтилового эфира и фильтровали через целит. Фильтрат разбавляли 20 мл воды и устанавливали рН 7-8 путем прибавления 28%-ного раствора гидроокиси натрия при охлаждении льдом. Продукт экстрагировали четырьмя порциями дихлорметана по 100 мл каждая. Объединенные органические слои промывали 50 мл соляного раствора, сушили (сульфатом магния) и упаривали, получали 2,31 г (количественный выход) указанного в заглавии соединения в виде пены белого цвета.
МС m/е(%): 269 (М+, 100).
е) Метил(6-морфолин-4-ил-4-о-толилпиридин-3-ил)амин
Раствор 2,24 г (8,3 ммолей) 6-морфолин-4-ил-4-о-толилпиридин-3-иламина в 17 мл триметилового эфира ортомуравьиной кислоты и 3 капли трифторуксусной кислоты нагревали 2 часа при 130°С. Реакционную смесь упаривали и сушили в вакууме 30 минут. Оставшееся масло растворяли в 5 мл тетрагидрофурана и прибавляли по каплям при охлаждении льдом к 630 мг (16,6 ммолей) алюмогидрида лития в 20 мл тетрагидрофурана. Реакционную смесь перемешивали 1 ч при комнатной температуре, опять охлаждали до 0°С и подкисляли (рН 1-2) путем прибавления 28%-ного раствора соляной кислоты. После перемешивания в течение 5 минут прибавляли 28%-ный раствор гидроокиси натрия для установления рН 10. Раствор фильтровали через целит, упаривали и очищали с помощью флэш-хроматографии, получали 1,56 г (66%) указанного в заглавии соединения в виде пены белого цвета.
МС m/е (%): 283 (М+, 100).
ж) 2-(3,5-Бис(трифторметил)фенил)-]N-метил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)изобутирамид
Раствор 1,46 г (5,15 ммолей) метил(6-морфолин-4-ил-4-о-толилпиридин-3-ил)-амина и 1,32 мл (7,73 ммолей) N-этилдиизопропиламина в 15 мл дихлорметана охлаждали в бане со льдом и прибавляли по каплям 1,8 г (5,67 ммолей) хлорангидрида 2-(3,5-бис(трифторметил)фенил)-2-метилпропионовой кислоты. Реакционную смесь нагревали при 35-40°С в течение 3 часов, охлаждали опять до комнатной температуры и перемешивали с 25 мл насыщенного раствора бикарбоната натрия. Органический слой отделяли и водную фазу экстрагировали дихлорметаном. Объединенные органические слои сушили (сульфатом магния) и упаривали. Остаток очищали с помощью флэш-хроматографии, получали 2,9 г (выход количественный) указанного в заглавии соединения в виде кристаллов белого цвета. Тпл 131-132°С.
з) 2-(3,5-Бис(трифторметил)фенил)-N-[6-(2-гидроксиэтиламино)-4-о-толил-пиридин-3-ил]-N-метилизобутирамид
Смесь 1,0 г (1,76 ммоля) 2-(3,5-бис(трифторметил)фенил)-N-метил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)изобутирамида, 100 мг (0,48 ммоля) гидрата хлористого рутения(III), 832 мг (3,87 ммоля) периодата натрия, 3,5 мл четыреххлористого углерода, 3,5 мл ацетонитрила и 5,3 мл воды перемешивали 4 дня при комнатной температуре. Прибавляли дихлорметан, органический слой отделяли, промывали раствором бисульфита натрия и фильтровали через целит. К фильтрату прибавляли 10 мл 1 н. раствора гидроокиси калия и 20 мл метанола. После нагревания смеси 1 час при 40°С растворители удаляли в вакууме и остаток очищали с помощью флэш-хроматографии, получали 352 мг (37%) указанного в заглавии соединения в виде пены светло-коричневого цвета.
МС m/е (%): 540 (М+Н+, 100).
Пример 8
2-(3,5-Бис(трифторметил)фенил)-N-[4-(2-хлорфенил)-6-(2-гидроксиэтиламино)-пиридин-3-ил]-N-метилизобутирамид
Указанное в заглавии соединение получали в виде пены светло-коричневого цвета со сравнимым выходом согласно методикам, описанным выше для получения 2-(3,5-бис(трифторметил)фенил)-N-[6-(2-гидроксиэтиламино)-4-о-толилпиридин-3-ил]-N-метилизобутирамида, используя 2-хлорборную кислоту вместо о-толилборной кислоты на стадии г).
МС m/е (%): 560 (М+Н+, 100).
Пример 9
2-(3,5-Бис(трифторметил)фенил)-N-[6-(2,3-дигидро-[1,4]оксазин-4-ил)-4-о-толилпиридин-3-ил]-N-метилизобутирамид
а) 2-(3,5-Бис(трифторметил)фенил)-N-метил-N-[6-(3-оксоморфолин-4-ил)-4-о-толилпиридин-3-ил]изобутирамид
К охлажденной до температуры льда суспензии 1,2 г (7,1 ммолей) гидрата окиси рутения(IV) в смеси 50 мл четыреххлористого углерода и 50 мл воды прибавляли 9,0 г (42 ммоля) периодата натрия. После перемешивания в течение 30 минут органический слой отделяли и водный слой экстрагировали дважды четыреххлористым углеродом порциями по 10 мл каждая. Объединенные органические слои фильтровали через целит, охлаждали до 0°С и медленно прибавляли к охлажденному до температуры льда раствору 2,0 г (3,54 ммоля) 2-(3,5-бис(трифторметил)фенил)-N-метил-N-(6-морфолин-4-ил-4-о-толил-пиридин-3-ил)изобутирамида в 20 мл четыреххлористого углерода. Смесь перемешивали еще 15 мин при 0°С, фильтровали через целит и упаривали. Остаток очищали с помощью флэш-хроматографии и получали 704 мг (34%) указанного в заглавии соединения в виде бесцветной пены.
MC m/e (%): 580 (M+H+, 100).
б) (RS)-2-(3,5-Бис(трифторметил)фенил)-N-[6-(3-гидроксиморфолин-4-ил)-4-о-толилпиридин-3-ил]-N-метилизобутирамид
К охлажденному до температуры льда раствору 494 мг (0,852 ммоля) 2-(3,5-бис(трифторметил)фенил)-N-метил-N-[6-(3-оксоморфолин-4-ил)-4-о-толилпиридин-3-ил]изобутирамида в 5 мл метанола и 5 мл тетрагидрофурана прибавляли 635 мг (1,70 ммоля) гептагидрата хлорида церия(III). После перемешивания в течение 5 мин прибавляли 64 мг (1,70 ммоля) боргидрида натрия в виде двух порций в течение 2 мин. После перемешивания в течение 3 часов при 0°С прибавляли 1 мл ацетона и перемешивание продолжали 10 минут. Растворитель удаляли, остаток заново растворяли в этилацетате и органическую фазу промывали насыщенным раствором карбоната натрия, сушили (сульфатом магния) и упаривали. Технический продукт очищали с помощью флэш-хроматографии, получали 87 мг (16%) указанного в заглавии соединения в виде кристаллов белого цвета.
MC m/e (%): 582 (М+Н+, 100).
в) 2-(3,5-Бис(трифторметил)фенил)-N-[6-(2,3-дигидро-[1,4]оксазин-4-ил)-4-о-толилпиридин-3-ил]-N-метилизобутирамид
К раствору 65 мг (0,11 ммоля) (RS)-2-(3,5-бис(трифторметил)фенил)-N-[6-(3-гидроксиморфолин-4-ил)-4-о-толилпиридин-3-ил]-N-метилизобутирамида в 2 мл хлороформа прибавляли несколько капель 2,3 н. раствора соляной кислоты в диэтиловом эфире. После перемешивания при комнатной температуре в течение 2 ч органический слой промывали насыщенным раствором карбоната натрия, сушили (сульфатом магния) и упаривали. Остаток очищали с помощью флэш-хроматографии, получали 47 мг (75%) указанного в заглавии соединения в виде пены белого цвета.
MC m/e (%); 564 (М+Н+, 100).
Пример 10
N-(6-Ацетиламино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамид
а) N2-Бензил-N5-метил-4-о-толилпиридин-2,5-диамин
Указанное в заглавии соединение получали согласно методикам, описанным выше для синтеза метил(6-морфолин-4-ил-4-о-толилпиридин-3-ил)амина.
МС m/е (%): 304 (М+Н+, 100).
б) Бензиловый эфир бензил(5-метиламино-4-о-толилпиридин-2-ил)-карбаминовой кислоты
К раствору 2,03 г (6,7 ммолей) N2-бензил-N5-метил-4-о-толилпиридин-2,5-диамина в 100 мл дихлорметана и 40 мл N-этилдиизопропиламина прибавляли по каплям раствор 2,1 мл (14,09 ммолей) бензилового эфира хлормуравьиной кислоты в 50 мл дихлорметана при 0°С. После перемешивания в течение 2 ч при комнатной температуре реакционную смесь промывали водой (2×50 мл), соляным раствором (50 мл), сушили (сульфатом магния) и упаривали. После хроматографии остатка получали 2,36 г (80%) указанного в заглавии соединения в виде кристаллов светло-коричневого цвета. Тпл 110-112°С.
МС m/е (%): 438 (М+Н+, 100).
в) Бензиловый эфир бензил(5-{[2-(3,5-бис(трифторметил)фенил)-2-метилпропионил]метиламино}-4-о-толилпиридин-2-ил)карбаминовой кислоты
К раствору 1,075 г (2,5 ммоля) бензилового эфира бензил(5-метиламино-4-о-толилпиридин-2-ил)карбаминовой кислоты в 10 мл дихлорметана и 1 мл N-этил-диизопропиламина прибавляли по каплям при 0°С раствор 1,15 г (3,5 ммоля) хлорангидрида 2-(3,5-бис(трифторметил)фенил)-2-метилпропионовой кислоты в 2 мл дихлорметана и смесь перемешивали 3 ч при комнатной температуре. Раствор промывали водой (20 мл), насыщенным водным раствором бикарбоната натрия (20 мл) и соляным раствором (20 мл), сушили (сульфатом магния) и упаривали. После хроматографии остатка получали 1,15 г (62%) указанного в заглавии соединения в виде масла желтого цвета.
МС m/е (%): 720 (М+Н+, 100).
г) N-(6-Бензиламино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамид
К раствору 973 мг (1,35 ммоля) бензилового эфира бензил(5-{[2-(3,5-бис-(трифторметил)фенил)-2-метилпропионил]метиламино)-4-о-толилпиридин-2-ил)-карбаминовой кислоты в 13 мл метанола и 1 мл N,N-диметилформамида прибавляли 40 мг 10% палладия на активированном угле и смесь гидрировали (комнатная температура, 1 бар) в течение 1 часа. Фильтрация от катализатора и упаривание фильтрата приводили к 795 мг (количественный выход) указанного в заглавии соединения в виде масла желтого цвета.
МС m/е (%): 586 (М+Н+, 100).
д) N-(6-Амино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамид
Раствор 750 мг (1,28 ммоля) N-(6-бензиламино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамида в 25 мл 5 н. раствора соляной кислоты в этаноле упаривали досуха и остаток растворяли в 30 мл метанола и гидрировали в присутствии 60 мг 10% палладия на активированном угле (комнатная температура, 10 бар) в течение 20 часов. После фильтрации от катализатора и выпаривания растворителя остаток растворяли в 30 мл этилацетата, дважды промывали насыщенным водным раствором бикарбоната натрия и сушили (сульфатом магния). Упаривание раствора приводило к 514 мг (81%) указанного в заглавии соединения в виде кристаллов светло-коричневого цвета.
МС m/е (%): 496 (М+Н+, 100).
е) N-(6-Ацетиламино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамид
К раствору 100 мг (0,20 ммоля) N-(6-амино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамида в 3 мл дихлорметана прибавляли 27 мг (0,21 ммоля) N-этилдиизопропиламина и 70 мг (0,69 ммоля) уксусного ангидрида. После перемешивания в течение ночи растворитель выпаривали и остаток очищали с помощью флэш-хроматографии, получали 100 мг (92%) указанного в заглавии соединения в виде твердого вещества белого цвета.
МС m/е (%): 537 (М+, 68), 282 (100).
Пример 11
N-[6-(Ацетилметиламино)-4-о-толилпиридин-3-ил]-2-(3,5-бис(трифторметил)-фенил)-N-метилизобутирамид
К раствору 60 мг (0,11 ммоля) N-(6-ацетиламино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамида в 2 мл тетрагидрофурана при комнатной температуре в атмосфере аргона прибавляли по каплям 0,13 мл (0,12 ммоля) 1 М раствора гексаметилдисилазида калия в тетрагидрофуране. Перемешивание продолжали 1 час при комнатной температуре и прибавляли 17 мг (0,12 ммоля) йодистого метила. После перемешивания в течение ночи растворитель выпаривали и остаток очищали с помощью флэш-хроматографии, получали 40 мг (65%) указанного в заглавии соединения в виде пены белого цвета.
МС m/е (%): 574 (M+Na+, 17), 552 (M+H+, 100).
Пример 12
(5-{[2-(3,5-Бис(трифторметил)фенил)-2-метилпропионил]метиламино}-4-о-толилпиридин-2-ил)амид циклопропанкарбоновой кислоты
К раствору 100 мг (0,20 ммоля) N-(6-амино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамида в 3 мл дихлорметана прибавляли 2 мл пиридина и 23 мг (0,22 ммоля) хлорангидрида циклопропанкарбоновой кислоты при 0°С. После перемешивания в течение 2 дней при комнатной температуре растворитель удаляли в вакууме и остаток очищали с помощью флэш-хроматографии, получали 61 мг (54%) указанного в заглавии соединения в виде твердого вещества белого цвета.
МС m/е (%): 586 (M+Na+, 25), 564 (M+H+, 100).
Пример 13
(5-{[2-(3,5-Бис(трифторметил)фенил)-2-метилпропионил]метиламино}-4-о-толилпиридин-2-ил)метиламид циклопропанкарбоновой кислоты
Указанное в заглавии соединение получали в виде белой пены со сравнимым выходом согласно методике, описанной выше для получения N-[6-(ацетилметиламино)-4-о-толилпиридин-3-ил]-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамида, используя (5-{[2-(3,5-Бис(трифторметил)фенил)-2-метилпропионил]метиламино}-4-о-толилпиридин-2-ил)амид циклопропанкарбоновой кислоты вместо N-[6-(ацетил-амино)-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метил-изобутирамида.
МС m/е (%): 600 (M+Na+, 22), 578 (М+Н+, 100).
Пример 14
2-(3,5-Бис(трифторметил)фенил)-N-(6-имидазол-1-ил-4-о-толилпиридин-3-ил)-N-метилизобутирамид
а) 6-Имидазол-1-ил-4-о-толилпиридин-3-иламин
Указанное в заглавии соединение получали в виде пены светло-коричневого цвета согласно методикам, описанным выше для получения 6-морфолин-4-ил-4-о-толилпиридин-3-иламина (пример 7, стадия д), используя имидазол вместо морфолина на стадии а).
МС m/е (%): 251 (М+Н+, 100).
б) 2-(3,5-Бис(трифторметил)фенил)-N-(6-имидазол-1-ил-4-о-толилпиридин-3-ил)изобутирамид
Указанное соединение получали в виде кристаллов желтого цвета согласно методике, описанной выше для получения 2-(3,5-бис(трифторметил)фенил)-N-метил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)изобутирамида (пример 7, стадия ж), используя 6-имидазол-1-ил-4-о-толилпиридин-3-иламин вместо метил(6-морфолин-4-ил-4-о-толилпиридин-3-ил)амина.
МС m/е (%): 532 (М+, 100).
в) 2-(3,5-Бис(трифторметил)фенил)-N-(6-имидазол-1-ил-4-о-толилпиридин-3-ил)-N-метилизобутирамид
Указанное в заглавии соединение получали в виде кристаллов белого цвета согласно методике, описанной выше для получения N-(3,5-бис(трифторметил)бензил)-6-хлор-N-метил-4-о-толилникотинамида (пример 1, стадия в), используя 2-(3,5-бис-(трифторметил)фенил)-N-(6-имидазол-1-ил-4-о-толилпиридин-3-ил)изобутирамид вместо 6-хлор-N-метил-4-о-толилникотинамида и йодистый метил вместо бромистого 3,5-бис(трифторметил)бензила.
МС m/е (%): 547 (М+Н+, 100).
Пример А
Таблетки следующего состава готовят обычным способом, мг/ в таблетке:
| Активное вещество |
5 |
| Лактоза |
45 |
| Кукурузный крахмал |
15 |
| Микрокристаллическая целлюлоза |
34 |
| Стеарат магния |
1 |
| Масса таблетки |
100 |
Пример Б
| Капсулы следующего состава изготавливают, мг/в капсуле: |
| Активное вещество |
10 |
| Лактоза |
155 |
| Кукурузный крахмал |
30 |
| Тальк |
5 |
| Масса заполняющего капсулу содержимого |
200 |
Активное вещество, лактозу и кукурузный крахмал сначала смешивают в миксере и затем в устройстве для измельчения. Смесь возвращают в миксер, прибавляют туда тальк и тщательно перемешивают. Этой смесью с помощью расфасовочной машины заполняют твердые желатиновые капсулы.
Пример В
Суппозитории следующего состава изготавливают, мг/ в суппозитории:
| Активное вещество |
15 |
| Масса для суппозитория |
1285 |
| Итого |
1300 |
Массу для суппозитория плавят в стеклянном или стальном сосуде, тщательно смешивают и охлаждают до 45°С. Затем к смеси прибавляют тонкоизмельченное активное вещество и перемешивают до полного его диспергирования. Смесь выливают в пресс-формы для суппозиториев подходящего размера, оставляют охлаждаться, суппозитории затем удаляют из форм и упаковывают по отдельности в вощеную бумагу или металлическую фольгу.
Формула изобретения
1. Производные 4-фенилпиридина общих формул,
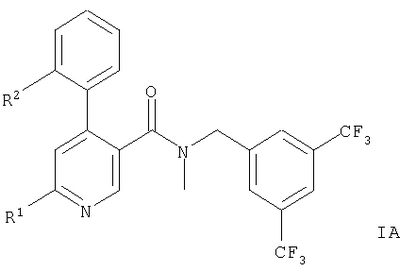 или или 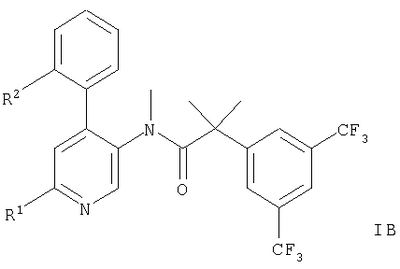
где
R1 означает
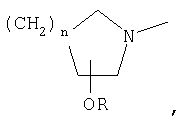 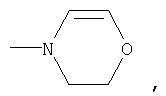 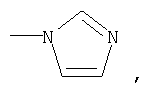 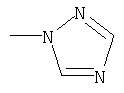 или означает или означает
-NH(CH2)2OH, -NR3С(О)СН3 или -NR3C(О)-циклопропил;
R2 означает метил или хлор;
R3 означает водород или метил;
R означает водород или -(СН2)2OH; и
n означает 1 или 2;
и их фармацевтически приемлемые кислотно-аддитивные соли.
2. Соединение формулы IA по п.1, где R2 означает метил.
3. Соединение по п.2, которое означает
N-(3,5-бис(трифторметил)бензил)-N-метил-4-о-толил-6-[1,2,4]триазол-1-ил-никотинамид,
N-(3,5-бис(трифторметил)бензил)-6-(2-гидроксиэтиламино)-N-метил-4-о-толилникотинамид,
(3,5-бис(трифторметил)бензил)метиламид 4-гидрокси-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты,
(3,5-бис(трифторметил)бензил)метиламид 4-(2-гидроксиэтокси)-4′-о-толил-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты или
(R)-N-(3,5-бис(трифторметил)бензил)-6-(3-гидроксипирролидин-1-ил)-N-метил-4-o-толилникотинамид.
4. Соединение формулы IA по п.1, где R2 означает хлор.
5. Соединение по п.4, которое означает
(3,5-бис(трифторметил)бензил)метиламид 4′-(2-хлорфенил)-4-гидрокси-3,4,5,6-тетрагидро-2Н-[1,2′]бипиридинил-5′-карбоновой кислоты.
6. Соединение формулы IB по п.1, где R2 означает метил.
7. Соединение по п.6, которое означает
2-(3,5-бис(трифторметил)фенил)-N-[6-(2-гидроксиэтиламино)-4-о-толилпиридин-3-ил]-N-метилизобутирамид,
2-(3,5-бис(трифторметил)фенил)-N-[6-(2,3-дигидро-[1,4]оксазин-4-ил)-4-о-толил-пиридин-3-ил]-N-метилизобутирамид,
N-(6-ацетиламино-4-о-толилпиридин-3-ил)-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамид,
N-[6-(ацетилметиламино)-4-о-толилпиридин-3-ил]-2-(3,5-бис(трифторметил)фенил)-N-метилизобутирамид,
(5-{[2-(3,5-бис(трифторметил)фенил)-2-метилпропионил]метиламино}-4-о-толил-пиридин-2-ил)амид циклопропанкарбоновой кислоты,
(5-{[2-(3,5-бис(трифторметил)фенил)-2-метилпропионил]метиламино}-4-о-толил-пиридин-2-ил)метиламид циклопропанкарбоновой кислоты или
2-(3,5-бис(трифторметил)фенил)-N-(6-имидазол-1-ил-4-о-толилпиридин-3-ил)-N-метилизобутирамид.
8. Соединение формулы IB по п.1, где R2 означает хлор.
9. Соединение по п.8, которое означает 2-(3,5-бис(трифторметил)фенил)-N-[4-(2-хлорфенил)-6-(2-гидроксиэтиламино)-пиридин-3-ил]-N-метилизобутирамид.
10. Лекарственное средство, обладающее действием антагониста рецептора NK-1, содержащее одно соединение по любому из пп.1-9 и фармацевтически приемлемые наполнители.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 21.07.2008
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
|