|
|
(21), (22) Заявка: 2004114314/04, 12.05.2004
(24) Дата начала отсчета срока действия патента:
12.05.2004
(45) Опубликовано: 10.05.2006
(56) Список документов, цитированных в отчете о
поиске:
МАШКОВСКИЙ М.Д. Лекарственные средства. – М., 2001, т.2, с.186. RU 2210568 C1, 20.08.2003. WO 9219597 A1, 12.11.1992.
Адрес для переписки:
107078, Москва, Красноворотский пр-д, 3, стр. 1, к.18, ООО Патентно-правовая фирма “Искона -II”, пат.пов. Е.А.Гавриловой
|
(73) Патентообладатель(и):
Марвел Лайф Сайнсез Лтд. (GB)
|
(54) ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ АНТИОКСИДАНТНОЙ, ГЕРОПРОТЕКТОРНОЙ И ПРОТИВОИШЕМИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ
(57) Реферат:
Изобретение относится к фармацевтически приемлемым солям 2,4,6-триметил-3-гидроксипиридина с низшими дикарбоновыми кислотами общей формулы 1а-г, обладающие антиоксидантной активностью,
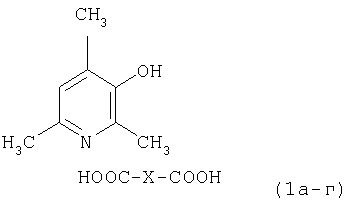
при X, равном простой связи (соединение 1а, оксалат, C8H11NO·C2H2O4; при X, равном СН2 (соединение 1б, малонат, С8Н11NO·С3H4O4); при X, равном СН2СН2 (соединение 1в, сукцинат, C8H11NO·C4H6O4); при X, равном группе СН2СН(ОН), (соединение 1г, малат, C8H11NO·C4H6O5). Также изобретение относится к фармацевтической соли формулы 1в, обладающей геропротекторной и противоишемической активностями, и к способу получения солей. 2 н. и 1 з.п.ф-лы, 5 табл.
Изобретение относится к области медицины, а именно к новым биологически активным соединениям, конкретно к солям 2,4,6-триметил-3-гидроксипиридина с низшими дикарбоновыми кислотами (соединения общей формулы 1 – соединения а-г), обладающими антиоксидантным, геропротекторным и противоишемическим действием. Соединения «а-г» проявляют антиоксидантную активность в отношении процесса перекисного окисления липидов, что свойственно всем производным 3-оксипиридина. Это свойство позволяет предполагать, что соединения «а-г», как и их аналоги, эмоксипин (гидрохлорид 2-метил-6-этил-3-гидроксипиридина) и мексидол (сукцинат 2-метил-6-этил-3-гидроксипиридина), могут быть применены в качестве лечебных средств в офтальмологии, а именно при субконъюктивальных и внутриглазных кровоизлияниях в любые отделы и ткани глаза, ангиоретинопатиях различной этиологии, включая диабетическую, хориоретинальных дистрофиях, тромбозе центральной вены сетчатки и ее ветвей, осложненной миопии, дистрофических кератитах, для защиты и лечения роговицы и сетчатки при воздействии света высокой эффективности, после операций с отслойкой сетчатки. Кроме того, наличие у соединения «в» выраженного противоишемического действия предполагает возможность применения в кардиологии для лечения ишемической болезни сердца и атеросклероза.
Соединение «в» также оказалось активным ингибитором фотоиндуцированного перекисного окисления липидов, сенсибилизированного «старческим пигментом» – липофусциновыми гранулами, выделенными из глаз пожилых людей. Это свидетельствует о том, что это соединение способно нейтрализовать токсическую активность липофусциновых гранул, накапливающихся в пожилом возрасте, т.е. проявлять геропротекторное действие. Исходя из этого можно предполагать, что соединение «в» может быть использовано для инактивации токсического действия липофусцина. Липофусцин, как сейчас общепринято, является основным фактором, приводящим к развитию старческой макулярной дегенерации сетчатки. Старческая макулярная дегенерация сетчатки относится к наиболее распространенным глазным заболеваниям, развивающимся у людей в возрасте свыше 60 лет. Согласно статистическим данным эта болезнь сетчатки, приводящая к полной слепоте, поражает почти 30% американцев в возрасте свыше 65 лет и процент заболевших быстро увеличивается с возрастом.
Известно средство антиоксидантной защиты сред и тканей глаза, которое представляет собой биорастворимый полимер с гидрофильной пластифицирующей добавкой и содержит в качестве лекарственного средства эмоксипин и пиридоксина гидрохлорид (RU 2070010, 1993).
Известна биологически активная пищевая добавка «глутапирон», обладающая в том числе геропротекторным действием, которая в качестве активного вещества содержит соли 2-(2,6-диметил-3,5-диэтоксикарбонил-1,4-дигидропиридин-4-карбоксамидо) глутаровой кислоты (RU 95116403, 1995).
Известно использование дикалиевой соли N-(3-хлоро-1,4-нафтохинонил)-2-глутаминовой кислоты в качестве вещества, проявляющего в том числе противоишемическую активность.
Наиболее близким аналогом к изобретению является сукцинат 2-метил-6-этил-3-гидроксипиридина (мексидол) (М.Д.Машковский, «Лекарственные средства», ч.II, 1993, М.: Медицина, с.216), обладающий антиоксидантным и мембранопротекторным действием, который получают нагреванием спиртового раствора 2-метил-6-этил-3-гидроксипиридина с янтарной кислотой в течение 1 ч (А.с. СССР 509047, 1973 г.).
Задачей изобретения является разработка и создание новых веществ, производных 3-гидроксипиридинового ряда, проявляющих антиоксидантные, геропротекторные и противоишемические свойства и не проявляющие раздражающего действия на ткани глаза.
Сущность изобретения достигается новыми соединениями – фармацевтически приемлемыми солями 2,4,6-триметил-3-гидроксипиридина с низшими дикарбоновыми кислотами, общей формулы 1a-г, обладающими антиоксидантной активностью:
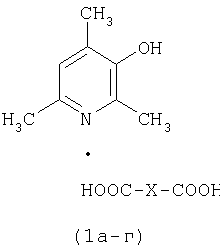 |
при X, равном простой связи (соединение Ia, оксалат, С9Н11NO·С2Н2О4);
при X, равном СН2 (соединение Iб, малонат, С9Н11NO·С3H4O4);
при X, равном CH2CH2 (соединение Iв, сукцинат, C9H11NO·C4H6O4);
при X, равном группе СН2СН(ОН),
соединение 1 г, малат, С9H11NO·C4Н6O5) |
Кроме того, фармацевтически приемлемая соль формулы 1в обладает также геропротекторной и противоишемической активностями.
Задача изобретения решается также способом получения солей 2,4,6-триметил-3-гидроксипиридина, обладающих антиоксидантной, геропротекторной и противоишемической активностями, который включает взаимодействие эквимолекулярных количеств 2,4,6-триметил-3-гидроксипиридина с дикарбоновой кислотой в растворе низшего спирта при кипячении с последующей обработкой реакционной массы органическим растворителем и, при необходимости, выдержкой в течение 2-5 ч при 10-15°С.
Пример 1. Получение органических солей 2,4,6-триметил-3-оксипиридина
А) Получение оксалата 2,4,6-триметил-3-оксипиридина (Ia).
В колбу с магнитной мешалкой и обратным холодильником загружают 0.8 г (0.00583 моль) основания 2,4,6-триметил-3-оксипиридина, 0.525 г (0.00583 моль) безводной щавелевой кислоты и 10 мл метанола. При работающей мешалке реакционную смесь нагревают до кипения и кипятят в течение 0.5 часа. Затем нагревание прекращают, растворитель отгоняют в вакууме, добавляют к реакционной массе 5 мл ацетона, растирают в течение 5-10 мин стеклянной палочкой. Образовавшийся кристаллический осадок отделяют фильтрованием, промывают на фильтре ацетоном, сушат в вакууме. Получают 1.1 г (83% от теории) соли. Т. пл. 140-142°С. Найдено, %: С 53.4, Н 5.9. Вычислено, %: С 52.9, Н 5.8. ЯМР1H Bruker WM-400 (400 МГц) (DMSO-d6): 2,20 (3Н, с, СН3); 2,34 (3Н, с, СН3); 2,37 (3Н, с, СН3); 7,05 м.д. (1Н, с, СН).
Б). Получение малоната 2,4,6-триметил-3-оксипиридина (Iб).
В колбу с магнитной мешалкой и обратным холодильником загружают 0.8 г (0.00583 моль) основания 2,4,6-триметил-3-оксипиридина, 0.607 г (0.00583 моль) малоновой кислоты и 10 мл этанола. При работающей мешалке реакционную смесь нагревают до кипения и кипятят в течение 0.5 часа. Затем нагревание прекращают, растворитель отгоняют в вакууме, добавляют к реакционной массе 5 мл ацетона, выдерживают 3 часа при 10-15°С. Образовавшийся осадок растирают, отделяют фильтрованием, промывают на фильтре ацетоном, сушат в вакууме. Получают 1.2 г (85.3% от теории) соли. Т. пл. 118-120°С. Найдено, %: С 55.0, Н 6.5. Вычислено, %: С 54.8, Н 6.3. ЯМР1H Bruker WM-400 (400 МГц) (DMSO-d6): 2,16 (3Н, с, СН3); 2,30 (3Н, с, СН3); 2,33 (3Н, с, СН3); 3,11 (2Н, с, СН2); 6,93 м.д. (1Н, с, СН).
В) Получение сукцината 2,4,6-триметил-3-оксипиридина (Iв).
В колбу с магнитной мешалкой и обратным холодильником загружают 3.4 г (0.025 моль) основания 2,4,6-триметил-3-оксипиридина, 2.93 г (0.025 моль) янтарной кислоты и 50 мл изопропанола. При работающей мешалке реакционную смесь нагревают до кипения и кипятят в течение 0.5 часа. Затем нагревание прекращают и постепенно добавляют к реакционной массе 30 мл ацетона, выдерживают 3 часа при 10-15°С. Образовавшийся осадок отделяют фильтрованием, промывают на фильтре ацетоном, сушат в вакууме. Получают 5.6 г (88.5% от теории) соли. Т. пл. 128-129°С. Найдено, %: С 56.5, Н 6.9. Вычислено, %: С 56.5, Н 6.7. ЯМР 1H (ДМСО-d6): 2.12 (3Н, с, СН3), 2.26 (3Н, с, СН3), 2.31 (3Н, с, СН3), 2.42 (4Н, с, СН3), 6.79 (1Н, с, СН-Ру), 10.57 (уш.с, СООН).
Г) Получение малата 2,4,6-триметил-3-оксипиридина (г).
В колбу с магнитной мешалкой и обратным холодильником загружают 0.8 г (0.00583 моль) основания 2,4,6-триметил-3-оксипиридина, 0.782 г (0.00583 моль) яблочной кислоты и 10 мл метанола. При работающей мешалке реакционную смесь нагревают до кипения и кипятят в течение 0.5 часа. Затем растворитель удаляют в вакууме. Маслообразный остаток дважды промывают ацетоном при перемешивании, растворитель удаляют декантацией. Полученную массу вакуумируют и выдерживают в течение часа при остаточном давлении 0.5 мм рт.ст., затем оставляют для кристаллизации на 48-72 ч. Получают белое твердое соединение с т.пл.70-75°С. Выход 1.12 г (70.8% от теоретического). Найдено, %: С 53.5, Н 6.4. Вычислено: 53.1. Н 6.3. ЯМР1H Bruker WM-400 (400 МГц) (DMSO-d6): 2,12 (3Н, с, СН3); 2,26 (3Н, с, СН3); 2,30 (3Н, с, СН3); 3,11 (2Н, с, СН3); 2,41 (1Н, дублет дубл. J2 HAHB=15,7 Гц; J3 HACH=5,4 Гц СНAНB); 2,58 (1Н, дублет дубл. J2 HAHB=15,7 Гц; J3 HACH=7,4 Гц СНAHB); 4,2 м.д. (1Н, дублет дубл. J3 CHHA=5,4 Гц; J3 CHHB=7,4 (1Н, с, СН-Ру).
Пример 2. Геропротекторное действие соединения 1 на примере ингибирования фотоиндуцированной липофусциновыми гранулами человека пероксидации липосом.
Липосомы приготавливали из метанольного раствора кардиолипина (исходная концентрация 5 мг/мл) путем выпаривания метанола и солюбилизации кардиолипина в фосфатном буфере. Смесь, содержащую суспензию липосом и липофусциновых гранул, выделенных из ткани ретинального пигментного эпителия глаза человека, подвергали облучению интенсивным синим светом при постоянном перемешивании. Через 20, 40, 60 и 90 мин определяли концентрацию продуктов пероксидации липидов (ТБК-активных продуктов). Опытная проба содержала либо 2 мМ раствор соединения «в», либо 2 мМ раствор мексидола. Результаты эксперимента приведены в таблице 1.
Таблица 1
Ингибирующее действие соединения «в» (в сравнении с мексидолом) на индуцированную липофусцином фотопероксидацию кардиолипина |
| Время облучения, мин |
Концентрация ТБК-активных продуктов, нмоль/мг липида |
Ингибирование, % |
| Контроль |
Соединение «в» |
Мексидол |
Соединение «в» |
Мексидол |
| 0 |
1,83 |
1.83 |
1,83 |
0 |
0 |
| 20 |
3,0 |
2,42 |
2,84 |
20 |
5 |
| 40 |
3,5 |
2,53 |
3,5 |
28 |
0 |
| 60 |
4,52 |
2,85 |
4,5 |
40 |
0 |
| 90 |
5,38 |
3,28 |
5,0 |
40 |
7 |
Результаты свидетельствуют о защитном эффекте соединения «в» в отношении фототоксического действия старческого пигмента – липофусциновых гранул глаза человека. Мексидол в этих условиях практически не оказывал ингибирующего действия.
Пример 3. Антиоксидантное действие соединения 1 на индуцированную аскорбатом пероксидацию фоторецепторных клеток глаза свиньи.
Наружные сегменты фоторецепторных клеток получали из сетчаток глаза свиньи по стандартной методике, используя методы дифференциального центрифугирования в градиенте плотности сахарозы. Смесь, содержащую натрий-фосфатный буфер (рН 7.3), 108 сегментов/мл наружных сегментов фоторецепторных клеток, 0.5 мМ аскорбиновую кислоту и 17 мМ соединения 1в, инкубировали в темноте при постоянном перемешивании в течение 15 и 30 минут. Затем процесс останавливали 15% трихлоруксусной кислотой и определяли концентрацию ТБК-активных продуктов. Контролем служили пробы без добавления соединения «в». Полученные результаты представлены в таблице 2а.
Таблица 2а
Ингибирующее действие соединения «в» на аскорбатиндуцированную пероксидацию наружных сегментов фоторецепторных клеток. |
| Время реакции, мин |
Концентрация ТБК-активных продуктов, относит. единицы |
Ингибирование, % |
| контроль |
Соединение «в» |
| 0 |
1 |
1 |
– |
| 15 |
4,37 |
2,70 |
49,6 |
| 30 |
7,04 |
5,09 |
32,3 |
Сравнение антиоксидантной активности соединений «а», «б», «в» и «г» приведены в таблице 2б. В этих экспериментах проведено сравнение скорости аскорбатиндуцированной пероксидации наружных сегментов фоторецепторных клеток глаза свиньи, измеренное по накоплению ТБК-активных продуктов, в присутствии различных солей соединения I.
Таблица 2б
Сравнение ингибирующего действия соединений «а», «б», «в», «г» на аскорбатиндуцированную пероксидацию наружных сегментов фото-рецепторных клеток. |
| Соединение I, концентрация в мМ |
Скорость накопления ТБК-активных продуктов за 30 мин реакции, нмоль/мг |
Ингибирование, % |
| Контроль, 0 мМ |
0,77 |
– |
| Соединение «а», 44 мМ |
0 |
100 |
| Соединение «б», 44 мМ |
0,23 |
70 |
| Соединение «в», 43 мМ |
0,05 |
93,5 |
| Соединение «г», 43 мМ |
0,1 |
87 |
Результаты свидетельствуют о том, что все соли соединения I проявляют выраженную антиоксидантную активность в отношении темновой пероксидации фоторецепторных клеток глаза.
Пример 4. Определение антирадикальной активности соединения 1в в сравнение с мексидолом.
Эффективность производных 3-гидроксипиридина как ингибиторов свободно радикальных реакций была оценена хемилюминесцентным методом посредством измерения констант скорости их реакции с перекисными радикалами этилбензола k7.
Измерения интенсивности хемилюминесценции (ХЛ) проводили на установке СНК-7, разработанной и изготовленной в ИХФ РАН СССР. В качестве приемника света использовали фотоумножитель ФЭУ-38. Стационарная концентрация радикалов в процессе окисления кумола обеспечивалась инициатором азо-бис-изобутиронитрилом.
Для усиления свечения ХЛ использовали активатор хелат Eu (тристеноил трифторацетонат европия с 1,10-фенатролином), что позволило проводить измерения при низких значениях скорости инициирования радикалов (W1=10-8·10-9 моль/л.с) и, следовательно, малых добавках препарата. Навеску исследуемых образцов растворяли в подходящем растворителе (хлорбензоле или ацетонитриле), затем небольшое количество приготовленного раствора (0,1-0,25 мл) вводили в реакционную смесь (5-6 мл), помещенную в термостатируемый реакционный сосуд ХЛ-установки, и регистрировали изменение интенсивности свечения. Полученные результаты приведены в таблице 3.
Таблица 3
Антирадикальная активность р-оксипроизводных азотистых гетероциклов относительно перекисных радикалов этилбензола |
| Соединение |
К7×10-4 л/моль × с |
| Мексидол |
4,5 |
| Соединение Iв |
9,5 |
Сравнительная оценка по антирадикальной активности соединения 1 и мексидола показала, что первый проявляет в два раза более высокую антирадикальную активность.
Пример 5. Исследование влияния соединения «в» на размеры зон ишемии некроза при острой ишемии миокарда.
Эксперименты поставлены на нелинейных крысах самцах массой 250-300 г, наркотизированных этаминалом натрия (40 мг/кг внутрибрюшинно). У животных, переведенных на управляемое дыхание, моделировали инфаркт миокарда перевязкой нисходящей ветви левой коронарной артерии на уровне нижнего края ушка предсердия.
Размеры зоны некроза и зоны ишемии определяли через 4 часа после окклюзии коронарной артерии дифференциальным индикаторным методом, принцип которого основан на раздельном количественном определении синьки Эванса (индикатор зоны ишемии) и красного формазана (индикатор зоны некроза).
Таблица 4
Противоишемическая активность соединения «в» в сравнении с другими производными 3-оксипиридина (через 4 часа после окклюзии коронарной артерии у крыс). |
| Условия опыта |
Доза, мг/кг |
Число животных |
Отношение зоны некроза к общей массе миокарда (%) |
Отношение зоны некроза к зоне ишемии (%) |
| Контроль |
– |
17 |
22±2.0 |
68±4.3 |
| Соединение 1 |
16 |
7 |
4±2.3 |
11±3.3 |
| Эмоксипин |
26 |
8 |
9±2.4 |
32±4.6 |
| Мексидол |
26 |
8 |
8±1.4 |
46±5.6 |
| Никорандил |
12 |
8 |
10±1.6 |
42±5.4 |
Видно, что соединение «в» проявляет значительно более высокую противоишемическую активность по сравнению с другими 3-оксипиридинами.
Пример 6. Исследование местно раздражающего действия соединения «в» на ткани глаза.
Экспериментальные исследования выполнены на шести кроликах. Всем животным однократно произведены инстилляции 1% раствора соединения 1 в правый глаз и 1% раствора эмоксипина в левый глаз. Через 1 минуту после закапывания капель проводили осмотр переднего отрезка глаза методом фокального освещения при помощи лупы в 20Д. Результаты показали, что:
На правых глазах животных реакции со стороны конъюнктивы век и глазного яблока роговой оболочки не обнаружено.
На левых глазах 4 животных наблюдалась выраженная конъюнктивальная инъекция глазного яблока и гиперемия конъюнктивы нижнего века, у двух остальных животных имела место умеренная конъюнктивальная инъекция глаза.
Результаты, таким образом, показывают, что заявляемое соединение I обладает антиоксидантной, геропротекторой и противоишемической активностями и не проявляют местнораздражающего действия на ткани глаза.
Сравнительная оценка антиоксидантных, антирадикальных геропротекторных и противоишемических свойств соединения «в» и широко используемых в медицинской практике препаратов мексидола и эмоксипина свидетельствует о значительно большей эффективности и меньшей токсичности предлагаемого препарата, а также о перспективности его применения в офтальмологической и кардиологической практике и других областях медицины.
Формула изобретения
1. Фармацевтически приемлемые соли 2,4,6-триметил-3-гидроксипиридина с низшими дикарбоновыми кислотами, общей формулы 1а-г, обладающие антиоксидантной активностью,
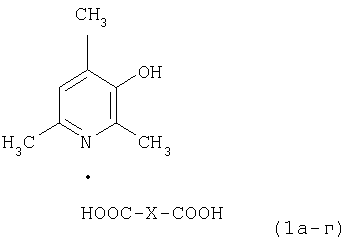
при X, равном простой связи (соединение 1а, оксалат, C8H11NO·C2H2O4) при X, равном СН2 (соединение 1б, малонат, C8H11NO·C3H4O4); при X, равном СН2СН2 (соединение 1в, сукцинат, С8Н11NO·С4Н6O4); при X, равном группе СН2СН(ОН), (соединение 1г, малат, C8H11NO·C4H6O5).
2. Фармацевтически приемлемая соль формулы 1в, как указано в п.1, обладающая геропротекторной и противоишемической активностями.
3. Способ получения солей по п.1, заключающийся в том, что осуществляют взаимодействие эквимолекулярных количеств 2,4,6-триметил-3-гидроксипиридина с дикарбоновой кислотой в растворе низшего спирта при кипячении с последующей обработкой реакционной массы органическим растворителем и, при необходимости, выдержкой в течение 2-5 ч при 10-15°С.
|
|