|
|
(21), (22) Заявка: 2003115092/04, 21.11.2001
(24) Дата начала отсчета срока действия патента:
21.11.2001
(30) Конвенционный приоритет:
22.11.2000 JP 2000-356146
22.12.2000 JP 2000-390321
(43) Дата публикации заявки: 10.12.2004
(45) Опубликовано: 10.05.2006
(56) Список документов, цитированных в отчете о
поиске:
WO 00/39111 A1, 06.07.2000. WO 99/00127 A1, 07.01.1999. RU 2148585 C1, 10.05.2000.
(85) Дата перевода заявки PCT на национальную фазу:
21.05.2003
(86) Заявка PCT:
JP 01/10176 (21.11.2001)
(87) Публикация PCT:
WO 02/42270 (30.05.2002)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ИСИХАРА Цукаса (JP),
ХИРАЯМА Фукуси (JP),
СУГАСАВА Кейзо (JP),
КОГА Юдзи (JP),
КАДОКУРА Такеси (JP),
СИГЕНАГА Такеси (JP)
(73) Патентообладатель(и):
АСТЕЛЛАС ФАРМА ИНК. (JP)
|
(54) ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ БЕНЗОЛА ИЛИ ИХ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ
(57) Реферат:
Описывается производное бензола формулы (I) или его соль
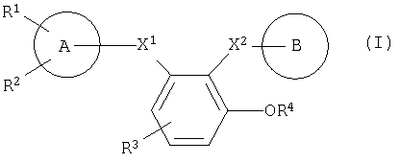
где X1 обозначает -C(=O)-NR5-, -NR5-С(=O)-; X2 обозначает -NR6-C(=O)-, -NR6-СН2-; R1 – атом галогена, низший алкил или низшая алкоксигруппа; R2 и R3 – атом водорода или галогена; R4 – атом водорода, -SO3Н- или остаток сахара; кольцо А – кольцо бензола или пиридина; кольцо В – кольцо пиперидина, а также фармацевтическая композиция на его основе. Предложенные соединения обладают антикоагулирующим действием, основанным на ингибировании актированного фактора Х коагуляции крови, и полезны в качестве антикоагулянтов или профилактических агентов против болезней, вызываемых тромбозом или эмболией. 2 н. и 3 з.п. ф-лы, 9 табл.
Область изобретения
Данное изобретение относится к новому замещенному производному бензола или его соли, которые применимы в качестве фармацевтического агента, в частности в качестве ингибитора активированного фактора Х коагуляции крови, и также к фармацевтическому агенту с таким же действием.
Предпосылки к созданию изобретения
В связи с изменением стиля жизни Европы и Америки и увеличением популяций пожилых людей в последние годы число пациентов с тромбоэмболическими заболеваниями, включая инфаркт миокарда, церебральный тромбоз и периферический артериальный тромбоз, растет из года в год и социальная значимость их лечения возрастает все больше и больше. Наряду с фибринолитической терапией и антитромбоцитарной терапией, антикоагулирующая терапия является частью медицинской терапии в профилактике и лечении тромбоза (Sogo Rinsho, 41; 2141-2145, 1989). В частности, безопасность, которая должна противостоять продолжительному введению, и точная и правильная экспрессия антикоагулирующей активности являются существенными в профилактике тромбоза. Варфарин калия часто используют в мире в качестве единственного орального антикоагулянта, но это лекарство чрезвычайно трудно применять клинически, потому что трудно контролировать антикоагулирующую способность из-за характерных особенностей механизма его действия (J.Clinical Pharmacology, 32, 196-209, 1992 и N. Eng. J. Med., 324(26), 1865-1875, 1991), поэтому большое внимание направлено на разработку более полезных и легко применимых антикоагулянтов.
Тромбин контролирует превращение фибриногена в фибрин, что является конечной стадией коагуляции, и также глубоко вовлекается в активацию и агрегацию тромбоцитов (“T-PA and Pro-UK”, издано S.Matsuo, опубликовано Gakusai, Kikaku pp. 5-40 “Blood Coagulation”, 1986), а его ингибитор является главным объектом исследований антикоагулянтов как цель разработки фармацевтических средств. Однако ингибиторы тромбина, которые можно было бы вводить орально, до сир пор не поступали на рынок из-за их низкой биодоступности при оральном введении и проблем, связанных с их безопасностью (Biomed. Biochim. Acta, 44, 1201-1210, 1985).
Активированный фактор Х коагуляции крови является ключевым ферментом, который локализуется в точке соединения каскада главных и альтернативных реакций коагуляции и локализуется выше по ходу каскада по отношению к тромбину, поэтому существует вероятность того, что ингибирование этого фактора является более эффективным, чем ингибирование тромбина, и что такой ингибитор может ингибировать эту систему коагуляции специфическим образом (THROMBOSIS RESEARCH (19), 339-349, 1980).
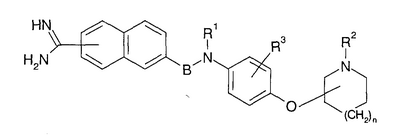
В качестве соединений, обладающих ингибирующим действием на активированный фактор Х коагуляции крови, известны производные амидинонафтил-алкилбензола или их соли (Japanese Patent Laid-Open № 208946/1993; Thrombosis Haemostasis, 71(3), 314-319, 1994, и Thrombosis Haemostasis, 72(3), 393-396, 1994).
В WO 96/16940 упоминается, что амидинонафтил-производное, представленное следующей формулой, или его соль является соединением, обладающим ингибирующим действием на активированный фактор Х коагуляции крови:
(символы формулы смотри в указанной публикации).
В WO 99/00121, WO 99/00126, WO 99/00127, WO 99/00128, WO 00/39111, WO 00/39117 и WO 00/39118 соединения фенилендиамина, представленные следующей формулой, и т.п. упоминаются как ингибитор фактора Ха:
(символы формулы смотри в указанных публикациях).
Далее, в WO 99/32477 в качестве антикоагулянта упоминается широкий диапазон соединений, представленных следующей формулой:
(символы формулы смотри в указанной публикации).
В антикоагулирующей терапии ингибитор активированного фактора Х коагуляции крови, как предполагается, должен ингибировать систему коагуляции эффективно и специфически по сравнению с ингибитором тромбина. Соответственно, есть насущная потребность создания селективного ингибитора активированного фактора Х коагуляции крови, который имеет химическую структуру, отличающуюся от указанных выше известных соединений, и который пригоден для орального введения и к тому же обладает превосходным действием.
Описание изобретения
В результате разнообразных исследований обнаружено, что замещенное производное бензола, представленное следующей формулой (I), или его соль, имеющие характерные особенности химической структуры, заключающиеся в том, что кольцо бензола или гетерокольцо (кольцо А) связано с кольцом бензола посредством амидной связи (Х1), и т.п., указанное кольцо бензола дополнительно связано с кольцом пиперидина или с кольцом бензола (кольцо В) посредством амидной связи (Х2), и т.п., центральное кольцо бензола всегда имеет -OR4 (-OH, -O-SO3H или -О- остаток сахара) и R1 всегда имеет заместитель иной, чем атом водорода (атом галогена, низший алкил, который может быть замещен атомом галогена, или низшую алкоксигруппу, которая может быть замещена атомом галогена), обладает превосходным ингибирующим действием на активированный фактор Х коагуляции крови и, в частности, имеет превосходную активность при оральном введении, посредством чего и было создано данное изобретение.
Таким образом, данное изобретение относится к замещенному производному бензола, представленному следующей формулой (I), или его соли и также к фармацевтической композиции, содержащей его в качестве активного ингредиента, особенно к ингибитору активированного фактора Х коагуляции крови:
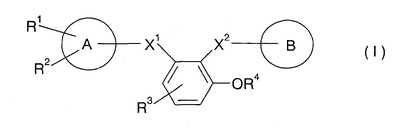
Символы в указанной формуле имеют следующие значения:
Х1: -C(=O)-NR5-, -NR5-C(=O)-, -СН2-NR5– или -NR5-СН2-;
Х2: -C(=O)-NR6-, -NR6-C(=O)-, -СН2-NR6– или -NR6-СН2-;
R1: атом галогена, низший алкил, который может быть замещен атомом галогена, или низшая алкоксигруппа, которая может быть замещена атомом галогена;
R2 и R3: одинаковые или разные и каждый из которых означает атом водорода, атом галогена, CN, -NH-SO2-(низший алкил), -NH-CO-(низший алкил), -CO-(низший алкил), -CO-(низшую алкоксигруппу), -СО-NH2, низший алкил, который может быть замещен атомом галогена, или низшую алкоксигруппу, которая может быть замещена атомом галогена, или -S-(низший алкил);
R4: атом водорода, -SO3Н- или остаток сахара;
кольцо А: кольцо бензола или пяти- или шестичленное гетерокольцо, содержащее от 1 до 4 гетероатомов, которые выбраны из группы, состоящей из N, S и О;
кольцо В: кольцо пиперидина, где атом азота замещен R7, когда R4 означает атом водорода или -SO3Н-, либо когда R4 означает остаток сахара, это кольцо пиперидина, где атом азота
замещен R7, или кольцо бензола, замещенное
R5 и R6: одинаковые или разные и каждый означает атом водорода или низший алкил;
R7 и R8 каждый означает атом водорода, низший алкил, -SO2-(низший алкил) или пяти- или шестичленное гетерокольцо, содержащее от 1 до 4 гетероатомов, которые выбраны из группы, состоящей из N, S и О,
при условии, что, когда Х2 означает -NR6-C(=O)- и R4 означает атом водорода, кольцо А означает пяти- или шестичленное гетерокольцо, содержащее от 1 до 4 гетероатомов, которые выбраны из группы, состоящей из N, S и О.
Соединение (I) по данному изобретению имеет структуру, отличающуюся от раскрытой в Japanese Patent Laid-Open № 208946/1993 и в WO 96/16940 в том отношении, что кольцо А означает кольцо бензола или гетерокольцо, не имеющее амидинонафтилгруппы, и часть молекулы X2 означает -C(=0)-NR6-, -NR6-C(=O)-, -CH2-NR6– или -NR6-CH2-, не имеющую простой эфирной связи и т.д.
Далее, соединение (I) по данному изобретению имеет структуру, отличающуюся от WO 99/00121, WO 99/00126, WO 99/00127, WO 99/00128, WO 00/39111, WO 00/39117 и WO 00/39118 в том отношении, что R4 всегда имеет атом водорода, -SO3H или остаток сахара, кольцо B имеет кольцо пиперидина, в котором атом азота замещен R7, или кольцо бензола, замещенное группой
и т.п.
Кроме того, соединение (I) по данному изобретению имеет структуру, отличающуюся от соединений, конкретно описанных в WO 99/32477, в том отношении, что кольцо В не имеет кольца триазола, R4 всегда имеет атом водорода, -SO3H или остаток сахара и т.п.
Здесь далее соединение (I) по данному изобретению будет пояснено подробно.
Термин “низший” в определении формулы в описании означает линейную или разветвленную углеродную цепь, имеющую 1-6 атомов углерода, если не указано иначе. Поэтому примерами “низшего алкила” являются метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, 1-метилбутил, 2-метилбутил, 1,2-диметилпропил, гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил. Из них предпочтительны те, которые имеют 1-3 атома углерода, и особенно предпочтительны метил и этил. “Низшая алкоксигруппа” означает “-O-(низший алкил)” и, более конкретно, ее примерами могут быть метокси, этокси, пропокси и изопропокси, хотя они не являются ограничительными. Метокси и этокси предпочтительны.
Примерами “атома галогена” являются атом фтора, атом хлора, атом брома и атом йода. Особенно предпочтительны атом хлора и атом брома.
“Низший алкил, который может быть замещен атомом галогена” или “низшая алкоксигруппа, которая может быть замещена атомом галогена” означают указанный “низший алкил” или “низшую алкоксигруппу”, где от 1 до 6 атомов углерода замещено “атомами галогена”, и их примерами являются трифторметил, дифторметил, фторметил, хлорметил, 2-хлорэтил, 2-бромэтил и трифторметокси, дифторметокси, фторметокси, хлорметокси и т.д., хотя они не являются ограничительными. Фторметил и фторметокси особенно предпочтительны.
“Остаток сахара” означает сахарный остаток моносахарида. Например, остатками сахара является то, что остается после удаления одной гидроксильной группы, особенно при положении 1, из сахара, такого как глюкоза, манноза, галактоза, арабиноза, ксилоза, рибоза, N-ацетилглюкозамин, глюкуроновая кислота, маннуроновая кислота и т.д., хотя они не являются ограничительными, но включены также остатки сахара, где указанная гидроксильная группа замещена низшей алкоксигруппой, или тому подобное. Предпочтителен остаток сахара от глюкуроновой кислоты.
Что касается “пяти- или шестичленного гетерокольца, содержащего от 1 до 4 гетероатомов, которые могут быть выбраны из группы, состоящей из N, S и O”, его примерами являются пиридин, пиримидин, пиразин, пиридазин, триазин, пиррол, фуран, тиофен, тиазол, имидазол, имидазолин, оксазол, изотиазол, пиразол, изоксазол, триазол и тетразол, хотя они не являются ограничительными. Указанное гетерокольцо не ограничивается ненасыщенным кольцом, но включает насыщенное кольцо, такое как пирролидин, имидазолидин, пиразолидин, пиперидин, пиперазин и морфолин. Может быть также включено гетерокольцо, конденсированное с кольцом бензола, такое как хинолин, изохинолин, хиноксалин и бензимидазол. Особенно предпочтительно кольцо пиридина. Когда указанным гетерокольцом является фуран или тиофен и R1 означает 2-хлор или 2-метил, X1 находится при положении, ином, чем 5, фурана или тиофена.
X1 означает -C(=O)-NR5-, -NR5-C(=O)-, -CH2-NR5– или -NR5-CH2– и более предпочтительны -C(=O)-NR5– или -NR5-C (=О)-, X2 означает -C(=O)-NR6-, -NR6-C(=O)-, -CH2-NR6– или -NR6-CH2– и более предпочтительны -NR6-C(=O)- или -NR6-CH2-.
R5 и R6 являются одинаковыми или разными и каждый означает атом водорода или низший алкил и более предпочтительным является атом водорода. Когда оба R7 и R8 означают низшие алкилы, особенно предпочтительно, когда они – изопропилы, хотя, когда они являются гетерокольцами, то они предпочтительно кольца пиридина.
Предпочтительно, чтобы кольцо А было кольцом бензола или кольцом пиридина.
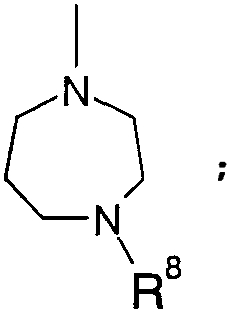
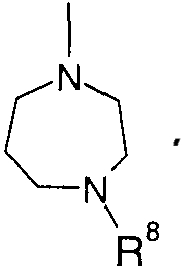
Когда R4 означает атом водорода или -SO3H, кольцо B означает кольцо пиперидина, где атом азота замещен R7, например
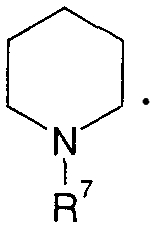
Когда R4 означает остаток сахара, кольцо В означает кольцо пиперидина, где атом азота замещен R7, или кольцо бензола; замещенное

(кольцо бензола, замещенное группой 1,4-диазепан-1-ил, где атом азота замещен R8), например
Особенно предпочтительными соединениями среди соединений по данному изобретению являются:
4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′- -D-галактопиранозилокси-1-изопропилпиперидин-4-карбоксанилид, -D-галактопиранозилокси-1-изопропилпиперидин-4-карбоксанилид,
2′-(2-ацетамидо-2-дезокси- -D-глюкопиранозилокси)-4′-бром-6′-[(5-хлор-2-пиридил)карбамоил]-1-изопропилпиперидин-4-карбоксанилид, -D-глюкопиранозилокси)-4′-бром-6′-[(5-хлор-2-пиридил)карбамоил]-1-изопропилпиперидин-4-карбоксанилид,
4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′- -D-глюкопиранозилокси-1-изопропилпиперидин-4-карбоксанилид, -D-глюкопиранозилокси-1-изопропилпиперидин-4-карбоксанилид,
5-хлор-3-[(5-хлор-2-пиридил)карбамоил]-2-[(1-изопропилпиперидин-4-карбонил)амино]фенил- -D-глюкопиранозид уроновая кислота, -D-глюкопиранозид уроновая кислота,
5-бром-3-[(5-хлор-2-пиридил)карбамоил]-2-[(1-изопропилпиперидин-4-карбонил)амино]фенил- -D-глюкопиранозид уроновая кислота, -D-глюкопиранозид уроновая кислота,
4′-хлор-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид,
4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид,
2′-[(5-бром-2-пиридил)карбамоил]-4′-хлор-6′-гидрокси-1-
изопропилпиперидин-4-карбоксанилид,
5-хлор-N-(5-хлор-2-пиридил)-3-гидрокси-2-{[(1-изопропил-4-
пиперидил)метил]амино}бензамид,
N-(5-бром-2-пиридил)-5-хлор-3-гидрокси-2-{[(1-изопропил-4-
пиперидил)метил]амино}бензамид,
3-[(4-метоксибензоил)амино]-2-{[(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил- -D-глюкопиранозид, -D-глюкопиранозид,
3-[(4-метоксибензоил)амино]-2-{[4-(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил- -D-глюкопиранозид уроновая кислота, и т.д. -D-глюкопиранозид уроновая кислота, и т.д.
Соединение по данному изобретению включает различные стереоизомеры, такие как геометрические изомеры, таутомеры и оптические изомеры, либо как их смеси, либо в их изолированных формах.
Соединение по данному изобретению может быть в форме аддитивной соли с кислотой. Дополнительно оно может образовывать соль с основанием в зависимости от типа заместителя. Конкретными примерами такой соли являются аддитивные соли с минеральной кислотой, такой как хлороводородная кислота, бромоводородная кислота, йодоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, или с органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота и этансульфоновая кислота, или с аминокислотой кислотного характера, такой как аспарагиновая кислота и глутаминовая кислота, и соли с неорганическим основанием, таким как основания натрия, калия, магния, кальция и алюминия, с органическим основанием, таким как метиламин, этиламин и этаноламин, с аминокислотой основного характера, такой как лизин и орнитин, и с солью аммония.
Дополнительно в объем данного изобретения включены гидраты, фармацевтически приемлемые различные сольваты и полиморфы соединения по данному изобретению. Кроме того, само собой разумеется, что данное изобретение не ограничивается соединениями, указанными в следующих примерах, но включает все замещенные производные бензола, представленные формулой (I), и их фармацевтически приемлемые соли.
Более того, соединение по данному изобретению включает все так называемые пролекарства, т.е. соединения, которые могут быть превращены в соединение, представленное формулой (I), или в его соль, путем метаболизма in vivo. Примерами группы, которая образует пролекарства соединения по данному изобретению, являются те, которые упомянуты в Prog. Med. 5: 2157-2161 (1985), и те, которые упомянуты в “ïyakuhin no Kaihatsu” (Development of Pharmaceuticals), опубликованной Hirokawa Shoten в 1990, Vol.7, “Molecular Design”, страницы 163-198. В частности, в качестве пролекарства соединения по данному изобретению может быть такое пролекарство, когда пролекарство, имеющее гидроксильную группу, подвергается метаболизму in vivo с образованием гликозида, представленного формулой (I), и такое пролекарство также входит в объем данного изобретения.
Кроме того, данное изобретение, конечно, включает гликозид, представленный формулой (I), который образуется в результате метаболизма in vivo.
Способы получения
Типичные способы получения соединения по данному изобретению будут пояснены далее ниже.
В случае соединения по данному изобретению (I), где R4 означает атом водорода, оно может быть получено следующим способом:
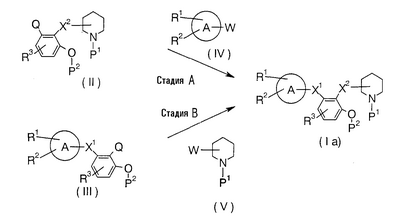
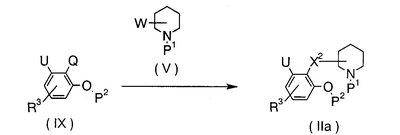
В формулах кольцо А, Х1, Х2, R1, R2 и R3 имеют указанные выше значения; Q и W являются такими, что, когда Q означает NH2 или -NH-(низший алкил), W означает уходящую группу -СООН, -СНО или -СН2-, тогда как, когда Q означает уходящую группу -СООН, -СНО или -СН2-, W означает NH2 или -NH-(низший алкил); Р1 означает атом водорода, низший алкил или защитную группу для амина; Р2 означает атом водорода или защитную группу для фенола; и примерами уходящей группы являются атом водорода, -O-SO2-алкил и -O-SO2-арил.
Стадия А
Для синтеза соединения (Ia) используют взаимодействие соединения (II) с соединением (IV), где происходит реакция конденсации карбоновой кислоты с амином, альдегида с амином или соединения, имеющего уходящую -СН2-группу, с амином.
В случае взаимодействия карбоновой кислоты с амином данная реакция предпочтительно соответствует обычной реакции ацилирования в присутствии агента конденсации для формирования амидной связи.
Примерами конденсирующего агента, который предпочтителен для использования, являются N,N-дициклогексилкарбодиимид (DCC), 1-этил-3-[3-(N,N-диметиламино)пропил]карбодиимид, карбонилдиимидазол, дифенилфосфорилазид (DPPA) и диэтилфосфорил-цианид.
Возможно также, что карбоновую кислоту превращают в активные производные соответствующей карбоновой кислоты и затем конденсируют с амином.
Примерами активного производного карбоновой кислоты являются активный сложный эфир, полученный взаимодействием соединения фенольного типа, такого как п-нитрофенол, или типа N-гидроксиамина, такого как 1-гидроксисукцинимид и 1-гидроксибензотриазол, моноалкиловый сложный эфир карбоновой кислоты, смешанный кислотный ангидрид, полученный взаимодействием с органической кислотой, и смешанный кислотный ангидрид типа фосфорной кислоты, полученный взаимодействием с дифенилфосфорилхлоридом и N-метилморфолином; азид кислоты, полученный взаимодействием сложного эфира с гидразином и алкилнитритом; галогенангидриды кислот, такие как хлорангидрид кислоты и бромангидрид кислоты, и ангидрид кислоты симметричного типа. Обычно указанную реакцию проводят в растворителе с охлаждением или при комнатной температуре, хотя в некоторых случаях она может быть проведена в безводных условиях в зависимости от типа реакции ацилирования.
Примерами применимого растворителя являются инертные растворители, которые не принимают участия в реакции, такие как диметилформамид, диоксан, тетрагидрофуран, простой эфир, дихлорэтан, дихлорметан, хлороформ, четыреххлористый углерод, диметоксиметан, диметоксиэтан, этилацетат, бензин, ацетонитрил, диметилсульфоксид, этанол, метанол и вода и смесь таких растворителей, и предпочтителен подходящий подбор в зависимости от применяемого способа.
Кроме того, в зависимости от применяемого способа существуют некоторые случаи, когда реакция протекает гладко в присутствии основания или при использовании такого основания в качестве растворителя, где основанием является N-метилморфолин, триэтиламин, триметиламин, пиридин, гидрид натрия, трет-бутоксид калия, бутиллитий, амид натрия, карбонат калия, карбонат натрия, гидрокарбонат натрия, карбонат цезия или тому подобное.
Помимо указанных выше, могут быть использованы любые реакции, формирующие амидную связь.
В случае взаимодействия альдегида и амина, реакция может быть проведена обычно согласно реакции восстановительного аминирования в присутствии восстановителя.
В качестве подходящего восстановителя могут быть использованы боргидрид натрия, цианоборгидрид натрия, триацетоксиборгидрид натрия, комплекс боран-триметиламин и тому подобное. Дополнительно, каталитическое гидрирование может быть проведено при атмосферном давлении или при пониженном давлении в присутствии катализатора, такого как палладий-углерод и оксид платины. Реакцию проводят при охлаждении или при нагревании в спирте или в растворителе, который не принимает участия в реакции. В дополнение, в зависимости от применяемого способа, существуют некоторые случаи, когда реакция гладко протекает в присутствии кислоты, такой как уксусная кислота, толуолсульфоновая кислота и серная кислота, или при использовании такой кислоты в качестве растворителя.
В случае взаимодействия соединения, содержащего уходящую СН2-группу, и амина реакция может быть проведена согласно обычной реакции N-алкилирования.
Реакцию проводят при охлаждении или при нагревании в растворителе, который не принимает участия в реакции. В дополнение, в зависимости от применяемого способа существуют некоторые случаи, когда реакция гладко протекает в присутствии основания, как описано выше, или при использовании такого основания в качестве растворителя.
Стадия В
Для синтеза соединения (Ia) используют взаимодействие соединения (III) и соединения (V), где происходит реакция карбоновой кислоты с амином, альдегида с амином или соединения, имеющего уходящую -СН2-группу, с амином. Эту реакцию проводят таким же образом, как на стадии А.
Когда Р1 в соединении (Ia) по данному изобретению является защитной группой для амина и защитную группу не отщепляют во время стадий А и В, отщепление с использованием способа, подходящего для отщепления защитной группы Р1, например отщепление кислотой, такой как трифторуксусная, или отщепление восстановительным присоединением каталитического водорода, проводят тогда, когда это возможно, чтобы получить соединение (I) по данному изобретению, где R1 означает атом водорода. Далее, когда Р2 соединения (Ia) по данному изобретению является защитной группой для фенола и защитную группу не отщепляют во время стадий А и В, отщепление с использованием способа, подходящего для отщепления защитной группы Р2, такого как отщепление восстановительным присоединением каталитического водорода, отщепление пентаметилбензолом и трифторуксусной кислотой или отщепление гидролизом с использованием основания, такого как гидроксид натрия, проводят тогда, когда это возможно, чтобы получить соединение (I) по данному изобретению, где R4 означает атом водорода.
Что касается защитной группы для амина, приводимой в качестве примера для Р1, нет конкретного ограничения до тех пор, пока она является группой, которую обычно используют для защиты амина, и ее примерами являются низший алкоксикарбонил, аралкилоксикарбонил, ацил, низший алкил, аралкил и сульфонил или тому подобное.
Что касается защитной группы для фенола, приводимой в качестве примера для Р2, нет конкретного ограничения до тех пор, пока она является группой, которую обычно используют для защиты фенола, и ее примерами являются необязательно замещенный низший алкил, аралкил, три(низший алкил)силил, низший алкилкарбонил, низший алкилоксикарбонил и сульфонил. «Аралкил» означает группу, где атом водорода указанного алкила замещен арилом, и его конкретными примерами являются бензил и фенилэтил. Конкретными примерами «ацила» являются формил, ацетил, пропионил и бутирил.
Далее способ, который показан следующими схемами реакции, представлен в качестве примера особенно эффективного способа:
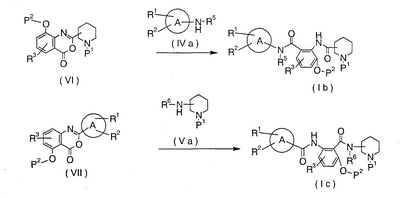
В формулах кольцо А, Р1, Р2, R1, R2, R3, R5 и R6 имеют указанные выше значения.
Это реакция, где амидную связь получают путем взаимодействия соединения (VI) с амином (IVa) или соединения (VII) с амином (Va), чтобы получить соединение (Ib) или соединение (Ic), и ее проводят в указанном выше растворителе, который не принимает участия в реакции, при комнатной температуре или при нагревании. В дополнение, в зависимости от применяемого способа есть некоторые случаи, когда реакция протекает гладко в присутствии основания или при использовании такого основания в качестве растворителя, где основанием является N-метилморфолин, триэтиламин, триметиламин, пиридин, гидрид натрия, трет-бутоксид калия, бутиллитий, амид натрия или тому подобное.
Когда используют соединение (I) по данному изобретению, где R4 означает атом водорода, и превращают его в сульфоновую кислоту, используя комплекс триметиламин-триоксид серы или тому подобное, возможно получить соединение (I) по данному изобретению, где R4 означает -SO3H.
Соединение (I) по данному изобретению, где R4 означает остаток сахара, может быть получено следующим способом с использованием соединения, где R4 означает атом водорода, или соединения, которое может быть синтезировано известным способом, описанным в патентных публикациях, цитированных в разделе «Предпосылки к созданию изобретения».
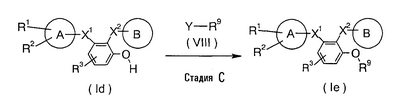
В формулах кольцо А, кольцо В, R1, R2, R3, Х1 и Х2 имеют указанные выше значения; Y означает уходящую группу и R9 означает остаток сахара, который может быть защищенным.
Стадия С
Это реакция, где содержащую донор сахара и фенол комбинацию соединения (Id) и соединения (VIII) приводят во взаимодействие предпочтительно в присутствии активатора, чтобы синтезировать соединение (Ie), имеющее остаток сахара, который может иметь защитную группу. Эта реакция может следовать общим способам получения гликозидов. Примерами способа являются те, которые описаны в Yuki Gosei Kagaku Kyokai Shi. vol. 50, № 5 (1992), стр. 378-390 и в “Jikken Kagaku Koza”, vol. 26, ‘Yuki Gosei’ VIII, страницы 267-354, опубликовано в 1992 Maruzen.
Примерами донора сахара являются производные сахара, имеющие уходящую группу в положении 1 сахара. Примерами уходящей группы являются галоген, тиоалкил, тиогертероарил, ацилокси, трихлорацетимидат, диарил-фосфат, имидат диариофосфина, тетраметилфосфорамидат и диалкил-фосфит.
Примерами используемого агента конденсации являются карбонат серебра, трифторметансульфонат серебра, перхлорат серебра, оксид серебра, гидроксид натрия, карбонат калия, метоксид натрия, гидрид натрия, диазабициклоундецен, триметилсилил-трифлат, трифторид бора, метилтрифлат, тетрафторид кремния, хлорид олова, п-толуолсульфоновая кислота и ее соль, ангидрид трифторметансульфоновой кислоты, бромид меди, бромид ртути и N-бромсукцинимид.
Возможно также использовать донор сахара, имеющий, например, гидроксильную группу в положении 1, тогда применяют такой активатор, как трифенилфосфин, диэтил-азодикарбоксилат и т.п.
Обычно указанную реакцию проводят в растворителе в условиях от охлаждения до нагревания. В зависимости от типа реакции получения гликозида существуют некоторые случаи, когда реакцию следует проводить в безводных условиях.
Что касается растворителя, может быть использован инертный растворитель, который не принимает участия в реакции, такой как диметилформамид, диоксан, тетрагидрофуран, простой эфир, дихлорэтан, дихлорметан, хлороформ, тетрахлорид углерода, диметоксиметан, диметоксиэтан, этилацетат, бензин, толуол, ацетонитрил, диметилсульфоксид, метанол, этанол и т.п. и смесь таких растворителей, и предпочтительно подходяще выбирать их в зависимости от применяемого способа.
Дополнительно, помимо указанных реакций, здесь может быть использована любая реакция, если только это реакция, которая формирует гликозидную связь.
Когда в соединении (Ie) по данному изобретению R9 означает остаток сахара, который может иметь защитную группу, и когда указанную защитную группу не отщепляют на стадии С, возможно также получать соединение по данному изобретению, где R9 означает остаток сахара, не имеющий защитной группы, путем отщепления с использованием способа, который подходит для отщепления указанной защитной группы, такого как отщепление гидролизом с использованием основания, такого как карбонат натрия, или отщепление восстановлением, такое как введение каталитического восстановления.
Не существует конкретного ограничения для защитной группы, пока эта группа является такой, которую обычно используют для защиты гидроксильной группы, карбоксильной группы и т.п., и ее конкретными примерами являются необязательно замещенный низший алкил, аралкил, три(низший алкил)силил и ацил. «Аралкил» означает группу, где атом водорода указанного низшего алкила замещен арилом, и его конкретными примерами являются бензил и т.п. Конкретными примерами «ацила» являются ацетил, пропионил, изопропионил и бензоил.
Между прочим, исходные соединения для соединений по данному изобретению могут быть получены следующим представленным в качестве примера способом.
В формулах кольцо R3, Х2, Р1, Р2, Q и W имеют те же значения, как уже было указано, U означает -COOH, -COOP3, -NH2, NH-(низший алкил), -NH-P4, -NH(P4)-(низший алкил), -NO2, -CHO, – СН2OH, -(низший алкил) или уходящую СН2-группу, и Р3 и Р4 означают защитные группы для карбоксила и амина, соответственно.
Для синтеза соединения (IIa) проводят взаимодействие соединения (IX) с соединением (V), при этом происходит реакция конденсации карбоновой кислоты с амином, альдегида с амином или соединения, имеющего уходящую СН2-группу, с амином. Эту реакцию проводят таким же образом, как в указанной выше стадии А. Когда U означает -NO2 в соединении (IIa), соединение, где U означает -NH2, может быть получено путем восстановительной реакции; когда U означает -СООН или -СООР3, соединение, где U означает -СНО, может быть получено путем восстановительной реакции; когда U означает -СН2ОН или -(низший алкил), соединение, где U означает -СНО или -СООН, может быть получено путем окислительной реакции, и когда U означает СООР3, -NH-P4 или -N(P4)-(низший алкил), соединение, где U означает -СООН, -NH2 или -NH-(низший алкил), может быть получено посредством способа, подходящего для отщепления каждой из защитных групп, таким как, например, отщепление гидролизом с использованием основания, такого как гидроксид натрия, или кислоты, такой как хлороводородная кислота, отщепление восстановлением, таким как каталитическое введение водорода, или отщепление с использованием кислоты, такой как трифторуксусная кислота.
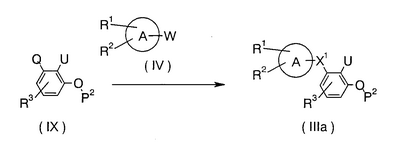
В формулах кольцо А, R1, R2, R3, Х1, Р2, Q, W и U имеют указанные выше значения.
Для синтеза соединения (IIIa) проводят взаимодействие соединения (IX) с соединением (IV), при этом происходит реакция конденсации карбоновой кислоты с амином, альдегида с амином или соединения, имеющего уходящую СН2-группу, с амином. Эту реакцию проводят таким же образом, как в указанной выше стадии А. Когда U означает -NO2 в соединении (IIIa), соединение, где U означает -NH2, может быть получено путем восстановительной реакции; когда U означает -СООН или -СООР3, соединение, где U означает -СНО, может быть получено путем восстановительной реакции; когда U означает -СН2ОН или -(низший алкил), соединение, где U означает -СНО или -СООН, может быть получено путем окислительной реакции, и когда U означает СООР3, -NH-P4 или -N(P4)-(низший алкил), соединение, где U означает -СООН, -NH2 или -NH-(низший алкил), может быть получено посредством способа, подходящего для отщепления каждой из защитных групп, таким как, например, отщепление гидролизом с использованием основания, такого как гидроксид натрия, или кислоты, такой как хлороводородная кислота, отщепление восстановлением, таким как каталитическое введение водорода, или отщепление с использованием кислоты, такой как трифторуксусная кислота.
Способ, который показан следующими схемами реакций, является особенно эффективным для синтеза соединений, представленных формулами (II) и (III).
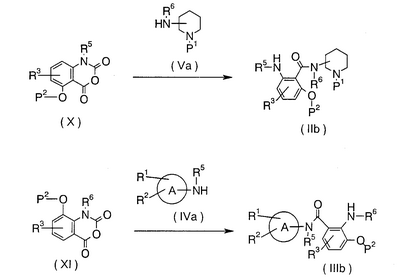
В формулах кольцо А, R1, R2, R3, R5, R6, Р1 и Р2 имеют указанные выше значения.
Это реакция, где амидную связь получают путем взаимодействия соединения (Х) с амином (Va) или соединения (XI) с амином (IVa), в результате чего получают соединение (IIb) или соединение (IIIa), и реакцию проводят в указанном выше инертном растворителе при комнатной температуре или при нагревании. В зависимости от применяемого способа может быть случай, когда реакция протекает гладко, когда реакцию проводят в присутствии основания, такого как N-метилморфолин, триэтиламин, триметиламин, пиридин, гидрид натрия, трет-бутоксид калия, бутиллитий или амид натрия, или при использовании такого основания в качестве растворителя.
Между прочим, стадия введения остатка сахара не ограничивается только указанными выше стадиями. Таким образом, возможно получение соединения путем необязательного сочетания стадий, которые обычно могут быть приспособлены (модифицированы) специалистами, таких как стадия, на которой содержащую донор сахара и фенол комбинацию соединения (VIII) с соединением (II), (III), (VI), (VII), (IX), (X) или (XI) приводят во взаимодействие предпочтительно в присутствии активатора, в результате чего синтезируют соединение, имеющее остаток сахара, который может быть защищен, и затем его конденсируют с (IV), (IVa), (V) или (Va) согласно способу, описанному выше.
Кроме того, соединение, представленное формулой (I), может быть получено путем необязательного сочетания известных стадий, которые могут быть приспособлены специалистами, таких как алкилирование, ацилирование, окисление, восстановление и гидролиз.
Соединение по данному изобретению, которое получают, может быть изолировано как таковое и очищено известными методами, такими как экстракция, осаждение, разделительная хроматография, фракционная кристаллизация, перекристаллизация и т.п. Также, соединение по данному изобретению может быть превращено в желательные соли путем обычной солеобразующей реакции. В дополнение, соединение по данному изобретению может существовать в форме оптических изомеров, когда оно имеет асимметричные атомы углерода. Эти оптические изомеры могут быть разделены обычным способом путем фракционной кристаллизации, когда изомер подвергают перекристаллизации с подходящей солью, или путем колоночной хроматографии или тому подобного.
Промышленное применение
Соединение по данному изобретению показывает сильное антикоагулирующее действие путем ингибирования активированного фактора Х коагуляции крови специфическим образом. Следовательно, соединение применимо в качестве ингибитора коагуляции крови или лекарства для применения в профилактике и лечении болезней, которые вызываются тромбом или эмболом.
Примеры таких болезней включают нарушения сосудов мозга, такие как церебральный инфаркт, церебральный тромбоз, церебральная эмболия, преходящее нарушение мозгового кровообращения (TIA), субарахноидальное кровоизлияние (спазм сосудов) и тому подобное, ишемические болезни сердца, такие как острый и хронический инфаркт миокарда, нестабильная стенокардия, тромбоз коронарной артерии и тому подобное, легочные сосудистые нарушения, такие как легочный тромбоз, легочная эмболия и тому подобное, и различные сосудистые нарушения, такие как обструкция периферических артерий, тромбоз глубоких вен, синдром рассеянной внутрисосудистой коагуляции, образование тромба после операции с искусственными кровеносными сосудами или после замены искусственного клапана, повторная окклюзия или повторная стриктура после операции шунтирования коронарной артерии, повторная окклюзия или повторная стриктура после операции РТСА (чрескожная внутрипросветная коронарная ангиопластика) или PTCR (чрескожная внутрипросветная коронарная реканализация) или образование тромба во время эктракорпорального кровообращения.
В дополнение, предполагается возможность применения соединения по данному изобретению в качестве лекарства для профилактики и лечения инфекции вируса гриппа на основании способности ингибировать рост вируса гриппа, осуществляемой за счет ингибирующего действия соединения по данному изобретению на активированный фактор Х коагуляции крови (Japanese Patent Laid-Open № 227971/1994).
Способность соединения по данному изобретению ингибировать активированный фактор Х коагуляции крови и продлевать время коагуляции при оральном введении подтверждена следующими испытаниями.
1) Тест in vitro для измерения времени коагуляции активированным фактором Х коагуляции крови человека
К 90 мкл плазмы крови человека добавляют 10 мкл лекарства или физиологического раствора и 50 мкл фактора Ха человека (Enzyme Research Labs), проводят инкубирование при 30°С в течение 3 минут, добавляют 100 мкл 20 мМ CaCl2, предварительно нагретого до 37°С, и время до коагуляции измеряют коагулометром (КС10 Amelung). Что касается плазмы крови человека, по 45 мл крови берут из вены локтевого сгиба у шести здоровых добровольцев с помощью шприца, в котором содержится 5 мл 3,8% цитрата натрия, и центрифугируют при 4°С в течение 15 минут при 3000 об./мин и отделенную плазму крови сливают и замораживают, затем оттаивают перед использованием. Что касается фактора Ха человека, выбирают концентрацию, при которой время коагуляции, когда добавляют физиологический раствор (контроль), составляет от около 30 до 40 секунд. Величину СТ2 (концентрация, при которой время коагуляции увеличивается в два раза) определяют путем построения графика зависимости концентраций лекарства и относительной величины (кратности) времени коагуляции по отношению к контролю, затем подвергая его линейной регрессии. Результаты показаны в следующей таблице 1.
| Таблица 1 |
| Соединение |
Тест для измерения времени коагуляции активированным фактором Х коагуляции крови человека (СТ2)(мкМ) |
| Пример 1 |
0,295 |
| Пример 3 |
0,062 |
| Пример 8 |
0,137 |
| Пример 10 |
0,617 |
| Пример 18 |
0,153 |
2) Тест in vitro для измерения времени коагуляции бычьим тромбином
К 50 мкл плазмы крови человека добавляют 50 мкл лекарства или физиологического раствора, проводят инкубирование при 37°С в течение 3 минут, добавляют 50 мкл тромбина (500 единиц тромбина (полученного от быка; Mochida Pharmaceutucal)), предварительно нагретого до 37°С, и время до коагуляции измеряют коагулометром (КС10 Amelung). Что касается плазмы крови человека, по 45 мл крови берут из вены локтевого сгиба у шести здоровых добровольцев с помощью шприца, в который введено 5 мл 3,8% цитрата натрия, и центрифугируют при 4°С в течение 15 минут при 3000 об./мин и отделенную плазму крови сливают и замораживают, выбирают концентрацию, при которой время коагуляции, когда добавляют физиологический раствор (контроль), составляет около 20 секунд. Величину СТ2 (концентрация, при которой время коагуляции увеличивается в два раза) определяют путем построения графика зависимости концентраций лекарства и относительной величины (кратности) времени коагуляции по отношению к контролю, затем подвергая его линейной регрессии.
Как результат, все величины СТ2 для соединений примеров 10 и 18 были ниже, чем 100 мкМ.
3) Тест для измерения ингибирования фермента методом синтетического субстрата
В 96-луночный микропланшет добавляют 80 мкл буфера реакции (рН 8,4), 15 мкл раствора соединения и 30 мкл 2мМ синтетического субстрата S-2222 (Chromogenix), затем добавляют 25 мкл 0,025 ед./мл активированного фактора Х коагуляции крови человека (фактор Ха; Enzyme Research Labs), реакцию проводят при 37°С в течение 10 минут, изменения в оптической плотности при 405 нм измеряют Bio-Rad (модель 3550) и рассчитывают IC50.
Результаты измерений указанных выше тестов 1), 2) и 3) подтверждают, что соединение по данному изобретению ингибирует активированный фактор Х коагуляции крови человека специфическим образом и обнаруживает сильное антикоагулирующее действие на кровь. Это подтверждается тем, что соединения, показанные в примерах 1, 3, 8, 10 и 18, по данному изобретению продлевают время коагуляции при низкой концентрации, обнаруживая превосходное действие против коагуляции крови.
4) Тест для ex vivo измерения времени коагуляции на обезьянах cynomolgus (оральное введение)
Лекарство (5 мг/мл или 0,5 мг/мл), которое растворяют (суспендируют) в 0,5% метилцеллюлозе, принудительно, путем кормления через зонд, вводят в дозе 2 мл/кг (10 мг/кг или 1 мг/кг) самцам обезьян cynomolgus (масса тела около 4 кг), голодавшим в течение 12 часов или дольше, пробы крови по 2 мл берут у них из бедренной вены, используя 1/10 объема 3,8% цитрата натрия, перед введением лекарства и через 1, 2, 4, 6 и 8 часов и плазму крови отделяют посредством центрифугирования при 3000 об./мин в течение 10 минут. Используя полученную плазму крови, измеряют время альтернативной (неприсущей) коагуляции (РТ) и время прямой коагуляции (АРТТ) в соответствии со следующими методами а) и b). Эксперимент проводят без анестезии. В данном случае, величины представлены как отношение времени коагуляции в группе с введением лекарства к времени коагуляции в контрольной группе (без введения лекарства), и описана величина на момент взятия крови, показывающая наиболее сильное воздействие на продление времени коагуляции.
а) Время альтернативной коагуляции (РТ)
Ortho Brain Thromboplastin (54 мл/склянка; лиофилизованный препарат; Ortho-Clinical Diagnostics) растворяют в 2,5 мл воды Milli-Q и предварительно нагревают при 37°С. Отделенную ранее плазму крови (50 мкл) нагревают при 37°С в течение 1 минуты, добавляют 50 мкл указанного выше раствора тромбопластина и измеряют время коагуляции. Результат показан в следующей таблице 2.
| Таблица 2 |
| Соединение |
Доза |
Тест для измерения времени коагуляции на обезьянах cynomolgus (РТ) |
| Пример 1 |
10 мг/кг |
7,69 |
| Пример 3 |
10 мг/кг |
5,60 |
| Пример 18 |
1 мг/кг |
1,94 |
| Пример 19 |
1 мг/кг |
2,26 |
Контрольное
соединение |
10 мг/кг |
2,00 |
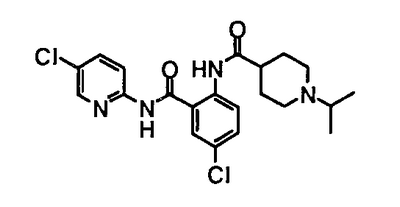
(Контроль)
(Пример 44 из WO 00/39118)
В результате этого испытания обнаружено, что соединения по данному изобретению имеют превосходное действие продления времени коагуляции, даже при оральном введении. При сравнении с примером 44 (контроль) из WO 00/39118 подтверждено, что соединения примеров 1 и 3 по данному изобретению имеют более продолжительное действие продления времени коагуляции при той же дозе и обнаруживают превосходное антикоагулирующее действие. В дополнение, соединения, показанные в примерах 18 и 19, обнаруживают подобное действие продления времени коагуляции при дозе, составляющей одну десятую по сравнению с контролем, и, как подтверждено, обнаруживают превосходное антикоагулирующее действие.
b) Время прямой коагуляции (АРТТ)
К 50 мкл указанной плазмы крови добавляют 50 мкл Hemoliance Thrombosil I (Dia-Iatron), смесь нагревают при 37°С в течение 3 минут, добавляют 50 мкл 20 мМ раствора CaCl2, предварительно нагретого до 37°С, и измеряют время коагуляции. Для измерения времени коагуляции используют КС10А, изготовленный Amelung.
Зависимость от дозы изменений антикоагулирующего действия с течением времени также исследуют, изменяя вводимую дозу или время отбора крови.
Фармацевтический состав, который содержит в качестве активного ингредиента одно или несколько соединений по данному изобретению, представленных формулой (I), или их фармацевтически приемлемые соли, готовят в виде таблеток, разбавленных порошков, мелких гранул, гранул, капсул, пилюль, растворов, растворов для инъекций, суппозиториев, мазей, пластырей и тому подобного, используя традиционно применяемые фармацевтические носители, наполнители и другие добавки, и вводят либо орально, либо парентерально (например, инъекцией, через кожу, через слизистую и т.п.).
Клиническую дозу соединения по данному изобретению для людей по возможности определяют, принимая во внимание симптомы, массу тела, возраст, пол и тому подобное пациента, которому требуется лечение, и обычно она равна от 0,1 до 500 мг при оральном введении или от 0,01 до 100 мг при парентеральном введении взрослому в сутки, где суточную дозу вводят один раз или делят на несколько приемов в сутки. Так как доза изменяется в зависимости от различных условий, в некоторых случаях может быть достаточной меньшая доза, чем указанные выше пределы.
Твердый препарат для применения путем орального введения согласно данному изобретению используют в форме таблеток, разбавленных порошков, гранул и тому подобного. В таком твердом препарате одно или несколько активных веществ смешано, по меньшей мере, с одним инертным разбавителем, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон, метакремниевая кислота или алюминат магния. Обычно состав может содержать добавки, иные, чем инертный разбавитель, такие как смазка (например, стеарат магния), дезинтегрирующее вещество (например, кальциевую соль гликолята целлюлозы), стабилизирующий агент (например, лактозу) и солюбилизирующий агент или солюбилизирующее вспомогательное вещество (например, глутаминовую кислоту или аспарагиновую кислоту). Если необходимо, таблетки или пилюли могут быть покрыты пленкой растворимого в желудке или кишечнике вещества, такого как сахароза, желатин, гидроксипропилцеллюлоза, фталат гидроксипропилметилцеллюлозы или тому подобное.
Жидкий состав для орального введения включает фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, эликсиры и тому подобное и содержит обычно используемый инертный разбавитель, такой как чистая вода или этиловый спирт. В дополнение к инертному разбавителю этот состав может также содержать вспомогательные агенты, такие как солюбилизирующий агент или солюбилизирующее вспомогательное вещество, увлажняющий агент, суспендирующий агент и тому подобное, а также подсластители, вкусовые вещества, ароматные вещества и антисептики.
Составы для инъекций для парентерального введения включают асептические водные или неводные растворы, суспензии и эмульсии. Примеры разбавителя для использования в водных растворах и суспензиях включают дистиллированную воду для инъекций и физиологический раствор. Примеры разбавителя для использования в неводных растворах и суспензиях включают пропиленгликоль, полиэтиленгликоль, растительное масло (например, оливковое масло), спирт (например, этиловый спирт), полисорбат 80 (торговое наименование) и тому подобное.
Такой состав может еще содержать дополнительные агенты, такие как изотонический агент, антисептический агент, увлажняющий агент эмульгирующий агент, диспергирующий агент, стабилизирующий агент (например, лактозу) и солюбилизирующий агент или солюбилизирующее вспомогательное вещество. Эти составы стерилизуют фильтрованием через задерживающий бактерии фильтр, примешиванием гермицида или облучением. В качестве варианта, они могут быть использованы так, что первоначально их превращают в стерильные твердые составы и растворяют их в стерильной воде или в стерильном растворителе для инъекций перед их применением.
Когда соединение по данному изобретению имеет низкую растворимость,оно может быть подвергнуто солюбилизирующей обработке. Солюбилизирующая обработка может быть проведена известными способами, которые могут быть применены к фармацевтическим препаратам, такими как способ, где добавляют поверхностно-активные вещества (полиэтоксилированное гидрогенизированное касторовое масло, сложные эфиры полиоксиэтилен-ангидросорбита и высших жирных кислот, полиоксиэтилен-полиоксипропилен-гликоли, сложные эфиры сахарозы и жирных кислот и тому подобное), и способ, где лекарство готовят в виде твердой дисперсии вместе с солюбилизирующим агентом, таким как полимер, например, растворимый в воде высший полимер, такой как гидроксипропил-метилцеллюлоза (НРМС), поливинилпирролидон (PVP) и полиэтиленгликоль (PEG) или растворимый в кишечнике полимер, такой как карбоксиметил-этилцеллюлоза (СМЕС), фталат гидроксипропил-метилцеллюлозы (НРМСР) и сополимер метилметакрилат-метакриловая кислота (торговые наименования Eudragit L и S, производимый Rohm & Haas). В дополнение, в случае необходимости, может быть использован способ, где лекарство превращают в растворимую соль, или способ, где получают соединение включения, используя циклодекстрин или тому подобное. Солюбилизирующие средства могут быть подходящим образом заменены в зависимости от каждого лекарства, представляющего интерес [Saikin no Seizai Gijutsu to Sono Oyo (Recent Pharmaceutical Technology and Application), I. Utsumi, et al., Iyaku Journal, 157-159 (1983) и Yakugaku Monograph, No.1, Bioavailability, K. Nagai, et al., опубликовано Soft Science, 78-82 (1988)]. Наряду с указанными выше методиками, предпочтительно может быть использован способ, где растворимость лекарства усовершенствуют формированием его твердой дисперсии с солюбилизирующим агентом (Japanese Patent Laid-Open № 49314/1981 и FR 2460667).
Наилучший вариант осуществления изобретения
Следующее описание конкретно поясняет способ получения соединений по данному изобретению со ссылкой на примеры получения соединений по данному изобретению. В связи с тем, что новые соединения включены в исходные соединения для соединений по данному изобретению, способы получения их также описаны как примеры сравнения.
Пример сравнения 1
Литий-алюминий гидрид (500 мг) суспендируют в 40 мл тетрагидрофурана, добавляют раствор 3,55 г этил-1-изопропилпиперидин-4-карбоксилата в 10 мл тетрагидрофурана при -50°C и смесь перемешивают в течение 2,5 часов при температуре от температуры при охлаждении льдом до комнатной температуры. К этому добавляют 0,5 мл воды, 0,5 мл 2 н. водного раствора гидроксида натрия, 1,5 мл воды и безводный сульфат магния при охлаждении льдом, полученный осадок удаляют фильтрованием и растворитель выпаривают в вакууме, чтобы получить 2,96 г (1-изопропил-4-пиперидил)метанола.
Пример сравнения 2
Оксалилхлорид (3,15 мл) растворяют в 30 мл дихлорметана, добавляют раствор 320 мл диметилсульфоксида в 6 мл дихлорметана при -70°C, смесь перемешивают в течение 15 минут, добавляют раствор 2,93 г (1-изопропил-4-пиперидил)метанола в 15 мл дихлорметана при -70°C и смесь перемешивают в течение 1 часа. Затем добавляют 12,5 мл триэтиламина при -70°C, смесь нагревают до комнатной температуры, затем добавляют воду и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния, растворитель выпаривают в вакууме и к полученному остатку добавляют этилацетат. После удаления нерастворимого вещества фильтрованием, растворитель выпаривают в вакууме, чтобы получить 1,15 г (1-изопропилпиперидин-4-карбальдегида. Это соединение используют для следующей реакции без очистки.
Пример сравнения 3
3-Гидрокси-2-нитробензойную кислоту (10,5 г) растворяют в 60 мл N,N-диметилформамида, затем добавляют 15 мл бензилбромида и 19,0 г карбоната калия при 0°C и смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор фильтруют через целит и фильтрат концентрируют в вакууме. К полученному остатку добавляют воду, смесь экстрагируют простым эфиром и экстракт промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают в вакууме, чтобы получить 20,7 г бензил-3-бензилокси-2-нитробензоата.
Пример сравнения 4
К 20,7 г бензил-3-бензилокси-2-нитробензоата добавляют 100 мл этанола и 120 мл 1 н. водного раствора гидроксида натрия и смесь перемешивают при комнатной температуре в течение ночи, при 60°C в течение 3 часов и при 80°C в течение 5 часов. Затем этанол выпаривают в вакууме, полученный водный раствор промывают простым эфиром и добавляют хлороводородную кислоту. Полученный осадок собирают фильтрованием и сушат в вакууме, чтобы получить 15,8 г 3-бензилокси-2-нитробензойной кислоты.
Пример сравнения 5
К 5,47 г 3-бензилокси-2-нитробензойной кислоты добавляют 20 мл тионилхлорида и несколько капель N,N-диметилформамида и смесь перемешивают при 80°C в течение 30 минут. Реакционный раствор концентрируют в вакууме, к полученному остатку добавляют 35 мл пиридина и 2,55 г 2-амино-5-хлорпиридина при 0°C и смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор концентрируют в вакууме, к полученному остатку добавляют насыщенный водный раствор гидрокарбоната натрия и смесь экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния, растворитель выпаривают в вакууме и проводят азеотропную операцию с толуолом, чтобы получить 7,44 г 3-бензилокси-N-(5-хлор-2-пиридил)-2-нитробензамида.
Пример сравнения 6
К 7,44 г 3-бензилокси-N-(5-хлор-2-пиридил)-2-нитробензамида добавляют 40 мл трифторуксусной кислоты и 3,72 г пентаметилбензола и смесь перемешивают при 40°C в течение ночи. Реакционный раствор концентрируют в вакууме, к остатку добавляют насыщенный водный раствор гидрокарбоната натрия до такой степени, что остаток не становится щелочным, и смесь экстрагируют хлороформом. Органический слой экстрагируют 1 н. водным раствором гидроксида натрия, водный слой подкисляют добавлением хлороводородной кислоты и смесь экстрагируют хлороформом. Экстракт сушат над безводным сульфатом магния, растворитель выпаривают в вакууме и к полученному остатку добавляют 200 мл суспензии никеля Ренея в этаноле. Это перемешивают в течение 6 часов в атмосфере водорода, добавляют N,N-диметилформамид и нерастворимое вещество отфильтровывают. Растворитель выпаривают в вакууме и к полученному остатку добавляют воду. Полученный осадок собирают фильтрованием и сушат в вакууме, чтобы получить 4,58 г 2-амино-N-(5-хлор-2-пиридил)-3-гидроксибензамида.
Пример сравнения 7
2-Амино-N-(5-хлор-2-пиридил)-3-гидроксибензамид (3,06 г) и 1,80 г N-хлорсукцинимида растворяют в 60 мл N,N-диметилформамида, раствор перемешивают при 50°C в течение 8 часов и при комнатной температуре в течение 4 часов и нерастворимое вещество отфильтровывают. Растворитель выпаривают в вакууме, к полученному остатку добавляют 1 н. водный раствор гидроксида натрия и смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния, растворитель выпаривают в вакууме и полученный остаток очищают колоночной хроматографией на силикагеле. К грубо очищенному продукту добавляют этанол и полученный осадок собирают фильтрованием и сушат в вакууме, чтобы получить 767 мг 2-амино-5-хлор-N-(5-хлор-2-пиридил)-3-гидроксибензамида. Маточную жидкость концентрируют, затем добавляют смесь этилацетата и простого изопропилового эфира и полученный осадок собирают фильтрованием и сушат в вакууме, чтобы получить более 942 мг указанного выше соединения.
Пример сравнения 8
2-Амино-N-(5-хлор-2-пиридил)-3-гидроксибензамид (5,27 г) растворяют в 60 мл N,N-диметилформамида и раствор перемешивают при -15°C. N-Бромсукцинимид (3,56 г) добавляют, разделив на четыре порции, с интервалами 5 минут между порциями и смесь перемешивают при -15°C в течение 1,5 часов. Затем добавляют более 0,36 г N-бромсукцинимида, смесь перемешивают при -15°C в течение 2 часов, затем добавляют 120 мл воды и 120 мл этилацетата и смесь перемешивают при комнатной температуре в течение 10 минут. Полученный осадок отделяют фильтрованием через целит и органический слой фильтрата собирают, тогда как водный слой дополнительно экстрагируют этилацетатом. Порошок активированного углерода (2,6 г) добавляют к полученному органическому слою и смесь перемешивают в течение 15 минут и фильтруют через целит. Фильтрат промывают водой и сушат над безводным сульфатом натрия, растворитель выпаривают в вакууме и остаток сушат, чтобы получить 5,70 г 2-амино-5-бром-N-(5-хлор-2-пиридил)-3-гидроксибензамида.
Пример сравнения 9
3-Гидрокси-2-нитробензойную кислоту (2,00 г) растворяют в 110 мл N,N-диметилформамида, затем добавляют 1,53 г 4-хлоранилина, 3,15 г гидрохлорида 1-этил-3-[3-(N,N-диметиламино)пропил]карбодиимида и 2,21 г 1-гидроксибензотриазола и смесь перемешивают при комнатной температуре в течение 4 дней. Реакционный раствор концентрируют в вакууме, насыщенный раствор соли добавляют к концентрату и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом магния и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформ:метанол (100:1) в качестве элюента, чтобы получить 2,97 г 4′-хлор-3-гидрокси-2-нитробензанилида.
Пример сравнения 10
К 7,09 г 3-бензилокси-2-нитробензойной кислоты добавляют 30 мл тионилхлорида и несколько капель N,N-диметилформамида и смесь перемешивают при 80°C течение 30 минут. Реакционный раствор концентрируют в вакууме, затем 40 мл пиридина и 4,91 г 2-амино-5-бромпиридина добавляют к полученному остатку при 0°C и смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор концентрируют в вакууме, затем к полученному остатку добавляют насыщенный водный раствор гидрокарбоната натрия и метанол и смесь экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния, растворитель выпаривают в вакууме и остаток подвергают азеотропной обработке толуолом, чтобы получить 11,01 г 3-бензилокси-N-(5-бром-2-пиридил)-2-нитробензамида.
Пример сравнения 11
К 10,7 г 3-бензилокси-N-(5-бром-2-пиридил)-2-нитробензамида добавляют 50 мл трифторуксусной кислоты и 4,88 г пентаметилбензола и смесь перемешивают при комнатной температуре в течение 4 дней. Реакционный раствор концентрируют в вакууме, к остатку добавляют насыщенный водный раствор гидрокарбоната натрия до такой степени, что остаток не становится щелочным, и смесь экстрагируют хлороформом. Органический слой экстрагируют 1 н. водным раствором гидроксида натрия и к водному слою добавляют концентрированную хлороводородную кислоту. Полученный осадок собирают фильтрованием и сушат в вакууме, чтобы получить 7,86 г N-(5-бром-2-пиридил)-3-гидрокси-2-нитробензамида.
Пример сравнения 12
N-(5-Бром-2-пиридил)-3-гидрокси-2-нитробензамид (7,71 г) суспендируют в 50 мл этанола и 22 мл дистиллированной воды, затем добавляют 12,7 г восстановленного железа и 2,45 г хлорида аммония и смесь нагревают до кипения с возвращением флегмы в течение 6 часов. Затем ее охлаждают до комнатной температуры, нерастворимое вещество отфильтровывают и промывают хлороформом. Фильтрат концентрируют в вакууме, добавляют насыщенный водный раствор гидрокарбоната натрия, смесь экстрагируют хлороформом и экстракт промывают насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и растворитель выпаривают в вакууме, чтобы получить 0,42 г 2-амино-N-(5-бром-2-пиридил)-3-гидроксибензамида. Затем N,N-диметилформамид добавляют к нерастворимому веществу, полученному фильтрованием реакционного раствора, смесь фильтруют и фильтрат концентрируют в вакууме. К полученному остатку добавляют воду и полученный осадок собирают фильтрованием и сушат в вакууме, чтобы получить дополнительные 3,28 г указанного выше соединения. Хотя оно содержит примеси, его не очищают, а используют для следующей реакции, как есть.
Пример сравнения 13
2-Амино-N-(5-бром-2-пиридил)-3-гидроксибензамид (1,99 г) и 990 мг N-хлорсукцинимида растворяют в 30 мл N,N-диметилформамида, раствор перемешивают при 50°С течение 2 часов и нерастворимое вещество отфильтровывают. Растворитель выпаривают в вакууме, к полученному остатку добавляют воду и осадок собирают фильтрованием. Его сушат в вакууме, очищают колоночной хроматографией на силикагеле, к полученному грубо очищенному продукту добавляют воду и полученный осадок собирают фильтрованием и сушат в вакууме, чтобы получить 1,12 г 2-амино-N-(5-бром-2-пиридил)-5-хлор-3-гидроксибензамида.
Пример 1
2-Амино-5-бром-N-(5-хлор-2-пиридил)-3-гидроксибензамид (5,14 г) и 2,83 г 1-изопропилпиперидин-4-карбоновой кислоты растворяют в 75 мл N,N-диметилформамида, затем добавляют 4,33 г гидрохлорида 1-этил-3-диметиламинопропилкарбодиимида и 3,04 г 1-гидроксибензотриазола и смесь перемешивают при комнатной температуре в течение 46 часов. Реакционный раствор добавляют к 750 мл 1% водного раствора бикарбоната натрия и туда же добавляют 200 мл этилацетата. Этилацетат выпаривают в вакууме и полученное твердое вещество собирают фильтрованием и промывают водой. Полученное твердое вещество суспендируют в 100 мл метанола и 10 мл воды и суспензию перемешивают в течение ночи. Полученный осадок собирают фильтрованием и сушат в вакууме, чтобы получить 4,41 г 4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилида.
4′-Бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид (480 мг) суспендируют в 15 мл хлороформа, 15 мл метанола и 10 мл 1,4-диоксана, затем добавляют 434 мг 1,8-диазабицикло[5,4,0]-7-ундецена и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют 1,19 г 1-бром-1-дезокси-2,3,4,6-тетра-O-ацетил- -D-галактопиранозида и смесь перемешивают при комнатной температуре в течение 3 часов. К реакционному раствору добавляют 868 мг 1,8-диазабицикло[5,4,0]-7-ундецена, смесь перемешивают при комнатной температуре в течение 3 часов и добавляют к ней 1,19 г 1-бром-1-дезокси-2,3,4,6-тетра-O-ацетил- -D-галактопиранозида и смесь перемешивают при комнатной температуре в течение 3 часов. К реакционному раствору добавляют 868 мг 1,8-диазабицикло[5,4,0]-7-ундецена, смесь перемешивают при комнатной температуре в течение 3 часов и добавляют к ней 1,19 г 1-бром-1-дезокси-2,3,4,6-тетра-O-ацетил- -D-галактопиранозида. Затем смесь перемешивают при комнатной температуре в течение 12 часов, концентрируют ее в вакууме. К полученному остатку добавляют 50 мл воды и смесь промывают 50 мл хлороформа и экстрагируют н-пентанолом. Растворитель выпаривают в вакууме и полученный остаток очищают посредством колоночной хроматографии ODS, используя смесь 0,1% водный раствор трифторуксусной кислоты:ацетонитрил (71:29) в качестве элюента, чтобы получить 300 мг трифторацетата 4-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′- -D-галактопиранозида. Затем смесь перемешивают при комнатной температуре в течение 12 часов, концентрируют ее в вакууме. К полученному остатку добавляют 50 мл воды и смесь промывают 50 мл хлороформа и экстрагируют н-пентанолом. Растворитель выпаривают в вакууме и полученный остаток очищают посредством колоночной хроматографии ODS, используя смесь 0,1% водный раствор трифторуксусной кислоты:ацетонитрил (71:29) в качестве элюента, чтобы получить 300 мг трифторацетата 4-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′- -D-галактопиранозилокси-1-изопропилпиперидин-4-карбоксанилида. -D-галактопиранозилокси-1-изопропилпиперидин-4-карбоксанилида.
Соединения примеров 2, 4 и 8 получают таким же образом, как в примере 1.
Пример 3
4′-Бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид (500 мг) суспендируют в 10 мл хлороформа, 10 мл метанола и 5 мл 1,4-диоксана, затем добавляют 0,45 мл 1,8-диазабицикло[5,4,0]-7-ундецена и смесь перемешивают при комнатной температуре в течение 1,5 часов. К реакционному раствору добавляют 1,11 г 2-ацетамидо-2,3,6-три-O-ацетил-2-дезокси- -D-глюкопиранозил-бромида и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют 0,90 мл 1,8-диазабицикло[5,4,0]-7-ундецена, смесь перемешивают при комнатной температуре в течение 30 минут и к ней добавляют 1,11 г 2-ацетамидо-2,3,6-три-O-ацетил-2-дезокси- -D-глюкопиранозил-бромида и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют 0,90 мл 1,8-диазабицикло[5,4,0]-7-ундецена, смесь перемешивают при комнатной температуре в течение 30 минут и к ней добавляют 1,11 г 2-ацетамидо-2,3,6-три-O-ацетил-2-дезокси- -D-глюкопиранозил-бромида. Затем смесь перемешивают при 60°С течение 2 часов и концентрируют в вакууме. К полученному остатку добавляют 50 мл воды и смесь промывают 50 мл хлороформа и экстрагируют н-пентанолом. Растворитель выпаривают в вакууме и полученный остаток очищают посредством колоночной хроматографии ODS, используя смесь 0,1% водный раствор трифторуксусной кислоты:ацетонитрил (71:29) в качестве элюента, чтобы получить 364 мг трифторацетата 2′-(2-ацетамидо-2-дезокси- -D-глюкопиранозил-бромида. Затем смесь перемешивают при 60°С течение 2 часов и концентрируют в вакууме. К полученному остатку добавляют 50 мл воды и смесь промывают 50 мл хлороформа и экстрагируют н-пентанолом. Растворитель выпаривают в вакууме и полученный остаток очищают посредством колоночной хроматографии ODS, используя смесь 0,1% водный раствор трифторуксусной кислоты:ацетонитрил (71:29) в качестве элюента, чтобы получить 364 мг трифторацетата 2′-(2-ацетамидо-2-дезокси- -D-глюкопиранозилокси)-4′-бром-6′-[(5-хлор-2-пиридил)карбамоил]-1-изопропилпиперидин-4-карбоксанилида. -D-глюкопиранозилокси)-4′-бром-6′-[(5-хлор-2-пиридил)карбамоил]-1-изопропилпиперидин-4-карбоксанилида.
Пример 5
3-Гидрокси-N1-(4-метоксибензоил)-N2-[4-(4-метил-1,4-диазепан-1-ил)бензоил]-1,2-фенилендиамин (300 мг), 377 мг метил 1-бром-1-дезокси-2,3,4-три-О-ацетил- -D-глюкопиранозид уроната и 225 мг бромида бензил-три-н-бутиламмония суспендируют в 6 мл хлороформа, добавляют 1,9 мл 1 н. водного раствора гидроксида натрия и смесь перемешивают при 60°С течение 2 часов. К реакционному раствору добавляют 754 мг метил 1-бром-1-дезокси-2,3,4-три-О-ацетил- -D-глюкопиранозид уроната и 225 мг бромида бензил-три-н-бутиламмония суспендируют в 6 мл хлороформа, добавляют 1,9 мл 1 н. водного раствора гидроксида натрия и смесь перемешивают при 60°С течение 2 часов. К реакционному раствору добавляют 754 мг метил 1-бром-1-дезокси-2,3,4-три-О-ацетил- -D-глюкопиранозид уроната и смесь перемешивают при 60°C в течение 3 часов. Реакционный раствор экстрагируют хлороформом и экстракт промывают насыщенным водным раствором соли. Полученный органический слой сушат над безводным сульфатом натрия и концентрируют в вакууме. Полученный остаток очищают посредством колоночной хроматографии на силикагеле, используя в качестве элюента смесь хлороформ:метанол:насыщенный водный аммиак (100:10:1), чтобы получить 210 мг грубо очищенного метил (3-[(4-метоксибензоил)амино]-2-{[4-(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил-2,3,4-три-О-ацетил- -D-глюкопиранозид уроната и смесь перемешивают при 60°C в течение 3 часов. Реакционный раствор экстрагируют хлороформом и экстракт промывают насыщенным водным раствором соли. Полученный органический слой сушат над безводным сульфатом натрия и концентрируют в вакууме. Полученный остаток очищают посредством колоночной хроматографии на силикагеле, используя в качестве элюента смесь хлороформ:метанол:насыщенный водный аммиак (100:10:1), чтобы получить 210 мг грубо очищенного метил (3-[(4-метоксибензоил)амино]-2-{[4-(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил-2,3,4-три-О-ацетил- -D-глюкопиранозид) уроната. Грубо очищенный продукт (220 мг), полученный этим способом, растворяют в 5,5 мл метанола и 2,7 мл дистиллированной воды, добавляют 85 мг карбоната натрия и смесь перемешивают при комнатной температуре в течение 2,5 часов и затем при 60°С течение 2 часов. Это концентрируют в вакууме и полученный остаток очищают посредством колоночной хроматографии ODS, используя в качестве элюента смесь 0,1% водный раствор трифторуксусная кислота:тетрагидрофуран (70:30), чтобы получить 150 мг грубо очищенного трифторацетата 3-[(4-метоксибензоил)амино]-2-{[4-(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил- -D-глюкопиранозид) уроната. Грубо очищенный продукт (220 мг), полученный этим способом, растворяют в 5,5 мл метанола и 2,7 мл дистиллированной воды, добавляют 85 мг карбоната натрия и смесь перемешивают при комнатной температуре в течение 2,5 часов и затем при 60°С течение 2 часов. Это концентрируют в вакууме и полученный остаток очищают посредством колоночной хроматографии ODS, используя в качестве элюента смесь 0,1% водный раствор трифторуксусная кислота:тетрагидрофуран (70:30), чтобы получить 150 мг грубо очищенного трифторацетата 3-[(4-метоксибензоил)амино]-2-{[4-(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил- -D-глюкопиранозид уроновой кислоты. Грубо очищенный продукт (310 мг), полученный этим способом, очищают посредством ЖХВР (Develosil ODS-UG-5), используя в качестве элюента смесь 0,1% водный раствор трифторуксусной кислоты:тетрагидрофуран (75:25), чтобы получить 115 мг трифторацетата 3-[(4-метоксибензоил)амино]-2-{[4-(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил- -D-глюкопиранозид уроновой кислоты. Грубо очищенный продукт (310 мг), полученный этим способом, очищают посредством ЖХВР (Develosil ODS-UG-5), используя в качестве элюента смесь 0,1% водный раствор трифторуксусной кислоты:тетрагидрофуран (75:25), чтобы получить 115 мг трифторацетата 3-[(4-метоксибензоил)амино]-2-{[4-(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил- -D-глюкопиранозид уроновой кислоты. -D-глюкопиранозид уроновой кислоты.
Пример 6
4′-Хлор-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид (150 мг) суспендируют в 1,6 мл хлороформа и 1,6 мл метанола, затем добавляют 152 мг 1,8-диазабицикло[5,4,0]-7-ундецена и смесь перемешивают при комнатной температуре в течение 35 минут. К реакционному раствору добавляют 397 мг метил-1-бром-1-дезокси-2,3,4-три-О-ацетил- -D-глюкопиранозид уроната и смесь перемешивают при комнатной температуре в течение 15 минут и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол:насыщенный водный аммиак (100:20:2), чтобы получить 240 мг грубо очищенного продукта метил-{5-хлор-3-[(5-хлор-2-пиридил)карбамоил]-2-[(1-изопропилпиперидин-4-карбонил)амино]фенил- -D-глюкопиранозид уроната и смесь перемешивают при комнатной температуре в течение 15 минут и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол:насыщенный водный аммиак (100:20:2), чтобы получить 240 мг грубо очищенного продукта метил-{5-хлор-3-[(5-хлор-2-пиридил)карбамоил]-2-[(1-изопропилпиперидин-4-карбонил)амино]фенил- -D-глюкопиранозид} уроната. Грубо очищенный продукт (230 мг) растворяют в 4,6 мл метанола и 2,3 мл дистиллированной воды, затем добавляют 114 мг карбоната натрия и смесь перемешивают при комнатной температуре в течение 1 часа. Ее нейтрализуют трифторуксусной кислотой и концентрируют в вакууме. Полученный остаток очищают посредством колоночной хроматографии OSD, используя в качестве элюента смесь 0,1% водный раствор трифторуксусной кислоты:ацетонитрил (71:29), чтобы получить 86 мг трифторацетата 5-хлор-3-[(5-хлор-2-пиридил)карбамоил]-2-[(1-изопропилпиперидин-4-карбонил)амино]фенил- -D-глюкопиранозид} уроната. Грубо очищенный продукт (230 мг) растворяют в 4,6 мл метанола и 2,3 мл дистиллированной воды, затем добавляют 114 мг карбоната натрия и смесь перемешивают при комнатной температуре в течение 1 часа. Ее нейтрализуют трифторуксусной кислотой и концентрируют в вакууме. Полученный остаток очищают посредством колоночной хроматографии OSD, используя в качестве элюента смесь 0,1% водный раствор трифторуксусной кислоты:ацетонитрил (71:29), чтобы получить 86 мг трифторацетата 5-хлор-3-[(5-хлор-2-пиридил)карбамоил]-2-[(1-изопропилпиперидин-4-карбонил)амино]фенил- -D-глюкопиранозид уроновой кислоты. -D-глюкопиранозид уроновой кислоты.
Пример 7
4′-Бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид (1,00 г) суспендируют в 20 мл хлороформа и 20 мл метанола, затем добавляют 0,91 мл 1,8-диазабицикло[5,4,0]-7-ундецена и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют 2,41 г метил-1-бром-1-дезокси-2,3,4-три-О-ацетил- -D-глюкопиранозид уроната и смесь перемешивают при комнатной температуре в течение 16 часов. К реакционному раствору добавляют 1,07 г карбоната натрия и 20 мл воды и смесь перемешивают при комнатной температуре в течение 23 часов и концентрируют в вакууме. К полученному остатку добавляют 50 мл 5% водного раствора бикарбоната натрия и смесь промывают хлороформом и экстрагируют н-пентанолом. Растворитель выпаривают в вакууме и полученный остаток очищают посредством колоночной хроматографии ODS, используя в качестве элюента смесь 0,1% водный раствор трифторуксусной кислоты:ацетонитрил (71:29), чтобы получить 502 мг трифторацетата 5-бром-3-[(5-хлор-2-пиридил)карбамоил]-2-[1-изопропилпиперидин-4-карбонил]амино]фенил -D-глюкопиранозид уроната и смесь перемешивают при комнатной температуре в течение 16 часов. К реакционному раствору добавляют 1,07 г карбоната натрия и 20 мл воды и смесь перемешивают при комнатной температуре в течение 23 часов и концентрируют в вакууме. К полученному остатку добавляют 50 мл 5% водного раствора бикарбоната натрия и смесь промывают хлороформом и экстрагируют н-пентанолом. Растворитель выпаривают в вакууме и полученный остаток очищают посредством колоночной хроматографии ODS, используя в качестве элюента смесь 0,1% водный раствор трифторуксусной кислоты:ацетонитрил (71:29), чтобы получить 502 мг трифторацетата 5-бром-3-[(5-хлор-2-пиридил)карбамоил]-2-[1-изопропилпиперидин-4-карбонил]амино]фенил  -D-глюкопиранозид уроновой кислоты. -D-глюкопиранозид уроновой кислоты.
Пример 9
2-Амино-N-(5-хлор-2-пиридил)-3-гидроксибензамид (100 мг) и 80 мг 1-изопропилпиперидин-4-карбальдегида суспендируют в 5 мл толуола, затем добавляют 10 мг гидрата п-толуолсульфоновой кислоты и смесь нагревают до кипения с возвращением флегмы в течение 2 часов вместе с удалением воды азеотропной операцией. Потом растворитель выпаривают в вакууме, добавляют к полученному остатку 7 мл уксусной кислоты и 88 мг комплекса боран-триметиламин и смесь перемешивают при 70°С течение 15 часов. Растворитель выпаривают в вакууме, к остатку добавляют насыщенный водный раствор гидрокарбоната натрия и смесь экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния, растворитель выпаривают в вакууме и полученный остаток очищают колоночной хроматографией на силикагеле. После добавления 1 н. хлороводородной кислоты и воды к полученному N-(5-хлор-2-пиридил)-3-гидрокси-2-{[(1-изопропил-4-пиперидил)метил]амино}бензамиду смесь сушат вымораживанием, чтобы получить 102 мг гидрохлорида N-(5-хлор-2-пиридил)-3-гидрокси-2-{[(1-изопропил-4-пиперидил)метил]амино}бензамида.
Соединения примеров 10, 11, 12 и 13 получают таким же образом, как в примере 9.
Пример 14
4′-Хлор-3-гидрокси-2-нитробензанилид (1,43 г) суспендируют в 50 мл метанола, затем добавляют 5 мл дистиллированной воды, 2,80 г восстановленного железа и 530 мг хлорида аммония и смесь перемешивают при 60°С течение 2 часов. Реакционную смесь фильтруют через целит и концентрируют в вакууме. К полученному остатку добавляют насыщенный раствор соли и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом магния и концентрируют в вакууме. Полученный остаток и 320 мг 1-изопропилпиридин-4-карбальдегида суспендируют в 14 мл толуола, затем добавляют 37 мг гидрата п-толуолсульфоновой кислоты и смесь нагревают до кипения с возвращением флегмы в течение 24 часов вместе с удалением воды азеотропной операцией. Затем концентрируют в вакууме, к полученному остатку добавляют 14 мл уксусной кислоты и 350 мг комплекса боран-триметиламин и смесь перемешивают при 70°С течение 17 часов. Затем концентрируют в вакууме, добавляют к полученному остатку 5% водный раствор бикарбоната натрия и смесь экстрагируют хлороформом. Органический слой сушат над сульфатом магния и концентрируют в вакууме. Полученный остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол:насыщенный водный аммиак (100:10:1), чтобы получить 380 мг грубо очищенного 4′-хлор-3-гидрокси-2-{[(1-изопропил-4-пиперидил)метил]амино}бензанилида. Грубо очищенный продукт (380 мг) очищают колоночной хроматографией ODS, используя в качестве элюента смесь 0,001 н. хлороводородная кислота:метанол (10:3), и затем сушат вымораживанием, чтобы получить 162 мг гидрохлорида 4′-хлор-3-гидрокси-2-{[(1-изопропил-4-пиперидил)метил]амино}бензанилида.
Соединения примеров 15 и 16 получают таким же образом, как в примере 14.
Пример 17
К 612 мг 1-изопропилпиперидин-4-карбоновой кислоты добавляют 5 мл тионилхлорида и несколько капель N,N-диметилформамида и смесь перемешивают при 60°С течение 1 часа. Растворитель выпаривают в вакууме, к полученному остатку добавляют 465 мг 2-амино-N-(5-хлор-2-пиридил)-3-гидроксибензамида и 20 мл пиридина при 0°C и температуру смеси повышают до комнатной температуры и смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают в вакууме, добавляют насыщенный водный раствор гидрокарбоната натрия и смесь экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния, растворитель выпаривают в вакууме и полученный остаток очищают колоночной хроматографией на силикагеле. Полученный сырой продукт суспендируют в этаноле, добавляют 1 н. хлороводородную кислоту, смесь перемешивают и полученный осадок собирают фильтрованием и сушат в вакууме, чтобы получить 226 мг гидрохлорида 2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилида. Так как это соединение содержит этанол, его переводят в водный раствор и сушат вымораживанием и измеряют ЯМР.
Соединение примера 20 получают таким же образом, как в примере 17.
Пример 18
К 450 мг 1-изопропилпиперидин-4-карбоновой кислоты добавляют 2,6 мл тионилхлорида и 3 капли N,N-диметилформамида и смесь перемешивают при 60°С течение 30 минут и концентрируют в вакууме. К полученному остатку добавляют толуол и смесь концентрируют в вакууме. После проведения указанной операции дважды добавляют 520 мг 2-амино-5-хлор-N-(5-хлор-2-пиридил)-3-гидроксибензамида и 6 мл пиридина и смесь перемешивают при комнатной температуре в течение 15 часов. Затем ее концентрируют в вакууме, добавляют 5% водный раствор бикарбоната натрия и смесь экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния, растворитель выпаривают в вакууме и полученный остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ:метанол:насыщенный водный аммиак (100:20:2), чтобы получить 490 мг грубо очищенного 4′-хлор-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилида. Грубо очищенный продукт (310 мг) очищают колоночной хроматографией ODS, используя в качестве элюента смесь 0,001 н. хлороводородная кислота:метанол (1:1), и сушат вымораживанием, чтобы получить 301 мг гидрохлорида 4′-хлор-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилида.
Пример 19
2-Амино-5-бром-N-(5-хлор-2-пиридил)-3-гидроксибензамид (2,39 г) и 1,32 г 1-изопропилпиперидин-4-карбоновой кислоты растворяют в 35 мл N,N-диметилформамида, затем добавляют 2,02 г гидрохлорида 1-этил-3-диметиламинопропилкарбодиимида, 1,42 г 1-гидроксибензотриазола и 1,46 мл триэтиламина и смесь перемешивают при комнатной температуре в течение 22 часов. К реакционному раствору добавляют 105 мл воды и 105 мл этилацетата, смесь перемешивают при комнатной температуре в течение 3 часов и полученный осадок отделяют фильтрованием, промывают этилацетатом и водой и сушат в вакууме. Полученное твердое вещество суспендируют в 60 мл этанола, добавляют 5 мл 1 н. хлороводородной кислоты и смесь перемешивают при комнатной температуре в течение 30 часов. Полученный осадок фильтруют, промывают этанолом и сушат в вакууме, чтобы получить 1,35 г гидрохлорида 4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилида.
Соединение примера 24 получают таким же образом, как в примере 19.
Пример 21
К 374 мг 1-изопропилпиперидин-4-карбоновой кислоты добавляют 3 мл тионилхлорида и несколько капель N,N-диметилформамида и смесь перемешивают при 80°С течение 30 минут. Растворитель выпаривают в вакууме, к полученному остатку добавляют 509 мг 2-амино-N-(5-бром-2-пиридил)-5-хлор-3-гидроксибензамида и 20 мл пиридина при 0°C и температуру смеси повышают до комнатной температуры и смесь перемешивают при комнатной температуре в течение ночи. Потом растворитель выпаривают в вакууме, добавляют насыщенный водный раствор бикарбоната натрия и смесь экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния, растворитель выпаривают в вакууме и полученный остаток очищают колоночной хроматографией на силикагеле. Добавляют 1 н. хлороводородную кислоту и воду к полученному N-(5-бром-2-пиридил)-5-хлор-3-гидрокси-2-[(1-изопропилпиперидин-4-карбонил)амино]бензамиду и сушат вымораживанием, чтобы получить 602 мг гидрохлорида 2′-[(5-бром-2-пиридил)карбамоил]-4′-хлор-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилида.
Соединение примера 22 получают таким же образом, как в примере 21.
Пример 23
4′-Бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид (495 мг) растворяют в 15 мл N,N-диметилформамида, добавляют 1,39 г комплекса триметиламинтриоксид серы и смесь перемешивают при 50°С течение 124 часов. Дополнительно добавляют комплекс триметиламинтриоксид серы (0,70 г), смесь перемешивают при 50°С в течение 21 часа, добавляют 30 мл воды и смесь перемешивают при комнатной температуре в течение 20 минут. Полученный осадок отделяют фильтрованием и промывают водой. Полученное твердое вещество суспендируют в метаноле, перемешивают при комнатной температуре в течение 12 часов, отфильтровывают, промывают метанолом и сушат в вакууме. Полученное твердое вещество растворяют в 40 мл метанола и 2 мл 1 н. водного раствора гидроксида натрия, полученный фильтрат отделяют фильтрованием и растворитель выпаривают в вакууме. Полученный остаток снова растворяют в смешанном растворителе из воды и метанола, раствор нейтрализуют 0,1 н. хлороводородной кислотой и полученный осадок отделяют фильтрованием, промывают водой и сушат в вакууме. Полученный грубо очищенный продукт растворяют в разбавленном водном растворе гидроксида натрия и очищают колоночной хроматогрфией ODS, используя в качестве элюента смесь ацетонитрил:вода (5:95 40:60). Ацетонитрил, находящийся во фракции, содержащей целевой продукт, выпаривают в вакууме и полученный осадок отфильтровывают, промывают водой и сушат в вакууме, чтобы получить 202 мг 5-бром-3-[(5-хлор-2-пиридил)карбамоил]-2-[(1-изопропилпиперидин-4-карбонил)амино]фенил-гидросульфата.
Пример 25
2-Амино-5-бром-N-(5-хлор-2-пиридил)-3-гидроксибензамид (0,37 г) и 0,50 г 1-изопропилпиперидин-4-карбоновой кислоты растворяют в 10 мл N,N-диметилформамида, затем добавляют 0,31 г гидрохлорида 1-этил-3-диметиламинопропилкарбодиимида, 0,22 г 1-гидроксибензотриазола и 0,45 мл триэтиламина и смесь перемешивают при комнатной температуре в течение 18 часов и при 60°С в течение 4 часов. Реакционный раствор концентрируют в вакууме, к полученному остатку добавляют 50 мл хлороформа и 50 мл 5% водного раствора бикарбоната натрия и смесь экстрагируют хлороформом. Растворитель выпаривают в вакууме и полученный остаток промывают метанолом и сушат в вакууме, чтобы получить 0,37 г 4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-метансульфонилпиперидин-4-карбоксанилида.
Структурные формулы и физические и химические свойства соединений вышеупомянутых примеров сравнения и примеров показаны в таблицах 3-4. Символы в таблицах имеют следующие значения: ЯМР: спектр ядерного магнитного резонанса (внутренний стандарт: TMS); FAB-MS: данные масс-спектрометрии.
Соединения, показанные в таблицах 5-9, легко были получены таким же способом, как способ, указанный в примерах и примерах получения выше, или с использованием некоторых модификаций, которые очевидны для специалиста в этой области.
В структурных формулах в таблицах 3 и 4 и таблице 9 “Y” означает изопропил, “O-” означает метокси, “-” означает метил и “SO2-” означает SO2-метил. Символ “__” в структурной формуле в таблицах 5-8 означает положение связи. Некоторые соединения, описанные в таблицах 3 и 4, могут быть смесью конформационных изомеров.
| Таблица 3 |
| Пример сравнения № |
Структурная формула (соль) |
Данные о свойствах |
| 1 |
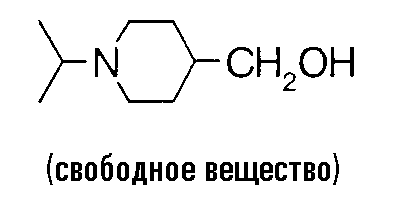 |
ЯМР (CDCl3):
 : 1,04 (6Н, д, J=6,0 Гц), 1,18-1,33 (2Н, м), 1,41-1,56 (1Н, м), 1,75 (2Н, д, J=13,7 Гц), 2,11 (2Н, дт, Jd=9,3 Гц, Jt=11,6 Гц), 2,63-2,77 (1Н, м), 2,85-2,94 (2Н, м), 3,49 (2Н, д, J=5,7 Гц). : 1,04 (6Н, д, J=6,0 Гц), 1,18-1,33 (2Н, м), 1,41-1,56 (1Н, м), 1,75 (2Н, д, J=13,7 Гц), 2,11 (2Н, дт, Jd=9,3 Гц, Jt=11,6 Гц), 2,63-2,77 (1Н, м), 2,85-2,94 (2Н, м), 3,49 (2Н, д, J=5,7 Гц). |
| 2 |
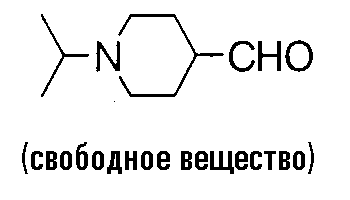 |
ЯМР (CDCl3):
 : 1,04 (6Н, д, J=6,6 Гц), 1,61-1,75 (2Н, м), 1,87-1,96 (2Н, м), 2,16-2,31 (3Н, м), 2,67-2,87 (3Н, м), 9,64 (1Н, д, J=1,3 Гц). : 1,04 (6Н, д, J=6,6 Гц), 1,61-1,75 (2Н, м), 1,87-1,96 (2Н, м), 2,16-2,31 (3Н, м), 2,67-2,87 (3Н, м), 9,64 (1Н, д, J=1,3 Гц). |
| 3 |
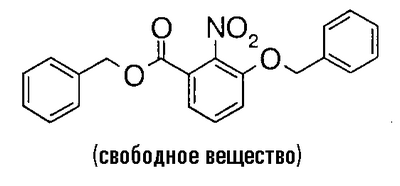 |
ЯМР (ДМСО-d6):
 : 5,33 (4H, с), 7,31-7,45 (10H, м), 7,6l (1Н, дд, J=1,4 Гц, 7,5 Гц), 7,68 (1H, т, J=7,9 Гц), 7,74 (1H, дд, J=1,5 Гц, 8,2 Гц) : 5,33 (4H, с), 7,31-7,45 (10H, м), 7,6l (1Н, дд, J=1,4 Гц, 7,5 Гц), 7,68 (1H, т, J=7,9 Гц), 7,74 (1H, дд, J=1,5 Гц, 8,2 Гц) |
| 4 |
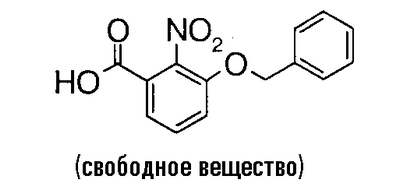 |
ЯМР (ДМСО-d6):
 : 5,32 (2H, с), 7,31-7,44 (5H, м), 7,56 (1H, дд, J=1,4 Гц, 7,5 Гц), 7,68 (1H, т, J=7,9 Гц), 7,74 (1H, дд, J=1,5 Гц, 8,2 Гц) : 5,32 (2H, с), 7,31-7,44 (5H, м), 7,56 (1H, дд, J=1,4 Гц, 7,5 Гц), 7,68 (1H, т, J=7,9 Гц), 7,74 (1H, дд, J=1,5 Гц, 8,2 Гц) |
| 5 |
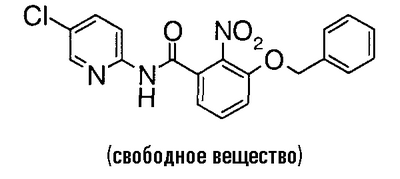 |
ЯМР (CDCl3):
 : 5,23 (2H, с), 7,22-7,26 (2H, м), 7,31-7,39 (5H, м), 7,46 (1H, т, J=8,3 Гц), 7,69 (1Н, дд, J=2,7 Гц, 9,1 Гц), 8,03 (1H, д, J=2,9 Гц), 8,26 (1Н, д, J=8,8 Гц), 9,01 (1H, ушир.с) : 5,23 (2H, с), 7,22-7,26 (2H, м), 7,31-7,39 (5H, м), 7,46 (1H, т, J=8,3 Гц), 7,69 (1Н, дд, J=2,7 Гц, 9,1 Гц), 8,03 (1H, д, J=2,9 Гц), 8,26 (1Н, д, J=8,8 Гц), 9,01 (1H, ушир.с) |
| 6 |
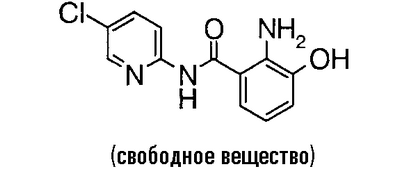 |
ЯМР (ДМСО-d6):
 : 5,93 (2H, с), 6,44 (1Н, т, J=7,9 Гц), 6,82 (1Н, д, J=7,7 Гц), 7,27 (1H, д, J=7,3 Гц), 7,93 (1Н, дд, J=2,6 Гц, 9,0 Гц), 8,14 (1H, д, J=8,8 Гц), 8,41 (1H, д, J=2,4 Гц), 9,60 (1H, с), 10,46 (1H, с) : 5,93 (2H, с), 6,44 (1Н, т, J=7,9 Гц), 6,82 (1Н, д, J=7,7 Гц), 7,27 (1H, д, J=7,3 Гц), 7,93 (1Н, дд, J=2,6 Гц, 9,0 Гц), 8,14 (1H, д, J=8,8 Гц), 8,41 (1H, д, J=2,4 Гц), 9,60 (1H, с), 10,46 (1H, с) |
| 7 |
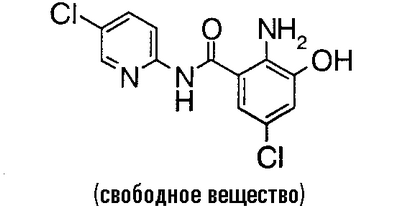 |
ЯМР (ДМСО-d6):
 : 6,04 (2H, ушир.с), 6,80 (1Н, д, J=2,4 Гц), 7,36 (1H, д, J=2,0 Гц), 7,93 (1H, дд, J=2,5 Гц, 8,8 Гц), 8,11 (1H, д, J=9,3 Гц), 8,42 (1Н, д, J=2,5 Гц), 10,16 (1H, ушир.с), 10,67 (1H, с) : 6,04 (2H, ушир.с), 6,80 (1Н, д, J=2,4 Гц), 7,36 (1H, д, J=2,0 Гц), 7,93 (1H, дд, J=2,5 Гц, 8,8 Гц), 8,11 (1H, д, J=9,3 Гц), 8,42 (1Н, д, J=2,5 Гц), 10,16 (1H, ушир.с), 10,67 (1H, с) |
| 8 |
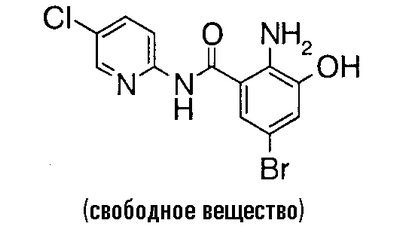 |
ЯМР (ДМСО-d6):
 : 6,06 (2H, ушир.с), 6,90 (1H, д, J=2,0 Гц), 7,47 (1H, д, J=1,9 Гц), 7,93 (1H, дд, J=2,4 Гц, 8,8 Гц), 8,10 (1H, д, J=8,8 Гц), 8,42 (1Н, д, J=2,4 Гц), 10,14 (1H, ушир.с), 10,68 (1H, ушир.с) : 6,06 (2H, ушир.с), 6,90 (1H, д, J=2,0 Гц), 7,47 (1H, д, J=1,9 Гц), 7,93 (1H, дд, J=2,4 Гц, 8,8 Гц), 8,10 (1H, д, J=8,8 Гц), 8,42 (1Н, д, J=2,4 Гц), 10,14 (1H, ушир.с), 10,68 (1H, ушир.с) |
| 9 |
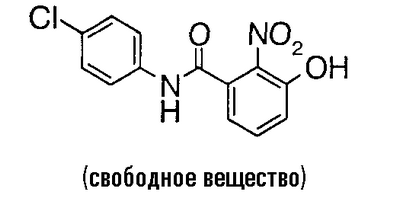 |
ЯМР (CDCl3):
 : 7,08 (1H, д, J=7,1 Гц), 7,26 (1Н, д, J=7,5 Гц), 7,34 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц), 7,57-7,62 (1H, м), 7,79 (1Н, ушир.с), 10,48 (1Н, ушир.с) : 7,08 (1H, д, J=7,1 Гц), 7,26 (1Н, д, J=7,5 Гц), 7,34 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц), 7,57-7,62 (1H, м), 7,79 (1Н, ушир.с), 10,48 (1Н, ушир.с) |
| 10 |
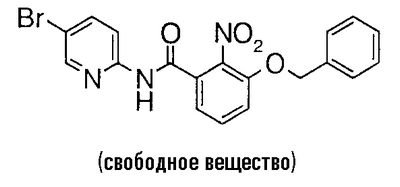 |
ЯМР (CDCl3):
 : 5,24 (2H, с), 7,22-7,27 (2H, м), 7,30-7,41 (5H, м), 7,47 (1H, т, J=8,1 Гц), 7,83 (1H, дд, J=2,4Гц, 8,8 Гц), 8,14-8,17 (1Н, м), 8,22 (1Н, д, J=8,8Гц), 8,90 (1H, ушир.с) : 5,24 (2H, с), 7,22-7,27 (2H, м), 7,30-7,41 (5H, м), 7,47 (1H, т, J=8,1 Гц), 7,83 (1H, дд, J=2,4Гц, 8,8 Гц), 8,14-8,17 (1Н, м), 8,22 (1Н, д, J=8,8Гц), 8,90 (1H, ушир.с) |
| 11 |
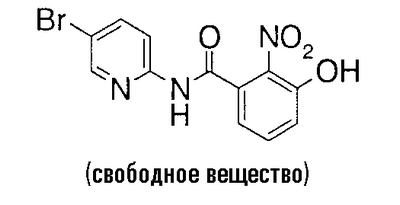 |
ЯМР (ДМСО-d6):
 : 7,25 (2H, д, J=7,9 Гц), 7,50 (1H, т, J=8,0 Гц), 8,00-8,09 (2H, м), 8,5l (1Н, дд, J=0,7 Гц, 2,4 Гц), 11,24 (1H, с), 11,37 (1H, с) : 7,25 (2H, д, J=7,9 Гц), 7,50 (1H, т, J=8,0 Гц), 8,00-8,09 (2H, м), 8,5l (1Н, дд, J=0,7 Гц, 2,4 Гц), 11,24 (1H, с), 11,37 (1H, с) |
| 12 |
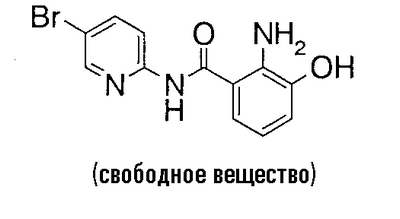 |
ЯМР (ДМСО-d6):
 : 5,94 (2H, ушир.с), 6,44 (1Н, т, J=8,1 Гц), 6,85 (1Н, дд, J=1,0 Гц, 7,8 Гц), 7,27, (1Н, дд, J=1,0 Гц, 8,3 Гц), 8,03 (1H, дд, J=2,4 Гц, 8,8 Гц), 8,09 (1H, д, J=8,8 Гц), 8,48 (1Н, д, J=2,4 Гц), 10,38-10,52 (1H, ушир.) : 5,94 (2H, ушир.с), 6,44 (1Н, т, J=8,1 Гц), 6,85 (1Н, дд, J=1,0 Гц, 7,8 Гц), 7,27, (1Н, дд, J=1,0 Гц, 8,3 Гц), 8,03 (1H, дд, J=2,4 Гц, 8,8 Гц), 8,09 (1H, д, J=8,8 Гц), 8,48 (1Н, д, J=2,4 Гц), 10,38-10,52 (1H, ушир.) |
| 13 |
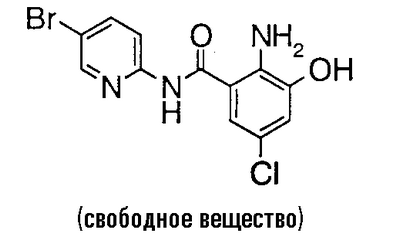 |
ЯМР (ДМСО-d6):
 : 6,04 (2H, ушир.с), 6,80 (1Н, д, J=2,2 Гц), 7,36 (1H, д, J=2,2 Гц), 8,05 (2H, ушир.с), 8,49 (1Н, д, J=1,5 Гц), 10,16 (1H, ушир.с), 10,66 (1H, с) : 6,04 (2H, ушир.с), 6,80 (1Н, д, J=2,2 Гц), 7,36 (1H, д, J=2,2 Гц), 8,05 (2H, ушир.с), 8,49 (1Н, д, J=1,5 Гц), 10,16 (1H, ушир.с), 10,66 (1H, с) |
| Таблица 4 |
| Пример № |
Структурная формула (соль) |
Данные о свойствах |
| 1 |
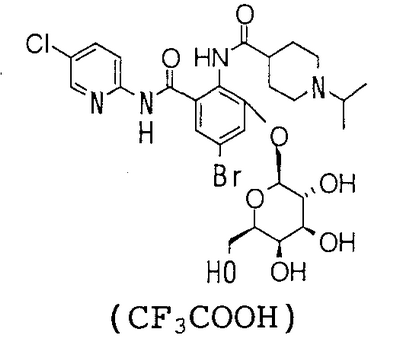 |
ЯМР (ДМСО-d6):
 : 1,01-1,06(1,5H, д, J=5,9 Гц), 1,23 (4,5H, д, J=6,4 Гц), 1,65-1,81 (2H, м), 1,82-2,14 (2H, м), 2,64-2,70 (1H, м), 2,87-2,98 (2H, м), 3,37-4,03 (13H, м), 4,85 (1H, д, J=7,3 Гц), 7,42 (1Н, с), 7,50 (1Н, с), 7,90-7,95 (1H, м), 8,09-8,13 (1Н, м), 8,39-8,41 (1H, м), 8,84 (0,75H, ушир.с), 8,95 (0,25H, ушир.с), 9,46 (0,25H, с), 9,50 (0,75H, с), 10,78 (0,75H, с), 10,92 (0,25H, с) : 1,01-1,06(1,5H, д, J=5,9 Гц), 1,23 (4,5H, д, J=6,4 Гц), 1,65-1,81 (2H, м), 1,82-2,14 (2H, м), 2,64-2,70 (1H, м), 2,87-2,98 (2H, м), 3,37-4,03 (13H, м), 4,85 (1H, д, J=7,3 Гц), 7,42 (1Н, с), 7,50 (1Н, с), 7,90-7,95 (1H, м), 8,09-8,13 (1Н, м), 8,39-8,41 (1H, м), 8,84 (0,75H, ушир.с), 8,95 (0,25H, ушир.с), 9,46 (0,25H, с), 9,50 (0,75H, с), 10,78 (0,75H, с), 10,92 (0,25H, с)
FAB-MS (m/z): 659 (M+H)+ |
| 2 |
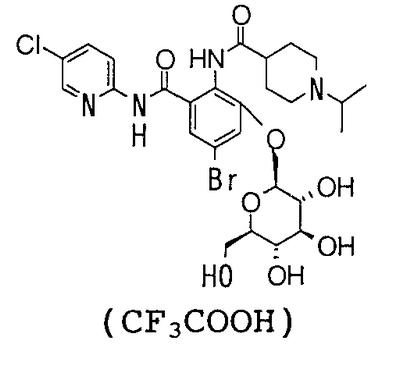 |
ЯМР (ДМСО-d6):
 : 1,02 (1,5H, д, J=5,9 Гц), 1,23 (4,5H, д, J=6,4 Гц), 1,72-2,15 (4H, м), 2,63-2,72 (1H, м), 2,84-2,98 (2H, м), 3,14-3,55 (8H, м), 3,72-3,76 (1Н, м), 4,60-5,25 (5H, м), 7,46 (1Н, д, J=2,1 Гц), 7,5l (1Н, д, J=1,6 Гц), 7,99 (1H, дд, J=1,3 Гц, 9,2 Гц), 8,06-8,10 (1H, м), 8,34-8,36 (1H, м), 8,75 (0,75H, ушир.с), 8,91 (0,25H, ушир.с), 9,24 (0,75H, с), 9,27 (0,25H, : 1,02 (1,5H, д, J=5,9 Гц), 1,23 (4,5H, д, J=6,4 Гц), 1,72-2,15 (4H, м), 2,63-2,72 (1H, м), 2,84-2,98 (2H, м), 3,14-3,55 (8H, м), 3,72-3,76 (1Н, м), 4,60-5,25 (5H, м), 7,46 (1Н, д, J=2,1 Гц), 7,5l (1Н, д, J=1,6 Гц), 7,99 (1H, дд, J=1,3 Гц, 9,2 Гц), 8,06-8,10 (1H, м), 8,34-8,36 (1H, м), 8,75 (0,75H, ушир.с), 8,91 (0,25H, ушир.с), 9,24 (0,75H, с), 9,27 (0,25H, |
| |
|
с), 10,39 (0,75H, с), 10,53 (0,25H, с)
FAB-MS (m/z): 659 (M+H)+ |
| 3 |
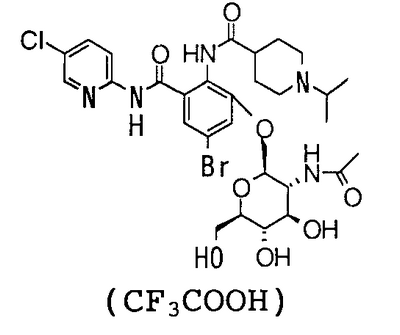 |
ЯМР (ДМСО-d6):
 : 1,02-1,05 (1,2H, м), 1,22 (4,8H, д, J=6,9 Гц), 1,62-2,16 (7H, м), 2,68-2,79 (1Н, м), 2,82-3,02 (3H, м), 3,13-3,23 (2H, м), 3,38-4,13 (9H, м), 4,97-4,99 (1Н, м), 7,37-7,39 (1Н, м), 7,43-7,45 (1H, м), 7,90-7,94 (1Н, м), 7,99 (1Н, д, J=8,3 Гц), 8,08-8,15 (1H, м), 8,38 (0,8H, д, J=2,9 Гц), 8,41 (0,2H, д, J=2,9 Гц), 8,71-8,82 (2H, м), 10,65 (0,8H, с), 10,87 (0,2H, с) : 1,02-1,05 (1,2H, м), 1,22 (4,8H, д, J=6,9 Гц), 1,62-2,16 (7H, м), 2,68-2,79 (1Н, м), 2,82-3,02 (3H, м), 3,13-3,23 (2H, м), 3,38-4,13 (9H, м), 4,97-4,99 (1Н, м), 7,37-7,39 (1Н, м), 7,43-7,45 (1H, м), 7,90-7,94 (1Н, м), 7,99 (1Н, д, J=8,3 Гц), 8,08-8,15 (1H, м), 8,38 (0,8H, д, J=2,9 Гц), 8,41 (0,2H, д, J=2,9 Гц), 8,71-8,82 (2H, м), 10,65 (0,8H, с), 10,87 (0,2H, с)
FAB-MS (m/z): 699 (M+H)+ |
| 4 |
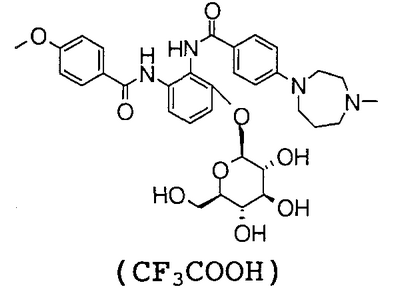 |
ЯМР (ДМСО-d6+CD3OD):
 : 2,16-2,24 (2H, м), 2,86 (3H, с), 3,15-3,27 (4H, м), 3,33-3,60 (7H, м), 3,69-3,76 (2H, м), 3,83 (3H, с), 3,90-3,96 (1H, м), 4,95 (1Н, д, J=7,4 Гц), 6,89 (2H, д, J=8,8 Гц), 7,04 (2H, д, J=8,8 Гц), 7,11 (1H, д, J=8,3 Гц), 7,29-7,33 (1Н, м), 7,52 (1Н, д, J=8,3 Гц), 7,86 (2H, д, J=8,8 Гц), 7,93 (2H, д, J=8,8 Гц) : 2,16-2,24 (2H, м), 2,86 (3H, с), 3,15-3,27 (4H, м), 3,33-3,60 (7H, м), 3,69-3,76 (2H, м), 3,83 (3H, с), 3,90-3,96 (1H, м), 4,95 (1Н, д, J=7,4 Гц), 6,89 (2H, д, J=8,8 Гц), 7,04 (2H, д, J=8,8 Гц), 7,11 (1H, д, J=8,3 Гц), 7,29-7,33 (1Н, м), 7,52 (1Н, д, J=8,3 Гц), 7,86 (2H, д, J=8,8 Гц), 7,93 (2H, д, J=8,8 Гц)
FAB-MS (m/z): 637 (M+H)+ |
| 5 |
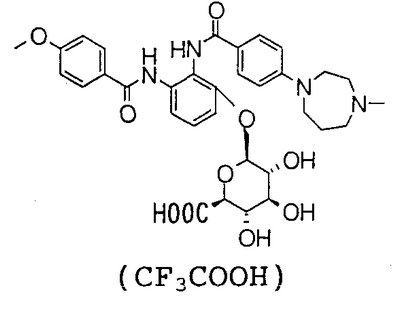 |
ЯМР (ДМСО-d6):
 : 2,13-2,22 (2H, м), 2,85 (3H, д, J=2,9 Гц), 3,12-3,27 (3H, м), 3,33-3,73 (7H, м), 3,82 (3H, с), 3,88-3,97 (1H, м), 4,00 (1H, д, J=9,3 Гц), 5,12 (1Н, д, J=6,3 Гц), 5,29 (3H, ушир.с), 6,88 (2H, д, J=8,8 Гц), 7,03-7,06 (3H, м), 7,29-7,33 (1Н, м), 7,48 (1Н, д, J=7,8 Гц), 7,85 (2H, д, J=9,2 Гц), 7,89 (2H, д, J=8,8 Гц), 9,48 (1H, с), 9,54 (1Н, ушир.с), 9,88 (1Н, с), 12,83 (1H, ушир.с) : 2,13-2,22 (2H, м), 2,85 (3H, д, J=2,9 Гц), 3,12-3,27 (3H, м), 3,33-3,73 (7H, м), 3,82 (3H, с), 3,88-3,97 (1H, м), 4,00 (1H, д, J=9,3 Гц), 5,12 (1Н, д, J=6,3 Гц), 5,29 (3H, ушир.с), 6,88 (2H, д, J=8,8 Гц), 7,03-7,06 (3H, м), 7,29-7,33 (1Н, м), 7,48 (1Н, д, J=7,8 Гц), 7,85 (2H, д, J=9,2 Гц), 7,89 (2H, д, J=8,8 Гц), 9,48 (1H, с), 9,54 (1Н, ушир.с), 9,88 (1Н, с), 12,83 (1H, ушир.с)
FAB-MS (m/z): 65l (M+H)+ |
| 6 |
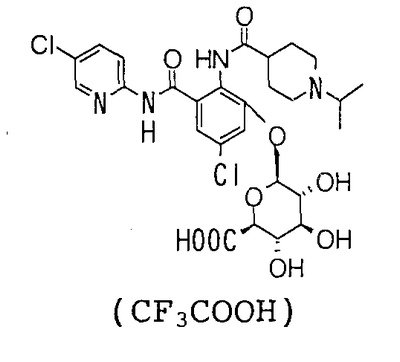 |
ЯМР (ДМСО-d6):
 : 1,02-1,05 (1,2H, м), 1,23 (4,8H, д, J=6,9 Гц), 1,66-2,13 (4H, м), 2,62-3,46 (9H, м), 4,02-4,05 (1H, м), 5,12 (1H, д, J=6,8 Гц), 5,40 (3H, ушир.с), 7,31-7,33 (1H, м), 7,38-7,40 (1H, м), 7,91-7,95 (1H, м), 8,08-8,13 (1Н, м), 8,40 (0,75H, д, J=2,5 Гц), 8,41 (0,25H, д, J=2,5 Гц), 8,76-8,92 (1H, м), 9,46 (0,2H, с), 9,49 (0,8H, с), 10,79 (0,8H, с), 10,93 (0,2H, с), 12,88 (1Н, ушир.с) : 1,02-1,05 (1,2H, м), 1,23 (4,8H, д, J=6,9 Гц), 1,66-2,13 (4H, м), 2,62-3,46 (9H, м), 4,02-4,05 (1H, м), 5,12 (1H, д, J=6,8 Гц), 5,40 (3H, ушир.с), 7,31-7,33 (1H, м), 7,38-7,40 (1H, м), 7,91-7,95 (1H, м), 8,08-8,13 (1Н, м), 8,40 (0,75H, д, J=2,5 Гц), 8,41 (0,25H, д, J=2,5 Гц), 8,76-8,92 (1H, м), 9,46 (0,2H, с), 9,49 (0,8H, с), 10,79 (0,8H, с), 10,93 (0,2H, с), 12,88 (1Н, ушир.с)
FAB-MS (m/z): 627 (M+H)+ |
| 7 |
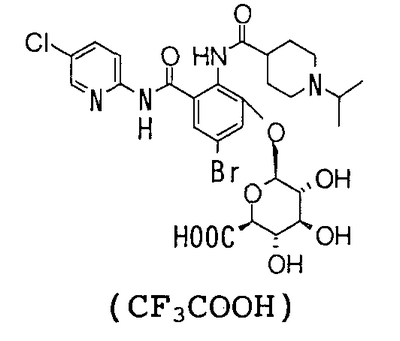 |
ЯМР (ДМСО-d6):
 : 1,02-1,04 (1,2H, м), 1,22 (4,8H, д, J=6,4 Гц), 1,63-2,13 (4H, м), 2,63-2,70 (1Н, м), 2,86-3,14 (2H, м), 3,36-3,46 (6H, м), 4,01-4,05 (1Н, м), 5,12 (1H, д, J=6,9 Гц), 5,18-5,54 (3H, ушир.), 7,43-7,45 (1H, м), 7,47-7,5l (1Н, м), 7,92-7,95 (1H, м), 8,08-8,14 (1H, м), 8,38-8,42 (1H, м), 8,80-9,00 (1H, ушир.), 9,44 (0,2H, с), 9,48 (0,8H, с), 10,79 (0,8H, с), 10,93 (0,2H, с), 12,85 (1H, ушир.с) : 1,02-1,04 (1,2H, м), 1,22 (4,8H, д, J=6,4 Гц), 1,63-2,13 (4H, м), 2,63-2,70 (1Н, м), 2,86-3,14 (2H, м), 3,36-3,46 (6H, м), 4,01-4,05 (1Н, м), 5,12 (1H, д, J=6,9 Гц), 5,18-5,54 (3H, ушир.), 7,43-7,45 (1H, м), 7,47-7,5l (1Н, м), 7,92-7,95 (1H, м), 8,08-8,14 (1H, м), 8,38-8,42 (1H, м), 8,80-9,00 (1H, ушир.), 9,44 (0,2H, с), 9,48 (0,8H, с), 10,79 (0,8H, с), 10,93 (0,2H, с), 12,85 (1H, ушир.с)
FAB-MS (m/z): 672 (M+H)+ |
| 8 |
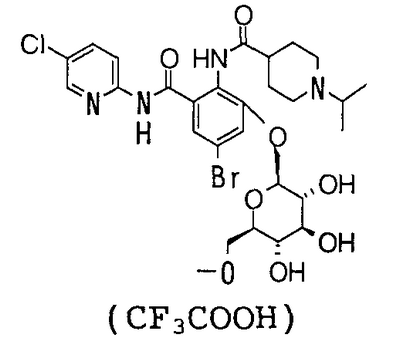 |
ЯМР (ДМСО-d6):
 : 1,02-1,05 (1,8H, м), 1,23 (4,2H, д, J=6,4 Гц), 1,66-2,14 (4H, м), 2,62-2,74 (1H, м), 2,83-3,16 (4H, м), 3,28-3,33 (5H, м), 3,37-3,47 (3H, м), 3,61-3,72 (2H, м), 4,97-4,99 (1Н, м), 5,30-6,20 (3H, ушир.), 7,42-7,44 (1H, м), 7,47-7,49 (1Н, м), 7,92-7,95 (1H, м), 8,07-8,13 (1Н, м), 8,38-8,42 (1H, м), 8,89 (0,3H, ушир.с), 9,07 (0,7H, ушир.с), 9,43 (0,3H, с), 9,47 (0,7H, с), 10,76 (0,7H, с), 10,91 (0,3H, с) : 1,02-1,05 (1,8H, м), 1,23 (4,2H, д, J=6,4 Гц), 1,66-2,14 (4H, м), 2,62-2,74 (1H, м), 2,83-3,16 (4H, м), 3,28-3,33 (5H, м), 3,37-3,47 (3H, м), 3,61-3,72 (2H, м), 4,97-4,99 (1Н, м), 5,30-6,20 (3H, ушир.), 7,42-7,44 (1H, м), 7,47-7,49 (1Н, м), 7,92-7,95 (1H, м), 8,07-8,13 (1Н, м), 8,38-8,42 (1H, м), 8,89 (0,3H, ушир.с), 9,07 (0,7H, ушир.с), 9,43 (0,3H, с), 9,47 (0,7H, с), 10,76 (0,7H, с), 10,91 (0,3H, с)
FAB-MS (m/z): 673 (M+H)+ |
| 9 |
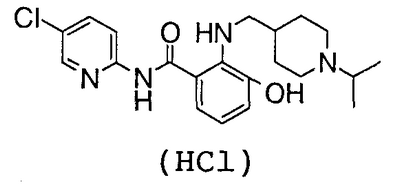 |
ЯМР (ДМСО-d6):
 : 1,27 (6H, д, J=6,3 Гц), 1,60-1,75 (2H, м), 1,95-2,07 (3H, м), 2,89 (2H, кв, J=11,1 Гц), 3,18 (2H, ушир.с), 3,37 (2H, д, : 1,27 (6H, д, J=6,3 Гц), 1,60-1,75 (2H, м), 1,95-2,07 (3H, м), 2,89 (2H, кв, J=11,1 Гц), 3,18 (2H, ушир.с), 3,37 (2H, д,
J=12,7 Гц), 3,85-3,95 (1H, м), 7,15-7,30 (2H, м), 7,32 (1Н, д, J=7,3 Гц), 8,00 (1H, дд, J=2,5 Гц, 8,8 Гц), 8,19 (1H, д, J=8,8 Гц), 8,45 (1H, д, J=2,5 Гц), 10,23-10,40 (1H, ушир.), 10,82-11,32 (1Н, ушир.), 11,53 (1H, ушир.с)
FAB-MS (m/z): 403 (M+H)+ |
| 10 |
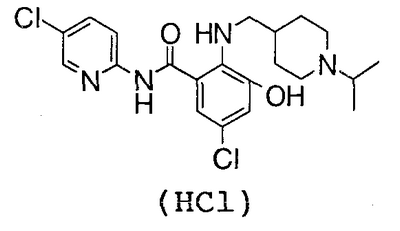 |
ЯМР (ДМСО-d6):
 : 1,23 (6H, д, J=6,9 Гц), 1,45-1,58 (2H, м), 1,75-1,9l (3H, м), 2,83 (2H, кв, J=11,1 Гц), 3,00 (2H, д, J=6,4 Гц), 3,27-3,40 (3H, м), 7,08 (1H, д, J=1,9 Гц), 7,20 (1H, д, J=2,4 Гц), 7,97 (1H, дд, J=2,7 Гц, 8,8 Гц), 8,18 (1Н, д, J=9,3 Гц), 8,43 (1H, д, J=2,4 Гц), 9,94 (1Н, ушир.с), 10,60-10,95 (1H, ушир.), 11,51 (1H, с) : 1,23 (6H, д, J=6,9 Гц), 1,45-1,58 (2H, м), 1,75-1,9l (3H, м), 2,83 (2H, кв, J=11,1 Гц), 3,00 (2H, д, J=6,4 Гц), 3,27-3,40 (3H, м), 7,08 (1H, д, J=1,9 Гц), 7,20 (1H, д, J=2,4 Гц), 7,97 (1H, дд, J=2,7 Гц, 8,8 Гц), 8,18 (1Н, д, J=9,3 Гц), 8,43 (1H, д, J=2,4 Гц), 9,94 (1Н, ушир.с), 10,60-10,95 (1H, ушир.), 11,51 (1H, с)
FAB-MS (m/z): 437 (M+H)+ |
| 11 |
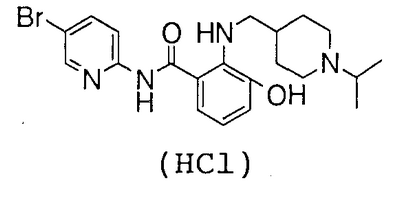 |
ЯМР (ДМСО-d6):
 : 1,25 (6H, д, J=6,4 Гц), 1,50-1,67 (2H, м), 1,75-2,02 (3H, м), 2,86 (2H, кв, J=11,1 Гц), 3,06 (2H, ушир.с), 3,30-3,45 (3H, м), 7,04 (1Н, ушир.с), 7,14 (1H, ушир.с), 7,29 (1H, д,J=7,8 Гц), 8,08 (1Н, дд, J=2,5 Гц, 9,3 Гц), 8,16 (1Н, д, J=8,8 Гц), 8,50 (1H, д, J=2,4 Гц), 10,09 (1Н, ушир.с), 10,20-10,90 (1H, ушир.), 11,60 (1H, ушир.с) : 1,25 (6H, д, J=6,4 Гц), 1,50-1,67 (2H, м), 1,75-2,02 (3H, м), 2,86 (2H, кв, J=11,1 Гц), 3,06 (2H, ушир.с), 3,30-3,45 (3H, м), 7,04 (1Н, ушир.с), 7,14 (1H, ушир.с), 7,29 (1H, д,J=7,8 Гц), 8,08 (1Н, дд, J=2,5 Гц, 9,3 Гц), 8,16 (1Н, д, J=8,8 Гц), 8,50 (1H, д, J=2,4 Гц), 10,09 (1Н, ушир.с), 10,20-10,90 (1H, ушир.), 11,60 (1H, ушир.с)
FAB-MS (m/z): 449 (M+H)+ |
| 12 |
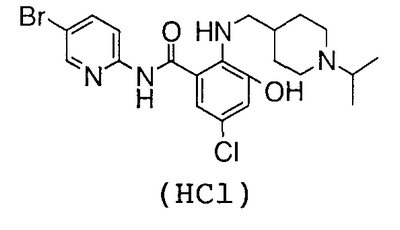 |
ЯМР (ДМСО-d6):
 : 1,23 (6H, д, J=6,9 Гц), 1,44-1,58 (2H, м), 1,75-2,00 (3H, м), 2,83 (2H, кв, J=11,2 Гц), 3,01 (2H, д, J=6,3 Гц), 3,27-3,43 (3H, м), 7,07 (1H, ушир.с), 7,20 (1H, д, J=2,4 Гц), 8,08 (1Н, дд, J=2,4 Гц, 8,8 Гц), 8,13 (1Н, д, J=8,8 Гц), 8,50 (1H, д, J=1,9 Гц), 9,82 (1H, ушир.с), 10,77 (1Н, ушир.с), 11,50 (1H, с) : 1,23 (6H, д, J=6,9 Гц), 1,44-1,58 (2H, м), 1,75-2,00 (3H, м), 2,83 (2H, кв, J=11,2 Гц), 3,01 (2H, д, J=6,3 Гц), 3,27-3,43 (3H, м), 7,07 (1H, ушир.с), 7,20 (1H, д, J=2,4 Гц), 8,08 (1Н, дд, J=2,4 Гц, 8,8 Гц), 8,13 (1Н, д, J=8,8 Гц), 8,50 (1H, д, J=1,9 Гц), 9,82 (1H, ушир.с), 10,77 (1Н, ушир.с), 11,50 (1H, с)
FAB-MS (m/z): 483 (M+H)+ |
| 13 |
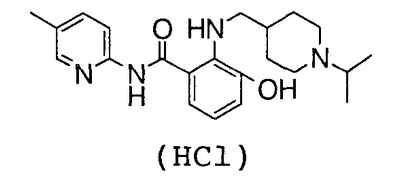 |
ЯМР (ДМСО-d6):
 : 1,26 (6H, д, J=6,8 Гц), 1,57-1,68 (2H, м), 1,83-1,95 (3H, м), 2,30 (3H, с), 2,77-2,89 (2H, м), 3,05 (2H, д, J=6,3 Гц), 3,28- : 1,26 (6H, д, J=6,8 Гц), 1,57-1,68 (2H, м), 1,83-1,95 (3H, м), 2,30 (3H, с), 2,77-2,89 (2H, м), 3,05 (2H, д, J=6,3 Гц), 3,28-
3,40 (3H, м), 6,91 (1H, т, J=7,8 Гц), 7,07 (1H, дд J=1,4 Гц, 7,8Гц), 7,31 (1H, дд, J=1,4 Гц, 7,8 Гц), 7,74 (1H, дд, J=2,0 Гц, 8,3 Гц), 8,03 (1Н, д, J=8,3 Гц), 8,21 (1H, д, J=2,0 Гц), 10,08 (1Н, ушир.с)
FAB-MS (m/z): 383 (M+H)+ |
| 14 |
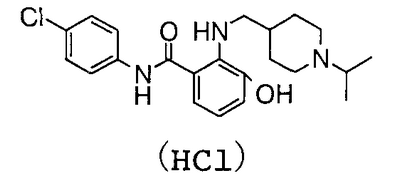 |
ЯМР (ДМСО-d6):
 : 1,22-1,26 (6H, м), 1,49-1,6l (2H, м), 1,74-1,92 (3H, м), 2,78-2,87 (2H, м), 3,10 (2H, д, J=6,9Гц), 3,25-3,35 (3H, м), 6,75-6,79 (1Н, м), 6,95-6,97 (1H, м), 7,07-7,09 (1H, м), 7,35-7,39 (2H, м), 7,72-7,75 (2H, м), 9,65 (1Н, ушир.с), 10,33 (1H, с) : 1,22-1,26 (6H, м), 1,49-1,6l (2H, м), 1,74-1,92 (3H, м), 2,78-2,87 (2H, м), 3,10 (2H, д, J=6,9Гц), 3,25-3,35 (3H, м), 6,75-6,79 (1Н, м), 6,95-6,97 (1H, м), 7,07-7,09 (1H, м), 7,35-7,39 (2H, м), 7,72-7,75 (2H, м), 9,65 (1Н, ушир.с), 10,33 (1H, с)
FAB-MS (m/z): 402 (M+H)+ |
| 15 |
 |
ЯМР (ДМСО-d6):
 : 1,23 (6H, д, J=6,4 Гц), 1,47-1,62 (2H, м), 1,80-1,94 (3H, м), 2,3l (3H, с), 2,84 (2H, кв, J=11,2 Гц), 3,14 (2H, д, J=4,9 Гц), 3,27-3,42 (3H, м), 6,93 (1H, д, J=7,3 Гц), 7,00-7,18 (3H, м), 7,23 (1H, т, J=7,8 Гц), 7,50 (1H, д, J=8,3 Гц), 7,56 (1H, с), 9,72-9,90 (1H, ушир.), 10,33-10,48 (1Н, ушир.) : 1,23 (6H, д, J=6,4 Гц), 1,47-1,62 (2H, м), 1,80-1,94 (3H, м), 2,3l (3H, с), 2,84 (2H, кв, J=11,2 Гц), 3,14 (2H, д, J=4,9 Гц), 3,27-3,42 (3H, м), 6,93 (1H, д, J=7,3 Гц), 7,00-7,18 (3H, м), 7,23 (1H, т, J=7,8 Гц), 7,50 (1H, д, J=8,3 Гц), 7,56 (1H, с), 9,72-9,90 (1H, ушир.), 10,33-10,48 (1Н, ушир.)
FAB-MS (m/z): 382 (M+H)+ |
| 16 |
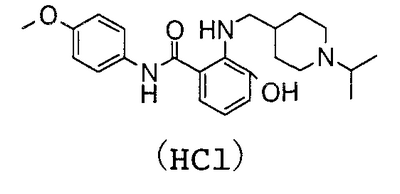 |
ЯМР (ДМСО-d6):
 : 1,18-1,26 (6H, м), 1,42-1,63 (2H, м), 1,68-2,04 (3H, м), 2,77-2,93 (2H, м), 3,00-3,70 (5H, м), 3,75 (3H, м), 6,84-7,24 (5H, м), 7,62 (2H, д, J=8,8 Гц), 9,67 (1H, ушир.с), 10,33 (1Н, ушир.с) : 1,18-1,26 (6H, м), 1,42-1,63 (2H, м), 1,68-2,04 (3H, м), 2,77-2,93 (2H, м), 3,00-3,70 (5H, м), 3,75 (3H, м), 6,84-7,24 (5H, м), 7,62 (2H, д, J=8,8 Гц), 9,67 (1H, ушир.с), 10,33 (1Н, ушир.с)
FAB-MS (m/z): 398 (M+H)+ |
| 17 |
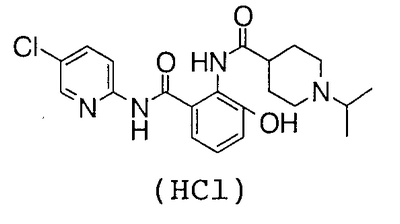 |
ЯМР (ДМСО-d6):
 : 1,06 (l,5H, д, J=6,4 Гц), 1,24 (4,5H, д, J=6,3 Гц), 1,75-2,10 (4H, м), 2,63-3,45 (6H, м), 7,01-7,09 (2H, м), 7,12-7,20 (1Н, м), 7,90-7,96 (1Н, м), 8,13 (0,25H, д, J=8,3 Гц), 8,15 (0,75H, д, J=8,8 Гц), 8,37 (0,75H, д, J=3,0 Гц), 8,39 (0,25H, д, J=2,5 Гц), 9,20-9,30 (0,75H, ушир.), 9,41 (0,75H, с), 9,46 (0,25H, с), 9,74-9,80 : 1,06 (l,5H, д, J=6,4 Гц), 1,24 (4,5H, д, J=6,3 Гц), 1,75-2,10 (4H, м), 2,63-3,45 (6H, м), 7,01-7,09 (2H, м), 7,12-7,20 (1Н, м), 7,90-7,96 (1Н, м), 8,13 (0,25H, д, J=8,3 Гц), 8,15 (0,75H, д, J=8,8 Гц), 8,37 (0,75H, д, J=3,0 Гц), 8,39 (0,25H, д, J=2,5 Гц), 9,20-9,30 (0,75H, ушир.), 9,41 (0,75H, с), 9,46 (0,25H, с), 9,74-9,80
(0,25H, ушир.), 9,84 (0,75H, с), 9,85 (0,25H, с), 10,39 (0,75H, с), 10,59 (0,25H, с)
FAB-MS (m/z): 417 (M+H)+ |
| 18 |
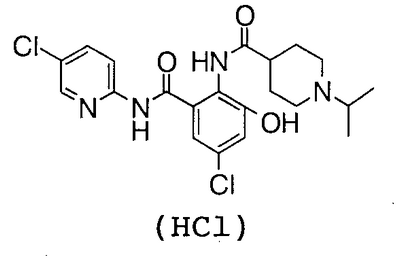 |
ЯМР (ДМСО-d6):
 : 1,05 (1,8H, д, J=6,8 Гц), 1,25 (4,2H, д, J=6,3 Гц), 1,81-2,18 (4H, м), 2,63-3,26 (4H, м), 3,34-3,44 (2H, м), 7,05-7,06 (1Н, м), 7,15-7,17 (1Н, м), 7,91-7,96 (1H, м), 8,09-8,13 (1Н, м), 8,37-8,41 (1H, м), 9,47 (0,7H, с), 9,56 (0,3H, с), 10,45-10,68 (1,7H, м), 10,41 (0,3H, ушир.с), 10,61 (0,7H, с), 10,81 (0,3H, с) : 1,05 (1,8H, д, J=6,8 Гц), 1,25 (4,2H, д, J=6,3 Гц), 1,81-2,18 (4H, м), 2,63-3,26 (4H, м), 3,34-3,44 (2H, м), 7,05-7,06 (1Н, м), 7,15-7,17 (1Н, м), 7,91-7,96 (1H, м), 8,09-8,13 (1Н, м), 8,37-8,41 (1H, м), 9,47 (0,7H, с), 9,56 (0,3H, с), 10,45-10,68 (1,7H, м), 10,41 (0,3H, ушир.с), 10,61 (0,7H, с), 10,81 (0,3H, с)
FAB-MS (m/z): 451 (M+H)+ |
| 19 |
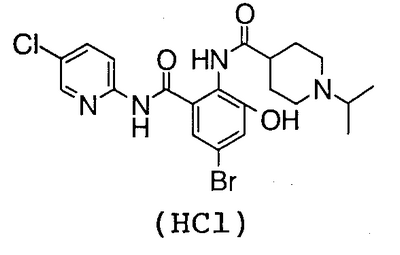 |
ЯМР (ДМСО-d6):
 : 1,04 (1,8H, д, J=6,8 Гц), 1,24 (4,2H, д, J=6,3 Гц), 1,74-2,12 (4H, м), 2,60-3,45 (6H, м), 7,15-7,19 (1H, м), 7,23-7,27 (1Н, м), 7,89-7,97 (1Н, м), 8,07-8,14 (1H, м), 8,35-8,4l (1Н, м), 9,39-9,55 (1,7H, м), 9,98-10,10 (0,3H, ушир.), 10,44-10,50 (1H, м), 10,62 (0,7H, с), 10,81 (0,3H, с) : 1,04 (1,8H, д, J=6,8 Гц), 1,24 (4,2H, д, J=6,3 Гц), 1,74-2,12 (4H, м), 2,60-3,45 (6H, м), 7,15-7,19 (1H, м), 7,23-7,27 (1Н, м), 7,89-7,97 (1Н, м), 8,07-8,14 (1H, м), 8,35-8,4l (1Н, м), 9,39-9,55 (1,7H, м), 9,98-10,10 (0,3H, ушир.), 10,44-10,50 (1H, м), 10,62 (0,7H, с), 10,81 (0,3H, с)
FAB-MS (m/z): 497 (M+H)+ |
| 20 |
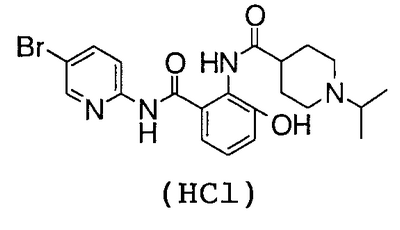 |
ЯМР (ДМСО-d6):
 : 1,06 (1,5H, д, J=6,4 Гц), 1,24 (4,5H, д, J=6,3 Гц), 1,75-2,08 (4H, м), 2,65-3,42 (6H, м), 7,01-7,08 (2H, м), 7,12-7,19 (1Н, м), 8,01-8,13 (2H, м), 8,44 (0,75H, д, J=2,5 Гц), 8,46 (0,25H, д, J=2,4 Гц), 9,25 (0,75H, ушир.с), 9,41 (0,75H, с), 9,46 (0,25H, с), 9,77 (0,25H, ушир.с), 9,84 (0,75H, с), 9,86 (0,25H, с), 10,39 (0,75H, с), 10,58 (0,25H, с) : 1,06 (1,5H, д, J=6,4 Гц), 1,24 (4,5H, д, J=6,3 Гц), 1,75-2,08 (4H, м), 2,65-3,42 (6H, м), 7,01-7,08 (2H, м), 7,12-7,19 (1Н, м), 8,01-8,13 (2H, м), 8,44 (0,75H, д, J=2,5 Гц), 8,46 (0,25H, д, J=2,4 Гц), 9,25 (0,75H, ушир.с), 9,41 (0,75H, с), 9,46 (0,25H, с), 9,77 (0,25H, ушир.с), 9,84 (0,75H, с), 9,86 (0,25H, с), 10,39 (0,75H, с), 10,58 (0,25H, с)
FAB-MS (m/z): 461 (M+H)+ |
| 21 |
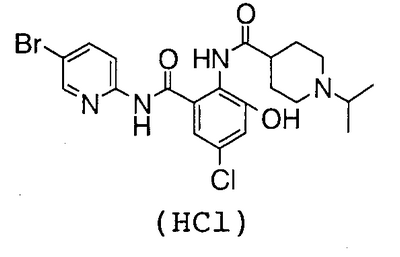 |
ЯМР (ДМСО-d6):
 : 1,03 (1,2H, д, J=6,8 Гц), 1,23 (4,8H, д, J=6,3 Гц), 1,68-2,10 (4H, м), 2,60-3,30 (6H, м), 7,05-7,09 (2H, м), 8,01-8,10 (2H, м), 8,44-8,48 (1Н, м), 8,98 (0,8H, ушир.с), 9,30-9,52 (1,2H, м), 10,38 (0,8H, с), 10,40 (0,2H, с), 10,62 (0,8H, с), : 1,03 (1,2H, д, J=6,8 Гц), 1,23 (4,8H, д, J=6,3 Гц), 1,68-2,10 (4H, м), 2,60-3,30 (6H, м), 7,05-7,09 (2H, м), 8,01-8,10 (2H, м), 8,44-8,48 (1Н, м), 8,98 (0,8H, ушир.с), 9,30-9,52 (1,2H, м), 10,38 (0,8H, с), 10,40 (0,2H, с), 10,62 (0,8H, с),
10,81 (0,2H, с)
FAB-MS (m/z): 497 (M+H)+ |
| 22 |
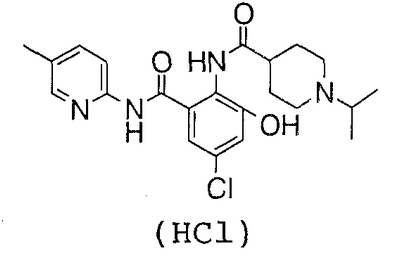 |
ЯМР (ДМСО-d6):
 : 1,04 (1,5H, д, J=6,3 Гц), 1,26 (4,5H, д, J=6,9 Гц), 1,83-2,22 (4H, м), 2,33 (0,8H, с), 2,35 (2,2H, с), 2,64-3,23 (4H, м), 3,32-3,40 (2H, м), 7,11-7,13 (1H, м), 7,22-7,25 (1Н, м), 7,85-7,91 (1Н, м), 7,95-8,08 (1H, м), 8,25-8,29 (1Н, м), 9,65 (0,75H, с), 9,70 (0,25H, с), 10,12 (0,75H, ушир.с), 10,58 (0,25H, ушир.с), 10,79 (1Н, ушир.с), 11,36 (0,25H, с), 11,49 (0,75H, с) : 1,04 (1,5H, д, J=6,3 Гц), 1,26 (4,5H, д, J=6,9 Гц), 1,83-2,22 (4H, м), 2,33 (0,8H, с), 2,35 (2,2H, с), 2,64-3,23 (4H, м), 3,32-3,40 (2H, м), 7,11-7,13 (1H, м), 7,22-7,25 (1Н, м), 7,85-7,91 (1Н, м), 7,95-8,08 (1H, м), 8,25-8,29 (1Н, м), 9,65 (0,75H, с), 9,70 (0,25H, с), 10,12 (0,75H, ушир.с), 10,58 (0,25H, ушир.с), 10,79 (1Н, ушир.с), 11,36 (0,25H, с), 11,49 (0,75H, с)
FAB-MS (m/z): 431 (M+H)+ |
| 23 |
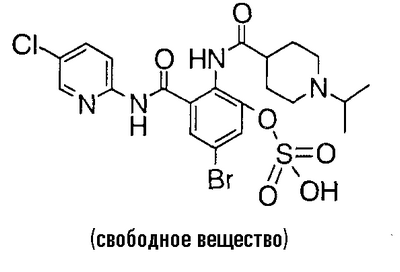 |
ЯМР (ДМСО-d6):
 : 1,08 (1,2H, д, J=6,8 Гц), 1,22 (4,8H, д, J=6,8 Гц), 1,65-2,21 (4H, м), 2,55-3,50 (6H, м), 7,45-7,50 (1H, м), 7,62-7,70 (1Н, м), 7,89-7,95 (1Н, м), 8,05-8,14 (1H, м), 8,36-8,42 (1Н, м), 8,63-8,79 (1H, ушир.), 9,51 (0,8H, с), 9,67 (0,2H, с), 10,78 (0,8H, с), 10,92 (0,2H, с) : 1,08 (1,2H, д, J=6,8 Гц), 1,22 (4,8H, д, J=6,8 Гц), 1,65-2,21 (4H, м), 2,55-3,50 (6H, м), 7,45-7,50 (1H, м), 7,62-7,70 (1Н, м), 7,89-7,95 (1Н, м), 8,05-8,14 (1H, м), 8,36-8,42 (1Н, м), 8,63-8,79 (1H, ушир.), 9,51 (0,8H, с), 9,67 (0,2H, с), 10,78 (0,8H, с), 10,92 (0,2H, с)
FAB-MS (m/z): 575 (M-H)– |
| 24 |
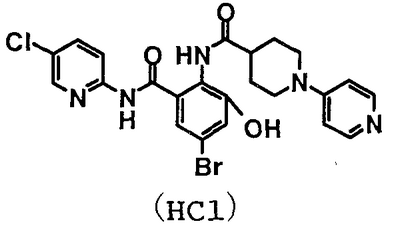 |
ЯМР (ДМСО-d6):
 : 1,46-1,57 (2H, м), 1,82-1,90 (2H, м), 2,81-2,90 (1H, м), 3,20-3,28 (2H, м), 4,08-4,14 (2H, м), 7,13-7,16 (3H, м), 7,27 (1Н, д, J=1,5 Гц), 7,88 (1H, дд, J=1,5 Гц, 8,8 Гц), 8,09 (1Н, д, J=Гц), 8,21 (2H, д, J=7,3 Гц), 8,33 (1Н, д, J=Гц), 9,42 (1H, с), 10,50 (1Н, с), 10,56 (1Н, с), 13,49 (1H, с) : 1,46-1,57 (2H, м), 1,82-1,90 (2H, м), 2,81-2,90 (1H, м), 3,20-3,28 (2H, м), 4,08-4,14 (2H, м), 7,13-7,16 (3H, м), 7,27 (1Н, д, J=1,5 Гц), 7,88 (1H, дд, J=1,5 Гц, 8,8 Гц), 8,09 (1Н, д, J=Гц), 8,21 (2H, д, J=7,3 Гц), 8,33 (1Н, д, J=Гц), 9,42 (1H, с), 10,50 (1Н, с), 10,56 (1Н, с), 13,49 (1H, с)
FAB-MS (m/z): 532 (M+H)+ |
| 25 |
 |
ЯМР (ДМСО-d6):
 : 1,44-1,55 (2H, м), 1,75-1,81 (2H, м), 2,48-2,54 (1H, м), 2,66-2,74 (2H, м), 2,82 (3H, с), 3,45-3,51 (2H, м), 7,16-7,19 (2H, м), 7,93 (1Н, дд, J=3,0 Гц, 8,8 Гц), 8,12 (1H, д, J=8,8 Гц), 8,38 (1H, д, J=2,4 Гц), 9,32 (1Н, ушир.с), 10,28 (1Н, ушир.с), 10,57 (1H, с) : 1,44-1,55 (2H, м), 1,75-1,81 (2H, м), 2,48-2,54 (1H, м), 2,66-2,74 (2H, м), 2,82 (3H, с), 3,45-3,51 (2H, м), 7,16-7,19 (2H, м), 7,93 (1Н, дд, J=3,0 Гц, 8,8 Гц), 8,12 (1H, д, J=8,8 Гц), 8,38 (1H, д, J=2,4 Гц), 9,32 (1Н, ушир.с), 10,28 (1Н, ушир.с), 10,57 (1H, с)
FAB-MS (m/z): 451 (M+H)+ |
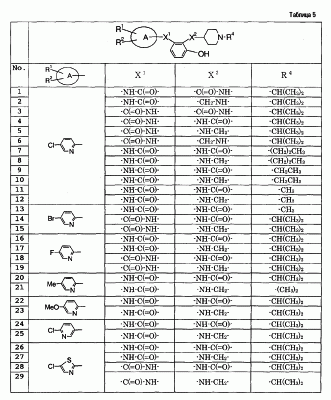
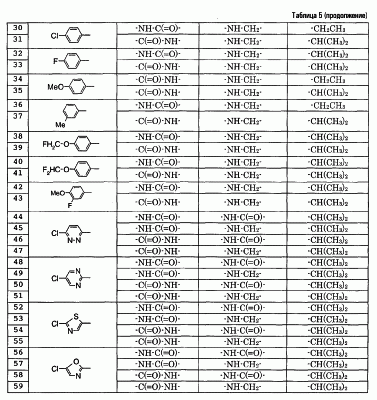
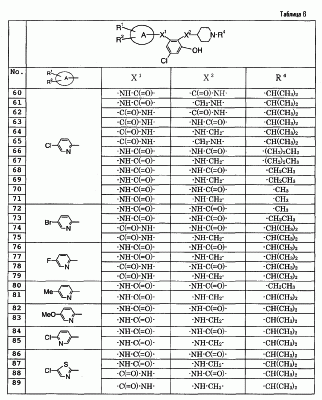
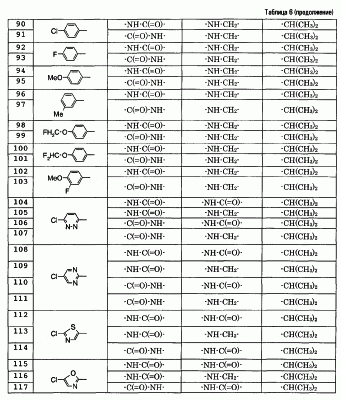
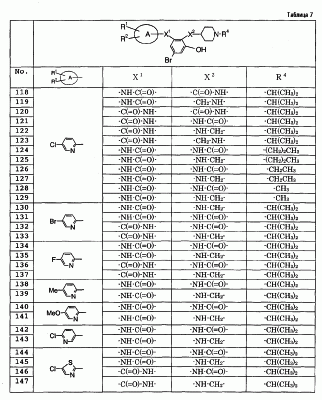
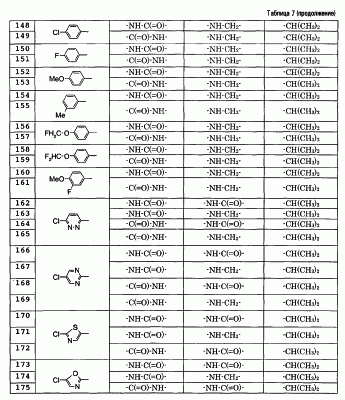
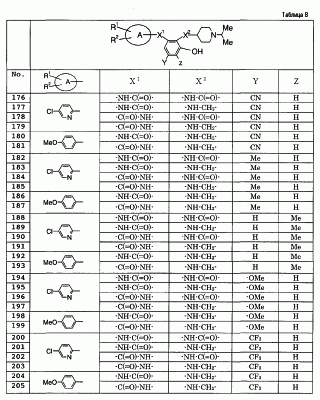
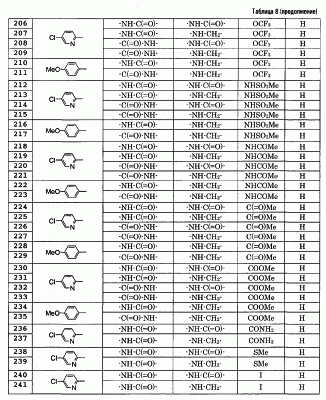
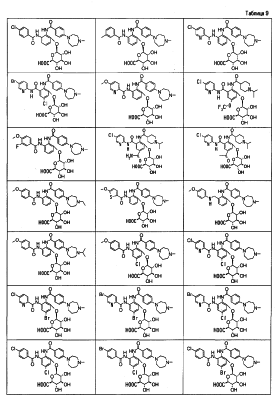
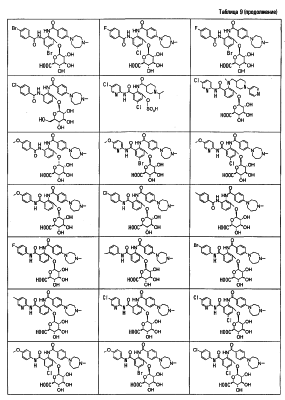
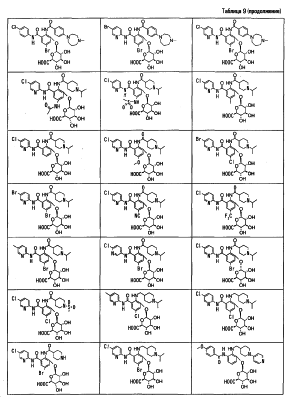
Формула изобретения
1. Производное бензола формулы (I), или его соль
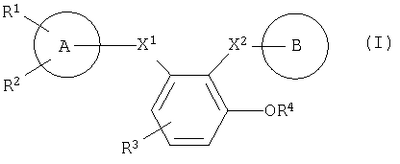
где:
X1: -C(=O)-NR5-, -NR5-C(=O)-;
X2: -NR6-C(=O)-, -NR6-CH2-;
R1: атом галогена, низший алкил или низшая алкоксигруппа;
R2 и R3, одинаковые или разные, и каждый означает атом водорода или атом галогена;
R4: атом водорода, -SO3Н- или остаток сахара;
кольцо А: кольцо бензола или пиридина;
кольцо В: кольцо пиперидина, где атом азота замещен R7, когда R4 означает атом водорода; либо когда R4 означает остаток сахара, кольцо В означает кольцо пиперидина, в котором атом азота замещен R7, или кольцо бензола, замещенное группой диазепана формулы:
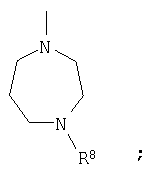
R5 и R6 означают атом водорода,
R7 и R8 каждый означают низший алкил, -SO2-(низший алкил) или пиридин,
при условии, что, когда X2 означает -NR6-C(=O)- и R4 означает атом водорода, кольцо А означает пиридин
2. Соединение по п.1 или его соль, где R4 означает атом водорода, -SO3Н- или остаток глюкуроновой кислоты.
3. Соединение по п.1 или его соль, где R4 означает атом водорода.
4. Соединение по п.1, выбранное из следующих соединений:
4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′- -D-галактопиранозилокси-1-изопропилпиперидин-4-карбоксанилид, -D-галактопиранозилокси-1-изопропилпиперидин-4-карбоксанилид,
2′-(2-ацетамидо-2-дезокси- -D-глюкопиранозилокси)-4′-бром-6′-[(5-хлор-2-пиридил)карбамоил]-1-изопропилпиперидин-4-карбоксанилид, -D-глюкопиранозилокси)-4′-бром-6′-[(5-хлор-2-пиридил)карбамоил]-1-изопропилпиперидин-4-карбоксанилид,
4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′- -D-глюкопиранозилокси-1-изопропилпиперидин-4-карбоксанилид, -D-глюкопиранозилокси-1-изопропилпиперидин-4-карбоксанилид,
5-хлор-3-[(5-хлор-2-пиридил)карбамоил]-2-[(1-изопропилпиперидин-4-карбонил)амино]фенил- -D-глюкопиранозид-уроновая кислота, -D-глюкопиранозид-уроновая кислота,
5-бром-3-[(5-хлор-2-пиридил)карбамоил]-2-[(1-изопропилпиперидин-4-карбонил)амино]фенил- -D-глюкопиранозид-уроновая кислота, -D-глюкопиранозид-уроновая кислота,
4′-хлор-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропил-пиперидин-4-карбоксанилид,
4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропил-пиперидин-4-карбоксанилид,
2′-[(5-бром-2-пиридил)карбамоил]-4′-хлор-6′-гидрокси-1-изопропил-пиперидин-4-карбоксанилид,
5-хлор-N-(5-хлор-2-пиридил)-3-гидрокси-2-{[(1-изопропил-4-пиперидил)метил]амино}бензамид,
N-(5-бром-2-пиридил)-5-хлор-3-гидрокси-2-{[(1-изопропил-4-пиперидил)метил]амино}бензамид,
3-[(4-метоксибензоил)амино]-2-{[4-(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил- -D-глюкопиранозид и -D-глюкопиранозид и
3-[(4-метоксибензоил)амино]-2-{[4-(4-метил-1,4-диазепан-1-ил)бензоил]амино}фенил- -D-глюкопиранозид-уроновая кислота, или его соль. -D-глюкопиранозид-уроновая кислота, или его соль.
5. Фармацевтическая композиция, ингибирующая активированный фактор Х коагуляции крови, включающая соединение по п.1 или его соль в качестве активного ингредиента, вместе с фармацевтически приемлемым носителем или наполнителем.
Приоритет по пунктам формулы:
п.1:
приоритет от 22.12.2000 по дате подачи заявки JP 20000390321, в части признаков: R4 – остаток сахара;
кольцо А: кольцо бензола;
кольцо В: кольцо бензола, замещенное группой диазепана;
приоритет от 21.11.2001 по дате подачи заявки PCT/JP 01/10176, в части признаков: R4: -SO3H-;
R7 и R8: -SO2– (низший алкил) или пиридин;
приоритет от 22.11.2000 по дате подачи заявки JP 20000356146, в части остальных признаков.
п.2:
приоритет от 22.12.2000 по дате подачи заявки JP 20000390321, в части признаков: R4 означает остаток глюкуроновой кислоты;
приоритет от 21.11.2001 по дате подачи заявки PCT/JP 01/10176, в части признаков: R4: -SO3Н-;
приоритет от 22.11.2000 по дате подачи заявки JP 20000356146, в части признаков: R4 означает атом водорода.
п.3:
приоритет от 22.11.2000 по дате подачи заявки JP 20000356146.
п.4:
приоритет от 22.11.2000 по дате подачи заявки JP 20000356146, в части соединений:
4′-хлор-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид,
4′-бром-2′-[(5-хлор-2-пиридил)карбамоил]-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид,
2′-[(5-бром-2-пиридил)карбамоил]-4′-хлор-6′-гидрокси-1-изопропилпиперидин-4-карбоксанилид,
5-хлор-N-(5-хлор-2-пиридил)-3-гидрокси-2-{[(1-изопропил-4-пиперидил)метил]амино}бензамид,
N-(5-бром-2-пиридил)-5-хлор-3-гидрокси-2-{[(1-изопропил-4-пиперидил)метил]амино}бензамид;
приоритет от 22.12.2000 по дате подачи заявки JP 20000390321, в части остальных соединений.
п.5:
приоритет от 22.12.2000 по дате подачи заявки JP 20000390321, в части композиций включающих соединения I, где:
R4 – остаток сахара;
кольцо А: кольцо бензола;
кольцо В: кольцо бензола, замещенное группой диазепана;
приоритет от 21.11.2001 по дате подачи заявки PCT/JP 01/10176, в части композиций включающих соединения I, где:
R4: -SO3H-;
R7 и R8: -SO2-(низший алкил) или пиридин;
приоритет от 22.11.2000 по дате подачи заявки JP 20000356146, в части остальных соединений I.
|
|