|
|
(21), (22) Заявка: 2002103219/04, 28.07.2000
(24) Дата начала отсчета срока действия патента:
28.07.2000
(30) Конвенционный приоритет:
30.07.1999 GB 9918037.4
(43) Дата публикации заявки: 20.09.2003
(45) Опубликовано: 10.05.2006
(56) Список документов, цитированных в отчете о
поиске:
SU 1582985 A3, 30.07.1990. WO 93/22288 A1, 11.11.1993. WO 98/01127 A1, 15.01.1998.
(85) Дата перевода заявки PCT на национальную фазу:
28.02.2002
(86) Заявка PCT:
EP 00/07309 (28.07.2000)
(87) Публикация PCT:
WO 01/09095 (08.02.2001)
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, ЕВРОМАРКПАТ, пат.пов. И.А.Веселицкой, рег. № 11
|
(72) Автор(ы):
АШЕР Герд (AT),
БЕРНЕР Хайнц (AT),
ХИЛЬДЕБРАНДТ Иоганнес (AT)
(73) Патентообладатель(и):
Сандоз АГ (CH)
|
(54) ПРОИЗВОДНЫЕ МУТИЛИНОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИБАКТЕРИАЛЬНЫХ СРЕДСТВ
(57) Реферат:
Настоящее изобретение относится к производным мутилинов формулы I
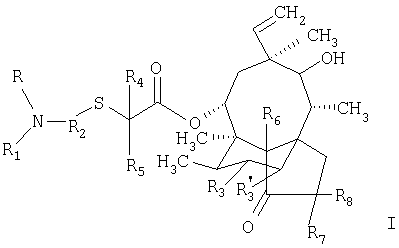
в которой R – водород или алкил;
R1 обозначает группу формулы
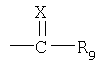
в которой
Х – сера или кислород, NR10 или N+(R’10)2;
R9 обозначает аминогруппу, алкил, арил, гетероциклил или меркаптогруппу, и если Х обозначает атом кислорода, дополнительным значением R9 является атом водорода;
R2 обозначает фенилен;
R4 – водород или алкил;
R5 – водород или алкил;
R3, R’3, R6, R7 и R8 каждый независимо друг от друга обозначает водород, или дейтерия; или
R и R2 совместно с азотным атомом, с которым они связаны, образуют 5 или 6-членное кольцо, a R1 обозначает группу формулы
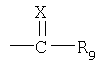
Описаны также фармацевтическая композиция на основе соединений I, способ лечения обусловленных микробами заболеваний и применение соединений в качестве антибактериальных средств в медицине и ветеринарии. 4 н. и 8 з.п. ф-лы, 2 табл.
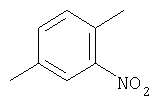
Настоящее изобретение относится к соединениям, обладающим, например, антимикробным, в частности антибактериальным, действием; более конкретно настоящее изобретение относится к мутилинам.
По одному из объектов настоящего изобретения предлагается соединение формулы
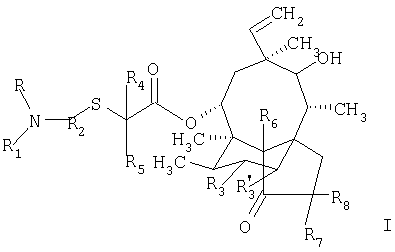
в которой
R обозначает водородный атом или алкил;
R1 обозначает водородный атом или группу формулы
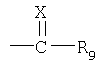
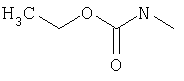
в которой
Х обозначает атом серы или кислорода, NR10, где R10 обозначает водородный атом или алкил, или N+(R’10)2, где R’10 обозначает алкил в присутствии соответствующего аниона;
R9 обозначает аминогруппу, алкил, арил, гетероциклил или меркаптогруппу, а если Х обозначает атом кислорода, дополнительным значением R9 является водородный атом;
R2 обозначает арилен или гетероциклен;
R4 обозначает водородный атом или алкил;
R5 обозначает водородный атом или алкил;
Р3 и R’3 обозначают атомы водорода или дейтерия;
R6, R7 и R8 обозначают атомы водорода или дейтерия; или
R1 и R2 совместно с азотным атомом, с которым они связаны, образуют неароматический гетероциклен. a R1 обозначает группу формулы
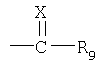
в которой Х и R9 имеют значения, указанные выше.
R обозначает водородный атом или алкил, например С1-С4алкил; предпочтительно водородный атом;
R1 обозначает водородный атом или группу формулы -C(=X)R9, например группу формулы -C(=X)R9;
Х обозначает атом серы или кислорода, NR10, где R10 обозначает водородный атом или алкил, например С1-С4алкил, или N+(R’10)2, где R’10 обозначает алкил, например С1-С4алкил, в присутствии соответствующего аниона, предпочтительно атома кислорода;
R9 обозначает аминогруппу, алкил, алкокси, например С1-С4алкокси, арил, гетероциклил или меркаптогруппу, например группу формулы -S-R12, в которой R12 обозначает алкил, например С1-С4алкил, а если Х обозначает атом кислорода, R9 обозначает водородный атом, аминогруппу, алкил, алкокси, арил, гетероциклил или меркаптогруппу.
Предпочтительным значением R9 является алкил, например C1-С8алкил, такой, как С1-С4алкил, например незамещенный или замещенный алкил, в частности замещенный группами, которые обычны для химии плевромутилина, например одной или несколькими такими группами, как аминогруппа, атом галогена, такой, как фтор, в частности трифторалкил, такой, как трифторметил; гуанидинил, гидроксил, гетероциклил, например включающий 5- или 6-членное кольцо, содержащее 1 или 2 азотных атома, в частности имидазолил. Если R9 обозначает алкил, замещенный аминогруппой, предпочтительным значением R9 является остаток аминокислоты, включая, например, валин, гистидин, аргинин, пипеколиновую кислоту, причем этот остаток включает тот фрагмент аминокислоты, который остается в результате отщепления карбоксильной группы.
Или предпочтительным значением R9 является гетероциклил, например 5- или 6-членный гетероциклил, в частности содержащий один или два гетероатома, выбранных, например, из атомов азота; например сконденсированный с дополнительным кольцом (кольцевой системой), в частности с дополнительной кольцевой системой, включающей фенил; предпочтительно пиперидинил, пирролидинил, пирролил, пиридинил, бензимидазолил, хинолинил, триазолил; например незамещенный гетероциклил или замещенный гетероциклил, в частности замещенный одним или несколькими алкилами, например метилом, гидроксилом, амино-, нитрогруппой или группой COOR13, в которой R13 обозначает алкил, например С1-С4алкил, такой, как трет-бутил; например предпочтительно замещенный одним или несколькими такими группами, как алкил, гидроксил, амино- и нитрогруппа.
Если R9 обозначает гетероциклил, например пиперидинил, то водородные атомы гетероциклического кольца, например пиперидинила, водородный атом, связанный с азотным атомом кольцевой системы, могут быть замещены атомом дейтерия.
К аминогруппам в качестве значения R9 относятся свободная аминогруппа, алкил- и диалкиламиногруппы, а также аминогруппа, замещенная -COOR11, в которой R11 обозначает алкил, предпочтительно С1-С4алкил.
R2 обозначает арилен, такой, как фенилен, например незамещенный арилен или замещенный арилен, например замещенный группами, которые обычны для химии плевромутилина, например одной или несколькими такими группами, как гидроксил, алкил, например С1-С4алкил; атом галогена, такой, как фтор, в частности трифторалкил; нитрогруппа; или гетероциклен. В настоящем описании понятие “гетероциклен” используют для обозначения гетероциклического кольца, у которого две связи являются связями с соседним азотным атомом и с серной группой у соединения формулы 1. Предпочтительным значением R2 является арилен, например незамещенный арилен или арилен, замещенный одной или несколькими группами, которые обычны для химии плевромутилина, например алкилом, в частности С1-С4алкилом, таким, как метил; атомом галогена, таким, как фтор; трифторалкилом, таким, как трифторметил. В соединении формулы I арилен и гетероциклен, обозначенные R2, связаны с атомом серы и с -N(R)(R1). В соответствующей кольцевой системе обе эти связи могут быть смежными или находиться в другом положении, например в орто-, пара- и мета-положениях. В предпочтительном соединении формулы I гетероциклен связан с атомом серы и с -N(R)(R1) через углеродные атомы гетероциклена.
R4 обозначает водородный атом или алкил, предпочтительно водородный атом или С1-С4алкил, например метил.
R5 обозначает водородный атом или алкил, предпочтительно водородный атом или С1-С4алкил, такой, как метил, например незамещенный алкил или замещенный алкил, в частности замещенный гидроксилом; более предпочтительным значением R5 является водородный атом.
R3 и R’3 обозначают атомы водорода или дейтерия, предпочтительно водорода. R6, R7 и R8 обозначают атомы водорода или дейтерия.
Если R1 обозначает группу формулы -C(=X)-R9, R и R2 совместно с азотным атомом, с которым они связаны, могут образовывать неароматический гетероциклен, например включающий 5 или 6 кольцевых членов и один гетероатом, в частности азота, предпочтительно включая пиперидинил, пирролидинил, предпочтительно пиперидин. В предпочтительном варианте этот гетероциклен связан с серной группой и с группой -N(R1) через углеродные атомы гетероциклена. Во всех случаях, если не указано иное, гетероциклил или гетероциклен включает 5- или 6-членное кольцо, содержащее от 1 до 4 гетероатомов, выбранных из S, О и N, например N, необязательно сконденсирован с дополнительным кольцом (кольцевой системой), в частности сконденсирован с фенильным кольцом, или, например, сконденсирован с гетероциклическим кольцом, включая, например, хинолин, пурин. Понятие “гетероцикл(ен)” охватывает незамещенный или замещенный гетероцикл(ен), в частности замещенный группами, которые обычны для химии плевромутилина, например включая алкил, гидроксил, амино-, нитрогруппы, группу COOR13, в которой R13 обозначает алкил. К алкилам относятся С1-С8алкилы, например С1-С4алкил. Арилы включают фенил.
По другому объекту настоящего изобретения предлагается соединение формулы 1, в которой
R обозначает водородный атом;
R1 обозначает водородный атом или группу формулы
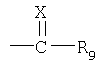
в которой Х обозначает атом серы или кислорода, NR10, где R10 обозначает водородный атом или алкил, или N+(R’10)2, где R’10 обозначает алкил в присутствии соответствующего аниона, например Cl–;
R9 обозначает аминогруппу, алкил, гетероциклил или меркаптогруппу, а если Х обозначает атом кислорода, дополнительным значением R9 является водородный атом;
R2 обозначает фенилен;
R4 обозначает водородный атом или алкил;
R5 обозначает водородный атом;
R3 и R’3 обозначают атомы водорода;
R6, R7 и R8 обозначают атомы водорода или дейтерия; или
R и R2 совместно с азотным атомом, с которым они связаны, образуют неароматический гетероциклен, а R1 обозначает группу формулы
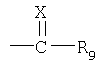
в которой Х обозначает кислородный атом, a R9 обозначает алкил.
По еще одному объекту настоящего изобретения предлагается соединение формулы
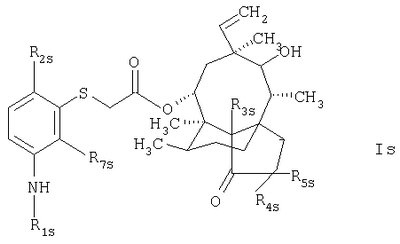
в которой R1s обозначает водородный атом или группу формулы
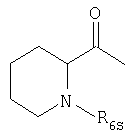
например группу формулы
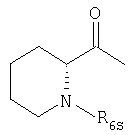
в которой R6s обозначает атом водорода или дейтерия;
R2s обозначает водородный атом, метил или трет-бутил;
R7s обозначает водородный атом или метил; а
R3s, R4s и R5s обозначают атомы водорода или дейтерия; и соединение формулы
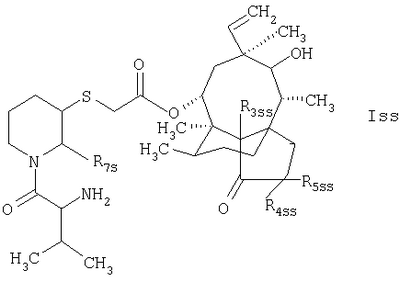
в которой R3ss, R4ss и R5ss обозначают атомы водорода или дейтерия.
Соединения формулы I включают соединения формул Is и Iss.
По другому объекту настоящего изобретения предлагаются соединения формулы I, включающие, например, соединения формул Is и Iss в форме солей или в форме солей и в форме сольватов, или в форме сольватов.
Кроме того, по другому объекту настоящего изобретения предлагаются
14-O-(3-амино)фенилсульфанилацетил)мутилин, например в свободной форме или в форме соли, например с соляной кислотой;
14-O-(3-амино)фенилсульфанилацетил)-2,2,4-тридейтеромутилин, например в свободной форме или в форме соли, например с соляной кислотой или с дейтерированной соляной кислотой;
14-O-(3-(пиперидин-2-илкарбониламино)фенилсульфанилацетил)мутилин, например в свободной форме или в форме соли, например с соляной кислотой;
14-O-(3-(пиперидин-2-илкарбониламино)фенилсульфанилацетил)-2,2,4-тридейтеромутилин, например в свободной форме или в форме соли, например с соляной кислотой или дейтерированной соляной кислотой;
14-O-(3-(пиперидин-2-илкарбониламино)-2,5-диметилфенилтиометил-карбонил)мутилин, например в свободной форме или в форме соли, например с соляной кислотой;
14-O-(3-(пиперидин-2-илкарбониламино)-2,5-диметилфенилтиометилкарбонил)-2,2,4-тридейтеромутилин, например в свободной форме или в форме соли, например с соляной кислотой или дейтеросоляной кислотой;
14-O-(3-(пиперидин-2-илкарбониламино)-5-трет-бутилфенилсульфанил-ацетил)мутилин, например в свободной форме или в форме соли, например с соляной кислотой;
14-O-(3-(пиперидин-2-илкарбониламино)-5-трет-бутилфенилсульфанилацетил)-2,2,4-тридейтеромутилин, например в свободной форме или в форме соли, например с соляной кислотой или дейтерированной соляной кислотой;
14-O-(1-(2-аминоизобутилкарбонил)пиперидин-3-илсульфанилацетил)мутилин, например в свободной форме или в форме соли, например с соляной кислотой; и
14-O-(1-(2-аминоизобутилкарбонил)пиперидин-3-илсульфанилацетил)-2,2,4-тридейтеромутилин, например в свободной форме или в форме соли, например с соляной кислотой или дейтерированной соляной кислотой.
Соли соединений формулы I охватывают фармацевтически приемлемые соли, включая, например, соли металлов и кислотно-аддитивные соли. Соли металлов включают, например, соли щелочных и щелочно-земельных металлов; кислотно-аддитивные соли включают соли соединений формулы I с кислотами, например с гидрофумаровой кислотой, фумаровой кислотой, нафталин-1,5-сульфоновой кислотой, соляной кислотой, дейтерированной соляной кислотой, предпочтительно с соляной кислотой и дейтерированной соляной кислотой.
Соединение формулы I в свободной форме можно превращать в соответствующее соединение в форме соли и наоборот. Соединение формулы I в свободной форме или в форме соли и в форме сольвата можно превращать в соответствующее соединение в свободной форме или в форме соли в несольватированной форме и наоборот.
По еще одному объекту настоящего изобретения предлагается соединение формулы
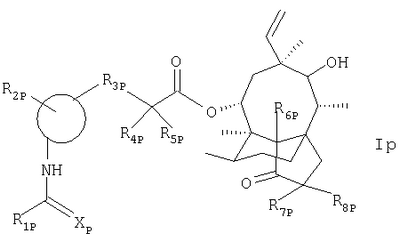
в которой
R1p обозначает водородный атом, аминогруппу, алкил, аминоалкил или необязательно амино- и/или гидрокси- и/или нитрозамещенное 5- или 6-членное гетероароматическое или гетероалициклическое кольцо, содержащее от 1 до 3 азотных атомов;
R2p обозначает необязательно алкил-, фтор- или трифторметилзамещенное ароматическое, 5- или 6-членное гетероароматическое кольцо, содержащее от 1 до 3 азотных атомов, пурин или хинолин;
Р3р обозначает S или О, предпочтительно S;
R4p обозначает водородный атом или метил;
R5p обозначает водородный атом, метил или СН2ОН;
Хр обозначает NH или О; а
R6р, R7p и R8p одинаковы или различны и обозначают атомы водорода или дейтерия; в свободной форме или в форме кислотно-аддитивной или четвертичной соли.
Соединения формулы I, включая соединения формул Is, Iss и Ip, могут существовать в форме изомеров и их смесей. Так, например соединения формулы I могут включать асимметричные углеродные атомы и могут, таким образом, существовать в форме диастереоизомеров и их смесей. Смеси изомеров и диастереоизомеров можно соответствующим образом разделять, например в соответствии с обычными методами, с получением соответственно чистых изомеров и диастереоизомеров. Объем настоящего изобретения включает соединения формулы I в любой изомерной и диастереоизомерной формах и в форме любых смесей изомеров и диастереоизомеров. Предпочтительная конфигурация мутилинового кольца соединения формулы такая же, как у образующегося естественным путем.
По другому объекту настоящего изобретения предлагается способ получения соединения формулы 1, как оно представлено выше, включающий следующие стадии:
либо
а1. реакция соединения формулы
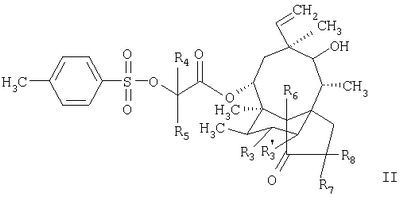
в которой R3, R’3, R4 и R5 имеют значения, приведенные в описании формулы I, a R6, R7 и R8 обозначают водородные атомы, с соединением формулы N(R)(R1)-R2-SH, в которой R, R1 и R2 имеют значения, приведенные в описании формулы I, с получением соединения формулы I, в которой R, R1, R2, Р3, R’3, R4 и R5 имеют значения, приведенные в описании формулы I, a R6, R7 и R8 обозначают водородные атомы; и, если необходимо,
б1. введение атома дейтерия в соединение формулы I, полученное на стадии а1., с получением соединения формулы I, в которой R6, R7 и R8 обозначают атомы дейтерия, a R, R1, R2, R3, R’3, R4 и R5 имеют значения, приведенные в описании формулы I;
либо
а2. реакция соединения формулы II, как оно представлено в описании стадии а1., с тиомочевиной и последующее восстановление с получением соединения формулы
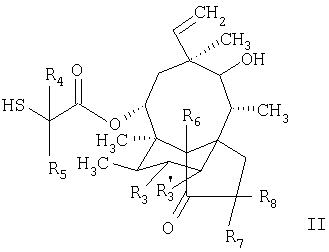
в которой R3, R’3, R4 и R5 имеют значения, приведенные в описании формулы I, а R6, R7 и R8 обозначают водородные атомы,
б2. реакция соединения формулы III, как оно представлено в описании стадии а2., с соединением формулы R2(NO2)2, в которой R2 имеет значения, приведенные в описании формулы I; или с неароматическим гетероциклическим кольцом, которое несет группу формулы -C(=X)R9, в которой Х and R9 имеют значения, приведенные в п.1 формулы изобретения, в форме реакционноспособного производного, например мезилата или тозилата, с получением соединения формулы
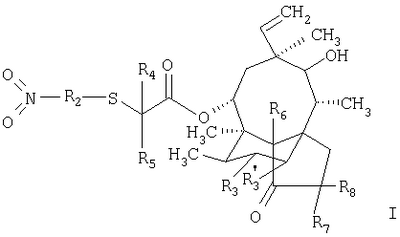
в которой R2, R3, R’3, R4 и R5 имеют значения, приведенные в описании формулы I, а R6, R7 и R8 обозначают водородные атомы,
с2. восстановление нитрогруппы соединения формулы IV, как оно представлено в описании стадии б2., с получением соединения формулы 1, в которой R2, R3, R’3, R4 и R5 имеют значения, приведенные в описании формулы I, a R, R1, R6, R7 и R8 обозначают водородные атомы, и, если необходимо,
г2. реакция аминогруппы соединения формулы I, как оно представлено в описании стадии в2., с получением соединения формулы I, в которой R1 обозначает группу формулы
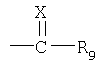
в которой R, R2, R3, R’3, R4, R5, R9 и Х имеют значения, приведенные в описании формулы I, а R6, R7 и R8 обозначают водородные атомы; и, если необходимо,
д2. введение атомов дейтерия в соединение формулы I, как оно представлено в описании стадии г2., с получением соединения формулы I, в которой R, R1, R2, R3, R’3, R4, R5, R9 и Х имеют значения, приведенные в описании формулы I, а R6, R7 R8 обозначают атомы дейтерия;
либо
а3. реакция соединения формулы
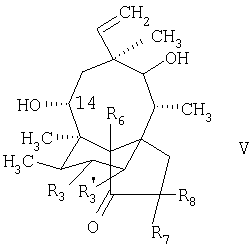
в которой R6, R7 и R8 обозначают водородные атомы, а R3 и R’3 обозначают атомы водорода или дейтерия, с соединением формулы
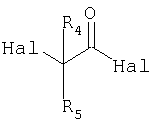
в которой R4 и R5 имеют значения, приведенные в описании формулы I, a Hal обозначает атом галогена, например хлора, брома или иода; с получением соединения формулы
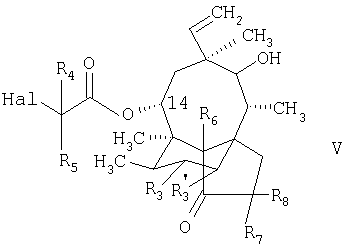
в которой R4, R5, Hal, R6, R7, R8, R3 и R’3 имеют значения, приведенные в описании стадии а3.;
б3. реакция соединения формулы VI, как оно представлено в описании стадии а3., с соединением формулы HS-R2(NO2)2, в которой R2 имеет значения, приведенные в описании формулы I, с получением соединения формулы IV, как оно представлено в описании стадии б2., и последующая реакция соединения формулы IV в соответствии со стадией в2. и, если необходимо, в соответствии с любой из стадий г2. и д2., как изложено выше, с получением соединения формулы I, как оно представлено в описании формулы I.
Любое соединение формулы I, например включая соединение формул Is, Iss или Ip, может быть получено приемлемым образом, например в соответствии с обычным методом, в частности или так, как изложено в настоящем описании. Любое соединение формул Is, Iss и Ip может быть получено, например, аналогичным путем, в соответствии со способом получения соединения формулы I.
Соединение формулы II и формулы V известно или может быть получено в соответствии с обычным методом.
Замещение водородных атомов в соединении формулы I, например в форме соли, атомами дейтерия может быть осуществлено приемлемым образом, например в соответствии с обычным методом, в частности или в соответствии с методом, изложенным в настоящем описании, например обработкой соединений формулы I, включая, например, соединения формул Is, Iss и Ip, дейтерированной соляной кислотой (DCl) в подходящем растворителе (системе растворителей) и выделением соединений формулы I, например в форме соли, в которой водородные атомы, например в группах, обозначенных R6, R7 и R8, замещены атомами дейтерия.
Процесс получения соединений формулы 1, в которой R3 и R’3 обозначают атомы дейтерия, можно проводить приемлемым путем, например в соответствии с обычным методом, например посредством обработки соединения формулы V, в которой углеродные атомы, несущие R3 и R’3, каждый из которых обозначает водородный атом, совместно образуют двойную связь, и которое является известным соединением, дейтерием с получением соединения формулы V, в которой R3 и R’3 обозначают атомы дейтерия; и последующей реакции соединения формулы V, в которой R3 and R’3 обозначают атомы дейтерия, проводимой приемлемым путем, например в соответствии с обычным методом, в частности в соответствии со стадиями с а3. по б3., как это изложено выше, с получением соединения формулы I.
Соединения формулы I, например включая соединения формул Is, Iss и Ip, в дальнейшем называемые “действующими соединениями по настоящему изобретению”, проявляют фармакологическое действие, и поэтому могут быть использованы в качестве фармацевтических средств. Так, например, действующие соединения по настоящему изобретению проявляют антимикробное, например антибактериальное, действие, направленное против грамотрицательных бактерий, таких, как Escherichia coli, и против грамположительных бактерий, таких, как Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae, Mycoplasms, Chalmydia и облигатные анаэробы, например Bacteroides fragilis, in vitro в тесте по методу посева разведений на агаре или тесте микроразведения в соответствии с клиническими лабораторными стандартами Национального комитета (КЛСНК) 1997, Документ М7-А4, том 17, No.2: “Methods for dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically-издание четвертое, утвержденный стандарт”; и, например in vivo при общем инфицировании мышей.
Действующие соединения по настоящему изобретению проявляют антибактериальное действие in vitro (МИК (мкг/мл)) в тесте по методу посева разведений на агаре или тесте микроразведения от примерно <0,01 мкг/мл до 25 мкг/мл, например против бактерий вышеупомянутых видов, и действие против микроорганизмов Mycoplasms и Chlamydia. МИК обозначает минимальную ингибирующую концентрацию.
Действующие соединения по настоящему изобретению проявляют действие при общем инфицировании мышей, например против микроорганизма Staphylococcus aureus (например, штамма АТСС 49951), в частности при парентеральном или пероральном введении, например в дозах от примерно 8 до 150 мг/кг массы тела. Так, например, при подкожном введении значения ЭД50 для соединения примера 23 составляет 7,55 мг/кг массы тела, а при пероральном введении – 7,72 мг/кг массы тела. ЭД50 означает эффективную дозу в мг/кг массы тела на процедуру, которая позволяет защитить от гибели 50% обработанных животных, рассчитанную анализом по Пробиту (при численности животных в группе 8 особей). Так, например, было установлено, что МИК (мкг/мл) (90%) для соединений примеров 1 и 52 в случаях, в частности, микроорганизма Staphylococcus aureus, например штаммов АТСС 10390, АТСС 29213, АТСС 29506, АТСС 49951 или АТСС 9144, составляет приблизительно  0,0125 мкг/мл, тогда как, например, МИК (мкг/мл) (90%) для эритромицина А, технически доступного продукта, равна приблизительно от 0,2 до 0,4. 0,0125 мкг/мл, тогда как, например, МИК (мкг/мл) (90%) для эритромицина А, технически доступного продукта, равна приблизительно от 0,2 до 0,4.
Действующие соединения по настоящему изобретению проявляют, что оказалось неожиданным, полный спектр действия. Так, например, было установлено, что действующие соединения по настоящему изобретению проявляют неожиданное действие, направленное против микроорганизма Enterococcus faecium, включая ванкомицин-резистентные штаммы; против микроорганизма Staphylococcus aureus, включая чувствительные к метициллину (MSSA) и не чувствительные к метициллину (MRSA) штаммы; и против микроорганизма Streptococcus pneumoniae, включая пенициллин-резистентные штаммы, например в тесте по методу посева разведении на агаре или тесте микроразведения в агаре Мюллера-Хинтона или в питательной среде Мюллера-Хинтона с добавками или без добавок в соответствии с принятыми стандартными сравнительными методами клинических лабораторных стандартов Национального комитета (КЛСНК), Документ М7-А4 для аэробных бактерий. Так, например, было установлено, что МИК (мкг/мл) для соединений примеров 1 и 52 (оба испытывали в гидрохлоридной форме) при их действии против, например, микроорганизма Staphylococcus aureus MSSA, составляла приблизительно 0,025, тогда как МИК (мкг/мл) для технически доступного азитромицина была равной приблизительно 1,6; МИК (мкг/мл) для соединения примера 1 при их действии против, например, микроорганизма Staphylococcus aureus MRSA, составляла приблизительно  0,0125; в то время как МИК (мкг/мл) для технически доступного азитромицина была равной приблизительно >25,6; МИК (мкг/мл) для соединений примеров 1 и 52 при их действии против, например, резистентного к пенициллину микроорганизма Streptococcus pneumoniae была равной приблизительно 0,0125; в то время как МИК (мкг/мл) для технически доступного азитромицина была равной приблизительно >25,6; МИК (мкг/мл) для соединений примеров 1 и 52 при их действии против, например, резистентного к пенициллину микроорганизма Streptococcus pneumoniae была равной приблизительно  0,0125; тогда как МИК (мкг/мл) для технически доступного азитромицина была равной приблизительно >2,56; а МИК для соединений примеров 1 и 52 при их действии против, например, ванкомицин-резистентного микроорганизма Enterococcus faecium составляла приблизительно от 0,0125; тогда как МИК (мкг/мл) для технически доступного азитромицина была равной приблизительно >2,56; а МИК для соединений примеров 1 и 52 при их действии против, например, ванкомицин-резистентного микроорганизма Enterococcus faecium составляла приблизительно от  0,0125 до 0,025. 0,0125 до 0,025.
По другому объекту настоящего изобретения предлагается соединение формулы I для применения в качестве фармацевтического средства, предпочтительно антимикробного, такого, как, например антибиотическое и антианаэробное.
По еще одному объекту настоящего изобретения предлагается соединение формулы I для применения при приготовлении лекарственного средства, предназначенного для лечения обусловленных микробами заболеваний, например заболеваний, вызванных бактериями, в частности выбранных из микроорганизмов Staphylococcus aureus. Streptococcus pyogenes, Streptococcus pneumoniae, Mycoplasms, Chalmydia и облигатных анаэробов; например включая штаммы, резистентные к пенициллину или множеству лекарств, в частности Streptococcus pneumoniae; например включая ванкомицин-резистентные штаммы, в частности Enterococcus faecium; например и включая метициллин-резистентные штаммы, в частности Staphylococcus aureus.
По другому объекту настоящего изобретения предлагается способ лечения обусловленных микробами заболеваний, который включает введение в организм субъекта, нуждающегося в таком лечении, эффективного количества соединения формулы I, например в форме фармацевтической композиции.
Для лечения обусловленных микробами заболеваний соответствующая доза обычно зависит, например, от конкретно используемого соединения по настоящему изобретению, реципиента, пути введения в организм, природы и серьезности заболевания, при котором проводят лечение. Однако обычно для достижения удовлетворительных результатов у более крупных млекопитающих, например у людей, целесообразная ежедневная доза действующего соединения по настоящему изобретению находится в интервале от примерно 0,5 до 3 г; его вводят в организм, в частности, в виде дробных доз для приема до четырех раз в день. Действующее соединение по настоящему изобретению можно вводить любым обычным путем, в частности перорально, например в форме таблеток или капсул, или парентерально, например в форме растворов или суспензий для ин”екций, например аналогично введению эритромицинов, в частности азитромицина.
Соединения примеров 1, 12, 21, 23, 35 и 52 являются предпочтительными соединениями по настоящему изобретению для применения в качестве антимикробного средства.
Было установлено, что МИК (мкг/мл) для соединений примеров 1 и 52 (оба испытывали в гидрохлоридной форме), когда определяли их действие против, например, микроорганизма Enterococcus faecalis штамма АТСС 29212, составляла приблизительно от 0,8 до 6,4, тогда как, например, технически доступный эритромицин А проявлял значения МИК (мкг/мл) приблизительно 1,6. Это указывает на то, что предпочтительные соединения по настоящему изобретению при лечении заболеваний, обусловленных микробами, в частности заболеваний, вызванных бактериями, можно вводить более крупным млекопитающим, например людям, используя такие же пути введения и те же дозы, как в случаях эритромицинов, в частности эритромицина А или азитромицина.
Действующие соединения по настоящему изобретению можно вводить в организм в форме фармацевтически приемлемой соли, например кислотно-аддитивной соли или соли металла, или в свободной форме, необязательно в форме сольвата. Действующие соединения по настоящему изобретению в форме соли проявляют действие такого же порядка, как действующие соединения по настоящему изобретению в свободной форме.
По настоящему изобретению предлагается фармацевтическая композиция, включающая соединение формулы I в свободной форме или в форме фармацевтически приемлемой соли, например и/или в форме сольвата; в сочетании с по меньшей мере одним фармацевтически приемлемым носителем или разбавителем.
Такие композиции можно готовить в соответствии с обычным методом. Препаративная форма в дозе на один прием может содержать, например, от примерно 100 мг до примерно 1 г действующего соединения.
Кроме того, действующие соединения по настоящему изобретению могут быть использованы в качестве ветеринарных средств, например ветеринарных действующих соединений, в частности при профилактике и лечении заболеваний, обусловленных микробами, в частности бактериями, у таких животных, как домашняя птица, свиньи и телята, и в составе жидких разбавителей для технологии искусственного оплодотворения и дезинфицирующей обработки яиц.
По другому объекту настоящего изобретения предлагается соединение формулы I для применения в качестве ветеринарного средства.
По еще одному объекту настоящего изобретения предлагается соединение формулы I для применения при приготовлении ветеринарной композиции, которая может быть использована в качестве ветеринарного средства.
Кроме того, по настоящему изобретению предлагается способ ветеринарии для профилактики и лечения заболеваний, обусловленных микробами, в частности бактериями, который включает введение в организм субъекта, нуждающегося в таком лечении, эффективного количества соединения формулы I, например в форме ветеринарной композиции.
При применении действующих соединений по настоящему изобретению в качестве ветеринарного средства дозу, что очевидно, обычно варьируют в зависимости от размеров и возраста животного и от целевого эффекта. Так, например, при профилактической обработке в организм вводят, по-видимому, относительно малые дозы в течение более длительного периода, например от 1 до 3 недель. Предпочтительные дозы в питьевой воде составляют от 0,0125 до 0,05 массы на объем, в частности от 0,0125 до 0,025, а в кормах – от 20 до 400 г/метрическую т, предпочтительно от 20 до 200 г/метрическую т. В предпочтительном варианте действующее соединение по настоящему изобретению в качестве ветеринарного средства для кур вводят в питьевую воду, для свиней в корм, а телятам – перорально или парентерально, например в форме препаратов для перорального или парентерального введения.
В следующих примерах, которые иллюстрируют изобретение, в ссылках на температуру указана температура в градусах Цельсия.
Использованы следующие аббревиатуры:
ДЦКД – дициклогексилкарбодиимид
ДИЭА – диизопропилэтиламин
БОК – трет-бутоксикарбонил
ПиБОФ-(бензотриазол-1-илокси)трипирролидинфосфонийгексафторфосфат
ТГМФ-триамид гексаметилфосфорной кислоты
DCl – дейтерированная соляная кислота
Приводимая в примерах нумерация позиций в мутилиновом цикле проиллюстрирована в следующей формуле
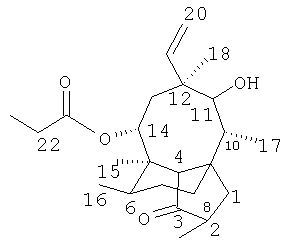
Пример 1
14-O-[(3-(пиперидин-2(R)-карбонил)амино)фенилсульфанил)ацетил]мутилин в форме гидрохлорида
206 мг ДЦКД при комнатной температуре добавляют в раствор 229 мг N-БОК-(R)-пипеколиновой кислоты и 485 мг 14-O-[(3-аминофенилсульфанил)ацетил]мутилина в 20 мл дихлорметана и полученную смесь перемешивают при комнатной температуре в течение приблизительно 12 ч. Мочевина выпадает в осадок, ее отфильтровывают и полученный фильтрат концентрируют под пониженным давлением. Полученный концентрат подвергают хроматографии (силикагель; циклогексан/этилацетат в соотношении 1/1). Получают 14-O-[(3-(N-БОК-(R)пиперидин-2(R)-карбонил)амино)фенилсульфанил)ацетил]мутилин и при комнатной температуре обрабатывают эфирным раствором соляной кислоты в течение приблизительно 1 ч. Под пониженным давлением из полученной смеси удаляют растворитель и полученный остаток кристаллизуют из этилацетата/гексана.
В форме гидрохлорида получают 14-O-[(3-(пиперидин-2(R)-карбонил)амино)фенилсульфанил)ацетил]мутилин.
Пример 2
14-O-[(2,6-диметил-3-(пиперидин-2(R)-карбониламино)фенилсульфанил)ацетил]мутилин в форме гидрохлорида
Раствор 200 мг 14-O-[(2,6-диметил-5-аминофенил)сульфанилацетил]мутилина в форме гидрохлорида, 84 мг N-БОК-(R)-пипеколиновой кислоты, 190,1 мг ПиБОФ и 143 мг ДИЭА в 20 мл диоксана выдерживают в течение приблизительно 24 ч при приблизительно 40°. Полученную смесь разбавляют водой и экстрагируют этилацетатом. Органическую фазу повторно экстрагируют 0,1н. гидроксидом натрия, 0,1н. соляной кислоты и рассолом. Полученную органическую фазу концентрируют и концентрат подвергают хроматографии (силикагель; толуол/этилацетат в соотношении 1,5/1). Получают 14-O-[(2,6-диметил-3(N-БОК-(R)-пиперидин-2(R)-карбониламино)фенилсульфанил)ацетил]мутилин. В смеси 10 мл диоксана и 10 мл эфирного раствора соляной кислоты отделяют БОК и в форме гидрохлорида получают
14-O-[(2,6-диметил-3(пиперидин-2(R)-карбониламино)фенилсульфанил)ацетил]мутилин.
Пример 3
14-O-[(3-(пиперидин-2(R)-карбонил)амино)фенилсульфанил)-2(R*)-пропионил]мутилин в форме гидрохлорида
206 мг ДЦКД при комнатной температуре добавляют в раствор 229 мг N-БОК-(R)-пипеколиновой кислоты и 499 мг 14-O-[(3-аминофенилсульфанил)-2-пропионил]мутилина в форме гидрохлорида в 20 мл дихлорметана и полученную смесь при комнатной температуре перемешивают в течение приблизительно 12 ч. Мочевина выпадает в осадок, ее отфильтровывают и полученный фильтрат концентрируют под пониженным давлением. Полученный концентрат подвергают хроматографии (силикагель; циклогексан/этилацетат в соотношении 1/1). Получают 14-O-[(3-(N-БОК-(R)пиперидин-2(R)-карбонил)амино)фенилсульфанил)-2(R*)-пропионил]мутилин и при комнатной температуре обрабатывают эфирным раствором соляной кислоты в течение приблизительно 1 ч. Из образовавшейся смеси удаляют растворитель и полученный остаток кристаллизуют из этилацетата/гексана.
В форме гидрохлорида получают 14-O-[(3-(пиперидин-2(R)-карбонил)амино)фенилсульфанил)-2(R*)-пропионил]мутилин.
В соответствии со способом, описанным в примерах с 1 по 3, но с использованием соответствующего исходного материала, получают соединения формулы I, в которой
R=Р3=R’3=R5 и каждый обозначает водородный атом;
R4 обозначает метил в примерах 37 и 38 и водородный атом во всех других примерах;
R1 обозначает группу формулы -C(=X)R9 в примерах с 1 по 35, с 43 по 49 и водородный атом в примерах с 36 по 42;
Х обозначает О в примерах с 1 по 45, S в примерах 46 и 47, N-СН3 в примере 48 и N+(CH3)2Cl– в примере 49;
R6=R7=R8 и в примерах с 1 по 11, с 13 по 24, с 26 по 28, 30, с 32 по 39 и с 41 по 49 каждый обозначает водородный атом, а в примерах 12, 25, 29, 31 и 40 каждый обозначает атом дейтерия;
и R2 и R9 имеют значения, указанные в приведенной ниже таблице 1:
| Таблица 1 |
| Пример |
R9 |
R2 |
| 4 |
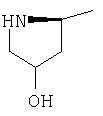 |
 |
| 5 |
 |
 |
| 6 |
 |
 |
| 7 |
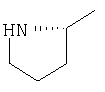 |
 |
| Пример |
R9 |
R2 |
| 8 |
 |
 |
| 9 |
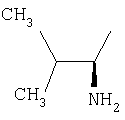
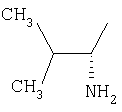 |
 |
| 10 |
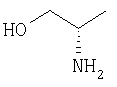 |
 |
| 11 |
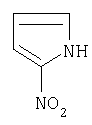 |
 |
| 12 |
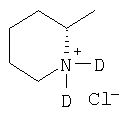 |
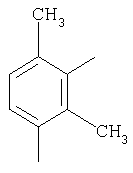 |
| 13 |
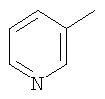 |
 |
| 14 |
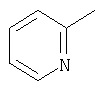 |
 |
| 15 |
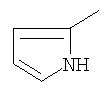 |
 |
| 16 |
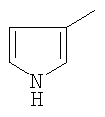 |
 |
| 17 |
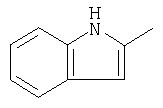 |
 |
| Пример |
R9 |
R2 |
| 18 |
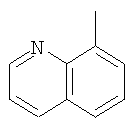 |
 |
| 19 |
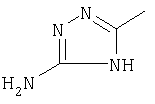 |
 |
| 20 |
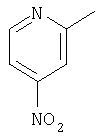 |
 |
| 21 |
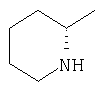 |
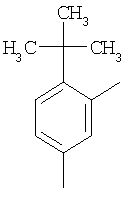 |
| 22 |
 |
 |
| 23 |
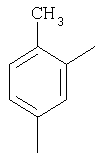
H |
 |
| 24 |
H |
 |
| 25 |
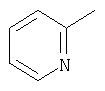 |
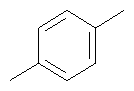 |
| Пример |
R9 |
R2 |
| 26 |
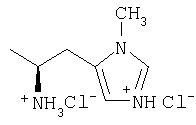 |
 |
| 27 |
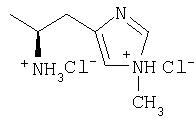 |
 |
| 28 |
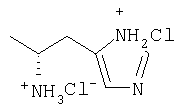 |
 |
| 29 |
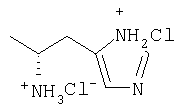 |
 |
| 30 |
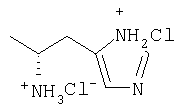 |
 |
| 31 |
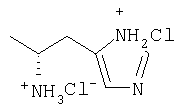 |
 |
| 32 |
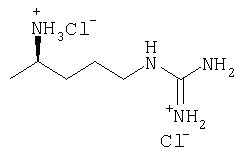 |
 |
| Пример |
R9 |
R2 |
| 33 |
 |
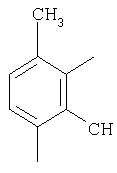 |
| 34 |
 |
 |
| 35 |
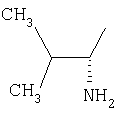 |
вместе с N и R образуется
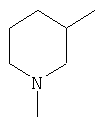 |
| 36 |
– |
 |
| 37 |
– |
 |
| 38 |
– |
 |
| 39 |
– |
 |
| 40 |
– |
 |
| 41 |
– |
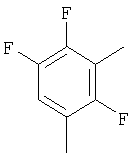 |
| Пример |
R9 |
R2 |
| 42 |
– |
 |
| 43 |
CH3 |
 |
| 44 |
CF3 |
 |
| 45 |
H |
 |
| 46 |
 |
 |
| 47 |
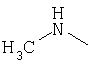 |
 |
| 48 |
-S-CH3 |
 |
| 49 |
H |
 |
Пример 50
Замена водородных атомов атомами дейтерия в соединении формулы I
Раствор 300 мг 14-O-[(3-(пиперидин-2(R)-карбонил)амино)фенилсульфанил)ацетил]мутилингидрохлорида в 30 мл диоксана и 5 мл DCl (20%-ный в D2O) выдерживают при комнатной температуре в течение 6 дней, полученную смесь концентрируют под пониженным давлением и лиофилизируют с получением 14-O-[(3-(пиперидин-2(R)-карбониламино)фенилсульфанил)ацетил]-2,2,4-тридейтеромутилина в форме дейтерохлорида.
ЯМР-анализ (CDCl3): в отличие от данных ЯМР-анализа соединения примера 1 сигналы 2-, 2′- и 4-протонов трициклического остатка отсутствуют.
В соответствии со способом, описанным в примере 50, в форме дейтерохлорида получают соединение формулы I, в которой R=R3=R’3=R5 и каждый обозначает водородный атом; R1 обозначает группу формулы -C(=X)R9, в которой Х обозначает О; R6=R7=R8 и каждый обозначает атом дейтерия; а R2 и R9 имеют значения, указанные в приведенной ниже таблице 2:
| Таблица 2 |
| Пример |
R9 |
R2 |
| 51 |
 |
 |
Пример 52
14-O-[(3-аминофенилсульфанил)ацетил]мутилин
Раствор 0,92 г натрия и 5 г 3-аминотиофенола в 100 мл сухого этанола при комнатной температуре и с регулированием температуры добавляют в раствор 21,3 г 22-O-тозилплевромутилина в 250 мл этилметилкетона. Полученную реакционную смесь выдерживают в течение приблизительно 15 ч при комнатной температуре, фильтруют и под пониженным давлением концентрируют досуха. Остаток подвергают хроматографии (силикагель; циклогексан/этилацетат в соотношении 1/1). Получают 14-O-[(3-аминофенилсульфанил)ацетил]мутилин.
Получение исходного материала
А.14-O-[(3-аминофенилсульфанил)ацетил]мутилин-см. пример 52
Б.14-O-[(2,6-диметил-5-аминофенил)сульфанилацетил]мутилин в форме гидрохлорида
Б.а 14-O-[(карбамимидоилсульфанил)ацетил]мутилинтозилат
Раствор 15,2 г тиомочевины и 106,4 г плевромутилин-22-О-тозилата в 250 мл ацетона кипятят с обратным холодильником в течение 1,5 ч, под пониженным давлением удаляют растворитель и добавляют 100 мл гексана. Образуется осадок, который отфильтровывают и сушат. Получают 14-O-[(карбамимидоилсульфанил)ацетил]мутилинтозилат.
Б. б 14-меркаптоацетилмутилин
Раствор 4,7 г пиросульфита натрия (Na2S2O5) в 25 мл Н2О добавляют в раствор 12,2 г 14-О-[(карбамимидоилсульфанил)ацетил]мутилинтозилата в смеси 20 мл этанола и 35 мл Н2О (нагретой до приблизительно 90°). В образовавшуюся реакционную смесь добавляют 100 мл CCl4 и смесь кипятят с обратным холодильником в течение приблизительно 2 ч. Образовавшуюся двухфазную систему разделяют, органическую фазу сушат и выпаривают растворитель.
Получают 14-меркаптоацетилмутилин.
Б. в 14-O-[(2,6-диметил-5-нитрофенил)сульфанилацетил]мутилин
Раствор 0,98 г 2,4-динитроксилола в 30 мл ТГМФ добавляют в раствор 3,94 г 14-меркаптоацетилмутилина и 115 мг натрия в 15 мл метанола. Полученную реакционную смесь выдерживают при приблизительно 120° в течение приблизительно одного часа, выдерживают в течение еще приблизительно 12 ч при комнатной температуре и выливают на лед. Образовавшуюся смесь экстрагируют толуолом, полученную органическую фазу сушат и растворитель выпаривают. Полученный остаток подвергают хроматографии (силикагель (толуол/этилацетат в соотношении 2/1).
Получают 14-O-[(2,6-диметил-5-нитрофенил)сульфанилацетил]мутилин.
Б. г 14-O-[(2,6-диметил-5-аминофенил)сульфанилацетил]мутилин в форме гидрохлорида
2,5 г порошкообразного олова добавляют в раствор 202 мг 14-O-[(2,6-диметил-5-нитрофенил)сульфанилацетил]мутилина в 10 мл диоксана, 1,5 мл муравьиной кислоты и 0,1 мл Н2О и полученную реакционную смесь выдерживают при температуре кипения с обратным холодильником в течение приблизительно 5 ч. Образовавшуюся смесь фильтруют и растворитель полученного фильтрата выпаривают. В полученный остаток добавляют смесь 5 мл диоксана и 10 мл эфирного раствора соляной кислоты и растворитель из полученной смеси выпаривают. Остаток подвергают кристаллизации в этилацетатегексане. В форме гидрохлорида получают кристаллический 14-O-[(2,6-диметил-5-аминофенил)сульфанилацетил]мутилин.
В. 14-О-[(3-аминофенилсульфанил)-2-пропионил]утилин в форме гидрохлорида
В. а 14-O-(2(R/S)-бромпропионил)мутилин
Раствор 3,2 г мутилина, 2 г N-метилморфолина и 4,3 г 2-бромпропионилбромида в 50 мл тетрагидрофурана выдерживают при комнатной температуре в течение приблизительно 24 ч. Образовавшуюся смесь концентрируют под пониженным давлением и полученный остаток выливают в смесь воды и этилацетата. Получают двухфазную систему и фазы разделяют. Полученную органическую фазу экстрагируют 1н. HCl и рассолом и подвергают хроматографии (циклогексан/диоксан в соотношении 6/1). Получают 14-O-(2(R/S)-бромпропионил)мутилин.
В.б 14-O-[(3-аминофенилсульфанил)-2(R*)-пропионил]мутилин в форме гидрохлорида и
14-O-[(3-аминофенилсульфанил)-2(S*)-пропионил]мутилин в форме гидрохлорида
Раствор 45 мг 14-O-(2(R/S)-бромпропионил)мутилина, 125 мг 3-аминотиофенола и 24 мг натрия в 10 мл этанола и 5 мл этилметилкетона выдерживают при комнатной температуре в течение приблизительно 12 ч. Растворитель из полученной смеси выпаривают и к полученному остатку добавляют 50 мл этилацетата. Полученную органическую фазу экстрагируют рассолом и подвергают хроматографии (силикагель; циклогексан/диоксан в соотношении 6/1). Получают смесь диастереоизомеров 14-O-[(3-аминофенилсульфанил)-2(R/S)-пропионил]мутилина. Диастереоизомеры разделяют препаративной ВЭЖХ-хроматографией (циклогексан/диоксан в соотношении 8/1) и обрабатывают соляной кислотой. Получают 14-O-[(3-аминофенилсульфанил)-2(R*)-пропионил]мутилин в форме гидрохлорида и 14-O-[(3-аминофенилсульфанил)-2(S*)-пропионил]мутилин в форме гидрохлорида.
Данные 1Н-ЯМР-спектрального анализа (CDCl3 если не указано иное) Прим.
1. 3,1, 3,5 (2×m, 2H,  , , ‘Н-пиперидин), АВ-система ( ‘Н-пиперидин), АВ-система ( A=3,57, A=3,57,  B=3,62, 2H, Н22, J=15,2 Гц), 4,42 (шир., 1Н, B=3,62, 2H, Н22, J=15,2 Гц), 4,42 (шир., 1Н,  -Н-пиперидин), 7,03 (d, 1H, аром. Н6, J=7,7 Гц), 7,13 (t, 1H, аром. Н5, J=5,9 Гц), 7,49 (d, 1H, аром. Н4, J=7,7 Гц), 7,85 (s, 1H, аром. Н2), 10,7 (s, 1H, NH). -Н-пиперидин), 7,03 (d, 1H, аром. Н6, J=7,7 Гц), 7,13 (t, 1H, аром. Н5, J=5,9 Гц), 7,49 (d, 1H, аром. Н4, J=7,7 Гц), 7,85 (s, 1H, аром. Н2), 10,7 (s, 1H, NH).
2. 2,48, 2,52 (2×s, 6H, 2 × аром. СН3), АВ-система ( A=3,3, A=3,3,  B=3,38, 2Н, Н22, J=15,8 Гц), 4,5 (шир., 1Н, B=3,38, 2Н, Н22, J=15,8 Гц), 4,5 (шир., 1Н,  -Н, пиперидин), 3,1, 3,3 (2 × шир., 2Н, -Н, пиперидин), 3,1, 3,3 (2 × шир., 2Н,  , , ‘-Н, пиперидин), 7,0, 7,4 (2×m, 2Н, аром. Н4, Н5), 8,45, 9,6 (2 × шир., 1Н, NH). ‘-Н, пиперидин), 7,0, 7,4 (2×m, 2Н, аром. Н4, Н5), 8,45, 9,6 (2 × шир., 1Н, NH).
3. (d6-AMCO): 1,48 (d, 3Н, С22-СН3, J=7,2 Гц), 2,75, 3,05 (2 × шир., 2Н,  , , ‘-Н-пиперидин), 3,38 (d, 1H, Н11, J=6,35 Гц), 3,82 (q, 1H, Н22, J=7,2 Гц), 7,2 (t, 1H, аром. Н5, J=7,8 Гц), 7,15 (ddd, 1H, аром. Н6, J=7,8 Гц, J=1,5 Гц, J=2,8 Гц), 7,55 (ddd, 1H, аром.Н4, J=7,8 Гц, J=2 Гц), 7,6 (t, 1H, аром. Н2, J=1,8 Гц, 8,9 (s, 1H, NH). ‘-Н-пиперидин), 3,38 (d, 1H, Н11, J=6,35 Гц), 3,82 (q, 1H, Н22, J=7,2 Гц), 7,2 (t, 1H, аром. Н5, J=7,8 Гц), 7,15 (ddd, 1H, аром. Н6, J=7,8 Гц, J=1,5 Гц, J=2,8 Гц), 7,55 (ddd, 1H, аром.Н4, J=7,8 Гц, J=2 Гц), 7,6 (t, 1H, аром. Н2, J=1,8 Гц, 8,9 (s, 1H, NH).
4. 3,5 (s. 2H, Н22), 2,7, 3,4, 3,7, 4,6, (4×m, 5H, пиперидин-Н), 8,1, 9,7, 10,3 (3 × шир. 2 × NH, ОН), 7,45 (d, 2H, аром. Н, J=6,2 Гц), 7,52 (d, 2H, аром.Н, J=6,2 Гц).
5. 1,08 (d, 6H, CH(Me)2, J=6,2 Гц), АВ-система ( A=3,5, A=3,5,  B=3,58, 2H, Н22, J=15,1 Гц), 3,92 (d, 1H, B=3,58, 2H, Н22, J=15,1 Гц), 3,92 (d, 1H,  -H, J=5,7 Гц), 7,7 (d, 2H, аром.Н, J=6,2 Гц), 7,51 (d, 2H, аром. Н, J=6,2 Гц). -H, J=5,7 Гц), 7,7 (d, 2H, аром.Н, J=6,2 Гц), 7,51 (d, 2H, аром. Н, J=6,2 Гц).
6. 3,5 (s, 2H, Н22), 2,7, 3,4, 3,7, 4,6, (4×m, 5 H, пиперидин-Н), 8,1, 9,7, 10,3 (3 × шир., 2 × NH, ОН), 7,01 (dd, 1H, аром.Н6, J=1,5 Гц, J=6,2 Гц), 7,18 (t, 1H, аром. Н5, J=6,2 Гц), 7,4 (dd, 1H, аром. Н4, J=1,5 Гц, J=6,2 Гц) 7,6 (d, NH, J=6 Гц).
7. 3,6 (s, 2H,H22), 5,01 (m, 1H,  -H), 7,1 (d, 1H, аром. H4, J=8,2 Гц), 7,3 (t, 1H, аром. Н5, J=8,2 Гц), 7,49 (d, 1H, аром.Н6, J=8,2 Гц), 7,82 (s, 1H, аром. Н2), 7,6, 10,8 (2 × шир., 2×NH). -H), 7,1 (d, 1H, аром. H4, J=8,2 Гц), 7,3 (t, 1H, аром. Н5, J=8,2 Гц), 7,49 (d, 1H, аром.Н6, J=8,2 Гц), 7,82 (s, 1H, аром. Н2), 7,6, 10,8 (2 × шир., 2×NH).
8. 1,1 (d, 6H, (CH(Me)2), J=6,5 Гц), АВ-система ( A=3,6, A=3,6,  B=3,65, 2H, Н22, J=15,2 Гц), 3,92 (d, 1H, B=3,65, 2H, Н22, J=15,2 Гц), 3,92 (d, 1H,  -H, J=6,2 Гц), 7,12 (dd, 1H, аром. Н6, J=7,9 25 Гц, J=2,1 Гц), 7,25 (t, 1H, аром. Н5, J=7,9 Гц), 7,42 (dd, 1H, аром. Н4, J=7,9, J=2,1 Гц), 7,75 (d, 1H, аром. Н2, J=2,1 Гц). -H, J=6,2 Гц), 7,12 (dd, 1H, аром. Н6, J=7,9 25 Гц, J=2,1 Гц), 7,25 (t, 1H, аром. Н5, J=7,9 Гц), 7,42 (dd, 1H, аром. Н4, J=7,9, J=2,1 Гц), 7,75 (d, 1H, аром. Н2, J=2,1 Гц).
9. 1,08 (d, 6H, (CH(Me)2), J=7 Гц), АВ-система ( A=3,42, A=3,42,  B=3,5, 2H, Н22, J=15,2 Гц), 3,45 (d, 1H, B=3,5, 2H, Н22, J=15,2 Гц), 3,45 (d, 1H,  -H, J=4,1 Гц), 7,0, 7,35, (2×m, аром. Н3, Н4), 7,51 (d, 1H, аром. Н2, J=7,5 Гц), 8,48 (d, 1H, аром. Н6, J=7,5 Гц), 10,55 (s, 1H, NH). -H, J=4,1 Гц), 7,0, 7,35, (2×m, аром. Н3, Н4), 7,51 (d, 1H, аром. Н2, J=7,5 Гц), 8,48 (d, 1H, аром. Н6, J=7,5 Гц), 10,55 (s, 1H, NH).
10. АВ-система ( A=3,58, A=3,58,  B=3,6, 2H, Н22, J=15,8 Гц), АВ-система ( B=3,6, 2H, Н22, J=15,8 Гц), АВ-система ( A=3,58, A=3,58,  B=3,59, СН2-ОН, J=14,2 Гц), 3,67 (d. шир., B=3,59, СН2-ОН, J=14,2 Гц), 3,67 (d. шир.,  -H, 4,9 Гц), 7,08 (dd, 1H, аром. Н6, J=7,9 Гц, J=2,1 Гц), 7,22 (t, 1H, аром. Н5, J=7,9 Гц), 7,45 (dd, 1H, аром. Н4, J=7,9, J=2,1 Гц), 7,65 (d, 1H, аром. Н2, J=2,1 Гц), 9,54 (шир., 1H, NH). -H, 4,9 Гц), 7,08 (dd, 1H, аром. Н6, J=7,9 Гц, J=2,1 Гц), 7,22 (t, 1H, аром. Н5, J=7,9 Гц), 7,45 (dd, 1H, аром. Н4, J=7,9, J=2,1 Гц), 7,65 (d, 1H, аром. Н2, J=2,1 Гц), 9,54 (шир., 1H, NH).
11. 3,62 (s, 2H, Н22), 6,75 (d, 1H, пиррол-Н, J=4,5 Гц) 7,12 (d, 1H, пиррол-Н, J=4,5 Гц), 7,18 (dd, 1H, аром. Н6, J=6,3 Гц, J=1,5 Гц), 7,28 (t, 1H, 5 аром. Н5, J=6,3 Гц), 7,5 (dd, 1H, аром. Н4, J=6,3 Гц, J=1,5 Гц), 7,62 (d, 1H, аром. Н2, J=1,5 Гц), 7,95 (s, 1H, NH).
12. В отличие от данных ЯМР-анализа соединения примера 2 сигналы 2,2′- и 4-протонов трициклического остатка отсутствуют. MS m/e: 626 (МН)+
13. 3,65 (s, 2H, H22), 7,3, 7,4, 7,8 (3×m, аром. Н), 8,15 (s, 1H, аром. Н2), 8,05, 8,8, 9,2, 10,4 (4 × шир., пиридин-Н), 10,9 (шир., 1H, NH).
14. 3,65 (s, 2H, H22), 7,18 (dd, 1H, аром. Н4, J=1 Гц, J=7,7 Гц,), 7,3 (t, 1H, аром. Н5, J=7,98 Гц), 7,73 (dd, 1H, аром. Н6, J=1 Гц, J=7,7 Гц), 8,03 (d, 1H, аром.H2, J=2 Гц), 7,82, 8,3 (2×m, пиридин-Н4, Н5), 8,6 (d, 1H, пиридин-Н6, J=7,75 Гц), 8,73 (d, 1H, пиридин-Н3, J=4,5 Гц), 11,95 (s, 1H, NH).
15. 15 3,6 (s, 2H, H22), 7,10 (dd, 1Н, аром. Н4, J=7,3 Гц, J=1,5 Гц), 7,24 (t, 1H, аром. Н5, J=8 Гц), 7,48 (dd, 1H, аром. Н6, J=7,3 Гц, J=1,5 Гц), 7,65 (d, 1H, аром. Н2, J=1,5 Гц), 6,3, 6,71, 7,0 (3×m, 3H, пиррол-Н), 7,62 (s, 1H, NH), 9,65 (s, 1H, NH).
16. АВ-система ( A=3,6, A=3,6,  B=3,68, 2H, Н22, J=15,2 Гц), 6,52, 6,83, 7,48 (3×m, 3H, пиррол-Н), 7,08 (dd, 1H, аром. Н4, J=1,5 Гц, J=7,7 Гц), 7,23 (t, 1H, аром. Н5, J=7,9 Гц), 7,52 (dd, 1H, аром. Н6, J=1,5 Гц, J=7,7 Гц), 7,65 (d, 1H, аром. Н2, J=1,5 Гц), 7,42 (s, 1H, NH), 8,55 (шир., 1Н, NH). B=3,68, 2H, Н22, J=15,2 Гц), 6,52, 6,83, 7,48 (3×m, 3H, пиррол-Н), 7,08 (dd, 1H, аром. Н4, J=1,5 Гц, J=7,7 Гц), 7,23 (t, 1H, аром. Н5, J=7,9 Гц), 7,52 (dd, 1H, аром. Н6, J=1,5 Гц, J=7,7 Гц), 7,65 (d, 1H, аром. Н2, J=1,5 Гц), 7,42 (s, 1H, NH), 8,55 (шир., 1Н, NH).
17. 3,62 (s, 2H, Н22), 7,15 (dd, 1Н, аром. Н6, J=2 Гц, J=7,8 Гц), 7,34 (t, 1H, аром. Н5, J=8,2 Гц), 7,54 (dd, 1H, аром. Н4, J=2 Гц, J=7,8 Гц), 7,01, 7,18, 7,3, 7,45, 7,7 (5×m, индол-Н), 7,88 (s, 1H, NH), 9,43 (s, 1H, NH).
18. АВ-система ( A=3,52, A=3,52,  B=3,58, 2H, Н22, J=14,9 Гц), 6,8, 7,2, 7,4, 7,82, 7,9 (5×m, 6H, аром. Н + хинолин-Н), 7,83 (t, 1H, аром. H5, J=7,7 Гц), 8,5 (d, 1H, хинолин-H1), 8,75 (d, 1H, хинолин-Н7). B=3,58, 2H, Н22, J=14,9 Гц), 6,8, 7,2, 7,4, 7,82, 7,9 (5×m, 6H, аром. Н + хинолин-Н), 7,83 (t, 1H, аром. H5, J=7,7 Гц), 8,5 (d, 1H, хинолин-H1), 8,75 (d, 1H, хинолин-Н7).
19. 3,55 (шир. s, 2H, H22), 7,03, 7,2, 7,55 (3×m, 3H, аром. Н4, Н5, Н6), 7,75 (s, 1H. аром. Н2), 7,7-8,1 (шир., NH2, NH), 9,6(шир., 1H, NH).
20. 3,65 (s, 2H, H22), 7,15 (dd, 1H, аром. Н6, J=1,5 Гц, J=7,3 Гц), 7,32 (t, 1H, аром. Н5, J=7,9 Гц), 7,65 (dd, 1H, аром. Н4, J=1,5 Гц, J=7,7 Гц), 7,8 (d, 1H, аром. Н2, J=1,5 Гц), 8,22 (dd, 1H, пиридин-Н5, J=2,2 Гц, J=5,3 Гц), 8,95 (dd, 1H, пиридин. Н6, J=0,8 Гц, J=5,3 Гц), 8,99 (d, 1H, пиридин-Н3, J=2,2 Гц), 9,82 (s, 1H, NH).
21. 1,45, (s, 9H, аром. трет-бутил), АВ-система ( A=3,65, A=3,65,  B=3,75, 2Н, Н22, J=14,8 Гц), 4,4 (шир., 1H, B=3,75, 2Н, Н22, J=14,8 Гц), 4,4 (шир., 1H,  -Н, пиперидин), 3,1, 3,5 (2 × шир., 2Н, -Н, пиперидин), 3,1, 3,5 (2 × шир., 2Н,  -H, пиперидин), 7,18, 7,28 (2×m, 2H, аром. Н4, Н3), 7,7 (шир., 1H, аром-Н6), 10,4 (шир., 1H, NH). -H, пиперидин), 7,18, 7,28 (2×m, 2H, аром. Н4, Н3), 7,7 (шир., 1H, аром-Н6), 10,4 (шир., 1H, NH).
22. 2,48, (s, 3H, аром. СН3), АВ-система ( A=3,2, A=3,2,  B=3,36, 2H, Н22, J=15,8 Гц), 4,4 (шир., 1H, B=3,36, 2H, Н22, J=15,8 Гц), 4,4 (шир., 1H,  -Н, пиперидин), 3,1, 3,5 (2 × шир., 2Н, -Н, пиперидин), 3,1, 3,5 (2 × шир., 2Н,  -H, пиперидин), 7,0, 7,4 (2×m, 2H, аром. Н4, Н3), 7,8 (шир., 1H, аром. Н6) 8,45, 9,6 (2 × шир., 2H, NH2), 10,4 (шир., 1Н, NH). -H, пиперидин), 7,0, 7,4 (2×m, 2H, аром. Н4, Н3), 7,8 (шир., 1H, аром. Н6) 8,45, 9,6 (2 × шир., 2H, NH2), 10,4 (шир., 1Н, NH).
23. Rotamere: 1,48 (s, 9H, трет-бутил), АВ-система ( A=3,61, A=3,61,  B=3,68, 1,2H, J=15 Гц, B=3,68, 1,2H, J=15 Гц,  A=3,64, A=3,64,  B=3,66, 0,8H, J=14,5 Гц), 7,1-7,5 (m, 2H, аром. Н3, Н4), 8,35 (d, 1H, аром. Н6, J=2 Гц), 8,65 (d, 0,8Н, формил-Н, J=11 Гц, 8,67 (шир. s, 0,2H). B=3,66, 0,8H, J=14,5 Гц), 7,1-7,5 (m, 2H, аром. Н3, Н4), 8,35 (d, 1H, аром. Н6, J=2 Гц), 8,65 (d, 0,8Н, формил-Н, J=11 Гц, 8,67 (шир. s, 0,2H).
24. Rotamere: 2,5, 2,55 (2×s, 6H, аром. СН3), АВ-система ( A=3,30, A=3,30,  B=3,4, 1,2H, J=15 Гц, B=3,4, 1,2H, J=15 Гц,  A=3,34, A=3,34,  B=3,4, 0,8H, J=14,5 Гц), 7,05 (d, 0,5H, аром. Н4, J=8 Гц), 7,78 (d, 0,5Н, аром. Н4, J=8 Гц), 7,1 (d, 1H, аром. Н5, J=8 Гц), 8,42 (d, 0,8Н, формил-Н, J=11 Гц, 8,67 (шир. s, 0,2Н), 6,9 (шир., 1H, NH). B=3,4, 0,8H, J=14,5 Гц), 7,05 (d, 0,5H, аром. Н4, J=8 Гц), 7,78 (d, 0,5Н, аром. Н4, J=8 Гц), 7,1 (d, 1H, аром. Н5, J=8 Гц), 8,42 (d, 0,8Н, формил-Н, J=11 Гц, 8,67 (шир. s, 0,2Н), 6,9 (шир., 1H, NH).
26. (в форме дигидрохлорида) 7,52 (s, 1H, имидазол-Н), 9,03 (s, 1H, имидазол-Н), 8,65 (шир., 2H, NH2), 7,16 (dd, 1H, аром. Н6, J=1,5 Гц, J=8,3 Гц), 7,42 (dd, 1H, аром. Н4, J=1,5 Гц, J=8,3 Гц), 7,73 (d, 1H, аром. Н2, J=1,5 Гц), 11,4 (s, 1H, NH), 4,45 (m, 1H,  -Н, аминокислота), 3,8 (s, 3H, N-СН3), АВ-система ( -Н, аминокислота), 3,8 (s, 3H, N-СН3), АВ-система ( A=4,4, A=4,4,  B=3,48, 2H, СН2СН, J=15,2 Гц, 7,8 Гц), АВ-система ( B=3,48, 2H, СН2СН, J=15,2 Гц, 7,8 Гц), АВ-система ( A=3,75, A=3,75,  B=3,65, 2H, Н22, J=15,2 Гц), 2,25 (s, 3H, аром. СН3). B=3,65, 2H, Н22, J=15,2 Гц), 2,25 (s, 3H, аром. СН3).
27. (в форме дигидрохлорида) (d6-ДМСО, 350 К): 11,8 (s, 1H, имидазол-Н), 9,03 (s, 1H, имидазол-Н), 8,65 (шир., 2H, NH2), 7,16 (dd, 1H, аром. Н6, J=1,5 Гц, J=8,3 Гц), 7,38 (dd, 1H, аром. Н4, J=1,5 Гц, J=8,3 Гц), 7,73 (d, 1H, аром. Н2, J=1,5 Гц), 7,54 (s, 1H, NH), 4,45 (m, 1H,  -Н, аминокислота), 3,3 (s, 3H, N-СН3) АВ-система ( -Н, аминокислота), 3,3 (s, 3H, N-СН3) АВ-система ( A=3,25, A=3,25,  B=3,4, 2H, СН2СН, J=15,2, 7,8 Гц), АВ-система ( B=3,4, 2H, СН2СН, J=15,2, 7,8 Гц), АВ-система ( A=3,78, A=3,78,  B=3,68, 2H, Н22, J=15,2 Гц), 2,25 (s, 3H, аром. СН3). B=3,68, 2H, Н22, J=15,2 Гц), 2,25 (s, 3H, аром. СН3).
28. (в форме дигидрохлорида) 9,7 (s, 1H, NH), 8,82 (s, 1H, имидазол-Н), 7,48 (s, 1H, имидазол-Н), 8,45 (шир., 3H, NH3), 6,83 (d, 1H, аром. Н4, J=8,4 Гц), 7,25 (d, 1H, аром. H5, J=8,4 Гц), 4,85 (m, 1H,  -H, аминокислота), 3,38-3,5 (m, 2Н, СН2СН, аминокислота), 2,3, 2,38 (2×СН3, аром. СН3), АВ-система ( -H, аминокислота), 3,38-3,5 (m, 2Н, СН2СН, аминокислота), 2,3, 2,38 (2×СН3, аром. СН3), АВ-система ( A=3,08, A=3,08,  B=3,18, 2Н, Н22, J=15,2 Гц), MS m/e: 651 (МН)+. B=3,18, 2Н, Н22, J=15,2 Гц), MS m/e: 651 (МН)+.
29. В отличие от данных ЯМР-анализа соединения примера 28 сигналы 2,2′- и 4-протонов трициклического остатка отсутствуют. MS m/e: 684 (МН)+
30. (в форме дигидрохлорида) (d6-ДМСО): 11,8 (s, 1H, имидазол-H), 9,03 (s, 1H, имидазол-Н), 8,6 (шир., 2Н, NH2), 7,09 (dd, 1H, аром. Н6, J=1,5 Гц, J=7,3 Гц), 7,27 (t, 1H, аром. Н5, J=7,9 Гц), 7,43 (dd, 1H, аром. Н4, J=1,5 Гц, J=7,3 Гц), 7,64 (d, 1H, аром. Н2, J=1,5 Гц), 7,54 (s, 1H, NH), 4,43 (m, 1H,  -H, 10 аминокислота), 3,2-3,4 (m, 2H, СН2СН, аминокислота). -H, 10 аминокислота), 3,2-3,4 (m, 2H, СН2СН, аминокислота).
31. (в форме дидейтерохлорида). В отличие от данных ЯМР-анализа соединения примера 30 сигналы 2,2′- и 4-протонов трициклического остатка отсутствуют. MS m/e: 625 (MH)+.
32. (в форме гидрохлорида) (de-ДМСО): 7,52 (s, 1H, имидазол-Н), 9,03 (s, 1H, имидазол-Н), 7,8 (m, 1H, NH2), 10,95 (s, 1H, NH), 8,45 (s, 3Н, NH3), 7,16 (dd, 1H, аром. Н6, J=1,5 Гц, J=8,3 Гц), 7,42 (dd, 1H, аром. Н4, J=1,5 Гц, J=8,3 Гц), 7,73 (d, 1H, аром. Н2, J=1,5 Гц), 4,05 (m, 1H,  -H, аминокислота), 3,8 (s, 3Н, N-СН3), АВ-система ( -H, аминокислота), 3,8 (s, 3Н, N-СН3), АВ-система ( A=4,4, A=4,4,  B=3,48, 2H, СН2СН, J=15,2, 7,8 Гц), АВ-система ( B=3,48, 2H, СН2СН, J=15,2, 7,8 Гц), АВ-система ( A=3,78, A=3,78,  B=3,68, 2H, Н22, J=15,2 Гц), 2,25 (s, 3Н, аром. СН3). B=3,68, 2H, Н22, J=15,2 Гц), 2,25 (s, 3Н, аром. СН3).
33. (в форме гидрохлорида) (d6-ДМСО): 10,2 (шир., 1H, NH), 8,5 (шир., 3Н, NH3), 7,15 (d, 1H, аром. Н4, J=8,2 Гц), 7,25 (d, 1H, аром. Н5, J=8,2 Гц), 4,13 (t, 1H,  -H, аминокислота, J=6,6 Гц), 3,4 (m, 2H, -H, аминокислота, J=6,6 Гц), 3,4 (m, 2H,  -Н,аминокислота), АВ-система ( -Н,аминокислота), АВ-система ( A=3,5, A=3,5,  B=3,36, 2H, Н22, J=15,2 Гц), 2,41, 2,44 (2×s, 6H, 2×СН3). B=3,36, 2H, Н22, J=15,2 Гц), 2,41, 2,44 (2×s, 6H, 2×СН3).
34. ЯМР (d6-ДМСО, 350 К): 10,9 (шир., 1H, NH), 8,6 (шир., 4Н, NH), 7,10 (dd, 1H, аром. Н6, J=1,5 Гц, J=7,3 Гц), 7,27 (t, 1H, аром. Н5, J=7,9 Гц), 7,50 (dd, 1H, аром. Н4, J=1,5 Гц, J=7,3 Гц), 7,74 (d, 1H, аром. Н2, J=1,5 Гц), 4,13 (t, 1H,  -H, аминокислота, J=6,6 Гц), 3,4 (m, 2H, -H, аминокислота, J=6,6 Гц), 3,4 (m, 2H,  -Н, аминокислота), АВ-система ( -Н, аминокислота), АВ-система ( A=3,6, A=3,6,  B=3,68, 2H, H22, J=15,2 Гц). B=3,68, 2H, H22, J=15,2 Гц).
35. (в форме гидрохлорида) (d6-ДМСО, 350 К): 8,03 (шир., 3Н, NH3), 4,25 (d, 1H,  -H, аминокислота, J=4,6 Гц), АВ-система ( -H, аминокислота, J=4,6 Гц), АВ-система ( A=3,45, A=3,45,  B=3,32, 2H, Н22, J=15,2 Гц) 0,85, 0,95 (2×d, СН(СН3)2, J=5,9 Гц), 4,0 (m, 2H, NCH2CH2). MS m/e: 577 (МН)+ B=3,32, 2H, Н22, J=15,2 Гц) 0,85, 0,95 (2×d, СН(СН3)2, J=5,9 Гц), 4,0 (m, 2H, NCH2CH2). MS m/e: 577 (МН)+
36. 7,26 (d, 2H, аром.Н, J=8,6 Гц), 6,58 (d, 2H, аром. Н, J=8,6 Гц) АВ-система ( A=3,42, A=3,42,  B=3,38, 2H, H22, J=14,4 Гц), Ms m/e: 621 (M++Na). B=3,38, 2H, H22, J=14,4 Гц), Ms m/e: 621 (M++Na).
37. Соединение (22-S*): (d6-ДМСО/CDCl3 в соотношении 1:3)): 7,37 (dd, 1H, аром. Н6, J=1,5 Гц, J=7,3 Гц), 7,27 (t, 1H, аром. Н5, J=7,9 Гц), 7,34 (dd, 1H, аром. Н2, J=1,5 Гц, J=7,3 Гц), 7,48 (d, 1H, аром. Н2, J=1,5 Гц), 3,82 (q, 1H, СНСН3, J=7,2 Гц), 1,49 (d, 3Н, СНСН3, J=7,2 Гц).
38. Соединение (22-S*): (d6-ДМСО/CDCl3 в соотношении 1:3)): 7,37 (dd, 1H, аром. Н6, J=1,5 Гц, J=7,3 Гц), 7,27 (t, 1H, аром. Н5, J=7,9 Гц), 7,34 (dd, 1H, аром. Н4, J=1,5 Гц, J=7,3 Гц), 7,48 (d, 1H, аром. Н2, J=1,5 Гц), 3,76 (q, 1H, СНСН3, J=7,2 Гц), 1,52 (d, 3Н, СНСН3, J=7,2 Гц).
39. См. данные в приведенном ниже примере А.
40. В отличие от данных ЯМР-анализа соединения примера 39 (в гидрохлоридной форме) сигналы 2,2′- и 4-протонов трициклического остатка отсутствуют. MS m/e: 489 (М+1)+.
41. 7,45 (m, 1 Н, аром. Н), АВ-система ( A=3,57, A=3,57,  B=3,63, 2H, Н22, J=14,8Гц). B=3,63, 2H, Н22, J=14,8Гц).
42. 6,88 (dd, 1H, аром. Н6, J=1,5 Гц, J=6,2 Гц), 7,32 (dd, 1H, аром. Н5, J=1,5 Гц, J=6,2 Гц), 7,4 (m, 1H, аром. Н3), 3,59 (s, 2H, H22).
43. 7,38 (dd, Н, аром. Н6, J=1,5 Гц, J=6,2 Гц), 7,2 (t, 1H, аром. Н5, J=6,2 Гц), 7,05 (dd, 1H, аром. Н4, J=1,5 Гц, J=6,2 Гц), 7,5 (m, 1H, аром. Н2), 3,4 (s, 2H, H22), 2,18 (s, 3H, COCH3).
44. 7,9 (шир., 1H, NH), 7,22 (dd, 1H, аром. Н6, J=1,5 Гц, J=6,2 Гц), 7,3 (t, 1H, аром. Н5, J=6,2 Гц), 7,43 (dd, 1H, аром. Н4, J=1,5 Гц, J=6,2 Гц), 7,56 (m, 1H, аром. Н2), 3,62 (s, 2H, Н22).
45. 7,48 (s, 1H, СН=O), 6,80 (dd, 1H, аром. Н6, J=1,5 Гц, J=6,2 Гц), 7,14 (t, 1H, аром. Н5, J=6,2 Гц), 6,98 (dd, 1H, аром. Н4, J=1,5 Гц, J=6,2 Гц), 6,94 (m, 1H, аром. Н2), 3,58 (s, 2H, Н22).
46. 3,62 (s, 2H, Н22), 7,23 (dd, 1H, аром. Н6, J=1,5 Гц, J=6,2 Гц), 7,3 (t, 1H, аром. Н5, J=6,2 Гц), 7,48 (dd, 1H, аром. Н4, J=1,5 Гц, J=6,2 Гц), 7,75 (m, 1H, аром. Н2), 11, 48, 8,05 (2× шир., NH), 4,3 (q, 2H, ОСН2СН3, J=7,2 Гц), 1,38 (t, 3Н, ОСН2СН3, J=7,2 Гц).
47. 7,72 (s, 1H, NH), 6,45 (q, 1H, NH, J=3,2 Гц), АВ-система ( A=3,52, A=3,52,  B=3,6, 2H, Н22, J=14,8 Гц), 6,99 (dd, 1H, аром. Н6, J=1,5 Гц, J=6,2 Гц), 7,3 (t, 1H, аром. Н5, J=6,2 Гц), 7,3 (m, 2H, аром. Н4, Н2), 3,28 (d, 3Н, NCH3, J=3,2 Гц). B=3,6, 2H, Н22, J=14,8 Гц), 6,99 (dd, 1H, аром. Н6, J=1,5 Гц, J=6,2 Гц), 7,3 (t, 1H, аром. Н5, J=6,2 Гц), 7,3 (m, 2H, аром. Н4, Н2), 3,28 (d, 3Н, NCH3, J=3,2 Гц).
48. 7,72 (s, 1H, NH), 6,45 (q, 1H, NH, J=3,2 Гц), АВ-система ( A=3,62, A=3,62,  B=3,66, 2H, Н22, J=14,9 Гц), 7,75 (m, 1H, аром. Н2), 7,32 (m, 3Н, аром. Н6, Н5, Н4), 3,18 (шир., 3Н, С=NCH3), 2,78 (s, 3Н, SCH3). B=3,66, 2H, Н22, J=14,9 Гц), 7,75 (m, 1H, аром. Н2), 7,32 (m, 3Н, аром. Н6, Н5, Н4), 3,18 (шир., 3Н, С=NCH3), 2,78 (s, 3Н, SCH3).
49. 7,48 (s, 1H, NHCH=N), 6,8 (dd, 1H, аром. Н6, J=1,5 Гц, J=6,2 Гц), 7,15 (t, 1H, аром. Н5, J=6,2 Гц), 6,99 (dd, 1H, аром. Н4, J=1,5 Гц, J=6,2 Гц), 6,95 (m, 1H, аром. Н2), 3,4 (s, 2H, Н22), 3,01 (s, 6H, М(СН3)2).
А. 0,58 (d, 3Н, Н16, J=7,2 Гц), 0,81 (d, 3Н, H17, J=7,3 Гц), 1,02 (s, 3Н, H18), 1,32 (s, 3Н, Н15), АВХ-система ( A=1,2, A=1,2,  B=1,88, Н13a, Н13b, J=16,1 Гц, J=9,1 Гц), 2,08 (d, 1H, H4, J=2,1 Гц). ABXY-система ( B=1,88, Н13a, Н13b, J=16,1 Гц, J=9,1 Гц), 2,08 (d, 1H, H4, J=2,1 Гц). ABXY-система ( A=2,23, A=2,23,  B=2,19, H2a, H2b, J=16,2 Гц, J=9,1 Гц, J=1,8 Гц), 2,3 (m, 1H, H10), 3,4 (d, 1H, H11, J=5,98 Гц), АВ-система ( B=2,19, H2a, H2b, J=16,2 Гц, J=9,1 Гц, J=1,8 Гц), 2,3 (m, 1H, H10), 3,4 (d, 1H, H11, J=5,98 Гц), АВ-система ( A=3,81, A=3,81,  B=3,89, 2Н, Н22, J=14,1 Гц), 5,18 (dd, 1H, Н20a, J=17,5 Гц, J=1,6 Гц), 5,29 (dd, 1H, Н20b J=11 Гц, J=1,6 Гц), 5,51 (d, 1H, H14, J=8,3 Гц), 6,05 (dd, 1H, H19, J=11 Гц, J=17,5 Гц), 7,0 (m, 1H, аром. Н), 7,18 (m, 2H, аром. Н), 7,3 (t, 1H, аром. Н5, J=8 Гц). B=3,89, 2Н, Н22, J=14,1 Гц), 5,18 (dd, 1H, Н20a, J=17,5 Гц, J=1,6 Гц), 5,29 (dd, 1H, Н20b J=11 Гц, J=1,6 Гц), 5,51 (d, 1H, H14, J=8,3 Гц), 6,05 (dd, 1H, H19, J=11 Гц, J=17,5 Гц), 7,0 (m, 1H, аром. Н), 7,18 (m, 2H, аром. Н), 7,3 (t, 1H, аром. Н5, J=8 Гц).
Б.а. АВ-система ( A=3,7, A=3,7,  B=3,82, 2H, Н22, J=15,8 Гц), 7,2 (d, 2H, аром. Н, J=8 Гц), 7,75 (d, 2H, аром. Н, J=8 Гц), 8,4, 9,8 (2 × шир., 4Н, 2 × NH2). B=3,82, 2H, Н22, J=15,8 Гц), 7,2 (d, 2H, аром. Н, J=8 Гц), 7,75 (d, 2H, аром. Н, J=8 Гц), 8,4, 9,8 (2 × шир., 4Н, 2 × NH2).
Б.б. АВХ-система ( A=3,15, A=3,15,  B=3,22, B=3,22,  X=1,92, 2H, Н22, J=15,8 Гц, J=8,2 Гц). X=1,92, 2H, Н22, J=15,8 Гц, J=8,2 Гц).
Б.в. 2,43, 2,48 (2×s, 6H, 2 × аром. СН3), АВ-система ( A=3,22, A=3,22,  B=3,4, 2H, Н22, J=13,8 Гц), 6,7, 6,95 (2×d, 2H, аром. Н4, H5). B=3,4, 2H, Н22, J=13,8 Гц), 6,7, 6,95 (2×d, 2H, аром. Н4, H5).
Б.г. 2,61, 2,74 (2×s, 6H, 2 × аром. СН3), АВ-система ( A=3,31, A=3,31,  B=3,43, 2H, Н22, J=15,8 Гц), 7,2, 7,7 (2×d, 2H, аром. Н4, Н5). B=3,43, 2H, Н22, J=15,8 Гц), 7,2, 7,7 (2×d, 2H, аром. Н4, Н5).
B.б(R). (d6-ДМСО): 1,35 (d, 3Н, С22-СН3, J=7,2 Гц), 3,25 (d, 1H, Н11, J=6,35 Гц), 3,75 (q, 1H, Н22, J=7,2 Гц), 7,18 (t, 1H, аром. Н5, J=7,8 Гц), 7,24 (ddd, 1H, аром. Н6, J=7,8 Гц, J=1,5 Гц, J=2,8 Гц), 7,28 (ddd, 1H, аром. Н4, J=7,8 Гц, J=1,5 Гц, J=2 Гц), 7,43 (t, 1H, аром.Н2, J=1,8 Гц).
B.б(S). (d6-ДМСО): 1,48 (d, 3Н, С22-СН3, J=7,2 Гц), 2,4-3,2 (шир., 2H, NH2), 3,38 (d, 1H, Н11, J=6,35 Гц), 3,82 (q, 1H, Н22, J=7,2 Гц), 7,28 (t, 1H, аром. Н5, J=7,8 Гц), 7,34 (ddd, 1H, аром. Н6, J=7,8 Гц, J=1,5 Гц, J=2,8 Гц), 7,36 (ddd, 1H, аром. Н4, J=7,8 Гц, J=1,5 Гц, J=2 Гц), 7,49 (t, 1H, аром. Н2, J 1,8 Гц).
Формула изобретения
1. Соединение формулы
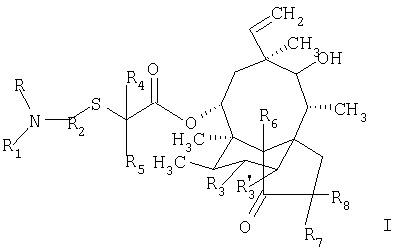
в которой
R обозначает атом водорода или алкил;
R1 обозначает группу формулы
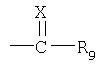
в которой
Х обозначает атом серы или атом кислорода, NR10, где R10 обозначает атом водорода или алкил, или N+(R’10)2, где R’10 обозначает алкил в присутствии соответствующего аниона;
R9 обозначает аминогруппу, алкил, арил, гетероциклил или меркаптогруппу, а если Х обозначает атом кислорода, дополнительным значением R9 является атом водорода;
R2 обозначает фенилен;
R4 обозначает атом водорода или алкил;
R5 обозначает атом водорода или алкил;
R3, R’3, R6, R7 и R8 каждый независимо друг от друга обозначает атом водорода или дейтерия; или
R и R2 совместно с азотным атомом, с которым они связаны, образуют 5 или 6-членное кольцо, a R1 обозначает группу формулы
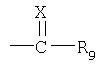
в которой Х и R9 имеют значения, указанные выше, и гетероциклил означает 5- или 6-членный гетероциклил, включающий один или два атома азота.
2. Соединение формулы I по п.1, в которой
R обозначает атом водорода;
R1 обозначает группу формулы
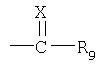
в которой Х обозначает атом серы или атом кислорода, NR10, где R10 обозначает атом водорода или алкил, или N+(R’10)2, где R’10 обозначает алкил в присутствии соответствующего аниона;
R9 обозначает аминогруппу, алкил, гетероциклил или меркаптогруппу, а если Х обозначает атом кислорода, дополнительным значением R9 является атом водорода;
R2 обозначает фенилен;
R4 обозначает атом водорода или алкил;
R5 обозначает атом водорода;
R3 и R’3 обозначают атомы водорода;
R6, R7 и R8 обозначают атомы водорода или дейтерия; или R и R2 совместно с азотным атомом, с которым они связаны, образуют 5 или 6-членное кольцо, а R1 обозначает группу формулы
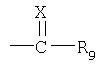
в которой Х обозначает атом кислорода, a R9 обозначает алкил.
3. Соединение по п.1, которое отвечает формуле
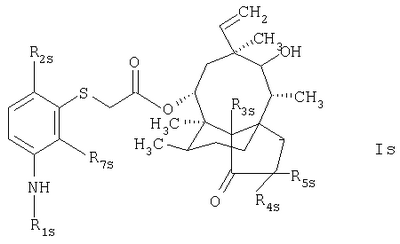
в которой R1s обозначает группу формулы
в которой R6s обозначает атом водорода или дейтерия;
R2s обозначает атом водорода, метил или третбутил;
R7s обозначает атом водорода или метил;
R3s, R4s и R5s обозначают атомы водорода или дейтерия.
4. Соединение по п.1, которое отвечает формуле
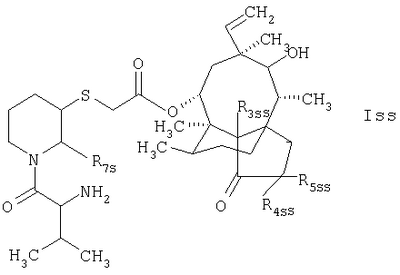
в которой R3ss, R4ss и R5ss обозначают атомы водорода или дейтерия.
5. Соединение по п.1, которое выбирают из ряда, включающего
14-O-(3-(пиперидин-2-илкарбониламино)фенилсульфанилацетил)мутилин;
14-O-(3-(пиперидин-2-илкарбониламино)фенилсульфанилацетил)-2,2,4-тридейтеромутилин;
14-O-(3-(пиперидин-2-илкарбониламино)-2,5-диметилфенилтиометил-карбонил)-мутилин;
14-O-(3-(пиперидин-2-илкарбониламино)-2,5-диметилфенилтиометил-карбонил)-2,2,4-тридейтеромутилин;
14-O-(3-(пиперидин-2-илкарбониламино)-5-трет-бутилфенилсульфанилацетил)-мутилин и
14-O-(3-(пиперидин-2-илкарбониламино)-5-трет-бутилфенилсульфанилацетил)-2,2,4-тридейтеромутилин.
6. Соединение по любому из пп.1-5 в форме соли, или в форме соли и в форме сольвата, или в форме сольвата.
7. Соединение по любому из пп.1-6, обладающее антибактериальной активностью.
8. Соединение формулы I для применения при приготовлении лекарственного средства для лечения обусловленных микробами заболеваний, вызванных бактериями, включая штаммы, резистентные к пенициллину или множеству лекарств, ванкомицинрезистентные штаммы и метициллинрезистентные штаммы.
9. Способ лечения обусловленных микробами заболеваний, который включает введение в организм субъекта, нуждающегося в таком лечении, эффективного количества соединения формулы I.
10. Фармацевтическая композиция, обладающая антибактериальной активностью и включающая соединение формулы I в свободной форме или в форме фармацевтически приемлемой соли в сочетании с по меньшей мере одним фармацевтически приемлемым носителем или разбавителем.
11. Соединение формулы I, обладающее антибактериальной активностью, для применения в качестве ветеринарного средства.
12. Соединение формулы I для приготовления ветеринарной композиции, обладающее антибактериальной активностью, которая может быть использована в качестве ветеринарного средства.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 29.07.2006
Извещение опубликовано: 10.01.2008 БИ: 01/2008
|
|