Патент на изобретение №2155772
|
||||||||||||||||||||||||||
(54) ЦИКЛОПЕПТОЛИД, ШТАММ ГРИБА, СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОПЕПТОЛИДА, ТЕРАПЕВТИЧЕСКИЙ СОСТАВ
(57) Реферат: Изобретение охватывает новый класс циклогептапептолидов формулы I, где A, B, R1 Ieu, С, Х и Y охарактеризованы в описании, и их терапевтическое применение в качестве ингибиторов экспрессии молекул адгезии для лечения многих болезненных состояний. Получение данного соединения возможно путем культивирования штамма гриба Bartalinia sp. NRRL21123 в питательной среде с последующим выделением из среды указанного соединения. В изобретении описывается также получение терапевтического состава, обладающего способностью ингибировать экспрессию молекул адгезии, включающего в качестве активного ингредиента соединение формулы I в эффективном количестве, а также целевые добавки. 4 с. и 2 з.п. ф-лы, 6 табл., 7 ил. 
Изобретение касается циклопептолидов и их терапевтического применения в качестве ингибиторов экспрессии молекул адгезии. Клеточные молекулы адгезии, такие как ICAM-1, VCAM-1 и E-селектин, экспрессируются на поверхности эндотелиальных клеток, а также кератиноцитов в случае ICAM-1, в ответ на действие провоспалительных медиаторов, включающих TNF  , IFN , IFN , IL1 и LPS. Соответствующие контрлиганды, например LFA-1, VLA-4 и SLEx, экспрессируются на поверхности циркулирующих кровяных клеток. Трансэндотелиальная миграция лейкоцитов во время воспалительных процессов, а также межклеточное взаимодействие вне сосудов регулируются путем взаимодействия между этими молекулами адгезии и их контрлигандами. Следовательно, представляется возможным использовать ингибиторы экспрессии молекул адгезии для лечения многих болезненных состояний. Однако к настоящему времени нет подходящих низкомолекулярных ингибиторов экспрессии молекул адгезии.
Циклопептолиды представляют собой вещества с замкнутыми в цикл молекулами, содержащими аминокислотные остатки, соединенные пептидными связями, и по меньшей мере один гидроксизамещенный остаток карбоновой кислоты, который соединен через заместитель его гидроксильной группы с соседним кислотным остатком посредством эфирной связи.
Мы открыли новый класс циклопептолидов, являющихся ингибиторами экспрессии ICAM-1, VCAM-1 и E-селектина.
Настоящее изобретение относится к циклогептапептолиду формулы I , IL1 и LPS. Соответствующие контрлиганды, например LFA-1, VLA-4 и SLEx, экспрессируются на поверхности циркулирующих кровяных клеток. Трансэндотелиальная миграция лейкоцитов во время воспалительных процессов, а также межклеточное взаимодействие вне сосудов регулируются путем взаимодействия между этими молекулами адгезии и их контрлигандами. Следовательно, представляется возможным использовать ингибиторы экспрессии молекул адгезии для лечения многих болезненных состояний. Однако к настоящему времени нет подходящих низкомолекулярных ингибиторов экспрессии молекул адгезии.
Циклопептолиды представляют собой вещества с замкнутыми в цикл молекулами, содержащими аминокислотные остатки, соединенные пептидными связями, и по меньшей мере один гидроксизамещенный остаток карбоновой кислоты, который соединен через заместитель его гидроксильной группы с соседним кислотным остатком посредством эфирной связи.
Мы открыли новый класс циклопептолидов, являющихся ингибиторами экспрессии ICAM-1, VCAM-1 и E-селектина.
Настоящее изобретение относится к циклогептапептолиду формулы I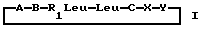 где А обозначает остаток масляной кислоты, замещенной по  -гидроксильной группе, который может быть дополнительно замещен по -гидроксильной группе, который может быть дополнительно замещен по  -положению радикалом R6, обозначающим CN, COOR2, CONR3R4, COR5, CSNH2 или алкил, который может быть замещен азидогруппой, атомом галогена, алкоксигруппой, возможно защищенной гидроксильной или аминогруппой, винил, который может быть замещен алкилом, атомом галогена или CN-группой, циклоалкил, тетразолил или группу -C -положению радикалом R6, обозначающим CN, COOR2, CONR3R4, COR5, CSNH2 или алкил, который может быть замещен азидогруппой, атомом галогена, алкоксигруппой, возможно защищенной гидроксильной или аминогруппой, винил, который может быть замещен алкилом, атомом галогена или CN-группой, циклоалкил, тетразолил или группу -C CH; где R2 обозначает водород или алкил, который может быть дополнительно замещен арилом, R3 и R4 – одинаковые или различные и обозначают водород или алкил либо образуют совместно с атомом азота кольцо, состоящее из 3-6 атомов, 20 которое может содержать второй гетероатом, а R5 обозначают водород или низший алкил; CH; где R2 обозначает водород или алкил, который может быть дополнительно замещен арилом, R3 и R4 – одинаковые или различные и обозначают водород или алкил либо образуют совместно с атомом азота кольцо, состоящее из 3-6 атомов, 20 которое может содержать второй гетероатом, а R5 обозначают водород или низший алкил;B обозначает остаток  -амино- -амино- -метилзамещенной октановой кислоты; -метилзамещенной октановой кислоты;R1 обозначает водород или метил; C обозначает триптофан или N-метилтриптофан формулы VI 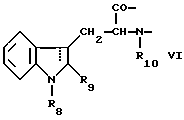 где R8 обозначает водород, алкоксигруппу, алкил или бензил, R9 обозначает водород или галоген, R10 обозначает водород или метил и  обозначает одинарную или двойную связь, обозначает одинарную или двойную связь,X обозначает остаток  -аминозамещенной (C2-C14)карбоновой кислоты, и Y обозначает остаток -аминозамещенной (C2-C14)карбоновой кислоты, и Y обозначает остаток  -амино- или N-метил- -амино- или N-метил- -аминозамещенной (C2-C10)карбоновой кислоты.
Расположение аминокислотных остатков в формуле I таково, что направление от C-конца к N-концу ориентировано по часовой стрелке, а пептолидная эфирная связь располагается между остатками A и Y. Если R1 является метилом, то остатки R1-Leu и Leu представляют собой остатки N-метиллейцина и лейцина соответственно.
Предпочтительно, когда A представляет собой остаток -аминозамещенной (C2-C10)карбоновой кислоты.
Расположение аминокислотных остатков в формуле I таково, что направление от C-конца к N-концу ориентировано по часовой стрелке, а пептолидная эфирная связь располагается между остатками A и Y. Если R1 является метилом, то остатки R1-Leu и Leu представляют собой остатки N-метиллейцина и лейцина соответственно.
Предпочтительно, когда A представляет собой остаток  -гидроксимасляной кислоты, замещенный в -гидроксимасляной кислоты, замещенный в  -положении цианогрупой; группой COOR2, где R2 представляет собой водород, низший алкил с числом атомов углерода от 1 до 4 или дифенилметил; CONR3R4, где R3 представляет собой атом водорода или метил, а R4 – атом водорода или алкил, либо R3 и R4 образуют совместно с атомом азота кольцо, содержащее от 3 до 6 атомов, или морфолиновое кольцо; COR5, где R5 представляет собой атом водорода или низший алкил, содержащий от 1 до 4 атомов углерода; винилом, который может быть дополнительно замещен группой CN, Br или низшим алкилом, содержащим от 1 до 4 атомов углерода; алкилом, который может быть дополнительно замещен азидо-, амино-, гидрокси-, хлор- или алкоксигруппой; CSNH2 или -C -положении цианогрупой; группой COOR2, где R2 представляет собой водород, низший алкил с числом атомов углерода от 1 до 4 или дифенилметил; CONR3R4, где R3 представляет собой атом водорода или метил, а R4 – атом водорода или алкил, либо R3 и R4 образуют совместно с атомом азота кольцо, содержащее от 3 до 6 атомов, или морфолиновое кольцо; COR5, где R5 представляет собой атом водорода или низший алкил, содержащий от 1 до 4 атомов углерода; винилом, который может быть дополнительно замещен группой CN, Br или низшим алкилом, содержащим от 1 до 4 атомов углерода; алкилом, который может быть дополнительно замещен азидо-, амино-, гидрокси-, хлор- или алкоксигруппой; CSNH2 или -C CH. CH.А также может быть замещен в  -положении CH2OH, тетразолилом или циклопропилом.
Предпочтительно, чтобы C являлся остатком N-метилтриптофана формулы VI, где R8 представляет собой атом водорода, (C1-C4)алкоксигруппу, главным образом метоксигруппу, или алкил, а R9 – атом водорода или галогена.
Предпочтительным остатком X является остаток -положении CH2OH, тетразолилом или циклопропилом.
Предпочтительно, чтобы C являлся остатком N-метилтриптофана формулы VI, где R8 представляет собой атом водорода, (C1-C4)алкоксигруппу, главным образом метоксигруппу, или алкил, а R9 – атом водорода или галогена.
Предпочтительным остатком X является остаток  -аминозамещенной (C4-C8)карбоновой кислоты, который может быть дополнительно замещен -аминозамещенной (C4-C8)карбоновой кислоты, который может быть дополнительно замещен  – или – или  -(C1-C4)алкильным заместителем. Наиболее предпочтительно, чтобы X представлял собой -(C1-C4)алкильным заместителем. Наиболее предпочтительно, чтобы X представлял собой  -амино- -амино- – или – или  -(C1-C4)алкил-, главным образом метил-, замещенный остаток октановой или масляной кислоты.
Предпочтительным остатком Y является остаток N-метил- -(C1-C4)алкил-, главным образом метил-, замещенный остаток октановой или масляной кислоты.
Предпочтительным остатком Y является остаток N-метил- -аминозамещенной (C2-C4)карбоновой кислоты, который может быть дополнительно замещен -аминозамещенной (C2-C4)карбоновой кислоты, который может быть дополнительно замещен  – или – или  -(C1-C4)алкильным заместителем. Наиболее предпочтительно, чтобы Y являлся остатком N-метилаланина или N-метилвалина.
Соединения формулы I имеют асимметричные атомы углерода, и соединения могут иметь как R-, так и S-конфигурацию.
Пептиды или пептолиды могут быть также с открытой цепью. Эти соединения с открытой цепью обычно получают как путем разрыва эфирной связи между остатками Y и A, так и путем разрыва амидной связи между любой другой парой соседних кислотных остатков. Например, производными с открытой цепью могут быть соединения формул IV и V: -(C1-C4)алкильным заместителем. Наиболее предпочтительно, чтобы Y являлся остатком N-метилаланина или N-метилвалина.
Соединения формулы I имеют асимметричные атомы углерода, и соединения могут иметь как R-, так и S-конфигурацию.
Пептиды или пептолиды могут быть также с открытой цепью. Эти соединения с открытой цепью обычно получают как путем разрыва эфирной связи между остатками Y и A, так и путем разрыва амидной связи между любой другой парой соседних кислотных остатков. Например, производными с открытой цепью могут быть соединения формул IV и V:H-C-X-Y-A-B-R1Leu-Leu  OR7 IV OR7 IVHA-B-R1Leu-Leu-C-X-Y  OR7 V OR7 Vгде R7 представляет собой атом водорода или алкил. Предпочтительной подгруппой соединений по изобретению являются соединения формулы Ip 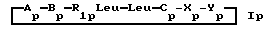 где Ap представляет собой остаток  -гидроксизамещенной масляной кислоты, который может быть замещен по -гидроксизамещенной масляной кислоты, который может быть замещен по  -положению группой R6p, представляющей собой CN-группу, возможно защищенные группы CH2OH, COOR2p, CONR3pR4p, COR5p или -CH= CH2, где R2p является атомом водорода или алкилом, который может быть дополнительно замещен арилом, R3p и R4p – одинаковые или различные и представляют собой атом водорода или алкил, либо образуют совместно с атомом азота 5- или 6-членное кольцо, которое может содержать второй гетероатом, а R5p представляет собой атом водорода или низший алкил; -положению группой R6p, представляющей собой CN-группу, возможно защищенные группы CH2OH, COOR2p, CONR3pR4p, COR5p или -CH= CH2, где R2p является атомом водорода или алкилом, который может быть дополнительно замещен арилом, R3p и R4p – одинаковые или различные и представляют собой атом водорода или алкил, либо образуют совместно с атомом азота 5- или 6-членное кольцо, которое может содержать второй гетероатом, а R5p представляет собой атом водорода или низший алкил;Bp является остатком  -амино- -амино- -метилзамещенной октановой кислоты; -метилзамещенной октановой кислоты;R1p является атомом водорода или метилом; представляет собой остаток триптофана или N-метилтриптофана, который может быть N’-(C1-C4)алкоксизамещенным; Xp является  -аминозамещенным (C2-C14)остатком карбоновой кислоты; и -аминозамещенным (C2-C14)остатком карбоновой кислоты; иYp представляет собой  -амино- или N-метил- -амино- или N-метил- -аминозамещенный (C2-C10)остаток карбоновой кислоты.
Следующей подгруппой соединений по изобретению являются соединения формулы I’p -аминозамещенный (C2-C10)остаток карбоновой кислоты.
Следующей подгруппой соединений по изобретению являются соединения формулы I’p где A’p представляет собой остаток  -гидроксизамещенной масляной кислоты, который может быть замещен по -гидроксизамещенной масляной кислоты, который может быть замещен по  -положению группой R’6p, представляющей собой CN, COOR’2p, CONR’3pR’4p, COR’5p, алкил, который может быть замещен азидогруппой, атомом галогена, алкоксигруппой, возможно защищенным гидроксилом или аминогруппой, винил (может быть замещен алкилом, атомом галогена или CN-группой), циклоалкил, тетразолил или группу -C -положению группой R’6p, представляющей собой CN, COOR’2p, CONR’3pR’4p, COR’5p, алкил, который может быть замещен азидогруппой, атомом галогена, алкоксигруппой, возможно защищенным гидроксилом или аминогруппой, винил (может быть замещен алкилом, атомом галогена или CN-группой), циклоалкил, тетразолил или группу -C CH; где R’2p представляет собой атом водорода или алкил, который может быть замещен арилом, R’3p и R’4p – одинаковые или различные и представляют собой атом водорода или алкил, либо образуют вместе с атомом азота кольцо, состоящее из 3-6 атомов, и которое может содержать второй гетероатом, а R’5p представляет собой атом водорода или низший алкил; CH; где R’2p представляет собой атом водорода или алкил, который может быть замещен арилом, R’3p и R’4p – одинаковые или различные и представляют собой атом водорода или алкил, либо образуют вместе с атомом азота кольцо, состоящее из 3-6 атомов, и которое может содержать второй гетероатом, а R’5p представляет собой атом водорода или низший алкил;B’p является остатком  -амино- -амино- -метилзамещенной октановой кислоты; -метилзамещенной октановой кислоты;R’1p является атомом водорода или метилом; C’p представляет собой остаток триптофана или N-метилтриптофана формулы 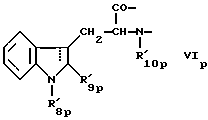 где R’8p представляет собой атом водорода, алкоксигруппу, алкил или бензил, R’9p – атом водорода или галогена, R’10p – атом водорода или метил, а  представляет собой одинарную или двойную связь; представляет собой одинарную или двойную связь;X’p является  -аминозамещенным (C2-C14)остатком карбоновой кислоты; и -аминозамещенным (C2-C14)остатком карбоновой кислоты; иY’p представляет собой  -амино- или N-метил- -амино- или N-метил- -аминозамещенный (C2-C10)остаток карбоновой кислоты.
Все соединения по изобретению могут быть в виде их солей и эфиров, равно как и в свободном виде.
Наиболее предпочтительными являются соединения формул II и III (обозначаемые далее как соединения A и B соответственно) -аминозамещенный (C2-C10)остаток карбоновой кислоты.
Все соединения по изобретению могут быть в виде их солей и эфиров, равно как и в свободном виде.
Наиболее предпочтительными являются соединения формул II и III (обозначаемые далее как соединения A и B соответственно)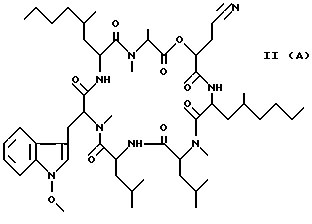 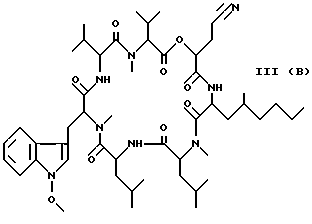 а также циклопептолид формулы I, где 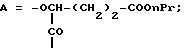 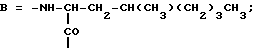 R1 = CH3 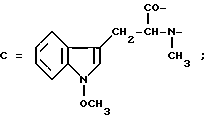 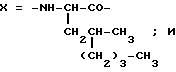 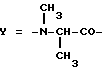 Объектом настоящего изобретения является также штамм гриба Bartalinia sp. NRRL 21123 – продуцент циклопептолида формулы I. Объектом изобретения также является способ получения соединения формулы I, заключающийся в том, что проводят культивирование штамма гриба Bartalinia sp. NRRL 21123 в питательной среде, с последующим выделением из среды указанного соединения. Циклогептапептолиды формулы A и B были выделены из культур грибного штамма F92-4471/08, изолированного из образцов лиственной подстилки, собранных вблизи Ла Платы (La Plata, Аргентина), для которого экспериментально установлено, что он принадлежит к роду Bartalinia. Образцы штамма F92-4471/08 в соответствии с условиями Будапештского договора были депонированы Отделом Сельского хозяйства США (коллекция NRRL-культур) 2 июля 1993 года и данному штамму присвоен депозитный номер NRRL 21123. Характеристики грибного штамма F92-4471/08 описаны далее в примере 1. Таким образом, настоящее изобретение включает как штамм F92-4471/08 (NRRL 21123) в изолированной форме. Соединения A и B и родственные соединения могут быть получены путем культивирования штамма F92-4471/08/NRRL 21123, или штаммов схожих грибных видов в питательной среде и извлечения из них указанных соединений, например, как описано в примере 2. Характеристики соединений A и B приводятся в примере 3. Соединения по изобретению могут быть получены путем модификаций соединений A и B, включающих: а) для получения соединений формулы I, в которых R6 представляет собой группу COOR2‘, где R2‘ является алкилом, который может быть замещен арилом, взаимодействие соединений формулы I, где R6 представлен CN-группой, с нуклеофилами, предпочтительно со спиртами, с соответствующим основным или кислотным катализатором, предпочтительно соляной кислотой, в органических растворителях, предпочтительно эфире, или б) для получения соединений формулы I, в которых R6 представляет собой COалкил, взаимодействие соединений формулы I, где R6 представлен CN-группой, с использованием в качестве нуклеофилов органометаллических соединений, предпочтительно соединений Гриньяра или литийалкилов, которые взаимодействуют в апротонных органических растворителях, предпочтительно эфирах, в присутствии катализатора или без него, или в) для получения соединений формулы I, в которых R6 представляет собой группу COOH, гидролиз соединений формулы I, где R6 представлен COOалкилом, с помощью минеральной кислоты, предпочтительно соляной, в водно-спиртовом растворе, или основания, или г) для получения соединений формулы I, в которых R6 представляет собой группу COOR2‘, этерификацию соединений формулы I, где R6 представлен группой COOH, стандартными методами, предпочтительно путем превращения в хлорангидрид кислоты с помощью, например, тионилхлорида, и обработки подходящим спиртом в присутствии или отсутствие кислотного связующего, или д) для получения соединений формулы I, в которых R6 представляет собой группу CH2OH, восстановление соединений формулы I, где R6 представлен группой COOR2, с помощью гидридов металлов или гидридов бора, предпочтительно борандиметилсульфидного комплекса, в органических растворителях, или е) для получения соединений формулы I, в которых R6 представляет собой группу CONR3R4, превращение соединений формулы I, где R6 представлен группой COOR2, реакцией с аминами, предпочтительно путем превращения свободной кислоты в хлорангидрид кислоты и затем реакцией с амином формулы HNR3R4, или ж) для получения соединений формулы I, в которых R6 представляет собой группу CHO, окисление соединений формулы I, где R6 представлен группой CH2OH, или з) для получения соединений формулы I, в которых R6 представляет собой возможно замещенный винил, взаимодействие соединений формулы I, где R6 представлен группой CHO и метильного производного реагента Виттига, или и) для получения соединений формулы I, в которых R6 представляет собой возможно замещенный алкил из соединений формулы I, где R6 представлен группой CH2OH, или к) для получения соединений формулы I, в которых R6 представляет собой группу CH2NH2, восстановление соединений формулы I, где R6 представлен группой CH2N3, или л) для получения соединений формулы I, в которых R6 представляет собой группу -C  CH, из соединений формулы I, где R6 представлен группой CH=CBr2, или CH, из соединений формулы I, где R6 представлен группой CH=CBr2, илим) для получения соединений формулы I, в которых R6 представляет собой циклопропил, взаимодействие соединений формулы I, где R6 представлен винилом, с диазометаном, или н) для получения соединений формулы I, в которых R6 представляет собой тетразолил, взаимодействие соединений формулы I, где R6 представлен группой CN, с азидом, или о) для получения соединений формулы I, в которых R8 представляет собой атом водорода, удаление метоксигруппы из соединений формулы I, где R8 представлен группой OCH3, или п) для получения соединений формулы I, в которых символ  обозначает одинарную связь, восстановление соединений формулы I, где символ обозначает одинарную связь, восстановление соединений формулы I, где символ  обозначает двойную связь, или обозначает двойную связь, илир) для получения соединений формулы I, в которых R8 представляет собой алкил или бензил, введение этих групп в соединения формулы I, где R8 представлен атомом водорода, или с) для получения соединений формулы I, в которых R9 представляет собой атом галогена, галогенирование соединений формулы I, где R9 представлен атомом водорода, или т) для получения соединений формулы I, в которых R8 представляет собой алкоксигруппу, а символ  обозначает двойную связь, взаимодействие соединений формулы I, где R8 представлен атомом водорода, а символ обозначает двойную связь, взаимодействие соединений формулы I, где R8 представлен атомом водорода, а символ  обозначает одинарную связь, с щелочным вольфраматом и перекисью водорода и алкилирование N-гидроксииндольного промежуточного соединения, или обозначает одинарную связь, с щелочным вольфраматом и перекисью водорода и алкилирование N-гидроксииндольного промежуточного соединения, илиу) для получения соединений формулы I, в которых R6 представляет собой группу CSNH2, взаимодействие соединений формулы I с производными серы, предпочтительно с дифенилфосфинодитионовой кислотой. Соединения по настоящему изобретению могут также быть получены с помощью химического синтеза, например, с использованием обычных методик пептидного синтеза. Типичным завершающим этапом получения таких соединений является стадия циклизации, в которой линейный пептид или пептолид, содержащий соединенные друг с другом в нужном порядке остатки A, B, R1Leu, Leu, C, X и Y, замыкаются в цикл в результате образования амидной или эфирной связи. Таким образом, изобретение охватывает способ получения циклических пептолидов формулы I, включающий в себя циклизацию линейных пептидов или пептолидов, содержащих остатки A, B, R1Leu, Leu, C, X и Y, соединенные друг с другом в соответствующем порядке. Соединения по настоящему изобретению проявляют фармакологическую активность и могут поэтому быть использованы в качестве фармацевтических средств. В частности, данные соединения являются ингибиторами стимулированной экспрессии клеточных молекул адгезии, в особенности ингибиторами VCAM-1-экспрессии по сравнению с экспрессией E-селектина и ICAM-1. Эффект ингибирования VCAM-1 проявляется как на транскрипционном, так и посттранскрипционном уровнях. Способы анализа, с помощью которых можно зарегистрировать ингибирование экспрессии ICAM-1, VCAM-1 и E-селектина под действием соединений по изобретению, описаны после раздела “Примеры”. Ввиду этого данные соединения могут быть полезны для лечения или профилактики тех болезней, при которых имеет место экспрессия клеточных молекул адгезии. Подобными болезнями являются многие приобретенные и наследственные заболевания/расстройства, при которых передвижение лейкоцитов играет значимую роль в патогенном процессе, особенно при остром и хроническом воспалительном процессе (например, аллергии, астме, псориазе, травме при реперфузии, ревматоидном артрите и септическом шоке) и аутоиммунных состояниях (например, рассеянном склерозе). Другие показания для применения соединений по изобретению включают раковые метастазы (например, при меланоме, остеокарциноме) и отторжение алло/ксенотрансплантата, так как известно, что ингибирование молекул адгезии сосудов может значительно улучшать прогнозы этих процессов. Кроме этого, соединения по данному изобретению возможно использовать для лечения как гиперпролиферативных (псориаз), так и разнообразных злокачественных заболеваний кожи ввиду того, что они обладают ингибирующей активностью в субмикромолярных концентрациях, что обнаружено при тестировании в течение 72 часов как в основанных на измерениях кератиноцитов, так и в других тестах на пролиферацию. Соединения по данному изобретению проявляют ингибирующую активность в отношении индуцируемого TNF  и IL6 размножения ВИЧ в U1-клеточной линии культуры моноцитов, как количественно установлено с помощью p24 ELISA, и ввиду этого также могут быть полезны при лечении иммунодефицитов и вирусных заболеваний, особенно СПИДа.
Таким образом, изобретение также включает терапевтическое применение соединений по изобретению и содержащих их терапевтических составов.
При лечении и профилактике заболеваний, вызываемых экспрессией молекул адгезии, вводят субъекту терапевтически и профилактически эффективное количество соединения, предусмотренного изобретением.
Изобретение также относится к терапевтическому составу, обладающему способностью ингибировать экспрессию молекул адгезии и включающему в качестве активного ингредиента соединение формулы I в эффективном количестве и целевые добавки.
Соединения по изобретению могут быть использованы для получения лекарственных средств с целью лечения и профилактики заболеваний, вызываемых экспрессией молекул адгезии.
Составы могут быть использованы для парентерального, перорального, аэрозольного и местного применения и обычно включают один или несколько приемлемых носителей, разбавителей или эксципиентов и могут содержать стабилизаторы и подобные им добавки.
Применяемые дозы соединений можно, среди прочего, варьировать в зависимости от состояния или вида заболевания, от того, используются они для лечения или профилактики, и от способа и пути введения лекарственного препарата. В целом, однако, удовлетворительные результаты получены при пероральном введении в дозах от приблизительно 0,05 до приблизительно 10 мг/кг/день, предпочтительно от приблизительно 0,1 до приблизительно 7,5 мг/кг/день, более предпочтительно от приблизительно 0,1 до приблизительно 2 мг/кг/день при однократном введении или с разбивкой на дозы, вводимые от 2 до 4 раз в день. Альтернативно, для парентерального введения, например, посредством капельного внутривенного вливания или инфузии могут быть использованы дозы от приблизительно 0,01 до приблизительно 5 мг/кг/день, предпочтительно от приблизительно 0,05 до приблизительно 1 мг/кг/день и более предпочтительно от приблизительно 0,1 до приблизительно 1,0 мг/кг/день.
Подходящие для человека дневные дозы составляют таким образом при пероральном введении приблизительно от 2,5 до 500 мг, предпочтительно – приблизительно от 5 до 250 мг, более предпочтительно – приблизительно от 5 до 100 мг; или при внутривенном введении – приблизительно от 0,5 до 250 мг, предпочтительно – приблизительно от 2,5 до 125 мг, более предпочтительно – приблизительно от 2,5 до 50 мг.
Рассматриваемые соединения могут вводиться любым подходящим способом, включая энтеральный, парентеральный и местный или с помощью ингалятора. Приемлемыми для энтерального введения формами являются растворы для питья, таблетки и капсулы. Приемлемыми для парентерального введения формами являются растворы или суспензии для инъекций. Приемлемые для местного введения формы включают кремы, лосьоны и подобные им формы, содержащие в этом случае от 0,01 до 10%, предпочтительно – от 0,1 до 1% по весу основного ингредиента. Приемлемая разовая доза соединения по изобретению при пероральном введении может лежать в пределах от 1 до 50 мг, обычно она составляет от 1 до 10 мг. Соединение из примера 4 является предпочтительным соединением по изобретению и может вводиться высшим млекопитающим, например людям, с использованием тех же способов введения и тех же или меньших доз, что и обычно используемые соединения с известными нормами для подобных показаний.
Дальнейшее описание изобретения приводится в нижеследующих примерах, данных только с целью иллюстрации и ссылающихся на диаграммы, на которых: и IL6 размножения ВИЧ в U1-клеточной линии культуры моноцитов, как количественно установлено с помощью p24 ELISA, и ввиду этого также могут быть полезны при лечении иммунодефицитов и вирусных заболеваний, особенно СПИДа.
Таким образом, изобретение также включает терапевтическое применение соединений по изобретению и содержащих их терапевтических составов.
При лечении и профилактике заболеваний, вызываемых экспрессией молекул адгезии, вводят субъекту терапевтически и профилактически эффективное количество соединения, предусмотренного изобретением.
Изобретение также относится к терапевтическому составу, обладающему способностью ингибировать экспрессию молекул адгезии и включающему в качестве активного ингредиента соединение формулы I в эффективном количестве и целевые добавки.
Соединения по изобретению могут быть использованы для получения лекарственных средств с целью лечения и профилактики заболеваний, вызываемых экспрессией молекул адгезии.
Составы могут быть использованы для парентерального, перорального, аэрозольного и местного применения и обычно включают один или несколько приемлемых носителей, разбавителей или эксципиентов и могут содержать стабилизаторы и подобные им добавки.
Применяемые дозы соединений можно, среди прочего, варьировать в зависимости от состояния или вида заболевания, от того, используются они для лечения или профилактики, и от способа и пути введения лекарственного препарата. В целом, однако, удовлетворительные результаты получены при пероральном введении в дозах от приблизительно 0,05 до приблизительно 10 мг/кг/день, предпочтительно от приблизительно 0,1 до приблизительно 7,5 мг/кг/день, более предпочтительно от приблизительно 0,1 до приблизительно 2 мг/кг/день при однократном введении или с разбивкой на дозы, вводимые от 2 до 4 раз в день. Альтернативно, для парентерального введения, например, посредством капельного внутривенного вливания или инфузии могут быть использованы дозы от приблизительно 0,01 до приблизительно 5 мг/кг/день, предпочтительно от приблизительно 0,05 до приблизительно 1 мг/кг/день и более предпочтительно от приблизительно 0,1 до приблизительно 1,0 мг/кг/день.
Подходящие для человека дневные дозы составляют таким образом при пероральном введении приблизительно от 2,5 до 500 мг, предпочтительно – приблизительно от 5 до 250 мг, более предпочтительно – приблизительно от 5 до 100 мг; или при внутривенном введении – приблизительно от 0,5 до 250 мг, предпочтительно – приблизительно от 2,5 до 125 мг, более предпочтительно – приблизительно от 2,5 до 50 мг.
Рассматриваемые соединения могут вводиться любым подходящим способом, включая энтеральный, парентеральный и местный или с помощью ингалятора. Приемлемыми для энтерального введения формами являются растворы для питья, таблетки и капсулы. Приемлемыми для парентерального введения формами являются растворы или суспензии для инъекций. Приемлемые для местного введения формы включают кремы, лосьоны и подобные им формы, содержащие в этом случае от 0,01 до 10%, предпочтительно – от 0,1 до 1% по весу основного ингредиента. Приемлемая разовая доза соединения по изобретению при пероральном введении может лежать в пределах от 1 до 50 мг, обычно она составляет от 1 до 10 мг. Соединение из примера 4 является предпочтительным соединением по изобретению и может вводиться высшим млекопитающим, например людям, с использованием тех же способов введения и тех же или меньших доз, что и обычно используемые соединения с известными нормами для подобных показаний.
Дальнейшее описание изобретения приводится в нижеследующих примерах, данных только с целью иллюстрации и ссылающихся на диаграммы, на которых:Фиг. 1 показывает УФ-спектры соединения A (а) и B (б). Фиг. 2 показывает ИК-спектр соединения A. Фиг. 3 показывает ИК-спектр соединения B. Фиг. 4 показывает спектр протонного ЯМР соединения A. Фиг. 5 показывает спектр протонного ЯМР соединения B. Фиг. 6 показывает спектр 13C ЯМР соединения A. Фиг. 7 показывает спектр 13C ЯМР соединения B. В последующих примерах, иллюстрирующих изобретение, не ограничивая его, значения температуры даны везде в градусах Цельсия и использованы следующие сокращения: Bz – бензил; iPr – изопропил; nPr – н-пропил; HBa – модифицированная 2-гидроксимасляная кислота; TFA – трифторуксусная кислота; THF – тетрагидрофуран; db – двойная связь; sb – одинарная связь; br – широкий; d – дуплет; m – мультиплет; q – квартет; t – триплет; 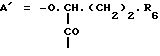 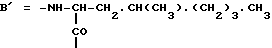 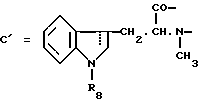 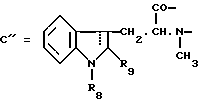 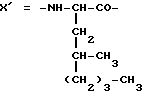 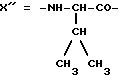 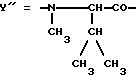 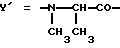 Пример 1. Описание штамма F/92-4471/08 (NRRL 21123) Грибной штамм NRRL 21123, продуцирующий соединения A и B, был выделен из образца лиственной подстилки, собранной вблизи Ла Платы, Аргентина. В процессе роста на солодовой Среде А (2% экстракта солода, 0,4% дрожжевого экстракта, 2% агара в деионизированной воде) штамм NRRL 21123 образует после 3 дней инкубации при 27oC колонии диаметром от 25 до 35 мм. Колонии обычно дают короткий воздушный мицелий от белой до серой или серовато-коричневой окраски. На основании измерения диаметра колоний на Среде А можно сказать, что оптимальной для роста является температура от 21 до 30oC, минимальной – температура от 0 до 6oC и максимальной – от 33 до 38oC. По истечении 4 дней инкубации при температуре от 21 до 33oC наблюдается образование спор. Грибной штамм NRRL 21123 образует гиалин для светло-коричневых конидий на фиалидных или аннелидных конидиогенных клетках, внутри хорошо различимой пикниды. Конидии, как правило, состоят из пяти клеток, имеют цилиндрическую форму, обычно слегка изогнуты и в большинстве случаев имеют размеры 24-26 х 2,6-4 мкм. Каждая конидия несет на одном конце единичный неразветвленный гиалиновый отросток, а на другой концевой клетке от 2 до 4 (обычно 3) гиалиновых и неразветвленных отростков. На основании этих морфологических характеристик и следуя правилам идентификации [B. C. Sutton (1960): The Coelomycetes (публикация Commonwealth Mycological Institude, Surrey, England)], штамм NRRL 21123 может быть приписан к роду Bartalinia Tassi. Пример 2. Ферментация Штамм NRRL 21123 выращивают в течение 15 дней при температуре 21oC на косяке агара, содержащем Среду А (2% экстракта солода, 0,4% дрожжевого экстракта, 2% агара, деионизированная вода). Конидии с одного косяка суспендируют в 10 мл стерильной водопроводной воды. Суспензией конидий (по 1 мл) инокулируют каждую из двух колб Эрленмейера вместимостью 500 мл, содержащих по 200 мл Среды Б (2% экстракта солода, 0,4% дрожжевого экстракта в деионизированной воде). Для получения затравочной культуры колбы инкубируют в течение 6 дней при температуре 21oC на ротационном шейкере при 200 об/мин. Затравочной культурой (по 2 мл) инокулируют каждую из 200 колб Эрленмейера вместимостью 500 мл, содержащих по 200 мл Среды В (2,2% моногидрата мальтозы, 0,72% дрожжевого экстракта в деионизованной воде). Колбы инкубируют при температуре 21oC на ротационном шейкере при 200 об/мин и полученную через 6 дней клеточную культуру объединяют для дальнейшей обработки. Пример 3. Выделение метаболитов, соединений A и B 50 л глубинной культуры штамма NRRL 21123, выращенного, как описано в примере 2, фильтруют, используя в качестве ускорителя фильтрования Clarcel. Собранный влажный мицелий экстрагируют смесью метанол-ацетон (1:1) (3 х 15 л). Объединенные экстракты концентрируют в вакууме на циркуляционном испарителе до остаточного объема жидкости приблизительно 3 л, который экстрагирует (4 х 1 л) этилацетатом. Этилацетатные экстракты объединяют и концентрируют в вакууме до получения 25 г маслянистого остатка, который затем фракционируют трехкратным распределением в системе растворителей: 90% водный метанол и гексан, получая после концентрирования в вакууме в виде нижней фазы 4,5 г неочищенного твердого материала. Полученный материал наносят на колонку с силикагелем (Мерк, Кизельгель 60, 40-63 мкм) размером 5,5 см внутр. диам. х 38 см и хроматографируют, элюируя сначала 1,4 л смеси растворителей метил-трет-бутиловый эфир/метанол (98: 2), затем 1 л той же смеси растворителей, взятых в отношении 95:5. Скорость подачи растворителя поддерживают равной 110 мл/мин. Отбирают фракции объемом 90 мл каждая, проявляющие ингибирующую активность в отношении ICAM-1-экспрессии (пример 4) и содержащие или соединение A (N 9-10) или соединение B (N 11-25). Соединение A Объединенные фракции 9-10, полученные, как описано выше, в результате хроматографирования на силикагеле, упаривают в вакууме, получая 1 г неочищенного материала. Далее его очищают с помощью препаративной ЖХВД, используя колонку фирмы Мерк (50 мм внутр. диам. х 250 мм) с носителем LiChrosper RP-18 (7 мкм). Элюирование осуществляют линейным градиентом метанола в воде (80-100%) в течение 60 мин при скорости потока 25 мл/мин. В процессе хроматографирования осуществляют детектирование на длине волны 220 нм и собирают фракции объемом 25 мл. На основании данных по поглощению в УФ, ТСХ и биологической активности отбирают фракции 56-62, объединяют и концентрируют в вакууме, получая 0,6 г остатка. Окончательную очистку осуществляют с помощью хроматографии на Сефадексе LH-20 с использованием колонки размерами 2,7 см внутр. диам. х 86 см и элюируя метанолом. Элюированные фракции, содержащие по данным ТСХ соединение A в очищенном виде, объединяют и упаривают досуха в вакууме, получая 580 мг бесцветного порошка. Свойства соединения A приведены ниже в таблице 1. Соединение B Объединенные фракции 11-25 дают после упаривания растворителя в вакууме 2 г неочищенного материала, который далее очищают препаративной ЖХВД, используя колонку фирмы Мерк (50 мм внутр. диам. х 250 мм) с носителем LiChrosper RP-18 (7 мкм). Элюирование осуществляют линейным градиентом метанола в воде (80-100%) в течение 60 мин при скорости потока 25 мл/мин. В процессе хроматографирования осуществляют детектирование на длине волны 220 нм и собирают фракции объемом 25 мл. Фракции 47-55 содержат основную часть соединения B по данным поглощения в УФ, ТСХ и биологической активности. Их объединяют и концентрируют в вакууме, получая 0,4 г остатка. Дальнейшую очистку осуществляют с помощью хроматографии на Сефадексе LH-20 на колонке размерами 2,7 см внутр. диам. х 86 см с элюированием метанолом. В процессе хроматографии осуществляют детектирование на длине волны 220 нм и собирают фракции объемом 12 мл. На основании данных по поглощению в УФ, ТСХ и биологической активности фракции 23-27 объединяют и упаривают в вакууме, получая 0,3 г остатка. Окончательный этап хроматографической очистки с использованием колонки (2,2 см внутр. диам. х 16 см), заполненной Кизельгелем 60, 40-63 мкм фирмы Мерк, с элюированием системой растворителей толуол-этанол (95:5) дает чистое по данным ТСХ соединение B. Полученные фракции объединяют и упаривают досуха в вакууме, получая 145 мг бесцветного порошка. Свойства соединения B также приведены ниже в таблице 1. В таблице 1 даны ссылки на фиг. 1-7. Пример 4. Соединение формулы I (A = A’, R6 = COOCH3, B = B’, R1 = CH3, C = C’, R8 = OCH3,  двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)К смеси, состоящей из 2 г соединения A и 1,65 мл метанола, добавляют холодный раствор HCl в эфире (30 мл, 17% вес/объем, -20oC) и полученную смесь выдерживают в течение 3 дней при -20oC. После этого реакционную смесь выливают в водный бикарбонатный раствор и экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом натрия, фильтруют и упаривают в вакууме. Неочищенный продукт растворяют в 30 мл смеси метанол/конц. водн. HCl (9/1) и перемешивают при комнатной температуре в течение 3 часов. Далее раствор разбавляют водой и экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом натрия, фильтруют и упаривают в вакууме. Неочищенную реакционную смесь очищают при помощи хроматографии с обратимой фазой на LiChroprep RP-8 (градиент: метанол/вода = от 8/2 до 10/0) и последующей хроматографии на силикагеле (градиент: толуол/метанол = от 100/0 до 95/5), получая указанное в заголовке соединение в виде бесцветной пены и производное соединения формулы IV с незамкнутой цепью (R6 = 15 COOCH3, R7 = CH3) в виде бесцветного твердого вещества. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,41 (указанное в заголовке соединение), Rf = 0,38 (производное с незамкнутой цепью); хроматография с обратимой фазой на RP-8, метанол/вода/трифторуксусная кислота = 95/4/1, Rf = 0,34 (указанное в заголовке соединение), Rf = 0,51 (производное с незамкнутой цепью). Пример 5. Соединение формулы I (A = A’, R6 = COOH, B = B’, R1 = CH3, C = C’, R8 = OCH3,  двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 209 мг соединения формулы I из примера 4 в 15 мл смеси трет-бутанол/конц. водн. HCl (9/1), нагревают при 60oC в течение 8 часов. Реакционную смесь выливают в насыщенный водный бикарбонатный раствор и экстрагируют этилацетатом. Органическую фазу промывают буферным раствором pH 7, высушивают над сульфатом натрия, фильтруют и упаривают в вакууме. Неочищенный продукт очищают с помощью хроматографии на силикагеле (градиент: толуол/метанол = от 100/0 до 95/5), получая указанное в заголовке соединение в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,25; хроматография с обратимой фазой на RP-8, метанол/вода = 92/8, Rf = 0,34. Пример 6. Соединение формулы I (A = A’, R6 = CO  NH NH CH3, B = B’, R1 = CH3, C = C’, R8 = OCH3, CH3, B = B’, R1 = CH3, C = C’, R8 = OCH3,  двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)К охлажденному до 0oC раствору, содержащему 10 мг соединения из примера 5 в 0,5 мл дихлорметана, добавляют 50 мкл тионилхлорида. Реакционную смесь выдерживают при 0oC в течение 1,5 часов, после чего упаривают в вакууме при 0oC. Оставшееся масло желтого цвета растворяют в 1 мл дихлорметана при 0oC и к нему добавляют 100 мкл 40% водного раствора метиламина. Через 45 минут реакционную смесь выливают в 0,1 М водный HCl, экстрагируют этилацетатом и распределяют между этилацетатом и насыщенным водным бикарбонатным раствором. Органическую фазу промывают солевым раствором, высушивают над сульфатом натрия и упаривают в вакууме. Неочищенный продукт очищают при помощи хроматографии на силикагеле (градиент: толуол/этилацетат/метанол = от 100/0/0 до 65/25/10), получая указанное в заголовке соединение в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,25; хроматография с обратимой фазой на RP-8, метанол/вода = 95/5, Rf = 0,33. Аналогично тому, как описано в примере 6, получают соединения формулы I (A = A’, B = B’, C = C’, X = X’, Y = Y’ и R1 = CH3), представленные в табл. А. Пример 13. Соединение формулы I (A = A’, R6 = COO-iPr, B = B’, R1 = CH3, C = C’, R8 = OCH3,  двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)К охлажденному до 0oC раствору, содержащему 15 мг соединения из примера 5 в 0,75 мл дихлорметана, добавляют 75 мкл тионилхлорида. Реакционную смесь выдерживают при 0oC в течение 2 часов, после чего упаривают в вакууме при 0oC. Оставшееся масло желтого цвета растворяют в 1 мл дихлорметана при 0oC и к нему добавляют 30 мкл изопропанола. По истечении 3 часов при 0oC реакционную смесь выливают в 0,1 М водный HCl и экстрагируют этилацетатом. Органическую фазу промывают солевым раствором, высушивают над сульфатом натрия и упаривают в вакууме. Неочищенный продукт очищают при помощи хроматографии на силикагеле (градиент: толуол/метанол = от 100/0 до 95/5), получая указанное в заголовке вещество в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,47; хроматография с обратимой фазой на RP-8, метанол/вода = 95/5, Rf = 0,37. Аналогично тому, как описано в примере 9, получают соединения формулы I (A = A’, B = B’, C = C’, X = X’, Y = Y’ и R1 = CH3), представленные в табл. Б. Пример 16. Соединение формулы I (A = A’, R6 = COCH3, B = B’, R1 = CH3, C = C’, R8 = OCH3,  двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор 200 мг соединения A в 2 мл добавляют к раствору метильного производного реактива Гриньяра (2 ммоля в 5 мл эфира) и перемешивают при комнатной температуре в течение 24 ч. После этого добавляют дополнительные 2 ммоля MeMgJ в эфире и опять перемешивают 24 часа при комнатной температуре. Реакционную смесь выливают в 0,1 М раствор HCl и экстрагируют этилацетатом. Органическую фазу промывают раствором бикарбоната натрия и солевым раствором, высушивают над сульфатом натрия и упаривают в вакууме. Неочищенную реакционную смесь очищают при помощи хроматографии на силикагеле (градиент: толуол/этилацетат/метанол = от 100/0/0 до 68/27/5), получая как указанное в заголовке вещество, так и значительное количество исходного соединения. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,30. Пример 17. Соединение формулы I (A = A’, R6 = CH2OH, B = B’, R1 = CH3, C = C’, R8 = OCH3,  двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)0,5 мл 2 М раствора борандиметилсульфидного комплекса добавляют при комнатной температуре к раствору, содержащему 27 мг соединения из примера 5 в 2 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 2,5 часов, выливают в 0,1 М HCl и экстрагируют этилацетатом. Органическую фазу промывают фосфатным буферным раствором (pH 7), высушивают над сульфатом натрия и упаривают в вакууме. Неочищенный материал очищают при помощи хроматографии на силикагеле (градиент: толуол/метанол = от 100/0 до 95/5), получая указанное в заголовке вещество в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,27; хроматография с обратимой фазой на RP-8, метанол/вода = 92/8, исходное соединение не отделяется. Пример 18. Соединение формулы I (A = A’, R6 = CN, B = B’, R1 = CH3, C = C’, R8 = H,  двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)18 мг палладия на активированном угле (10%) добавляют к раствору, содержащему 53 мг соединения A и 66 мг ацетата натрия в 4 мл уксусного ангидрида. Реакционную смесь перемешивают при комнатной температуре в атмосфере водорода в течение 20 часов (50% конверсия по данным ТСХ), выливают в водный раствор бикарбоната натрия и экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом натрия и упаривают в глубоком вакууме. Неочищенный материал очищают при помощи хроматографии с обратимой фазой на носителе RP-8 (градиент: метанол/воды = от 80/20 до 100/0), получая указанное в заголовке вещество в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,33; хроматография с обратимой фазой на RP-8, метанол/вода = 92/8, Rf = 0,50 (исходное соединение Rf = 0,44). Пример 19. Соединение формулы I (A = A’, R6 = CHO, B = B’, R1 = CH3, C = C’, R8 = OCH3,  двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)К раствору, содержащему 50 мг соединения из примера 17 в 4 мл дихлорметана, добавляют 35 мг периодированный реагент Десс-Марбина (1,1,1-трис(ацетилокси)-1,1-дигидро-1,2-бенздиоксол-3-(1H)-он) и суспензию перемешивают при 20oC в течение 3 часов. После этого неочищенную ” реакционную смесь наносят на силикагель и элюируют этилацетатом. Фракции, содержащие продукт, объединяют, упаривают в вакууме и очищают хроматографией на силикагеле (градиент: толуол/метанол = от 100/0 до 95/5), получая указанное в заголовке вещество в виде бесцветной пены. Пример 20. Соединение формулы I (A = A’, R6 = CH=CH2, B = B’, R1 = CH3, C = C’, R8 = OCH3,  двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор метильного реагента Виттинга, полученный путем перемешивания 15 метилтрифенилфосфонийбромида и амида натрия в сухом THF, медленно добавляют при температуре 20oC к раствору, содержащему 24,7 мг соединения из примера 19 в сухом THF до тех пор, пока сохраняется желтая окраска реагента. После этого реакционную смесь выливают в 0,1 М соляную кислоту и экстрагируют этилацетатом. Органический экстракт упаривают в вакууме и оставшийся после упаривания неочищенный продукт очищают хроматографией на силикагеле (градиент: толуол/метанол = от 100/0 до 97/3), получая указанное в заголовке соединение в виде бесцветной пены. Пример 21. Соединение формулы I (A = A’, R6 = CH=CH-C2H5, B = B’, R1 = CH3, C = C’, R8 = OCH3, 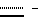 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Указанное в заголовке соединение получают аналогично тому, как описано в примере 20. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,44. Пример 22. Соединение формулы I (A = A’, R6 = CH2N3, B = B’, R1 = CH3, C = C’, R8 = OCH3, 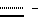 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)К раствору, содержащему 30 мг соединения из примера 17 и 12 мг трифенилфосфина в 3 мл сухого THF, добавляют 150 мкл 0,38 М раствора азотисто-водородной кислоты в толуоле. К раствору до исчезновения желтой окраски добавляют при комнатной температуре диэтилазобикарбоксилат и смесь перемешивают при комнатной температуре в течение 10 минут. Неочищенную реакционную смесь наносят на 5 г нейтрального оксида алюминия и элюируют этилацетатом. Фракции, содержащие продукт, упаривают в вакууме и очищают хроматографией на силикагеле (градиент: толуол/метанол = от 99,5/0,5 до 95/5), получая указанное в заголовке вещество в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,46; хроматография с обратимой фазой на RP-8, метанол/вода/TFA = 95/4/1, Rf = 0,41. Пример 23. Соединение формулы I (A = A’, R6 = CH2  NH2, B = B’, R1 = CH3, C = C’, R8 = OCH3, NH2, B = B’, R1 = CH3, C = C’, R8 = OCH3, 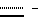 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 20 мг соединения из примера 22 в 2 мл метанола, перемешивают в атмосфере водорода с 4 мг палладия на угле (10%) в течение 20 часов. Катализатор удаляют фильтрованием и реакционную смесь упаривают в вакууме. Неочищенный продукт очищают при помощи хроматографии с обратимой фазой на RP-8 (градиент: метанол/0,5% водн. TFA = от 80/20 до 100/0), получая указанное в заголовке вещество в виде бесцветной пены. ТСХ: с обратимой фазой на RP-8, метанол/вода/TFA = 95/4/1, Rf = 0,69. Пример 24. Соединение формулы I (A = A’, R6 = CH= CBr2, B = B’, R1 = CH3, C = C’, R8 = OCH3, 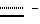 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 225 мг соединения из примера 19 в 2,5 мл дихлорметана, добавляют к смеси, состоящей из 30 мг цинкового порошка, 120 мг трифенилфосфина и 150 мг тетрабромметана, и перемешивают в течение 30 минут при комнатной температуре. После этого смесь наносят на 5 г оксида алюминия и элюируют этилацетатом. Фракции, содержащие продукт, упаривают в вакууме и очищают хроматографией на силикагеле (градиент: толуол/метанол = от 99,5/0,5 до 97/3), получая указанное в заголовке вещество в виде бесцветной твердой пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,27. Пример 25. Соединение формулы I (A = A’, R6 = C  CH, B = B’, R1 = CH3, C = C’, R8 = OCH3, CH, B = B’, R1 = CH3, C = C’, R8 = OCH3, 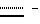 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор н-бутиллития в гексане (3 моль-эквивалента) добавляют при температуре -78oC в течение 2 часов к 50 мг соединения из примера 24. Реакционную смесь выливают в 0,1 М водный HCl и экстрагируют этилацетатом. Органическую фазу промывают бикарбонатным и солевым растворами и упаривают в вакууме. Неочищенный продукт очищают при помощи хроматографии на силикагеле (градиент: толуол/метанол = от 99,5/0,5 до 97/3), получая указанное в заголовке вещество в виде бесцветной твердой пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,44. Пример 26. Соединение формулы I (A = A’. R6 = C= CH-CN, B = B’, R1 = CH3, C = C’, R8 = OCH3, 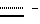 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 30 мг соединения из примера 19 и 270 мг цианометилентрифенилфосфорана в 5 мл толуола, перемешивают при комнатной температуре в течение 4 часов. После этого неочищенную реакционную смесь фильтруют через нейтральный оксид алюминия и элюируют этилацетатом. Фракции, содержащие продукт, объединяют и упаривают в вакууме. Указанное в заголовке соединение представляет собой смесь E/Z изомеров. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,39. Пример 27. Соединение формулы I (A = A’, R6 = CH2Cl, B = B’, R1 = CH3, C = C’, R8 = OCH3, 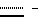 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 20 мг соединения из примера 17 в 1 мл толуола, добавляют к раствору 10 мг дихлортрифенилфосфорана в 1 мл толуола и перемешивают при температуре 60oC. Через 2 часа в реакционную смесь вносят дополнительные 35 мг дихлортрифенилфосфина. По истечении 1 часа реакционную смесь фильтруют через нейтральный оксид алюминия и элюируют этилацетатом. Фракции, содержащие продукт, упаривают и неочищенный материал очищают хроматографией на силикагеле (градиент: толуол/метанол = от 100/0 до 97/3), получая указанное в заголовке вещество в виде бесцветной твердой пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,34. Пример 28. Соединение формулы I (A = A’, R6 = CH2  O O CH3, B = B’, R1 = CH3, C = C’, R8 = OCH3, CH3, B = B’, R1 = CH3, C = C’, R8 = OCH3, 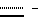 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 34 мг соединения из примера 17 в 6 мл дихлорметана и 100 мг силикагеля, обрабатывают эфирным раствором диазометана до тех пор, пока не прореагирует весь исходный материал. Для удаления образующегося в ходе реакции смесь полиметилена фильтруют, упаривают и добавляют к ней свежие порции дихлорметана и силикагеля. После окончательного упаривания в вакууме неочищенный материал очищают хроматографией на силикагеле (градиент: толуол/метанол = от 99,7/0,3 до 97/3), получая указанное в заголовке вещество в виде бесцветной твердой пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,34. Пример 29. Соединение формулы I (A = A’, 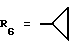 , B = B’, R1 = CH3, C = C’, R8 = OCH3, , B = B’, R1 = CH3, C = C’, R8 = OCH3, 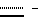 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 13 мг соединения из примера 20 и 2,8 мг ацетата палладия в 2,5 мл дихлорметана, обрабатывают при комнатной температуре эфирным раствором диазометана до тех пор, пока не прореагирует весь исходный материал. Неочищенную реакционную смесь фильтруют через силикагель и элюируют смесью толуол/метанол. Фракции, содержащие продукт, упаривают и неочищенный продукт очищают хроматографией на силикагеле (градиент: толуол/метанол = от 99,5/0,5 до 97/3), получая указанное в заголовке вещество в виде бесцветной твердой пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,38; хроматография с обратимой фазой RP-8, метанол/фосфатный буфер pH 7 = 92/8, Rf = 0,27. Пример 30. Соединение формулы I (A = A’, R6 = COO  CH(C6H5)2, B = B’, R1 = CH3, C = C’, R8 = OCH3, CH(C6H5)2, B = B’, R1 = CH3, C = C’, R8 = OCH3, 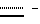 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 8,2 мг соединения из примера 5 и 3,1 мг дифенилдиазометана в 0,5 мл толуола, нагревают при 60oC в течение 3 часов. Далее раствор непосредственно очищают хроматографией на силикагеле (градиент: толуол/метанол = от 100/0 до 97/3), получая указанное в заголовке вещество в виде бесцветной твердой пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,46. Пример 31. Соединение формулы I (A = A’, 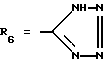 , B = B’, R1 = CH3, C = C’, R8 = OCH3, , B = B’, R1 = CH3, C = C’, R8 = OCH3, 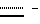 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 50 мг вещества A в 1 мл диметилформамида, нагревают с 125 мг хлорида трибутилтия и 25 мг азида натрия при температуре 100oC в течение 8 дней. Затем смесь выливают в 1 М водный HCl, экстрагируют этилацетатом. Органическую фазу промывают солевым раствором, высушивают над сульфатом натрия и упаривают в вакууме. Неочищенный продукт очищают при помощи хроматографии на силикагеле (градиент: толуол/метанол = от 100/0,25 до 100/2,5), получая указанное в заголовке 25 вещество в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,12; хроматография с обратимой фазой на RP-8, метанол/фосфатный буфер pH 7 = 92/8, Rf = 0,48. Пример 32. Соединение формулы I (A = A’, R6 = CN, B = B’, C = C’, R8 = CH3, 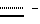 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 20 мг соединения из примера 18 в 1 мл сухого диметилформамида, перемешивают 1 мл йодметана, после чего к нему добавляют раствор 5 мг бис(триметилсилил)амида натрия в 0,3 мл диметилформамида. После перемешивания реакционной смеси в течение 1,5 часов при комнатной температуре ее выливают в 0,1 М водный HCl, экстрагируют этилацетатом и распределяют между этилацетатом и насыщенным водным бикарбонатным раствором. Органическую фазу промывают солевым раствором, высушивают над сульфатом натрия и упаривают в вакууме. Неочищенный продукт очищают при помощи хроматографии на силикагеле (градиент: толуол/метанол = от 100/0,25 до 100/2,5), получая указанное в заголовке вещество в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,43. Аналогично тому, как описано в примере 32, получают соединения формулы I (A = A’, R6 = CN, B = B’, X = X’, Y = Y’), представленные в табл. В. Пример 35. Соединение формулы I (A = A’, R6 = CN, B = B’, C = C’, R8 = CH2C(CH3)3, 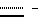 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)К раствору, содержащему 38 мг соединения из примера 18 в 2 мл уксусной кислоты и 0,2 мл пивальальдегида, добавляют 30 мкл 2 М раствора боран-диметилсульфидного комплекса в THF и смесь перемешивают 5 минут при комнатной температуре. После этого смесь выливают в бикарбонат натрия/этилацетат и к ней добавляют небольшое количество воды. Органический слой отделяют, промывают солевым раствором, высушивают над сульфатом натрия и упаривают в вакууме. Оставшееся бесцветное масло (ТСХ: на силикагеле, толуол/метанол 9/1, Rf = 0,53) растворяют в 3 мл THF и к нему при комнатной температуре добавляют раствор 2,3-дихлор-5,6-дициано-1,4-бензохинона (DDQ) в THF (8 мг в 0,2 мл) до тех пор, пока смесь не станет темной. Смесь фильтруют через 5 г силикагеля и градиентно элюируют системой растворителей толуол/метанол = от 100/0,5 до 95/5, получая указанное в заголовке вещество в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол 9/1, Rf = 0,49. Аналогично тому, как описано в примере 35, получают соединения формулы I (A = A’, R6 = CN, B = B’, X = X’, Y = Y’), представленные в табл. Г. Пример 38. Соединения формулы I (A = A’, R6 = CN, V = V’, C = C’, R8 = H, 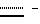 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Гетерогенную смесь, состоящую из 25 мг соединения из примера 18, 1 мл трифторуксусной кислоты и 0,3 мл триэтилсилана, энергично перемешивают в атмосфере аргона при 4oC в течение 20 ч. Затем реакционную смесь выливают в насыщенный водный бикарбонатный раствор и экстрагируют этилацетатом. Органическую фазу промывают солевым раствором, высушивают над сульфатом натрия и упаривают в вакууме. Неочищенный продукт очищают при помощи хроматографии на силикагеле (градиент: толуол/метанол в отношении от 100/0,5 до 100/5), получая указанные в заголовке соединения в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, индолин A Rf = 0,16, индолин B Rf = 0,10; хроматография с обратимой фазой на RP-8, метанол/вода/TFA = 95/4/1, индолин A + B Rf = 0,71. Пример 39. Соединение формулы I (A = A’, R6 = CN, B = B’, C = C’, R8 = O(CH2)2CH3, 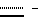 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)К раствору, содержащему 30 мг соединения из примера 38 (смесь диастереомеров) в 1 мл метанола, добавляют 100 мг вольфрамата натрия (Na2WO4  2H2O) и 100 мкл 30% перекиси водорода. Реакционную смесь перемешивают 20 минут при комнатной температуре и затем непосредственно очищают с помощью гель-проникающей хроматографии (Сефадекс LH-20, метанол/этилацетат = 1:1). Фракции, содержащие N-гидроксииндольное промежуточное соединение, упаривают, остаток переносят в 2 мл сухого DMF, в который добавляют 2 мл пропилйодида и 7,5 мг бис(триметилсилил)амида натрия. После перемешивания при комнатной температуре в течение 30 минут содержимое реакционной смеси выливают в 0,1 М соляную кислоту и экстрагируют этилацетатом. Органический слой промывают раствором бикарбоната натрия и солевым раствором и упаривают в вакууме. Продукт очищают с помощью хроматографии на силикагеле (градиент: толуол/метанол = от 100/0,5 до 98/2) и хроматографии с обратной фазой (RP-8, градиент – водный раствор метанола в концентрации от 75 до 100%), получая указанное в заголовке вещество в виде бесцветной пены.
ТСХ: на силикагеле, толуол/метанол = 90/10, Rf = 0,51; на RP-8, метанол/фосфатный буфер pH 7 = 92/8, Rf = 0,30.
Пример 40. Соединение формулы I 2H2O) и 100 мкл 30% перекиси водорода. Реакционную смесь перемешивают 20 минут при комнатной температуре и затем непосредственно очищают с помощью гель-проникающей хроматографии (Сефадекс LH-20, метанол/этилацетат = 1:1). Фракции, содержащие N-гидроксииндольное промежуточное соединение, упаривают, остаток переносят в 2 мл сухого DMF, в который добавляют 2 мл пропилйодида и 7,5 мг бис(триметилсилил)амида натрия. После перемешивания при комнатной температуре в течение 30 минут содержимое реакционной смеси выливают в 0,1 М соляную кислоту и экстрагируют этилацетатом. Органический слой промывают раствором бикарбоната натрия и солевым раствором и упаривают в вакууме. Продукт очищают с помощью хроматографии на силикагеле (градиент: толуол/метанол = от 100/0,5 до 98/2) и хроматографии с обратной фазой (RP-8, градиент – водный раствор метанола в концентрации от 75 до 100%), получая указанное в заголовке вещество в виде бесцветной пены.
ТСХ: на силикагеле, толуол/метанол = 90/10, Rf = 0,51; на RP-8, метанол/фосфатный буфер pH 7 = 92/8, Rf = 0,30.
Пример 40. Соединение формулы I(A = A’, R6 = CN, B = B’, C = C’, R8 = OC2H5, 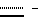 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Указанное в заголовке соединение получают аналогично тому, как описано в примере 39. Пример 41. Соединение формулы I (A = A’, R6 = CN, B = B’, C = C’, R8 = OCH3, R9 = Br, 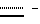 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 50 мг соединения A в 2 мл тетрахлорметана, перемешивают с 3 мг порошка железа и к нему в течение 1 часа добавляют раствор брома (10 мг) в тетрахлорметане. Неочищенную реакционную смесь выливают в водный бикарбонатный раствор и экстрагируют этилацетатом. Органическую фазу промывают раствором тиосульфата натрия и солевым раствором, после чего упаривают в вакууме. Неочищенный продукт очищают при помощи хроматографии на силикагеле (градиент: толуол/метанол = от 99,5/0,5 до 97/3), получая указанное в заголовке вещество в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 90/10, Rf = 0,48 хроматография с обратимой фазой; на RP-8, метанол/вода = 92/8, Rf = 0,19. Пример 42. Соединение формулы I (A = A’, R6 = CSNH2, B = B’, R1 = CH3, C = C’, R8 = OCH3, 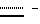 двойная связь, X = X’, Y = Y’) двойная связь, X = X’, Y = Y’)Раствор, содержащий 50 мг соединения A и 50 мг дифенилфосфинодитиокислоты в 4 мл изопропанола, нагревают при 60oC в течение 3 дней. Реакционную смесь охлаждают до -20oC, преципитат удаляют фильтрованием, раствор разбавляют этилацетатом и экстрагируют водным раствором бикарбоната натрия. Органическую фазу упаривают в вакууме и неочищенный продукт очищают с помощью хроматографии на силикагеле (градиент: толуол/метанол = от 100/0,5 до 96/4), получая указанное в заголовке вещество в виде бесцветной пены. ТСХ: на силикагеле, толуол/метанол = 9/1, Rf = 0,29. Биологическая активность Активность соединений по изобретению протестирована как в анализах на цитотоксичность и ингибирование экспрессии ICAM-1, VCAM-1 и E-селектина, так и в анализах на клеточную пролиферацию. Концентрации соединений, необходимые для проявления ингибирующего эффекта величиной в половину от максимального (IC50), для каждого вида анализа приведены ниже в таблице 2. Анализы проводили следующим образом: в обоих видах анализов, как на клеточную пролиферацию, так и в ELISA-анализе на ICAM-1, использовали HaCaT-клетки – спонтанно трансформированную, неопухолеродную клеточную линию человеческих кератиноцитов с высококонсервативными характеристиками фенотипической дифференциации нормальных кератиноцитов [(BouKamp et al., 1988, J. Cell. Biol. 106, 761-771)]. А. Клеточный ELISA-анализ на ICAM-1 I. Клеточный ELISA-анализ на ICAM-1 кератиноцитов Клеточный ELISA-анализ на ICAM-1 используется для установления ингибирования экспрессии ICAM-1 в значительной степени так же, как описано в работе [WinisKi and Foster (1992, J. Inverst, Dermatol., 99, 48-52)]. HaCaT-клетки высевают в 96-луночные планшеты для микротитрования (2  104 клеток на лунку в культуральной среде следующего состава: DMEM с 5% FSC, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ глутамина, 1 мМ пирувата натрия), выращивают до слияния, после чего инкубируют в течение приблизительно 24 часов в свежей тест-среде (такая же, как культуральная, но с 0,5% FSC вместо 5%) в присутствии и отсутствие стимулирующей среды с IFN- 104 клеток на лунку в культуральной среде следующего состава: DMEM с 5% FSC, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ глутамина, 1 мМ пирувата натрия), выращивают до слияния, после чего инкубируют в течение приблизительно 24 часов в свежей тест-среде (такая же, как культуральная, но с 0,5% FSC вместо 5%) в присутствии и отсутствие стимулирующей среды с IFN- /TFN- /TFN- (тест-среда, содержащая 1000 ед/мл IFN- (тест-среда, содержащая 1000 ед/мл IFN- /3 нг/мл TNF- /3 нг/мл TNF- ) в обоих случаях в присутствии и отсутствии соединения A и B. После этого 1 еще раз смывают культуральную среду и клеточные монослои фиксируют 1% параформальдегидом. Монослои инкубируют с насыщающими количествами первичных (моноклональных мышиных антиICAM-1) и вторичных (козьих, антимышиных, конъюгированных с пероксидазой) антител. В последующей пероксидазной реакции с использованием 3-амино-9-этилкарбазола (AEC) в качестве субстрата образуется нерастворимый окрашенный продукт, содержание которого легко измеряется с помощью стандартной техники для прочтения планшетов.
II. Степень цитотоксичности ) в обоих случаях в присутствии и отсутствии соединения A и B. После этого 1 еще раз смывают культуральную среду и клеточные монослои фиксируют 1% параформальдегидом. Монослои инкубируют с насыщающими количествами первичных (моноклональных мышиных антиICAM-1) и вторичных (козьих, антимышиных, конъюгированных с пероксидазой) антител. В последующей пероксидазной реакции с использованием 3-амино-9-этилкарбазола (AEC) в качестве субстрата образуется нерастворимый окрашенный продукт, содержание которого легко измеряется с помощью стандартной техники для прочтения планшетов.
II. Степень цитотоксичностиПо завершении реакции детектирования ICAM-1 с помощью AEC монослои HaCaT-клеток прополаскивают PBS (200 мкл), PBS убирают из планшетов, которые далее подсушивают встряхиванием над бумажным полотенцем. Нижние поверхности планшетов аккуратно протирают сначала влажной салфеткой для ухода за лицом, затем сухой салфеткой и измеряют поглощение света при 492 нм. Перед тем, как монослои высохнут, в каждую лунку добавляют по 0,1 мл 0,1% раствора фиолетового кристаллического в PBS (предварительно профильтрованного через 0,2 мкм фильтр). Планшеты затем инкубируют при комнатной температуре в течение 10 минут, тщательно промывают 5 раз с помощью PBS, удаляют избыток жидкости тем же способом, что и ранее, и прежде чем монослои подсохнут, измеряют поглощение света при 492 нм. Разница оптических плотностей до и после окрашивания дает величины, обусловленные связыванием фиолетового кристаллического, и, следовательно, указывает на количество клеточного монослоя в лунках. Эти величины используют для коррекции данных, полученных с помощью AEC. Б. Клеточный ELISA-анализ на VCAM-1, ICAM-1 и E-селектин эндотелиальных клеток Метод основан на клеточном ELISA-анализе с использованием 96-луночных планшетов линии эндотелиальных клеток микрососудов человека (HMEC-1) и эндотелиальных клеток пуповинных вен человека (HUVEC). Клетки предварительно обрабатывают в течение четырех часов тестируемыми соединениями A и B, стимулируют в течение следующих 8-16 часов с помощью TNF  , после чего фиксируют параформальдегидом для последующей оценки экспрессии VCAM-1, ICAM-1 или E-селектина с использованием непрямой иммунопероксидазной методики окрашивания. Цитотоксические эффекты определяют подсчетом относительного числа клеток (с помощью ядерного красителя Giemsa) после выдерживания с тестируемыми веществами в сравнении с контрольными лунками (только растворитель и среда). Считается, что соединения оказывают положительный эффект, если они вызывают ингибирование VCAM-1, ICAM-1 или E-селектина , после чего фиксируют параформальдегидом для последующей оценки экспрессии VCAM-1, ICAM-1 или E-селектина с использованием непрямой иммунопероксидазной методики окрашивания. Цитотоксические эффекты определяют подсчетом относительного числа клеток (с помощью ядерного красителя Giemsa) после выдерживания с тестируемыми веществами в сравнении с контрольными лунками (только растворитель и среда). Считается, что соединения оказывают положительный эффект, если они вызывают ингибирование VCAM-1, ICAM-1 или E-селектина  50% при потере клеток < 25%.
Методология 50% при потере клеток < 25%.
МетодологияI. Клеточная линия: в анализах на ингибирование экспресси. VCAM-1 и ICAM-1 используют иммортализованную (большой T-антиген вируса SV-40) линию эндотелиальных клеток микрососудов человека (HMEC-1 [Ades et al. Irl Invest Dermatol 99: 683-690, 1992]). Данная клеточная линия конститутивно экспрессирует в небольшом количестве ICAM-1, который регулируется воспалительными медиаторами. Однако после цитокиновой стимуляции они экспрессируют только VCAM-1. Были проведены эксперименты для определения оптимальных условий индукции экспрессии VCAM-1 и ICAM-1 в зависимости от дозы и времени воздействия. II. Условия роста: клетки HMEC-1 выращивают в T-75 колбах (Nunc) в стандартных условиях (37oC, 5% CO2) с 1,5  106 клеток в мл культуральной среды (CM) (CM = основная среда для эндотелиальных клеток [EBM; Clonetics], дополненная 10% FSC, 10 мг/мл человеческого EGF (Boehringr), 1 мкг/мл гидрокортизона (Sigma # 0888), 2,2 г/л NaHCO3, 15 мМ HEPES, 0,11 г/л пирувата натрия, 4 мМ глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина). После трипсинизации в мягких условиях (0,25% трипсина с 0,1% ЭДТА в течение 8 мин) и ресуспендирования клетки пересевают каждые 2-3 дня, разделяя в отношении 1:3.
III. Клеточный ELISA-анализ на VCAM-1 и ICAM-1 106 клеток в мл культуральной среды (CM) (CM = основная среда для эндотелиальных клеток [EBM; Clonetics], дополненная 10% FSC, 10 мг/мл человеческого EGF (Boehringr), 1 мкг/мл гидрокортизона (Sigma # 0888), 2,2 г/л NaHCO3, 15 мМ HEPES, 0,11 г/л пирувата натрия, 4 мМ глутамина, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина). После трипсинизации в мягких условиях (0,25% трипсина с 0,1% ЭДТА в течение 8 мин) и ресуспендирования клетки пересевают каждые 2-3 дня, разделяя в отношении 1:3.
III. Клеточный ELISA-анализ на VCAM-1 и ICAM-1Поверхность лунок плоскодонных 96-луночных планшетов для микротитрования предварительно покрывают бычьим фибронектином (FN; Sigma # F1141), после чего лунки засевают клетками (2  104 клеток на лунку в 200 мкл EBM-среды для роста) и инкубируют в течение ночи. На следующий день культуральную среду (CM) заменяют сначала на EBM-среду для анализа (CM с 5% FCS вместо 10%), затем на среду (180 мкл на лунку), содержащую либо (1) нужные концентрации соединения A или B, либо (2) соответствующие концентрации среды, экстрагированной растворителем/метанолом, либо (3) только одну EBM-среду для анализа, и инкубируют в течение 4 ч при температуре 37oC. Каждый из 96-луночных анализов выполняется в двух повторах. После этого клетки стимулируют, добавляя 20 мкл концентрированного раствора цитокина (2000 ед/мл TNF 104 клеток на лунку в 200 мкл EBM-среды для роста) и инкубируют в течение ночи. На следующий день культуральную среду (CM) заменяют сначала на EBM-среду для анализа (CM с 5% FCS вместо 10%), затем на среду (180 мкл на лунку), содержащую либо (1) нужные концентрации соединения A или B, либо (2) соответствующие концентрации среды, экстрагированной растворителем/метанолом, либо (3) только одну EBM-среду для анализа, и инкубируют в течение 4 ч при температуре 37oC. Каждый из 96-луночных анализов выполняется в двух повторах. После этого клетки стимулируют, добавляя 20 мкл концентрированного раствора цитокина (2000 ед/мл TNF ), и инкубируют в течение 16 ч при температуре 37oC.
Клеточный монослой промывают 1% параформальдегидом в EBM-среде, фиксируют 2% параформальдегидом в течение 15 мин при комнатной температуре (RT) и несколько раз прополаскивают PBS. После удаления PBS монослои инкубируют в течение 30 мин в PBS, содержащем 10% нормальной козьей сыворотки (NGS). Раствор NGS заменяют раствором моноклональных анти-VCAM-1 и анти-ICAM-1 антител (100 мкл на лунку) и инкубируют в течение ночи при 4oC. После удаления раствора моноклональных антител (mAb) клетки прополаскивают PBS с последующей инкубацией в течение 30-60 мин при RT в PBS, содержащем 10% NGS. Удаляют раствор NGS, в лунки добавляют по 100 мкл конъюгата пероксидазы хрена с козьими F(Ab’)2-антителами против IgG мыши (Tago; разведение 1:500 в PBS, содержащем 5% NGS) и инкубируют в течение 1 ч при RT. По окончании инкубации удаляют вторичные антитела, клетки прополаскивают PBS, который заменяют затем на свежеприготовленный отфильтрованный раствор AEC (3-амино-9-этилкарбазол; Sigma; 150 мкл на лунку) и инкубируют в течение 45-60 мин при RT. Субстрат пероксидазы удаляют и клетки прополаскивают PBS. Далее с помощью оборудования для прочтения планшетов производят измерения поглощения света AEC при 550 нм и полученные значения корректируют с учетом “бланка” или значений сравнения, измеренных при 690 нм.
IV. Анализ на E-селектин: анализ на E-селектин проводят, используя свежевыделенные HUVEC-клетки, по существу так же, как описано для анализа на VCAM-1 и ICAM-1, за исключением более короткого периода стимуляции под действием TNF ), и инкубируют в течение 16 ч при температуре 37oC.
Клеточный монослой промывают 1% параформальдегидом в EBM-среде, фиксируют 2% параформальдегидом в течение 15 мин при комнатной температуре (RT) и несколько раз прополаскивают PBS. После удаления PBS монослои инкубируют в течение 30 мин в PBS, содержащем 10% нормальной козьей сыворотки (NGS). Раствор NGS заменяют раствором моноклональных анти-VCAM-1 и анти-ICAM-1 антител (100 мкл на лунку) и инкубируют в течение ночи при 4oC. После удаления раствора моноклональных антител (mAb) клетки прополаскивают PBS с последующей инкубацией в течение 30-60 мин при RT в PBS, содержащем 10% NGS. Удаляют раствор NGS, в лунки добавляют по 100 мкл конъюгата пероксидазы хрена с козьими F(Ab’)2-антителами против IgG мыши (Tago; разведение 1:500 в PBS, содержащем 5% NGS) и инкубируют в течение 1 ч при RT. По окончании инкубации удаляют вторичные антитела, клетки прополаскивают PBS, который заменяют затем на свежеприготовленный отфильтрованный раствор AEC (3-амино-9-этилкарбазол; Sigma; 150 мкл на лунку) и инкубируют в течение 45-60 мин при RT. Субстрат пероксидазы удаляют и клетки прополаскивают PBS. Далее с помощью оборудования для прочтения планшетов производят измерения поглощения света AEC при 550 нм и полученные значения корректируют с учетом “бланка” или значений сравнения, измеренных при 690 нм.
IV. Анализ на E-селектин: анализ на E-селектин проводят, используя свежевыделенные HUVEC-клетки, по существу так же, как описано для анализа на VCAM-1 и ICAM-1, за исключением более короткого периода стимуляции под действием TNF (6-8 часов).
V. Степень цитотоксичности (учет потери клеток на основании окрашивания клеточных ядер) (6-8 часов).
V. Степень цитотоксичности (учет потери клеток на основании окрашивания клеточных ядер)Эндотелиальные клетки отмывают, заменяя на 20 мин PBS на 95% этанол (2 смены по 10 мин), с контролем под микроскопом. Вслед за этим клетки прополаскивают в дистиллированной воде (Aquadest) и монослои покрывают 33% раствором Giemsa в Aquadest на 5 минут при RT. Лунки промывают Aquadest и сушат воздухом в течение по меньшей мере 15 минут. С помощью микроскопа контролируют, чтобы окрашиванию подвергались только ядра, но не цитоплазма. Проводят измерения поглощения света при 550 нм, обусловленного связыванием красителя Giemsa и полученные значения корректируют с учетом поглощения “бланка” (ряды лунок без клеток) при 690 нм. VI. Обработка данных: результаты анализа с AEC для конститутивной экспрессии VCAM-1 или E-селектина (контрольные лунки без стимулирования) совпадают в значительной степени с результатами для изотипически парных контрольных mAb и отражают фоновую окраску. Для каждой из 96 лунок среднее значение величины конститутивной экспрессии вычитают из среднего значения соответствующей величины, полученной в анализе с AEC для стимулированной цитокином группы (как для контрольной на EBM и растворитель, так и для тестируемого вещества), в результате чего получают число, выражающее величину регулируемой в случае ICAM-1 и индуцируемой в случае VCAM-1 или E-селектина экспрессии клеточных молекул адгезии (CAM), обозначенную здесь как AEC-CAM. Значение AEC-CAM в каждом случае затем делят на соответствующее значение величины, определенной в анализе с Giemsa, получая число, дающее оценку уровня экспрессии CAM по отношению к плотности клеток, измеренной на основании окрашивания клеточных ядер (обозначено здесь как отношение AEC:Giemsa). AEC (стимулированная) – AEC (нестимулированная) = AEC-CAM AEC-CAM/Giemsa = отношение AEC:Giemsa Таким образом, “истинные” величины IC50 экспрессии CAM определяют, сравнивая величины AEC:Giemsa, полученные в пробах тестируемых соединений, с соответствующими величинами для стимулированных контрольных проб (EBM, растворитель). Значения этих величин сравнивают со значениями величин IC50 только для Giemsa. Строгий критерий, показывающий наличие ингибирования CAM в сравнении с профилем цитотоксичности (Giemsa) означает “реальную” цель, которая должна быть достигнута. В. Анализ пролиферации HaCaT-клеток HaCaT-клетки культивируют в DMEM (Gibro # 074-02100), дополненной 2,2 г/л NaHCO3, 0,11 г/л пирувата натрия, 15 г/л HEPES, 5% эмбриональной телячьей сыворотки (FCS), пенициллином (100 ед. /мл), стрептомицином (100 мкг/мл) и глутамином (для увеличения конечной концентрации до 4 мМ). Для проведения анализа на пролиферацию клетки обрабатывают трипсином, суспендируют в свежей среде и высеивают на 96-луночные планшеты для микротитрования, при этом значение конечной плотности клеточной суспензии соответствует 4000 клеток/0,2 мл на лунку. Через 24 часа (день 0) среду заменяют на свежую, содержащую набор концентраций тестируемых соединений. По окончании 3 дней инкубации при 37oC/5% CO2, степень клеточной пролиферации в сравнении с контролями (растворитель) измеряют колориметрически, определяя относительную клеточную массу с помощью красителя сульфородамина B [(Skehan et al., 1990, I. Natt. Cancer Inst. 82, 1107-1112)]. “Стартовое клеточное число” определяют, измеряя относительную клеточную массу в день 0. Результаты выражают в % ингибирования = 100% – % контрольного поглощения (где 100% – это контроль с растворителем) и представляют по результатам трех измерений в виде среднего значения  стандартного отклонения. График зависимости от дозы строят в полулогарифмическом масштабе, определяя концентрацию, необходимую для ингибирования в половину от максимального (IC50) с помощью линейной интерполяции. Максимальное ингибирование без потери клеток, выражаемое значением “стартового клеточного числа”, обычно составляет 90-98%.
Для демонстрации токсичности заявленных соединений ниже приведены исследования на примере соединений согласно примеру 15.
Тестирование in vitro в отношении микронуклеусов.
Клетки китайского хомячка V79 обрабатывали тестируемым соединением, растворенным в диметилсульфоксиде, в присутствии или без S9 гомогената печени (10%) самца крысы, предварительно обработанного Aroclor 1254. Выявляли фракции клеток, содержащие микронуклеусы в качестве индикаторов хромосомных перестроек.
Исходя из условий этого теста (клетки обрабатывали различными дозами соединения) тестируемое соединение не является кластогенным или анеугенным.
Тест Эймса стандартного отклонения. График зависимости от дозы строят в полулогарифмическом масштабе, определяя концентрацию, необходимую для ингибирования в половину от максимального (IC50) с помощью линейной интерполяции. Максимальное ингибирование без потери клеток, выражаемое значением “стартового клеточного числа”, обычно составляет 90-98%.
Для демонстрации токсичности заявленных соединений ниже приведены исследования на примере соединений согласно примеру 15.
Тестирование in vitro в отношении микронуклеусов.
Клетки китайского хомячка V79 обрабатывали тестируемым соединением, растворенным в диметилсульфоксиде, в присутствии или без S9 гомогената печени (10%) самца крысы, предварительно обработанного Aroclor 1254. Выявляли фракции клеток, содержащие микронуклеусы в качестве индикаторов хромосомных перестроек.
Исходя из условий этого теста (клетки обрабатывали различными дозами соединения) тестируемое соединение не является кластогенным или анеугенным.
Тест ЭймсаБыли тестированы следующие концентрации: первый тест 5, 50 и 5000 мкг/чашку; второй тест: 250, 750 и 2500 мкг/чашку. Исходя из условий этого анализа не было получено доказательств наличия бактериотоксического эффекта у тестируемого соединения в концентрациях до 5000 мкг/чашку (самая высокая изученная концентрация). Кроме того, циклопептолиды не увеличивали соответствующую норму при других условиях анализа. 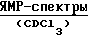 Пример 4. Спектр: (3 конформера 55: 44:3, основной и дополнит, конформеры помечены * и o соотв. ): 8.80* (d, J = 10 Hz, NH); 7.89* (d, J = 10 Hz, NH); 7.78o (d, J = 10 Hz, NH); 7.57o (d, J = 10 Hz, NH); 7.50*o (d, J = 7 Hz, MeMeOTrp H-4′); 7.39o, 7.37o (2d, J = 8 Hz, MeMeOTrp H-7′), 7.20*o (m, MeMeOTrp, H-6′); 7.11o, 7,06* (2s, MeMeOTrp H-2′); 7.03*o (2dd, MeMeOTrp H-5′); 6.16o (d, J = 10 Hz, Leu NH); 5.95* (d, J = 6 Hz, Leu NH); 5.30o (m, al-H); 5.10* (dd, hydoxybutyric acid al-H); 5.03-4.98 (m, al-H); 4.91 (dd, al-H); 4.85 (m, al-H); 4.71o (m, al-H); 4.45* (dd, al-H); 4.29* (m, al-H); 4.03*, 4.02o (2s, N-OMe); 3.87 (dd); 3.72*, 3.64o (2s, COOMe); 3.63-3.50 (m); 3.47* (q, J = 7 Hz, MeAla al-H); 3.41o (s, N-Me); 3.36* (dd, MeMeOTrp  -H); 3.23-3.17 (m); 3.20* (s, MeAla N-Me); 3.19o (s, N-Me); 2.91* (s, MeMeOTrp N-Me); 2.53* (s, MeLeu N-Me); 2.51o (s, MeMeOTrp N-Me); 2.43-2.09 (m); 2.03-1.89 (m); 1.83-1.75 (m); 1.68-1.07 (m); 1.52* (d, J = 7 Hz, MeAla -H); 3.23-3.17 (m); 3.20* (s, MeAla N-Me); 3.19o (s, N-Me); 2.91* (s, MeMeOTrp N-Me); 2.53* (s, MeLeu N-Me); 2.51o (s, MeMeOTrp N-Me); 2.43-2.09 (m); 2.03-1.89 (m); 1.83-1.75 (m); 1.68-1.07 (m); 1.52* (d, J = 7 Hz, MeAla  -Me); 1.48o (d, J = 7 Hz, MeAla -Me); 1.48o (d, J = 7 Hz, MeAla  -Me); 1.04 (d, J = 6.5 Hz); 0.98-0.83 (m); 0.53* (d, J = 6.6 Hz, Leu Me); 0,01* (d, J = 6.6, Leu Me); -0.32 (ddd, J = 3.6 Hz, J = 11.1 Hz, J = 14.5 Hz, Leu -Me); 1.04 (d, J = 6.5 Hz); 0.98-0.83 (m); 0.53* (d, J = 6.6 Hz, Leu Me); 0,01* (d, J = 6.6, Leu Me); -0.32 (ddd, J = 3.6 Hz, J = 11.1 Hz, J = 14.5 Hz, Leu  -CH).
(производное с открытой цепью формулы IV): (два конформера 68:32, основной и дополнит, конформеры помечены * и o соотв.): 8.16, 8.12, 8.05, 8.00 (4d, NH); 7.58o, 7.55* (2d, J = 8 Hz, MeMeOTrp 4′-H); 7.38*o (d, MeMeOTrp H-7′); 7.22*, 7.20o (2m, MeMeOTrp H-6′); 7.15*, 7.12o (2s, MeMeOTrp H-2′); 7.07*, 7.03o (2m, MeMeOTrp H-5′); 6.57 (s br, NH); 5.10o (dd, al-H); 5.17* (dd, hydroxybutyric acid al-H); 5.11*o (m, MeLeu al-H); 5.04*o (dd, al-H); 4.99* (ddd, al-H); 4.88o (ddd, al-H); 4.51o (dd); 4.53* (m, Leu al-H); 4.48o (m); 4.42* (m br, MeAla al-H); 4.05*, 4.03o (2s, N-OMe); 3.88o (q, J = 7 Hz, MeAla al-H); 3.71o, 3.68* (2s, COOMe); 3.57*, 3.54o (2s, COOMe); 3.47* (m br, MeMeOTrp al-H); 3.27o, 3.21* (2s, NMe); 3.2 (m, MeMeOTrp -CH).
(производное с открытой цепью формулы IV): (два конформера 68:32, основной и дополнит, конформеры помечены * и o соотв.): 8.16, 8.12, 8.05, 8.00 (4d, NH); 7.58o, 7.55* (2d, J = 8 Hz, MeMeOTrp 4′-H); 7.38*o (d, MeMeOTrp H-7′); 7.22*, 7.20o (2m, MeMeOTrp H-6′); 7.15*, 7.12o (2s, MeMeOTrp H-2′); 7.07*, 7.03o (2m, MeMeOTrp H-5′); 6.57 (s br, NH); 5.10o (dd, al-H); 5.17* (dd, hydroxybutyric acid al-H); 5.11*o (m, MeLeu al-H); 5.04*o (dd, al-H); 4.99* (ddd, al-H); 4.88o (ddd, al-H); 4.51o (dd); 4.53* (m, Leu al-H); 4.48o (m); 4.42* (m br, MeAla al-H); 4.05*, 4.03o (2s, N-OMe); 3.88o (q, J = 7 Hz, MeAla al-H); 3.71o, 3.68* (2s, COOMe); 3.57*, 3.54o (2s, COOMe); 3.47* (m br, MeMeOTrp al-H); 3.27o, 3.21* (2s, NMe); 3.2 (m, MeMeOTrp  -Ha); 3.00* (s, NMe); 2.9 (m, MeMeOTrp -Ha); 3.00* (s, NMe); 2.9 (m, MeMeOTrp  -Hb); 2.64o (s, NMe); 2.32*, 2.28o (2s, NMe); 2.33-2.13 (m); 2.20 (m); 1.86 (m); 1.7-1.1 (m); 1.50o, 1.48* (2d, J = 7 Hz, MeAla -Hb); 2.64o (s, NMe); 2.32*, 2.28o (2s, NMe); 2.33-2.13 (m); 2.20 (m); 1.86 (m); 1.7-1.1 (m); 1.50o, 1.48* (2d, J = 7 Hz, MeAla  -Me); 0.97-0.93 (m); 0.90-0.76 (m).
Пример 5.
(3 конформера 2:2:1, дополнит, конформер помечен *): 8.81 (d, J = 10 Hz, NH); 7.93 (d, J = 10 Hz, NH); 7.79 (d, J = 9 Hz, NH); 7.65 (m br, NH); 7.54 (m, MeMeOTrp H-4′); 7.38, 7.37, 7.34* (3d, J = 8 Hz, MeMeOTrp H-7′); 7.19 (m, MeMeOTrp, H-6′); 7.08-6.98 (m, MeMeOTrp H-5′); 7.02 (s, MeMeOTrp H-2′); 6.14 (d, J = 10 Hz, Leu NH); 6.29* (d, J = 7 Hz, Leu NH); 6.07 (d, J = 6 Hz, Leu NH); 5.25 (m, al-H); 5.12-4.92 (al-H); 4.84 (m, al-H); 4.69 (m, al-H); 4.43 (m, al-H); 4.29 (m, al-H); 4.03*, 4.02, 4.00 (3s, N-OMe); 3.98 (m, al-H); 3.63-3.3 (m); 3.39-3.34* (s br NMe); 3.21 (s, NMe); 3.18* (s, NMe); 3.13 (m); 3.07* (s, NMe); 3.04* (s, NMe); 2.91 (s, N-Ms); 2.53 (s, NMe); 2.37 (s br, NMe); 2.5-1.05 (m); 1.47, 1.43, 1.41* (3d, J = 7 Hz, MeAla -Me); 0.97-0.93 (m); 0.90-0.76 (m).
Пример 5.
(3 конформера 2:2:1, дополнит, конформер помечен *): 8.81 (d, J = 10 Hz, NH); 7.93 (d, J = 10 Hz, NH); 7.79 (d, J = 9 Hz, NH); 7.65 (m br, NH); 7.54 (m, MeMeOTrp H-4′); 7.38, 7.37, 7.34* (3d, J = 8 Hz, MeMeOTrp H-7′); 7.19 (m, MeMeOTrp, H-6′); 7.08-6.98 (m, MeMeOTrp H-5′); 7.02 (s, MeMeOTrp H-2′); 6.14 (d, J = 10 Hz, Leu NH); 6.29* (d, J = 7 Hz, Leu NH); 6.07 (d, J = 6 Hz, Leu NH); 5.25 (m, al-H); 5.12-4.92 (al-H); 4.84 (m, al-H); 4.69 (m, al-H); 4.43 (m, al-H); 4.29 (m, al-H); 4.03*, 4.02, 4.00 (3s, N-OMe); 3.98 (m, al-H); 3.63-3.3 (m); 3.39-3.34* (s br NMe); 3.21 (s, NMe); 3.18* (s, NMe); 3.13 (m); 3.07* (s, NMe); 3.04* (s, NMe); 2.91 (s, N-Ms); 2.53 (s, NMe); 2.37 (s br, NMe); 2.5-1.05 (m); 1.47, 1.43, 1.41* (3d, J = 7 Hz, MeAla  -Me); 1.03 (d, J = 6.5 Hz); 0.98-0.83 (m); 0.68*, 0.55, 0.47*, -0.02 (4d, J = 6.6 Hz, Leu Me); -0.32 (ddd, Leu -Me); 1.03 (d, J = 6.5 Hz); 0.98-0.83 (m); 0.68*, 0.55, 0.47*, -0.02 (4d, J = 6.6 Hz, Leu Me); -0.32 (ddd, Leu  -CH).
Пример 6.
(3 конформера 4:3:1, дополнит, конформер помечен *): 8.82 (d, J = 10 Hz, NH); 7.95* (d, J = 9.3 Hz, NH); 7.90 (d, J = 9.8 Hz, NH); 7.80 (d, J = 9.4 Hz, NH); 7.59, 7.53 (2d, J = 8 Hz, MeMeOTrp H-4′); 7.45-7.30 (m, MeMeOTrp H-7′); 7.23-7.15 (m, MeMeOTrp, H-6′); 7.20, 7.18 (2s, MeMeOTrp H-2′); 7.11-7.03 (m, MeMeOTrp H-5′); 6.86* (q, J = 5 Hz, NHMe), 6.23 (d, 9.5 Hz, Leu NH); 5.95 (d, J = 6.5 Hz, Leu NH; q, NHMe); 5.84* (d, J = 8.9 Hz, Leu NH); 5.55 (q, 5 Hz, NHMe); 5.3-4.95 (m, al-H); 4.84 (ddd, al-H); 4.69 (ddd, al-H); 4.42 (dd, MeLeu al-H); 4.34 (ddd, Leu al-H); 4.05*, 4.03, 4.02 (3s, N-OMe); 3.98 (m, al-H); 3.63-3.52 (m, al-H); 3.47 (q, Ala al-H); 3.37, 3.35*, 3.24*, 3.22, 3.20 (5s, NMe); 3.3-3.2 (m); 3.03*, 2.92 (2s, NMe); 2.85, 2.74, 2.70* (3d, J = 5 Hz, NH-Me), 2.53, 2.52 (2s, NMe); 2.23-1.93 (m); 1.85-1.05 (m); 1.53, 1.47, 1.44* (3d, J = 7 Hz, MeAla -CH).
Пример 6.
(3 конформера 4:3:1, дополнит, конформер помечен *): 8.82 (d, J = 10 Hz, NH); 7.95* (d, J = 9.3 Hz, NH); 7.90 (d, J = 9.8 Hz, NH); 7.80 (d, J = 9.4 Hz, NH); 7.59, 7.53 (2d, J = 8 Hz, MeMeOTrp H-4′); 7.45-7.30 (m, MeMeOTrp H-7′); 7.23-7.15 (m, MeMeOTrp, H-6′); 7.20, 7.18 (2s, MeMeOTrp H-2′); 7.11-7.03 (m, MeMeOTrp H-5′); 6.86* (q, J = 5 Hz, NHMe), 6.23 (d, 9.5 Hz, Leu NH); 5.95 (d, J = 6.5 Hz, Leu NH; q, NHMe); 5.84* (d, J = 8.9 Hz, Leu NH); 5.55 (q, 5 Hz, NHMe); 5.3-4.95 (m, al-H); 4.84 (ddd, al-H); 4.69 (ddd, al-H); 4.42 (dd, MeLeu al-H); 4.34 (ddd, Leu al-H); 4.05*, 4.03, 4.02 (3s, N-OMe); 3.98 (m, al-H); 3.63-3.52 (m, al-H); 3.47 (q, Ala al-H); 3.37, 3.35*, 3.24*, 3.22, 3.20 (5s, NMe); 3.3-3.2 (m); 3.03*, 2.92 (2s, NMe); 2.85, 2.74, 2.70* (3d, J = 5 Hz, NH-Me), 2.53, 2.52 (2s, NMe); 2.23-1.93 (m); 1.85-1.05 (m); 1.53, 1.47, 1.44* (3d, J = 7 Hz, MeAla  -Me); 1.03 (d, J = 6.5 Hz); 0.98-0.80 (m); 0.57*, 0.55, 0.38*, 0.08 (4d, J = 6.6 Hz, Leu Me); -0.30 (ddd. Leu -Me); 1.03 (d, J = 6.5 Hz); 0.98-0.80 (m); 0.57*, 0.55, 0.38*, 0.08 (4d, J = 6.6 Hz, Leu Me); -0.30 (ddd. Leu  -CH).
Пример 7.
(3 конформера 40: 53: 7, помечены *, o и ‘): 8.81* (d, J = 10 Hz, C9AA NH); 7.88* (d, J = 10 Hz, C9AA NH); 7.78o (d, J = 10 Hz, NH); 7.57o (d, J = 10 Hz, NH); 7.52*o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.39*, 7.37o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.27* (s, MeMeOTrp H-2′); 7.20, 7.18 (2m, MeMeOTrp, H-6′); 7.17* (s, MeMeOTrp H-2′); 7.03o, 7.01* (2m, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.98* (d, J = 6 Hz, Leu NH); 5.77′ (d, J = 10 Hz, Leu NH); 5.31o (ddd, MeAla al-H); 5.19* (dd, hydroxybutyric acid al-H); 5.05-4.94 (m, al-H); 4.88-4.83 (m, al-H); 4.70-4.64 (m, al-H); 4.48* (dd, MeLeu al-H); 4.32* (m, Leu al-H); 4.03*, 4.02o (2s, N-OMe); 3.93o (m, al-H); 3.7-3.5 (m, morpholine); 3.5-3.2 (m); 3.40o (s, N-Me); 3.34o (dd, MeMeOTrp H- -CH).
Пример 7.
(3 конформера 40: 53: 7, помечены *, o и ‘): 8.81* (d, J = 10 Hz, C9AA NH); 7.88* (d, J = 10 Hz, C9AA NH); 7.78o (d, J = 10 Hz, NH); 7.57o (d, J = 10 Hz, NH); 7.52*o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.39*, 7.37o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.27* (s, MeMeOTrp H-2′); 7.20, 7.18 (2m, MeMeOTrp, H-6′); 7.17* (s, MeMeOTrp H-2′); 7.03o, 7.01* (2m, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.98* (d, J = 6 Hz, Leu NH); 5.77′ (d, J = 10 Hz, Leu NH); 5.31o (ddd, MeAla al-H); 5.19* (dd, hydroxybutyric acid al-H); 5.05-4.94 (m, al-H); 4.88-4.83 (m, al-H); 4.70-4.64 (m, al-H); 4.48* (dd, MeLeu al-H); 4.32* (m, Leu al-H); 4.03*, 4.02o (2s, N-OMe); 3.93o (m, al-H); 3.7-3.5 (m, morpholine); 3.5-3.2 (m); 3.40o (s, N-Me); 3.34o (dd, MeMeOTrp H- a); 3.22 (m, MeMeOTrp H- a); 3.22 (m, MeMeOTrp H- b), 3.20o (s, N-Me); 3,17* (s, N-Me); 2.93* (s, MeMeOTrp N-Me); 2.54* (s, MeLeu N-Me); 2.53o (s, N-Me); 2.4-2.35 (m); 2.2-1.9 (m); 1.83-1.05 (m); 1.53*, 1.50o (2d, J = 7 Hz, MeAla b), 3.20o (s, N-Me); 3,17* (s, N-Me); 2.93* (s, MeMeOTrp N-Me); 2.54* (s, MeLeu N-Me); 2.53o (s, N-Me); 2.4-2.35 (m); 2.2-1.9 (m); 1.83-1.05 (m); 1.53*, 1.50o (2d, J = 7 Hz, MeAla  -Me); 1.04 (d, J = 6.5 Hz, MeLeu Me); 1.00-0.77 (m); 0.57* (d, J = 6.6 Hz, Leu Me); 0.52′, 0.34′ (2d, J = 6.6 Hz, Leu Me); 0.09* (d, J = 6.6 Hz, Leu Me); -0.25 (ddd, Leu -Me); 1.04 (d, J = 6.5 Hz, MeLeu Me); 1.00-0.77 (m); 0.57* (d, J = 6.6 Hz, Leu Me); 0.52′, 0.34′ (2d, J = 6.6 Hz, Leu Me); 0.09* (d, J = 6.6 Hz, Leu Me); -0.25 (ddd, Leu  -CH).
Пример 8.
(2 конформера 45: 55, помечены *, o): 8.84* (d, J = 10 Hz, C9AA NH); 7.87* (d, J = 10 Hz, C9AA NH); 7.77o (d, J = 10 Hz, NH); 7.57o (d, J = 10 Hz, NH); 7.55*, 7.52o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.36*, 7.35o (2d, J = 8 Hz, MeMeOTrp H-7′), 7.36* (s, MeMeOTrp H-2′); 7.23* (s, MeMeOTrp H-2′); 7.20, 7.17 (2m, MeMeOTrp, H-6′); 7.03o, 7.01* (2m, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.95* (d, J = 6 Hz, Leu NH); 5.31o (ddd, MeAla al-H); 5.24* (dd, hydroxybutyric acid al-H); 5.05-4.97 (m, al-H); 4.93 (dd, al-H); 4.87 (dd, al-H); 4.88-4.83 (m, al-H); 4.66-4.60 (m, al-H); 4.48* (dd, MeLeu al-H); 4.38* (ddd, Leu al-H); 4.15-4.00 (m); 4.03*, 4.02o (2s, N-OMe); 3.98o (m, al-H); 3.7-3.2 (m); 3.40o (s, N-Me); 3.20o (s, N-Me); 3.17* (s, N-Me); 3.05-2.9 (m); 2.99, 2.98 (2s, CON-Me); 2.96 (s, 2xCON-Me); 2.92* (s, MeMeOTrp N-Me); 2.54 (s, MeLeu N-Me and N-Me); 2.4-2.25 (m); 2.15-1.9 (m); 1.83-1.05 (m); . 1.53*, 1.50o (2d, J = 7 Hz, MeAla -CH).
Пример 8.
(2 конформера 45: 55, помечены *, o): 8.84* (d, J = 10 Hz, C9AA NH); 7.87* (d, J = 10 Hz, C9AA NH); 7.77o (d, J = 10 Hz, NH); 7.57o (d, J = 10 Hz, NH); 7.55*, 7.52o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.36*, 7.35o (2d, J = 8 Hz, MeMeOTrp H-7′), 7.36* (s, MeMeOTrp H-2′); 7.23* (s, MeMeOTrp H-2′); 7.20, 7.17 (2m, MeMeOTrp, H-6′); 7.03o, 7.01* (2m, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.95* (d, J = 6 Hz, Leu NH); 5.31o (ddd, MeAla al-H); 5.24* (dd, hydroxybutyric acid al-H); 5.05-4.97 (m, al-H); 4.93 (dd, al-H); 4.87 (dd, al-H); 4.88-4.83 (m, al-H); 4.66-4.60 (m, al-H); 4.48* (dd, MeLeu al-H); 4.38* (ddd, Leu al-H); 4.15-4.00 (m); 4.03*, 4.02o (2s, N-OMe); 3.98o (m, al-H); 3.7-3.2 (m); 3.40o (s, N-Me); 3.20o (s, N-Me); 3.17* (s, N-Me); 3.05-2.9 (m); 2.99, 2.98 (2s, CON-Me); 2.96 (s, 2xCON-Me); 2.92* (s, MeMeOTrp N-Me); 2.54 (s, MeLeu N-Me and N-Me); 2.4-2.25 (m); 2.15-1.9 (m); 1.83-1.05 (m); . 1.53*, 1.50o (2d, J = 7 Hz, MeAla  -Me); 1.04 (d, J = 6.5 Hz, MeLeu Me); 1.00-0.83 (m); 0.79o, 0.74o (2d); 0.57* (d, J = 6.6 Hz, Leu Me); 0.13* (d, J = 6.6 Hz, Leu Me); -0.25 (ddd, Leu -Me); 1.04 (d, J = 6.5 Hz, MeLeu Me); 1.00-0.83 (m); 0.79o, 0.74o (2d); 0.57* (d, J = 6.6 Hz, Leu Me); 0.13* (d, J = 6.6 Hz, Leu Me); -0.25 (ddd, Leu  -CH).
Пример 9.
(3 конформера 0: 28:2, помечены *, o, ‘): 8.89* (d, 10 Hz, PrLeu6 NH); 7.89* (d, 10 Hz, PrLeu2 NH); 7.77o (d, 10 Hz, PrLeu6 NH); 7.52o (d, 8 Hz, indole H-4′); 7.50o (d, PrLeu2 NH); 7.48* (d, 8 Hz, indole H-4′); 7.38* (d, 8 Hz, indole H-7′); 7.37o (d, 8 Hz, indole H-7′); 7.19o (dd, indole H-6′); 7.18* (dd, indole H-6′); 7.13o (s, indole H-2′); 7.02* (s, indole H-2′); 6.99o (dd, indole H-5′); 6.90* (dd, indole H-5′); 6.18o (d br, 10 Hz, Leu NH); 5.93* (d, 6 Hz, Leu NH); 5.83′ (d, Leu NH); 5.30o (ddd, PrLeu6 -CH).
Пример 9.
(3 конформера 0: 28:2, помечены *, o, ‘): 8.89* (d, 10 Hz, PrLeu6 NH); 7.89* (d, 10 Hz, PrLeu2 NH); 7.77o (d, 10 Hz, PrLeu6 NH); 7.52o (d, 8 Hz, indole H-4′); 7.50o (d, PrLeu2 NH); 7.48* (d, 8 Hz, indole H-4′); 7.38* (d, 8 Hz, indole H-7′); 7.37o (d, 8 Hz, indole H-7′); 7.19o (dd, indole H-6′); 7.18* (dd, indole H-6′); 7.13o (s, indole H-2′); 7.02* (s, indole H-2′); 6.99o (dd, indole H-5′); 6.90* (dd, indole H-5′); 6.18o (d br, 10 Hz, Leu NH); 5.93* (d, 6 Hz, Leu NH); 5.83′ (d, Leu NH); 5.30o (ddd, PrLeu6  -H); 5.30* (dd, Hba -H); 5.30* (dd, Hba  -H); 5.02* (ddd, PrLeu6 -H); 5.02* (ddd, PrLeu6  -H); 5.00o (ddd, PrLeu2 -H); 5.00o (ddd, PrLeu2  -H); 4.89* (dd, MeTrp -H); 4.89* (dd, MeTrp  -H); 4.84* (ddd, PrLeu2 -H); 4.84* (ddd, PrLeu2  -H); 4.71o (ddd, -H); 4.71o (ddd,  -H); 4.44* (dd, MeLeu -H); 4.44* (dd, MeLeu  -H); 4.37* (ddd, Leu -H); 4.37* (ddd, Leu  -H); 4.03*, 4.02o (2s, N-OMe); 3.63-3.52; 3.49* (q, 7 Hz, MeAla -H); 4.03*, 4.02o (2s, N-OMe); 3.63-3.52; 3.49* (q, 7 Hz, MeAla  -H); 3.40o (s, N-Me); 3.38* (dd, MeTrp -H); 3.40o (s, N-Me); 3.38* (dd, MeTrp  -Ha); 3.26-3.20; 3.23* (s, MeAla N-Me); 3.21o (s, N-Me); 2.93* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.45-1.75; 2.33, 2.15 (2m, aziridine); 1.56-1.07; 1.50* (d, 7Hz, MeAla -Ha); 3.26-3.20; 3.23* (s, MeAla N-Me); 3.21o (s, N-Me); 2.93* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.45-1.75; 2.33, 2.15 (2m, aziridine); 1.56-1.07; 1.50* (d, 7Hz, MeAla  -Me); 1.47o (d, 7Hz, MeAla -Me); 1.47o (d, 7Hz, MeAla  -Me); 1.03* (d, 6.5 Hz, MeLeu d-Me); 0.98-O.83; 0.48* (d, 6.6 Hz, Leu -Me); 1.03* (d, 6.5 Hz, MeLeu d-Me); 0.98-O.83; 0.48* (d, 6.6 Hz, Leu   -Me); -0.13* (d, 6.6 Hz, Leu -Me); -0.13* (d, 6.6 Hz, Leu   -Me); -0.48* (ddd, Leu -Me); -0.48* (ddd, Leu  -CH).
Пример 10.
(3 конформера 45:51:4, помечены *, o и ‘): 8.86* (d, 10 Hz, PrLeu6 NH); 7.87* (d, 10 Hz, PrLeu2 NH); 7.75o (d, 10 Hz, PrLeu6 NH); 7.57* (d, 8 Hz, indole H-4′), 7.55o (d, PrLeu2 NH); 7.51o (d, 8 Hz, indole H-4′); 7.41o (s, indole H-2′); 7.38* (d, 8 Hz, indole H-7′); 7.36o (d, 8 Hz, indole H-7′); 7.29* (s, indole H-2′); 7.18* (dd, indole H-6′); 7.17o (dd, indole H-6′); 7.03o (dd, indole H-5′); 7.01* (dd, indole H-5′); 6.17o (d br, 10 Hz, Leu NH); 5.94* (d, 6 Hz, Leu NH); 5.79′ (d, Leu NH); 5.30o (ddd, PrLeu6 -CH).
Пример 10.
(3 конформера 45:51:4, помечены *, o и ‘): 8.86* (d, 10 Hz, PrLeu6 NH); 7.87* (d, 10 Hz, PrLeu2 NH); 7.75o (d, 10 Hz, PrLeu6 NH); 7.57* (d, 8 Hz, indole H-4′), 7.55o (d, PrLeu2 NH); 7.51o (d, 8 Hz, indole H-4′); 7.41o (s, indole H-2′); 7.38* (d, 8 Hz, indole H-7′); 7.36o (d, 8 Hz, indole H-7′); 7.29* (s, indole H-2′); 7.18* (dd, indole H-6′); 7.17o (dd, indole H-6′); 7.03o (dd, indole H-5′); 7.01* (dd, indole H-5′); 6.17o (d br, 10 Hz, Leu NH); 5.94* (d, 6 Hz, Leu NH); 5.79′ (d, Leu NH); 5.30o (ddd, PrLeu6  -H); 5.27* (dd, -H); 5.27* (dd,  -H); 5.00* (ddd, PrLeu6 -H); 5.00* (ddd, PrLeu6  -H); 4.98o (ddd, -H); 4.98o (ddd,  -H); 4.93o (dd, -H); 4.93o (dd,  -H); 4.87* (dd, -H); 4.87* (dd,  -H); 4.85* (ddd, PrLeu2 -H); 4.85* (ddd, PrLeu2  -H); 4.63o (ddd, -H); 4.63o (ddd,  -H); 4.47* (dd, MeLeu -H); 4.47* (dd, MeLeu  -H); 4.40 (m); 4.02* (ddd, Leu -H); 4.40 (m); 4.02* (ddd, Leu  -H); 4.02, 4.01 (2s, N-OMe); 3.68-3.22; 3.40o (s, N-Me); 3.20o (s, N-Me); 3.18* (s, MeAla N-Me); 2.91* (s, MeTrp N-Me); 2.55o (s, N-Me); 2.53* (s, MeLeu N-Me); 2.35-1.05; 1.54* (d, 7 Hz, MeAla -H); 4.02, 4.01 (2s, N-OMe); 3.68-3.22; 3.40o (s, N-Me); 3.20o (s, N-Me); 3.18* (s, MeAla N-Me); 2.91* (s, MeTrp N-Me); 2.55o (s, N-Me); 2.53* (s, MeLeu N-Me); 2.35-1.05; 1.54* (d, 7 Hz, MeAla  -Me); 1.50o (d, 7 Hz, MeAla -Me); 1.50o (d, 7 Hz, MeAla  -Me); 1.03* (d. 6.5 Hz, MeLeu d-Me); 0.98-0.83; 0.78o (d, 6 Hz, Leu -Me); 1.03* (d. 6.5 Hz, MeLeu d-Me); 0.98-0.83; 0.78o (d, 6 Hz, Leu   -Me); 0.73o (d, 6 Hz, Leu -Me); 0.73o (d, 6 Hz, Leu   -Me); 0.57* (d, 6.6 Hz, Leu -Me); 0.57* (d, 6.6 Hz, Leu   -Me); 0.16* (d, 6.6 Hz, Leu -Me); 0.16* (d, 6.6 Hz, Leu   -Me); -0.27 (ddd, Leu -Me); -0.27 (ddd, Leu  -CH).
Пример 11.
(3 конформера 46:51:3, помечены *, o и ‘): 8.87* (d, 10 Hz, PrLeu6 NH); 7.87* (d, 10 Hz, PrLeu2 NH); 7.76o (d, 10 Hz, PrLeu6 NH); 7.56o (d, PrLeu2 NH); 7.55* (d, 8 Hz, indole H-4′); 7.52o (d, 8 Hz, indole H-4′); 7.37 (d, 8 Hz, indole H); 7.36 (d, 8 Hz, indole H); 7.36o (s, indole H-2′); 7.22* (s, indole H-2′); 7.20* (dd, indole H-6′); 7.18o (cc, indole H-6′); 7.03o (dd, indole H-5′); 7.00o (dd, indole H-5′); 6.16o (d, 10 Hz, Leu NH); 5.94* (d, 6 Hz, Leu NH); 5.78′ (d, Leu NH); 5.31o (ddd, PrLeu6 -CH).
Пример 11.
(3 конформера 46:51:3, помечены *, o и ‘): 8.87* (d, 10 Hz, PrLeu6 NH); 7.87* (d, 10 Hz, PrLeu2 NH); 7.76o (d, 10 Hz, PrLeu6 NH); 7.56o (d, PrLeu2 NH); 7.55* (d, 8 Hz, indole H-4′); 7.52o (d, 8 Hz, indole H-4′); 7.37 (d, 8 Hz, indole H); 7.36 (d, 8 Hz, indole H); 7.36o (s, indole H-2′); 7.22* (s, indole H-2′); 7.20* (dd, indole H-6′); 7.18o (cc, indole H-6′); 7.03o (dd, indole H-5′); 7.00o (dd, indole H-5′); 6.16o (d, 10 Hz, Leu NH); 5.94* (d, 6 Hz, Leu NH); 5.78′ (d, Leu NH); 5.31o (ddd, PrLeu6  -H); 5.27* (dd, -H); 5.27* (dd,  -H); 5.06-4.80; 4.65 (ddd, -H); 5.06-4.80; 4.65 (ddd,  -H); 4.47* (dd, MeLeu -H); 4.47* (dd, MeLeu  -H); 4.33 (m); 4.03, 4.01 (2s, N-OMe); 4.00 (ddd, -H); 4.33 (m); 4.03, 4.01 (2s, N-OMe); 4.00 (ddd,  -H); 3.75-3.20; 3.40 (s, N-Me); 3.20 (s, N-Me); 3.18* (s, MeAla N-Me); 2.91* (s, MeTrp MeMe); 2.53 (s, N-Me); 2.53o (s, MeLeu N-Me); 2.45-1.07; 1.53* (d, 7 Hz, MeAla -H); 3.75-3.20; 3.40 (s, N-Me); 3.20 (s, N-Me); 3.18* (s, MeAla N-Me); 2.91* (s, MeTrp MeMe); 2.53 (s, N-Me); 2.53o (s, MeLeu N-Me); 2.45-1.07; 1.53* (d, 7 Hz, MeAla  -Me); 1.49o (d, 7 Hz, MeAla -Me); 1.49o (d, 7 Hz, MeAla  -Me); 1.03* (d. 6.5 Hz, MeLeu -Me); 1.03* (d. 6.5 Hz, MeLeud-Me); 0.98-0.83; 0.79 (d, 6 Hz, Me); 0.74 (d, 6 Hz, Me); 0.55* (d, 6.6 Hz, Leu   -Me); 0.07* (d, 6.6 Hz, Leu -Me); 0.07* (d, 6.6 Hz, Leu   -Me); -0.36* (ddd, Leu -Me); -0.36* (ddd, Leu  -CH).
Пример 12.
(4 конформера 27:33:17:33 помечены *, o, ‘, ”): 8.9* (d, 10 Hz, PrLeu6 NH); 8.82′ (d, 10 Hz, PrLeu6 NH); 7.9* (d, 10 Hz, PrLeu2 NH); 7.86′ (d, 10 Hz, PrLeu2 NH); 7.76o (d, 10 Hz, PrLeu6 NH); 7.75” (d, 10 Hz, PrLeu6 NH); 7.24* (s, indole); 7.03* (dd, indole); 6.17” (d br, 10 Hz, Leu NH); 6.17o (d br, 10 Hz, Leu NH); 6.03′ (d, 6Hz, Leu NH); 5.98* (d, 6 Hz, Leu NH); 4.02” (s); 4.02o (s); 4.02* (s); 4.02′ (s); 3.40 (s, N-Me); 3.40 (s, N-Me); 3.20 (s, N-Me); 3.20 (s, N-Me); 3.17 (s, N-Me); 2.97 (s, N-Me); 2.94 (s, N-Me); 2.94 (s, N-Me); 2.93 (s, N-Me); 2.91 (s, N-Me); 2.56 (s, N-Me); 2.56 (s, N-Me); 2.53′ (s, MeLeu N-Me); 2.53* (s, MeLeu N-Me); 1.53* (d, 7 Hz, MeAla -CH).
Пример 12.
(4 конформера 27:33:17:33 помечены *, o, ‘, ”): 8.9* (d, 10 Hz, PrLeu6 NH); 8.82′ (d, 10 Hz, PrLeu6 NH); 7.9* (d, 10 Hz, PrLeu2 NH); 7.86′ (d, 10 Hz, PrLeu2 NH); 7.76o (d, 10 Hz, PrLeu6 NH); 7.75” (d, 10 Hz, PrLeu6 NH); 7.24* (s, indole); 7.03* (dd, indole); 6.17” (d br, 10 Hz, Leu NH); 6.17o (d br, 10 Hz, Leu NH); 6.03′ (d, 6Hz, Leu NH); 5.98* (d, 6 Hz, Leu NH); 4.02” (s); 4.02o (s); 4.02* (s); 4.02′ (s); 3.40 (s, N-Me); 3.40 (s, N-Me); 3.20 (s, N-Me); 3.20 (s, N-Me); 3.17 (s, N-Me); 2.97 (s, N-Me); 2.94 (s, N-Me); 2.94 (s, N-Me); 2.93 (s, N-Me); 2.91 (s, N-Me); 2.56 (s, N-Me); 2.56 (s, N-Me); 2.53′ (s, MeLeu N-Me); 2.53* (s, MeLeu N-Me); 1.53* (d, 7 Hz, MeAla  -Me); 1.53′ (d, 7 Hz, MeAla -Me); 1.53′ (d, 7 Hz, MeAla  -Me); 1.50o (d, 7 Hz, MeAla -Me); 1.50o (d, 7 Hz, MeAla  -Me); 1.50” (d, 7 Hz, MeAla -Me); 1.50” (d, 7 Hz, MeAla  -Me); 1.03′ (d, 6.5 Hz, MeLeu d-Me); 1.03* (d, 6.5 Hz, MeLeu d-Me); 0.78o (d, 6.6 Hz, Leu -Me); 1.03′ (d, 6.5 Hz, MeLeu d-Me); 1.03* (d, 6.5 Hz, MeLeu d-Me); 0.78o (d, 6.6 Hz, Leu   -Me); 0.77” (d, 6.6 Hz, Leu -Me); 0.77” (d, 6.6 Hz, Leu   -Me); 0.72” (d, 6.6 Hz, Leu -Me); 0.72” (d, 6.6 Hz, Leu   -Me); 0.72o (d, 6.6 Hz, Leu -Me); 0.72o (d, 6.6 Hz, Leu   -Me); 0.61′ (d, 6.6 Hz, Leu -Me); 0.61′ (d, 6.6 Hz, Leu   -Me); 0.55* (d, 6.6 Hz, Leu -Me); 0.55* (d, 6.6 Hz, Leu   -Me); 0.21′ (d, 6.6 Hz, Leu -Me); 0.21′ (d, 6.6 Hz, Leu   -Me); 0.12* (d, 6.6 Hz, Leu -Me); 0.12* (d, 6.6 Hz, Leu   -Me); -0.17′ (ddd, Leu -Me); -0.17′ (ddd, Leu  -CH); -0.31* (ddd, Leu -CH); -0.31* (ddd, Leu  -CH).
Пример 13.
(2 конформера 55: 45, основной и дополнит. конформеры помечены * и o): 8.80* (d, J = 10 Hz, NH); 7.88* (d, J = 10 Hz, NH); 7.77o (d, J = 10 Hz, NH); 7.57o (d, J = 10 Hz, NH); 7.52*, 7.51o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.39*, 7.37o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.20*o (m, MeMeOTrp, H-6′); 7.16o, 7.09* (2s, MeMeOTrp H-2′); 7.03*o (2dd, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.97* (d, J = 6 Hz, Leu NH); 5.31o (m. MeAla al-H); 5.11-4.96 (m, al-H); 4.92* (dd, MeMeOTrp al-H); 4.87 (ddd, al-H); 4.69o (m, Leu al-H); 4.47* (dd, MeLeu al-H); 4.27* (dd, Leu al-H); 4.03*, 4.02o (2s, N-OMe); 3.92 (dd); 3.65-3.15 (m); 3.47* (q, J = 7 Hz; MeAla al-H); 3.41o (s, N-Me); 3.21* (s, MeAla NMe); 3.20o (s, N-Me); 2.92* (s, MeMeOTrp N-Me); 2.53* (s, MeLeu N-Me); 2.51o (s, N-Me); 2.35-2.75 (m); 1.7-1.05 (m); 1.53* (d, J = 7 Hz, MeAla -CH).
Пример 13.
(2 конформера 55: 45, основной и дополнит. конформеры помечены * и o): 8.80* (d, J = 10 Hz, NH); 7.88* (d, J = 10 Hz, NH); 7.77o (d, J = 10 Hz, NH); 7.57o (d, J = 10 Hz, NH); 7.52*, 7.51o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.39*, 7.37o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.20*o (m, MeMeOTrp, H-6′); 7.16o, 7.09* (2s, MeMeOTrp H-2′); 7.03*o (2dd, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.97* (d, J = 6 Hz, Leu NH); 5.31o (m. MeAla al-H); 5.11-4.96 (m, al-H); 4.92* (dd, MeMeOTrp al-H); 4.87 (ddd, al-H); 4.69o (m, Leu al-H); 4.47* (dd, MeLeu al-H); 4.27* (dd, Leu al-H); 4.03*, 4.02o (2s, N-OMe); 3.92 (dd); 3.65-3.15 (m); 3.47* (q, J = 7 Hz; MeAla al-H); 3.41o (s, N-Me); 3.21* (s, MeAla NMe); 3.20o (s, N-Me); 2.92* (s, MeMeOTrp N-Me); 2.53* (s, MeLeu N-Me); 2.51o (s, N-Me); 2.35-2.75 (m); 1.7-1.05 (m); 1.53* (d, J = 7 Hz, MeAla  -Me); 1.49o (d, J = 7 Hz, MeAla -Me); 1.49o (d, J = 7 Hz, MeAla  -Me); 1.28*, 1.25*, 1.23o, 1.18o (4d, J = 6 Hz, COOCHMe2); 1.04 (d, J = 6.5 Hz, MeLeu Me); 0.98-0.83 (m); 0.55* (d, J = 6.6 Hz, Leu Me); 0.05* (d, J = 6.6, Leu Me); -0.31 (ddd, Leu -Me); 1.28*, 1.25*, 1.23o, 1.18o (4d, J = 6 Hz, COOCHMe2); 1.04 (d, J = 6.5 Hz, MeLeu Me); 0.98-0.83 (m); 0.55* (d, J = 6.6 Hz, Leu Me); 0.05* (d, J = 6.6, Leu Me); -0.31 (ddd, Leu  -CH).
Пример 14.
(3 конформера 55: 43: 2, помечены, *, o и ‘): 8.82* (d, J = 10 Hz, C9AANH); 7.85* (d, J = 10 Hz, C9AANH), 7.78o (d, J = 10 Hz, NH); 7.58o (d, J = 10 Hz, NH), 7.52*, 7.51o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.39*, 7.37o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.22*, 7.21o (2m, MeMeOTrp, H-6′); 7.14o, 7.08* (2s, MeMeOTrp H-2′); 7.03*o (2dd, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.95* (d, J = 6 Hz, Leu NH); 5.78′ (d, J = 10 Hz, Leu NH); 5.31o (ddd, MeAla al-H); 5.12* (dd, hydroxybutyric acid al-H); 5.05-4.98 (m, al-H); 4.91* (dd, MeMeOTrp al-H); 4.86* (ddd, C9AA al-H) 4.73-4.68 (m, Leu al-H); 4.47* (dd, MeLeu al-H); 4.32-4.26 (m, Leu al-H); 4.25 (dq, J = 11 Hz, J = 7 Hz, COOCH2-); 4.15-4.07 (m, COOCH2-); 4.04*, 4.03o (2s, N-OMe); 3.84 (m, al-H); 3.64-3.50 (m); 3.47* (q, J = 7 Hz, MeAla al-H); 3.41o (s, N-Me); 3.34o (dd, MeMeOTrp H- -CH).
Пример 14.
(3 конформера 55: 43: 2, помечены, *, o и ‘): 8.82* (d, J = 10 Hz, C9AANH); 7.85* (d, J = 10 Hz, C9AANH), 7.78o (d, J = 10 Hz, NH); 7.58o (d, J = 10 Hz, NH), 7.52*, 7.51o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.39*, 7.37o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.22*, 7.21o (2m, MeMeOTrp, H-6′); 7.14o, 7.08* (2s, MeMeOTrp H-2′); 7.03*o (2dd, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.95* (d, J = 6 Hz, Leu NH); 5.78′ (d, J = 10 Hz, Leu NH); 5.31o (ddd, MeAla al-H); 5.12* (dd, hydroxybutyric acid al-H); 5.05-4.98 (m, al-H); 4.91* (dd, MeMeOTrp al-H); 4.86* (ddd, C9AA al-H) 4.73-4.68 (m, Leu al-H); 4.47* (dd, MeLeu al-H); 4.32-4.26 (m, Leu al-H); 4.25 (dq, J = 11 Hz, J = 7 Hz, COOCH2-); 4.15-4.07 (m, COOCH2-); 4.04*, 4.03o (2s, N-OMe); 3.84 (m, al-H); 3.64-3.50 (m); 3.47* (q, J = 7 Hz, MeAla al-H); 3.41o (s, N-Me); 3.34o (dd, MeMeOTrp H- a); 3.22 (m, MeMeOTrp H- a); 3.22 (m, MeMeOTrp H- b); 3.20* (s, MeAla NMe); 3.19o (s, N-Me); 2.93* (s, MeMeOTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.4-2.1 (m); 2.05-1.9 (m); 1.83-1.76 (m); 1.7-1.07 (m); 1.53*, 1.49o (2d, J = 7 Hz, MeAla b); 3.20* (s, MeAla NMe); 3.19o (s, N-Me); 2.93* (s, MeMeOTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.4-2.1 (m); 2.05-1.9 (m); 1.83-1.76 (m); 1.7-1.07 (m); 1.53*, 1.49o (2d, J = 7 Hz, MeAla  -Me); 1.30, 1.25 (2t, J = 7 Hz, COOCH2CH3); 1.04 (d, J = 6.5 Hz, MeLeu Me); 1.00-0.84 (m); 0.55* (d, J = 6.6 Hz, Leu Me); 0.03* (d, J = 6.6 Hz, Leu Me); -0.32 (ddd, Leu -Me); 1.30, 1.25 (2t, J = 7 Hz, COOCH2CH3); 1.04 (d, J = 6.5 Hz, MeLeu Me); 1.00-0.84 (m); 0.55* (d, J = 6.6 Hz, Leu Me); 0.03* (d, J = 6.6 Hz, Leu Me); -0.32 (ddd, Leu  -CH).
Пример 15.
(3 конформера 57: 41: 2, помечены *, o и ‘): 8.82* (d, J = 10 Hz, C9AA NH); 7.90* (d, J = 10 Hz, C9AA NH); 7.78o (d, J = 10 Hz, NH); 7.58o (d, J = 10 Hz, NH); 7.52*o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.39*, 7.38o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.22*, 7.21o (2m, MeMeOTrp, H-6′); 7.14o, 7.08* (2s, MeMeOTrp H-2′); 7.03o, 7.02* (2m, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.98* (d, J = 6 Hz, Leu NH); 5.82′ (d, J = 10 Hz, Leu NH); 5.31o (ddd, MeAla al-H); 5.12* (dd, hydroxybutyric acid al-H); 5.05-4.98 (m, al-H); 4.91* (dd, MeMeOTrp al-H); 4.86* (ddd, C9AA al-H) 4.73-4.68 (m, Leu al-H); 4.47* (dd, MeLeu al-H); 4.28* (m, Leu al-H); 4.2-3.95 (m, COOCH2); 4.03*, 4.02o (2s, N-OMe); 3.90o (m, al-H); 3.64-3.42 (m); 3.47* (q, J = 7 Hz, MeAla al-H); 3.41o (s, N-Me); 3.34o (dd, MeMeOTrp H- -CH).
Пример 15.
(3 конформера 57: 41: 2, помечены *, o и ‘): 8.82* (d, J = 10 Hz, C9AA NH); 7.90* (d, J = 10 Hz, C9AA NH); 7.78o (d, J = 10 Hz, NH); 7.58o (d, J = 10 Hz, NH); 7.52*o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.39*, 7.38o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.22*, 7.21o (2m, MeMeOTrp, H-6′); 7.14o, 7.08* (2s, MeMeOTrp H-2′); 7.03o, 7.02* (2m, MeMeOTrp H-5′); 6.17o (d, J = 10 Hz, Leu NH); 5.98* (d, J = 6 Hz, Leu NH); 5.82′ (d, J = 10 Hz, Leu NH); 5.31o (ddd, MeAla al-H); 5.12* (dd, hydroxybutyric acid al-H); 5.05-4.98 (m, al-H); 4.91* (dd, MeMeOTrp al-H); 4.86* (ddd, C9AA al-H) 4.73-4.68 (m, Leu al-H); 4.47* (dd, MeLeu al-H); 4.28* (m, Leu al-H); 4.2-3.95 (m, COOCH2); 4.03*, 4.02o (2s, N-OMe); 3.90o (m, al-H); 3.64-3.42 (m); 3.47* (q, J = 7 Hz, MeAla al-H); 3.41o (s, N-Me); 3.34o (dd, MeMeOTrp H- a); 3.22 (m, MeMeOTrp H- a); 3.22 (m, MeMeOTrp H- b); 3.20*(s, MeAla NMe); 3.19o (s, N-Me); 2.93* (s, MeMeOTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.4-2.1 (m); 2.03-1.9 (m); 1.83-1.76 (m); 1.72-1.58 (m, COOCH2CH2CH3); 1.55-1.07 (m); 1.53*, 1.49o (2d, J = 7 Hz, MeAla b); 3.20*(s, MeAla NMe); 3.19o (s, N-Me); 2.93* (s, MeMeOTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.4-2.1 (m); 2.03-1.9 (m); 1.83-1.76 (m); 1.72-1.58 (m, COOCH2CH2CH3); 1.55-1.07 (m); 1.53*, 1.49o (2d, J = 7 Hz, MeAla  -Me); 1.04 (d, J = 6.5 Hz, MeLeu Me); 1.00-0.84 (m); 0.54* (d, J = 6.6 Hz, Leu Me); 0.02* (d, J = 6.6 Hz, Leu Me); -0.34 (ddd, Leu -Me); 1.04 (d, J = 6.5 Hz, MeLeu Me); 1.00-0.84 (m); 0.54* (d, J = 6.6 Hz, Leu Me); 0.02* (d, J = 6.6 Hz, Leu Me); -0.34 (ddd, Leu  -CH).
Пример 16.
(2 конформера 70:30, помечены * и o): 8.92*, 7.87, 7.75o, 7.58o (4d, J = 10 Hz, NH); 7.49* (d, J = 8 Hz, MeMeOTrp H-4′); 7.37* (d, J = 8 Hz, MeMeOTrp H-7′); 7.20* (dt, MeMeOTrp H-6′); 7.18o, 7.03* (2s, MeMeOTrp H-2′); 7.03o, 6.97* (2 dt, MeMeOTrp H-5′); 6.20o (d, J = 10 Hz, Leu NH); 5.96* (d, J = 7 Hz, Leu NH); 5.33* (m, hydroxybutyric acid al-H); 5.02 (m, al-H); 4.90* (dd, al-H); 4.83* (ddd, al-H); 4.79* (dd, al-H); 4.70o (m, al-H); 4.39* (dd, al-H); 4.38o (m, al-H); 4.03* (s, N-OMe); 3.92o (m); 3.63-3.53 (m); 3.44-3.40 (m); 3.39o, 3.20o (2s, NMe); 3.32-3.18 (m); 3.17* (s, MeAla NMe); 2.94* (s, MeMeOTrp NMe); 2.53* (s, MsLeu NMe); 2.52o (s, NMe); 2.5-2.3 (m); 2.1-1.1 (m); 2.17*, 2.11o (2s, COMe); 1.51*, 1.48o (2d, J = 7 Hz, MeAla -CH).
Пример 16.
(2 конформера 70:30, помечены * и o): 8.92*, 7.87, 7.75o, 7.58o (4d, J = 10 Hz, NH); 7.49* (d, J = 8 Hz, MeMeOTrp H-4′); 7.37* (d, J = 8 Hz, MeMeOTrp H-7′); 7.20* (dt, MeMeOTrp H-6′); 7.18o, 7.03* (2s, MeMeOTrp H-2′); 7.03o, 6.97* (2 dt, MeMeOTrp H-5′); 6.20o (d, J = 10 Hz, Leu NH); 5.96* (d, J = 7 Hz, Leu NH); 5.33* (m, hydroxybutyric acid al-H); 5.02 (m, al-H); 4.90* (dd, al-H); 4.83* (ddd, al-H); 4.79* (dd, al-H); 4.70o (m, al-H); 4.39* (dd, al-H); 4.38o (m, al-H); 4.03* (s, N-OMe); 3.92o (m); 3.63-3.53 (m); 3.44-3.40 (m); 3.39o, 3.20o (2s, NMe); 3.32-3.18 (m); 3.17* (s, MeAla NMe); 2.94* (s, MeMeOTrp NMe); 2.53* (s, MsLeu NMe); 2.52o (s, NMe); 2.5-2.3 (m); 2.1-1.1 (m); 2.17*, 2.11o (2s, COMe); 1.51*, 1.48o (2d, J = 7 Hz, MeAla  -Me); 1.03* (d, J = 6.5 Hz); 0.98-0.83 (m); 0.52*, -0.11* (d, J = 6.6 Hz, Leu Me); -0.39* (ddd, Leu -Me); 1.03* (d, J = 6.5 Hz); 0.98-0.83 (m); 0.52*, -0.11* (d, J = 6.6 Hz, Leu Me); -0.39* (ddd, Leu  -CH).
Пример 17.
(3 конформера 45: 40:15, помечены *, o, ‘): 8.78o (d, J = 9.9 Hz, NH); 7.83* (d, J = 9,7 Hz, NH); 7.76′ (d, NH); 7.59′ (d, J = 7.8 Hz, MeMeOTrp H-4′); 7.57 (d, J = 9.5 Hz, NH); 7.56, 7.53 (2d, J = 8 Hz, MeMeOTrp H-4′); 7.46′ (s, MeMeOTrp H-2′); 7.42*, 7.39o, 7.34′ (3d, J = 8.2 Hz, MeMeOTrp H-7′); 7.24*, 7.22o, 7.18′ (3t, MeMeOTrp H-6′); 7.11*, 7.08′, 7.06o (3t, MeMeOTrp H-5′); 7.04*, 7.03o (2s, MeMeOTrp H-2′); 6.25o (d, J = 9.5 Hz, Leu NH); 6.03* (d, J = 7 Hz, Leu NH); 5.99′ (d, J = 8.8 Hz, Leu NH); 5.28* (m, al-H); 5.13′ (t, J = 4 Hz, OH); 5.09-4.98 (m, al-H); 5.02 (t, J = 4 Hz, OH); 4.97 (dd, al-H), 4.88 (dd, al-H); 4.84 (m, al-H); 4.78-4.70 (m, al-H); 4.41 (dd, MeLeu al-H); 4.18 (ddd, Leu al-H); 4.04, 4.02 (2s, N-OMe); 3.78 (m, al-H); 3.65-3.35 (m); 3.42o, 3.32′, 3.22*, 3.20o (4s, NMe); 3.17-3.08 (m); 3.03′, 2.92′, 2.90*, 2.52*, 2.51o (5s, NMe); 2.01-1.1 (m); 1.53, 1.49, 1.40′ (3d, J = 7 Hz, MeAla -CH).
Пример 17.
(3 конформера 45: 40:15, помечены *, o, ‘): 8.78o (d, J = 9.9 Hz, NH); 7.83* (d, J = 9,7 Hz, NH); 7.76′ (d, NH); 7.59′ (d, J = 7.8 Hz, MeMeOTrp H-4′); 7.57 (d, J = 9.5 Hz, NH); 7.56, 7.53 (2d, J = 8 Hz, MeMeOTrp H-4′); 7.46′ (s, MeMeOTrp H-2′); 7.42*, 7.39o, 7.34′ (3d, J = 8.2 Hz, MeMeOTrp H-7′); 7.24*, 7.22o, 7.18′ (3t, MeMeOTrp H-6′); 7.11*, 7.08′, 7.06o (3t, MeMeOTrp H-5′); 7.04*, 7.03o (2s, MeMeOTrp H-2′); 6.25o (d, J = 9.5 Hz, Leu NH); 6.03* (d, J = 7 Hz, Leu NH); 5.99′ (d, J = 8.8 Hz, Leu NH); 5.28* (m, al-H); 5.13′ (t, J = 4 Hz, OH); 5.09-4.98 (m, al-H); 5.02 (t, J = 4 Hz, OH); 4.97 (dd, al-H), 4.88 (dd, al-H); 4.84 (m, al-H); 4.78-4.70 (m, al-H); 4.41 (dd, MeLeu al-H); 4.18 (ddd, Leu al-H); 4.04, 4.02 (2s, N-OMe); 3.78 (m, al-H); 3.65-3.35 (m); 3.42o, 3.32′, 3.22*, 3.20o (4s, NMe); 3.17-3.08 (m); 3.03′, 2.92′, 2.90*, 2.52*, 2.51o (5s, NMe); 2.01-1.1 (m); 1.53, 1.49, 1.40′ (3d, J = 7 Hz, MeAla  -Me); 1.04 (d, J = 6.5 Hz); 0.98-0.83 (m); 0.72′, 0.60*, 0.56′, 0.03* (4d, J = 6.6 Hz, Leu Me); -0.16 (ddd, Leu -Me); 1.04 (d, J = 6.5 Hz); 0.98-0.83 (m); 0.72′, 0.60*, 0.56′, 0.03* (4d, J = 6.6 Hz, Leu Me); -0.16 (ddd, Leu  -CH).
Пример 18.
(3 конформера 73: 20: 7, помечены *, o, ‘): 8.54o (d, J = 10 Hz, NH); 8.38′ (s br, MeTrp N’-H); 8.26*, 8.17o (2d br, J = 2 Hz, MeTrp N’-H); 8.13*, 8.03o, 8.01′ (3d, J = 9.7 Hz, NH); 7.78* (d, J = 7.7 Hz, MeTrp H-4′); 7.74′, 7.70′, 7.63o, 7.63o (4d); 7.46*, 7.44o, 7.40′ (3d, J = 8 Hz MeTrp H-7′); 7.27* (dt, MeTrp H-6′); 7.20*, 7.17o (2dt, MeTrp H-5′); 7.09o, 7.03* (2d, J = 2 Hz, MeTrp H-2′); 6.33o (d, J = 10 Hz, Leu NH); 6.17* (d, J = 7.4 Hz, Leu NH); 5.97′ (d, J = 9 Hz, Leu NH); 5.38o (m, al-H); 5.27* (dd, hydroxybutyric acid al-H); 5.21o (dd, al-H); 5.12* (ddd, al-H); 5.07* (dd, al-H); 4.96* (ddd, al-H); 4.87 (m); 4.55* (dd, MeLeu al-H); 4.29* (ddd, Leu al-H); 3.85-3.25 (m); 3.76* (q, J = 7 Hz, MeAla al-H); 3.49o, 3.36′ (2s, NMe); 3.13* (s, MeAla NMe); 3.29o, 3.13′ (2s NMe); 3.02* (s, MeTrp NMe); 2.62o (s, NMe); 2.60* (s, MeLeu NMe); 2.38-1.15 (m); 1.62*, 1.56o, 1.51′ (3d, J = 7 Hz, MeAla -CH).
Пример 18.
(3 конформера 73: 20: 7, помечены *, o, ‘): 8.54o (d, J = 10 Hz, NH); 8.38′ (s br, MeTrp N’-H); 8.26*, 8.17o (2d br, J = 2 Hz, MeTrp N’-H); 8.13*, 8.03o, 8.01′ (3d, J = 9.7 Hz, NH); 7.78* (d, J = 7.7 Hz, MeTrp H-4′); 7.74′, 7.70′, 7.63o, 7.63o (4d); 7.46*, 7.44o, 7.40′ (3d, J = 8 Hz MeTrp H-7′); 7.27* (dt, MeTrp H-6′); 7.20*, 7.17o (2dt, MeTrp H-5′); 7.09o, 7.03* (2d, J = 2 Hz, MeTrp H-2′); 6.33o (d, J = 10 Hz, Leu NH); 6.17* (d, J = 7.4 Hz, Leu NH); 5.97′ (d, J = 9 Hz, Leu NH); 5.38o (m, al-H); 5.27* (dd, hydroxybutyric acid al-H); 5.21o (dd, al-H); 5.12* (ddd, al-H); 5.07* (dd, al-H); 4.96* (ddd, al-H); 4.87 (m); 4.55* (dd, MeLeu al-H); 4.29* (ddd, Leu al-H); 3.85-3.25 (m); 3.76* (q, J = 7 Hz, MeAla al-H); 3.49o, 3.36′ (2s, NMe); 3.13* (s, MeAla NMe); 3.29o, 3.13′ (2s NMe); 3.02* (s, MeTrp NMe); 2.62o (s, NMe); 2.60* (s, MeLeu NMe); 2.38-1.15 (m); 1.62*, 1.56o, 1.51′ (3d, J = 7 Hz, MeAla  -Me); 1.13* (d, J = 6.5 Hz MeLeu); 1.07-0.93 (m); 0.73′, 0.63*, 0.58′, 0.02* (4d, J = 6.6 Hz, Leu Me); -0.28* (ddd, Leu -Me); 1.13* (d, J = 6.5 Hz MeLeu); 1.07-0.93 (m); 0.73′, 0.63*, 0.58′, 0.02* (4d, J = 6.6 Hz, Leu Me); -0.28* (ddd, Leu  -CH).
Пример 19.
(3 конформера 67:29:4, помечены *, o и ‘): 9.52* (t, J = 1.5 Hz, CHO); 9.41o (t, J = 1 Hz, CHO); 9.05′ (m, CHO); 8.73* (d, J = 10 Hz, C9AA NH); 7.86* (d, J = 10 Hz, C9AA NH); 7.77o (d, J = 10 Hz, NH); 7.60o (d, J = 10 Hz, NH); 7.47*o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.38*o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.20*o (2t, MeMeOTrp, H-6′); 7.15o, 7.04* (2s, MeMeOTrp H-2′); 7.03o (m, MeMeOTrp H-5′); 7.00* (dd, MeMeOTrp H-5); 6.22o (d, J = 10 Hz, Leu NH); 6.02* (d, J = 6 Hz, Leu NH); 5.87′ (d, J = 10 Hz, Leu NH); 5.29o (ddd, MeAla al-H); 5.17* (dd, hydroxybutyric acid al-H); 5.03-4.93 (m, al-H); 4.91* (dd, MeMeOTrp al-H); 4.84* (ddd, C9AA al-H); 4.79-4.64o (m, Leu al-H); 4.43* (dd, MeLeu al-H); 4.35* (ddd, Leu al-H); 4.04′, 4.03*, 4.02o (3s, N-OMe); 3.81o (m, al-H); 3.63o (dd); 3.57-3.50 (m); 3.48-3.42 (m); 3.43* (q, J = 7 Hz, MeAla al-H); 3.38o (s, N-Me); 3.30-3.12 (m); 3.20o (s, N-Me); 3.15* (s, MeAla NMe); 2.93* (s, MeMeOTrp N-Me); 2.58o (s, N-Me); 2.53* (s, MeLeu N-Me); 2.25 (m, CH2-CHO); 2.15-1.9 (m); 1.85-1.74 (m); 1.65-1.08 (m); 1.48*, 1.45o (2d, J = 7 Hz, MeAla -CH).
Пример 19.
(3 конформера 67:29:4, помечены *, o и ‘): 9.52* (t, J = 1.5 Hz, CHO); 9.41o (t, J = 1 Hz, CHO); 9.05′ (m, CHO); 8.73* (d, J = 10 Hz, C9AA NH); 7.86* (d, J = 10 Hz, C9AA NH); 7.77o (d, J = 10 Hz, NH); 7.60o (d, J = 10 Hz, NH); 7.47*o (2d, J = 7 Hz, MeMeOTrp H-4′); 7.38*o (2d, J = 8 Hz, MeMeOTrp H-7′); 7.20*o (2t, MeMeOTrp, H-6′); 7.15o, 7.04* (2s, MeMeOTrp H-2′); 7.03o (m, MeMeOTrp H-5′); 7.00* (dd, MeMeOTrp H-5); 6.22o (d, J = 10 Hz, Leu NH); 6.02* (d, J = 6 Hz, Leu NH); 5.87′ (d, J = 10 Hz, Leu NH); 5.29o (ddd, MeAla al-H); 5.17* (dd, hydroxybutyric acid al-H); 5.03-4.93 (m, al-H); 4.91* (dd, MeMeOTrp al-H); 4.84* (ddd, C9AA al-H); 4.79-4.64o (m, Leu al-H); 4.43* (dd, MeLeu al-H); 4.35* (ddd, Leu al-H); 4.04′, 4.03*, 4.02o (3s, N-OMe); 3.81o (m, al-H); 3.63o (dd); 3.57-3.50 (m); 3.48-3.42 (m); 3.43* (q, J = 7 Hz, MeAla al-H); 3.38o (s, N-Me); 3.30-3.12 (m); 3.20o (s, N-Me); 3.15* (s, MeAla NMe); 2.93* (s, MeMeOTrp N-Me); 2.58o (s, N-Me); 2.53* (s, MeLeu N-Me); 2.25 (m, CH2-CHO); 2.15-1.9 (m); 1.85-1.74 (m); 1.65-1.08 (m); 1.48*, 1.45o (2d, J = 7 Hz, MeAla  -Me); 1.04* (d, J = 6.5 Hz, MeLeu Me); 0.98-0.83 (m); 0.67′, 0.58*, 0.52′, 0.01* (4d, J = 6.6 Hz, Leu Me); – 0.20* (ddd, Leu -Me); 1.04* (d, J = 6.5 Hz, MeLeu Me); 0.98-0.83 (m); 0.67′, 0.58*, 0.52′, 0.01* (4d, J = 6.6 Hz, Leu Me); – 0.20* (ddd, Leu  -CH).
Пример 20.
(2 конформера 1: 1): 8.77 (d, J = 10 Hz, C9AA NH); 7.79 (d, J = 10 Hz, C9AA NH); 7.73 (d, J = 10 Hz, NH); 7.65 (d, J = 10 Hz, NH); 7.44, 7.44, 7.42, 7.39 (4d, MeMeOTrp H-4′ and H-7′); 7.25, 7.22 (2t, MeMeOTrp, H-6′); 7.13-7.03 (m, MeMeOTrp H-5′); 7.02, 6.98 (2s, MeMeOTrp H-2′); 6.19 (d, J = 10 Hz, Leu NH); 6.00 (d, J = 6 Hz, Leu NH); 5.80-5.53 (m, olefin-H); 5.31 (ddd, MeAla al-H); 5.08-4.67 (m, al-H, olefin-H); 4.47 (dd, MeLeu al-H); 4.15-3.98 (m); 4.05, 4.02 (2s, N-OMe); 3.7-3.0 (m); 3.44, 3.21, 3.20, 2.92, 2.52, 2.44 (6s, N-Me); 2.15-1.90 (m); 1.90-1.08 (m); 1.55, 1.50 (2d, J = 7 Hz, MeAla -CH).
Пример 20.
(2 конформера 1: 1): 8.77 (d, J = 10 Hz, C9AA NH); 7.79 (d, J = 10 Hz, C9AA NH); 7.73 (d, J = 10 Hz, NH); 7.65 (d, J = 10 Hz, NH); 7.44, 7.44, 7.42, 7.39 (4d, MeMeOTrp H-4′ and H-7′); 7.25, 7.22 (2t, MeMeOTrp, H-6′); 7.13-7.03 (m, MeMeOTrp H-5′); 7.02, 6.98 (2s, MeMeOTrp H-2′); 6.19 (d, J = 10 Hz, Leu NH); 6.00 (d, J = 6 Hz, Leu NH); 5.80-5.53 (m, olefin-H); 5.31 (ddd, MeAla al-H); 5.08-4.67 (m, al-H, olefin-H); 4.47 (dd, MeLeu al-H); 4.15-3.98 (m); 4.05, 4.02 (2s, N-OMe); 3.7-3.0 (m); 3.44, 3.21, 3.20, 2.92, 2.52, 2.44 (6s, N-Me); 2.15-1.90 (m); 1.90-1.08 (m); 1.55, 1.50 (2d, J = 7 Hz, MeAla  -Me); 1.05 (d, J = 6.5 Hz, MeLeu Me); 1.0-0.8 (m); 0.60, 0.06 (2d, J = 6.6 Hz, Leu Me); -0.20 (ddd, Leu -Me); 1.05 (d, J = 6.5 Hz, MeLeu Me); 1.0-0.8 (m); 0.60, 0.06 (2d, J = 6.6 Hz, Leu Me); -0.20 (ddd, Leu  -CH).
Пример 21.
(3 конформера 44: 53:3 помечены *, o, ‘): 8.81* (d, 10 Hz, PrLeu6 NH); 7.78, 7.73, 7.67 (3d, 10 Hz, NH); 7.43, 7.42 (2d, 8 Hz, indole H-4′); 7.37 (d, 8 Hz, indole H-7′); 7.28-7.00; 7.02, 6.97 (2s, indole H-2′); 6.21o (d, 10 Hz, Leu NH); 5.97* (d, 6 Hz, Leu NH); 5.75′ (d, Leu NH); 5.50-4.65; 4.47* (dd, MeLeu -CH).
Пример 21.
(3 конформера 44: 53:3 помечены *, o, ‘): 8.81* (d, 10 Hz, PrLeu6 NH); 7.78, 7.73, 7.67 (3d, 10 Hz, NH); 7.43, 7.42 (2d, 8 Hz, indole H-4′); 7.37 (d, 8 Hz, indole H-7′); 7.28-7.00; 7.02, 6.97 (2s, indole H-2′); 6.21o (d, 10 Hz, Leu NH); 5.97* (d, 6 Hz, Leu NH); 5.75′ (d, Leu NH); 5.50-4.65; 4.47* (dd, MeLeu  -H); 4.05 (ddd, -H); 4.05 (ddd,  -H); 4.04 (s, OMe); 4.02 (s, OMe); 3.65-3.10; 3.44o (s, MeAla N-Me); 3.22 (s, MeAla N-Me); 3.19 (s, N-Me); 2.93* (s, MeTrp N-Me); 2.52, 2.39 (2s, N-Me); 2.15-0.82; 1.54*, 1.50o (2d, 7 Hz, MaAla -H); 4.04 (s, OMe); 4.02 (s, OMe); 3.65-3.10; 3.44o (s, MeAla N-Me); 3.22 (s, MeAla N-Me); 3.19 (s, N-Me); 2.93* (s, MeTrp N-Me); 2.52, 2.39 (2s, N-Me); 2.15-0.82; 1.54*, 1.50o (2d, 7 Hz, MaAla  -Me); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.57* (d, 6.6 Hz, Leu -Me); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.57* (d, 6.6 Hz, Leu   -Me); 0.48′ (d, Leu -Me); 0.48′ (d, Leu   -Me); 0.26′ (d, Leu -Me); 0.26′ (d, Leu   -Me); -0.04* (d, 6.6 Hz, Leu -Me); -0.04* (d, 6.6 Hz, Leu   -Me).
Пример 22.
(3 конформера 47:48:5, помечены *, o, ‘): 8.63, 7.87, 7.77, 7.63 (4d, 10 Hz, PrLeu NH); 7.49* (d, 7 Hz, indole H-4′); 7.48o (d, 7 Hz, indole H-4′); 7.43* (d, 8 Hz, indole H-7′); 7.41o (d, 8 Hz, indole H-7′); 7.27* (dd, indole H-6′); 7.23o (dd, indole H-6′); 7.13* (dd, indole H-5′); 7.08o (dd, indole H-5′); 7.04o (s, indole H-2′); 7.02* (s, indole H-2′); 6.98′ (s, indole H-2′); 6.2o (d, 10 Hz, Leu NH); 6.01* (d, 7 Hz, Leu NH); 5.79′ (d, 9 Hz, Leu NH); 5.30o (ddd, PrLeu6 -Me).
Пример 22.
(3 конформера 47:48:5, помечены *, o, ‘): 8.63, 7.87, 7.77, 7.63 (4d, 10 Hz, PrLeu NH); 7.49* (d, 7 Hz, indole H-4′); 7.48o (d, 7 Hz, indole H-4′); 7.43* (d, 8 Hz, indole H-7′); 7.41o (d, 8 Hz, indole H-7′); 7.27* (dd, indole H-6′); 7.23o (dd, indole H-6′); 7.13* (dd, indole H-5′); 7.08o (dd, indole H-5′); 7.04o (s, indole H-2′); 7.02* (s, indole H-2′); 6.98′ (s, indole H-2′); 6.2o (d, 10 Hz, Leu NH); 6.01* (d, 7 Hz, Leu NH); 5.79′ (d, 9 Hz, Leu NH); 5.30o (ddd, PrLeu6  -H); 5.07* (dd, Hba -H); 5.07* (dd, Hba  -H); 5.03* (ddd, PrLeu6 -H); 5.03* (ddd, PrLeu6  -H); 4.86* (ddd, PrLeu2 -H); 4.86* (ddd, PrLeu2  -H); 4.79 (dd, MeTrp -H); 4.79 (dd, MeTrp  -H); 4.47* (dd, MeLeu -H); 4.47* (dd, MeLeu  -H); 4.18* (ddd, Leu -H); 4.18* (ddd, Leu  -H); 4.06 (s, N-OMe); 4.05′ (s, N-OMe); 4.03 (s, N-OMe); 3.71-3.50; 3.42 (s, N-Me); 3.23-3.05; 3.20 (s, N-Me); 3.18 (s, N-Me); 2.92 (s, N-Me); 2.52 (s, N-Me); 2.51 (s, N-Me); 2.03-1.08; 1.54* (d, 7 Hz, MeAla -H); 4.06 (s, N-OMe); 4.05′ (s, N-OMe); 4.03 (s, N-OMe); 3.71-3.50; 3.42 (s, N-Me); 3.23-3.05; 3.20 (s, N-Me); 3.18 (s, N-Me); 2.92 (s, N-Me); 2.52 (s, N-Me); 2.51 (s, N-Me); 2.03-1.08; 1.54* (d, 7 Hz, MeAla  -Me); 1.50o (d, 7 Hz, MeAla -Me); 1.50o (d, 7 Hz, MeAla  -Me); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.84; 0.63* (d, 6.6 Hz, Leu -Me); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.84; 0.63* (d, 6.6 Hz, Leu   -Me); 0.53′ (d, 7 Hz, Leu -Me); 0.53′ (d, 7 Hz, Leu   -Me); 0.34′ (d, 7 Hz, Leu -Me); 0.34′ (d, 7 Hz, Leu   -Me); 0.11* (d, 6.6 Hz, Leu -Me); 0.11* (d, 6.6 Hz, Leu   -Me); -0.13* (ddd, Leu -Me); -0.13* (ddd, Leu  -CH).
Пример 23.
[3 конформера 40:40:20, помечены *, o, ‘): 8.50* (d, 10 Hz, PrLeu6 NH); 8.20 (m); 7.98* (d, 10 Hz, PrLeu2 NH); 7.57* (d, 8 Hz, indole H-4′); 7.53-7.35; 7.25-7.18; 7.23* (s, indole H-2′); 7.13-7.06; 7.05o (s, indole H-2′); 6.69 (d); 6.29 (d, br); 6.22 (d, br); 6.14o (d, 7 Hz, Leu NH); 6.07* (d, 9 Hz, Leu NH); 5.5o (ddd, PrLeu6 -CH).
Пример 23.
[3 конформера 40:40:20, помечены *, o, ‘): 8.50* (d, 10 Hz, PrLeu6 NH); 8.20 (m); 7.98* (d, 10 Hz, PrLeu2 NH); 7.57* (d, 8 Hz, indole H-4′); 7.53-7.35; 7.25-7.18; 7.23* (s, indole H-2′); 7.13-7.06; 7.05o (s, indole H-2′); 6.69 (d); 6.29 (d, br); 6.22 (d, br); 6.14o (d, 7 Hz, Leu NH); 6.07* (d, 9 Hz, Leu NH); 5.5o (ddd, PrLeu6  -H); 5.26-4.63 (m, -H); 5.26-4.63 (m,  -H); 4.36 (m, MeLeu -H); 4.36 (m, MeLeu  -H); 4.18* (ddd, Leu -H); 4.18* (ddd, Leu  -H); 4.04 (s, OMe); 4.03′ (s, OMe,); 4.02 (s, OMe); 3.68-2.78; 3.34 (s, N-Me); 3.19 (s, N-Me); 3.12 (s, N-Me); 3.03 (s, N-Me); 2.91 (s, N-Me); 2.53 (s, N-Me); 2.10-1.05; 1.03-0.78; 0.76 (d); 0.71 (d, 6.5 Hz, Leu g-Me); 0.60 (d, 6.6 Hz, Leu g-Me); 0.08 (d, 6.6 Hz, Leu g-Me); -0.10 (ddd, Leu -H); 4.04 (s, OMe); 4.03′ (s, OMe,); 4.02 (s, OMe); 3.68-2.78; 3.34 (s, N-Me); 3.19 (s, N-Me); 3.12 (s, N-Me); 3.03 (s, N-Me); 2.91 (s, N-Me); 2.53 (s, N-Me); 2.10-1.05; 1.03-0.78; 0.76 (d); 0.71 (d, 6.5 Hz, Leu g-Me); 0.60 (d, 6.6 Hz, Leu g-Me); 0.08 (d, 6.6 Hz, Leu g-Me); -0.10 (ddd, Leu  -CH).
Пример 24.
(3 конформера 43:47:5, помечены *, o и ‘): 8.68* (d, 10 Hz, PrLeu6 NH); 7.87* (d, 10 Hz, PrLeu2 NH); 7.80o (d, 10 Hz, NH); 7.63o (d, 10 Hz, NH); 7.55-7.37 (m, indole); 7.27-7.10 (m, indole); 7.08o (s, indole H-2′); 7.03* (s, indole H-2′); 6.58 (t, 8 Hz C=C); 6.23 (t, 8 Hz C=C); 6.18o (d, 6.7 Hz, Leu NH); 6.03* (d, 10 Hz, Leu NH), 5.80′ (d. Leu NH); 5.31o (ddd, PrLeu6 -CH).
Пример 24.
(3 конформера 43:47:5, помечены *, o и ‘): 8.68* (d, 10 Hz, PrLeu6 NH); 7.87* (d, 10 Hz, PrLeu2 NH); 7.80o (d, 10 Hz, NH); 7.63o (d, 10 Hz, NH); 7.55-7.37 (m, indole); 7.27-7.10 (m, indole); 7.08o (s, indole H-2′); 7.03* (s, indole H-2′); 6.58 (t, 8 Hz C=C); 6.23 (t, 8 Hz C=C); 6.18o (d, 6.7 Hz, Leu NH); 6.03* (d, 10 Hz, Leu NH), 5.80′ (d. Leu NH); 5.31o (ddd, PrLeu6  -H); 5.08-4.91 ( -H); 5.08-4.91 ( -H); 4.86* (add, PrLeu2 -H); 4.86* (add, PrLeu2  -H); 4.77-4.68 M, -H); 4.77-4.68 M,  -H); 4.46* (dd, MeLeu -H); 4.46* (dd, MeLeu  -H); 4.14* (ddd, Leu -H); 4.14* (ddd, Leu  -H); 4.05o (s, OMe); 4.03* (s, OMe); 4.02′ (s, OMe, ); 3.71o (q, 7 Hz, MeAla -H); 4.05o (s, OMe); 4.03* (s, OMe); 4.02′ (s, OMe, ); 3.71o (q, 7 Hz, MeAla  -H); 3.60* (q, 7 Hz, MeAla -H); 3.60* (q, 7 Hz, MeAla  -H); 3.53-3.00; 3.44o (s, MeAla N-Me); 3.23 (s, N-Me); 3.20 (s, N-Me); 2.93* (s, MeTrp N-Me); 2.52 (s, N-Me); 2.44 (s, N-Me); 2.20-0.83; 1.56* (d, 7 Hz, MeAla -H); 3.53-3.00; 3.44o (s, MeAla N-Me); 3.23 (s, N-Me); 3.20 (s, N-Me); 2.93* (s, MeTrp N-Me); 2.52 (s, N-Me); 2.44 (s, N-Me); 2.20-0.83; 1.56* (d, 7 Hz, MeAla  -Me); 1.51o (d, 7 Hz, MeAla -Me); 1.51o (d, 7 Hz, MeAla  -Me); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.62* (d, 6.6 Hz, Leu -Me); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.62* (d, 6.6 Hz, Leu   -Me); 0.57′ (d, Leu -Me); 0.57′ (d, Leu   -Me); 0.40′ (d, Leu -Me); 0.40′ (d, Leu   -Me); 0.10* (d, 6.6 Hz, Leu -Me); 0.10* (d, 6.6 Hz, Leu   -Me); -0.17* (ddd, Leu -Me); -0.17* (ddd, Leu  -CH).
Пример 25.
(3 конформера 51:45:4, помечены *, o и ‘): 8.68* (d, 10 Hz, PrLeu6 NH); 7.87* (d, 10 Hz, PrLeu2 NH); 7.81o (d, 10 Hz, PrLeu6 NH); 7.63o (d, 10 Hz, PrLeu2 NH); 7.53 (d, 8 Hz, indole H-4′); 7.51 (d, 8 Hz, indole H-4′); 7.43 (d, 8 Hz, indole H-7′); 7.40 (d, 8 Hz, indole H-7′); 7.26 (dd, indole H-6′); 7.23 (dd, indole H-6′); 7.13 (dd, indole H-5′); 7.07o (s, indole H-2′); 7.07 (dd, indole H-5′); 7.03* (s, indole H-2′); 6.21o (d, 10 Hz, Leu NH); 6.05* (d, 6 Hz, Leu NH); 5.79′ (d. 10 Hz, Leu NH); 5.32o (ddd, PrLeu6 -CH).
Пример 25.
(3 конформера 51:45:4, помечены *, o и ‘): 8.68* (d, 10 Hz, PrLeu6 NH); 7.87* (d, 10 Hz, PrLeu2 NH); 7.81o (d, 10 Hz, PrLeu6 NH); 7.63o (d, 10 Hz, PrLeu2 NH); 7.53 (d, 8 Hz, indole H-4′); 7.51 (d, 8 Hz, indole H-4′); 7.43 (d, 8 Hz, indole H-7′); 7.40 (d, 8 Hz, indole H-7′); 7.26 (dd, indole H-6′); 7.23 (dd, indole H-6′); 7.13 (dd, indole H-5′); 7.07o (s, indole H-2′); 7.07 (dd, indole H-5′); 7.03* (s, indole H-2′); 6.21o (d, 10 Hz, Leu NH); 6.05* (d, 6 Hz, Leu NH); 5.79′ (d. 10 Hz, Leu NH); 5.32o (ddd, PrLeu6  -H); 5.14* (dd, Hba -H); 5.14* (dd, Hba  -H);) 5.03* (ddd, PrLeu6 -H);) 5.03* (ddd, PrLeu6  -H); 4.87* (ddd, PrLeu2 -H); 4.87* (ddd, PrLeu2  -H); 4.83* (dd, MeTrp -H); 4.83* (dd, MeTrp  -H); 4.77o (ddd, Leu -H); 4.77o (ddd, Leu  – H); 4.51* (dd, MeLeu – H); 4.51* (dd, MeLeu  -H); 4.13* (ddd, Leu -H); 4.13* (ddd, Leu  -H); 4.06o (s, OMe); 4.03* (s, OMe); 3.68*(m); 3.57* (q, 7 Hz, MeAla -H); 4.06o (s, OMe); 4.03* (s, OMe); 3.68*(m); 3.57* (q, 7 Hz, MeAla  -H); 3.44o (s, MeAla N-Me); 3.36* (dd, MeTrp -H); 3.44o (s, MeAla N-Me); 3.36* (dd, MeTrp  -Ha); 3.23 (dd, MeTrp -Ha); 3.23 (dd, MeTrp  -Hb); 3.22 (s, N-Me); 3.17 (s, N-Me); 3.14 (dd); 2.96 (m, CCH); 2.93* (s, MeTrp N-Me); 2.53 (s, N-Me); 2.49 (s, N-Me); 2.25-1.97; 1.86-1.78; 1.55* (d, 7 Hz, MeAla -Hb); 3.22 (s, N-Me); 3.17 (s, N-Me); 3.14 (dd); 2.96 (m, CCH); 2.93* (s, MeTrp N-Me); 2.53 (s, N-Me); 2.49 (s, N-Me); 2.25-1.97; 1.86-1.78; 1.55* (d, 7 Hz, MeAla  -Me); 1.52o (d, 7 Hz, MeAla -Me); 1.52o (d, 7 Hz, MeAla  -Me); 1.50-1.09; 1.06* (d, 6.5 Hz, MeLeu d-Me); 1.00-0.85; 0.63* (d, 6.6 Hz, Leu -Me); 1.50-1.09; 1.06* (d, 6.5 Hz, MeLeu d-Me); 1.00-0.85; 0.63* (d, 6.6 Hz, Leu   -Me); 0.58′ (d, Leu -Me); 0.58′ (d, Leu   -Me); 0.38′ (d, Leu -Me); 0.38′ (d, Leu   -Me); 0.07* (d, 6.6 Hz, Leu -Me); 0.07* (d, 6.6 Hz, Leu   -Me); -0.11* (ddd, Leu -Me); -0.11* (ddd, Leu  -CH).
(смесь E/Z изомеров 6: 4 в виде трех конформеров, имеющих один характерный сигнал): 8.61, 8.48, 7.93, 7.84, 7.82. 7.74, (d, 10 Hz, PrLeu NH); 7.52 (d, 8 Hz, indole); 7.08 (s, indole H-2′), 6.44, 6.22 (2dt, CH=CHCN); 6.36-6.26 (m); 6.13, 6.07, 5.87 (3d, Leu NH); 5.33-5.28 (m); 5.24, 5.20 (2dm, CH= CHCN); 5.06-4.97.(m); 4.92 (2d); 4.87-4.75 (m); 4.49, 4.46 (2dd, MeLeu -CH).
(смесь E/Z изомеров 6: 4 в виде трех конформеров, имеющих один характерный сигнал): 8.61, 8.48, 7.93, 7.84, 7.82. 7.74, (d, 10 Hz, PrLeu NH); 7.52 (d, 8 Hz, indole); 7.08 (s, indole H-2′), 6.44, 6.22 (2dt, CH=CHCN); 6.36-6.26 (m); 6.13, 6.07, 5.87 (3d, Leu NH); 5.33-5.28 (m); 5.24, 5.20 (2dm, CH= CHCN); 5.06-4.97.(m); 4.92 (2d); 4.87-4.75 (m); 4.49, 4.46 (2dd, MeLeu  -H); 4.28, 4.18 (2ddd, Leu -H); 4.28, 4.18 (2ddd, Leu  -H); 4.07, 4.06, 4.05, 4.03 (4s, N-OMe); 3.88, 3.82 (2q, 7 Hz, MeAla -H); 4.07, 4.06, 4.05, 4.03 (4s, N-OMe); 3.88, 3.82 (2q, 7 Hz, MeAla  -H); 3.43, 3.40, 3.23, 3.21, 3.19, 3.12, 2.93, 2.55, 2.53, 2.52, 2.51 (11s, N-Me); 1.54-1.49 (5d, MeAla -H); 3.43, 3.40, 3.23, 3.21, 3.19, 3.12, 2.93, 2.55, 2.53, 2.52, 2.51 (11s, N-Me); 1.54-1.49 (5d, MeAla  -Me); 1.06, 1.04 (2d, 7 Hz, MeLeu d-Me); 0.74, 0.65, 0.52, 0.26, 0.08 (5d, Leu g-Me); -0.04 (ddd, Leu -Me); 1.06, 1.04 (2d, 7 Hz, MeLeu d-Me); 0.74, 0.65, 0.52, 0.26, 0.08 (5d, Leu g-Me); -0.04 (ddd, Leu  -CH).
Пример 27.
(3 конформера 51: 46:3 помечены *, o, ‘): 8.71* (d, 10 Hz, PrLeu6 NH); 7.90* (d, 10 Hz, PrLeu2 NH); 7.76o (d, 10 Hz, PrLeu6 NH); 7.6o (d, 10 Hz, PrLeu2 NH); 7.52* (d, 8 Hz, indole H-4′); 7.48o (d, 8 Hz, indole H-4′); 7.42 (d, 8 Hz, indole); 7.40 (d, 8 Hz, indole); 7.26* (dd, indole H-6′); 7.13* (dd, indole H-5′); 7.07o (dd, indole H-5′); 7.03* (s, indole H-2′); 7.02o (s, indole H-2′); 6.16 (d br, 10 Hz, Leu NH); 6.01* (d, 6 Hz, Leu NH); 5.77′ (d, Leu NH); 5.31 (ddd, -CH).
Пример 27.
(3 конформера 51: 46:3 помечены *, o, ‘): 8.71* (d, 10 Hz, PrLeu6 NH); 7.90* (d, 10 Hz, PrLeu2 NH); 7.76o (d, 10 Hz, PrLeu6 NH); 7.6o (d, 10 Hz, PrLeu2 NH); 7.52* (d, 8 Hz, indole H-4′); 7.48o (d, 8 Hz, indole H-4′); 7.42 (d, 8 Hz, indole); 7.40 (d, 8 Hz, indole); 7.26* (dd, indole H-6′); 7.13* (dd, indole H-5′); 7.07o (dd, indole H-5′); 7.03* (s, indole H-2′); 7.02o (s, indole H-2′); 6.16 (d br, 10 Hz, Leu NH); 6.01* (d, 6 Hz, Leu NH); 5.77′ (d, Leu NH); 5.31 (ddd,  -H); 5.05-4.97; 4.86 (ddd, -H); 5.05-4.97; 4.86 (ddd,  -H); 4.82 (dd, -H); 4.82 (dd,  -H); 4.74 (m); 4.46* (dd, MeLeu -H); 4.74 (m); 4.46* (dd, MeLeu  -H); 4.17* (ddd, Leu -H); 4.17* (ddd, Leu  -H); 4.05* (s, N-OMe); 4.03o (s, N-OMe); 3.68 (m); 3.57 (m); 3.47* (m, CH2Cl); 3.43 (s, N-Me); 3.28* (dd, MeTrp -H); 4.05* (s, N-OMe); 4.03o (s, N-OMe); 3.68 (m); 3.57 (m); 3.47* (m, CH2Cl); 3.43 (s, N-Me); 3.28* (dd, MeTrp  -Ha); 3.23* (s, MeAla N-Me); 3.21 (s, N-Me); 3.20* (dd, MeTrp -Ha); 3.23* (s, MeAla N-Me); 3.21 (s, N-Me); 3.20* (dd, MeTrp  -Hb); 2.92* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.49 (s, N-Me); 2.23o (dd, indole H-6′); 2.05-1.1; 1.54* (d, 7 Hz, MeAla -Hb); 2.92* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.49 (s, N-Me); 2.23o (dd, indole H-6′); 2.05-1.1; 1.54* (d, 7 Hz, MeAla  -Me); 1.50o (d, 7 Hz, MeAla -Me); 1.50o (d, 7 Hz, MeAla  -Me); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.85; 0.57* (d, 6.6 Hz, Leu -Me); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.85; 0.57* (d, 6.6 Hz, Leu   -Me); 0.52′ (d, Leu -Me); 0.52′ (d, Leu   -Me); 0.28′ (d, Leu -Me); 0.28′ (d, Leu   -Me); 0.06* (d, 6.6 Hz, Leu -Me); 0.06* (d, 6.6 Hz, Leu   -Me); -0.32* (ddd, Leu -Me); -0.32* (ddd, Leu  -CH).
Пример 28.
(3 конформера 37: 59:4 помечены *, o, ‘): 8.73* (d, 10 Hz, PrLeu6 NH); 7.8* (d, 10 Hz, PrLeu2 NH); 7.73o (d, 10 Hz, PrLeu6 NH); 7.63o (d, 10 Hz, PrLeu2 NH); 7.49o (d, 8 Hz, indole H-4′); 7.47* (d, 8 Hz, indole H-4′); 7.42* (d, 8 Hz, indole H-7′); 7.38o (d, 8 Hz, indole H-7′); 7.25 (dd, indole); 7.22o (dd, indole H-6′); 7.12* (dd, indole H-5′); 7.06o (dd, indole H-5′); 7.04 (s, indole H-2′); 7.03 (s. indole H-2′); 6.22o (d br, 10 Hz, Leu NH); 6.00* (d, 6 Hz, Leu NH); 5.78′ (d, Leu NH); 5.31o (ddd, PrLeu6 -CH).
Пример 28.
(3 конформера 37: 59:4 помечены *, o, ‘): 8.73* (d, 10 Hz, PrLeu6 NH); 7.8* (d, 10 Hz, PrLeu2 NH); 7.73o (d, 10 Hz, PrLeu6 NH); 7.63o (d, 10 Hz, PrLeu2 NH); 7.49o (d, 8 Hz, indole H-4′); 7.47* (d, 8 Hz, indole H-4′); 7.42* (d, 8 Hz, indole H-7′); 7.38o (d, 8 Hz, indole H-7′); 7.25 (dd, indole); 7.22o (dd, indole H-6′); 7.12* (dd, indole H-5′); 7.06o (dd, indole H-5′); 7.04 (s, indole H-2′); 7.03 (s. indole H-2′); 6.22o (d br, 10 Hz, Leu NH); 6.00* (d, 6 Hz, Leu NH); 5.78′ (d, Leu NH); 5.31o (ddd, PrLeu6  -H); 5.07 (dd, -H); 5.07 (dd,  -H); 5.05-4.90; 4.87 (ddd, -H); 5.05-4.90; 4.87 (ddd,  -H); 4.79 (dd, -H); 4.79 (dd,  -H); 4.72 (m); 4.49* (dd, MeLeu -H); 4.72 (m); 4.49* (dd, MeLeu  -H); 4.11* (ddd, Leu -H); 4.11* (ddd, Leu  -H); 4.05* (s, N-OMe); 4.03o (s, N-OMe); 3.75-3.50; 3.43 (s, N-Me); 3.38-3.13; 3.28 (s, OMe); 3.28 (s, OMe); 3.23 (s, N-Me); 3.21o (s, N-Me); 2.92* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.48o (s, N-Me); 2.00-1.08; 1.55* (d, 7 Hz, MeAla -H); 4.05* (s, N-OMe); 4.03o (s, N-OMe); 3.75-3.50; 3.43 (s, N-Me); 3.38-3.13; 3.28 (s, OMe); 3.28 (s, OMe); 3.23 (s, N-Me); 3.21o (s, N-Me); 2.92* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.48o (s, N-Me); 2.00-1.08; 1.55* (d, 7 Hz, MeAla  -Me); 1.50o (d, 7 Hz, MeAla -Me); 1.50o (d, 7 Hz, MeAla  -Me); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.85; 0.60* (d, 6.6 Hz, Leu -Me); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.85; 0.60* (d, 6.6 Hz, Leu   -Me); 0.05* (d, 6.6 Hz, Leu -Me); 0.05* (d, 6.6 Hz, Leu   -Me); -0.18* (ddd, Leu -Me); -0.18* (ddd, Leu  -CH).
Пример 29.
(2 конформера 50:50, помечены * и o): 8,70* (d, 10 Hz, PrLeu6 NH); 7.80* (d, 10 Hz, PrLeu2 NH); 7.71o (d, 10 Hz, PrLeu6 NH); 7.69o (d, 10 Hz, PrLeu2 NH); 7.47-7.35; 7.24 (dd, indole); 7.21 (dd, indole); 7.04 (dd, indole); 7.01 (dd, indole); 7.01 (s, indole H-2′); 6.97 (s, indole H-2′); 6.25o (d br, 10 Hz, Leu NH); 6.00* (d, 6 Hz, Leu NH); 5.30o (ddd, PrLeu6 -CH).
Пример 29.
(2 конформера 50:50, помечены * и o): 8,70* (d, 10 Hz, PrLeu6 NH); 7.80* (d, 10 Hz, PrLeu2 NH); 7.71o (d, 10 Hz, PrLeu6 NH); 7.69o (d, 10 Hz, PrLeu2 NH); 7.47-7.35; 7.24 (dd, indole); 7.21 (dd, indole); 7.04 (dd, indole); 7.01 (dd, indole); 7.01 (s, indole H-2′); 6.97 (s, indole H-2′); 6.25o (d br, 10 Hz, Leu NH); 6.00* (d, 6 Hz, Leu NH); 5.30o (ddd, PrLeu6  -H); 5.10-4.69; 4.49* (dd, MeLeu -H); 5.10-4.69; 4.49* (dd, MeLeu  -H); 4.07* (ddd, Leu -H); 4.07* (ddd, Leu  -H); 4.04* (s); 4.02o (s); 3.72-3.02; 3.41 (s, N-Me); 3.20 (s, N-Me); 3.20* (s, MeAla N-Me); 2.91* (s, MeTrp N-Me); 2.53 (s, N-Me); 2.45 (s, N-Me); 2.07-0.82; 1.55* (d, 7 Hz, MeAla -H); 4.04* (s); 4.02o (s); 3.72-3.02; 3.41 (s, N-Me); 3.20 (s, N-Me); 3.20* (s, MeAla N-Me); 2.91* (s, MeTrp N-Me); 2.53 (s, N-Me); 2.45 (s, N-Me); 2.07-0.82; 1.55* (d, 7 Hz, MeAla  -Me); 1.50o (d, 7 Hz, MeAia -Me); 1.50o (d, 7 Hz, MeAia  -Me); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.6* (d, 6.6 Hz, Leu -Me); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.6* (d, 6.6 Hz, Leu   -Me); 0.41 (m, cyPr); -0.03* (d, 6.6 Hz, Leu -Me); 0.41 (m, cyPr); -0.03* (d, 6.6 Hz, Leu   -Me); -0.24* (ddd, Leu -Me); -0.24* (ddd, Leu  -CH).
Пример 30.
(3 конформера 63:35:2, помечены *, o и ‘): 8.78o (d, 10 Hz, PrLeu6 NH); 7.93*, 7.77o (2d, 10 Hz, PrLeu2 NH); 7.47* (d, 8 Hz, indole H-7′); 7.43* (d, 8 Hz, indole H-4′); 7.40-7.23; 7.17o, 7.13* (2dd, indole H-6′); 7.04, 7.03 (2s, indois H-2′); 6.93o (dd, indole H-5′); 6.97, 6.93 (2s, CH-Ph2,); 6.74* (dd, indole H-5′); 6.14o (d, 10 Hz, Leu NH); 5.92* (d, 6 Hz, Leu NH); 5.78′ (d, Leu NH); 5.27o (ddd, PrLeu6 -CH).
Пример 30.
(3 конформера 63:35:2, помечены *, o и ‘): 8.78o (d, 10 Hz, PrLeu6 NH); 7.93*, 7.77o (2d, 10 Hz, PrLeu2 NH); 7.47* (d, 8 Hz, indole H-7′); 7.43* (d, 8 Hz, indole H-4′); 7.40-7.23; 7.17o, 7.13* (2dd, indole H-6′); 7.04, 7.03 (2s, indois H-2′); 6.93o (dd, indole H-5′); 6.97, 6.93 (2s, CH-Ph2,); 6.74* (dd, indole H-5′); 6.14o (d, 10 Hz, Leu NH); 5.92* (d, 6 Hz, Leu NH); 5.78′ (d, Leu NH); 5.27o (ddd, PrLeu6  -H); 5.12* (dd, Hba -H); 5.12* (dd, Hba  -H); 4.98* (ddd, PrLeu6 -H); 4.98* (ddd, PrLeu6  -H); 4.96* (dd, MeTrp -H); 4.96* (dd, MeTrp  -H); 4.85* (ddd, PrLeu2 -H); 4.85* (ddd, PrLeu2  -H); 4.70o (ddd, -H); 4.70o (ddd,  -H); 4.47* (dd, MeLeu -H); 4.47* (dd, MeLeu  -H); 4.18* (ddd, Leu -H); 4.18* (ddd, Leu  -H); 4.00*, 3.97o (2s, OMe); 3.57o (dd, MeTrp -H); 4.00*, 3.97o (2s, OMe); 3.57o (dd, MeTrp  -Ha); 3.53o (dd, MeTrp -Ha); 3.53o (dd, MeTrp  -Hb); 3.37* (dd, MeTrp -Hb); 3.37* (dd, MeTrp  -Ha); 3.27* (dd, MeTrp -Ha); 3.27* (dd, MeTrp  -Hb); 3.20, 3.19, 2.93, 2.83 (4s, N-Me); 2.66 (q, 7 Hz); 2.55-2.33; 2.52 (s, N-Me); 2.46 (s, N-Me); 2.27-1.92; 1.80 (m); 1.68-1.05; 1.35o, 1.28* (2d, 7 Hz, MeAla -Hb); 3.20, 3.19, 2.93, 2.83 (4s, N-Me); 2.66 (q, 7 Hz); 2.55-2.33; 2.52 (s, N-Me); 2.46 (s, N-Me); 2.27-1.92; 1.80 (m); 1.68-1.05; 1.35o, 1.28* (2d, 7 Hz, MeAla  -Me); 1.03* (d, 6.5 Hz, MeLeu d-Me); 0.96-0.83; 0.53′ (d, Leu -Me); 1.03* (d, 6.5 Hz, MeLeu d-Me); 0.96-0.83; 0.53′ (d, Leu   -Me); 0.49* (d, 6.6 Hz, Leu -Me); 0.49* (d, 6.6 Hz, Leu   -Me); 0.32′ (d, Leu -Me); 0.32′ (d, Leu   -Me); -0.12* (d, 6.6 Hz, Leu -Me); -0.12* (d, 6.6 Hz, Leu   -Me); -0.49* (ddd, Leu -Me); -0.49* (ddd, Leu  -CH).
Пример 31.
(смесь конформеров, дающих только один сигнал): 7.13, 7.03 (2s, indole H-2′); 4.56, 4.40 (2m, -CH).
Пример 31.
(смесь конформеров, дающих только один сигнал): 7.13, 7.03 (2s, indole H-2′); 4.56, 4.40 (2m,  -H); 4.03 (s, N-OMe); 3.42, 3.23, 3.07, 2.94, 2.53 (5s, N-Me); 0.57, 0.53, (2d, 6.6 Hz, Leu -H); 4.03 (s, N-OMe); 3.42, 3.23, 3.07, 2.94, 2.53 (5s, N-Me); 0.57, 0.53, (2d, 6.6 Hz, Leu   -Me); 0.17, 0.03 (2d, 6.6 Hz, Leu -Me); 0.17, 0.03 (2d, 6.6 Hz, Leu   -Me); -0.03,-0.27 (2ddd, Leu -Me); -0.03,-0.27 (2ddd, Leu  -CH).
Пример 32.
(3 конформера 78: 16:6, помечены *, o, ‘): 8.45* (d, J = 10 Hz, PrLeu6 NH); 8.04* (d, J = 10 Hz, PrLeu2 NH); 7.83o (d, J = 10 Hz, NH); 7.68*, 7.53o (2d, J = 7 Hz, indole H-4′); 7.30* (d, J = 8 Hz, indole H-7′); 7.23* (m, indole H-6′); 7.10* (dd, indole H-5′); 6.87o, 6.79* (2s, indoie H-2′); 6.28o (d, J = 10 Hz, Leu NH); 6.07* (d, J = 6 Hz, Leu NH); 5.83′ (d, J = 10 Hz, Leu NH); 5.31o (ddd, PrLeu -CH).
Пример 32.
(3 конформера 78: 16:6, помечены *, o, ‘): 8.45* (d, J = 10 Hz, PrLeu6 NH); 8.04* (d, J = 10 Hz, PrLeu2 NH); 7.83o (d, J = 10 Hz, NH); 7.68*, 7.53o (2d, J = 7 Hz, indole H-4′); 7.30* (d, J = 8 Hz, indole H-7′); 7.23* (m, indole H-6′); 7.10* (dd, indole H-5′); 6.87o, 6.79* (2s, indoie H-2′); 6.28o (d, J = 10 Hz, Leu NH); 6.07* (d, J = 6 Hz, Leu NH); 5.83′ (d, J = 10 Hz, Leu NH); 5.31o (ddd, PrLeu  -H); 5.18* (dd, Hba -H); 5.18* (dd, Hba  -H); 5.13o (dd, Hba -H); 5.13o (dd, Hba  -H); 5.05* (ddd, PrLeu6 -H); 5.05* (ddd, PrLeu6  -H); 4.98o (ddd, Leu -H); 4.98o (ddd, Leu  -H); 4.93* (dd, MeTrp -H); 4.93* (dd, MeTrp  -H); 4.84* (ddd, PrLeu2 -H); 4.84* (ddd, PrLeu2  -H); 4.78o (ddd, PrLeu2 -H); 4.78o (ddd, PrLeu2  -H); 4.47* (dd, MeLeu -H); 4.47* (dd, MeLeu  -H); 4.13* (ddd, Leu -H); 4.13* (ddd, Leu  -H); 3.8-3.5 (m); 3.72*o (2s, MeTrp N1′-Me); 3.69* (q, J = 7 Hz, MeAla -H); 3.8-3.5 (m); 3.72*o (2s, MeTrp N1′-Me); 3.69* (q, J = 7 Hz, MeAla  -H); 3.40o (s, MeAla N-Me); 3.28* (s, MeAla N-Me); 3.20 (dd, MeTrp -H); 3.40o (s, MeAla N-Me); 3.28* (s, MeAla N-Me); 3.20 (dd, MeTrp  -Hb); 3.12* (dd, MeTrp -Hb); 3.12* (dd, MeTrp  -Ha); 2.93* (s, MeTrp, N-Me); 2.53o (s, N-Me); 2.52* (s, MeLeu N-Me); 3.21o (s, N-Me); 2.25-2.08 (m, Hba -Ha); 2.93* (s, MeTrp, N-Me); 2.53o (s, N-Me); 2.52* (s, MeLeu N-Me); 3.21o (s, N-Me); 2.25-2.08 (m, Hba  -CH2, -CH2,  -Ha); 1.92* (m, Hba -Ha); 1.92* (m, Hba  -Hb); 1.83-1.75 (m); 1.7-1.07 (m); 1.53*, 1.48o (2d, J = 7 Hz, MeAla -Hb); 1.83-1.75 (m); 1.7-1.07 (m); 1.53*, 1.48o (2d, J = 7 Hz, MeAla  -Me); 1.04 (d, J = 6.5 Hz, MeLeu -Me); 1.04 (d, J = 6.5 Hz, MeLeu  -Me); 0.97-0.84 (m); 0.53* (d, J = 6.6 Hz, Leu Me) 0.28′ (d); -0.17* (d, J = 6.6 Hz, Leu Me); -0.53* (ddd, Leu -Me); 0.97-0.84 (m); 0.53* (d, J = 6.6 Hz, Leu Me) 0.28′ (d); -0.17* (d, J = 6.6 Hz, Leu Me); -0.53* (ddd, Leu  -CH).
Пример 33.
(3 конформера 80:14:6, помечены *, o, ‘): 8.48* (d, 10 Hz, PrLeu6 NH); 8.06* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu NH); 7.68* (d, 8 Hz, indole H-4′); 7.54o (d, indole); 7.33* (d, 8 Hz, indole H-7′); 7.31o (d, 8 Hz, indole); 7.22* (dd, indole H-6′); 7.1* (dd, indole H-5′); 7.53o (d, PrLeu NH); 6.93o (s, indole H-2′); 6.84* (s, indole H-2′); 6.26o (d, br, Leu NH); 6.05* (d, 7.5 Hz, Leu NH); 5.84′ (d, Leu NH); 5.31o (ddd, PrLeu6 -CH).
Пример 33.
(3 конформера 80:14:6, помечены *, o, ‘): 8.48* (d, 10 Hz, PrLeu6 NH); 8.06* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu NH); 7.68* (d, 8 Hz, indole H-4′); 7.54o (d, indole); 7.33* (d, 8 Hz, indole H-7′); 7.31o (d, 8 Hz, indole); 7.22* (dd, indole H-6′); 7.1* (dd, indole H-5′); 7.53o (d, PrLeu NH); 6.93o (s, indole H-2′); 6.84* (s, indole H-2′); 6.26o (d, br, Leu NH); 6.05* (d, 7.5 Hz, Leu NH); 5.84′ (d, Leu NH); 5.31o (ddd, PrLeu6  -H); 5.18* (dd, Hba -H); 5.18* (dd, Hba  -H); 5.13o (dd, Hba -H); 5.13o (dd, Hba  -H); 5.06* (ddd, PrLeu6 -H); 5.06* (ddd, PrLeu6  -H); 4.99o (ddd, Leu -H); 4.99o (ddd, Leu  -H); 4.93* (dd, MeTrp -H); 4.93* (dd, MeTrp  -H); 4.87* (ddd, PrLeu2 -H); 4.87* (ddd, PrLeu2  -H); 4.8o (ddd, PrLeu2 -H); 4.8o (ddd, PrLeu2  -H); 4.47* (dd, MeLeu -H); 4.47* (dd, MeLeu  -H); 4.16* (ddd, Leu -H); 4.16* (ddd, Leu  -H); 4.1* (m, N-CH2); 3.78-3.57; 3.69* (q, 7 Hz, MeAla -H); 4.1* (m, N-CH2); 3.78-3.57; 3.69* (q, 7 Hz, MeAla  -H); 3.47-2.90; 3.42o (s, MeAla N-Me); 3.32* (dd, MeTrp -H); 3.47-2.90; 3.42o (s, MeAla N-Me); 3.32* (dd, MeTrp  -Ha); 3.3* (s, MeAla N-Me); 3.23* (dd, MeTrp -Ha); 3.3* (s, MeAla N-Me); 3.23* (dd, MeTrp  -Hb); 3.21o (s, N-Me); 3.06′ (s, N-Me); 2.93* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.32-2.10; 1.93* (m, Hba -Hb); 3.21o (s, N-Me); 3.06′ (s, N-Me); 2.93* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.32-2.10; 1.93* (m, Hba  -CHb); 1.83-1.08; 1.53* (d, 7 Hz, MeAla -CHb); 1.83-1.08; 1.53* (d, 7 Hz, MeAla  -Me); 1.48o (d, 7 Hz, MeAla -Me); 1.48o (d, 7 Hz, MeAla  -Me); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.97-0.84; 0.52* (d, 6.6 Hz, Leu -Me); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.97-0.84; 0.52* (d, 6.6 Hz, Leu   -Me); 0.26′ (d, Leu -Me); 0.26′ (d, Leu   -Me); -0.17* (d, 6.6 Hz, Leu -Me); -0.17* (d, 6.6 Hz, Leu   -Me); -0.55* (ddd, Leu -Me); -0.55* (ddd, Leu  -CH).
Пример 34.
(3 конформера 71:24:5, помечены *, o и ‘): 8.50* (d, 10 Hz, PrLeu6 NH); 8.06* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu NH); 7.77o (d, 8 Hz, indole H-4′); 7.72* (d, 8 Hz, indole H-4′); 7.53o (d, 10 Hz, PrLeu NH); 7.40-7.05, 6.92o (s, indole H-2′); 6.88* (s, indole H-2′); 6.23o (d, 9.4 Hz, Leu NH); 6.09* (d, 7.4 Hz, Leu NH); 5.87′ (d, Leu NH); 5.32o (ddd, PrLeu6 -CH).
Пример 34.
(3 конформера 71:24:5, помечены *, o и ‘): 8.50* (d, 10 Hz, PrLeu6 NH); 8.06* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu NH); 7.77o (d, 8 Hz, indole H-4′); 7.72* (d, 8 Hz, indole H-4′); 7.53o (d, 10 Hz, PrLeu NH); 7.40-7.05, 6.92o (s, indole H-2′); 6.88* (s, indole H-2′); 6.23o (d, 9.4 Hz, Leu NH); 6.09* (d, 7.4 Hz, Leu NH); 5.87′ (d, Leu NH); 5.32o (ddd, PrLeu6  -H); 5.23* (AB; N1′-CH2); 5.20* (AB; N1′-CH2); 5.17* (dd, Hba -H); 5.23* (AB; N1′-CH2); 5.20* (AB; N1′-CH2); 5.17* (dd, Hba  -H); 5.14o (dd, Hba -H); 5.14o (dd, Hba  -H); 5.04* (ddd, PrLeu6 -H); 5.04* (ddd, PrLeu6  -H); 4.99o (ddd, PrLeu2 -H); 4.99o (ddd, PrLeu2  -H); 4.96* (dd, MeTrp -H); 4.96* (dd, MeTrp  -H); 4.87* (ddd, PrLeu2 -H); 4.87* (ddd, PrLeu2  -H); 4.78o (ddd, Leu -H); 4.78o (ddd, Leu  -H); 4.47* (dd, MeLeu -H); 4.47* (dd, MeLeu  -H); 421* (ddd, Leu -H); 421* (ddd, Leu  -H); 3.76o (q, 7 Hz, MeAla -H); 3.76o (q, 7 Hz, MeAla  -H); 3.73-3.65, 3.67* (q, 7 Hz, MeAla -H); 3.73-3.65, 3.67* (q, 7 Hz, MeAla  -H); 3.58o (dd, MeLeu -H); 3.58o (dd, MeLeu  -H); 3.50-3.37, 3.42o (s, MeAla N-Me); 3.33* (dd, MeTrp -H); 3.50-3.37, 3.42o (s, MeAla N-Me); 3.33* (dd, MeTrp  -Ha); 3.27* (s, MeAla N-Me); 3.23o (s, N-Me); 3.23* (dd, MeTrp -Ha); 3.27* (s, MeAla N-Me); 3.23o (s, N-Me); 3.23* (dd, MeTrp  -Hb); 2.92* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.28-1.08; 1.53* (d, 7 Hz, MeAla -Hb); 2.92* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.52o (s, N-Me); 2.28-1.08; 1.53* (d, 7 Hz, MeAla  -Me); 1.49o (d, 7 Hz, MeAla -Me); 1.49o (d, 7 Hz, MeAla  -Me); 1.06* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.82, 0.50′ (d, Leu -Me); 1.06* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.82, 0.50′ (d, Leu   -Me); 0.45* (d, 6.6 Hz, Leu -Me); 0.45* (d, 6.6 Hz, Leu   -Me); 0.28′ (d, Leu -Me); 0.28′ (d, Leu   -Me); -0.11* (d, 6.6 Hz, Leu -Me); -0.11* (d, 6.6 Hz, Leu   -Me); -0.47* (ddd, Leu -Me); -0.47* (ddd, Leu  -CH).
Пример 35.
(3 конформера 1:1:1): 8.62, 8.43, 8.07, 7.94, 7.87, 7.42 (6d, J = 10 Hz, NH); 7.12 (d, J = 7.4 Hz, indoline arom. H); 7.08-6.99 (m, indoline arom. H); 6.72, 6.69, (2dd indoline arom. H); 6.66-6.63 (m, indoline arom. H); 6.58 (d, J = 8 Hz, indoline arom. H); 6.29 (d, J = 8 Hz, Leu NH); 6.15 (m br, Leu NH); 5.88 (d, J = 8 Hz, Leu NH); 5.28-4.98 (m, -CH).
Пример 35.
(3 конформера 1:1:1): 8.62, 8.43, 8.07, 7.94, 7.87, 7.42 (6d, J = 10 Hz, NH); 7.12 (d, J = 7.4 Hz, indoline arom. H); 7.08-6.99 (m, indoline arom. H); 6.72, 6.69, (2dd indoline arom. H); 6.66-6.63 (m, indoline arom. H); 6.58 (d, J = 8 Hz, indoline arom. H); 6.29 (d, J = 8 Hz, Leu NH); 6.15 (m br, Leu NH); 5.88 (d, J = 8 Hz, Leu NH); 5.28-4.98 (m,  -H); 4.93 (ddd, -H); 4.93 (ddd,  -H); 4.74 (ddd, -H); 4.74 (ddd,  -H); 4.65 (m, -H); 4.65 (m,  -H); 4.54 (dd, -H); 4.54 (dd,  -H); 4.43 (dd, -H); 4.43 (dd,  -H); 3.80-3.65 (m); 3.55-3.0 (m); 3.46, 3.35, 3.31, 3.24, 3.22, 3.12, 3.00, 2.82, 2.57 (9s, N-Me); 2.55-1.1 (m); 1.52, 1.48, 1.43 (3d, J = 7 Hz, MeAla -H); 3.80-3.65 (m); 3.55-3.0 (m); 3.46, 3.35, 3.31, 3.24, 3.22, 3.12, 3.00, 2.82, 2.57 (9s, N-Me); 2.55-1.1 (m); 1.52, 1.48, 1.43 (3d, J = 7 Hz, MeAla  -Me); 1.13 (d, J = 7 Hz); 1.03-0.83 (m); 0.78, 0.76, 0.73 (3d, J = 6.5 Hz).
Пример 36.
(3 конформера 73: 23:4, помечены *, o и ‘): 8.53* (d, J = 10 Hz, PrLeu NH); 8.06* (d, J = 10 Hz, PrLeu’ NH); 7.95o (d, J = 10 Hz, NH); 7.67*, 7.52o (2d, J = 7 Hz, indole H-4′); 7.55o (d, J = 10 Hz, NH); 7.33*, 7.31o (2d, J = 8 Hz, indole -Me); 1.13 (d, J = 7 Hz); 1.03-0.83 (m); 0.78, 0.76, 0.73 (3d, J = 6.5 Hz).
Пример 36.
(3 конформера 73: 23:4, помечены *, o и ‘): 8.53* (d, J = 10 Hz, PrLeu NH); 8.06* (d, J = 10 Hz, PrLeu’ NH); 7.95o (d, J = 10 Hz, NH); 7.67*, 7.52o (2d, J = 7 Hz, indole H-4′); 7.55o (d, J = 10 Hz, NH); 7.33*, 7.31o (2d, J = 8 Hz, indoleH-7′); 7.19*, 7.17o (2dd, indole H-6′); 7.08*, 7.04o (2dd, indole H-5′); 6.98′, 6.88o, 6.80* (3s, indole H-2′); 6.23o (d, J = 9.3 Hz, Leu NH); 6.05* (d, J = 7.5 Hz, Leu NH); 5.84′ (d, Leu NH); 5.33o (ddd, PrLeu  -H); 5.18* (dd, Hba -H); 5.18* (dd, Hba  -H); 5.14o (dd, Hba -H); 5.14o (dd, Hba  -H); 5.05* (ddd, PrLeu -H); 5.05* (ddd, PrLeu  -H); 4.98o (ddd, Leu -H); 4.98o (ddd, Leu  -H); 4.93* (dd, indole -H); 4.93* (dd, indole  -H); 4.87* (ddd, PrLeu’ -H); 4.87* (ddd, PrLeu’  -H); 4.81o (ddd, Leu -H); 4.81o (ddd, Leu  -H); 4.47* (dd, MeLeu -H); 4.47* (dd, MeLeu  -H); 4.22* (ddd Leu -H); 4.22* (ddd Leu  -H); 3.86-3.67 (m); 3.83* (s, t-Bu-CH2-N); 3.69* (q, J = 7 Hz, MeAla -H); 3.86-3.67 (m); 3.83* (s, t-Bu-CH2-N); 3.69* (q, J = 7 Hz, MeAla  -H); 3.5-3.2 (m); 3.43o (s, MeAla N-Me); 3.30* (s, MeAla N-Me); 3.22o (s, N-Me); 2.93* (s, MeMeTrp, N-Me); 2.53* (s, MeLeu N-Me); 2.53o (s, N-Me); 2.25 (m, Hba g-CH2); 2.18 (m, Hba -H); 3.5-3.2 (m); 3.43o (s, MeAla N-Me); 3.30* (s, MeAla N-Me); 3.22o (s, N-Me); 2.93* (s, MeMeTrp, N-Me); 2.53* (s, MeLeu N-Me); 2.53o (s, N-Me); 2.25 (m, Hba g-CH2); 2.18 (m, Hba  -Ha); 2.0-1.08 (m); 1.54*, 1.49o (2d, J = 7 Hz, MeAla -Ha); 2.0-1.08 (m); 1.54*, 1.49o (2d, J = 7 Hz, MeAla  -Me); 1.05 (d, J = 6.5 Hz, MeLeu Me); 0.97-0.84 (m); 0.52* (d, J = 6.6 Hz, Leu Me); 0.28′ (d); -0.06* (d, J = 6.6 Hz, Leu Me); -0.49* (ddd, Leu -Me); 1.05 (d, J = 6.5 Hz, MeLeu Me); 0.97-0.84 (m); 0.52* (d, J = 6.6 Hz, Leu Me); 0.28′ (d); -0.06* (d, J = 6.6 Hz, Leu Me); -0.49* (ddd, Leu  -CH).
Пример 37.
(3 конформера 78:19:3, помечены *, o, ‘): 8.52* (d, 10 Hz, PrLeu6 NH); 8.06* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu NH); 7.68* (d, 8 Hz, indole H-4′); 7.53o (d, 8 Hz, indole H-4′); 7.52o (d, 10 Hz, PrLeu NH); 7.36* (d, 8 Hz, indole H-7′); 7.33o (d, 8 Hz, indole H-7′); 7.2* (dd, indole H-6′); 7.17o (dd, indole H-6′); 7.09* (dd, indole H-5′); 7.05o (dd, indole H-5′); 7.02o (s, indole H-2′); 6.91* (s, indole H-2′); 6.23o (d, 9.5 Hz, Leu NH); 6.03* (d, 7.4 Hz, Leu NH); 5.87′ (d, Leu NH); 5.32o (ddd, PrLeu6 -CH).
Пример 37.
(3 конформера 78:19:3, помечены *, o, ‘): 8.52* (d, 10 Hz, PrLeu6 NH); 8.06* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu NH); 7.68* (d, 8 Hz, indole H-4′); 7.53o (d, 8 Hz, indole H-4′); 7.52o (d, 10 Hz, PrLeu NH); 7.36* (d, 8 Hz, indole H-7′); 7.33o (d, 8 Hz, indole H-7′); 7.2* (dd, indole H-6′); 7.17o (dd, indole H-6′); 7.09* (dd, indole H-5′); 7.05o (dd, indole H-5′); 7.02o (s, indole H-2′); 6.91* (s, indole H-2′); 6.23o (d, 9.5 Hz, Leu NH); 6.03* (d, 7.4 Hz, Leu NH); 5.87′ (d, Leu NH); 5.32o (ddd, PrLeu6  -H); 5.18* (dd, Hba -H); 5.18* (dd, Hba  -H); 5.14o (dd, Hba -H); 5.14o (dd, Hba  -H); 5.05* (ddd, PrLeu6 -H); 5.05* (ddd, PrLeu6  -H); 4.98o (ddd, PrLeu2 -H); 4.98o (ddd, PrLeu2  -H); 4.93* (dd, MeTrp -H); 4.93* (dd, MeTrp  -H); 4.87* (ddd, PrLeu2 -H); 4.87* (ddd, PrLeu2  -H); 4.81o (ddd, Leu -H); 4.81o (ddd, Leu  -H); 4.60 (m, N-CH); 4.46* (dd, MeLeu -H); 4.60 (m, N-CH); 4.46* (dd, MeLeu  -H); 4.16* (ddd, Leu -H); 4.16* (ddd, Leu  -H); 3.75o (q, 7 Hz, MeAla -H); 3.75o (q, 7 Hz, MeAla  -H); 3.70 (m); 3.69* (q, 7 Hz, MeAla -H); 3.70 (m); 3.69* (q, 7 Hz, MeAla  -H); 3.57o (dd, MeLeu -H); 3.57o (dd, MeLeu  -H); 3.45 (m); 3.42o (s, MeAla N-Me); 3.32* (dd, MeTrp -H); 3.45 (m); 3.42o (s, MeAla N-Me); 3.32* (dd, MeTrp  -Ha); 3.31* (s, MeAla N-Me); 3.23* (dd, MeTrp -Ha); 3.31* (s, MeAla N-Me); 3.23* (dd, MeTrp  -Hb); 3.21o (s, N-Me); 2.93* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.50o (s, N-Me); 2.28 (AB-XY); 2.18 (AB-XY, Hba g-CH2); 2.13* (m, Hba -Hb); 3.21o (s, N-Me); 2.93* (s, MeTrp N-Me); 2.53* (s, MeLeu N-Me); 2.50o (s, N-Me); 2.28 (AB-XY); 2.18 (AB-XY, Hba g-CH2); 2.13* (m, Hba  -CHa); 1.93* (m, Hba -CHa); 1.93* (m, Hba  -CHb); 1.85-1.08; 1.53* (d, 7 Hz, MeAla -CHb); 1.85-1.08; 1.53* (d, 7 Hz, MeAla  -Me); 1.47 (m, N-CHMe2); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.83; 0.52′ (d, Leu -Me); 1.47 (m, N-CHMe2); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.83; 0.52′ (d, Leu   -Me); 0.51* (d, 6.6 Hz, Leu -Me); 0.51* (d, 6.6 Hz, Leu   -Me); 0.34′ (d, Leu -Me); 0.34′ (d, Leu   -Me); -0.2* (d, 6.6 Hz, Leu -Me); -0.2* (d, 6.6 Hz, Leu   -Me); -0.60* (ddd, Leu -Me); -0.60* (ddd, Leu  -CH).
Пример 38.
Индолин A (3 конформера 46:27:27, помечены *, o, o): 8.62* (d, J = 10 Hz, PrLeu NH); 8.13o (d, J = 10 Hz, NH); 8.02o (d, J = 10 Hz, NH); 7.92o (d, J = 10 Hz, NH); 7.86* (d, J = 10 Hz, PrLeu’ NH); 7.40o (d, J = 10 Hz, NH); 7.23o, 7.16*, 7.09o (3d, J = 7.4 Hz, indoline arom. H); 7.05o, 7.02*, 7.02o (3dd, indoline arom. H); 6.76o, 6.72*, 6.71o (3dd, indoline arom. H); 6.64o, 6.62o, 6.58* (3d, J = 7.7 Hz, indoline arom. H); 6.32o (d, J = 8 Hz, Leu NH); 6.10o (m br, Leu NH); 5.94* (d, J = 9 Hz, Leu NH); 5.28-4.73 (m); 4.60o (dd, -CH).
Пример 38.
Индолин A (3 конформера 46:27:27, помечены *, o, o): 8.62* (d, J = 10 Hz, PrLeu NH); 8.13o (d, J = 10 Hz, NH); 8.02o (d, J = 10 Hz, NH); 7.92o (d, J = 10 Hz, NH); 7.86* (d, J = 10 Hz, PrLeu’ NH); 7.40o (d, J = 10 Hz, NH); 7.23o, 7.16*, 7.09o (3d, J = 7.4 Hz, indoline arom. H); 7.05o, 7.02*, 7.02o (3dd, indoline arom. H); 6.76o, 6.72*, 6.71o (3dd, indoline arom. H); 6.64o, 6.62o, 6.58* (3d, J = 7.7 Hz, indoline arom. H); 6.32o (d, J = 8 Hz, Leu NH); 6.10o (m br, Leu NH); 5.94* (d, J = 9 Hz, Leu NH); 5.28-4.73 (m); 4.60o (dd,  -H); 4.13* (dd, -H); 4.13* (dd,  -H); 3.75-2.85 (m); 3.45*, 3.33o, 3.33*, 3.23o, 3.20o, 3.02*, 2.81o, 2.79o, 2.57o (9s, N-Me); 2.45-0.83 (m); 1.52o, 1.46o, 1.42* (3d, J = 7 Hz, MeAla -H); 3.75-2.85 (m); 3.45*, 3.33o, 3.33*, 3.23o, 3.20o, 3.02*, 2.81o, 2.79o, 2.57o (9s, N-Me); 2.45-0.83 (m); 1.52o, 1.46o, 1.42* (3d, J = 7 Hz, MeAla  -Me).
Индолин B (3 конформ. 1:1:1): 8.62, 8.43, 8.07, 7.94, 7.87, 7.42 (6d, J = 10 Hz, NH); 7.12 (s, J = 7.4 Hz, indoline arom. H); 7.08-6.99 (m, indoline arom. H); 6.72, 6.69, (2dd indoline arom. H); 6.66-6.63 (m, indoline arom. H); 6.58 (d, J = 8 Hz, indoline arom. H); 6.29 (d, J = 8 Hz, Leu NH); 6.15 (m br, Leu NH); 5.88 (d, J = 8 Hz, Leu NH); 5.28-4.98 (m, -Me).
Индолин B (3 конформ. 1:1:1): 8.62, 8.43, 8.07, 7.94, 7.87, 7.42 (6d, J = 10 Hz, NH); 7.12 (s, J = 7.4 Hz, indoline arom. H); 7.08-6.99 (m, indoline arom. H); 6.72, 6.69, (2dd indoline arom. H); 6.66-6.63 (m, indoline arom. H); 6.58 (d, J = 8 Hz, indoline arom. H); 6.29 (d, J = 8 Hz, Leu NH); 6.15 (m br, Leu NH); 5.88 (d, J = 8 Hz, Leu NH); 5.28-4.98 (m,  -H); 4.93 (ddd, -H); 4.93 (ddd,  -H); 4.74 (ddd, -H); 4.74 (ddd,  -H); 4.65 (m, -H); 4.65 (m,  -H); 4.54 (dd, -H); 4.54 (dd,  -H); 4.43 (dd, -H); 4.43 (dd,  -H), 3.80-3.66 (m); 3.55-3.0 (m); 3.46, 3.35, 3.31, 3.24, 3.22, 3.12, 3.00, 2.82, 2.57 (9s, N-Me); 2.55-1.1 (m); 1.52, 1.48, 1.43 (3d, J = 7 Hz, MeAla -H), 3.80-3.66 (m); 3.55-3.0 (m); 3.46, 3.35, 3.31, 3.24, 3.22, 3.12, 3.00, 2.82, 2.57 (9s, N-Me); 2.55-1.1 (m); 1.52, 1.48, 1.43 (3d, J = 7 Hz, MeAla  -Me); 1.13 (d, J = 7 Hz); 1.03-0.83 (m); 0.78, 0.76, 0.73 (3d, J = 6.5 Hz).
Пример 39.
(3 конформера 76:18:6, помечены *, o и ‘): 8.49* (d, 10 Hz, PrLeu6 NH); 8.05* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu6 NH); 7.67* (d, 8 Hz, indoie H-4′); 7.53o (d, 8 Hz, indole H-4′); 7.52o (d, 10 Hz, PrLeu2 NH); 7.4* (d, 8 Hz, indole H-7′); 7.38o (d, 8 Hz, indole H-7′); 7.23* (dd, indoie H-6′); 7.19o (dd, indole H-6′); 7.11* (dd, indoie H-5′); 7.07o (dd, indole H-5′); 7.05o (s, indole H-2′); 7.01* (s, indole H-2′); 6.22o (d, br, Leu NH); 6.05* (d, 7.5 Hz, Leu NH); 5.84′ (d, Leu NH); 5.31o (ddd, PrLeu6 -Me); 1.13 (d, J = 7 Hz); 1.03-0.83 (m); 0.78, 0.76, 0.73 (3d, J = 6.5 Hz).
Пример 39.
(3 конформера 76:18:6, помечены *, o и ‘): 8.49* (d, 10 Hz, PrLeu6 NH); 8.05* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu6 NH); 7.67* (d, 8 Hz, indoie H-4′); 7.53o (d, 8 Hz, indole H-4′); 7.52o (d, 10 Hz, PrLeu2 NH); 7.4* (d, 8 Hz, indole H-7′); 7.38o (d, 8 Hz, indole H-7′); 7.23* (dd, indoie H-6′); 7.19o (dd, indole H-6′); 7.11* (dd, indoie H-5′); 7.07o (dd, indole H-5′); 7.05o (s, indole H-2′); 7.01* (s, indole H-2′); 6.22o (d, br, Leu NH); 6.05* (d, 7.5 Hz, Leu NH); 5.84′ (d, Leu NH); 5.31o (ddd, PrLeu6  -H); 5.19* (dd, Hba -H); 5.19* (dd, Hba  -H); 5.16o (dd, Hba -H); 5.16o (dd, Hba  -H); 5.04* (ddd, PrLeu6 -H); 5.04* (ddd, PrLeu6  -H); 5.00o (ddd, PrLeu2 -H); 5.00o (ddd, PrLeu2  -H); 4.94* (dd, MeTrp -H); 4.94* (dd, MeTrp  -H); 4.87* (ddd, PrLeu2 -H); 4.87* (ddd, PrLeu2  -H); 4.81o (ddd, Leu -H); 4.81o (ddd, Leu  -H); 4.67′ (ddd, Leu -H); 4.67′ (ddd, Leu  -H); 4.45* (dd, MeLeu -H); 4.45* (dd, MeLeu  -H); 4.18* (ddd, Leu -H); 4.18* (ddd, Leu  -H); 4.14 (s, OPr); 3.80-3.55; 3.67* (q, 7 Hz, MeAla -H); 4.14 (s, OPr); 3.80-3.55; 3.67* (q, 7 Hz, MeAla  -H); 3.50-3.40; 3.42o (s, N-Me); 3.29* (dd, MeTrp -H); 3.50-3.40; 3.42o (s, N-Me); 3.29* (dd, MeTrp  -Ha); 3.27* (s, MeAla N-Me); 3.21o (s, N-Me); 3.18* (dd, MeTrp -Ha); 3.27* (s, MeAla N-Me); 3.21o (s, N-Me); 3.18* (dd, MeTrp  -Hb); 3.04′ (s, N-Me); 2.93* (s, MeTrp N-Me); 2.55o (s, N-Me); 2.53* (s, MeLeu N-Me); 2.30-1.90; 1.80 (m, OPr); 1.53* (d, 7 Hz, MeAla -Hb); 3.04′ (s, N-Me); 2.93* (s, MeTrp N-Me); 2.55o (s, N-Me); 2.53* (s, MeLeu N-Me); 2.30-1.90; 1.80 (m, OPr); 1.53* (d, 7 Hz, MeAla  -Me); 1.48o (d, 7 Hz, MeAla -Me); 1.48o (d, 7 Hz, MeAla  -Me); 1.08o (t, OPr); 1.07 (t, OPr); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.85; 0,59′ (d, Leu -Me); 1.08o (t, OPr); 1.07 (t, OPr); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.85; 0,59′ (d, Leu   -Me); 0.57* (d, 6.6 Hz, Leu -Me); 0.57* (d, 6.6 Hz, Leu   -Me); 0.37′ (d, Leu -Me); 0.37′ (d, Leu   -Me); -0.07* (d, 6.6 Hz, Leu -Me); -0.07* (d, 6.6 Hz, Leu   -Me).
Пример 40.
(3 конформера 73:21:6, помечены *, o, ‘): 8.49* (d, 10 Hz, PrLeu6 NH); 8.05* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu6 NH); 7.67* (d, 8 Hz, indole H-4′); 7.53o (d, 8 Hz, indole H-4′); 7.52o (d, 10 Hz, PrLeu2 NH); 7.4* (d, 8 Hz, indole H-7′); 7.38o (d, 8 Hz, indole H-7′); 7.23* (dd, indole H-6′); 7.19o (dd, indole H-6′); 7.11* (dd, indole H-5′); 7.07o (dd, indole H-5′); 7.05o (s, indole H-2′); 7.01* (s, indole H-2′); 6.22o (d, 9.4 Hz, Leu NH); 6.05* (d, 7.3 Hz, Leu NH); 5.86′ (d, Leu NH); 5.31o (ddd, PrLeu6 -Me).
Пример 40.
(3 конформера 73:21:6, помечены *, o, ‘): 8.49* (d, 10 Hz, PrLeu6 NH); 8.05* (d, 10 Hz, PrLeu2 NH); 7.94o (d, 10 Hz, PrLeu6 NH); 7.67* (d, 8 Hz, indole H-4′); 7.53o (d, 8 Hz, indole H-4′); 7.52o (d, 10 Hz, PrLeu2 NH); 7.4* (d, 8 Hz, indole H-7′); 7.38o (d, 8 Hz, indole H-7′); 7.23* (dd, indole H-6′); 7.19o (dd, indole H-6′); 7.11* (dd, indole H-5′); 7.07o (dd, indole H-5′); 7.05o (s, indole H-2′); 7.01* (s, indole H-2′); 6.22o (d, 9.4 Hz, Leu NH); 6.05* (d, 7.3 Hz, Leu NH); 5.86′ (d, Leu NH); 5.31o (ddd, PrLeu6  -H); 5.19* (dd, Hba -H); 5.19* (dd, Hba  -H); 5.16o (dd, Hba -H); 5.16o (dd, Hba  -H); 5.03* (ddd, PrLeu6 -H); 5.03* (ddd, PrLeu6  -H); 5o (ddd, PrLeu2 -H); 5o (ddd, PrLeu2  -H); 4.94* (dd, MeTrp -H); 4.94* (dd, MeTrp  -H); 4.87* (ddd, PrLeu2 -H); 4.87* (ddd, PrLeu2  -H); 4.81o (ddd, Leu -H); 4.81o (ddd, Leu  – H); 4.65′ (ddd, Leu – H); 4.65′ (ddd, Leu  -H); 4.46* (dd, MeLeu -H); 4.46* (dd, MeLeu  -H); 4.26* (q, OEt); 4.26o (q, OEt); 4.19* (ddd, Leu -H); 4.26* (q, OEt); 4.26o (q, OEt); 4.19* (ddd, Leu  -H); 3.80-3.56; 3.67* (q, 7 Hz, MeAla -H); 3.80-3.56; 3.67* (q, 7 Hz, MeAla  -H); 3.45-3.33; 3.41o (s, MeAla N-Me); 3.29* (dd, MeTrp -H); 3.45-3.33; 3.41o (s, MeAla N-Me); 3.29* (dd, MeTrp  -Ha); 3.27* (s, MeAla N-Me); 3.21o (s, N-Me); 3.19* (dd, MeTrp -Ha); 3.27* (s, MeAla N-Me); 3.21o (s, N-Me); 3.19* (dd, MeTrp  -Hb); 3.04′ (s, N-Me); 2.93* (s, MeTrp N-Me); 2.57o (s, N-Me); 2.52* (s, MeLeu N-Me); 2.32-1.08; 1.53* (d, 7 Hz, MeAla -Hb); 3.04′ (s, N-Me); 2.93* (s, MeTrp N-Me); 2.57o (s, N-Me); 2.52* (s, MeLeu N-Me); 2.32-1.08; 1.53* (d, 7 Hz, MeAla  -Me); 1.48o (d, 7 Hz, MeAla -Me); 1.48o (d, 7 Hz, MeAla  -Me); 1.40o (t, OEt); 1.40* (t, OEt); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.84; 0.60′ (d, Leu -Me); 1.40o (t, OEt); 1.40* (t, OEt); 1.05* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.84; 0.60′ (d, Leu   -Me); 0.57* (d, 6.6 Hz, Leu -Me); 0.57* (d, 6.6 Hz, Leu   -Me); 0.37′ (d, Leu -Me); 0.37′ (d, Leu   -Me); -0.07* (d, 6.6 Hz, Leu -Me); -0.07* (d, 6.6 Hz, Leu   -Me); -0.36* (ddd, Leu -Me); -0.36* (ddd, Leu  -CH).
Пример 41.
(3 конформера 63:32:5, помечены *, o, ‘): 8.45* (d, 10 Hz, PrLeu6 NH); 8.06* (d, 10 Hz, PrLeu2 NH); 7.97o (d, 10 Hz, PrLeu6 NH); 7.90′ (d, 10 Hz, PrLeu6 NH); 7.63* (d, 8 Hz, indole H-4′); 7.56o (d, 10 Hz, PrLeu2 NH); 7.45o (d, 8 Hz, indole H-4′); 7.4* (d, 8 Hz, indole H-7′); 7.38o (d, 8 Hz, indole H-7′); 7.23* (dd, indole H-6′); 7.22o (dd, indole H-6′); 7.13* (dd, indole H-5′); 7.08o (dd, indole H-5′); 6.2o (d, 10 Hz, Leu NH); 6.07* (d, 7.5 Hz, Leu NH); 5.77′ (d, 8.5 Hz, Leu NH); 5.32o (ddd, PrLeu6 -CH).
Пример 41.
(3 конформера 63:32:5, помечены *, o, ‘): 8.45* (d, 10 Hz, PrLeu6 NH); 8.06* (d, 10 Hz, PrLeu2 NH); 7.97o (d, 10 Hz, PrLeu6 NH); 7.90′ (d, 10 Hz, PrLeu6 NH); 7.63* (d, 8 Hz, indole H-4′); 7.56o (d, 10 Hz, PrLeu2 NH); 7.45o (d, 8 Hz, indole H-4′); 7.4* (d, 8 Hz, indole H-7′); 7.38o (d, 8 Hz, indole H-7′); 7.23* (dd, indole H-6′); 7.22o (dd, indole H-6′); 7.13* (dd, indole H-5′); 7.08o (dd, indole H-5′); 6.2o (d, 10 Hz, Leu NH); 6.07* (d, 7.5 Hz, Leu NH); 5.77′ (d, 8.5 Hz, Leu NH); 5.32o (ddd, PrLeu6  -H); 5.26′ (dd, Hba -H); 5.26′ (dd, Hba  -H); 5.2* (dd, Hba -H); 5.2* (dd, Hba  -H); 5.16o (dd, Hba -H); 5.16o (dd, Hba  -H); 5.03* (ddd, PrLeu6 -H); 5.03* (ddd, PrLeu6  -H); 4.97* (dd, MeTrp -H); 4.97* (dd, MeTrp  -H); 4.87* (ddd, PrLeu2 -H); 4.87* (ddd, PrLeu2  -H); 4.67o (ddd, -H); 4.67o (ddd,  -H); 4.46* (dd, MeLeu -H); 4.46* (dd, MeLeu  -H); 4.13* (ddd, Leu -H); 4.13* (ddd, Leu  -H); 4.09* (s, N-OMe); 4.04′ (s, N-OMe); 4.03o (s, N-OMe); 3.74o (q, 7 Hz, MeAla -H); 4.09* (s, N-OMe); 4.04′ (s, N-OMe); 4.03o (s, N-OMe); 3.74o (q, 7 Hz, MeAla  -H); 3.71* (q, 7 Hz, MeAla -H); 3.71* (q, 7 Hz, MeAla  -H); 3.70-3.60; 3.54-3.50; 3.47o (s, MeAla N-Me); 3.28-3.17; 3.25* (s, MeAla N-Me); 3.20o (s, N-Me); 2.97* (s, MeTrp N-Me); 2.52* (s, MeLeu N-Me); 2.42o (s, N-Me); 2.40-2.14; 1.97 (m); 1.79 (m); 1.65-1.08; 1.53* (d, 7 Hz, MeAla -H); 3.70-3.60; 3.54-3.50; 3.47o (s, MeAla N-Me); 3.28-3.17; 3.25* (s, MeAla N-Me); 3.20o (s, N-Me); 2.97* (s, MeTrp N-Me); 2.52* (s, MeLeu N-Me); 2.42o (s, N-Me); 2.40-2.14; 1.97 (m); 1.79 (m); 1.65-1.08; 1.53* (d, 7 Hz, MeAla  -Me); 1.5o (d, 7 Hz, MeAla -Me); 1.5o (d, 7 Hz, MeAla  -Me); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.83; 0.62′ (d, Leu -Me); 1.04* (d, 6.5 Hz, MeLeu d-Me); 0.98-0.83; 0.62′ (d, Leu   -Me); 0.57* (d, 6.6 Hz, Leu -Me); 0.57* (d, 6.6 Hz, Leu   -Me); 0.37′ (d, Leu -Me); 0.37′ (d, Leu   -Me); -0.09* (d, 6.6 Hz, Leu -Me); -0.09* (d, 6.6 Hz, Leu   -Me); -0.35* (ddd, Leu -Me); -0.35* (ddd, Leu  -CH).
Пример 42.
(3 конфорнера 44: 30:26, помечены *, o и ‘): 8.85 (d. CSNH2); 8.60 (d, PrLeu6 NH); 8.17 (d, CSNH2); 8.03, 8.00 (2d, NH); 7.88 (m, CSNH2); 7.6-7.1; 6.28* (d, 10 Hz, Leu NH); 6.07o (d, 7 Hz, Leu NH); 5.87′ (d, 9 Hz, Leu NH); 6.26* (ddd, PrLeu2 -CH).
Пример 42.
(3 конфорнера 44: 30:26, помечены *, o и ‘): 8.85 (d. CSNH2); 8.60 (d, PrLeu6 NH); 8.17 (d, CSNH2); 8.03, 8.00 (2d, NH); 7.88 (m, CSNH2); 7.6-7.1; 6.28* (d, 10 Hz, Leu NH); 6.07o (d, 7 Hz, Leu NH); 5.87′ (d, 9 Hz, Leu NH); 6.26* (ddd, PrLeu2  -H), 5.22 (dd, Hba -H), 5.22 (dd, Hba  -H); 5.15-4.95, 5.08*, (dd, Hba -H); 5.15-4.95, 5.08*, (dd, Hba  -H); 4.83o (ddd, PrLeu2 -H); 4.83o (ddd, PrLeu2  -H); 4.50* (ddd, Leu -H); 4.50* (ddd, Leu  -H); 4.37* (dd, MeTrp -H); 4.37* (dd, MeTrp  -H); 4.25o (ddd, Leu -H); 4.25o (ddd, Leu  -H); 4.09, 4.05, 4.03* (3s, OMe); 3.89 (m, -H); 4.09, 4.05, 4.03* (3s, OMe); 3.89 (m,  -H); 3.65*, 3.63′, 3.52o (3q, 7 Hz, MeAla -H); 3.65*, 3.63′, 3.52o (3q, 7 Hz, MeAla  -H); 3.57 (m), 3.17, 3.16, 3.15, 3.22, 3.20, 3.05, 2.92, 2.55, 2.53 (9s, NMe); 1.8-1.1; 1.05 (d, 7 Hz); 0.99-0.82, 0.60o, 0.55′, 0.23′, 0.17o (4d, 7 Hz, Leu -H); 3.57 (m), 3.17, 3.16, 3.15, 3.22, 3.20, 3.05, 2.92, 2.55, 2.53 (9s, NMe); 1.8-1.1; 1.05 (d, 7 Hz); 0.99-0.82, 0.60o, 0.55′, 0.23′, 0.17o (4d, 7 Hz, Leu  -Me); -0.15o, -0.17′ (ddd, Leu -Me); -0.15o, -0.17′ (ddd, Leu  -CH). -CH).
Формула изобретения
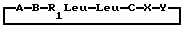 где A обозначает остаток масляной кислоты, замещенной по  -гидроксильной группе, который может быть дополнительно замещен по -гидроксильной группе, который может быть дополнительно замещен по  -положению радикалом R6, обозначающим CN, COOR2, CONR3R4, COR5, CSNH2 или алкил, который может быть замещен азидогруппой, атомом галогена, алкоксигруппой, возможно защищенной гидроксильной или аминогруппой, винил, который может быть замещен алкилом, атомом галогена или CN-группой, циклоалкил, тетразолил или группу -C -положению радикалом R6, обозначающим CN, COOR2, CONR3R4, COR5, CSNH2 или алкил, который может быть замещен азидогруппой, атомом галогена, алкоксигруппой, возможно защищенной гидроксильной или аминогруппой, винил, который может быть замещен алкилом, атомом галогена или CN-группой, циклоалкил, тетразолил или группу -C CH; где R2 обозначает водород или алкил, который может быть дополнительно замещен арилом, R3 и R4 – одинаковые или различные и обозначают водород или алкил либо образуют совместно с атомом азота кольцо, состоящее из от 3 до 6 атомов, которое может содержать второй гетероатом, а R5 обозначают водород или низший алкил; CH; где R2 обозначает водород или алкил, который может быть дополнительно замещен арилом, R3 и R4 – одинаковые или различные и обозначают водород или алкил либо образуют совместно с атомом азота кольцо, состоящее из от 3 до 6 атомов, которое может содержать второй гетероатом, а R5 обозначают водород или низший алкил;B обозначает остаток  -амино- -амино- -метилзамещенной октановой кислоты; -метилзамещенной октановой кислоты;R1 обозначает водород или метил; С обозначает триптофан или N-метилтриптофан формулы VI 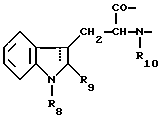 где R8 обозначает водород, алкоксигруппу, алкил или бензил; R9 обозначает водород или галоген; R10 обозначает водород или метил;  обозначает одинарную или двойную связь, обозначает одинарную или двойную связь,X обозначает остаток  -аминозамещенной (C2-C14)карбоновой кислоты, и Y обозначает остаток -аминозамещенной (C2-C14)карбоновой кислоты, и Y обозначает остаток  -амино- или N-метил- -амино- или N-метил- -аминозамещенной (C2-С10) карбоновой кислоты.
2. Циклопептолид по п.1 формулы II или III -аминозамещенной (C2-С10) карбоновой кислоты.
2. Циклопептолид по п.1 формулы II или III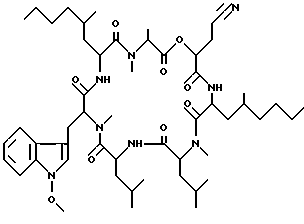 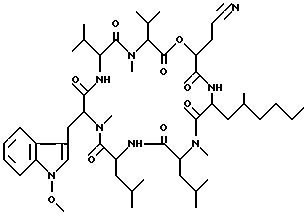 3. Циклопептолид по п.1 формулы I, где 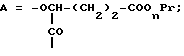 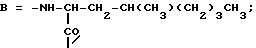 R1 = CH3; 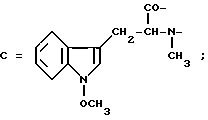 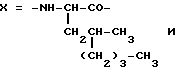 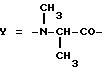 4. Штамм гриба Bartalinia sp.NRRL 21123 продуцент циклопептолида по п.1. 5. Способ получения соединения по п.1, отличающийся тем, что проводят культивирование штамма гриба Bartalinia sp. NRRL 21123 в питательной среде с последующим выделением из среды указанного соединения. 6. Терапевтический состав, обладающий способностью ингибировать экспрессию молекул адгезии, включающий в качестве активного ингредиента соединение формулы I по п.1 в эффективном количестве и целевые добавки. Приоритет по признакам: 27.07.94 – соединения, попадающие под формулу I, где R6 – возможно защищенные группы CH2OH, C3H6OH или -CH=CH2; R3 и R4 – образуют совместно с атомом азота 5 – или 6-членное кольцо; C- N-метилтриптофан, который может быть N’-(C1-C4)алкоксизамещенным; 03.03.95 – соединения подпадающие под формулу I, где R6 – алкил, который может быть замещен азидогруппой, атомом галогена, алкоксигруппой, возможно защищенным гидроксилом или аминогруппой, винил (может быть замещен алкилом, атомом галогена или CN-группой), циклоалкил, тетразолил или группа -C  CH; R3 и R4 образуют вместе с атомом азота кольцо, состоящее из 3 – 6 атомов; C – N-метилтриптофан формулы CH; R3 и R4 образуют вместе с атомом азота кольцо, состоящее из 3 – 6 атомов; C – N-метилтриптофан формулы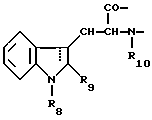 где R8 – атом водорода, алкоксигруппа, алкил или бензил; R9 – атом водорода или галогена; R10 – атом водорода или метил;  одинарная или двойная связь. одинарная или двойная связь.
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 27.07.2003
Извещение опубликовано: 10.08.2005 БИ: 22/2005
|
||||||||||||||||||||||||||
